-
Medical journals
- Career
AIP - Aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe
Authors: M. Dobiášová
Authors‘ workplace: Fyziologický ústav Akademie věd České republiky, ředitel RNDr. Jaroslav Kuneš, DrSc.
Published in: Vnitř Lék 2006; 52(1): 64-71
Category: Review
Předneseno na Kongresu „Pokroky ve farmakoterapii 2005 pro lékaře v praxi“ ve Zlíně ve dnech 7. - 9. září 2005
Overview
Velikost částic lipoproteinů je významným prediktorem kardiovaskulárních onemocnění (KVO). Aterogenní index plazmy (AIP), logaritmicky transformovaný molární poměr triglyceridů a HDL-cholesterolu, významně koreluje s velikostí částic HDL, LDL a VLDL a tak poskytuje jedním číslem informaci o lipoproteinovém profilu plazmy. Přednáška shrnuje údaje o AIP vypočítaném u 8 394 účastníků ze 6 populačních a klinických studií.
Výsledky:
AIP hodnoty rostou s narůstajícím rizikem KVO. Novorozenci, děti, zdravé ženy mají hodnoty pod 0,1, zatímco u mužů se hodnoty zvyšují a u rizikových onemocnění jako je hypertenze, diabetes 2. typu, dyslipidemie a KVO se hodnoty zvyšují až do 0,4. Na základě těchto údajů jsme navrhli, že AIP mezi –0,3 až 0,1 je spojeno s nízkým rizikem KVO, hodnoty 0,1 až 0,24 se středním a hodnoty nad 0,24 s vysokým rizikem. V populační studii měli muži vyšší AIP než ženy. Ve skupině, která podstoupila koronární angiografii, byl AIP nejlepším prediktorem pozitivního nálezu mezi 12 vyšetřovaným parametry (věk, BMI, obvod pasu, diabetes 2. typu, krevní tlak,, kouření, triglyceridy, HDL-, LDLa celkový cholesterol, apoB a poměr celkový/HDL-cholesterol). AIP byl také vysoce citlivý indikátor rozdílu mezi lipoproteinovým profilem v rodinách pacientů s předčasným iunfarktem myokardu ve srovnání s kontrolními rodinami. Léčba pacientů ciprofibratem nebo kombinací statinu a niacinu významně AIP snížila. Také pioglitazon v kombinaci s další hypoglykemickou terapií u pacientů s diabetem 2. typu významně snížil AIP.Závěry:
AIP lze snadno spočítat z běžného lipidního vyšetření. Jako indikátor velikosti částic lipoproteinů má prediktivní hodnotu převyšující jednotlivé lipidy a také poměr TC/HDL-C.Klíčová slova:
velikost částic lipoproteinů – kardiovaskulární onemocnění – aterogenní index plazmy [Log(TG/HDL-C)] – – esterifikační rychlost cholesterolu v HDL (FERHDL)Diagnóze nebo prognóze kardiovaskulárních onemocnění (KVO) pomáhají algoritmy nebo indexy, které dávají do souvislostí jednotlivé faktory KV rizika získané z výsledků velkých epidemiologických studií. Index AIP, logaritmicky transformovaný poměr molekulárních koncentrací triglyceridů a HDL-cholesterolu je na rozdíl od jiných indexů založen na laboratorních poznatcích o mechanizmu regulace velikosti lipoproteinových subpopulací [1,2].
Velikost subpopulací lipoproteinů patří k indikátorům KV rizika nové generace [3,4,5], která definuje aterogenní fenotyp plazmy přesněji než klasické biochemické indikátory, jako jsou celkový cholesterol (TC), LDL-cholesterol (LDL-C), HDL-cholesterol (HDL-C), triglyceridy (TG), apoprotein B (apoB), apoprotein AI (apoAI) a také index poměru TC/HDL-C. Je známo, že 50 - 70 % pacientů s KVO má normální hladiny cholesterolu [6] a že mírné zvýšení či snížení ostatních parametrů má na predikci individuálního rizika jen malý vliv. Pátrání po jediném a nezávislém indikátoru KV rizika nebylo zatím úspěšné, protože riziko je vždy spojeno s asociací více faktorů. Asociace rozmanitých rizikových parametrů se odráží v zastoupení různě velkých částic v lipoproteinovém spektru plazmy. I když je prevalence malých či velkých částic lipoproteinů lepším prediktorem než jednotlivé biochemické parametry, nelze aktuální zastoupení různě velkých částic popsat jedním číslem. Tuto možnost poskytuje biochemický funkční indikátor dynamiky přeměny volného cholesterolu na cholesterol-estery, která závisí na velikosti částic HDL - frakční esterifikační rychlost cholesterolu (FERHDL). FERHDL se měří v plazmě zbavené nízkodenzních lipoproteinů VLDL a LDL, které se samy neúčastní reakce přenosu mastné kyseliny na volný cholesterol, zprostředkované plazmatickým enzymem lecitin-cholesterol-acyltransferázou [7]. Dalším indikátorem nové generace je AIP [log(TG/HDL-C)], který úzce souvisí s FERHDL, a tím s velikostí částic lipoproteinů [1]. Je to logické vyústění faktu, že regulace velikosti lipoproteinových subpopulací je spojena především s triglyceridy, kdy jsou působením lipoproteinové a hepatické lipázy remodelovány HDL a poměr malých a velkých HDL-makromolekul zpomaluje nebo zrychluje esterifikační rychlost FERHDL, která je tak biochemickým a funkčním indikátorem jejich velikosti [2].
Jaký je vztah velikosti jednotlivých lipoproteinů ke KV riziku? Z hlediska aterogenního rizika jsou důležité největší a nejmenší částice HDL: prevalence velkých částic HDL je protektivní, malé částice zvyšují riziko (obr. 1). Metody, které se používají pro měření velikosti lipoproteidů, jsou elektroforéza v gradientových gelech (GGE) anebo protonová nukleárně magnetická rezonanční spektroskopie (NMR); jsou to laboratorně, přístrojově a ekonomicky značně náročné metody [8,9,10].
Image 1. Vztah velikosti lipoproteinových částic k riziku – HDL (GGE). 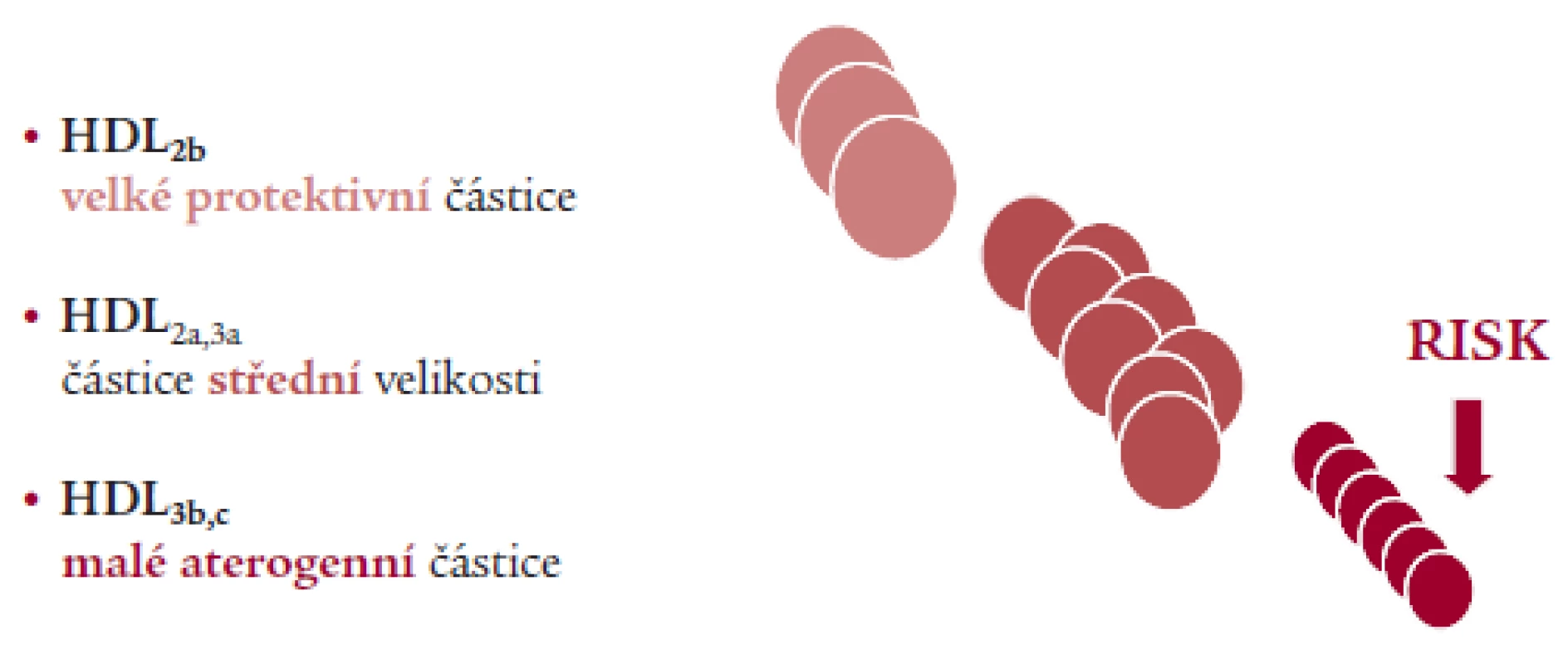
Zastoupení malých a velkých HDL-částic u různých populačních souborů se významně liší (obr. 2). Normální zdraví muži mají méně velkých protektivních částic než ženy, zato mají více rizikových částic. Naopak ženy mají více protektivních a méně rizikových částic než muži [11]. Muži s diabetem 2. typu (ženy také, ale nezobrazeno na obr. 2) mají dramaticky zvýšené rizikové částice, ale minimální množství částic protektivních [12]. Prevalence malých nebo velkých částic pak ovlivňuje destinaci vzniklých cholesterol-esterů, zdali budou putovat aterogenní cestou přes VLDL a LDL, nebo spolu s velkými HDL neaterogenní cestou k receptorům v jaterních buňkách (SRBI).
Image 2. HDL protektivní a rizikové částice. 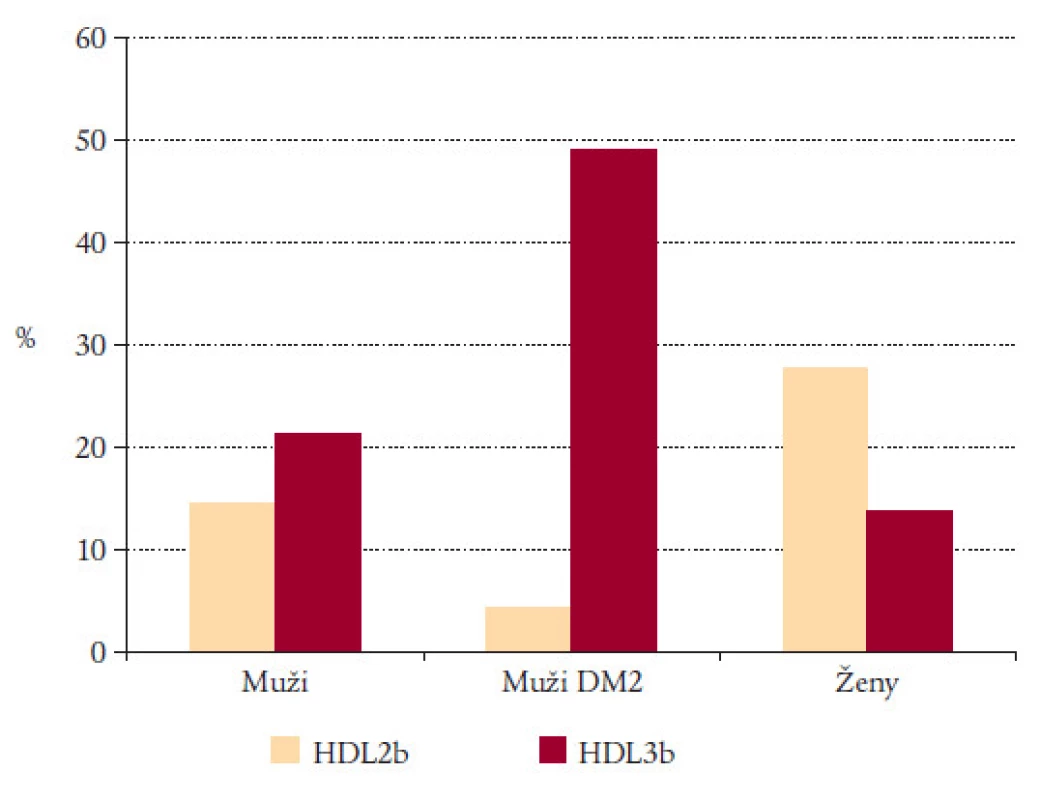
Podobně jako u HDL, tak i u LDL (obr. 3) charakterizuje převaha velkých LDL částic neaterogenní fenotyp plazmy, označovaný také jako A profil, zatímco převaha malých LDL částic je dobrým prediktorem KVO. Za hranici mezi A neaterogenním profilem a B aterogenním profilem se považuje velikost částic 25,5 nm [13].
Image 3. Vztah velikosti lipoproteinových částic k riziku – LDL (GGE). 
U velmi nízko denzních lipoproteinů - VLDL je tomu naopak (obr. 4). U VLDL jsou to malé částice, mezi 30 až 40 nm, které jsou neaterogenní. Naopak velké částice, 60 až 100 nm, bohaté na triglyceridy, jsou aterogenní. Tím se liší od velkých LDL a HDL, které nemají aterogenní potenciál [10].
Image 4. Vztah velikosti lipoproteinových částic k riziku – VLDL (NMR). 
Stručně lze shrnout, že zvýšení koncentrace triglyceridů spolu se snížením koncentrace HDL-cholesterolu vede k prevalenci rizikových malých denzních LDL, malých HDL, velkých VLDL a ke zvýšené rychlosti esterifikace cholesterolu v HDL-plazmě.
Na základě těchto poznatků jsme navrhli a ověřovali hypotézu, která uvádí do souvislosti dynamiku transformace cholesterolu a velikost částic. Opírá se o dva body: 1. TG a HDL-C působí protichůdně na velikost lipoproteinů; 2. na velikosti částic lipoproteinů závisí rychlost esterifikace cholesterolu v HDL neboli FERHDL, kterou můžeme snadno měřit. Logickým výstupem je, že FERHDL reflektuje poměr TG/HDL-C (obr. 5) a logaritmicky upravený vztah je lineární (obr. 6). Takto upravený vztah jsme nazvali AIP [1]. Korelace mezi FERHDL a AIP je vysoce signifikantní, korelační koeficienty se pohybují kolem 0,8.
Image 5. FER<sub>HDL</sub> proti TG/HDL-C. 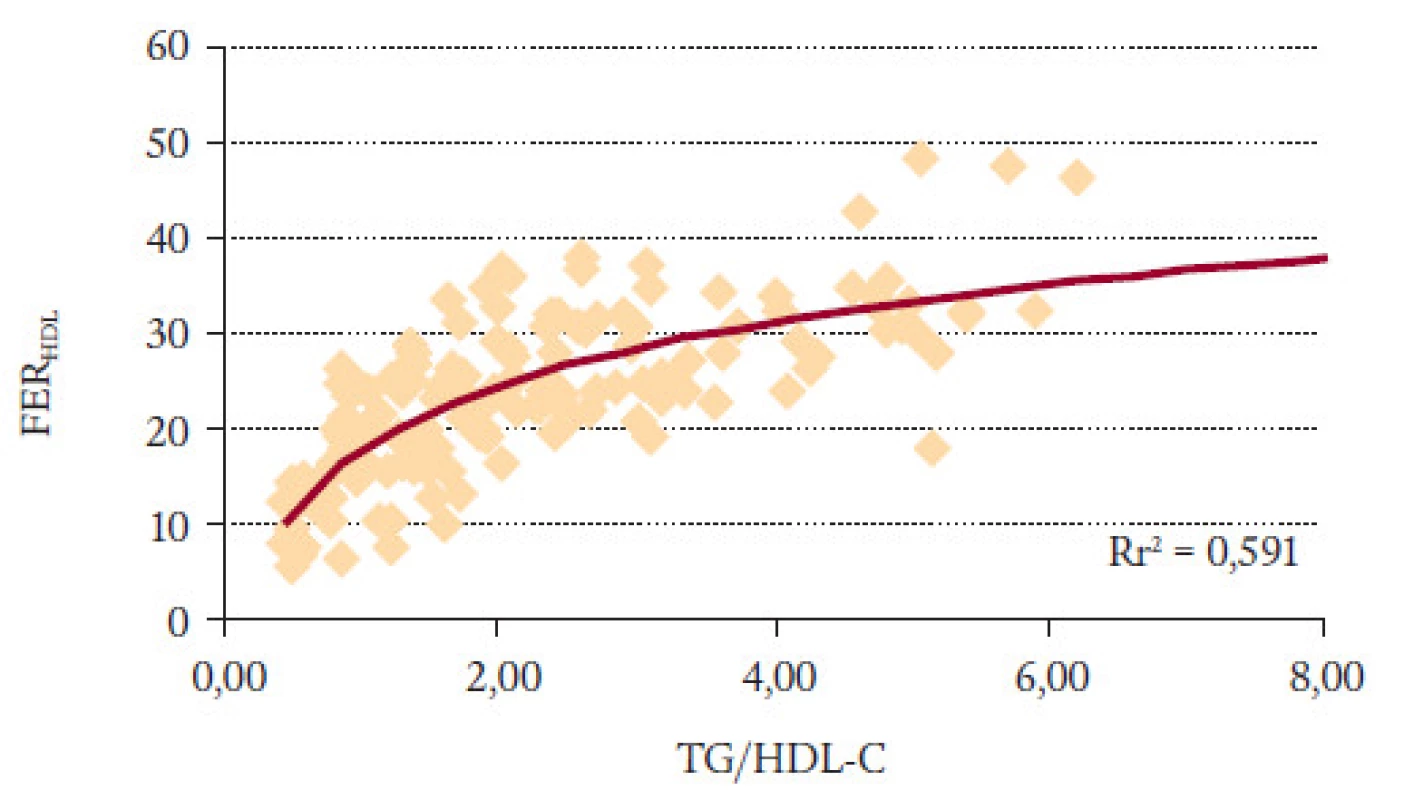
Image 6. FER<sub>HDL</sub> proti AIP [Log (TG/HDL-C)]. ![FER<sub>HDL</sub> proti AIP [Log (TG/HDL-C)].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cfed8ca00a4694c6f6f62cd01c88460c.jpg)
Naši hypotézu, že AIP závisí na velikostí lipoproteinů, potvrzují také konkrétní údaje ze studie HATS [14,15]. Velikost částic LDL a HDL je v inverzním vztahu k AIP. Mezi velikostí VLDL částic a AIP je naopak pozitivní korelace (obr. 7).
Image 7. Korelace velikosti lipoproteinů s AIP. 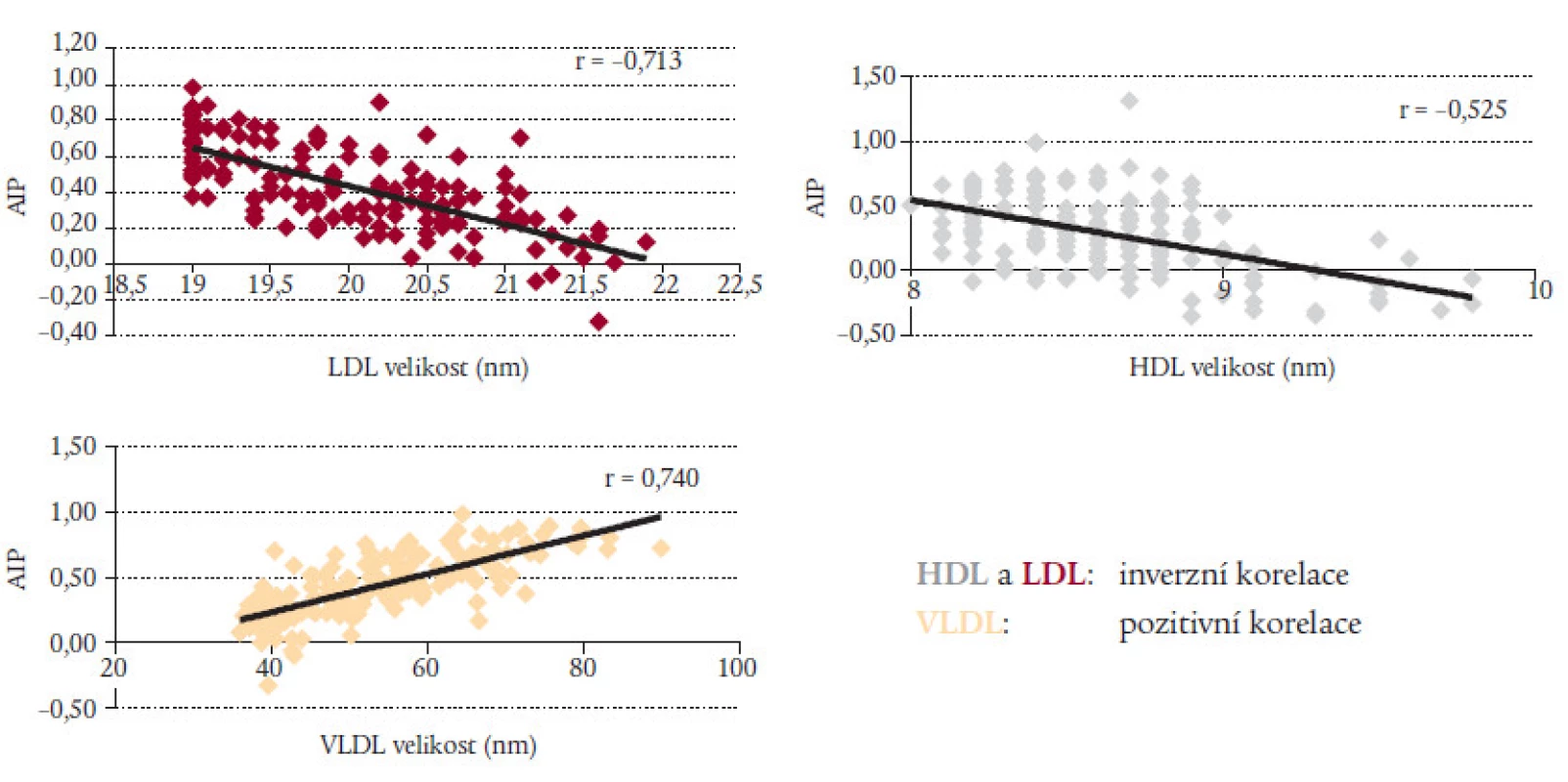
AIP také souvisí s dalšími rizikovými biochemickými a klinickými ukazateli. Ačkoliv korelace s celkovým cholesterolem bývá nízká, AIP souvisí s rizikovými apoproteiny, jako je apoB, apoCIII, apoE, inverzně s ApoAI. Existuje také významná souvislost mezi antropometrickými a klinickými riziky. Jsou to obvod pasu, obezita, DM 2. typu a inzulinová rezistence [16,17]. Předpoklad, že by se měl AIP zvyšovat u rizikových skupin populace, jsme sledovali u subjektů s různým stupněm KV rizika: AIP v pupečníkové plazmě, u dětí (dívek, chlapců), žen, mužů, rodin probandů s předčasným infarktem myokardu a kontrolních rodin, pacientů už s manifestním KVO, mužů a žen s DM 2. typu, pacientů s kombinovanou hyperlipoproteinemií. AIP rostlo od nejméně k nejvíce rizikovým skupinám, od -0,4 do +0,7 (obr. 8). Nízké hodnoty obsazují především ženy (žluté sloupce), vyšší hodnoty zaujímají muži (modré sloupce) a nejvyšší hodnoty jsou sloupce s žlutými hvězdičkami, které už představují rizikové onemocnění jako DM 2. typu, hypertenze, hypelipoproteinemie, a také kardiovaskulární onemocnění po IM (červené hvězdičky). U rizikových onemocnění už nejsou rozdíly mezi ženami a muži. Hodnota označená zelenou tečkou (AIP = 0,07) odpovídá rozmezí mezi aterogenním a neaterogenním profilem podle velikosti LDL [1].
Image 8. AIP v plazmě subjektů s různým stupněm KV rizika. 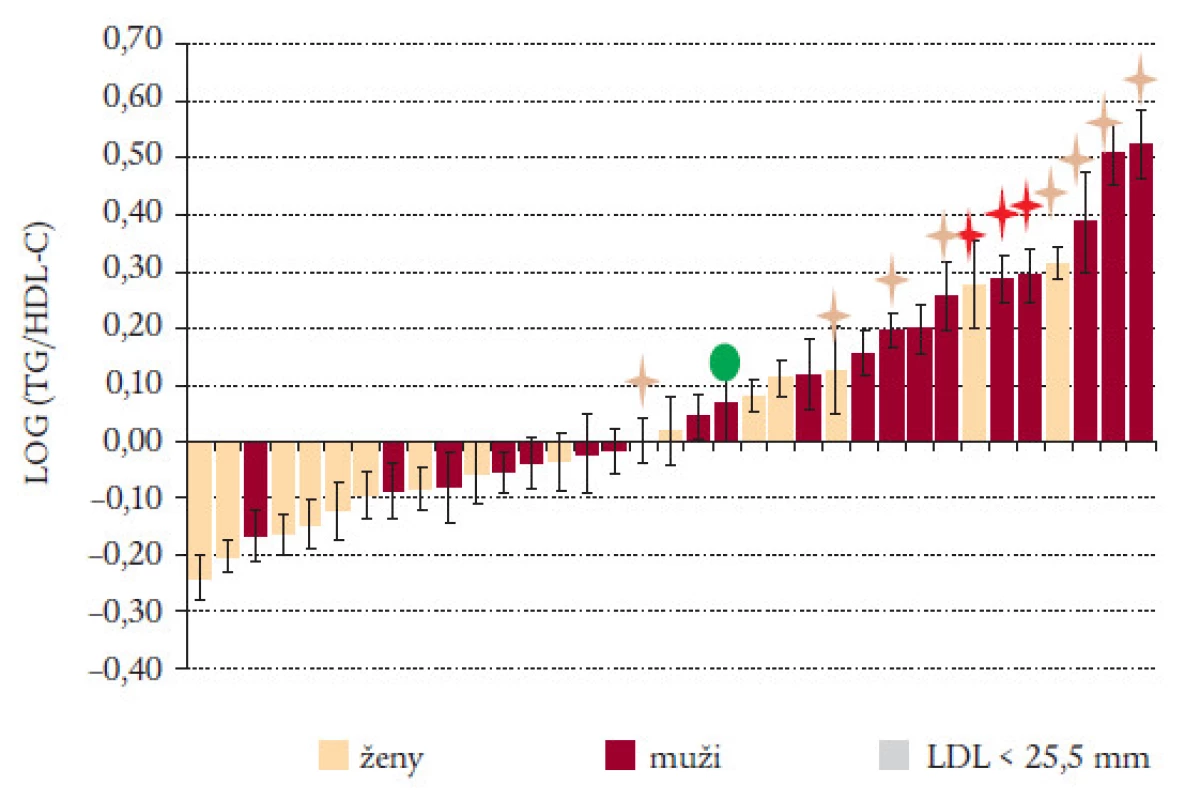
Na základě předchozích údajů jsme navrhli rozdělení AIP do tří rizikových kategorií. Podle tohoto návrhu by nejnižší riziko představovaly hodnoty mezi -0,3 až 0,1, střední riziko by bylo mezi 0,1 až 0,24 a vysoké riziko nad 0,24 (obr. 9).
Image 9. Tři stupně KV rizika podle AIP. 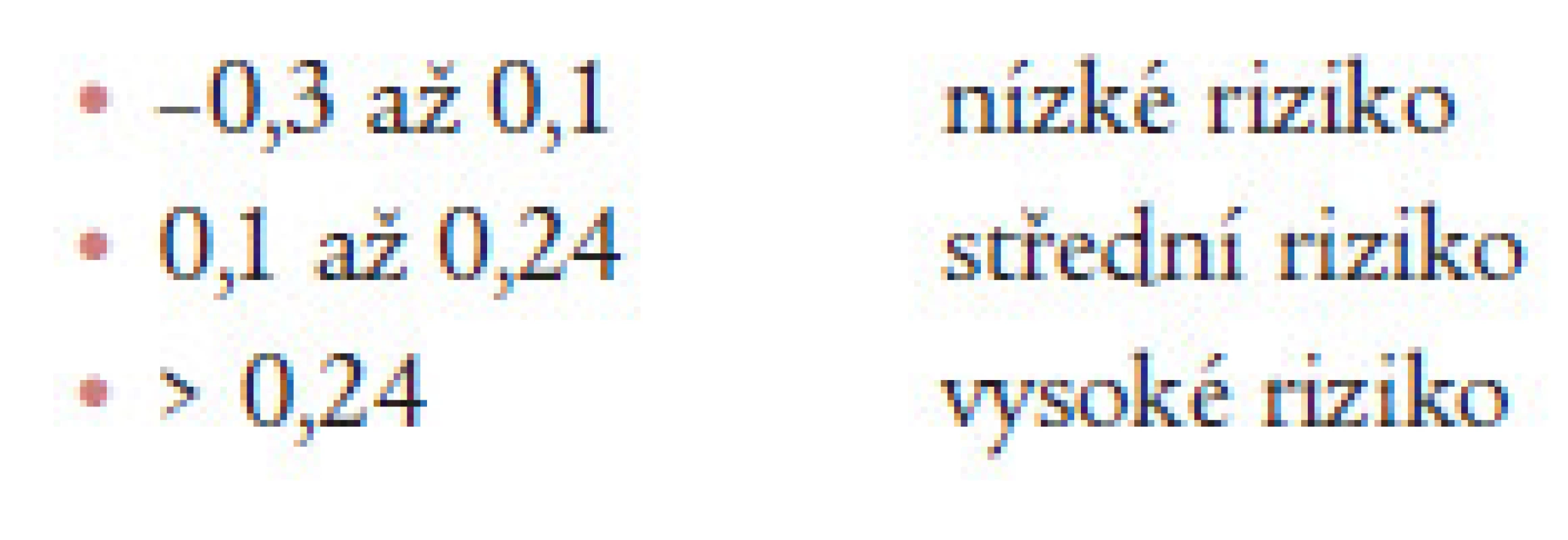
AIP byl až dosud využit v několika studiích. Obr. 10 ukazuje vývoj AIP u české populace. Do studie byl zařazen 1% náhodně vybraný vzorek populace mužů a žen v 9 okresech České republiky ve věku 25 až 64 let a stanovení se provedlo opakovaně po 3 letech (žluté sloupce). Potvrdilo se, že muži mají vyšší AIP než ženy. Pouze nejstarší ženy měly průměrné hodnoty AIP vyšší než nula, tedy přibližně v dimenzích nejmladších mužů. AIP rostl s věkem, a to jak u mužů tak u žen. Největší nárůst AIP byl zaznamenán u žen v období menopauzy a také v období 3 let byl tento nárůst u týchž žen statisticky významný [18].
Image 10. Vývoj AIP u české populace. 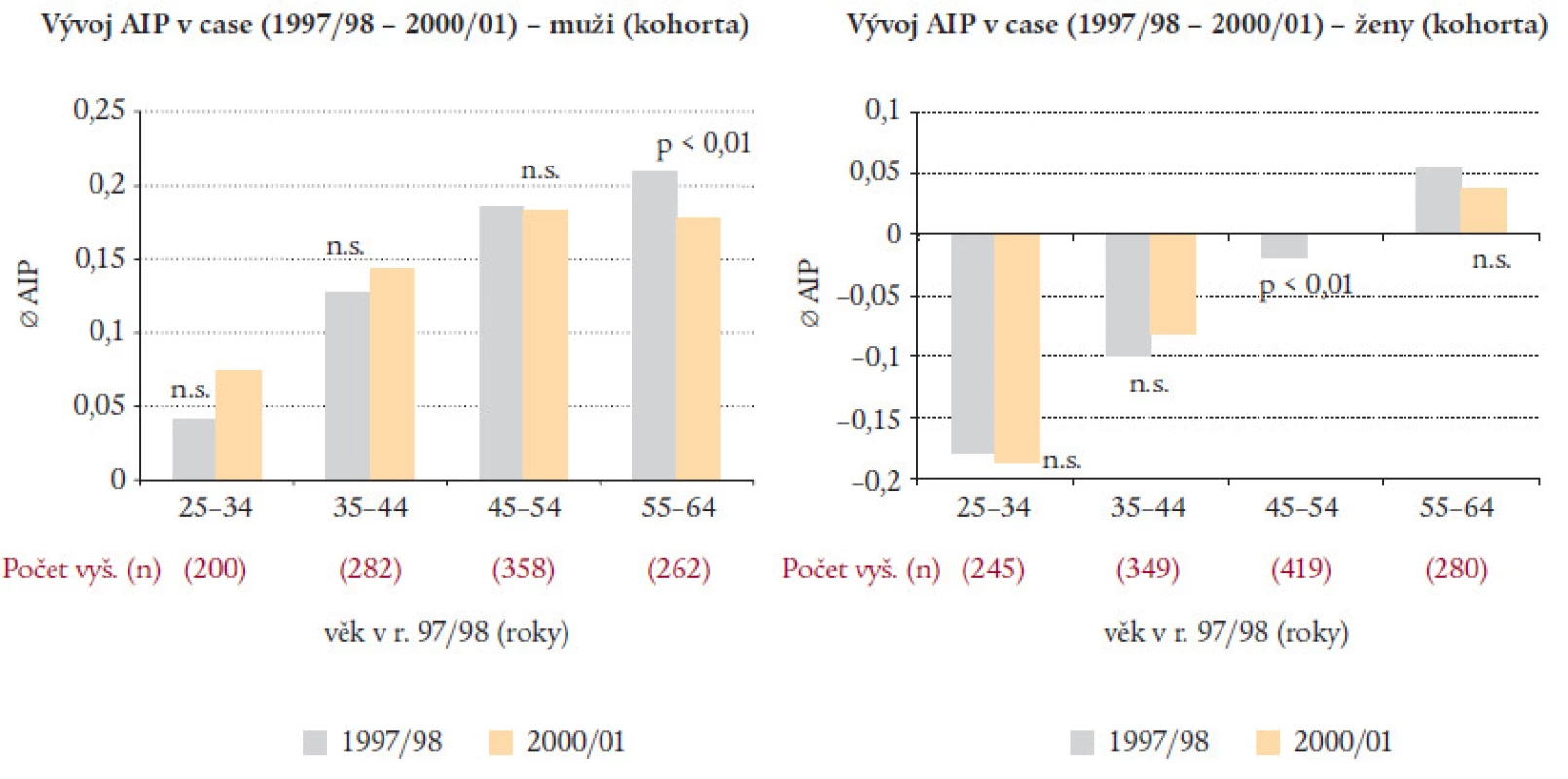
V jiné studii (obr. 11) byl hledán nezávislý prediktor pozitivního angiografického nálezu [aCAD(+)]. Koronární angiografii podstoupilo 1 108 účastníků. Stanovené hodnoty byly testovány v různých regresních modelech. Byly to věk, BMI, obvod pasu, DM 2. typu, kouření, C, TG, LDL-C, apoB, HDL-C, funkční marker - FERHDL a oba indexy - C/HDL-C a AIP. Jako nejlepší prediktor byl nalezen FERHDL v těch regresních modelech, kde byl zahrnut, potom věk, kouření a DM 2. typu. V regresních modelech, kde FERHDL nebyl zahrnut jako poměrně náročný laboratorní test, byl nejlepším prediktorem AIP a následovaly, podobně jako v předchozí skupině, věk, kouření, obvod pasu a DM 2. typu [16].
Image 11. Nezávislý prediktor pozitivního angiografického nálezu aCAD(+). 
V další studii (obr. 12) byly srovnávány rozdíly v indikátorech lipoproteinového profilu plazmy u rodin probandů s předčasným IM a jejich kontrol. Zatímco rozdíly v koncentraci cholesterolu mezi probandy a kontrolami nebyly významné, citlivější AIP ukázal na významné rozdíly nejen mezi probandy a jejich kontrolami, ale také mezi manželkami a dcerami probandů a kontrol. Zdá se, že AIP ukazuje i na rozdíly v životním stylu (v dietě a fyzické aktivitě) v rodinách probandů a kontrol, které se projevují mírným zvýšením HDL-cholesterolu a snížením TG [19].
Image 12. Cholesterol a AIP v rodinách kontrol a probandů s předčasným I.M. 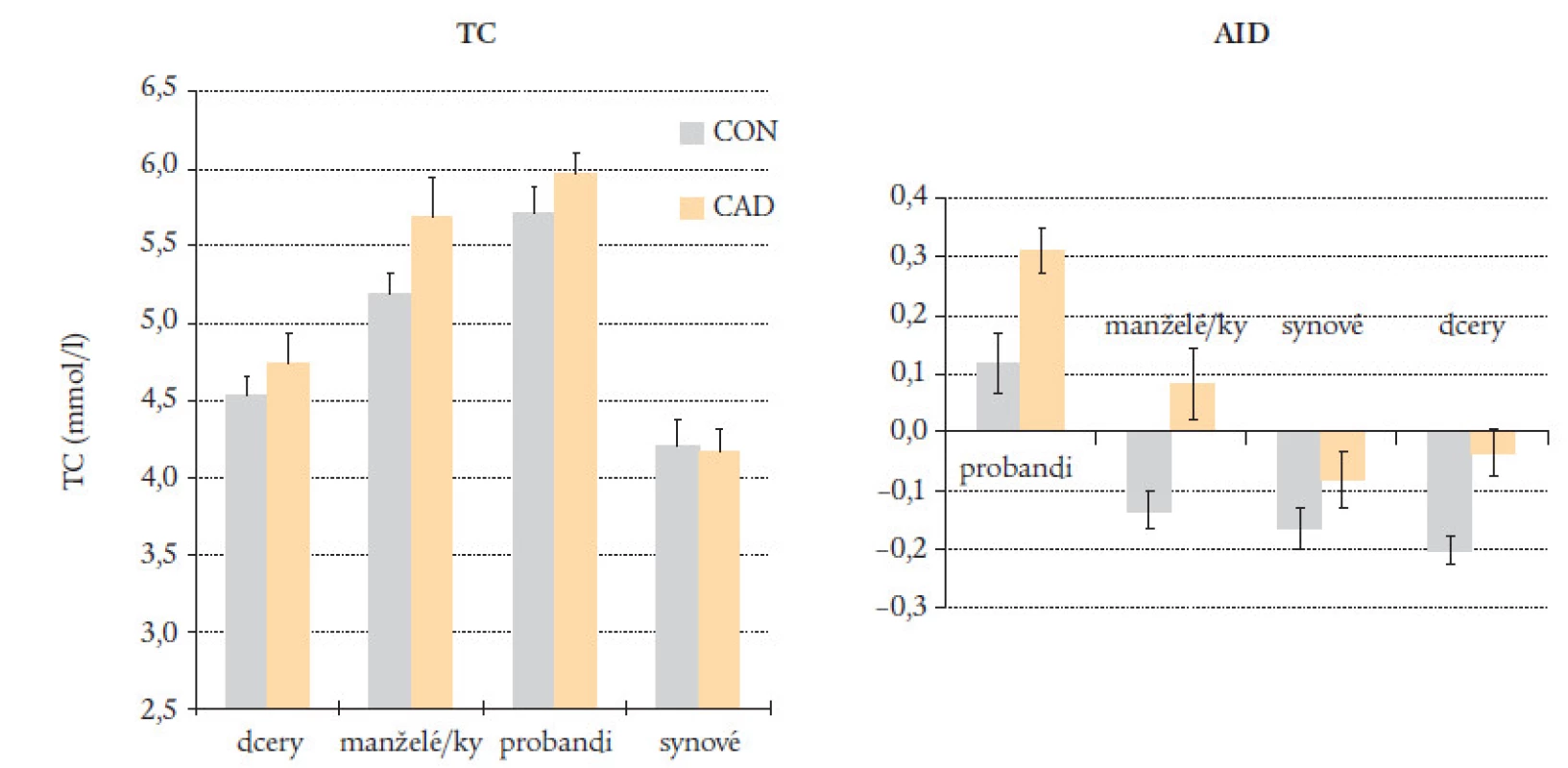
AIP byl využit také při hodnocení vlivu kombinované terapie statinů s niacinem a antioxidanty na regresi či progresi koronárních lézí u 160 pacientů s KVO a nízkým HDL-cholesterolem (obr. 13). Ze čtyř skupin, do kterých byli pacienti rozděleni, byl zaznamenán největší pokles AIP u pacientů, kteří dostávali kombinaci niacin a simvastatin. Tito pacienti také měli nejlepší výsledky při reangiografii [14].
Image 13. HATS – HDL-Atherosclerosis Treatment Study. 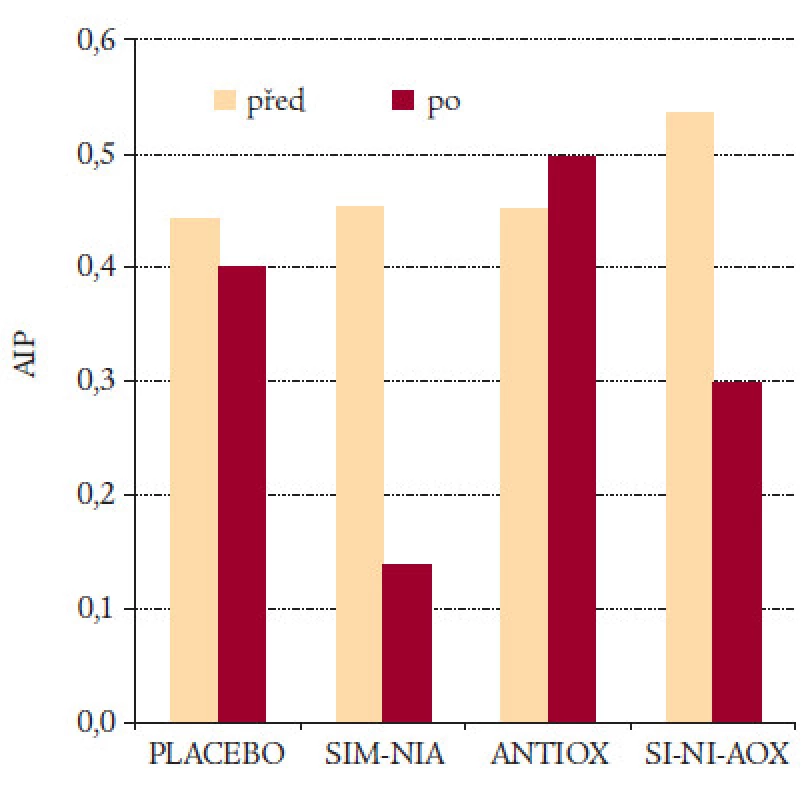
Také hodnocení výsledků terapie fibráty pomocí AIP vypadá slibně (obr. 14). Zajímavý je rozdíl mezi muži a ženami: obě skupiny měly před terapií hodnoty v kategorii vysokého rizika kolem 0,4 - 0,5. Po terapii se ke kategorii nízkého rizika přiblížily pouze ženy [20].
Image 14. Pokles AIP po 3měsíční léčbě ciprofibrátem u mužů a žen. 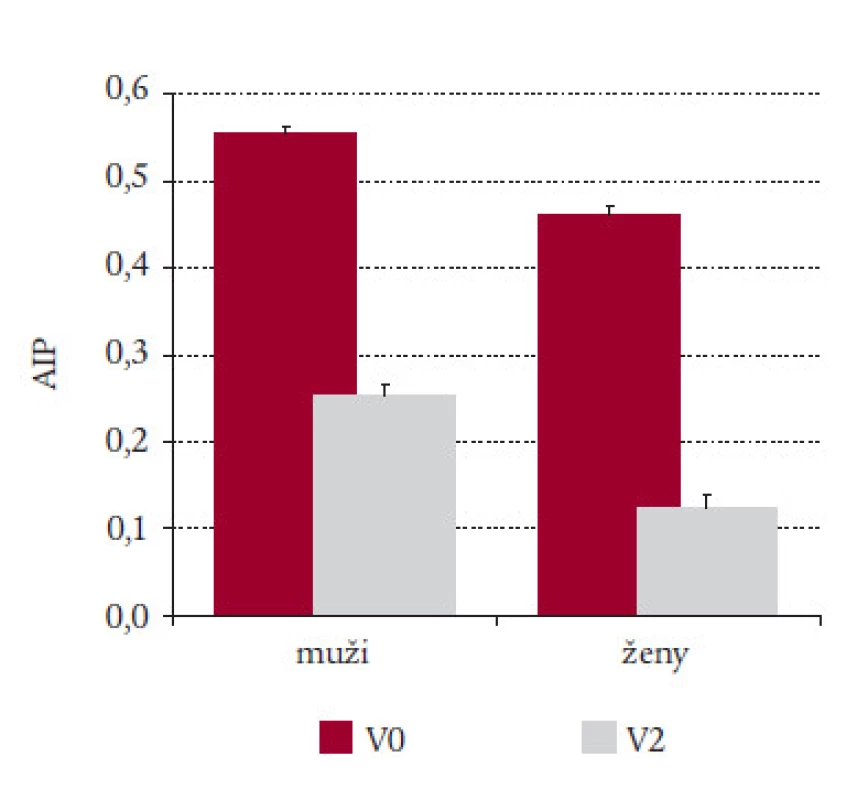
AIP může také monitorovat výsledky farmakologické intervence zaměřené na jiný než lipidní rizikový faktor (obr. 15). Terapie zaměřená na léčbu inzulinové rezistence u 1 569 diabetiků 2. typu, randomizovaných do 5 skupin (placebo, pioglitazon, P + sulfonylurea, P + metformin, P + inzulin) vedla k podstatnému snížení AIP. Největšího zlepšení lipidního profilu podle kritéria AIP bylo dosaženo u pacientů léčených kombinací pioglitazonu se sulfonylureou nebo inzulinem [17].
Image 15. Pioglitazon snižuje AIP plazmy u pacientů s DM 2. typu. 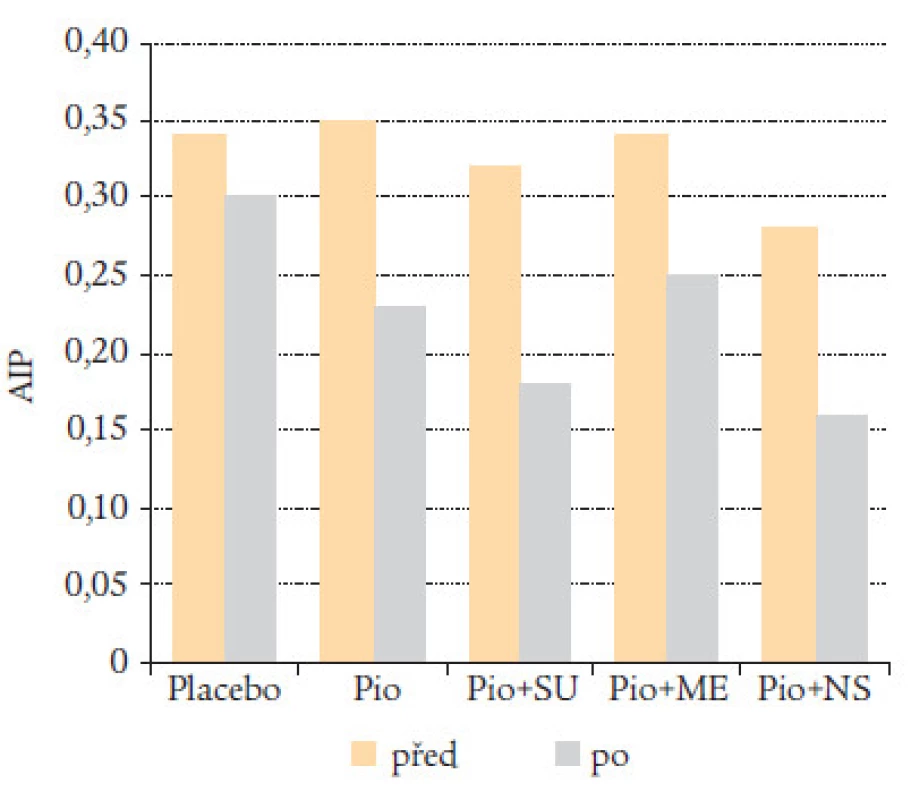
Jak použít AIP v praxi? Např. pacient s vysokým KV rizikem, AIP = 0,26, má hodnoty TG 2,10 mmol/l a HDL-C 1,14 mmol/l. Abychom ho dostali do pásma středního rizika (0,1 - 0,24) při stejné koncentraci HDL-cholesterolu, museli bychom snížit TG na 1,63 mmol/l. Pokud by se nezměnila koncentrace TG, pak by se měl HDL-C zvýšit na 1,47 mmol/l. Podobně by se dalo postupovat při snaze sestoupit ještě dál do pásma nízkého rizika. Ve skutečnosti se však působením terapie mění současně i TG i HDL-C, a tak by se měl HDL-C při doporučované hladině TG 1,7 mmol/l zvýšit na 1,35 mmol/l (obr. 16). Výpočty, kde se pracuje s naměřenými a cílovými hodnotami TG a HDL, jsou uvedeny na obr. 17.
Image 16. AIP v praxi: Jaká má být cílová koncentrace TG(c) a HDL-C(c)? 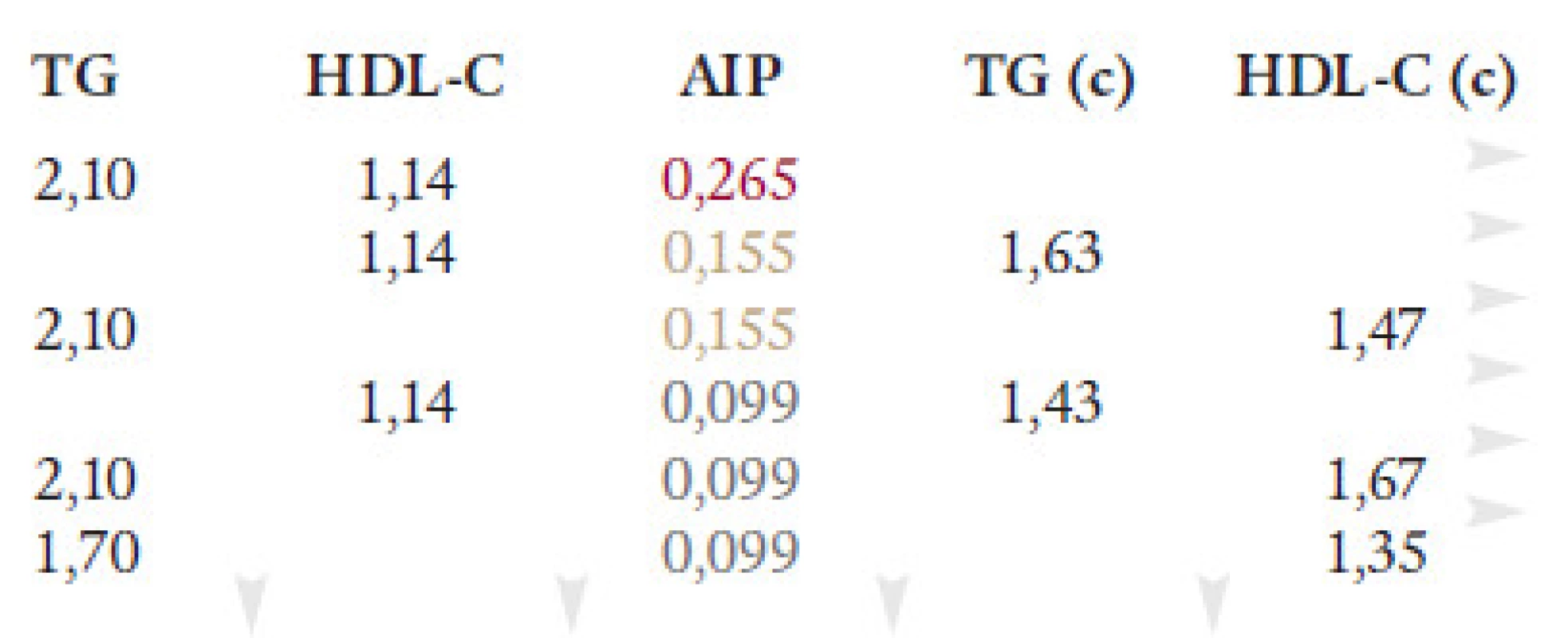
Image 17. Výpočet cílových hodnot. 
Závěry
Asociace TG a HDL-C v AIP reflektuje rovnováhu mezi rizikovými a protektivními složkami lipoproteinů. AIP významně koreluje s FERHDL, který je funkčním indikátorem velikosti a interakcí lipoproteinových částic a prediktorem aterogenních cévních změn. AIP může být důležitým snadno dostupným nástrojem pro stanovení kardiovaskulárního rizika a sledování účinnosti farmakologické intervence.
Děkuji spoluautorům studií, podle kterých byla zpracována tato přednáška: Lida Adler, B.G. Brown, Marianne Cheung, Renata Cífková, Richard Češka, Jiri Frohlich, Gérald Luc, Anna Mydlilová, J. Otvos, Jan Piťha, Markéta Plášková, Rudolf Poledne, P.H. Pritchard, Kateřina Ptáčková, Katarína Rašlová, Hana Rauchová, Jarmila Stříbrná, Milan Šamánek, Zdena Škodová, Meng H. Tan, Zuzana Urbanová, Bohumil Vohnout, Michal Vrablík.
Tento přehled byl podpořen grantem IGA MZ ČR NR/8328 Metabolismus HDL a jeho změny u pacientů s metabolickým syndromem při léčbě fibrátem.
RNDr. Milada Dobiášová, Ph.D., DrSc.
www.
e-mail: dobias@biomed.cas.cz
Doručeno do redakce: 29. 9. 2005
Přijato k otištění: 29. 9. 2005
Sources
1. Dobiášová M, Frohlich J. The plasma parameter log (TG/HDL-C) as an atherogenic index: correlation with lipoprotein particle size and esterification rate in apoB-lipoprotein-depleteed plasma (FERHDL). Clinical Biochemistry 2001; 34 : 583-588.
2. Dobiášová M. Atherogenic index of plasma [Log(triglycerides/HDL/cholesterol]: Theoretical and practical implications. Clin Chem 2004; 50 : 113-115.
3. Dobiášová M, Stříbrná J, Sparks DL et al. Cholesterol esterification rates in very low density lipoprotein and low density lipoprotein-depleted plasma: relation to high density lipoprotein subspecies, sex, hyperlipidemia, and coronary artery disease. Arteriosclerosis and Thrombosis 1991; 11 : 64-70.
4. Campos H, Genest Jr JJ, Blijlevens E et al. Low density lipoprotein particle size and coronary artery disease. Arterioscler Thromb 1992; 12 : 187-195.
5. Coresh J, Kwiterovich PO Jr, Smith HH et al. Association of plasma triglyceride concentration and LDL particle diameter, density, and chemical composition with premature coronary artery disease in men and women. J Lipid Res 1993; 34 : 1687-1697.
6. Superko RH. Beyond cholesterol reduction. Circulation 1996; 94 : 2351-2360.
7. Dobiášová M, Stříbrná J, Pritchard P et al. Cholesterol esterification rate in plasma depleted of very low and low density lipoprotein is controlled by he proportion of HDL2 and HDL3 subclasses: study in hypertensive and normal middle aged and septuagenarian men. J Lipid Res 1992; 33 : 1411-1418.
8. Dobiášová M, Frohlich J. Assays of lecithin cholesterol acyltransferase (LCAT). In: Ordovas JM (ed). Methods in molecular biology. Lipoprotein protocols. Totowa: Humana Press 1998 : 217-230.
9. Rainwater DL. Electrophoretic separation of LDL and HDL subclasses In: Ordovas JM (ed). Methods in molecular biology. Lipoprotein protocols. Totowa: Humana Press 1998 : 137-151.
10. Freedman DS, Otvos JD, Jeyarajah EJ et al. Relation of lipoprotein subclasses as measured by proton nuclear magnetic resonance spectroscopy to coronary artery disease. Arterioscler Thromb Vasc Biol 1998; 18 : 1046-1053.
11. Dobiášová M, Frohlich J. Measurement of fractional esterification rate of cholesterol in apoB containing lipoproteins depleted plasma: methods and normal values. Physiol Res 1996; 45 : 65-73.
12. Rašlová K, Nagyová A, Dobiášová M et al. Effect of ciprofibrate on lipoprotein metabolism and oxidative stress parameters in patients with type 2 diabetes mellitus and atherogenic lipoprotein phenotype. Acta Diabetol 2000, 37 : 131-134.
13. Williams PT, Superko HR, Haskell WL et al. Smallest LDL particles are most strongly related to coronary disease progression in men. Arterioscler Thromb Vasc Biol 2003; 23 : 314-321.
14. Brown BG, Xue-Qiao Z, Chait A et al. Simvastatin and Niacin, antioxidans vitamins, or the combination for the prevention of coronary disease. N Engl J Med 2001; 345 : 1583-1592.
15. Dobiášová M, Frohlich J, Brown BG et al. Relation of FERHDL and AIP to clinical and laboratory parameters in HATS. 75th EAS Congress, Prague, May 2005.
16. Frohlich J, Dobiášová M. Fractional esterification rate of cholesterol and ratio of triglycerides to HDL-cholesterol are powerful predictors of positive findings on coronary angiography. Clin Chem 2003; 49 : 1873-1880.
17. Tan MH, Johns D, Glazer NB. Pioglitazone Reduces Atherogenic Index of Plasma in Patients with Type 2 Diabetes. Clin Chem 2004; 50 : 111-115.
18. Plášková M, Cifková R, Škodová Z et al. A logarithmically transformed ratio of triglyceride/HDL-cholesterol as an indicator of the atherogenic risk in the Czech population. 75th EAS Congress, Prague, May 2005.
19. Dobiášová M, Rašlová K, Rauchová H et al. Atherogenic lipoprotein profile in families with and without history of early myocardial infarction; fractional esterification rate of cholesterol in plasma depleted of apoB lipoproteins (FERHDL) and logarithmically transformed ratio of triglycerides to HDL-cholesterol. Physiol Res 2001, 50 : 1-8.
20. Dobiášová M, Frohlich J. Nový aterogenní index plazmy (AIP) odpovídá poměru triglyceridů a HDL-cholesterolu, velikosti částic lipoproteidů a esterifikační rychlosti cholesterolu: změny po léčbě lipanorem. Vnitř Lék 2000; 46 : 152-156.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 1-
All articles in this issue
- Vliv cílené intervence na výskyt rizikových faktorů kardiovaskulárních onemocnění u zdravotnických zaměstnanců
- Klidový energetický výdej při hemodialýze
- Má polymorfizmus G8002A v genu pro endotelin význam pro další rizika u pacientů se srdečním selháním?
- Je zvýšený enddiastolický tlak v levé komoře u populace staršího věku patologický?
- Intervalový a kontinuální trénink v kardiovaskulární rehabilitaci
- Lokální cévní komplikace u pacientů s akutním infarktem myokardu řešeným direktní perkutánní koronární intervencí
- Volumy štítné žlázy u dospělé populace ve věku 18 - 65 let v České republice - stanovení norem
- AIP - Aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe
- Nefluoroskopické mapovacie techniky v súčasnej katétrovej ablačnej liečbe dysrytmií
- Studie FIELD přednesena a uveřejněna. Nepřesvědčivé výsledky fenofibrátu u diabetiků.
-
Diagnostika a léčba jaterní encefalopatie
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E. Purkyně - „Nejasná“ příčina vzniku a recidivy venózního tromboembolizmu
- Antifosfolipidový syndrom - popisy dvou případů
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- AIP - Aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe
- Volumy štítné žlázy u dospělé populace ve věku 18 - 65 let v České republice - stanovení norem
-
Diagnostika a léčba jaterní encefalopatie
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E. Purkyně - Antifosfolipidový syndrom - popisy dvou případů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

