-
Medical journals
- Career
Glykoproteiny destičkové membrány z hlediska jejich genetických změn
Authors: J. Gumulec 1; M. Penka 2; R. Richterová 1; M. Brejcha 1; D. Klodová 1; M. Wróbel 1; P. Janotová 1; K. Klaricová 1; M. Kneiflová 1; M. Kučerová 1; M. Radina 1
Authors‘ workplace: Centrum pro trombózu a hemostázu při Onkologickém centru J. G. Mendla, Nový Jičín, přednosta prim. MUDr. Jaromír Gumulec 1; Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc. 2
Published in: Vnitř Lék 2005; 91(7 a 8): 833-839
Category: 128th Internal Medicine Day - 21rd Vanysek's Day Brno 2005
Overview
Role trombocytů v hemostáze je zcela zásadní. Začíná adhezí destiček k místu poškození cévy s následným rozšířením po celé ploše obnaženého subendotelia a pokračuje sekrecí působků uskladněných v destičkových granulích s cílem vytvořit velké agregáty destiček. Adheze trombocytů je proces iniciovaný jejich kontaktem s nefyziologickými povrchy. Zásadní roli zde hraje kolagen z extracelulární matrix a ze subendotelia. Interakce mezi kolagenem a trombocyty zprostředkovávají různé receptory glykoproteinové povahy zakotvené na povrchu destiček a von Willebrandův faktor z plazmy nebo subendotelu. V podmínkách nízkého střihového stresu jsou hlavními receptory pro adhezi destiček ke kolagenu glykoproteiny GP Ia/IIa, GP VI a velmi pravděpodobně i GP IV, v situaci vysokého střihového stresu přebírá hlavní roli komplex GP Ib/IX/V. Konformační změny v trombocytech vzniklé po vazbě vWF – GP Ib/IX vedou k aktivaci komplexů GP IIb/IIIa, které pak mohou vázat fibrinogen. Molekuly fibrinogenu vytvářejí můstky mezi jednotlivými destičkami, což je podkladem agregace destiček.
Klíčová slova:
trombocyty – hemostáza – receptory glykoproteinové povahy – von Willebrandův faktor – komplexy GP IIb/IIIaJako přehled bylo publikováno také formou přednášky v únoru 2004 na X. Pařízkově dni v Novém Jičíně a v listopadu 2004 na X. sympoziu MEFA v Brně
Úvod
Hemostatický systém člověka je sestaven tak, aby za fyziologických podmínek umožnil zachování tekutého stavu krve a aby v případě cévního poškození rychle reagoval stavěním krvácení s cílem uzavření defektu cévní stěny. Trombóza se může objevit v situaci, v níž není hemostatický podnět kontrolovaný sníženou inhibiční kapacitou systému nebo, mnohem častěji, je-li kapacita přirozených antikoagulačních mechanizmů rozdrcena nepřiměřeně vysokou intenzitou prokoagulačního podnětu.
Okrajové vrstvy cévní stěny a povrch endoteliálních buněk jsou za klidových podmínek hemokompatibilní. Intima a media jsou silně trombogenní (obr. 1) [2].
Image 1. Příčný řez cévní stěnou, volně podle [2]. ![Příčný řez cévní stěnou, volně podle [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8786e0a4d9ce88b4ce467d6ccad4641a.jpg)
Proud krve je závislý na průměru a typu cévy. Mnohem prudší je proud krve v tepnách než v žilách. Nejvyšší je rychlost krevního proudu v centrální části cévního lumen a nejnižší v místě kontaktu s glykokalyxem luminálního povrchu endoteliálních buněk. Velké erytrocyty lze tedy najít především ve středu cév, naproti tomu malé trombocyty cirkulují častěji v oblastech pomalého proudění podél cévní stěny [2]. Laminární proudění krve ve zdravé tepně se v případě jejího zúžení zrychluje a při překročení určité hranice nastarne vířivé proudění na všechny strany. Krevní tlak působí v tepně jednak směrem vpřed, jednak laterálně. Při stoupající rychlosti se zvyšuje krevní tlak směrem vpřed, avšak snižuje se směrem do stran. Při zrychlení za určitou kritickou hranici pak může vzniknout do stran tlak nulový nebo dokonce negativní – hovoří se o tzv. vývěvovém efektu. Pod vlivem tohoto negativního tlaku (střihový stres, „shear stress“) dochází k poškozování hemokompatibilního, netrombogenního endotelu a odhalení silně trombogenních subendoteliálních struktur [3].
Kromě vlivu na endotel vede zrychlení proudu ke změně tvaru velkých molekul von Willebrandova faktoru (vWF), který hraje v podmínkách vysokého střihového stresu hlavní roli v adhezi destiček ke kolagenu (prostřednictvím glykoproteinu GP Ib/IX) i agregaci trombocytů mezi sebou (prostřednictvím vazby fibrinogenu a GP IIb/IIIa) [2].
Endotel přispívá k zachování tekutosti krve produkcí inhibitorů koagulace (trombomodulin a heparan sulfát) a agregace destiček (prostacyklin – PGI2 a oxid dusnatý – NO, tzv. faktor relaxující endoteliální buňky), vlivem na cévní tonus a permeabilitu (PGI2 a NO), účinnou bariérou oddělující krevní komponenty od trombogenních subendoteliálních struktur (kolagen, fibronektin, vWF) a zásahem do fibrinolýzy (poměr aktivit tkáňového aktivátoru plazminogenu a inhibitoru aktivátoru plazminogenu, t-PA/PAI-1) – obr. 2 a 3 [1].
Image 2. Antitrombogenní vlastnosti endotelilálních buněk, volně podle [1]. ![Antitrombogenní vlastnosti endotelilálních buněk, volně podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d2c97e06042ba607d795804ec1491a4b.jpg)
Image 3. Trombocyty a intaktní endotel. 
Endotelové buňky nesou na svém povrchu negativní náboj, který odpuzuje stejně negativně nabité trombocyty. Negativní povrchový náboj a antitrombotické vlastnosti endotelu zamezují nekontrolovanému intravaskulárnímu šíření hemostatické reakce indukované cévním poškozením.
Stimulované endotelové buňky syntetizují a uvolňují v okolí místa tvorby hemostatické zátky 2 různé faktory, které tlumí intravaskulární agregaci destiček a vedou k vazodilataci – PGI2 a NO. Podnětem pro syntézu a uvolnění PGI2 může být trombin, epinefrin, trauma apod. Histamin, adenozintrifosfát (ATP) a acetylcholin stimulují v endoteliálních buňkách guanylát cyklázu, která v těchto buňkách zvyšuje hladinu cyklického guanozinmonofosfátu (GMP) s následnou syntézou NO.
Trombomodulin i heparan sulfát, inhibitory trombinu vázané na povrchu endotelových buněk, mohou v okolí omezovat intravaskulární šíření fibrinu. Heparan sulfát cestou aktivace antitrombinu (AT), který inhibuje trombin a F Xa, trombomodulin prostřednictvím vazby trombinu, čímž je omezeno štěpení fibrinogenu, aktivace destiček, F V a F VIII, a naopak je akcelerována aktivace proteinu C (PC) vedoucího k inhibici F Va a F VIIIa a k potenciaci fibrinolýzy (nejspíše vyvázáním PAI-1).
Endotelové buňky ztrácejí své tromboprotektivní vlastnosti po stimulaci trombinem, cytokiny (IL-1, TNF, γ-INF), syntetickými hormony (desmopresin, DDAVP) a endotoxiny. Cytokiny a endotoxiny indukují syntézu TF a PAI-1 a snížení trombomodulinu na povrchu endotelových buněk, DDAVP vede k uvolnění obrovských multimerů vWF, které zvyšují adhezivitu destiček k poškozené cévní stěně. Kromě toho obsahují endotelové buňky řadu receptorů pro vazbu fibronektinu, kolagenu, lamininu, vitronektinu a řady mezibuněčných a endotelových adhezivních molekul.
Receptorem zásadního významu pro vitronektin je glykoproteinový komplex GP V/IIIa (heterodimer αVβ3). Je přítomen na endotelových buňkách, buňkách hladké svaloviny cévní stěny, na makrofázích (ne na cirkulujících monocytech) a v malém množství na trombocytech. Podjednotka αV je ze 36 % srovnatelná s podjednotkou IIb glykoproteinového komplexu GP IIb/IIIa, významného receptoru krevních destiček a, což se zdá být velmi důležité, podjednotka β3 je identická s IIIa podjednotkou zmiňovaného destičkového receptoru. Jeho role pravděpodobně spočívá v adhezivitě těchto buněk ke složkám extracelulární matrix [1].
Endotel je metabolicky i strukturálně velmi heterogenní orgán a jednotlivé buňky se liší v závislosti na lokalizaci a typu cév. Obrat endotelových buněk je nízký za klidových podmínek, ale v místech hemodynamického stresu a poškození proliferace buněk významně narůstá.
Role trombocytů v hemostáze je zcela zásadní. Začíná adhezí destiček k místu poškození cévy s následným rozšířením po celé ploše obnaženého subendotelia a pokračuje sekrecí působků uskladněných v destičkových granulích s cílem vytvořit velké agregáty destiček. Destičková membrána navíc poskytuje fosfolipidový povrch, nezbytný pro adsorpci koagulačních faktorů a průběh plazmatické koagulace. Výsledkem je vytvoření fibrinové sítě zpevňující jinak křehkou primární destičkovou zátku. Zpevněné fibrinové koagulum se působením kontraktilního aparátu destiček retrahuje, čímž se jeho objem zmenšuje a rána se ještě těsněji uzavírá [1].
Adheze trombocytů je komplexní proces iniciovaný jejich kontaktem s nefyziologickými povrchy, například s poškozenou cévou. Zásadní roli zde hraje kolagen pocházející z extracelulární matrix a ze subendotelia. Interakce mezi kolagenem a trombocyty zprostředkovávají různé receptory glykoproteinové povahy zakotvené na povrchu destiček a vWF z plazmy nebo subendotelu (obr. 4 a 5).
Image 4. Aktivace trombocytu pri kontaktu s poškozeným endotelem. 
Image 5. Adheze trombocytu v míste poškození endotelu. 
Von Willebrandův faktor je syntetizován endoteliálními buňkami (a megakaryocyty) a skladován ve Weibelova-Paladehových tělíscích. Nachází se i v subendoteliu, kde je vázán ke kolagenu a fibronektinu. vWF má specifická vazebná místa pro destičkové glykoproteiny GP Ib a GP Iib/IIIa, pro F VIIIC, kolagen, sulfatidy, heparin a botrocetin (protein hadího jedu) [2]. Další z významných rolí vWF je transport a protekce F VIIIC před jeho proteolytickou inaktivací. Vazbou vWF ke kolagenu a k receptorům destiček dochází k lokálnímu zvýšení koncentrace FVIIIC v místě tvorby koagula, což má význam pro další průběh plazmatické koagulace. V klidovém stavu endotelové buňky uvolňují dimery proformy vWF i zralé podjednotky, po stimulaci jsou však zWeibelových-Paladehových tělísek uvolňovány především velké multimery. Ty se přednostně vážou k extracelulární matrix, k fibrinu a podporují adhezi trombocytů [1].
Zakotvení trombocytů k subendotelu umožňuje vazba destičkových GP Ib/IX s vWF fixovaným na kolagen (obr. 6). Podmínkou této vazby je právě fixace vWF ke kolagenu v subendotelu, volně cirkulující plazmatické multimery vWF toto prakticky neumožňují. Díky propojení nitrobuněčné části GP Ib/IX s destičkovým cytoskeletem dochází po vazbě vWF a GP Ib k jeho kontrakci. Ta vede k centralizaci destičkových granulí, jejichž obsah se později uvolňuje do okolí, a k poměrně rychlé tvorbě dlouhých tenkých výběžků – filopodií. Původně diskoidní tvar trombocytů se tak mění na trnitou kouli s četnými filopodii. Povrch destiček nutný pro další průběh plazmatické koagulace se tím zvětšuje až o 50 %.
Image 6. Interakce destickových glykoproteinu s von Willebrandovým faktorem z extralelulární matrix, volne podle [1]. ![Interakce destickových glykoproteinu s von Willebrandovým faktorem z extralelulární matrix, volne podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/553ab122a334b7b97cf94bbfe7e20bd6.jpg)
V podmínkách nízkého střihového stresu jsou hlavními receptory pro adhezi destiček ke kolagenu glykoproteiny GP Ia/IIa, GP VI a velmi pravděpodobně i GP IV, v situaci vysokého střihového stresu přebírá roli primárního receptoru komplex GP Ib/IX/V [2]. Cirkulující destičky v klidovém stavu nemohou molekuly fibrinogenu vázat, protože komplex GP IIb/IIIa není aktivován. Teprve konformační změny v trombocytech vzniklé po vazbě vWF – GP Ib/IX vedou k aktivaci komplexů GP Iib/IIIa, které pak mohou vázat fibrinogen. Molekuly fibrinogenu vytvářejí můstky mezi jednotlivými destičkami, což je podkladem agregace destiček.
V případě nedostatku fibrinogenu a/nebo v místech vysokého střihového stresu plní roli můstku mezi agregujícími destičkami vWF, který se ke GP IIb/IIIa za těchto okolností může vázat také. Dvě možnosti vazby vWF k destičkám jsou dány dvěma doménami na každé podjednotce vWF. Tyto domény nesou místo pro vazbu GP Ib (amino-terminal doména podjednotek vWF) a GP IIb/IIIa (na ADP závislá karboxy-terminal doména podjednotek vWF). Multimerický charakter vWF fixovaného v extracelulární matrix nabízí velké množství vazebných míst na malém prostoru, což zajišťuje podstatně větší funkční afinitu, než umožňuje cirkulující vWF (v tekuté fázi). Neobvykle velké multimery vWF uvolňované stresovanými endotelovými buňkami mohou přispět k tvorbě okluzivních destičkových trombů v malých tepnách a arteriolách, které jsou zúžené aterosklerotickými pláty nebo cévním spazmem [1].
Z mikroskopického sledování časné fáze vzniku hemostatické zátky vyplývá významnost afinity destiček ke kolagenním vláknům subendotelia [4]. Receptorem destiček pro kolagen typu I a IV je GP Ia/IIa. Kolagen může indukovat uvolnění ADP a oxygenaci arachidonové kyseliny vedoucí k tvorbě tromboxanu A2 (TXA2). ADP i TXA2 jsou součástí buněčné odpovědi na aktivaci včetně změny tvaru destiček a aktivace GP Iib/IIIa [5,6,7].
Řada agonistů, jako jsou ADP a destičky aktivující faktor (PAF), se váže ke specifickým receptorům destiček a pravděpodobně prostřednictvím guanozintrifosfátu (G-protein) aktivuje fosfolipázu C (PLC) (obr. 7). PLC štěpí fosfatidyl inozitol bifosfát (PIP2) na inozitol trifosfát (IP3), který mobilizuje u denzních granulí Ca++. Uvolněné ionty Ca++ aktivují kinázu lehkých řetězců myozinu (MLCK), která fosforyluje lehké řetězce myozinu (MLC) na MLC-PO4. Ca++ kromě toho aktivuje fosfolipázu A2 (PLA2) s následným uvolněním arachidonové kyseliny z destičkových fosfolipidů, která je cyklooxygenázou (CO) přeměněna na PGG2 a PGH2 a dále tromboxansyntetázou (TS) na TXA2. Další produkt štěpení PIP2 je diacylglycerol (DAG), který stimuluje protein kinázu C (PKC) k fosforylaci nitrobuněčného proteinu P47 na P47-PO4. Prioritním cílem aktivity MLC-PO4, TXA2 a P47-PO4 je spuštění sekrece denzních alfa granulí a lyzozomů, a tedy podpora agregace trombocytů mezi sebou.
Image 7. Biochemie stimulovaného trombocytu, volně podle [1]. ![Biochemie stimulovaného trombocytu, volně podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/04481dc491437b1a1d17791d490f736d.jpg)
Hlavní rolí destičkových atomistů, jako jsou ADP, epinefrin a trombin, je aktivace destičkových receptorů pro fibrinogen (obr. 8). GP IIb/IIIa je transmembránový protein, jehož nitrobuněčná část je svázána s aktinem. V klidovém stavu je mezi oběma podjednotkami jiný transmembránový protein – agregin, který znemožňuje kontakt obou podjednotek nutný k aktivaci komplexu a který je také na vnitřní straně destičkové membrány vázán na aktin. Aktivace receptoru může probíhat dvěma mechanizmy. ADP vede po vazbě na agregin ke konformačním změnám jeho molekuly, což způsobí, že agregin již déle nebrání sjednocení obou podjednotek GP IIb/III, a tedy jeho aktivaci. Aktivace tohoto receptoru trombinem probíhá nezávisle na ADP. Trombin prostřednictvím vazby na svůj receptor aktivuje proteinkinázu C a zvyšuje inozitol trifosfát, a touto cestou uvolňuje Ca++ a aktivuje kalpain. Kalpain může štěpit agregin na nízkomolekulární peptidy, které umožní sjednocení obou podjednotek GP IIb/IIIa (obr. 9) [1].
Image 8. Schéma struktury glykoproteinového komplexu GP IIb/IIIa, volně podle [1]. ![Schéma struktury glykoproteinového komplexu GP IIb/IIIa, volně podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/126cc08f60a989489377c99adbfa6d57.jpg)
Image 9. Pracovní model aktivace komplexu GPIIb/IIIa, volně podle [1]. ![Pracovní model aktivace komplexu GPIIb/IIIa, volně podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/615fc2ff0abc651025f58ba570f099bf.jpg)
Interakce destičkového GP Iib/IIIa s fibrinogenem hraje hlavní roli v agregaci, v adhezi destiček k povrchům a při zpevnění primární destičkové zátky fibrinovým koagulem [8,9,10]. Komplex GP IIb/IIIa patří do rodiny integrinů, adhezivních membránových receptorů zodpovědných za interakce buněk mezi sebou a k matrix. Je hlavní komponentou destičkové membrány (50 000, podle některých prací až 80 000 kopií na každém trombocytu) a jeho snížení, absence nebo mutace je podkladem Glanzmannovy trombastenie, hereditární hemoragické choroby. Jako ostatní integriny jde o transmembránovou heterodimerickou molekulu αIIbβ3. Glykoprotein IIb (αIIb) sestává ze dvou podjednotek spojených disulfidovými můstky (lehký a těžký řetězec), naproti tomu GP IIIa (β3) je tvořen jen jedním polypeptidovým řetězcem (obr. 8) [9]. Obě komponenty vytvářejí na povrchu destičkové membrány Ca++-dependentní komplex v poměru 1 : 1 [1]. Vazebná místa pro fibrinogen se nacházejí na obou podjednotkách (GP IIb i GP IIIa), přičemž γ-řetězec fibrinogenu se váže k sekvenci aminokyselin 294 až 314 GP IIb podjednotky [16,17], RGD-peptid je v oblasti sekvence aminokyselin 109–171 GP IIIa a další region umožňující vazbu fibrinogenu je v oblasti 211–222 GP IIIa. GP IIb/IIIa váže 4 různé adhezivní proteiny: fibrinogen, vWF, fibronektin a vitronektin [1,8,9,10,11]. Jak již bylo podrobně popsáno výše, fibrinogen ani ostatní adhezivní molekuly se nevážou k trombocytům v klidovém stavu; vazebná místa musí být vystavena účinku ADP, jiných destičkových agonistů, nebo proteolytických enzymů. Vazba vWF a GP IIb/IIIa podporuje adhezi destiček k subendoteliu, trombospondin, zdá se, potencuje agregaci tvorbou komplexů s fibrinogenem.
Molekula fibrinogenu je složena ze 3 párů řetězců α, β a γ a nese 3 vazebná místa rozpoznatelná destičkovým GP IIb/IIIa: dodekapeptid (HHLGGAKQAG-DV) lokalizovaný v C-terminální části (zbytky 400 až 411) γ-řetězce fibrinogenu, RGDF-sekvence (zbytky 95 až 98) a RGDS-sekvence (zbytky 572 až 575) ze 610 aminokyselin α-řetězce fibrinogenu [12,13]. C-terminální dodekapeptid γ-řetězce fibrinogenu je pro vazbu fibrinogenu k destičkám nejvýznamnější (obr. 10 a 11) [14]. Podle jedné práce tak každá molekula fibrinogenu obrácená k destičce nese 3 vazebná místa umožňující hexavalentní interakci fibrinogenu a destičky. Podle jiné práce jsou pro interakci fibrinogenu s destičkami významná jen 2 místa – RGDF-sekvence α-řetězce a dodekapeptid γ-řetězce [15].
Image 10. Schéma molekuly fibrinogenu s vazebnými místy pro GPIIb/IIIa, volně podle [1]. ![Schéma molekuly fibrinogenu s vazebnými místy pro GPIIb/IIIa, volně podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f72a72d9e6df9d1c1b5c7b2ddf3f6673.jpg)
Image 11. Vazba fibrinogenu na destičkový GPIIb/IIIa, volně podle [1]. ![Vazba fibrinogenu na destičkový GPIIb/IIIa, volně podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f25e5e99b440ed624934af65f21df8cb.jpg)
Aktivace GP IIb/IIIa spouští proces agregace trombocytů (obr. 12 a 13). Dimerické molekuly fibrinogenu se vážou ke GP IIb/IIIa a spojují 2 destičky mezi sebou. Stejným mechanizmem se postupně na sebe nabaluje stále více trombocytů (efekt sněhové koule). Fibrinogen není tedy významný jen v plazmatické koagulaci, hraje také klíčovou roli v primární hemostáze.
Image 12. Postupující agregace trombocytů. 
Image 13. Vznik primární destičkové zátky. 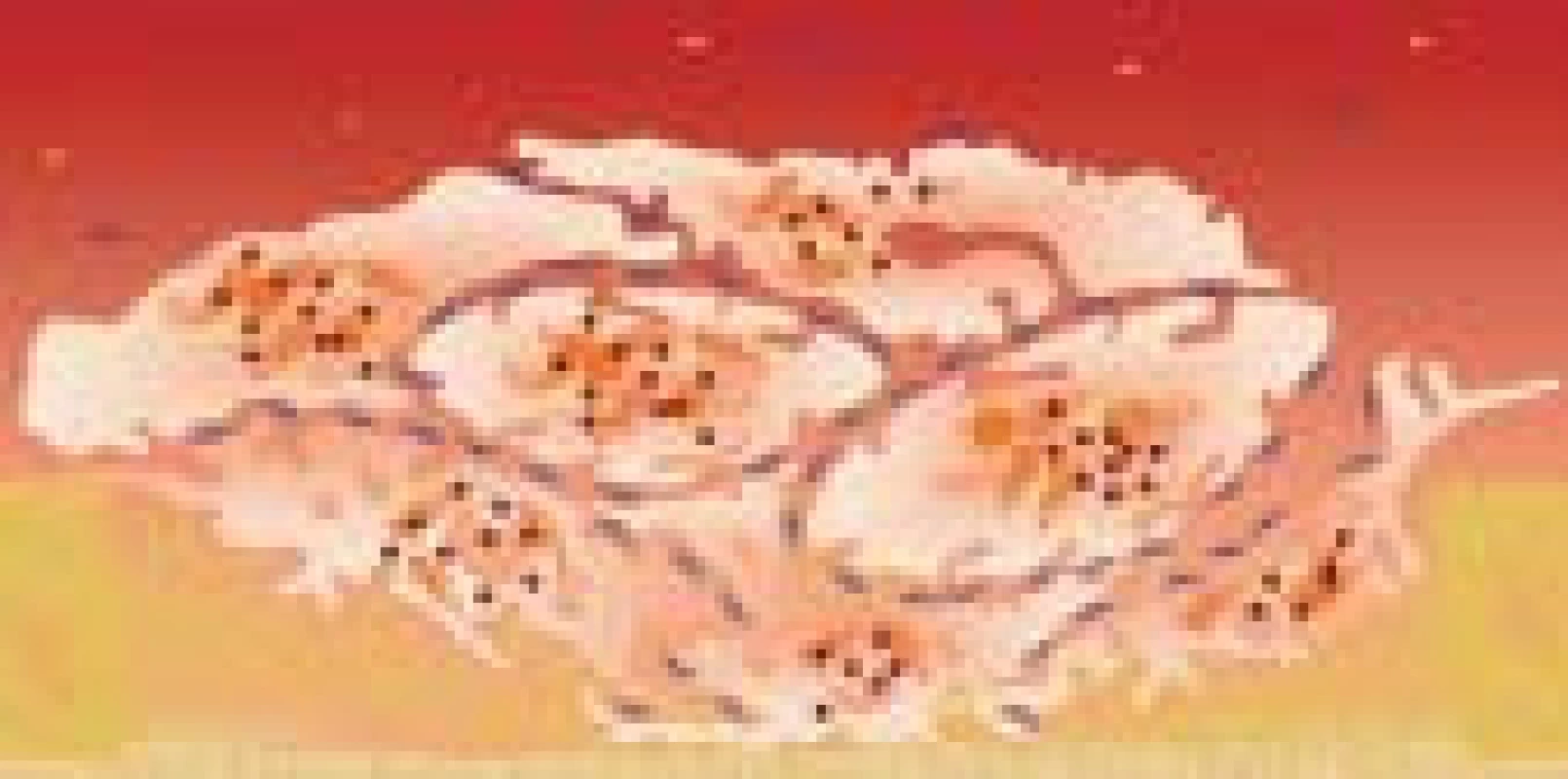
Destičková membrána bohatá na fosfolipidy umožňuje rychlý průběh plazmatické koagulace (generace trombinu v přítomnosti buněčné složky probíhá 300 000krát intenzivněji než v bezbuněčném prostředí) [1]. Trombin přeměňuje fibrinogen na monomery fibrinu, které polymerizují, fibrinová vlákna obalují primární hemostatickou zátku, čímž vzniká odolnější sekundární zátka (obr. 14). Působením trombinem aktivovaného F XIII dochází k zesíťovatění fibrinových vláken. Kontrakce filopodií adherovaných k vláknům fibrinu vede k retrakci koagula vedoucí k pevnějšímu uzavření rány (obr. 15).
Image 14. Aktivace koagulace na povrchu destiček. 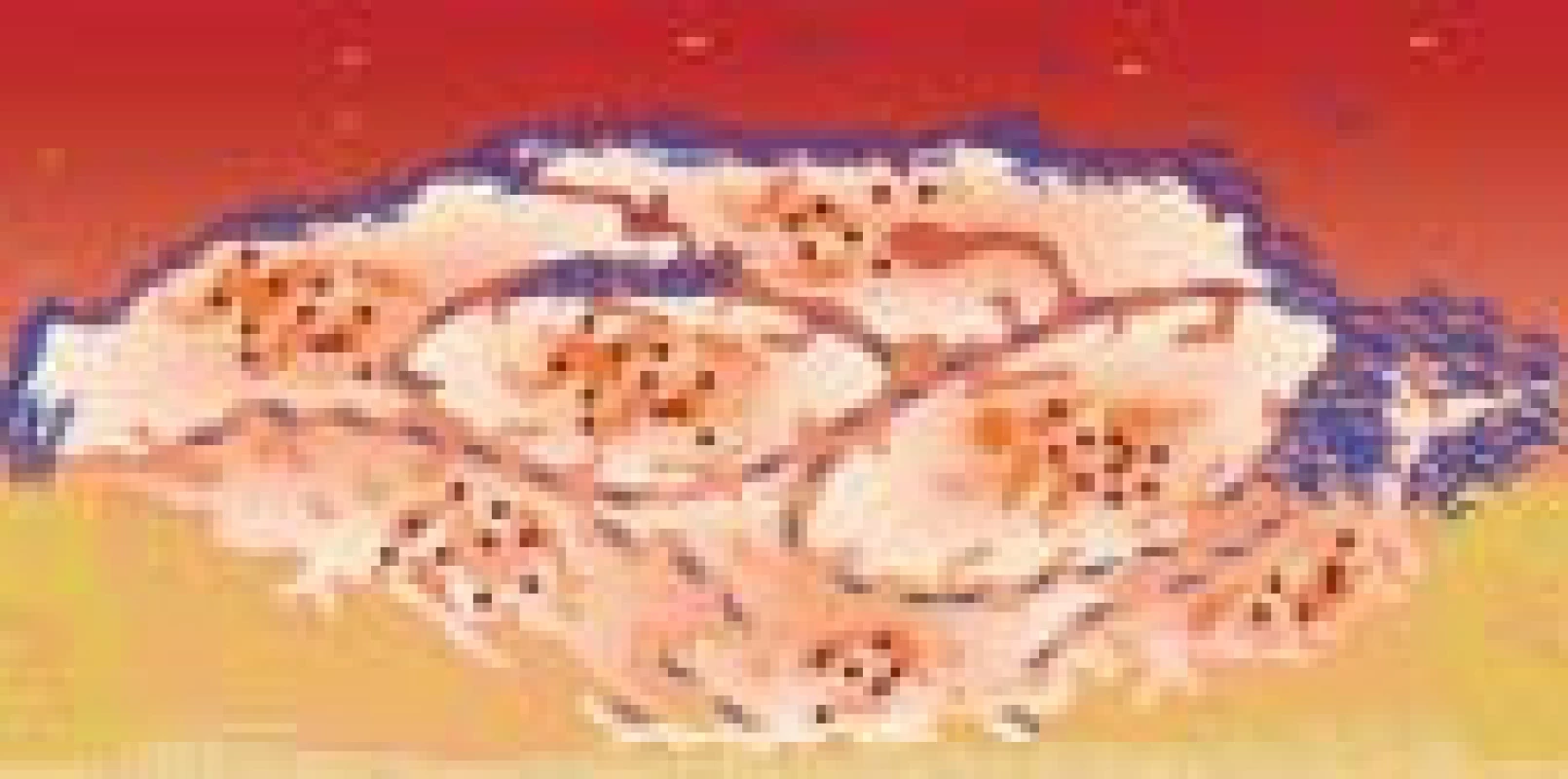
MUDr. Jaromír Gumulec
www.pr-lab.cz
e-mail: jaromir.gumulec@pr-lab.cz
Doručeno do redakce: 11. 3. 2005
Přijato k otištění: 11. 3. 2005
Sources
1. Colman RW, Marder VJ, Salzman EW et al. Plasma coagulation factor. In: Colman RW, Hirsh J, Marder VJ et al (eds). Hemostasis and thrombosis, basic principles and clinical practice. 3rd ed. Philadelphia: Lippincott 1994 : 1275–1296.
2. Kolde HJ. Haemostasis. Physiology, Pathology, Diagnostics. 1st ed. Basel: Pentapharm 2001.
3. Puchmayer V, Roztočil K. Praktická angiologie. 2. vyd. Praha: Triton 2003.
4. Spaet TH, Zucker MB. Mechanism of platelet plug formation and role of adenosin diphosphate. Am J Physiol 1964; 207 : 1267.
5. Huang TF, Holt JC, Lukasiewicz H et al. Trigramin, a low molecular weight peptide inhibiting fibrinogen interaction with platelet receptors expressed on glycoprotein IIb–IIIa complex. J Biol Chem 1987; 262 : 16157.
6. Kinlough-Rathbone R, Reimers H, Mustard J. Sodium arachidonate can induce platelet shape change and aggregation which are independent of the release reaction. Science 1976; 192 : 1011.
7. Colman RW, Figures WR, Scearce LM et al. Inhibition of collagen-induced platelet activation by 5’-p-fluorosulfonylbenzoyl adenosine: Evidence for an ADP requirement and synergistic influence of prostaglandin endoperoxides. Blood 1986; 68 : 563.
8. Gaarder A, Jonsen J, Laland S et al. Adenosine diphosphate in red cells as a factor in the adhesiveness of human blood platelets. Nature 1961; 192 : 531.
9. Shattil SJ, Brass LF. Induction of the fibrinogen receptor on human platelets by intracellular mediators. J Biol Chem 1987; 262 : 992.
10. Niewiarowski S, Kornecki E, Budzynski AZ et al. Fibrinogen interaction with platelet receptors. Ann NY Acad Sci 1983; 408 : 536.
11. Pytela R, Pierschbacher MD, Ginsberg EF et al. Platelet membrane glycoproteine IIb/IIIa: Member of a family of arg-gly-asp-specific adhesion receptors. Science 1986; 231 : 1559.
12. Kloczewiak M, Timmons S, Lukas TJ et al. Platelet receptor recognition site on human fibrinogen. Synthesis and structure-function relationship of peptides corresponding to the carboxy-terminal segment of the gamma chain. Biochemistry 1984; 23 : 1767.
13. Doolitle RF, Watt KWK, Cottrell BA et al. The amino acid sequence of the α chain of human fibrinogen. Nature 1979; 280 : 464.
14. Farrel DH, Thiagarajan P, Huang S et al. Role of fibrinogen α and γ chain sites in platelet aggregation. Proc Natl Acad Sci USA 1992; 89 : 10729.
15. Andrieux A, Hudry-Clergeon G, Ryckewaert JJ et al. Amino acid sequences in fibrinogen mediating its
interaction with its platelet receptor, GPIIb–IIIa. J Biol Chem 1989; 28 : 2909.
16. Parise LV, Steiner B, Nannizzi L et al. Fibrinogen binding sites exist on glycoprotein IIb and IIIa. Blood 1987; 70(Suppl 1): 357a.
17. D’Souza SE, Ginsberg MH, Burke TA et al. The ligand binding site of the paltelet integrin receptor GPIIb–IIIa is proximal to the second calcium binding domain of it’s α subunit. J Biol Chem 1990; 256 : 3440.
18. Zimmerman FH, Cameron A, Fisher LD et al. Myocardial infarction in young adults: Angiographic characterization, risk factors and prognosis (Coronary Artery Surgery Registry). J Am Coll Cardiol 1995; 26 : 654.
19. Kanitz MG, Giovannucci SI, Jones JS et al. Myocardial infarction in young adults: Rick factors and clinical features. J Emerg Med 1996; 14 : 139.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 7 a 8-
All articles in this issue
- Ohlédnutí a perspektivy současné hematologie
- Primární antitrombotická prevence žilní trombózy ve vnitřním lékařství
- Antikoagulační léčba flebotrombóz v ambulantní praxi
- Invazivní kontrolovaná léčba hluboké žilní trombózy
- Glykoprotein IIb/IIIa destičkové membrány z hlediska jeho genetických změn
- Trombocytopenické purpury
- Trombocytózy a trombocytemie
- Antitrombotická léčba v etiologii akutní posthemoragické anémie
- Anémie chronických chorob
- Autoimunitní hemolytické anémie
- Některé vzácnější formy hereditárních anémií vyskytující se v dospělé populaci v ČR - β-talasemie a nestabilní hemoglobinové varianty
- Zajištění spolehlivosti vyšetření krevních obrazů
- Fenotypová a genotypová analýza vrodenej hypofibrinogenémie a dysfibrinogenémie
- Antifosfolipidový syndrom – diagnostika a léčba
- Trombofilní stavy
- Protidestičková léčba
- Glykoproteiny destičkové membrány z hlediska jejich genetických změn
- Glykoprotein Ia/IIa destičkové membrány z hlediska jeho genetických změn
- Hemoterapie a její bezpečnost
- Potransfuzní reakce
- Refrakterita k trombocytovým transfuzním přípravkům
- Hemovigilance
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Potransfuzní reakce
- Trombocytózy a trombocytemie
- Antifosfolipidový syndrom – diagnostika a léčba
- Protidestičková léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


