-
Medical journals
- Career
Incizionální a neincizionální síňové makroreentry tachykardie u dospělých pacientů
Příčiny, principy mapování a dlouhodobé výsledky katétrové ablace
Authors: M. Fiala 1,2; J. Chovančík 1; P. Heinc 2; R. Neuwirth 1; I. Nykl 1; R. Nevřalová 1; M. Branny 1
Authors‘ workplace: Kardiocentrum Nemocnice Podlesí, Třinec, přednosta prim MUDr. Marian Branny 1; I. interní klinika Lékařské fakulty UP a FN, Olomouc, přednosta prof. MUDr. Jan Lukl, CSc. 2
Published in: Vnitř Lék 2005; 51(11): 1236-1247
Category: Original Contributions
Overview
Síňové makroreentry tachykardie (SMRT) nezávislé na subeustachovském můstku představují vzácnější skupinu různých reentry okruhů vznikajících v důsledku individuálních arytmogenních substrátů.
Cílem práce je prezentovat příčiny, možnosti mapování a výsledky katétrové ablace těchto arytmií.Soubor nemocných a metodika:
Bylo vyšetřeno 42 nemocných (11 žen), průměrného věku 57,2 ± 12,8 let, s klinicky významnou SMRT. Z nich 18 nemocných mělo strukturální postižení srdce a 24 pacientů nemělo významné strukturální postižení srdce. Elektroanatomické mapování bylo použito ve 33 (67 %) ze 49 výkonů.Výsledky:
Pacienti podstoupili 49 výkonů s katétrovou ablací, při nichž bylo cíleno 59 kritických míst reentry okruhů a celkem eliminováno 70 morfologií o 61 frekvencích mapovatelné SMRT. 56 morfologií (41 v pravé síni a 15 v levé síni) o 49 frekvencích (35 v pravé síni a 14 v levé síni) bylo odstraněno lineární radiofrekvenční (RF) lézí. 14 morfologií o 12 frekvencích (v pravé síni) bylo odstraněno fokální RF lézí. U 20 pacientů byla provedena i katétrová ablace flutteru síní I. typu. U 6 pacientů byl použit také anatomický přístup k ablaci pomocí lineárních lézí k odstranění nemapovatelných SMRT. Bezprostředně na konci výkonu bylo dosaženo úplné nevyvolatelnosti SMRT u 37 (88 %) pacientů, z toho u 31 ze 32 pacientů (97 %) s pravosíňovou SMRT a u 6 z 10 pacientů (60 %)s levosíňovou SMRT. V průběhu dlouhodobého sledování 34 ± 24,7 měsíce od posledního výkonu nemělo 39 pacientů (93 %) recidivu SMRT. 7 pacientů (17 %) mělo v období po ablaci paroxyzmální fibrilaci síní.Závěr:
SMRT se vyskytují při různých kardiopatiích, ale i bez souvislosti s významným strukturálním postižením srdce, typicky ve více morfologiích a frekvencích. Anatomii srdečních síní a šíření elektrické depolarizace při SMRT lze věrně zrekonstruovat elektroanantomickým mapováním a SMRT mohou být s vysokou účinností eliminovány fokální nebo lineární RF lézí. Dlouhodobý efekt katétrové ablace je příznivý a sklon ke vzniku fibrilace síní je relativně malý.Klíčová slova:
síňová makroreentry tachykardie - konveční mapování - elektroanatomické mapování - katétrová ablaceÚvod
Síňové makroreentry tachykardie (SMRT), které se vyskytují nezávisle na tzv. subeustachovském můstku, představují široké spektrum individuálních reentry okruhů [16]. Příčiny jejich vzniku jsou různé. Mohou se objevit jako důsledek předchozích chirurgických zásahů na srdci a ve svém názvu pak nesou přívlastek „incizionální“ [1,3,11,14,19]. Jindy doprovázejí různé kardiopatie, ale mohou se objevit i u pacientů bez zjevného strukturálního postižení srdce detekovatelného současnými zobrazovacími metodami [7,8,9,10,12,13,15]. Také mohou vzniknout v důsledku předchozí ablace, typicky po rozsáhlejších obkružujících lézích v levé srdeční síni v léčbě fibrilace síní [5,18]. Společným jmenovatelem těchto arytmií je přítomnost abnormálních bariér pro vedení elektrického vzruchu, reprezentovaných především okrsky jizevnaté tkáně. Tyto abnormální bariéry společně s přirozenými bariérami, jako jsou ústí cév a síňokomorové prstence, vytvářejí prostředí vhodné ke vzniku reentry mechanizmu.
Na rozdíl od flutteru síní I. typu, jehož reentry okruh je v základních rysech u všech pacientů stejný a jenž je do značné míry produktem normální anatomické stavby a převodních funkcí pravé srdeční síně, SMRT jsou u každého pacienta individuální a liší se tvarem reentry okruhu a lokalizací jeho kritického místa. Proto nelze při jejich mapování užít jednoduché anatomické vodítko, ale vždy je nutné určit charakter reentry okruhu a především přesně stanovit jeho kritické místo, ve kterém je tento okruh nejužší a nejzranitelnější. Katétrová ablace v tomto místě vede k trvalému přerušení reentry okruhu a odstranění dotyčné tachykardie.
Použití konvenčního mapování neumožňuje přesnou anatomickou definici celého reentry okruhu, ale lze jím poměrně přesně stanovit kritické místo na reentry okruhu [1,3,7,11]. Je to metoda poměrně pracná a náročná na představivost vyšetřujícího. Použitím trojrozměrného elektroanatomického mapování se daří celý reentry okruh zobrazit přesně a pomocí navigace ablačního katétru se mohou snadno provádět i cílené lineární léze napříč kritickými místy reentry okruhu [2,4,14]. Cílem této práce je prezentace techniky mapování a dlouhodobých klinických výsledků katétrové ablace u pacientů se SMRT v obou srdečních síních.
Soubor nemocných a metodika
Soubor pacientů
Od ledna roku 1998 do července roku 2004 bylo provedeno elektrofyziologické vyšetření a katétrová ablace pro klinicky významnou SMRT u 42 po sobě následujících pacientů (z toho 11 žen) průměrného věku 57,2 ± 12,8 (42-79) let. U 18 pacientů byly základním strukturálním postižením srdce stav po operaci defektu septa síní, případně v kombinaci s jinou vrozenou srdeční vadou, dále postižení mitrální chlopně bez předchozí operace či po mitrální komisurotomii, respektive po náhradě mitrální chlopně mechanickou protézou, stav po operaci konstriktivní perikarditidy a nebo stav po infarktu myokardu. U 24 pacientů nebylo možné detektovat žádné významné strukturální postižení srdce i při vyšetření transezofageální echokardiografií. Koronarografie provedená u 15 z těchto 24 pacientů odhalila normální nález na věnčitých tepnách. Dva z těchto pacientů v minulosti podstoupili katétrovou ablaci pro fibrilaci síní v levé srdeční síní, ale jen u jednoho z nich byl tento výkon v přímé souvislosti se vznikem SMRT. Podrobnosti jsou uvedeny v tab. 1.
Table 1. Základní charakteristiky souboru nemocných. 
Elektrofyziologické vyšetření
K provedení elektrofyziologického vyšetření, mapování a katétrové ablace byly obvykle zavedeny jeden 20polární katétr (Daig) k mapování pravé srdeční síně, jeden 10polární katétr (Daig) k mapování uvnitř koronárního sinu a jeden 7 F řiditelný katétr se 4mm koncovou elektrodou (Biosense Webster) k podrobnějšímu mapování a aplikaci radiofrekvenční (RF) energie. K mapování a ablaci v levé srdeční síni byl transseptálně zaveden 1 mapovací/ablační katétr.
Při konvenčním mapování byly intrakardiální bipolární elektrokardiogramy filtrované v pásmu 30-400 Hz zaznamenávány v digitální formě na mnohakanálovém registračním zařízení (Cardiolab Systém, Prucka Engineering).
Elektroanatomické mapování bylo prováděno se 7F řiditelným katétrem (Navi-Star, Biosense Webster) a bipolární elektrokardiogramy filtrované v pásmu 10-400 Hz byly zaznamenány na elektroanatomickém a současně na konvečním registračním systému. Jako časový referenční bod byl použit bipolární signál z katétru umístěného v koronárním sinu nebo z katétru s aktivní fixací umístěného v pravé srdeční síni.
Jako zdroj RF byl použit buď generátor HAT 200S (Osypka) nebo Stockert (Biosense Webster).
Součástí výkonu je provedení standardního diagnostického vyšetření se stanovením základních převodních parametrů. K vyvolání všech existujících forem SMRT a k hodnocení bezprostředního výsledku, jímž je posouzení vyvolatelnosti či nevyvolatelnosti SMRT na konci výkonu (s odstupem nejméně 15-20 minut od ablace), byla prováděna vzestupná a programovaná stimulace síní.
Důležitým krokem diagnostické části výkonu před případným provedením transseptální punkce bylo rozlišení, zda SMRT vychází z pravé nebo levé srdeční síně. Pro pravosíňovou SMRT svědčí následující kritéria: 1. kontinuální aktivace v pravé srdeční síni pokrývající celou délku cyklu tachykardie, při níž se pozdní aktivace objevuje v blízkosti aktivace časné; 2. entrainment se skrytým splynutím (viz dále) s poststimulačním intervalem < 30 ms a s intrakardiální aktivační sekvencí shodnou s aktivační sekvencí při tachykardii dosažený při stimulaci v místech, o kterých se předpokládá, že jsou součástí reentry okruhu. Přítomnost levosíňové SMRT je před zavedením katétru do levé síně podporována následujícími kritérii: 1. aktivací podél koronárního sinu s odlišnou sekvencí než od přepážky k levé laterální stěně; 2. pasivní (nikoli reentry) aktivací pravé srdeční síně s nejčasnější aktivací pravé síně v oblasti síňové přepážky, obvykle v oblasti Bachmanova svazku, ale i níže; 3. poststimulačním intervalem přesahujícím 30 ms při vyšetření entrainmentu (viz dále), kdekoli v pravé srdeční síni, v praxi na nejméně 5 místech, u nichž lze podle přítomného potenciálu připustit, že by mohla být součástí reentry okruhu.
Konvenční mapování a katétrová ablace reentry okruhu
Principem konvenčního mapování SMRT je určení a odhad rozsahu kritického místa reentry okruhu. Při běžící tachykardii, případně i při sinusovém rytmu, jsou definovány oblasti, které nejeví žádnou elektrickou aktivitu a/nebo oblasti s dvojitými potenciály. V blízkosti těchto oblastí zájmu jsou při běžící tachykardii vyhledávány více či méně abnormální frakcionované potenciály dlouhého trvání a nízké amplitudy, lokalizované v diastolické fázi vůči aktivaci okolního normálního myokardu (obr. 1). Pokud se před vyvoláním tachykardie provede mapování při sinusovém rytmu, lze dokumentovat, že oblasti s abnormálními diastolickými potenciály při tachykardii korespondují s oblastmi, ve kterých jsou snímány pozdní potenciály při sinusovém rytmu (obr. 2). V některých případech lze u delších užších jizev, např. jizev po pravosíňové laterální atriotomii, sledovat při makroreentry tachykardii elektrickou aktivaci šířící se kolem jizvy. Projevuje se jako linie dvojitých potenciálů reprezentující aktivaci podél jedné a druhé strany jizvy, splývajících na jednom konci jizvy v pivotním bodě do splynulého frakcionovaného potenciálu (obr. 3). Tento potenciál většinou představuje aktivaci kritického místa reentry okruhu a stopování podél linie dvojitých potenciálů je umožňuje poměrně pohotově stanovit. Skutečnost, že diastolický potenciál reprezentuje aktivaci kritického místa reentry okruhu, je definitivně potvrzena tzv. entrainmentem se skrytým splynutím (obr. 4). Principy entrainmentu byly vysvětleny dříve [5,17].
Image 1. Elektrická aktivace kritické oblasti reentry okruhu SMRT s diastolickým potenciálem. Jedná se o příklad pravosíňové makroreentry tachykardie, která vznikla v důsledku přítomnosti dvou kompaktních elektricky němých oblastí (jizev) označených šedou barvou v elektroanatomické mapě (B), ohraničujících úzké kritické místo reentry okruhu. Aktivace kritického místa se projevuje pomalým vedením a diastolickým frakcionovaným potenciálem o nízké amplitudě ve svodu MAPdist z ablačního katetru (šipka) (A). Tachykardie je udržována kroužením elektrického vzruchu po dvou makroreentry okruzích kolem obou kompaktních jizev, společným místem těchto okruhů je kritická oblast mezi jizvami. V elektroanatomické mapě (B) jsou reentry okruhy znázorněny dvěma elipsami se směrovou šipkou, postup elektrické aktivace je znázorněn v barevném spektru, v němž červená barva představuje aktivaci časnou a fialová barva aktivaci pozdní. Kritická oblast je dostatečně úzká, aby zde mohl být reentry okruh přerušen jednou aplikací RF energie. 
Vysvětlivky: 19,20 až 1,2 – intrakardiální bipolární záznamy z proximální až distální dvojice elektrod z 20polárního katétru v pravé srdeční síni, CS 7,8 a 5,6 – bipolární záznamy z katétru v koronárním sinu, SVC – horní dutá žíla, IVC – dolní dutá žíla, TA – trikuspidální prstenec, rychlost EKG záznamu 200 mm/s Image 2. Pozdní potenciál při sinusovém rytmu. V místě, v němž je při tachykardii přítomen diastolický potenciál, je při sinusovém rytmu snímán ablačním katétrem (MAPdist, MAPprox) a také blízko uloženými distálními svody dvacetipolárního katétru [3,4; 1,2) pozdní potenciál (šipky). Tento potenciál je projevem aktivace relativně úzkého místa, které, pokud běží tachykardie, se uplatňuje jako kritické místo reentry okruhu. B: Při aplikaci RF-energie do tohoto místa dochází k odstranění pozdního potenciálu a přerušení vedení elektrického potenciálu tímto místem. Jestliže předchozí aplikace RF energie v tomto místě vedla k ukončení běžící tachykardie, teprve následná eliminace pozdních potenciálů při sinusovém rytmu spojená s přerušením vedení napříč touto oblastí je zárukou trvalého odstranění SMRT. 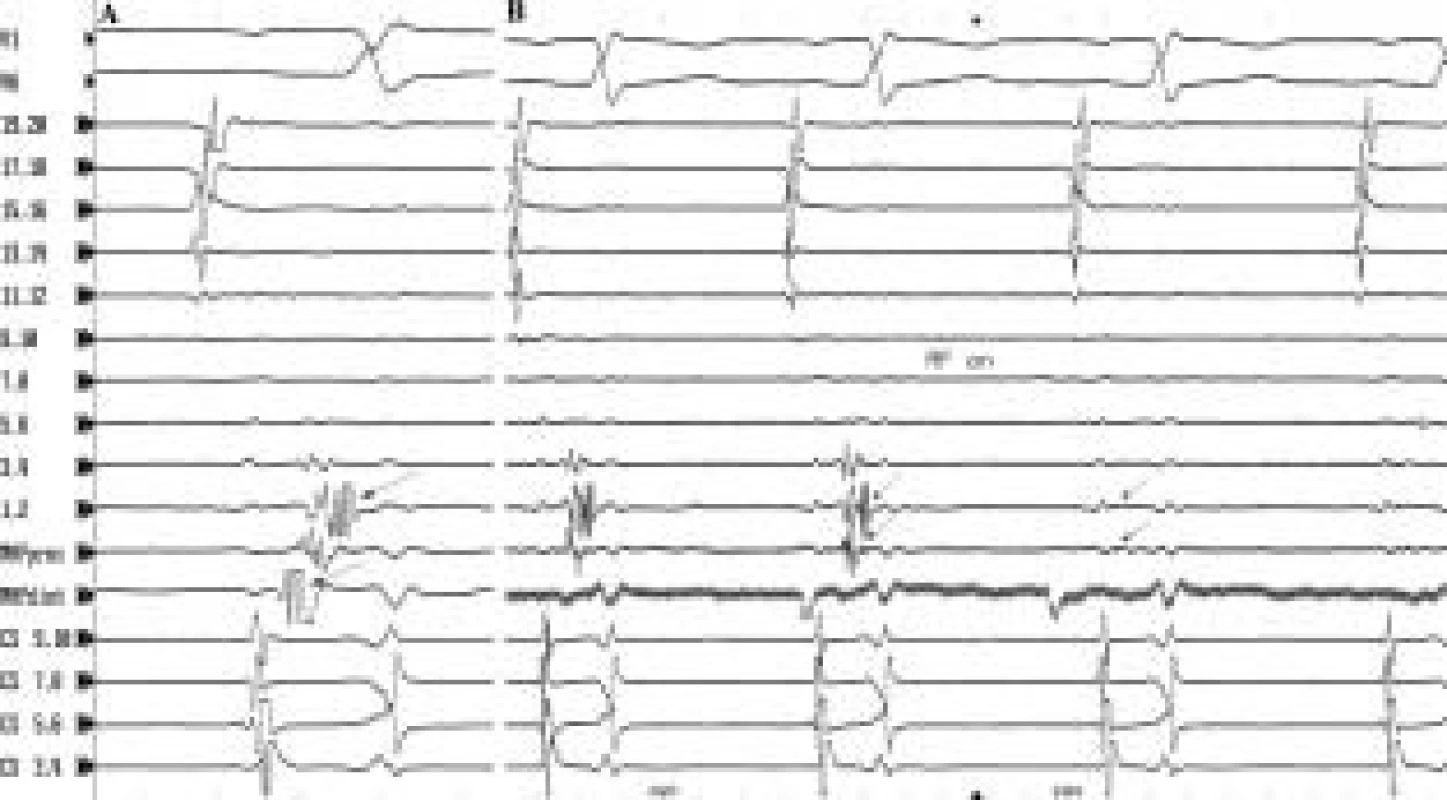
Vysvětlivky jako na obr. 1; CS 9,10 – 3,4 jsou záznamy z katétru v koronárním sinu; rychlost posunu EKG na obr. A je 200 mm/s, na obr. B 100 mm/s Image 3. „Incizionální“ SMRT s linií dvojitých potenciálů kolem jizvy po atriotomii. V bipolárních záznamech 13,14 až 1,2 z 20polárního katétru snímaných z laterální stěny pravé síně je možné sledovat dvojité potenciály, které reprezentují aktivaci šířící se v různé době po obou stranách jizvy. Přiklonění 20polárního katétru k jedné nebo druhé straně jizvy zvýrazní potenciály představující jednu nebo druhou aktivační frontu (velké šipky) (A, B). V části B v záznamu z ablačního katétru (MAPdist) je vidět splynutí těchto dvou aktivačních front do jednoho frakcionovaného potenciálu v dolním pivotním bodě mezi atriotomií a ústím dolní duté žíly (šipky v MAPdist). Možnost sledovat obě aktivační fronty propagující se kolem atriotomie zrychluje vyhledání kritického místa reentry okruhu. 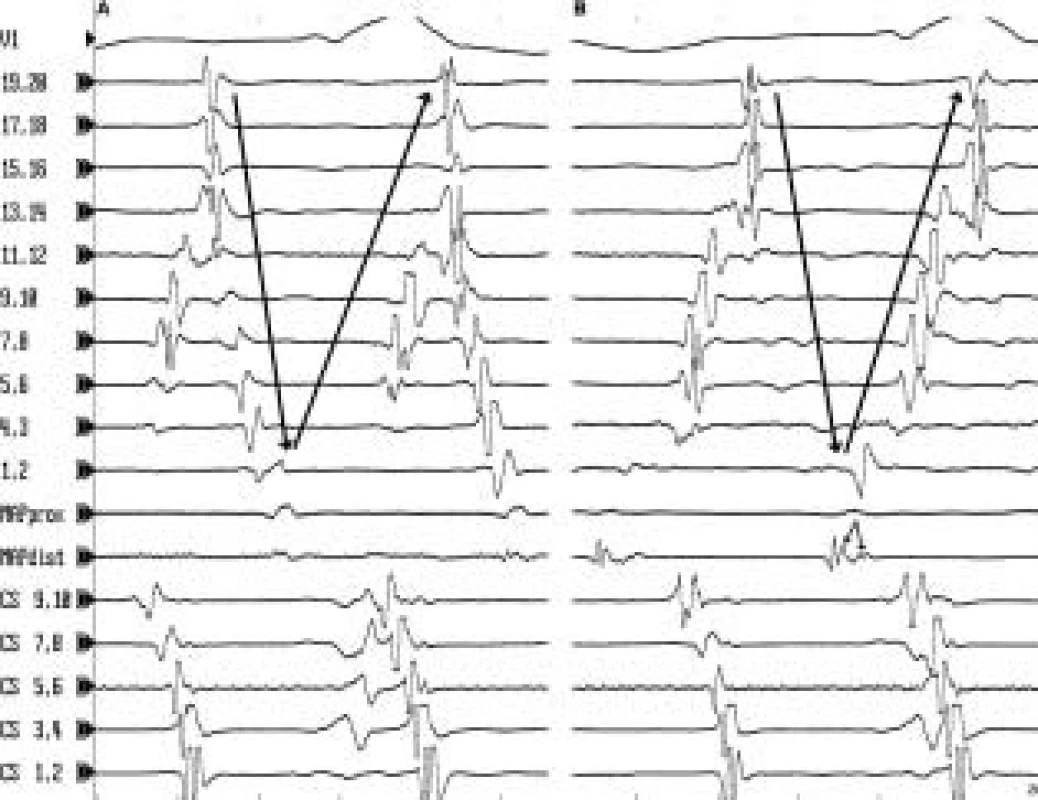
Vysvětlivky: CS 9,10 – 1,2 jsou bipolární záznamy z katétru v koronárním sinu Image 4. Entrainment se skrytým splynutím. A. Síňová makroreentry tachykardie s diastolickým potenciálem (MAPdist) snímaným v kritickém místě reentry okruhu. B. Při stimulaci do kritického místa reentry tachykardie při běžící tachykardii o frekvenci lehce rychlejší než je frekvence tachykardie dojde k urychlení aktivace velké části dotyčného reentry okruhu na frekvenci stimulace, aniž by se změnila morfologie aktivace síní snímaná intrakardiálně. Při srovnání stimulované a spontánní tachykardické aktivace jsou zachovány intervaly mezi aktivací kritické oblasti a potenciály v ostatních místech v srdečních síních. Došlo k najetí, čili tzv. entrainmentu do tachykardie. Po ukončení stimulace se tachykardie nepřeruší, ale pokračuje v původní frekvenci. Přitom doba od posledního stimulu v kritickém místě do první spontánní aktivace kritického místa (tzv. poststimulační interval) (viz MAPprox) se víceméně rovná délce cyklu spontánní tachykardie neboli době potřebné k rozšíření elektrického potenciálu kolem celého reentry okruhu. Tento tzv. entrainment se skrytým splynutím slouží k průkazu, že je stimulováno místo, které leží na reentry okruhu v oblasti chráněné dvěma bariérami převodní blokády. 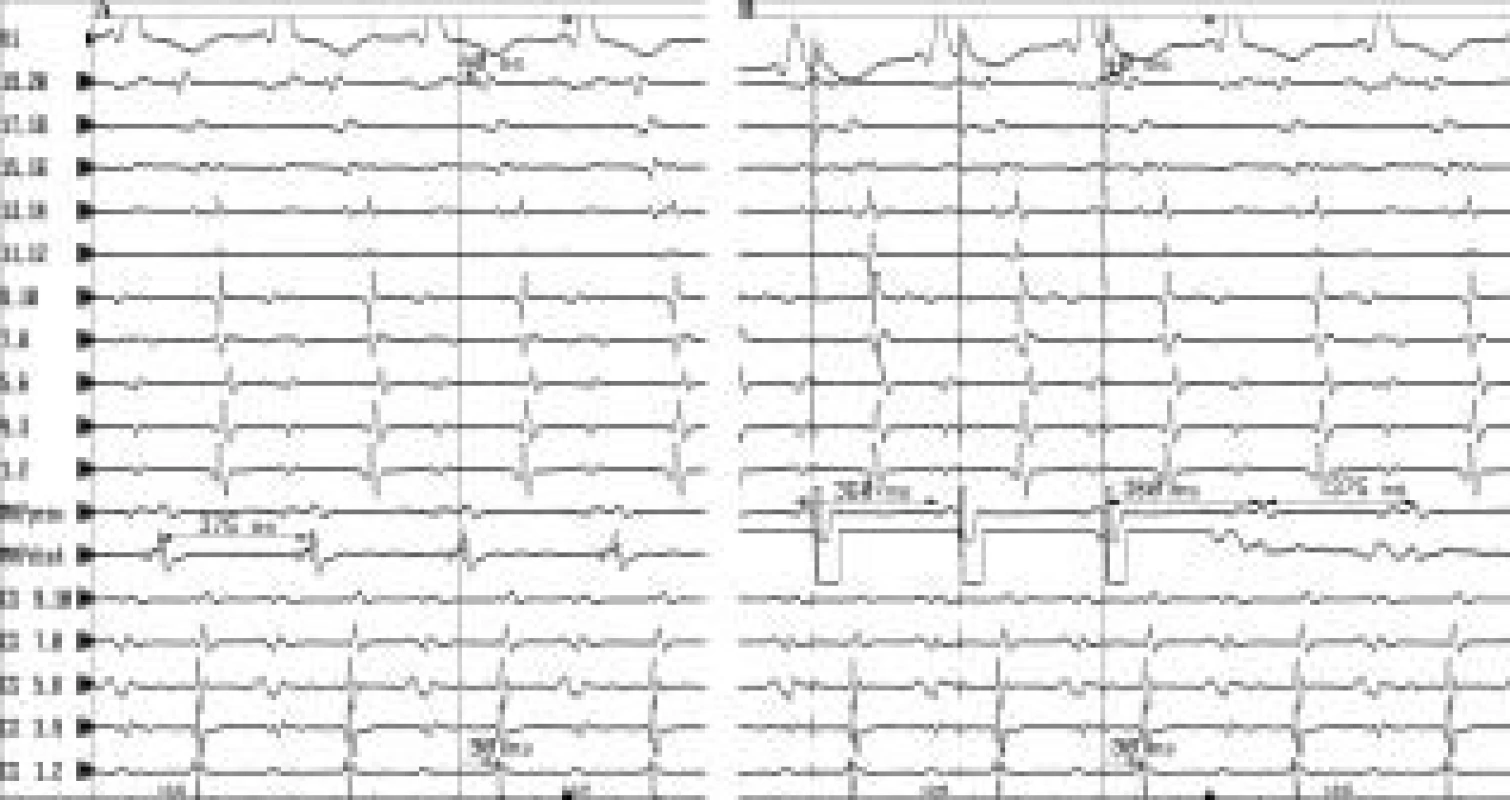
Vysvětlivky jako na předchozích obrázcích. Do místa s diastolickým potenciálem a příznivým výsledkem entrainmentu se skrytým splynutím se aplikuje radiofrekvenční (RF) energie. Je-li kritické místo reentry okruhu úzké, může být běžící tachykardie ukončena a trvale eliminována jedinou aplikací RF energie. V případě širšího kritického místa reentry okruhu je zapotřebí provést sérii aplikací RF energie na několika sousedících místech tak, aby výsledná lineární léze spojila dvě nejbližší převodní bariéry. V praxi to znamená, že po ukončení tachykardie se doplní ještě několik aplikací RF při sinusovém rytmu tak, aby se spojily nejbližší abnormální oblasti bez elektrické aktivity nebo oblasti dvojitých potenciálů mezi sebou či s přirozenými převodními bariérami a současně byly eliminovány přítomné pozdní potenciály. Po eliminaci jedné nebo více forem SMRT lineární lézí v jednom místě je opět provedena stimulace síní a v případě vyvolání jiné formy SMRT se celý proces mapování a ablace opakuje, dokud se nepodaří dosáhnout nevyvolatelnosti jakékoli setrvalé SMRT.
Elektroanatomické mapování a katétrová ablace reentry okruhu
Při elektroanatomickém mapování se provádí úplná rekonstrukce anatomické stavby cílové srdeční síně a šíření elektrického potenciálu při tachykardii. Podmínkou je stabilita tachykardie. Při vytváření elektroanatomické mapy lze označit okrsky bez elektrické aktivity a oblasti s dvojitými a diastolickými potenciály stejně jako polohu ústí žil a síňokomorových prstenců. Mapování se provádí při té formě tachykardie, která má stabilní morfologii a délku cyklu a je ideální, jde-li o tachykardii totožnou s tachykardií klinickou. Oproti konvenčnímu mapování je výhodnější neprovádět entrainment, aby nedošlo k přerušení tachykardie před dokončením elektroanatomické mapy a před započetím ablace.
Přesná rekonstrukce reentry okruhu přináší také přesnou definici kritického místa reentry okruhu (obr. 1 a 5). Proto bez bližšího rozlišení místa s ideálním entrainmentem se skrytým splynutím lze stanovit nejužší kritické místo reentry okruhu a přímo pomocí elektroanatomické navigace ablačního katetru provést sérii aplikací RF energie napříč touto oblastí od jedné převodní bariéry k druhé a tuto linii dokončit bez ohledu na to, ve kterém okamžiku došlo k ukončení tachykardie. Bylo-li před započetím mapování dokumentováno více forem SMRT, lze po dokončení jedné strategické lineární léze postupně vytvářet při sinusovém rytmu jiné strategické lineární léze, které se logicky odvodí z první elektroanatomické mapy. Tak může být dosaženo eliminace všech SMRT a přitom se redukuje čas, který by byl nezbytný k postupnému elektroanatomickému mapování všech tachykardií zvlášť.
Image 5. Levosíňová makroreentry tachykardie se širokým kritickým místem reentry okruhu. Levosíňová makroreentry tachykardie se dvěma aktivačními frontami označenými schematicky elipsami se směrovými šipkami stýkajícími se v jednom širokém kritickém místě lokalizovaném (nezávisle na přítomnosti elektricky němých oblastí roztroušených na zadní stěně a septálně) mezi horní částí mitrálního prstence a linií dvojitých potenciálů v oblasti Bachmanova svazku (označeny modrošedými body). Jedna aktivační fronta obíhá mitrální prstenec proti směru hodinových ručiček, zatímco druhá aktivační fronta obíhá víceméně ústí pravostranných plicních žil. V kritickém místě je sytě červenou barvou označeno rozhraní mezi nejčasnější aktivací (červená barva) a pozdní aktivací (fialová barva). Uvedené kritické místo může být přerušeno pouze dlouhou lineární lézí spojující mitrální prstenec a oblast dvojitých potenciálů. A. Pohled zepředu. B. Pohled zezadu. Šedou barvou jsou znázorněny elektricky němé oblasti, RUPV – pravá horní plicní žíla a LUPV – levá horní plicní žíla. 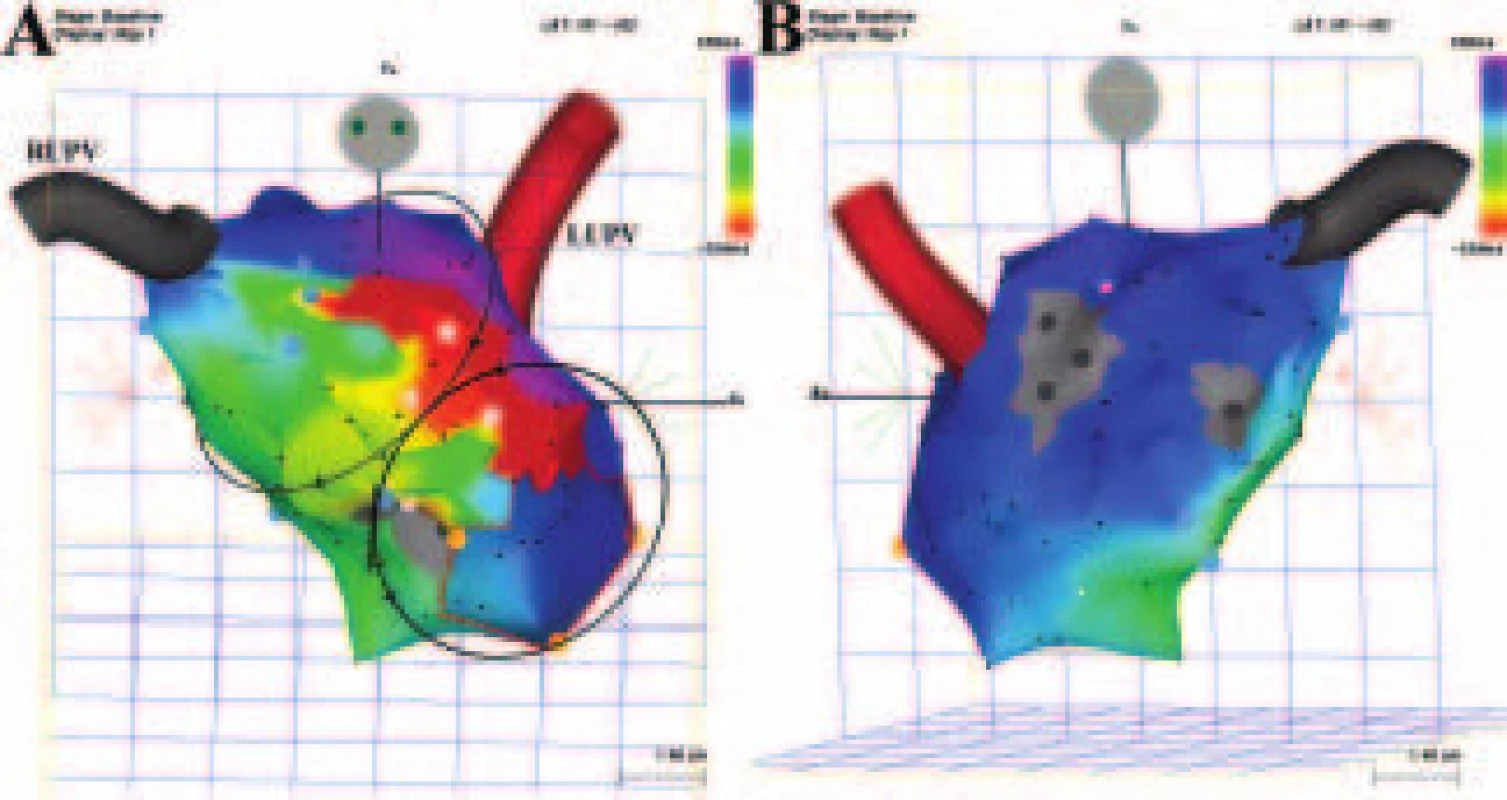
Tato strategie lineárních lézí prováděných na pozadí elektroanatomické mapy vytvořené při sinusovém rytmu nebo při stimulaci síní je používána také k eliminaci mnohočetných proměnlivých morfologií SMRT, které se neudržují dostatečně dlouho, aby u nich bylo možné mapování dokončit. Umístění strategických lineárních lézí se odhaduje z informací získaných jak z aktivační mapy (dvojité potenciály, pozdní potenciály) (obr. 6), tak i z voltážové mapy.
Image 6. Anatomický přístup k ablaci nemapovatelných SMRT s lineárními lézemi v pravé srdeční síni. Voltážová elektroanatomická mapa pravé srdeční síně, v níž červená barva znázorňuje místa s elektrickými potenciály nižšími než 0,5 mV a fialová barva místa s elektrickými potenciály přesahujícími 1,5 mV. A. V pohledu na inferolaterální stěnu pravé síně jsou dvě lineární léze spojující elektricky němou oblast (jizvu) (označenou šedou barvou), jednak k ústí dolní duté žíly, a jednak k trikuspidálnímu prstenci. Místa jednotlivých aplikací RF energie jsou označena hnědými body. B. Při pohledu ze septální strany je vidět posteriorní lineární lézi spojující dolní a horní dutou žílu a další lineární lézi vedenou k horní části trikuspidálního prstence. Další lineární léze byla provedena konvečně napříč subeustachovským můstkem. Kromě voltážové mapy je umístění strategických lineárních lézí voleno podle lokalizace pozdních potenciálů při sinusovém rytmu nebo při stimulaci síní a podle diastolických potenciálů, které se podaří lokalizovat konvečním mapováním při tachykardiích, které přetrvávají dostatečně dlouho (minuty). 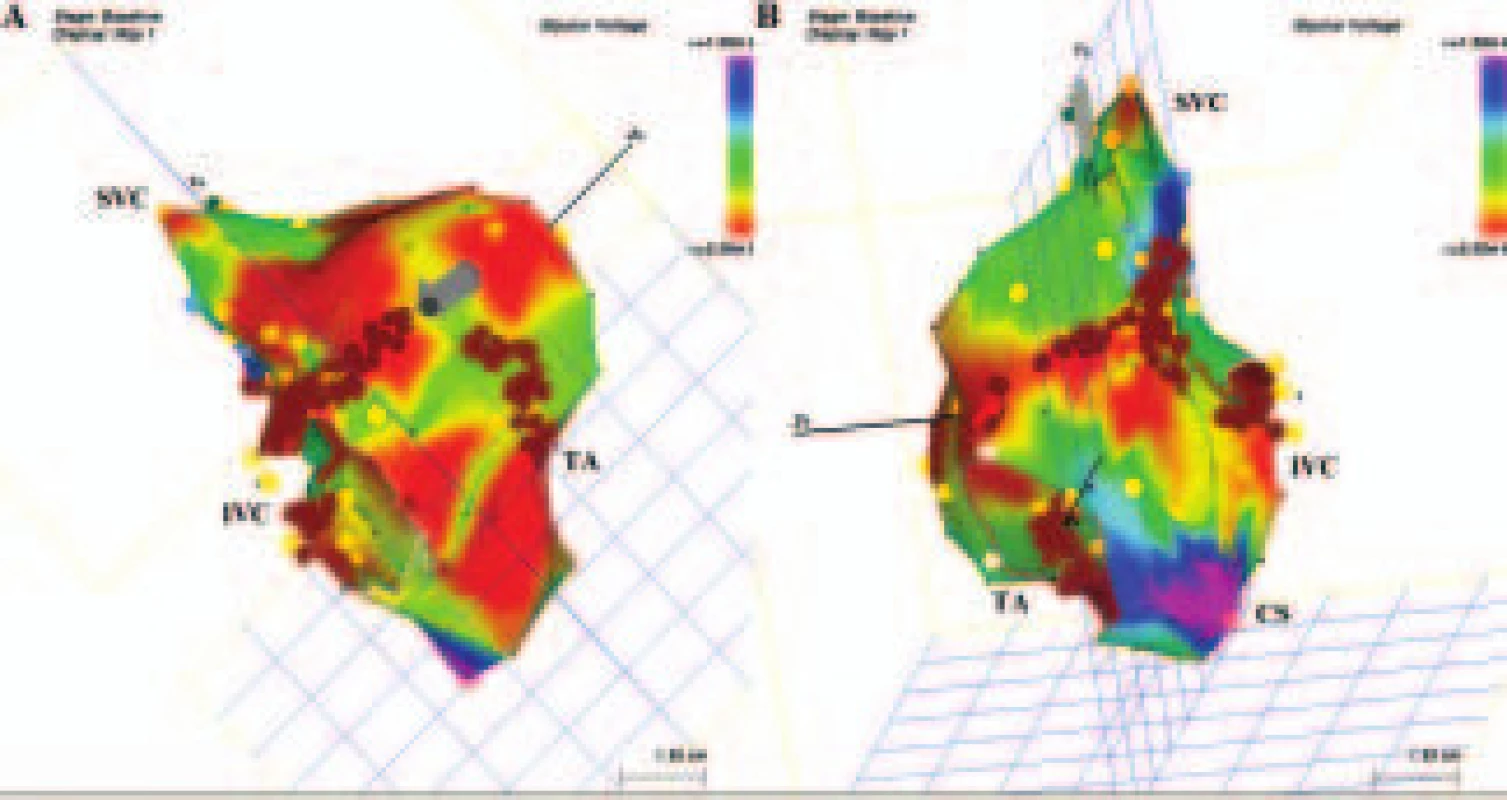
Definice
Kritická oblast reentry okruhu je definována jako místo, které musí být cíleno fokální nebo lineární katétrovou ablací, aby se odstranily jedna nebo více morfologií a/nebo frekvencí SMRT. Kritické místo je obvykle nejužším místem reentry okruhu a jeví více či méně abnormálně zpomalené vedení elektrického vzruchu.
Elektricky němá oblast je definována jako místo, kde není rozpoznatelná žádná elektrická aktivita nad úrovní artefaktu izoelektrické linie (0,035 mV na elektroanatomickém registračním zařízení) jak na elektroanatomickém, tak i na konvečním registračním zařízení při maximální amplitudě signálu. V elektroanatomické mapě jsou elektricky němé oblasti kódovány šedou barvou.
Cílovým momentem výkonu je ukončení všech běžících mapovatelných SMRT aplikací RF energie a na konci výkonu nevyvolatelnost jakékoli SMRT, spontánní nebo neklinické, vyvolané při elektrofyziologickém vyšetření. Tento cílový moment je hodnocen při programované stimulaci síní a vzestupné stimulaci síní do uchvácení síní 2 : 1.
Antikoagulační léčba před ablací a po ablaci
Antikoagulační léčba byla vedena podle zásad platných pro flutteru síní I. typu (resp. pro fibrilaci síní). Tzn. pacienti s častou paroxyzmální formou nebo permanentní formou síňové tachykardie užívali nejméně 5-6 týdnů warfarin (INR 2-3), který byl 5 dní před výkonem vysazen a nahrazen nízkomolekulárním heparinem. Po výkonu byl warfarin znovu nasazen a pokud měl pacient sinusový rytmus, antikoagulační léčba se vysadila po uplynutí předpokládané doby nutné k ústupu omráčení síní, čili asi po 4 až 5 týdnech.
Sledování pacientů po ablaci
Pacienti byli pravidelně sledováni v kardiologické ambulanci a svými kardiology a internisty. Při ambulantních návštěvách byla anamnéza zaměřena na výskyt symptomů souvisejících s arytmiemi a bylo hodnoceno standardní povrchové EKG. Při recidivách palpitací byl důraz kladen na dokumentaci EKG při potížích, zvláště s pomocí opakovaných Holterových EKG-monitorování. Pacienti s recidivující setrvalou monomorfní síňovou tachyarytmií podstoupili opakované elektrofyziologické vyšetření a případně katétrovou ablaci.
Hodnocení dat
Číselné hodnoty byly vyjádřeny jako průměr - směrodatná odchylka. Délky cyklu tachykardií mezi jednotlivými skupinami byly srovnány pomocí Studentova t-testu. Hodnota p < 0,05 byla definována jako statisticky významná.
Výsledky
Bezprostřední výsledky mapování a katétrové ablace
U 42 pacientů bylo provedeno 49 ablačních výkonů. U 7 pacientů byl výkon opakován pro recidivu SMRT. Elektroanatomické mapování bylo použito ve 22 ze 38 (58 %) výkonů u pacientů s pravosíňovou SMRT a ve všech 11 výkonech u 10 pacientů s levosíňovou SMRT. V 49 výkonech bylo ablací cíleno celkem 59 kritických míst reentry okruhů, které se uplatňovaly ve vzniku a udržování 70 morfologií o 61 frekvencích mapovatelné SMRT. 56 morfologií (41 v pravé síni a 15 v levé síni) o 49 frekvencích (35 v pravé síni a 14 v levé síni) bylo odstraněno lineární RF-lézí. 14 morfologií o 12 frekvencích (všechny z pravé síně) bylo odstraněno fokální RF - lézí. Podrobnosti uvádějí tab. 2 a 3.
Table 2. Výsledky mapování a katetrové ablace u pacientů se SMRT z pravé síně. 
Table 3. Výsledky mapování a katetrové ablace u pacientů se SMRT z levé síně. 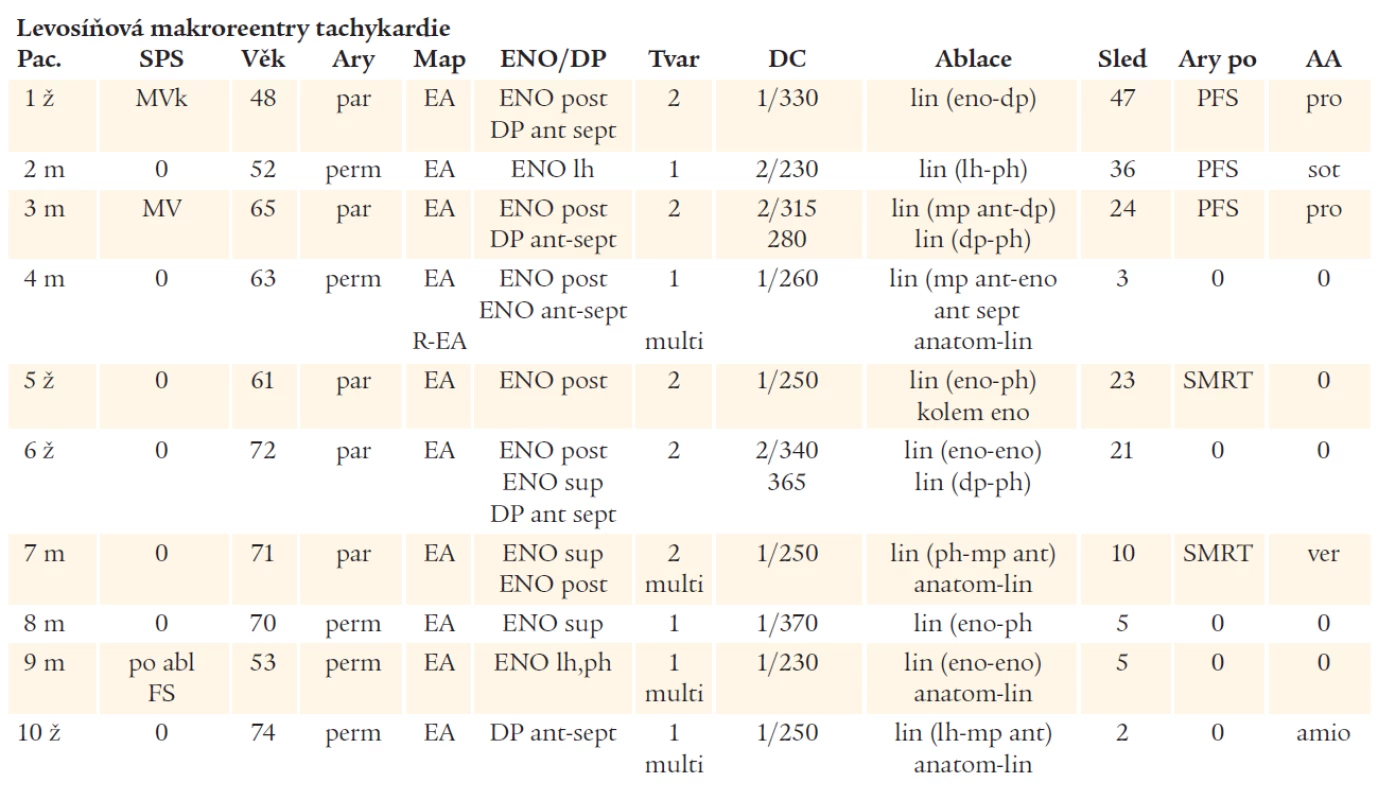
Vysvětlivky k tab. 2 a 3: pac. – pacient, SPS – strukturální postižení srdce, SMRT – síňová makroreenry tachykardie, ary po – arytmie po ablaci, map – způsob mapování, KO – konvenční mapování, EA – elektroanatomické mapování, R – reablace, ENO – elektricky němá oblast, eno s – elektricky němá oblast septálně, DP – dvojité potenciály, tvar – tvar tachykardie, DC – počet frekvencí/délka cyklu tachykardie (v ms), sled – doba sledování po ablaci (v měsících), AA – antiarytmická léčba po ablaci, amio – amiodarone, sot – sotalol, pro – propafenon, m – muž, ž – žena, DSS – po operaci defektu septa síní, Eb – Ebsteinova anomálie, IM – po infarktu myokardu, AKB – aortokoronární vypase, MV – mitrální vada, MV n – náhrada mitrální chlopně, MVk – po komisurotomii mitrální chlopně, perikard – po perikardektomii, par – paroxyzmální, per – permanentní, lat – laterálně, sept – septálně, inf – inferiorně, sup – superiorně, ant – anteriorně, inf – inferiorně, post – posteriorně, centr – centrálně, lh – levá horní plicní žíla, ph – pravá horní plicní žíla, AP – ouško levé síně, DPBB – dvojité potenciály v oblasti Bachmanova svazku, fok – fokální radiofrekvenční léze, lin – lineární radiofrekvenční léze, anatom lin – anatomický přístup s lineárními lézemi, multi – mnohočetné proměnlivé morfologie frekvence SMRT, hdž – horní dutá žíla, ddž – dolní dutá žíla, tp – trikuspidální prstenec, mp – mitrální prstenec, PFS – paroxyzmální fibrilace síní U 20 pacientů byla také provedena lineární léze napříč subeustachovským můstkem k eliminaci flutteru síní I. typu. U 17 pacientů byl flutter síní I. typu vyvolán při elektrofyziologickém vyšetření. V 10 případech rotoval flutter proti směru hodinových ručiček, ve 3 případech po směru hodinových ručiček a u 4 pacientů střídavě v obou směrech. U ostatních 3 pacientů byl reentry okruh pro flutter síní I. typu eliminován empiricky na počátku výkonu ke zjednodušení mapování. Kromě toho byl vzhledem k nálezu nemapovatelných mnohočetných střídajících se tvarů a frekvencí SMRT použit anatomický přístup k ablaci u 6 pacientů, z nichž u 4 byla ve stejném a u jednoho pacienta v jiném výkonu prováděna i ablace mapovatelné SMRT. Ve 2 případech byl anatomický přístup využit v pravé srdeční síni a ve 4 případech v levé srdeční síni. Průměrný skiaskopický čas na výkon byl 25,9 ± 14,6 (4-70) minut. Průměrný skiaskopický čas na ablaci v pravé síni byl 23,4 ± 13 (4-51) minut a na ablaci v levé síni 34,7 ± 17 (17-70) minut. V souvislosti s provedením ablace se nevyskytla se žádná komplikace.
Průměrná délka cyklu SMRT byla 304,6 ± 66,7 (180-440) ms, délka cyklu pravosíňových a levosíňových SMRT, která byla 308,6 ± 70 (180-440) ms, resp. 289,2 ± 52 (230-370) ms se významně nelišila (p = 0,15). Délka cyklu pravosíňových SMRT odstraněných fokální lézí, 361,3 ± 68,0 v rozmezí 200-440 ms, byla významně delší než délka cyklu pravosíňových SNRT eliminovaných lineární lézí, 290 ± 61,1 v rozmezí 180-410 ms (p = 0,002).
Bezprostředně bylo po ukončení ablace (u pacientů s více výkony po ukončení reablace) dosaženo úplné nevyvolatelnosti SMRT u 37 (88 %) ze 42 pacientů, u 31 (97 %) ze 32 pacientů s pravosíňovou SMRT a u 6 (60 %) z 10 pacientů s levosíňovou SMRT. U jednoho pacienta s pravosíňovu SMRT, u nějž bylo při prvním výkonu dosaženo eliminace všech tachykardií, se nepodařilo při opakovaném výkonu o 2 roky později eliminovat recidivující mnohočetné nemapovatelné tachykardie anatomickým přístupem. U jednoho pacienta s levosíňovou SMRT byla lineární lézí přerušena perzistující tachykardie, která přešla v jinou morfologii SMRT, jež vyhasla spontánně až po ukončení výkonu. U dalších 3 pacientů s levosíňovou SMRT došlo po odstranění perzistující klinické morfologie SMRT ke změně na jiné proměnlivé makroreentry tachykardie, které nebyly zcela eliminovány následujícím použitím anatomického přístupu a byly ukončeny elektrickou kardioverzí.
Dlouhodobé výsledky katétrové ablace
V průběhu dlouhodobého sledování (v případě opakování ablace v době od druhého výkonu) 34 ± 24,7 (2-86) měsíce zůstává 39 pacientů (93 %)bez recidivy SMRT. Pacienti s pravosíňovou SMRT jsou sledováni 39,1 ± 25 (2-86) měsíců a pacienti s levosíňovou SMRT jsou sledováni 17,6 ± 15,3 (2-47) měsíců. 7 pacientů (17 %) bez SMRT zaznamenalo později paroxyzmální fibrilaci síní, kterou se poměrně dobře daří potlačit antiarytmickou léčbou (sotalolem u 3 pacientů, propafenonem u 3 pacientů a amiodaronem u 1 pacientky). U dalších 2 pacientů je zatím ponechána původní léčba amiodaronem vzhledem ke krátké době sledování po ablaci složitého arytmogenního substrátu. Podrobnosti uvádějí tab. 2 a 3.
Diskuse
Výsledky této práce prokazují vysokou technickou účinnost a dlouhodobý efekt katétrové ablace u pacientů se SMRT nezávisle na její etiologii. Po opakování ablace u některých pacientů bylo dosaženo přibližně 90% bezprostřední a dlouhodobé účinnosti. Podobné výsledky dlouhodobého sledování jsou prezentovány i z jiných pracovišť [4]. Většina recidiv SMRT byla odstraněna opakovanou katétrovou ablací, pokud k ní byla příležitost. Na druhé straně je zjevné, že existence dalších reziduálních tachykardií vyvolatelných při elektrofyziologickém vyšetření po eliminaci klinicky významných tachykardií nemusí nezbytně předznamenat klinické potíže v dlouhodobém sledování, zvláště po ablaci v levé srdeční síni, je-li použita strategie komplexních lineárních lézí. U pacientů, u nichž se podařilo odstranit všechny formy SMRT v pravé srdeční síni, respektive klinické formy SMRT v levé srdeční síni, bylo dosaženo dlouhodobého příznivého klinického efektu bez nutnosti pokračovat v antiarytmické léčbě. Pokud byl klinický benefit narušen, obvykle se tak stalo v důsledku výskytu fibrilace síní, která však byla prakticky u všech pacientů potlačitelná antiarytmickou léčbou. Zásadou přesto zůstává, že pokud je to technicky možné, mělo být cílem ablace odstranění všech vyvolatelných tachykardií.
SMRT vznikají na základě přítomnosti abnormálních bariér vedení elektrického vzruchu. Těmito bariérami jsou nejčastěji jizvy, které představují ryze anatomické překážky pro šíření elektrického potenciálu. V některých případech mohou jako převodní bariéry působit místa, ve kterých myokardiální snopce vytvářejí hrany či hřebeny, např. terminální hřeben v pravé srdeční síni nebo zřejmě Bachmanův svazek v levé srdeční síni. Tato místa se vyznačují tzv. anizotropním vedením, tj. rychlým vedením podél svalového hřebene a velmi pomalým vedením napříč tímto hřebenem. Tyto anatomické a anatomicko-funkční abnormální bariéry, buď samotné nebo spolu s přirozenými bariérami, jako jsou ústí žil nebo síňokomorové prstence, ohraničují kritická místa reentry okruhu tvořená myokardem s více či méně zpomaleným vedením. Jestliže se podaří vedení těmito kritickými místy dostatečně poškodit katétrovou ablací, dotyčný reentry okruh se přeruší a přestane trvale existovat [3,9,14].
V mnoha případech se vyskytuje u jednoho pacienta více morfologií a frekvencí SMRT [4,9,15]. Obvykle se jedna frekvence pojí se dvěma morfologiemi SMRT, a to proto, že šíření elektrického potenciálu jedním stabilním reentry okruhem se děje v jednom nebo opačném směru. Kromě toho jedna tzv. kritická oblast reentry okruhu může být sdílena více proměnnými reentry okruhy, což se projeví proměnlivou frekvencí morfologicky podobných tachykardií. V praxi sice nelze např. elektroanatomickým mapováním přesně zobrazit postupně všechny formy spontánních nebo vyvolaných síňových tachykardií, ale pro existenci sdílených reentry okruhů a jejich kritických oblastí hovoří eliminace více morfologií či frekvencí SMRT po ablaci jednoho kritického místa. Na druhé straně mohou mnohočetné morfologie SMRT využívat různé reentry okruhy, které musejí být eliminovány nezávisle.
Bezprostřední účinnost katétrové ablace SMRT je vysoká bez ohledu na způsob mapování. I konveční přístup poskytuje relativně spolehlivé metody mapování a přesného stanovení kritického místa reentry okruhu, zvláště při ablaci v pravé srdeční síni. Vyžaduje však dobrou představivost a větší zkušenost vyšetřujícího, jenž si musí z velké míry domyslet anatomické poměry srdeční síně a tvar reentry okruhu na základě analýzy elektrické aktivace snímané z relativně malého počtu míst. Druh a lokalizace dřívějších chirurgických zásahů a znalost příčin a charakteru strukturálního postižení srdce poskytují prospěšná vodítka k odhadu arytmie již před mapováním. Pro úspěšnou ablaci je po stanovení kritického místa reentry okruhu podstatná správná analýza rozsahu tohoto místa a nejbližších převodních bariér, které je ohraničují. S tím souvisí nevýhoda konvenčního mapování, neboť pokud je kritické místo poměrně široké, může být obtížné je přerušit úplnou dlouhou lineární lézí. Ponechání i malé převodní mezery, respektive zotavení části svalové tkáně v kritickém místě reentry okruhu, bývají důvodem recidivy tachykardie, třebaže ve srovnání s původní tachykardií v důsledku ovlivnění reentry okruhu ablací pomalejší. Je však dobré znát a aplikovat principy konvečního mapování i při použití elektroanatomického mapování zvláště při střídání morfologií tachykardie a při tachykardiích, které se udržují jen přechodnou dobu.
V současné době poskytuje elektroanatomický přístup řadu nesporných výhod, pro něž by mělo být rutinně využíváno při mapování všech makroreentry tachykardií na srdci. Přináší velmi přesnou rekonstrukci cílového srdečního oddílu nebo více oddílů, je-li jejich mapování potřebné, a také celého reentry okruhu. Kritické místo reentry okruhu je přirozeně identifikováno jako jeho nejužší místo a navíc jsou přesně zobrazeny převodní bariéry, které je ohraničují. Navigace ablačního katétru, tj. možnost kontinuálně sledovat jeho polohu v trojrozměrné elektroanatomické mapě, umožňuje velmi přesně a efektivně naplánovat a provést i dlouhé lineární léze s co nejmenším počtem RF aplikací [2,4,8,14]. Unikátní výhodou elektroanatomického přístupu je možnost účinného odstranění mnohočetných reentry tachykardií. V případě nemapovatelných proměnlivých mnohočetných tachykardií umožňuje elektroanatomické mapování tzv. anatomický přístup k ablaci. Při něm se z rekonstrukce anatomických poměrů srdečního oddílu včetně hodnocení voltáže jeho jednotlivých okrsků a z elektrokardiografických nálezů při sinusovém rytmu nebo při stimulaci síní odhaduje poloha potenciálních kritických míst reentry okruhů. Strategické lineární radiofrekvenční léze jsou pak namířeny tak, aby potenciální reentry okruhy byly v těchto místech přerušeny.
Technická účinnost katétrové ablace SMRT může být potenciálně absolutní, ale je ovlivněna opakovatelností tachykardie při elektrofyziologickém vyšetření, možností dokonalého zobrazení reentry okruhu a anatomickými vlastnostmi jeho kritického místa. Někdy se při elektrofyziologickém vyšetření nedaří stimulací reprodukovat všechny tachykardie, jejichž odstranění by vyžadovalo ablaci na nezávislém místě, a tyto arytmie mohou později recidivovat. Jiným problémem může být častá proměnlivost morfologií a frekvencí tachykardie (byť monomorfní), což nedovoluje v současné době dokončit elektroanatomickou rekonstrukci jednotlivých forem tachykardie. V těchto případech lze využít tzv. anatomického přístupu (viz výše) se strategickými lineárními RF-lézemi napříč předpokládanými kritickými místy reentry okruhů. Ačkoli tato metoda může být účinná, je zatížena jistou mírou nepřesnosti vycházející z nahrazení přesné definice reentry okruhu jeho odhadem. Dále je tato metoda obvykle spojena s vytvářením delších lineárních lézí, jejichž kvalita se v praxi špatně hodnotí. Navíc může být obtížné vytvořit nezbytnou transmurální lézi v místě, kde jsou myokardiální snopce silné. S tím souvisí i to, že je-li kritické místo anatomicky rozsáhlejší a složitější, může s odstupem hodin až dnů po ablaci dojít k zotavení tkáně v okrajových nebo epikardiálně uložených oblastech a reentry okruh se může obnovit, přestože ablace byla bezprostředně úspěšná. Možnost zopakovat mapování a kumulovat další aplikace RF-energie do kritických míst vedou téměř ve všech případech k eliminaci všech recidivujících tachykardií, což potvrzují i naše zkušenosti. Konečně, nezávisle na kvalitě provedené ablace, se může arytmogenní substrát měnit s vývojem základního strukturálního postižení srdce a časem mohou vzniknout reentry okruhy, které v době ablace neexistovaly. Příznivý dlouhodobý efekt katétrové ablace v našem souboru dokládá, že vliv těchto negativních faktorů je naštěstí malý.
Přestože je arytmogenní substrát ve formě jizevnaté tkáně a svalových struktur jevících anizotropní vedení v principu podobný, jeho etiologie a lokalizace se liší. Tzv. incizionální tachykardie souvisí s přítomností jizev po atriotomii při předchozích chirurgických výkonech na srdci. Např. při operaci defektu septa síní je obvyklá jizva po atriotomii na laterální stěně pravé síně [3,11,14]. Kromě toho zůstává na přepážce elektricky němá oblast v místě záplaty. Vzniku těchto tachykardií by se mohlo předejít, pokud by již při operaci byla přerušena potenciální kritická místa reentry okruhu, např. u pacientů s defektem septa síní tkáň mezi atriotomií a nejbližší anatomickou překážkou, kterou je obvykle dolní dutá žíla.
U pacientů se známým strukturálním postižením srdce bez předchozí operace srdce se nacházejí jizvy v obou srdečních síních. Ve čtyřech případech jsme viděli jizvy na boční stěně pravé srdeční síně u pacientů, kteří dříve prodělali infarkt myokardu při uzávěru pravé věnčité tepny. Tato souvislost nabízí možnost infarktového postižení i boční stěny pravé srdeční síně. Podobně u pacientů s mitrální vadou jsme stejně jako jiní autoři [9,15] viděli jizvy, především na zadní stěně levé síně, které by mohly být vysvětleny vazivovou přestavbou tkáně v důsledku dlouhodobého tlakového či objemového přetížení.
Méně jasné jsou příčiny vzniku elektricky němých oblastí, s největší pravděpodobností v důsledku vazivových změn, u pacientů bez zřejmého strukturálního postižení srdce. Nejčastěji se objevují na laterální stěně pravé síně (její trabekulární části) a na zadní stěně levé síně. V této oblasti byly elektricky němé oblasti viděny u více než poloviny našich pacientů se SMRT z pravé síně, u nichž nebylo žádné strukturálního postižení srdce, tj. častěji než v souborech jiných autorů [10,20]. O jejich etiologii se pouze spekuluje. Nabízí se opět možnost infarktu síně, a to i přesto, že pokud u těchto pacientů byla provedena koronarografie, přinesla víceméně normální nález. Tento nález nevylučuje spekulaci o uzávěru drobných větví zásobujících srdeční síně. Podobně lze spekulovat o možných změnách ve stěně zvláště pravé srdeční síně, podobných změnám v pravé komoře při její arytmogenní dysplazii.
Závěr
Monomorfní makroreentry tachykardie jsou relativně vzácnou arytmií a představují skupinu individuálních reentry okruhů, které jsou jedinečné v závislosti na přítomném arytmogenním substrátu. Objevují se u pacientů po chirurgických výkonech na srdci, u pacientů s různým strukturálním postižením srdce, u pacientů po předchozí komplexní ablaci v levé srdeční síni pro fibrilaci síní, ale i u pacientů bez zjevného strukturálního postižení srdce a bez předchozího zásahu na srdci. Vznikají v důsledku složitého arytmogenního substrátu, tvořeného oblastmi elektricky zcela němými, pravděpodobně vazivovými jizvami, oblastmi jevícími anizotropní vedení a přirozenými anatomickými strukturami. Monomorfní makroreentry tachykardie, které na tomto terénu vznikají, jsou často mnohočetné, různých morfologií a frekvencí. Navzdory tomu jsou tyto arytmie odstranitelné s vysokou účinností a bezpečností pomocí fokálních a lineárních RF lézí přerušujících reentry okruhy napříč jejich nejzranitelnějšími kritickými místy. Elektroanatomická zobrazovací metoda přináší zásadní výhody při mapování těchto tachykardií, neboť umožňuje přesnou rekonstrukci anatomických poměrů srdečních oddílů a charakteru šíření elektrické depolarizace při tachykardii. Dlouhodobý účinek katétrové ablace je rovněž vysoký a sklon ke vzniku klinicky významné fibrilace síní je u těchto pacientů poměrně nízký.
MUDr. Martin Fiala, Ph.D.
www.nempodlesi.cz
e-mail: martin.fiala@nempodlesi.cz
Doručeno do redakce: 21. 10. 2004
Přijato po recenzi: 3. 2. 2005
Sources
1. Baker BM, Lindsay BD, Bromberg BI et al. Catheter ablation of clinical intraatrial reentrant tachycardias resulting from previous atrial surgery: localizing and transecting the critical isthmus. J Am Coll Cardiol 1996; 28 : 411-417.
2. Gepstein L, Hayam G, Ben-Haim SA. A novel method for nonfluoroscopic catheter-based electroanatomical mapping of the heart: in vitro and in vivo accuracy results. Circulation 1997; 95 : 1611-1612.
3. Chinitz LA, Bernstein NE, O´Connor B et al. Mapping reentry around atriotomy scars using double potentials. Pacing Clin Electrophysiol 1996; 19 : 1978-1983.
4. Delacretaz E, Ganz LI, Soejima K et al. Multi atrial macro-re-entry circuits in adults with repaired congenital heart disease: entrainment mapping combined with three-dimensional electroanatomic mapping. J Am Coll Cardiol 2001; 37 : 1665-1676.
5. Duru F, Hindricks G, Kottkamp H. Atypical left atrial flutter after intraoperative radiofrequency ablation of chronic atrial fibrillation: successful ablation using three-dimensional electroanatomic mapping. J Cardiovasc Electrophysiol 2001; 12 : 602-605.
6. Fiala M, Heinc P, Lukl J. Katétrová ablace síňových tachyarytmií: Síňová tachykardie, flutter síní, fibrilace síní. Kardiologická revue 1999; 1(4): 215-223.
7. Fiala M, Heinc P, Lukl J. Radiofrequency catheter ablation of right atrial reentry tachycardia: multiple arrhythmogenic substrate does not prevent technical feasibility and long-term benefit using conventional mapping technique. Cor Vasa 2000; 42 : 438-442.
8. Iesaka Y, Takahashi A, Goya M et al. Nonlinear ablation targeting an isthmus of critically slow conduction detected by high density electroanatomical mapping for atypical atrial flutter. Pacing Clin Electrophysiol 2000; 23 : 1911-1915.
9. Jaïs P, Shah DC, Haïssaguere M et al. Mapping and ablation of left atrial flutters. Circulation 2000; 101 : 2928-2934.
10. Kall JG, Rubenstein DS, Kopp DE et al. Atypical atrial flutter originating in the right atrial free wall. Circulation 2000; 101 : 270-279.
11. Kalman JM, Van Hare GF, Olgin JE et al. Ablation of “incisional” reentrant atrial tachycardia complicating surgery for congenital heart disease: use of entrainment to define a critical isthmus of conduction. Circulation 1996; 93 : 502-512.
12. Kalman JM, Olgin JE, Saxon LA et al. Electrocardiographic and electrophysiologic characterization of atypical atrial flutter in man. J Cardiovasc Electrophysiol 1997; 8 : 121-144.
13. Lai LP, Lin JL, Tseng CD et al. Electropysiologic study and radiofreqeucny catheter ablation of isthmus-independent atrial flutter. J Cardiovasc Electrophysiol 1999; 10 : 728-735.
14. Nakagawa H, Shah N, Matsudaira K et al. Characterization of reentrant circuit in acroreentrant right atrial tachycardia after surgical repair of congenital heart disease: isolated channels between scars allow “focal” ablation. Circulation 2001; 103 : 699-709.
15. Ouyang F, Ernst S, Vogtmann T et al. Characterization of reentrant circuits in left atrial macroreentrant tachycardia: critical isthmus block can prevent atrial tachycardia recurrence. Circulation 2002; 105 : 1934-1942.
16. Saoudi N, Cosio F, Waldo A et al. Classification of atrial flutter and regular atrial tachycardia according to electrophysiologic mechanism and anatomic bases: A statement from a joint expert group from the working group of arrhythmias of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. J Cardiovasc Electrophysiol 2001; 12 : 852-866.
17. Stevenson WG, Sager PT, Friedman PL. Entrainment techniques for mapping atrial and ventricular tachycardias. J Cardiovasc Electrophysiol 1995; 6 : 201-216.
18. Thomas SP, Nunn GR, Nicholson IA et al. Mechanism, localization and cure of atrial arrhythmias occurring after a new intraoperative endocardial radiofrequency ablation procedure for atrial fibrillation. J Am Coll Cardiol 2000; 35 : 442-450.
19. Triedman JK, Bergau DM, Saul JP et al. Efficacy of radiofrequency ablation for control of intraatrial reentrant tachycardia in patients with congenital heart disease. J Am Coll Cardiol 1997; 30 : 1032-1038.
20. Yang Y, Cheng J, Bochoeyer A et al. Atypical right atrial flutter patterns. Circulation 2001; 103 : 3092-3098.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 11-
All articles in this issue
- Rizikové faktory ovlivňující přežívání pacientů s implantabilními kardiovertery-defibriátory
-
Incizionální a neincizionální síňové makroreentry tachykardie u dospělých pacientů
Příčiny, principy mapování a dlouhodobé výsledky katétrové ablace - Význam sérových hladin volných lehkých řetězců imunoglobulinu v diagnostice a hodnocení aktivity mnohočetného myelomu a vybraných monoklonálních gamapatií
- Vzťah medzi hodnotami prolaktínu a mierou funkčnej neschopnosti hodnotenej dotazníkom HAQ u pacientov s reumatoidnou artritídou
- Vplyv skrátenia pasívnej fázy na diagnostickú výťažnosť nitroglycerínom stimulovaného head-up tilt testu
- Regresné rovnice pre interval QT a QTc elektrokardiogramu
- Nové možnosti léčby chronické tromboembolické plicní hypertenze v České republice
- Diabetes mellitus 1. typu a autoimunita
- Neobvyklá komplikace po aortokoronárním bypassu: akutní cholestatická hepatitida a agranulocytóza indukovaná tiklopidinem a simvastatinem u pacienta s alergií na salicyláty
-
Diagnostika a léčba chronické hepatitidy C
Doporučený postup České hepatologické společnosti a Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně - První zkušenosti s léčbou chronické hepatitidy C PegIntronem a Rebetolem v České republice
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Regresné rovnice pre interval QT a QTc elektrokardiogramu
- Neobvyklá komplikace po aortokoronárním bypassu: akutní cholestatická hepatitida a agranulocytóza indukovaná tiklopidinem a simvastatinem u pacienta s alergií na salicyláty
- Diabetes mellitus 1. typu a autoimunita
- Nové možnosti léčby chronické tromboembolické plicní hypertenze v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

