-
Medical journals
- Career
Poruchy polykání u neurologických onemocnění
Authors: M. Vališ 1; L. Šimůnek 1; Viktor Chrobok 2; Z. Pavelek 1; Michal Černý 2; E. Ehler 3; P. Kunc 1
Authors‘ workplace: Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice Hradec Králové ; Neurologická klinika Přednosta: doc. MUDr. Martin Vališ, Ph. D. 1; Klinika otorinolaryngologie a chirurgie hlavy a krku Přednosta: prof. MUDr. Viktor Chrobok, CSc., Ph. D. 2; Univerzita Pardubice, Fakulta zdravotnických studií Krajská nemocnice Pardubice, a. s., Neurologická klinika Přednosta: doc. MUDr. Edvard Ehler, CSc. 3
Published in: Prakt. Lék. 2014; 94(6): 254-258
Category: Various Specialization
Overview
Porucha polykání neboli dysfagie bývá důsledkem či komplikací dalšího onemocnění. Nesprávné zhodnocení stavu polykání může vést k bezprostřednímu ohrožení života pacienta aspirací nebo k výraznému zhoršení zdravotního stavu malnutricí či dehydratací. V úvodu článku se popisuje správný průběh polykacího aktu a uvádí se základní dělení poruch polykání. Poté jsou podrobně představeny poruchy polykání u neurologických onemocnění. Diskutovány jsou příčiny a možnosti terapie dysfagie u cévních mozkových příhod, amyotrofické laterální sklerózy, Parkinsonovy nemoci, Alzheimerovy nemoci, roztroušené sklerózy mozkomíšní, myasthenia gravis, syndromu Guillaina-Barrého, svalových dystrofií a zánětlivých myopatií.
Klíčová slova:
dysfagie – polykací akt – logopedie – aspiraceÚVOD
Dysfagie je porucha polykání pevné nebo tekuté potravy, k níž dochází v průběhu transportu požité stravy či tekutiny od úst do žaludku. Příčiny poruch polykání jsou značně různorodé, v praxi se klinik setkává s dysfagií většinou jako s komplikací vzniklou v důsledku dalšího onemocnění, nejčastěji neurologického, nádorového nebo zánětlivého (tab. 1). Nejvíce pacientů se vyskytuje ve věkové kategorii nad 60 let, na druhém místě jsou zastoupeny děti s vrozeným neurologickým postižením. Podle statistik je celoživotní prevalence poruch polykání 38 % (17). Nesprávné zhodnocení stavu polykání může vést k bezprostřednímu ohrožení života pacienta aspirací nebo k výraznému zhoršení zdravotního stavu malnutricí či dehydratací.
Table 1. Vybraná onemocnění doprovázená dysfagií 
U poruch polykání se používá celá řada přesně definovaných odborných termínů: odynofagie (bolestivé polykání), aspirace (vdechnutí potravy nebo tekutiny do dýchacích cest), penetrace (proniknutí stravy do hrtanu nad hlasivky bez aspirace), drooling (neudržení, únik tekutiny nebo pevného sousta z dutiny ústní), reflux (zpětný tok či přesun tekutiny), regurgitace (zpětný tok kyselých šťáv ze žaludku do jícnu bez vyvolání dávivého reflexu).
FYZIOLOGIE POLYKÁNÍ
Polykání (deglutice) je jeden z nejkomplexnějších procesů v lidském těle sdružující jednotlivé senzomotorické funkce. Musí při něm dojít ke koordinaci pohybu rtů, tváří, jazyka, měkkého patra, hltanu, hrtanu a jícnu. Polykací akt se skládá ze tří fází, které na sebe plynule navazují: orální fáze (přípravná a transportní), faryngeální fáze a ezofageální fáze. Délka přípravné orální fáze je závislá na množství a charakteru sousta. Zahrnuje kousání, žvýkání a smíchání potravy se slinami. V transportní orální fázi, která trvá 1 s, tlačí jazyk sousto dozadu nahoru proti měkkému patru. Sousto podráždí kořen jazyka, patrové oblouky a hltan, tím se aktivuje polykací reflex a začíná fáze faryngeální trvající méně než 1 s. Dochází k sevření čelistí, k velofaryngeálnímu uzávěru a za současné elevace laryngu a sklopení epiglottis je sousto posouváno z oblasti jazyka do hltanu. Uvedená akce potencuje vznik vlny kontrakce, která posune sousto do jícnu. Dojde k relaxaci horního jícnového svěrače, který je jinak mezi polknutími silně kontrahovaný, aby nebyl vzduch při dýchání nasáván do jícnu. V ezofageální fázi vzniká za polknutým soustem kontrakce jícnového svalstva, která jej transportuje peristaltickou vlnou dolů ke kardii rychlostí asi 4 cm/s. Dolní jícnový svěrač má aktivní tonus, který zabraňuje refluxu žaludečního obsahu v období mezi jídly a který při polykání povolí. Doba trvání ezofageální fáze je 8–20 s.
Centrum polykání je uloženo v prodloužené míše. Na správném průběhu polykacího aktu se podílejí V., VII., IX., X., XI. a XII. hlavový nerv. Zdravý dospělý člověk polyká v průběhu 24 hodin 580–2000krát. V bdělém stavu, kromě příjmu potravy a tekutin, polkne dospělý jedinec jednou až 2krát za minutu (závisí na produkci slin), ve spánku polyká jednou za minutu nebo může přestat polykat úplně.
DYSFAGIE A JEJÍ PŘÍZNAKY
Dle místa, ve kterém při dysfagii vázne sousto, dělíme dysfagii na vysokou (horní, orofaryngeální), při které nedochází k transportu bolusu z úst do jícnu, a nízkou (dolní, jícnovou), během níž se transport bolusu zastaví za sternem. Další možné dělení je dle fáze polykání, která je narušena, tedy na orální, faryngeální a ezofageální dysfagie.
K příznakům, které upozorňují na možnou přítomnost dysfagie, patří prodloužená doba přijímání potravy, přítomnost zbytků jídla v ústech, pocit zvýšeného slinění, kašel v průběhu jídla a po něm, změna hlasu po polknutí. Na dysfagii může upozornit i úbytek tělesné hmotnosti. Ke specifickým příznakům patří narušený dávivý reflex, slabý reflexní kašel či jeho nepřítomnost. Přidruženým příznakem bývá dysartrie.
Další část podrobně popisuje poruchy polykání u neurologických onemocnění (tab. 2).
Table 2. Prevalence dysfagie u jednotlivých neurologických onemocnění 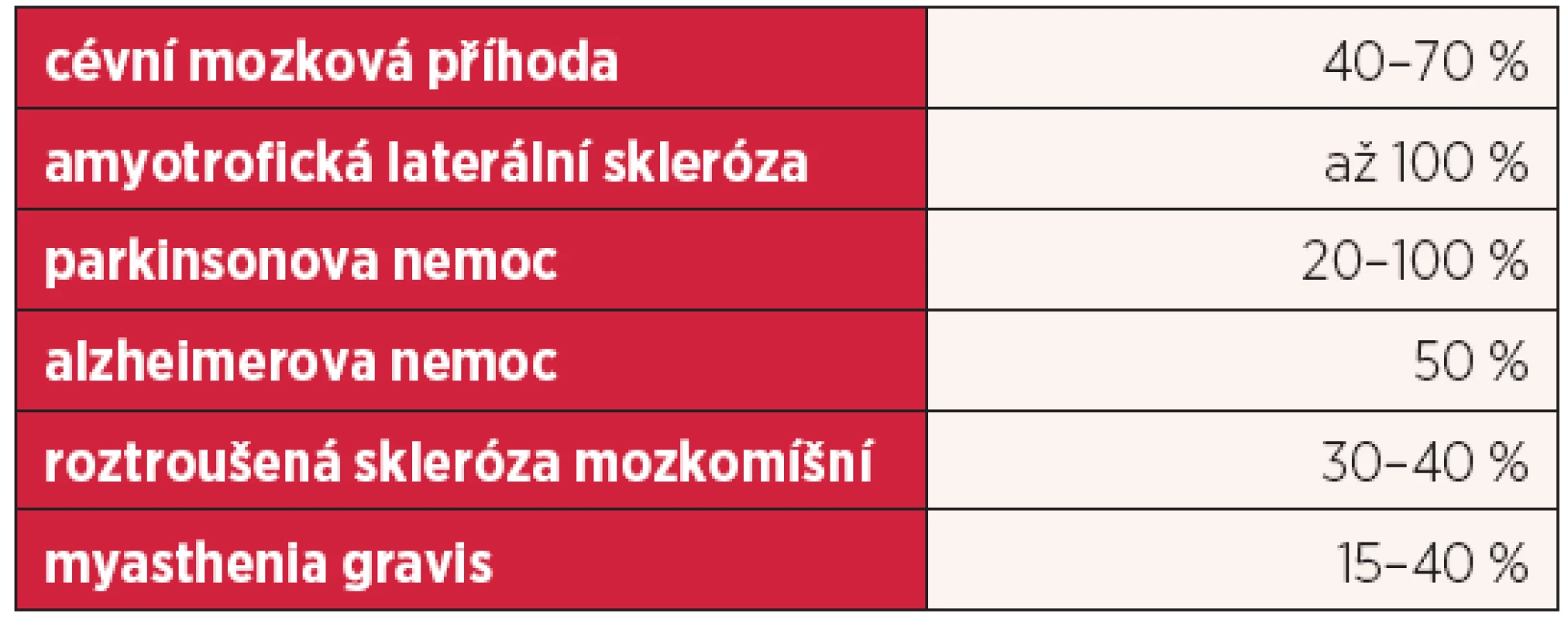
DYSFAGIE U CÉVNÍCH MOZKOVÝCH PŘÍHOD
Výskyt dysfagie v akutním stadiu cévní mozkové příhody (CMP) je uváděn v 37–45 % při využití screeningových metod, v 51–55 % při využití klinického logopedického vyšetření dysfagie a v 64–78 % při využití instrumentálního vyšetření (14). Doporučuje se, aby sestra provedla do 24 hodin od vzniku CMP orientační vyšetření polykání v rámci ošetřovatelského screeningu. Při pozitivním výsledku lékař indikuje logopedické vyšetření, podle doporučení klinického logopeda eventuálně následuje instrumentální vyšetření polykacího aktu (FEES – flexible endoscopic evaluation of swallowing, videofluoroskopie).
Včasné rozpoznání poruchy polykání a zahájení intervence snižuje morbiditu a délku pobytu v nemocnici. Závažnost dysfagie u pacientů po CMP vyplývá zejména z rizika aspirační pneumonie. V důsledku narušení senzitivity hrtanu a hltanu je značné riziko tzv. tiché aspirace, kdy pacient aspiruje bez kašle či jiné zjevné známky vdechnutí sousta. Velká část dysfagií u pacientů po prodělané CMP vykazuje úpravu do 3 týdnů (18).
DYSFAGIE U NEURODEGENERATIVNÍCH ONEMOCNĚNÍ
Poruchy polykání jsou součástí celé řady neurodegenerativních onemocnění a prakticky se vyskytují v určitém stupni a fázi u všech těchto chorob. Prognóza závisí na základním onemocnění. Jsou velmi častou příčinou aspirace.
Amyotrofická laterální skleróza
Dysfagie bývá u amyotrofické laterální sklerózy (ALS) nezřídka iniciálním příznakem, zpravidla se však objevuje po několika měsících od propuknutí nemoci. Pacient má zprvu problémy s polykáním tekutin. Vzhledem k paréze měkkého patra nedochází k dostatečnému uzávěru nosohltanu a při pokusu o polknutí se tekutina vrací nosem. Jde o zásadní rozdíl oproti jiným typům poruch polykání, u kterých váznou nejprve tuhá sousta. Ve velmi pokročilém stadiu ALS je pacient zcela neschopen polykání, zavření úst či pohybů jazykem. Současně s dysfagií se rozvíjí i dysartrie. Degenerace jádra XII. hlavového nervu vede k atrofii jazyka s fascikulacemi. Jazyk je přitom nepohyblivý, jakoby přivázaný ke spodině ústní. Jedná se o kombinaci periferní léze s centrální spastickou poruchou. Polykací akt je rovněž postižen narušením faryngeální fáze. Jícnová fáze polykání není ovlivněna, protože onemocnění nepostihuje hladkou svalovinu. Nejzávažnějším důsledkem dysfagie je riziko aspirační pneumonie, malnutrice a hypohydratace.
Léčebná opatření související s dysfagií zahrnují v úvodu změnu konzistence stravy. K redukci rizika aspirace je možné použít supraglotické polykání, kdy pacient zabraňuje průniku sousta do dýchacích cest tím, že nachýlí bradu na hrudník, zadrží dech, polkne sousto, poté zakašle a opět polkne (4). Při nedostatečném příjmu potravy nebo ztrátě tělesné hmotnosti o více než 20 % by mělo být zváženo zavedení perkutánní endoskopické gastrostomie.
Parkinsonova nemoc
Parkinsonova nemoc (PN) postihuje i bulbární oblast a postižení pak vede k poruše polykání. Dysfagii jako jeden z projevů tohoto extrapyramidového onemocnění zmínil již Parkinson v roce 1817. Vzhledem k nutričním a plicním komplikacím je spojena se zvýšenou mortalitou a morbiditou. Častěji se vyskytuje u pacientů s pokročilou formou nemoci. Prevalence v literatuře kolísá mezi 18,5–100 % (7). Dysfagie u nemocných trpících PN je charakterizována různými pohybovými abnormalitami polykacích struktur. Je zajímavé, že tíže nekoreluje s tíží pohybového postižení končetin (2).
V orální fázi polykání zahrnují pohybové abnormality vytékání stravy z úst, nedostatečné žvýkaní, tremor jazyka, zpomalené zvedání jazyka a omezené exkurze mandibuly. Tyto abnormality mohou vést k prodlouženému setrvávání potravy v ústech, poruše posunu potravy do kaudálnějších částí zažívacího traktu, zpomalené iniciaci polykání a k reziduu přijímané potravy v dutině ústní (7). Ve faryngeální fázi polykání pohybové abnormality zahrnují porušenou nebo zpožděnou kontrakci faryngu, poruchu postavení epiglottis, zpomalené pohyby laryngu a dyskoordinaci horního jícnového svěrače. Uvedené dysfunkce mohou vést k setrvávání potravy v partiích zažívacího traktu, penetraci nebo aspiraci (5, 7).
V případě léčby připadají v úvahu tři základní možnosti: rehabilitační, chirurgická a farmakologická. El Sharkawi et al. (8) pozorovali přínos jednoměsíční terapie Lee Silverman Voice Treatment. Jedná se o hlasová cvičení pro pacienty s PN, která mají efekt nejen na fonaci, ale i na další motorické funkce. Data o chirurgické terapii dysfagie jsou velmi limitována a ojedinělé publikace jsou z devadesátých let 20. století. Born et al. (5) a Byrne et al. (6) prezentovali pozitivní výsledky u sedmi pacientů s dysfunkcí horního jícnového svěrače, kteří podstoupili krikofaryngeální myotomii. Levodopa jako základní lék na motorické projevy PN není v léčbě dysfagie účinná (12). Iwasaki et al. (13) popsali pozitivní efekt tradiční čínské medicíny „Banxia Houpo Tang“, nicméně není zřejmé, jaká komponenta extraktu nebo sušených bylin zlepšila polykání.
Alzheimerova nemoc
Časnou známkou Alzheimerovy nemoci (AD) je hyposmie či anosmie a pacienti si v počátcích AD stěžují na horší chuť potravy. S tím související změna stravovacích zvyklostí může negativně ovlivnit prospívání pacienta. Po 8 letech trvání nemoci až 50 % pacientů ztrácí schopnost samostatného příjmu potravy (20). Příčinou je odcházení od stolu během příjmu potravy, vyplivování potravy nebo obtížné polykání tekutých či tuhých soust. U nemocných je popisováno nedostatečné či chybějící žvýkaní, narušení pohybů jazyka či dolní čelisti, a právě porucha orální fáze polykání je nejčastěji se vyskytující příčinou poruchy příjmu potravy u nemocných s AD (11). Protože funkce mozkového kmene je u pacientů s AD relativně neporušena, lze vysvětlit poruchu orální fáze polykání dysfunkcí cerebrálního kortexu, který má roli v iniciaci, ovlivnění a integraci polykacího aktu (3).
Terapie zahrnuje především režimová opatření. Pečovatelům se doporučuje, aby stimulovali zájem pacienta o jídlo a respektovali jeho chuťové preference. Je vhodný častý příjem potravy v menších porcích, v případě zvýšené aktivity pacienta v noci lze nabízet svačiny i v noční dobu. Při nízké zručnosti nemocného se doporučuje podávat jídla, která je možné konzumovat bez použití příboru.
DYSFAGIE U ROZTROUŠENÉ SKLERÓZY MOZKOMÍŠNÍ
Roztroušená skleróza mozkomíšní (RSM) je chronické autoimunitní zánětlivé onemocnění postihující centrální nervový systém. Dysfagie je velmi vzácně izolovaný syndrom u RSM, nicméně problémy s polykáním se vyskytují mnohem častěji, než se dříve předpokládalo. Jako projev RSM byla popsána již v roce 1877. Prevalence je odhadována na 30–40 % (16). Dysfagie může být pro pacienty život ohrožující, aspirační pneumonie jako komplikace dysfagie je hlavní příčinou úmrtí pacientů léčených pro RSM (1). Další závažnou komplikací je dehydratace nebo malnutrice.
Hlavní příčiny poruchy polykání u pacientů s RSM jsou porušená hybnost jazyka, snížený či chybějící polykací reflex, snížená kontrakce faryngu, dysfunkce horního jícnového svěrače, porušené uzavírání laryngu, snížená senzitivní inervace laryngu a faryngu (16), které vyplývají z poškození kortikobulbárního traktu, cerebelární dysfunkce, kmenové léze, abnormální respirační kapacity a kognitivní dysfunkce (19).
Terapie zahrnuje změnu diety, speciální rehabilitační cviky a posturální kompenzace, jako je např. předklon hlavy při polykání (tab. 3). Z medikace jsou vhodná v případě hypersalivace anticholinergika, v případě singultu baclofen, domperidon, inhibitory protonové pumpy či gabapentin, při extraezofageálním refluxu inhibitory protonové pumpy a při dysfunkci horního jícnového svěrače lze zvážit aplikaci botulotoxinu (tab. 4).
Table 3. Nefarmakologická terapeutická opatření při poruchách polykání u RSM (upraveno dle Prosiegel et al. (16)) 
Table 4. Farmakologická léčba poruch polykání u RSM (upraveno dle Prosiegel et al. (16) 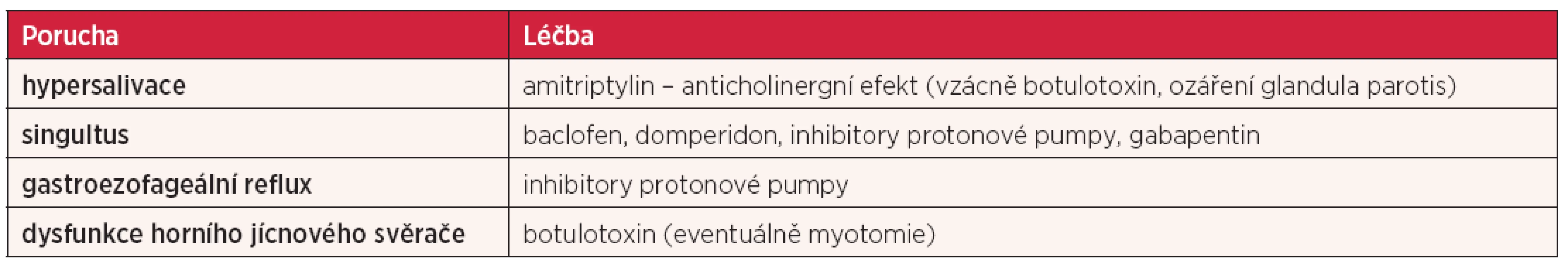
DYSFAGIE U JINÝCH NEUROLOGICKÝCH ONEMOCNĚNÍ
Myasthenia gravis
Dysfagie postihuje 15–40 % pacientů s generalizovanou formou myasthenia gravis (MG) (9). Je většinou přechodná a kolísá s kompenzací MG. Porucha polykání vyplývá z narušené orální a faryngeální fáze. Oslabení rtů způsobuje zpětné vytékání tekutin z úst, oslabení žvýkacích svalů znemožňuje dokonale rozkousat potravu. Teplá potrava (polévka či kaše) obtíže zhoršuje, zatímco chladné potraviny je zmírňují. V nejzávažnějších případech pacienti nejsou schopni polknout ani vlastní sliny. Nemocní jsou ohroženi aspirační pneumonií s možnými fatálními následky.
Rehabilitační procedury nejsou vhodné vzhledem ke svalové unavitelnosti typické pro MG. Z ní vycházejí i dietetická doporučení, která zahrnují častý příjem potravy v malých dávkách a nutnost vyhýbat se stravě vyžadující dlouhé a usilovné žvýkání. Jako doplňující krátkodobá farmakoterapie ke zlepšení kousání a polykání se doporučuje neostigmin (15).
Syndrom Guillaina-Barrého
Syndrom se řadí mezi imunitně zprostředkované akutní polyneuropatie. Je charakterizován poměrně rychlým rozvojem ascendentně se šířících periferních paréz, časté jsou současně myalgie a senzitivní projevy. Může být přítomna i dysfagie, která bývá spojena s poruchou zvednutí hlavy vleže, častou lézí n. VII i dalšími projevy postižení hlavových nervů bulbární oblasti.
Svalové dystrofie
Dysfagie se vyskytuje také u hereditárních svalových dystrofií, např. u facioskapulohumerální svalové dystrofie (FSHMD) nebo okulofaryngeální svalová dystrofie. Příznaky FSHMD se objevují v pozdním dětství nebo adolescenci. Postup choroby je pomalý a zpravidla kraniokaudální, nejprve jsou postiženy mimické svaly, potom pletenec ramenní, břišní svalstvo a nakonec dolní končetiny. Choroba neomezuje délku života. Slabost mimického svalstva, která patří do časné fáze onemocnění, souvisí s narušením orální fáze polykání. Mezi vzácné dystrofie patří okulofaryngeální svalová dystrofie, která mimo oční extraokulární svaly postihuje faryngeální svalstvo. V klinickém obraze tak dominuje ptóza, dysfagie a dysartrie.
Zánětlivé myopatie
Dysfagií se projevují i některé získané zánětlivé myopatie. Polymyozitida a dermatomyozitida je typická převážně proximální symetrickou svalovou slabostí končetin, obvykle jsou však oslabeny také flexory hlavy a polykací svalstvo. Myozitida s inkluzními tělísky (IBM – inclusion body myositis) se manifestuje také slabostí končetin, na dolních končetinách bývají nejvýrazněji postiženy kvadricepsy, na horních pak hluboké flexory prstů. Do obrazu choroby patří i dysfagie z postižení svalů proximální části jícnu. U těchto myopatií bývá vyjádřen i syndrom klesající hlavy (dropped head syndrome), který je důsledkem slabosti šíjového svalstva. Brada postiženého jedince se dotýká hrudníku, což znesnadňuje polykání, mluvení i dýchání.
DISKUZE
Četné poruchy polykání lze léčit dlouhodobou rehabilitací pod vedením klinického logopeda. Vždy je nutné dohlížet na dostatečný příjem stravy a je třeba podávat stravu vhodné konzistence. Zjednodušeně lze říci, že pacient s poškozenou přípravnou orální fází potřebuje řídkou stravu. Pacient, kterému vytékají tekutiny nosem, potřebuje tekutiny zahustit pomocí instantních zahušťovadel. Husté tekutiny a hustší strava se podávají i pacientovi s opožděným polykáním ve fázi faryngeální (10). K rozhodnutí o adekvátních dietetických opatřeních je nezbytné podrobné vyšetření polykacího aktu. Pro mnohé pacienty s poruchou polykání je vhodný individuální nutriční režim.
V případě, že perorální příjem není dostatečný, je potřeba doplňovat jej gastrickou cestou. Zprvu se zavádí nazogastrická sonda (NGS). Dlouhodobě zavedená NGS vede k četným komplikacím (záněty, striktury jícnu, ezofagotracheální píštěle), navíc komplikuje rehabilitaci řeči a hůře se ošetřuje. Pokud předpokládáme gastrickou výživu po delší dobu než 6 týdnů, přistoupíme k perkutánní endoskopické gastrostomii (PEG).
Na diagnostice a léčbě poruch polykání se podílejí jak lékařské obory (otorinolaryngologie, neurologie, radiologie, interní lékařství, chirurgie, pneumologie), tak obory nelékařské (klinická logopedie, fyzioterapie, neuropsychologie, ergoterapie, dietologie). Lékařské obory důsledně dohlížejí nad prováděnou terapií a tím minimalizují možná ohrožení pacientů s dysfagií.
Podpořeno grantem IGA MZČR NT 13725-4/2012 a PRVOUK P37/08.
ADRESA PRO KORESPONDENCI:
doc. MUDr. Martin Vališ, Ph.D.
Neurologická klinika FN
Sokolská 581, 500 05 Hradec Králové
e-mail: valismar@seznam.cz
Sources
1. Adams C. Complications and causes of death in multiple sclerosis. In Adams C, et al. Colour atlas of multiple sclerosis and other myelin disorders. London: Wolfe Medical Publications Ltd., 1989; 202–208.
2. Ali GN, Wallace KL, Schwartz R, et al. Mechanisms of oral-pharyngeal dysphagia in patients with Parkinson’s disease. Gastroenterology 1996; 10(2): 383–392.
3. Blass JP. Pathyphysiology of Alzheimer’s syndrome. Neurology 1993; 43(Suppl 4): 25–38.
4. Borasio GD, Voltz R. Palliative care in amyotrophic lateral sclerosis. J Neurol 1997; 244(4): 11–17.
5. Born LJ, Harned RH, Rikkers LF, et al. Cricopharyngeal dysfunction in Parkinson’s disease: role in dysphagia and response to myotomy. Mov Disord 1996; 1(1): 53–58.
6. Byrne KG, Pfeiffer R, Quigley EM. Gastrointestinal dysfunction in Parkinson’s disease. A report of clinical experience at a single center. J Clin Gastroenterol 1994; 19(1): 11–16.
7. Coates C, Bakheit AM. Dysphagia in Parkinson’s disease. Eur Neurol 1997; 38(1): 49–52.
8. El Sharkawi A, Ramig L, Logemann J, et al. Swallowing and voice effects of Lee Silverman voice treatment: a pilot study. J Neurol Neurosurg Psychiatry 2002; 72(1): 31–36.
9. Ertekin C, Yuceyar N, Aydogdu I. Clinical and electrophysiological evaluation of dysphagia in myasthenia gravis. J Neurol Neurosurg Psychiatry 1998; 65 : 848–856.
10. Grofová Z. Výživa u poruch polykání. Med. Pro Praxi 2008; 5(10): 399–400.
11. Horner J, Alberts MJ, Dawson DV, Cook GM. Swallowing in Alzheimer’s disease. Alzheimer Dis Assoc Disord 1994; 8(3): 177–189.
12. Hunter PC, Crameri J, Austin S, et al. Response of parkinsonian swallowing dysfunction to dopaminergic stimulation. J Neurol Neurosurg Psychiatry 1997; 63 : 579–583.
13. Iwasaki K, Wang Q, Seki H, et al. The effects of the traditional chinese medicine „Banxia Houpo Tang (Hange-Koboku To)“ on the swallowing reflex in Parkinson’s disease. Phytomedicine 2000; 7(4): 259–263.
14. Martino R, Foley N, Bhogal S, et al. Dysphagia after stroke: incidence, diagnosis, and pulmonary complications. Stroke 2005; 36(12): 2756–2763.
15. Piťha J, Bednařík J, Zapletalová O. Klinický standard pro diagnostiku a léčbu myasthenia gravis. 1. vyd. Edice Národní sada klinických standardů. Praha: Národní referenční centrum 2011.
16. Prosiegel M, Schelling A, Wagner-Sonntag E. Dysphagia and multiple sclerosis. Int MS J 2004; 11(1): 22–31.
17. Roy N, Stemple J, Merrill R, Thomas L. Dysphagia in the elderly: preliminary evidence of prevalence, risk factors, and socioemotional effects. Ann Otol Rhinol Laryngol 2007; 116(11): 858–865.
18. Smith HA, Lee SH, O’Neill PA, Connolly MJ. The combination of bedside swallowing assessment and oxygen saturation monitoring of swallowing in acute stroke: a safe and humane screening tool. Age Ageing 2000; 29(6): 495–499.
19. Thomas FJ, Wiles CM. Dysphagia and nutritional status in multiple sclerosis. J Neurol 1999; 246(8): 677–682.
20. Volicer L, Seltzer B, Rheaume Y, et al. Progression of Alzheimer-type dementia in instituonalized patients: a cross-sectional study. J Appl Gerontol 1987; 6 : 83–94.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2014 Issue 6-
All articles in this issue
- Zánětlivý pseudotumor očnice
- Infarkt myokardu jako první příznak esenciální trombocytémie u mladého muže
- Poruchy polykání u neurologických onemocnění
-
Očkování a jeho role v prevenci infekčních nemocí.
Odmítání očkování – vážný problém veřejného zdravotnictví - Profesionální onemocnění hlášená v České republice v roce 2013
- Bezpečnost pacienta na operačním sále v českých a švédských nemocnicích
- Lékaři a zákony
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poruchy polykání u neurologických onemocnění
- Zánětlivý pseudotumor očnice
- Bezpečnost pacienta na operačním sále v českých a švédských nemocnicích
-
Očkování a jeho role v prevenci infekčních nemocí.
Odmítání očkování – vážný problém veřejného zdravotnictví
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

