-
Medical journals
- Career
Nanočástice a nanostruktury v biomedicínských aplikacích
Authors: A. Fojtík 1; K. Piksová 2; M. Weiserová 3; V. Bencko 4
Authors‘ workplace: České vysoké učení technické v Praze, Fakulta biomedicínského inženýrství, Kladno, Děkan: doc. MUDr. Jozef Rosina, Ph. D. 1; České vysoké učení technické v Praze, Fakulta jaderná a fyzikálně inženýrská, Děkan: doc. Ing. Miroslav Čech, CSc., Katedra fyzikální elektroniky Vedoucí: prof. Ing. Pavel Fiala, CSc. 2; Akademie věd České republiky, Mikrobiologický ústav Praha, v. v. i., Ředitel: RNDr. Martin Bilej, DrSc., Buněčná a molekulární mikrobiologie, Vedoucí: RNDr. Jan Nesvera, CSc. 3; 1. lékařská fakulta Univerzity Karlovy v Praze, Ústav hygieny a epidemiologie, Přednosta: doc. MUDr. Milan Tuček, CSc. 4
Published in: Prakt. Lék. 2012; 92(8): 440-444
Category: Of different specialties
Overview
Magnetické nanočástice jsou často využívány v medicínských aplikacích, neboť s nimi lze manipulovat pomocí vnějšího elektrického a magnetického pole. Tyto nanočástice můžeme povrchově upravit (funkcionalizovat) a tím určovat jejich chemické a biochemické vlastnosti. Článek se zabývá také studiem antiseptických účinků některých kovových nanočástic. Je navržen a stručně popsán model příslušných mechanismů a jsou vysvětleny základní bioaplikační procesy s těmito nanostrukturami. Prezentovaná práce nastiňuje možnosti experimentálního studia, kterými se zabývá naše i řada dalších laboratoří v České republice. Bylo zjištěno, že magnetické nanočástice v průběhu likvidace v lidském organismu zvýší hladinu hemoglobinu. Této skutečnosti může být využito při aplikaci léků, které významně snižují počty erytrocytů.
Klíčová slova:
nanočástice, funkcionalizované nanostruktury, modifikace povrchu, magnetické vlastnosti, chemisorpceÚvod
Předpona nano znamená miliardtina (10-9) a v podstatě vystihuje to, o čem celá nanověda je, totiž o zkoumání struktur velikosti řádu nanometrů a posléze hledání jejich užitečných aplikací. V současné době je již věda na takové úrovni, že nám umožňuje nahlížet do přírodních procesů, které se odehrávají uvnitř hmoty.
Protože nanostruktury mají unikátní vlastnosti, můžeme říci, že z hlediska využití těchto struktur pro praktické aplikace se otevírají dveře k netušenému dalšímu rozvoji vědy. Klíčem k unikátním vlastnostem je prostorové omezení těchto struktur. Tímto omezením se zásadním způsobem mění fyzikální a chemické vlastnosti materiálu, např. uhlí je červené a rozpustné v organických rozpouštědlech, křemík je bledě žlutý a má silnou oranžovou luminiscenci, železo je žluté a rozpustné v polárních rozpouštědlech, atd. Je možné konstatovat, že když člověk začal tvořit vlastní nástroje, dělal to způsobem ve směru od velkého materiálového celku – postupným opracováním získal potřebný tvar a funkčnost předmětu. Z pohledu přírody je to postup složitý a neekonomický, protože příroda může využít schopnosti samotných molekul automaticky se uspořádat. Jediné co potřebujeme, je znát podmínky pro tvorbu a růst těchto struktur. Příroda měla na „vývoj“ takovýchto struktur miliony let. Ve srovnání s tím je doba existence rozvinuté lidské civilizace zanedbatelná.
Nanostruktury a s nimi spojené procesy příroda znala a využívala od nepaměti, např. buněčná membrána, pumpování protonů přes membránu, ukládání informace o vidění v očním pigmentu (obrázek 1), nanovlákna pavoučí sítě, svalové buňky, apod. V jistém slova smyslu by se dalo napsat, že nanověda je o návratu se k přírodě, o odhalování způsobů a postupů, které příroda využívá ke stavění svých výtvorů a jejich aplikaci pro naše potřeby. Je to nová úroveň materiálového inženýrství, kdy se materiál tvoří na míru pro daný účel cílenou manipulací (1–7).
Image 1. Foto-izomerizace rodopsinu (8) 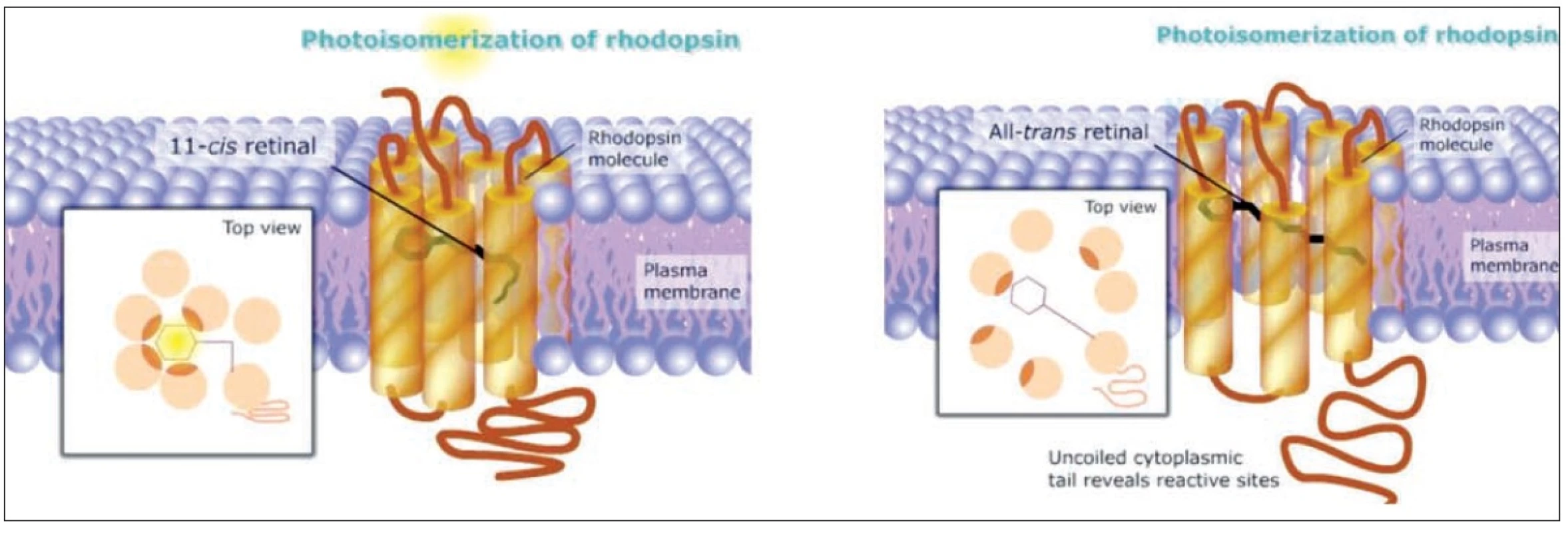
Nanočástice v biomedicínských aplikacích
Nanočástice díky svým vlastnostem nabízejí rozsáhlé a významné využití v biomedicínských oborech a v medicínských aplikacích. Velikost nanočástic a modifikace jejich povrchů dovoluje vzájemnou interakci mezi molekulami buněk i buněčných povrchů cestou, která nemění jejich chování ani biochemické vlastnosti. Nanočástice mohou být použity buď přímo jako aktivní medium nebo jako nosiče různých léčiv.
Vlastnosti nanočástic jsou závislé nejenom na tvaru a velikosti, ale také na jejich povrchové modifikaci. Nanočástice je obvykle tvořena jádrem a povrchovou vrstvou z anorganických nebo polymerických materiálů. Jádro může být z několika vrstev a plnit více funkcí. Například, kombinací magnetických a luminiscenčních vrstev je možné částici detekovat a také v magnetickém poli s částicemi manipulovat. Obal tvořený jednou či více vrstvami, které určují vlastnosti nanočástice. Vrstvy mohou být hydrofilní, a pak jsou částice kompatibilní s polárním prostředím (voda, krevní plazma) nebo mohou být vrstvy hydrofobní a pak jsou kompatibilní s nepolárním prostředím (olej, tuky, organická nepolární rozpouštědla). Svými povrchovými vlastnostmi nabývají nanočástice tzv. rozhodovací vlastnost. Tvar je nejčastěji kulový, může však být i válcový nebo diskový, ale možné jsou i další tvary.
Nanočástice zajišťující funkci transportního systému, musí splňovat řadu podmínek:
- vysokou kapacitu nosiče pro léčivo (velký povrch nanočástic, m2/g);
- zajištění stability transportovaných látek i samotného nosiče za fyziologických podmínek;
- schopnost „nalezení“ místa určení;
- možnost kontrolovaného uvolnění léčiva v terapeutickém rozmezí (uvolňování léčiva lze nastartovat např. působením intracelulárních látek či kolapsem liposomů v důsledku změny hodnoty pH v cílové tkáni, zvýšením teploty, vlivem elektromagnetického či magnetického pole);
- schopnost následného odbourání nosiče z organismu.
Nanočástice, které by měly sloužit jako nosiče léků, musí umožňovat prodlouženou cirkulaci účinných látek v krevním řečišti, řízenou aktivaci a selektivní zaměření účinků na cílovou tkáň či soubor buněk, jako je například nádor, a to chemickými vlastnostmi nebo fyzikálními podmínkami (magnetické pole v místě lokalizace). Velká pozornost je zaměřena na vývoj nosičů chemoterapeutik a cytostatik, jejichž aplikace je obvykle provázena výraznými nežádoucími účinky, které účinnou léčbu omezují, neboť dávky cytotoxického léčiva potřebné pro úplné dosažení terapeutického účinku jsou příliš vysoké. Transport léčiva se děje tzv. inkapsulací, kdy léčivo je umístěno do kapsle, z které je následně uvolněno její biodegradací v organismu (8–13).
Funkcionalizované magnetické nanočástice
Aplikace nanočástic obecně by měly u nádorových onemocnění usnadnit jejich diagnostiku a umocnit včasnost této diagnostiky, měly by upřesnit a specifikovat zacílení nádorové léčby. Magnetické částice mají jedinečné vlastnosti, které mohou být výhodně využity pro některé biomedicíncké aplikace. Základním rysem magnetických částic je jejich reakce v magnetickém poli. Další důležité vlastnosti magnetických nanočástic určených pro lékařské aplikace představuje jejich netoxicita, biokompatibilita, možnost podání injekční formou a schopnost vysoké kumulace v cílové tkáni nebo orgánu.
V biomedicínských aplikacích se nejčastěji využívají oxidy železa. Základem částice je jádro z magnetického materiálu, nejčastěji z oxidu železa, a z povrchového obalu, tzv. zapouzdření. Částice jsou pokryty biokompatibilními materiály. Povrchová úprava částicím dává schopnost stabilizace a zabraňuje jejich aglomeraci. Používají se různé polymery, makromolekuly a další v současné době studované alternativy. Díky těmto obalovým vrstvám jednotlivé nanočástice mohou plnit také úlohu nosičů léčiv, proteinů nebo plazmidů. Magnetické nanočástice díky povrchu z biologicky kompatibilních molekul a díky kontrolovatelnému způsobu označení mohou interagovat nebo se navázat k cílovému biologickému materiálu. Se značenými magnetickými částicemi je možné manipulovat v magnetickém poli. Toto „působení na dálku“ v kombinaci s prostupností magnetického pole lidskou tkání otevírá řadu aplikací umožňujících transport, fixaci magnetických nanočástic nebo označení biologických lokalit. Magnetické částice mohou být vyrobeny k rezonančním odezvám na střídavé magnetické pole tak, aby splňovaly podmínky související s přenosem energie. Tyto částice pak umožňují ohřev tkáně a jsou využívány k hypertermii, při které se obvykle do nádorového ložiska dodá toxické množství tepelné energie. Hypertermie v kombinaci s radioterapií nebo chemoterapií může umocňovat jejich konečný efekt (14–18).
Image 2. Příklad multifunkční nanočástice (pro aktivní zacílení). Jádro obsahující magnetické nanočástice je „zabaleno“ do obalu liposomu, ke kterému je kovalentně připojena specifická protilátka (13) 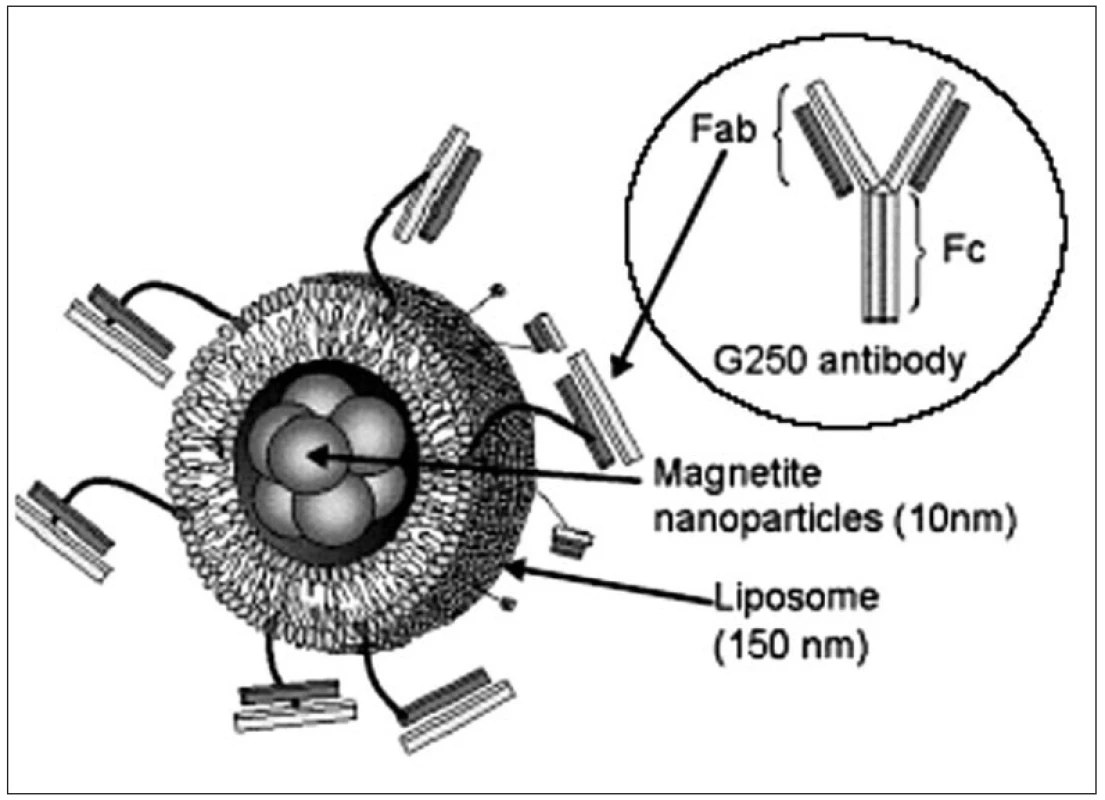
Baktericidní vlastnosti nanočástic
Nežádoucí růst bakterií představuje již řadu let problém, a to nejen v současné medicíně, ale například i v potravinářském průmyslu. Zajímavou alternativou existujících metod je použití kovových nanočástic s baktericidními vlastnostmi. Jeden z nejslibnějších typů představují nanočástice stříbra, které mají schopnost interagovat s proteiny obsaženými v bakteriálních membránách.
Bylo zjištěno, že kovové nanočástice stříbra mají velmi silný antiseptický účinek pro velký počet bakteriálních kmenů. Tyto vlastnosti byly měřeny v různých laboratořích různými metodami. Ve všech případech byla jednoznačně potvrzena antiseptická aktivita. Mechanismus nebyl doposud dostatečně objasněn. Biologické laboratoře se tímto problémem nezabývaly. V naší laboratoři bylo zjištěno, že stříbrné nanočástice musí mít kovový charakter, tj. musí mít dostatečnou velikost, takovou kdy se na jejich povrchu začne objevovat lokalizovaný povrchový plazmon. To je základní podmínka pro přechod stříbrného klastru na kovovou strukturu. Proces antiseptických účinků závisí na přítomnosti kyslíku.
Stříbrné nanočástice mají úzkou absorpci v okolí hodnoty 380 nm, způsobenou rezonancí lokalizovaného povrchového plazmonu. Absorpční pík se silně mění v závislosti na adsorpci cizích molekul na povrchu částice. Lokalizovaný povrchový plazmon je silně závislý na povrchových vlastnostech částice. Mezi adsorpční látky, silně tlumící lokalizovaný povrchový plazmon, patří například merkaptové sloučeniny obsahující SH skupinu. Účinek je přisuzován uvolnění aglomerovaných částic, jejichž stabilita je snížená adsorbovanou látkou:
Agn + R + SH + O2 → Agn-1 + R – SAg + H20
Sulfhydrilová skupina –SH, která ve struktuře bakteriálních proteinů představuje jednu ze základních částí, se adsorbuje na povrch kovové nanočástice stříbra v disociované formě RS-. Na povrchu částice se vytvoří vazba mezi sulfhydrilovou skupinou bakterie, iontem stříbra Ag+ a přebytečným elektronem, který vznikne v částici disociací jednoho atomu stříbra:
Ag0 → Ag+ + e–
Přebytečný elektron, zůstává v částici. Za přítomnosti kyslíku pak Ag nanočástice, nacházející se ve výše uvedeném stavu, může redukovat kyslík na . Pokud se částice zbaví přebytečného záporného náboje, oddělí se od klastru nebo dojde k oddělení organické molekuly s navázaným stříbrem RS-Ag.
Tímto krokem se bakterie zbaví možnosti pokračování reprodukčního cyklu. Těžký kovový iont změní strukturu bakterie a ta v důsledku změny odumírá (místo volné sulfhydrilové skupiny se vytváří vazba stříbrného iontu na místo vodíku a vzniká R-SAg).
Po adsorpci R-SH, nebo jim podobných biologických sloučenin, na povrch nanočástice dojde ke snížení absorpce plazmonového píku. To lze vysvětlit tím, že adsorbované molekuly změní strukturu elektronů na povrchu částice nebo jinými slovy zablokuje jeden povrchový atom, který se v přítomnosti kyslíku od nanočástice oddělí. Tento proces se může mnohonásobně opakovat, částice se zmenšuje až do vyčerpání všech atomů, které tvořily kovovou strukturu částice. Pak se tento efekt „likvidace“ zastaví. V běžných biologických prostředích vydrží částice několik týdnů i měsíců (19–21).
Experimentální výsledky
Při pokusech k ověření baktericidních vlastností stříbra byly použity stříbrné nanočástice připravené modifikovanou Turkevichovou metodou syntézy (22). Stříbrné nanočástice byly připraveny ve velikostech 10–30 nm. Při prováděných mikrobiologických testech se vycházelo ze studií (23–25). Baktericidní aktivita stříbra byla testována na následujících bakteriálních kmenech: Escherichia coli K12 C 600, Candida albicans, Enterococcus faecalis (EFCA), Staphylococcus aureus a Methicilin-rezistentní Staphylococcus aureus (MRSA). Grafy č. 1–3 ilustrují prováděné pokusy. Celkovou účinnost stříbrných nanočástic na jednotlivé bakteriální kmeny, tak koncentrační i časové závislosti jejich působení.
Graph 1. Souhrnná účinnost stříbrných nanočástic 
Graph 2. Koncentrační závislost účinnosti stříbrných nanočástic a/ bakterie: stříbro =10<sup>7</sup> bac./ml: 10<sup>11</sup> částic /ml b/ bakterie: stříbro =10<sup>7</sup> bac./ml: 10<sup>10</sup> částic /ml c/ bakterie: stříbro =10<sup>7</sup> bac./ml: 10<sup>9</sup> částic /ml d/ bakterie: stříbro =10<sup>7</sup> bac./ml: 10<sup>8</sup> částic /ml 
Graph 3. Časová závislost účinnosti stříbrných nanočástic a/ bakterie : stříbro = 10<sup>7</sup> bac./ ml : 10<sup>11</sup> částic /ml b/ bakterie : stříbro = 10<sup>7</sup> bac./ ml : 10<sup>9</sup> částic /ml 
Výsledky ukázaly, že takto připravené částice měly 99,8% až 100% účinnost u vyšetřovaných typů bakterií. Podrobnější informace jsou uvedeny v publikaci (26–28).
Závěr
Použité nanočástice kovové a kovových oxidů byly vybrány a připravovány s ohledem na co nejmenší biologickou toxicitu (co největší biologickou kompatibilitu). U magnetických nanočástic (Fe3O4-oxid železnatoželezitý) je možné uvažovat o aplikaci in vitro (kdy se vše odehrává mimo lidské tělo, v přístrojích podobných umělé ledvině, externě) nebo in vivo ve stejných podmínkách jako se používá kontrastní látka resovist. V tomto případě jsou naše kovové magnetické nanočástice chemicky identické s magnetickými vlastnostmi resovitu, jsou účinnější a mají silnější magnetické vlastnosti. Tyto částice (naše magnetické i resovist) jsou odbourávány v lidském těle.
Bylo zjištěno, že kovové magnetické nanočástice v průběhu likvidace v lidském organismu zvýší hladinu hemoglobinu. Tento fakt je v pozornosti našeho současného zájmu z hlediska možnosti překlenutí významného poklesu počtu erytrocytů při aplikaci některých léků.
Poděkování
Tato práce vznikla za podpory Ministerstva školství, mládeže a tělovýchovy – výzkumný záměr č. 60840770022 a Grantové agentury Akademie věd ČR – projekt KAN40122801.
Ing. Kateřina Piksová
Katedra fyzikální elektroniky,
FJFI ČVUT v Praze
V Holešovičkách 2
180 00 Praha 8
E-mail: katerina.piksova@fjfi.cvut.cz
Sources
1. Poole, Ch.P., Jr., Owens, F.J.: Introduction to nanotechnology. New York: John Willey and Sons, 2003. ISBN 0-471-07935-9.
2. Zhang, D.: Magnetic nanomaterials: conventional synthesis and properties. In Schwarz J.A., Contescu C.I., Putyera K. (Eds.). Dekker encyclopedia of nanoscience and nanotechnology. New York: M. Dekker, 2004.
3. Beiser, A.: Úvod do moderní fyziky. Praha: Academia, 1977.
4. Klusot, P.: Skončil věk „nanotechnologické“ nevinnosti? Vesmír, 2010, 89, s. 286–289.
5. Čapková, P.: Nové funkční nanostruktury s požadovanými vlastnostmi. Vesmír, 2010, 89, s. 295.
6. Černík, M.: Použití nanomateriálů při ochraně a čištění životního prostředí. Vesmír, 2010, 89, s. 316–317.
7. Giersig, M., Chomutov, G. B.: Nanomaterials for application in medicine and biology. Proceedings of the NATO Advanced Research Workshop on Nanomaterials for Application in Medicine and Biology, Bonn,Germany, 4-6 October 2006. Berlin: Springer 2008, 188 p. ISBN 978-1-4020-6829-4.
8. Matthews, G.G.: Neurobiology, molecules, cells and systems [online]. 2nd ed. Dostupný na WWW: http://www.blackwellpublishing.com/matthews/default.html [cit. 2011-11-04].
9. Feldheim, D.L., Foss, C.A.jr.: Metal nanoparticles: synthesis, characterization, and applications. New York: M. Dekker, 2002. ISBN 0-8247-0604-8.
10. Rabišková, M.: Nanočástice pro lékové formy. Remedia 2007; 17: s. 495–501.
11. Rabišková, M.: Využití nanočásticových systémů v medicíně. Remedia 2008, 18: s. 89-97.
12. Pankhurst, Q.A., Connolly, J., Jones, S.K., Dobson, J.: Applications of magnetic nanoparticles in biomedicine. J. Phys. D: Appl. Phys. 2003, 36, R167-R181.
13. Akira, I, Masashige, S. Hiroyuki, H., Takeshi, K.: Medical application of functionalized magnetic nanoparticles. J Biosci Bioeng, 2005, 100(1), p. 1–11.
14. Buřičová, P.: Vybrané nanočástice a nanostruktury pro aplikaci v biologii, biomedicíně. Diplomová práce. Praha: ČVUT, Fakulta biomedicínského inženýrství, 2008.
15. Nováková, M.: Vybrané magnetické nanočástice a nanostruktury pro aplikace v biomedicíně a lékařství. Diplomová práce. Praha: ČVUT, Fakulta biomedicínského inženýrství, 2008.
16. Kim, J.S., Yoon, T-J, Yu, K. N. et al.: Toxicity and tissue distribution of magnetic nanoparticles in mice. Toxicol Sci. 2006; 89(1): p. 338–347.
17. Arruebo, M., Fernández-Pacheco, R., Ibarra, M.R., Santamaría, J.: Magnetic nanoparticles for drug delivery. Nanotoday 2007, 2(3), p. 22–32.
18. Sun, C., Lee, J.S.H., Zhang, M.: Magnetic nanoparticles in MR imaging and drug delivery. Adv Drug Deliv Rev 2008, 60, p. 1252–1265.
19. Fojtík, A., Novotný, F., Štyndlová, K.: Metal nanoparticles in statu nascendi. (From embryonic stage of Ag nanoparticles to the metal nanoclusters). International Conference NANO 06, November 13-15, 2006, Brno, Czech Republic. Abstract booklet pp. 32. ISBN 80-214-3308-6.
20. Henglein, A., Fojtík, A., Keller, H.: Reaction on colloidal semiconductor particles. Ber. Bunsenges. Phys. Chem. 1987; 91: p. 441–446.
21. Fojtik, A., Mulvaney P., Linnert, T., et al.: Formation and reduction of semiconductor-like aggregates of silver-carboxy-alkane-thiolates in aqueous solutions. Ber. Bunsenges. Phys. Chem. 1991, 95(7), p. 770–777.
22. Kimling, J., Maier, M., Okenve, B., et al.: Turkevich method for gold nanoparticle synthesis revisited. J. Phys. Chem. B, 2006; 110(32): p. 15700-15707.
23. Appleyard, R.K.: Segregation of new lysogenic types during growth of doubly lysogenic strains derived from Escherichia coli K-12. Genetics, 1954; 39: p. 440–452.
24. Luria, S.E.: Host-induced modifications of viruses. Cold Spring Harb Symp Quant Biol, 1953; 18: p. 237–244.
25. Huang, L., Li, D.Q., Lin, Y.J. et al.: Controllable preparation of Nano-MgO and investigation of its bactericidal properties. J Inorg Biochem, 2005; 99(5): p. 986-993.
26. Piksová, K., Weiserová, M., Jedlličková, A., Fojtík, A.: Silver nanoparticles and their bactericidal effect. Conference proceedings NANOCON 2009, No. 48, ISBN 978-80-87294-12-3.
27. Piksová, K., Weiserová, M., Fojtík, A.: Bactericidal effect of metal nanoparticles and their characterization. Book of Abstracts: 2008 E-MRS Fall Meeting & Exhibit, Varšava, p. 127, ISBN 83-89585-23–5.
28. Berger, J.: Příprava, charakterizace vybraných kovových nočástic a ověření jejich bakteriocidních účinků. Bakalářská práce. Praha: ČVUT, Fakulta jaderná a fyzikálně inženýrská, 2009.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2012 Issue 8-
All articles in this issue
-
Základy kognitivní, afektivní a sociální neurovědy
XXII. Freud 2012 - Přehled doporučení pro předpis pohybové aktivity v primární prevenci onemocnění
- Nanočástice a nanostruktury v biomedicínských aplikacích
- Sarkosin v moči pacientů se zhoubným nádorem prostaty
- K čemu slouží elektronické cigarety? Aktuální poznatky pro praxi
- Intersticiální plicní procesy a postižení bronchiolů
- Marihuana: rizika a krátká intervence
- Měření kvality života u seniorů s demencí
- Dlouhodobá prognóza pacientů hospitalizovaných pro akutní srdeční selhání
- Praktičtí lékaři jsou nepostradatelným článkem veřejného zdravotnictví
-
Základy kognitivní, afektivní a sociální neurovědy
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Marihuana: rizika a krátká intervence
- Intersticiální plicní procesy a postižení bronchiolů
- Přehled doporučení pro předpis pohybové aktivity v primární prevenci onemocnění
- Sarkosin v moči pacientů se zhoubným nádorem prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

