-
Medical journals
- Career
Zinek a jeho vztah k nádorům prostaty
: J. Gumulec 1; M. Masařík 1; R. Hrabec 2; A. Rovný 2; H. Binková 3; P. Babula 4; V. Adam 5; R. Kizek 5
: Ústav patologické fyziologie, Lékařská fakulta Masarykova univerzita Přednostka: prof. MUDr. Anna Vašků, CSc. 1; Oddělení urologie, Fakultní nemocnice u sv. Anny, Brno Primář: MUDr. Arne Rovný 2; Klinika otorinolaryngologie a chirurgie hlavy a krku Lékařská fakulta, Masarykova univerzita Přednosta: prof. MUDr. Rom Kostřica, CSc. 3; Ústav přírodních léčiv, Veterinární a farmaceutická fakulta v Brně Děkan: doc. RNDr. Milan Žemlička, CSc. 4; Ústav chemie a biochemie, Mendelova univerzita v Brně Děkan: prof. Ing. Ladislav Zeman, CSc. 5
: Prakt. Lék. 2010; 90(8): 455-459
: Reviews
Zinečnaté ionty (Zn2+) jsou významným esenciálním prvkem, nutným pro správnou funkci savčích buněk. Podílejí se na regulaci imunitního systému, genové exprese, energetického metabolismu, transdukce signálu a plní strukturální funkci. Protože vyšší hladiny těchto iontů působí toxicky, je nutná přesná regulace jejich hladiny. Na té se podílejí zinkové přenašeče a zinek-vázající proteiny, zejména metalothioneiny. Prostatická tkáň je v metabolismu Zn2+ specifická. Její buňky akumulují až desetinásobně větší množství těchto iontů. Karcinom prostaty, časté nádorové onemocnění mužů, je charakteristický rozdílnými a nepříliš jasnými mechanismy, které slouží pro udržování hladiny Zn2+. To má dva významné důsledky:
- podíl na patogenezi onemocnění (vlivem na apoptózu), a
- zvýšení sérové hladiny metalothioneinu (s možným využitím jako nádorového markeru onemocnění).
Klíčová slova:
Zinek, metalothionein, thiolové sloučeniny, rezistence, nádorové onemocnění.Úvod
Hlavní funkcí prostaty je tvorba seminální tekutiny, která tvoří až 30 % jejího celkového objemu. Úkolem prostatické frakce seminální tekutiny je vytvořit prostředí vhodné pro přežívání spermií v nepříznivých podmínkách vaginy (1). Tato slabě zásaditá frakce obsahuje prostaglandiny, řadu enzymů, zinečnaté ionty a citrát. Prostatické buňky jsou jedinečné v křížení metabolických drah, obsahu zinečnatých iontů a citrátu, k němuž u jiných buněk dochází spíše výjimečně. Akumulovaný zinek v prostatě blokuje enzymy, které by jinak zapříčinily vstup citrátu do Krebsova cyklu. Tyto metabolické dráhy jsou u karcinomu prostaty změněny a k akumulaci zinku a citrátu dochází v omezené míře, anebo vůbec, protože je tento mechanismus blokován zcela.
Zhoubné nádory prostaty
Nádory prostaty patří k nejčastějším nádorovým onemocněním mužů. Jejich incidence se v České republice pohybuje kolem 100 případů na 100 000 mužů (2). Jsou druhou nejčastější příčinou úmrtí na nádorové onemocnění, předcházené novotvary průdušek a plic. Je pro ně typická incidence ve vyšším věku, ve věkové skupině 50–54 let dosahuje 58,8 případů na 100 000 mužů, ve věkové skupině 70–74 let je více než dvanáctinásobná (2).
Incidence tohoto onemocnění se od roku 1990 přibližně zdvojnásobila, což je důsledkem stárnutí populace a rutinního vyšetřování sérových hladin prostatického specifického antigenu (PSA) u starších pacientů. Vyšší hodnoty tohoto markeru nebo rychlý vzestup jeho hladin indikuje pacienty k biopsii. I přes vysokou senzitivitu a specifitu tohoto nádorového markeru je řada pacientů indikována na zbytečná vyšetření či neadekvátně léčena. V naprosté většině se totiž jedná o nádory klinicky němé, pomalu rostoucí s malým potenciálem metastázovat. Jsou proto často rozpoznané až u pitvy pacientů zemřelých na jinou příčinu (1).
Nádory prostaty se vyskytují nejčastěji (70–75 %) v laterálních částech prostaty, která je dostupná fyzikálnímu vyšetření per rectum (1, 3). Zhoubné nádory jsou typicky multifokální (až v 85 % případech), ložiska jsou často mikroskopických rozměrů s jednoznačně negativním fyzikálním vyšetřením (3). Většina přibližně 95 % nádorů, jsou histologicky acinární adenokarcinomy odvozené z glandulárního epitelu, o různém stupni diferenciace, od špatně diferenciovaných až po dobře diferenciované, mnohdy těžko odlišitelné od benigně hyperplastických žláz (3). Zbylých 5 % tvoří adenokarcinomy:
- duktální,
- mukózní,
- karcinomy přechodné,
- malobuněčné,
- dlaždicobuněčné, a
- bazocelulární.
Typickou vlastností většiny karcinomů prostaty je jejich závislost na androgenech. Androgen-ablační léčba je proto postupem používaným při pokročilých stádiích onemocnění a je prováděna chirurgickou nebo chemickou kastrací. U pokročilých stádií androgen-nezávislých forem je metodou volby chemoterapie. Léčba zářením je léčbou volby kostních metastáz (1).
Zinek a prostata
Jak je uvedeno výše, prostata se podílí na tvorbě 30 % objemu seminální tekutiny. Do té uvolňují epiteliální buňky prostaty prostaglandiny, řadu enzymů, zinečnaté ionty (Zn2+) a citrát (4). Metabolismus těchto látek, zejména Zn2+ a citrátu, je v prostatických buňkách odlišný oproti řadě jiných tkání. Citrát se běžně využívá v Krebsově cyklu za vzniku ATP. Aby nedocházelo ke vstupu citrátu do tohoto cyklu a jeho následné degradaci v něm, musí být zablokován mitochondriální enzym akonitáza, přeměňující citrát na izocitrát (5).
Akonitáza je blokována právě zinečnatými ionty, které prostata akumuluje ve zvýšené míře, až desetinásobně více oproti jiným tkáním (6). Na akumulaci Zn2+ se podílejí zinkové přenašeče, zodpovědné za redistribuci zinku mezi extracelulárním prostředím, cytoplazmou a organelami, a zinek-vázající proteiny. Touto drahou však přichází prostata o podstatnou část energie v podobě ATP (65 % ATP oproti kompletní oxidaci glukózy) (5).
Zinek má kromě přímých efektů na akonitázu také další vlivy, a to indukce apoptózy cestou cytochromu C a regulace exprese řady genů prostřednictvím kináz (7). Apoptózu způsobuje přímými vlivy na jádro a mitochondrii a dále regulací apoptických signálních drah (7).
Role zinku u karcinomu prostaty
Pro karcinom prostaty je typická nevratná ztráta schopnosti akumulovat Zn2+ (6, 8). Snížení schopnosti akumulace Zn2+ je způsobeno dosud neznámými vlivy snižujícími expresi zinkového přenašeče ZRT-IRT-like proteinu 1 (ZIP-1), který je transmembránovým proteinem zodpovědným za přenos Zn2+ do buněk (9). To vede zejména ke snížení apoptického působení a ke ztrátě schopnosti produkovat citrát ve zvýšené míře (10). Dochází ke snížení inhibičního vlivu na enzym akonitázu, jak je tomu u buněk zdravé prostaty (Obr. 1). Citrát tak může vstoupit do Krebsova cyklu a buňky karcinomu získávají výhodu v podobě schopnosti získat více energie (6).
1. Zinkové transportéry<br> Legenda: Přenašeče ZIP zodpovídají za transport Zn<sup>2+</sup> do cytoplazmy z extracelulárního prostředí a z organel. Naopak přenašeče ZnT jsou zodpovědné za transport ven z cytoplazmy, tedy do organel a do extracelulárního prostředí. 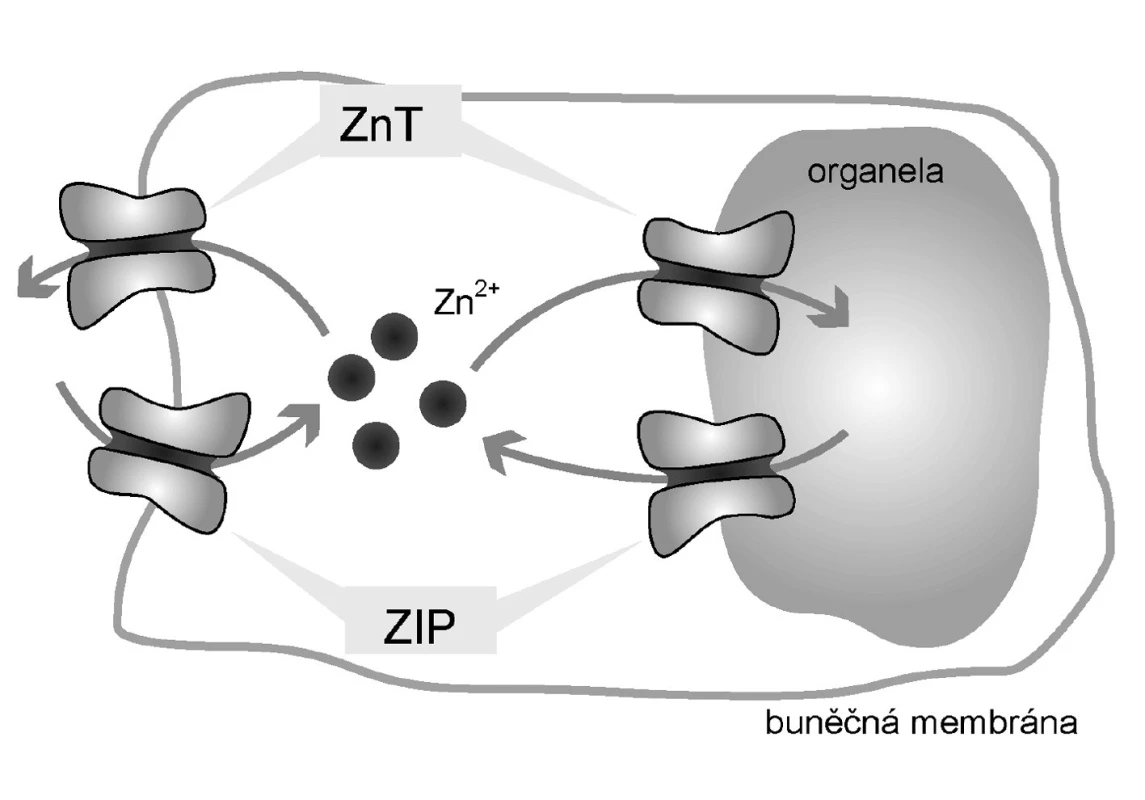
Zinek – výskyt a jeho fyziologická funkce
Řada epidemiologických studií poukazuje na nedostatečný příjem zinečnatých iontů potravou (11). Na základě mnoha uskutečněných studií je doporučováno dospělým lidem přijímat potravou přibližně 50 mg Zn2+ denně (12). Průměrně je však potravou přijímáno v USA a v Evropě asi pouze pětina tohoto doporučeného množství (13). Častým projevem nedostatku zinečnatých iontů je ztráta chuti k jídlu (13). Při jejich dlouhodobějším nedostatku dochází k dalším patofyziologickým projevům, jejichž míra projevu je závislá na míře nedostatku zinečnatých iontů (13). Mezi nejvíce zastoupené příznaky je možné zařadit zpomalení růstu dtí, narušení funkcí imunitního systému. Dále se objevují dermatitidy, prodlužuje se doba hojení ran, dochází k nefyziologickému vývoji plodu, zpomaluje se sexuální vývoj a objevují se neurologické příznaky, jako je třes (13, 14).
Zinečnaté ionty (Zn2+) jsou esenciálním prvkem nezbytným pro správnou funkci buněk. Jsou kofaktorem řady proteinů. Zn2+ jsou tak nezbytné pro správnou funkci transkripčních faktorů, enzymů a strukturních proteinů. Podílejí se na regulaci imunitního systému, genové exprese, energetického metabolismu, transdukce signálu a řadě jiných funkcí (7).
Koncentrace zinku v intersticiální tekutině se pohybuje v rozmezí 2–5 ∝M. Hladina volného Zn2+ je však výrazně nižší, přibližně 200 nM (7). Většina je totiž vázána na albumin a α2 makroglobulin. Vedle toho se v buňkách koncentrace Zn2+ pohybuje v rozmezí 100-500 ∝M. Většina tohoto obsahu je asi 90 % vázána na proteiny pevně. Pouze 10 % funguje jako rezervní forma Zn2+, která je vázána na sloučeniny s nízkou molekulovou hmotností:
- metalothionein,
- aminokyseliny (cystein, histidin, prolin), a
- organické kyseliny (citrát, oxalát) (5, 15).
Přibližně 30–40 % Zn2+ se vyskytuje v jádře, asi 50 % je v cytoplazmě a v konvenčních organelách (mitochondrie, endoplazmatické retikulum, Golgiho aparát, endozomy a lysozomy) a zbytek je vázán na buněčné membrány (16).
Podobně jako jakýkoli jiný kov, vyšší hladiny Zn2+ mohou mít toxické účinky (14). Je proto nutná přesná regulace hladiny tohoto jinak esenciálního prvku. Tu na buněčné úrovni zajišťují zinkové přenašeče a zmíněné intracelulární Zn2+-vázajícími proteiny (Obr. 1). Klíčovým regulátorem jak přenašečů, tak Zn2+-vázajících proteinů je metal-responsive-element-binding transcription factor-1 (MTF-1). MTF-1 ovlivňuje expresi metalothioneinů a zinkových transportérů, zejména těch zodpovědných ze eflux (14). Mimoto má MTF-1 účinky nesouvisející s metabolismem Zn2+, a to především v molekulárních mechanismech odstraňujících toxicitu těžkých kovů a v reakcích souvisejících s oxidativním stresem (14). Zjednodušené schéma je ukázáno na obrázku 2.
2. Účinky zinečnatých iontů<br> Legenda: Zinečnaté ionty způsobují akumulaci citrátu (a proto i změnu energetického metabolismu buněk) (a) inhibicí mitochondriální akonitázy přeměňující citrát na izocitrát. Prostatické buňky tak produkují výrazně méně ATP; (b) Zn<sup>2+</sup> působí proapoptoticky zvýšením uvolňování cytochromu C (CytC) z mitochondrií; (c) Zn<sup>2+</sup> funguje jako signální molekula a ovlivňuje tak zejména genovou expresi působením na mitogen-aktivované proteinové kinázy (MAPK); (d) Zn<sup>2+</sup> indukuje expresi metalothioneinu (MT) prostřednictvím jeho regulačního proteinu Metal-regulatory transcription factor-1 (MTF-1), čímž MT ovlivňuje intracelulární hladinu volných Zn<sup>2+</sup>. 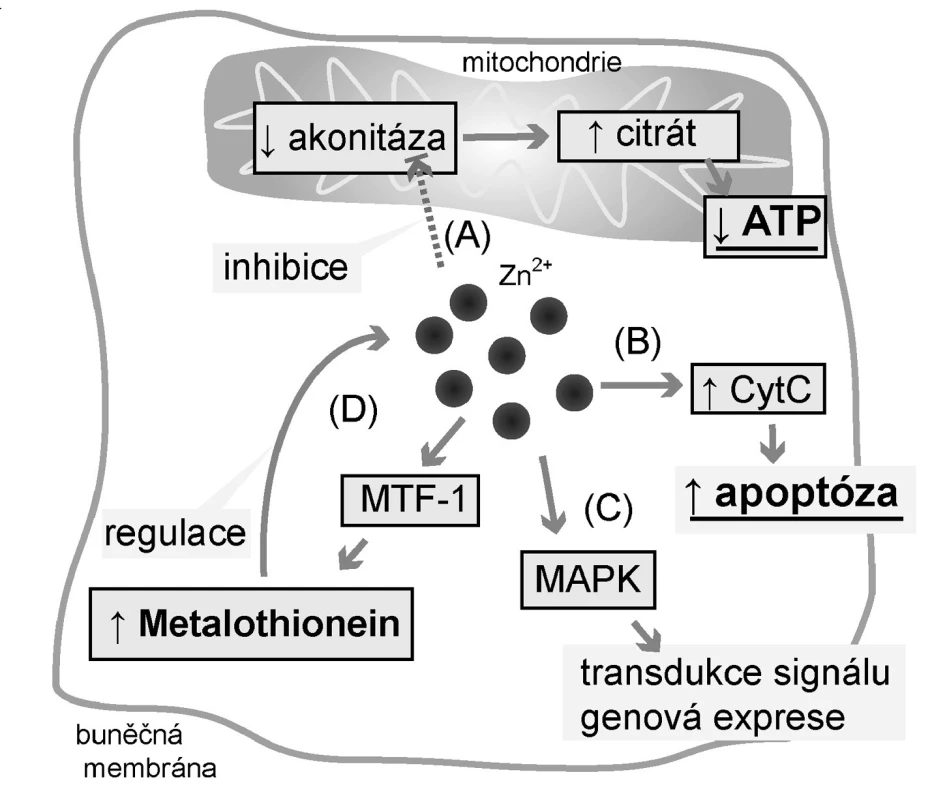
Zinkové přenašeče
Za transmembránový přenos Zn2+ jsou zodpovědné dvě rodiny přenašečů:
- rodina „Zrt - Irt-like Protein“ (ZIP), a
- rodina Zinc-transporter (ZnT).
ZIP přenašeče jsou zodpovědné za influx Zn2+ do cytoplazmy, tedy přesun z extracelulárního prostředí do cytoplazmy a z organel do cytoplazmy.
Transportéry CDF zodpovídají naopak za eflux Zn2+, tedy transport z cytoplazmy do extracelulárního prostředí a do organel (8). Metabolismus Zn2+ je regulován na úrovni transkripce těchto transportérů.
Zn2+ není jediným kovem, který může být těmito transportéry přenášen. ZIP přenašeče jsou v menší míře zodpovědné také za influx železa, manganu a kadmia do cytoplazmy. U lidí bylo popsáno 14 podtypů přenašečů této rodiny, nazývaných ZIP1–14 (17, 18). Jak mechanismus regulace jejich exprese, tak mechanismus transportu Zn2+ není zcela zřejmý. Exprese některých transportérů ZIP se zvyšuje při nedostatku Zn2+. Tak je tomu např. u přenašeče ZIP1, 2 a 4. Není jasné, zdali se tak děje cestou transkripční aktivace, nebo stabilizace mediátorové RNA (19).
Naopak, je-li Zn2+ nadbytek, dochází k inaktivaci transportérů. Ty jsou označeny ubiquitinem a degradovány ve vakuolách (20). Tento efekt byl popsán u kvasinek a podobný mechanismus se dá očekávat také u savčích buněk.
Rodina přenašečů ZnT zastává opačnou funkci oproti transportérům ZIP – transportují Zn2+ z cytoplazmy do extracelulárního prostředí a do organel. Chrání buňky před toxickými hladinami Zn2+. Dosud bylo popsáno devět lidských transportérů této rodiny, pojmenovaných Zn2+ transporter (ZnT-1–9). Také u této rodiny přenašečů není mechanismus aktivace a transportu zcela objasněn. Je ale zřejmé, že zinkové ionty mají na expresi těchto přenašečů opačný vliv proti rodině ZIP.
Vysoká hladina Zn2+ zvyšuje jejich expresi (8). Toto chování bylo popsáno u přenašečů ZnT-1 a 2. Kromě toho velmi vysoké hladiny Zn2+ také způsobují přesuny přenašečů ZnT-4 a 6 z perinukleární zóny do periferie buněk. Transportér (ZnT-1) je transportérem této rodiny vyskytujícím se na plazmatické membráně buněk (8). Je tedy jediným transportérem, zodpovědným za eflux Zn2+ z buněk. Chrání buňky před toxickými hladinami Zn2+. Vyskytuje se u mnoha druhů buněk a spolu s metalothioneiny hraje klíčovou roli v regulaci hladiny volného Zn2+ (21).
Přenašeč ZnT-2 zodpovídá za transport Zn2+ do endozomů (22). Velké množství mRNA tohoto přenašeče se nachází v laterálních a dorzálních lalocích prostaty, tedy v místech, kde epiteliální buňky akumulují velká množství zinku a produkují citrát. V těchto umístěních se nachází ve vezikulech a v lyzosomům podobných strukturách (23).
Metalothionein
Metalothioneiny náleží do rodiny metaloproteinů, které jsou široce rozšířeny v živočišné říši, nicméně podobné typy proteinů byly popsány i u bakterií, rostlin a hub. Metalothioneiny popsali poprvé Margoshes a Valee v roce 1957, kteří je izolovali z koňských ledvin (24). Existuje řada izoforem, ale strukturní rysy jsou v drtivé většině stejné. Jedná se o nízkomolekulární (6–10 kDa), na cysteiny bohaté proteiny, které neobsahují žádné aromatické aminokyseliny. Primární struktura je založena na repetici motivů, v nichž hlavní roli hraje aminokyselina cystein. Takto jsou vytvořena dvě rezidua, která vytváří cysteinové klastry. První z nich, β doména, má vazebné místo pro tři dvojmocné ionty kovů, a druhá αdoména potom až pro čtyři takové ionty. Celkově je tedy metalothionein schopen vázat až 7 dvojmocných nebo 12 jednomocných iontů (15).
Metalothionein se v organismech vyskytuje v několika izoformách:
- MT-1,
- MT-2,
- MT-3, a
- MT-4 (25).
Široce rozšířené jsou především izoformy MT-1 a MT-2, přičemž zastoupení formy MT-2 ve tkáních je častější. Forma MT-3 je nejhojněji exprimována v mozkové tkáni (26). Nejméně prozkoumanou formou je MT-4. Exprese genů ukazuje na její výskyt v šupinkovém epitelu (27). In vitro bylo prokázáno, že buňky mají schopnost sekrece forem MT-1 a MT-2 (28).
Metalothionein hraje klíčovou roli v transportu těžkých kovů (tedy také Zn2+), jejich detoxikaci a v ochraně buněk před oxidativním stresem (29). Při toxických hladinách těžkých kovů dochází k jejich navázání na metalothionein a k jejich transportu do ledvin, kde jsou vylučovány. Antioxidační působení podmiňují cysteinové aminokyseliny v molekule metalothioneinu (Obr. 3). Kromě toho metalothioneiny mohou s dalšími thiolovými sloučeninami, jako je redukovaný glutation (GSH), snižovat hladinu volných radikálů (30). A navíc bylo pozorováno, že se metalothionein objevuje v prostředí se zvýšeným rizikem tvorby volných radikálů, v místech se zvýšenou buněčnou proliferací a přiembryonálním vývoji (30).
3. Účinky metalothioneinu<br> Legenda: Volné radikály indukují expresi metalothioneinu (MT) (cestou MTF-1), který spolu s redukovaným glutationem (GSH) působí antioxidačně. Nenavázané kovy, zejména zinek a kadmium, zvyšují expresi MT, a ten je váže a snižuje tak jejich hladinu. 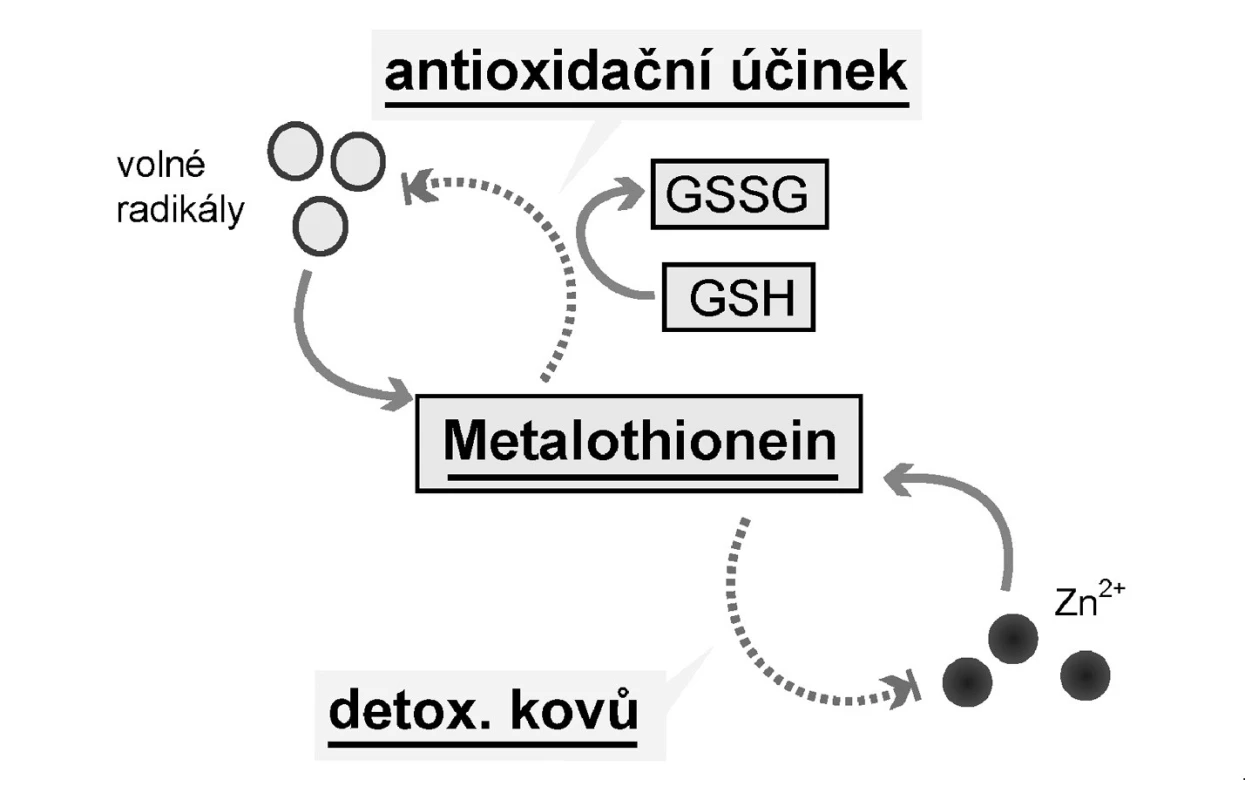
Řada nedávných studií poukazuje na zvýšené sérové hladiny metalothioneinu pacientů s karcinomem prostaty s velkou mírou specifity pro toto onemocnění. To staví metalothionein na pozici kandidáta nového markeru tohoto onemocnění (30–39).
Závěr
Zinek, významný esenciální prvek, je ve velkém množství akumulován prostatickými buňkami. V nich zasahuje do řady biochemických pochodů a ovlivňuje jejich chování prostřednictvím indukce apoptózy a regulace genové exprese a energetického metabolismu. Zn2+ také úzce souvisí s patogenezí karcinomu prostaty. Buňky karcinomu nemohou tyto ionty akumulovat, a nemohou se proto projevit fyziologické proapoptické mechanismy. Významnou měrou se na ztrátě schopnosti akumulovat Zn2+ podílí zinkové přenašeče, zejména přenašeč ZIP-1, jehož exprese je neznámými vlivy tlumena. Pochopení tohoto mechanismu, vedoucí k obnovení vysokých intracelulárních hladin Zn2+, má možná terapeutická uplatnění.
Alterovaný metabolismus Zn2+ se projevuje také změněnou sérovou hladinou Zn2+-vázajícího proteinu metalothioneinu. Metalothionein tak v budoucnu může být využit jako nový marker tohoto onemocnění stojící v diagnostickém algoritmu vedle současně široce používaného PSA.
Poděkování
Práce na tomto projektu byla podpořena projekty: Grantové Agentury Akademie věd ČR IAA401990701, Grantové agentury České republiky 301/09/P436, IGA MZ ČR č. 10200–3 a IGA VFU 9/2010/FaF.
Doc. Ing. René Kizek, Ph.D.
Laboratoř molekulární biochemie a bioelektrochemie, Ústav chemie a biochemie
Mendelova univerzita v Brně
Zemědělská 1
613 00 Brno
E-mail: kizek@sci.muni.cz
Sources
1. Giles, G. The epidemiology of prostate cancer. In: W.D. Foulkes and K.A. Cooney (Eds.). Male reproductive cancers epidemiology, pathology and genetics. New York, Dordrecht, Heidelberg, London: Springer Verlag, 2009.
2. ÚZIS. Novotvary 2007 ČR. Praha: Ústav zdravotnických informací a statistiky ČR ve spolupráci s Národním onkologickým registrem ČR, 2010.
3. Begin, L.R., Bismar, T.A. Prostate cancer: pathological perspective. In: W.D. Foulkes and K.A. Cooney (Eds.). Male reproductive cancers epidemiology, pathology and genetics. New York, Dordrecht, Heidelberg, London: Springer Verlag, 2009.
4. Medrano, A., Fernandez-Novell, J.M., Ramio, L. et al. Utilization of citrate and lactate through a lactate dehydrogenase and ATP-regulated pathway in boar spermatozoa. Mol. Reprod. Dev. 2006, 73, p. 369-378.
5. Franklin, R.B., Feng, P., Milon, B. et al. hZIP1 zinc uptake transporter down regulation and zinc depletion in prostate cancer. Mol. Cancer 2005, 4, p. 13.
6. Costello, L.C., Franklin, R.B. The clinical relevance of the metabolism of prostate cancer; zinc and tumor suppression: connecting the dots. Mol. Cancer 2006, 5, p. 13.
7. Franklin, R.B., Costello, L.C. The important role of the apoptotic effects of zinc in the development of cancers. J. Cell. Biochem. 2009, 106, p. 750-757.
8. Kambe, T., Yamaguchi-Iwai, Y., Sasaki, R. et al. Overview of mammalian zinc transporters. Cell. Mol. Life Sci. 2004, 61, p. 49-68.
9. Hogstrand, C., Kille, P., Nicholson, R.I. et al. Zinc transporters and cancer: a potential role for ZIP7 as a hub for tyrosine kinase activation. Trends Mol. Med. 2009, 15, p. 101-111.
10. Costello, L.C., Franklin, R.B. The intermediary metabolism of the prostate: A key to understanding the pathogenesis and progression of prostate malignancy. Oncology 2000, 59, p. 269-282.
11. Song, Y., Elias, V., Loban, A. et al. Marginal zinc deficiency increases oxidative DNA damage in the prostate after chronic exercise. Free Radic. Biol. Med. 2010, 48, p. 82-88.
12. Hambidge, M. Human zinc deficiency. J. Nutr. 2000, 130, p. 1344S-1349S.
13. Oteiza, P.I., Mackenzie, G.G. Zinc, oxidant-triggered cell signaling and human health. Mol. Asp. Med. 2005, 26, p. 245-255.
14. Laity, J.H., Andrews, G.K. Understanding the mechanisms of zinc-sensing by metal-response element binding transcription factor-1 (MTF-1). Arch. Biochem. Biophys. 2007, 463, p. 201-210.
15. Coyle, P., Philcox, J.C., Carey, L.C. et al. Metallothionein: The multipurpose protein. Cell. Mol. Life Sci. 2002, 59, p. 627-647.
16. Vallee, B.L., Falchuk, K.H. The biochemical basis of zinc physiology. Physiol. Rev. 1993, 73, p. 79-118.
17. Eide, D.J. Zinc transporters and the cellular trafficking of zinc. Biochim. Biophys. Acta-Mol. Cell Res. 2006, 1763, p. 711-722.
18. Gaither, L.A., Eide, D.J. Eukaryotic zinc transporters and their regulation. Biometals, 2001, 14, p. 251-270.
19. Costello, L.C., Liu, Y.Y., Zou, J. et al. Evidence for a zinc uptake transporter in human prostate cancer cells which is regulated by prolactin and testosterone. J. Biol. Chem. 1999, 274, p. 17499-17504.
20. Gitan, R.S., Eide, D.J. Zinc-regulated ubiquitin conjugation signals endocytosis of the yeast ZRT1 zinc transporter. Biochem. J. 2000, 346, p. 329-336.
21. Urani, C., Melchioretto, P., Gribaldo, L. Regulation of metallothioneins and ZnT-1 transporter expression in human hepatoma cells HepG2 exposed to zinc and cadmium. Toxicol. Vitro. 2010, 24, p. 370-374.
22. Kobayashi, T., Beuchat, M.H., Lindsay, M. et al. Late endosomal membranes rich in lysobisphosphatidic acid regulate cholesterol transport. Nat. Cell Biol. 1999, 1, p. 113-118.
23. Sorensen, M.B., Stoltenberg, M., Juhl, S. et al. Ultrastructural localization of zinc ions in the rat prostate: An autometallographic study. Prostate 1997, 31, p. 125-130.
24. Margoshes, M., Vallee, B.L. A cadmium protein from equine kidney cortex. J. Am. Chem. Soc. 1957, 79, p. 4813-4814.
25. Miles, A.T., Hawksworth, G.M., Beattie, J.H. et al. Induction, regulation, degradation, and biological significance of mammalian metallothioneins. Crit. Rev. Biochem. Mol. Biol. 2000, 35, p. 35-70.
26. Masters, B.A., Quaife, C.J., Erickson, J.C. et al. Metallothionein-Iii is expressed in neurons that sequester zinc in synaptic vesicles. J. Neurosci. 1994, 14, p. 5844-5857.
27. Quaife, C.J., Findley, S.D., Erickson, J.C. et al. Induction of a new metallothionein isoform (Mt-Iv) occurs during differentiation of stratified squamous epithelia. Biochemistry 1994, 33, p. 7250-7259.
28. Trayhurn, P., Duncan, J.S., Wood, A.M. et al. Metallothionein gene expression and secretion in white adipose tissue. Am. J. Physiol.-Regul. Integr. Comp. Physiol. 2000, 279, p. R2329-R2335.
29. Eckschlager, T., Adam, V., Hrabeta, J. et al. Metallothioneins and Cancer. Curr. Protein Pept. Sci. 2009, 10, p. 360-375.
30. Krizkova, S., Fabrik, I., Adam, V. et al. Metallothionein - a promising tool for cancer diagnostics. Bratisl. Med. J. 2009, 110, p. 93-97.
31. Krizkova, S., Blahova, P., Nakielna, J. et al. Comparison of metallothionein detection by using Brdicka reaction and enzyme-linked immunosorbent assay employing chicken yolk antibodies. Electroanalysis 2009, 21, p. 2575-2583.
32. Adam, V., Blastik, O., Krizkova, S. et al. Application of the Brdicka reaction in determination of metallothionein in patients with tumours. Chem. Listy, 2008, 102, p. 51-58.
33. Adam, V., Fabrik, I., Kizek, R. et al. Vertebrate metallothioneins as target molecules for analytical techniques. Trac-Trends Anal. Chem. 2010, 29, p. 409-418.
34. Blastik, O., Hubalek, J., Adam, V. et al. Electrochemical sensor for determination of metallothionein as biomarker. Proceedings of IEEE Sensors, Daegu, 2006, p. 1171-1174.
35. Fabrik, I., Adam, V., Krizkova, S. et al. Level of heat-stable thiols in patients with a malignant tumor. Klin. Onkol. 2007, 20, p. 384-389.
36. Fabrik, I., Kukacka, J., Adam, V. et al. Metallothionein and its relation to anticancer treatment by platinum complexes. Prakt. Lek. 2008, 88, p. 90-93.
37. Horakova, Z., Thova, E., Salzman, R. et al. Importace of elevation of metallothionein blood levels in patients with head and neck tumors - Part 2. Otorinolaryng. Foniatrie 2008, 57, p. 90-97.
38. Petrlova, J., Blastik, O., Prusa, R. et al. Determination of metallothionein content in patients with breast cancer, colon cancer, and malignant melanoma. Klin. Onkol. 2006, 19, p. 138-142.
39. Petrlova, J., Blastik, O., Prusa, R. et al. Using of electrochemical methods for studying of metallothionein content in the human blood serum of a patient poisoned by lead and treated by platinum. Biomed. Pap. Med. Fac. Univ. Palacky, Olomouc, Czechoslovakia. 2005, 149, p. 485-488.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2010 Issue 8-
All articles in this issue
- Human biomonitoring – its importance and application for evaluating population exposure to environmental chemicals (toxins)
- Arrhythmias in patients with metabolic syndrome and critical limb ischemia
- Relapse prevention treatment of addictive diseases
- Spontaneous intracranial hypotension
- Pancreatic cancer: Molecular biology and early detection
- Has the time come for more personalised medicine in psychiatry?
-
Evolution and evolutionary theory for physicians.
VIII. Evolution of the human brain - Zinc and its relation to prostate tumours
-
How can be quality of care successfully measured:
an example of good practice from Denmark - Family caregivers of patients with dementia
- Physical activity as a part of cardiovascular disease prevention in the general practitioner’s surgery
- Occurrence of symptoms and risk factors for obstructive sleep apnea in patients examined for cardiac arrhythmias through Holter ECG monitoring
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spontaneous intracranial hypotension
- Zinc and its relation to prostate tumours
- Human biomonitoring – its importance and application for evaluating population exposure to environmental chemicals (toxins)
- Physical activity as a part of cardiovascular disease prevention in the general practitioner’s surgery
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

