-
Medical journals
- Career
Acellulární porcinní dermis v lokální léčbě syndromu diabetické nohy
Authors: M. Dubský 1; A. Jirkovská 1; R. Bém 1; B. Sixta 2; V. Fejfarová 1; L. Řezaninová 1; E. Matoušková 3; J. Skibová 4
Authors‘ workplace: Centrum diabetologie IKEM, Praha Přednostka: prof. MUDr. Terezie Pelikánová, DrSc. 1; Klinika transplantační chirurgie IKEM, Praha Přednosta: prof. MUDr. Miloš Adamec, CSc. 2; Klinika popáleninové medicíny, 3. LF UK a FNKV Přednosta: doc. MUDr. Leo Klein, CSc. 3; Oddělení statistiky IKEM 4
Published in: Prakt. Lék. 2010; 90(6): 342-348
Category: Of different specialties
Overview
Syndrom diabetické nohy patří k nejčastějším a nejzávažnějším komplikacím diabetu. Vzhledem k multifaktoriální etiologii je však terapie chronických defektů u diabetiků velmi obtížná. U nehojících se defektů bez osteomyelitidy a bez kritické ischemie je možné využít acellulární porcinní dermis pro urychlení hojení rány. Hlavní výhodou acellulární porcinní dermis je dlouhodobá skladovatelnost v sušeném stavu a velmi dobrá dostupnost. V naší pilotní studii provedené na 14 pacientech jsme zjistili, že tato léčba je u pacientů s povrchovějšími ulceracemi bez známek infekce účinnější než terapie xenotransplantáty a je vhodnou alternativou použití moderních umělých kožních náhrad. Nebyly pozorovány žádné závažné nežádoucí účinky této léčby.
Klíčová slova:
syndrom diabetické nohy, hojení ran, kožní deriváty, xenotransplantát.Úvod
Syndrom diabetické nohy (SDN) je definován jako ulcerace nebo postižení hlubokých tkání nohy distálně od kotníku, včetně kotníku, se současnou neuropatií a různým stupněm ischemie (10). Vedle ulcerací jde nejčastěji o gangrény, ale také o postižení kostí osteomyelitidou nebo Charcotovou osteoartropatií nebo o postižení měkkých tkání infekcí (7). Vzhledem k přítomnosti diabetické neuropatie, ischemie a infekce je hojení diabetických ulcerací velmi komplikované a při hlubších defektech nezřídka končí amputací. Současný výběr prostředků lokální terapie SDN je poměrně široký, efektivita léčby je však v řadě případů sporná (5).
V léčbě povrchových chronických defektů dolních končetin se osvědčilo použití různých druhů kožních štěpů. Autologní kůže pacienta (přenesený kožní štěp) není vždy optimálním typem kožního krytí u pacientů s diabetem, protože diabetické ulcerace jsou často lokalizovány plantárně, kde jsou přenesené štěpy např. z oblasti stehna vystaveny tlakovému zatížení. Autologní kožní štěp z nezatěžované oblasti není na plantární tlak adaptován a dochází k morfologickým změnám, hyperkeratózám, tvorbě keratomů a riziku malignizace.
Jinou možností terapie chronických ulcerací je allogenní kožní štěp. Účinnost těchto krytí jsme ověřili pilotní studií, provedenou v Centru diabetologie IKEM (4). Kadaverózní allotransplantáty vykazovaly pozitivní efekt na hojení diabetických ulcerací ve srovnání s xenotransplantáty, jejich dostupnost je však omezená a lze je obtížně skladovat.
V podiatrické ambulanci Centra diabetologie IKEM jsme po dobu několika let využívali ke krytí povrchovějších defektů také xenotransplantáty (XENO) (13). Zdrojem xenotransplantátů (dočasné náhrady kůže) jsou čerstvé, nespařené, veterinárně kontrolované jateční krupony, tj. hřbetní části kůže prasat zasahující na boky. Z nich jsou po přípravě odebrány za sterilních podmínek jemné dermo-epidermální štěpy o síle 0,2–0,3 mm a o rozměrech zhruba 30 x 7 cm. Tyto štěpy nemohou být vzhledem k mikrobiálnímu osídlení kůže běžného jatečního zvířete použity přímo ke krytí kožních defektů, proto po odběru projdou laváží chemoterapeutik a antibiotik. Poté je sterilita štěpů testována v mikrobiologické laboratoři a teprve na základě negativního výsledku mohou být použity k léčbě pacientů.
Velmi efektivní v léčbě SDN jsou umělé kožní deriváty. Jedná se o biomateriály s navázanými růstovými faktory, živými buňkami nebo genovými produkty (3). Dvojvrstevné kožní náhrady (bi-layered bioengineered skin substitues – BBSS) se skládají z epidermální vrstvy tvořené lidskými keratinocyty, z dermální vrstvy tvořené lidskými fibroblasty a z matrix, kterou bývá např. bovinní kolagen typu I. Podle jedné z publikovaných metaanalýz (2) byla léčba BBSS ve srovnání s kontrolní léčbou (sterilní gáza s fyziologickýžm roztokem) účinnější v terapii chronických nehojících se defektů, nebyly pozorovány žádné závažné nežádoucí účinky této terapie a ve srovnání s kontrolní skupinou byl nižší výskyt osteomyelitidy a amputací.
Za hlavní nevýhodu těchto moderních kožních derivátů je považována vysoká cena a velmi omezená dostupnost v Evropě. Jednou z vhodných alternativ v této indikaci je acellulární porcinní dermis (APD).
APD je získána enzymatickou degradací epidermis a dermálních buněk, poté je vysušena a sterilizována jak zářením, tak chemicky. Původně byla APD vyvinuta jako podklad pro kultivaci lidských keratinocytů. Bezbuněčná dermis je připravována z pruhů prasečí kůže o síle 0,3–0,5 mm odebíraných z jatečních zvířat v kožní bance. Je dodávána a skladována v sušeném stavu. APD je indikována jako dočasné krytí povrchových a hlubokých dermálních popálenin, nekrektomovaných ploch a odběrových ploch po odběru kožních štěpů (16). Ve spojení s allogenními kultivovanými keratinocyty se jedná o velmi účinnou léčbu povrchovějších popálelnin (9).
Cílem naší práce bylo porovnat efekt acellulární porcinní dermis na hojení ulcerací s porcinními xenotransplantáty a posoudit její případné nežádoucí účinky.
Metodika
Studie byla uspořádána jako kontrolovaná, nerandomizovaná. Byli do ní zařazeni pacienti se syndromem diabetické nohy z podiatrické ambulance Centra diabetologie IKEM léčení v letech 2005–2008 pro chronické, alespoň 2 měsíce se nehojící defekty dolních končetin (dle mezinárodní Texaské klasifikace (1) stupně IA, IIA, IC, IIC). Vyloučeni byli pacienti s klinickými známkami těžké infekce (silně povleklá spodina defektu, sekrece hnisu z rány, flegmóna), pacienti s osteomyelitidou (stanovenou dle RTG snímku) a prokázanou těžkou ischemií (index kotník paže < 0,6 nebo měření transkutánní tenze kyslíku < 25 mm Hg). Pacienti s pozitivním kultivačním nálezem stěru z rány, ale bez klinických známek infekce, byli zařazeni. Všichni pacienti podepsali informovaný souhlas se studií, která byla schválena lokální etickou komisí.
Soubor pacientů
Vstupní charakteristiky souboru pacientů ukazuje tabulka 1.
Table 1. Charakteristika pacientů 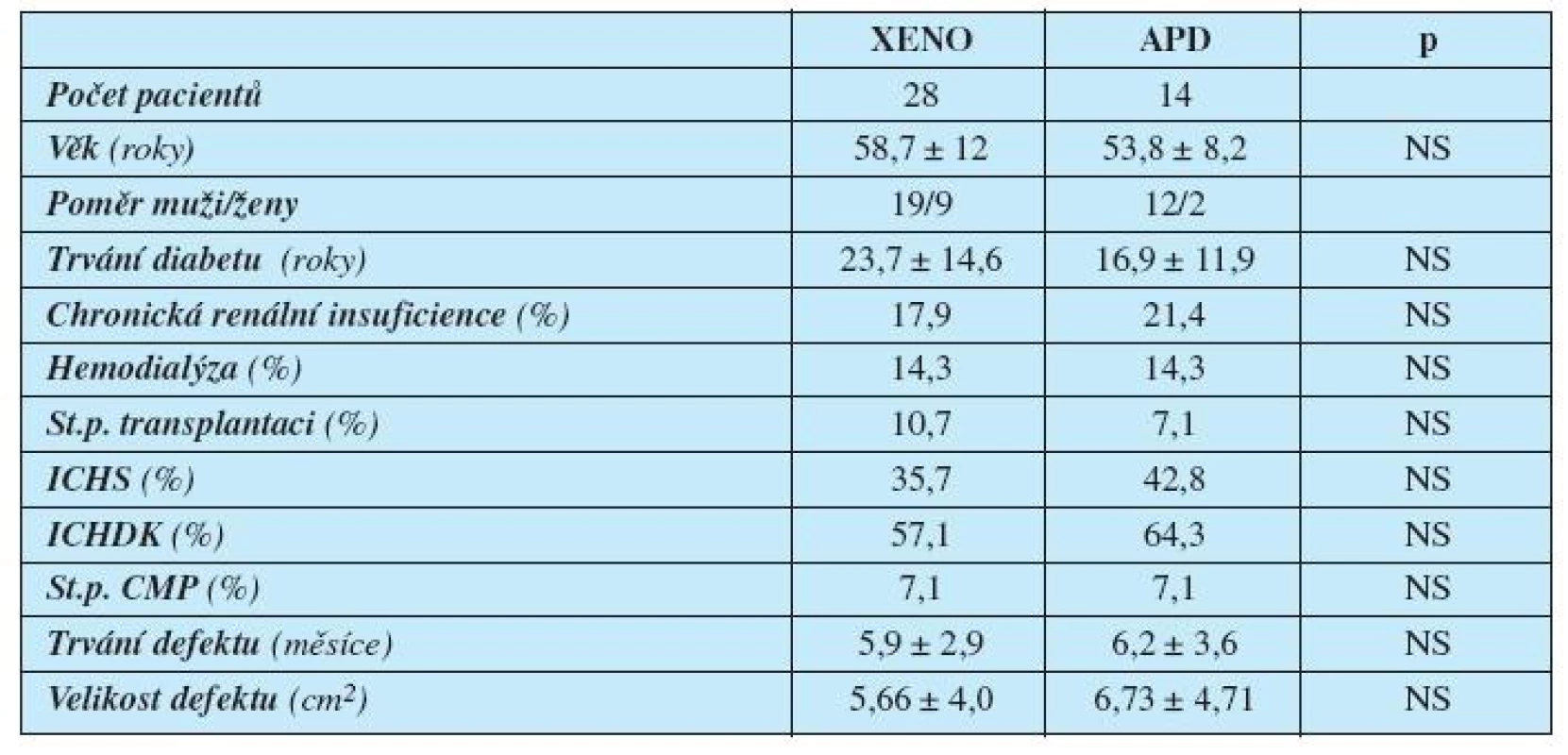
Legenda: XENO = xenotransplantát APD = acellulární porcinní dermis ICHS = ischemická choroba srdeční ICHDK = ischemická choroba dolních končetin CMP = cévní mozková příhoda p = hladina statistické významnosti Skupinu zkoumanou (léčenou APD) tvořilo 14 pacientů se syndromem diabetické nohy. APD (Xe-Derma, Bioskin a.s., Praha, Česká republika) byla před použitím jemně meshována pomocí skalpelu a chirurgické pinzety, vložena do fyziologického roztoku a následně sterilně aplikována na ránu v rozsahu mírně přesahujícím okraje rány (obrázek 1). Vzhledem k tomu, že APD samotná nemá žádnou antibakteriální aktivitu, vždy jsme ji překrývali mastným tylem s chlorhexidinem (Bactigras, Smith & Nephew, Anglie).
Image 1. Postup aplikace APD na ránu 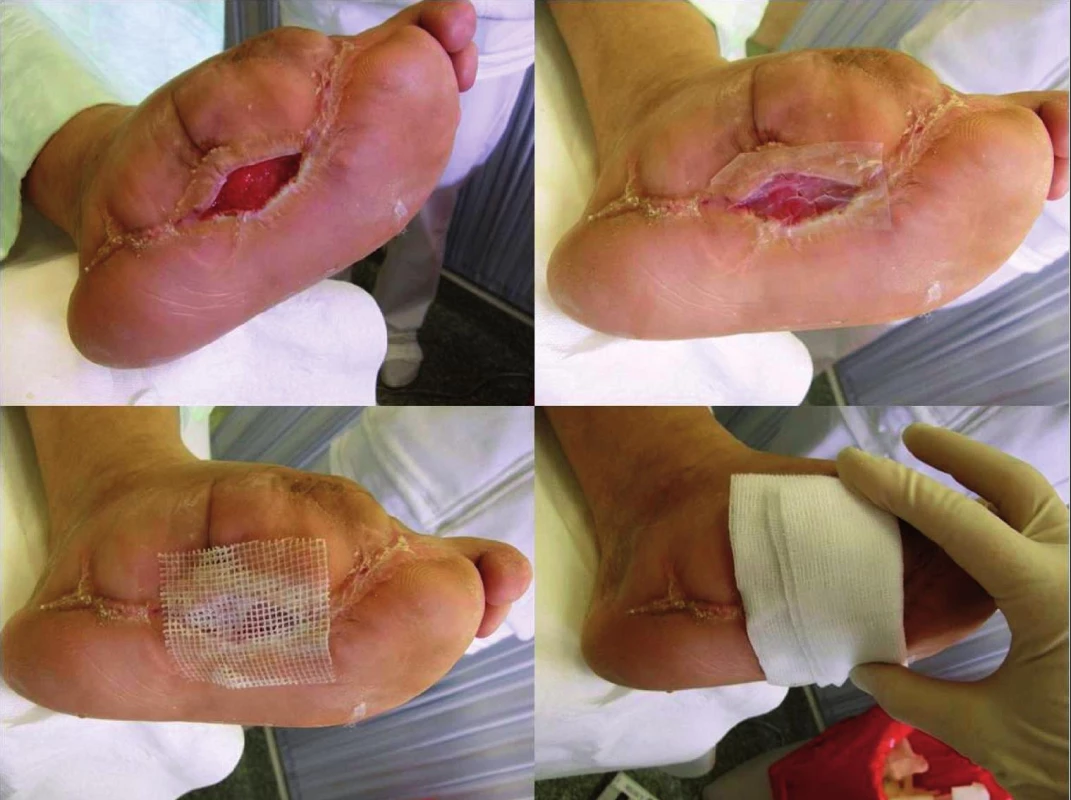
a – rána po fiádném debridementu, b – APD aplikována na ráně, c – APD překryta mastným tylem s chlorhexidinem, d – vnější krytí gázou. Do kontrolní skupiny (léčené XENO) bylo zahrnuto 28 pacientů se syndromem diabetické nohy (viz. tab. 1). XENO použité v této studii byly vepřové kožní štěpy dodávány kožní bankou, které byly postupně převedeny do 85% glycerolu, ve kterém jsou též při teplotě 4°C uloženy (chlazené jsou dlouhodobě použitelné, mohou být skladovány až 5 let). Přímo před jejich použitím byly vyprány v teplém fyziologickém roztoku po dobu 15 minut a mohou být ihned přiloženy na rannou plochu (zbytky glycerolu v tkáni působí v průběhu hojení defektu antimikrobiálně a nejsou na závadu).
XENO i APD jsme aplikovali na ránu až do výrazného zlepšení granulací a epitelizaci rány posouzené zkušenou podiatrickou sestrou neangažovanou v hodnocení preparátů. Délka terapie kožními náhradami byla u obou skupin srovnatelná (u zkoumané skupiny 40,07±13,92 dnů oproti 34,81±16,80 dní u skupiny kontrolní), rozdíl nebyl statisticky signifikantní. Sledovaným parametrem účinnosti léčby byla změna plochy defektu při ukončení aplikace XENO či APD. Aplikace byla přerušena při zhoršení lokálního nálezu na noze, zejména při progresi infekce. Dále byly u obou skupin hodnoceny kultivační nálezy a případné nežádoucí účinky.
Všichni pacienti byli současně léčeni standardním odlehčením ulcerací (byli vybaveni buď terapeutickou obuví a podpažními berlemi, nebo pojízdným vozíkem) a dále komplexně léčeni v podiatrické ambulanci. V indikovaných případech pacienti užívali antibiotika a ischemie končetin byla léčena adekvátní revaskularizací (nejčastěji perkutánní transluminální angioplastikou).
Výsledky
Mezi oběma skupinami nebyl signifikantní rozdíl v délce trvání diabetu, přítomných komorbiditách (ICHS, ICHDK, dialýza, st.p. transplantaci, st.p. CMP), délce trvání defektu, ani vstupní velikosti defektu (viz tab. 1).
Ve zkoumané skupině léčené APD došlo k redukci plochy ulcerace z 5,66 ± 4,0 na 0,34 ± 0,47 cm2 (p = 0,0001), v kontrolní skupině léčené XENO došlo k redukci plochy z 6,73 ± 4,71 na 3,39 ± 2,85 cm2 (p = 0,06); (graf 1).
Graph 1. Redukce plochy defektů 
Legenda: XENO = xenotransplantát APD = acellulární porcinní dermis Medián redukce plochy ulcerace byl větší ve zkoumané skupině oproti skupině kontrolní (96,3 [27; 100] % vs. 48,5 [-33,3; 97,5] %, p < 0,001). Rychlost redukce plochy za týden byla v obou skupinách srovnatelná (ve zkoumané skupině 16,49 ± 7,49 %; v kontrolní skupině 12,37 ± 8,92 % (p = 0,137; NS); (obrázek 2).
Image 2. Hojení chronického defektu po aplikaci APD 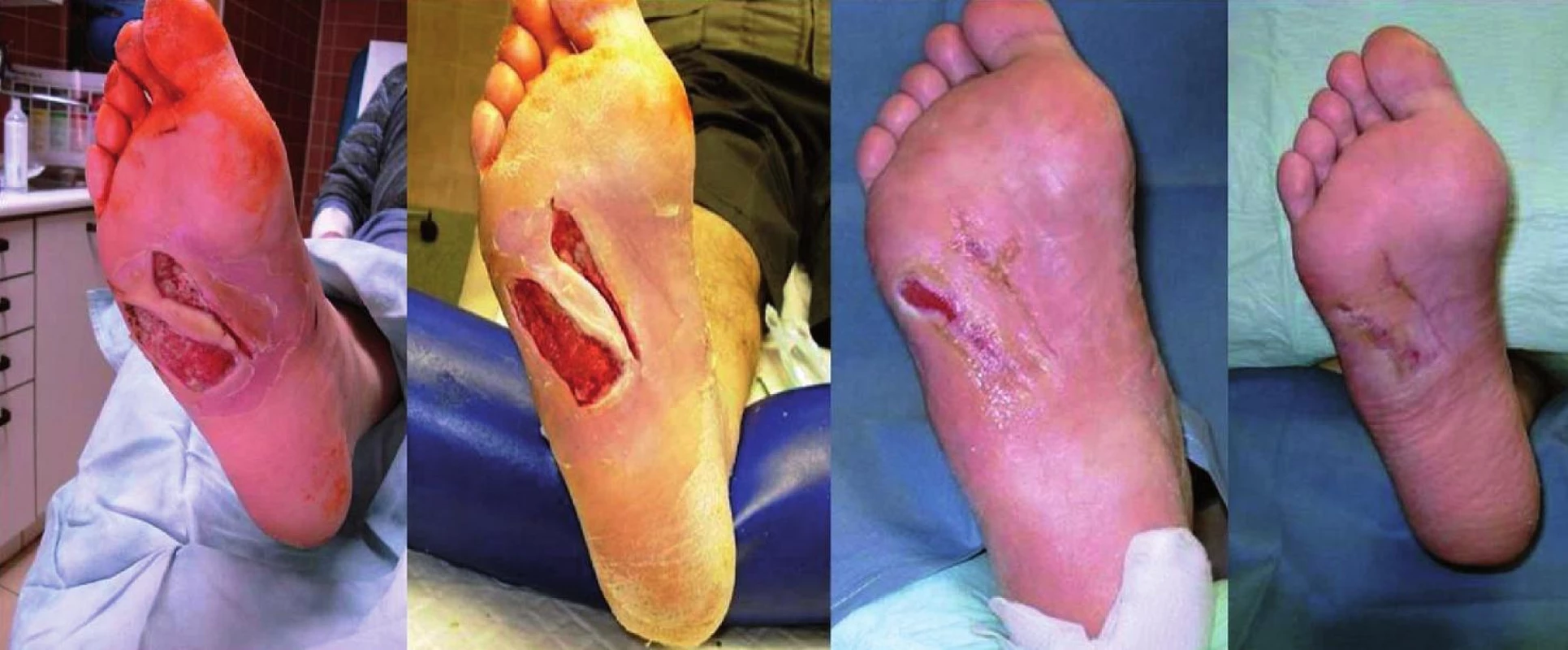
a – před aplikací, b – 7 dní po aplikaci, c – 26 dní po aplikaci, d – 48 dní po aplikaci. Kultivační nálezy před aplikací a po skončení aplikace byly bez významného rozdílu: 14,3 % pacientů ze zkoumané skupiny a 6,2 % pacientů z kontrolní skupiny vykazovalo pozitivní kultivační nález meticillin-oxacillin rezistentní staphylococcus aureus (MRSA), rozdíl nebyl statisticky signifikantní.
Z hlediska nežádoucích účinků byly ve zkoumané skupině ve 2 případech pozorovány mírné hypergranulace, u 2 pacientů z kontrolní skupiny musely být xenotransplantáty předčasně odstraněny – pro progresi lokálního nálezu na dolní končetině.
Diskuse
Dle našich výsledků byla léčba APD účinnější než léčba xenotransplantáty při léčbě povrchovějších defektů dolních končetin u pacientů se syndromem diabetické nohy.
V léčbě nehojících se defektů se mohou uplatňovat různé typy xenogenních kožních krytů. Kožní náhrada vyrobená ze submukózy prasečího tenkého střeva (SPTS; Oasis Wound Matrix) byla s úspěchem použita v randomizované studii k terapii bércových vředů u obézních pacientů (11). Ze 120 pacientů zařazených do této studie bylo po 12 týdnech zhojeno 55 % pacientů v intervenované skupině oproti 34 % pacientů ve skupině kontrolní léčené gázou a kompresivní terapií (p < 0,014).
Jiná randomizovaná studie provedená na 73 pacientech (12) porovnávala efekt léčby SPTS s terapií pomocí gelu obohaceného o destičkový růstový faktor (PDGF). Po 12 týdnech bylo dosaženo kompletního zhojení u 49 % pacientů léčených SPTS oproti 10 % pacientů léčených PDGF (p = 0,055).
Terapie nejen xenogenní decelularizovanou dermis je v poslední době často využívána k léčbě defektů různé etiologie. Multicentrická studie zabývající se terapií lidskou acelulární dermální matrix (14) provedená u 75 diabetiků prokázala plnou epitelizaci u 91 % defektů po 7 týdnech od začátku terapie. Indikováni byli i pacienti s hlubšími defekty penetrujícími ke kloubnímu pouzdru (Texas IIIB-D) a nebyl prokázán signifikantní rozdíl mezi jednotlivými stupni Texaské klasifikace.
V současnosti existuje několik variant uměle vyrobených kožních náhrad. Jednou z prvních byla kožní náhrada obsahující kultivované keratinocyty v polyglactinu (tzv. Dermagraft). Po dvoutýdenní kultivaci produkují tyto buňky při kontaktu s ránou růstové faktory, cytokiny a proteiny extracellulární matrix a podporují formování nové epidermis (6). V této studii bylo po terapii Dermagraftem prokázáno signifikantně rychlejší dosažení 50% redukce plochy defektu ve srovnání s kontrolní léčbou gázou s fyziologickým roztokem (p = 0,03).
Jiná randomizovaná kontrolovaná studie na 314 pacientech prokázala vyšší procento (30 vs. 18,3 %) zhojených ulcerací a signifikantně kratší dobu terapie (p = 0,023) u pacientů léčených Dermagraftem oproti kontrolní skupině (gáza) (8). Multicentrická randomizovaná studie (15) na 208 pacientech prokázala účinnější a rychlejší hojení při použití jiného typu BBSS – Graftskinu ve srovnání s kontrolní skupinou. Indikováni byli pacienti s povrchovějšími ulceracemi (Wagner 1 a 2) bez známek ischemie a infekce. Po 12 týdnech došlo ke zhojení 56 % pacientů léčených Gratskinem oproti 36 % pacientů léčených kompresivní terapií (p = 0,0042).
Mezi hlavní výhody APD patří dobrá dostupnost, skladovatelnost v sušeném stavu a úhrada zdravotními pojišťovnami. Výhledově je také nadějným materiálem, který by mohl sloužit jako podklad pro kultivované keratinocyty nebo autologní kmenové buňky (v současnosti je možno použít i přímo meshovaný typ APD).
Xenotransplantáty nejsou v současnosti dále využívány nejen z důvodu zpřísnění norem Evropské komise pro využití xenogenních materiálů v humánní medicíně, ale také pro jejich horší dostupnost při soustředění výroby do několika málo kožních bank.
Hlavní limitací naší studie je malý soubor pacientů shrnující pilotní zkušenosti s tímto novým kožním krytím a sledování pacientů po dobu aplikace krytí a ne až do úplného zhojení. Studie nebyla randomizovaná, byla pouze kontrolovaná s aktivním komparátorem.
Compliance pacienta je dalším z významných faktorů, který podle našich zkušeností i dle publikovaných studií ovlivnil hojení defektů na dolních končetinách.
Závěr
Výsledky naší studie ukázaly, že acellulární porcinní dermis je u vhodných typů ran u pacientů se SDN účinná metoda lokální léčby, která je levnější a dostupnější než léčba specielními bioinženýrsky kultivovanými kožními deriváty. Redukce velikosti ulcerací při léčbě APD byla v naší studii větší než při léčbě xenotransplantáty. Verifikace těchto výsledků však vyžaduje větší randomizované studie.
MUDr. Michal Dubský
Centrum diabetologie IKEM
Vídeňská 1958/9
14021 Praha 4 - Krč
E-mail: michal.dubsky@gmail.com
Sources
1. Armstrong, D.G., Lavery, L.A., Harkless, L.B. Validation of a diabetic wound classification system. The contribution of depth, infection, and ischemia to risk of amputation. Diabetes Care 1998, 21(5), p. 855-859.
2. Bello, Y.M., Falabella, A.F., Eaglstein, W.H. Tissue-engineered skin: current status in wound healing. Am. J. Clin. Dermatol. 2001, 2(5), p. 305-313.
3. Dini, V., Romanelli, M., Piaggesi, A. et al. Cutaneous tissue engineering and lower extremity wounds (part 2). Int. J. Low Extrem Wounds 2006, 5(1), p. 27-34.
4. Dubský, M., Jirkovská, A., Bém, R. et al. Use of allogenic dermoepidermal grafts can accelerate healing of diabetic foot disease (Abstract). EWMA Journal 2008, 8 (Suppl.), p. 59.
5. Eldor, R., Raz, I., Ben Yehuda, A. et al. New and experimental approaches to treatment of diabetic foot ulcers: a comprehensive review of emerging treatment strategies. Diabet. Med. 2004, 21(11), p. 1161-1173.
6. Gentzkow, G.D., Iwasaki, S.D., Hershon, K.S. et al. Use of Dermagraft, a cultured human dermis, to treat diabetic foot ulcers. Diabetes Care 1996, 19, p. 350–354.
7. Jirkovská, A. Syndrom diabetické nohy – základní informace, In: Syndrom diabetické nohy, Ed: Jirkovská A. Praha: Maxdorf, 2006, s. 22 – 35.
8. Marston, W.A., Hanft, J. Norwood, P. et al. The efficacy and safety of Dermagraft in improving the healing of chronic diabetic foot ulcers: results of a prospective randomized trial. Diabetes Care 2003, 26, p. 1701-1705.
9. Matoušková, E., Brož, L., Pokorná, E. et al. Prevention of burn wound conversion by allogeneic keratinocytes cultured on acellular xenodermis. Cell Tissue Bank 2002, 3(1), p. 29-35.
10. Mezinárodní pracovní skupina pro syndrom diabetické nohy. Syndrom diabetické nohy. Mezinárodní konsensus. Amsterdam, 1999. České vydání: Ed. Jirkovská A. Praha: Galén, 2000.
11. Mostow, E.N., Haraway, G.D., Dalsing, M. et al. Effectiveness of an extracellular matrix graft (OASIS Wound Matrix) in the treatment of chronic leg ulcers: a randomized clinical trial. J. Vasc. Surg. 2005, 41(5), p. 837-843.
12. Niezgoda, J.A., Van Gils, C.C., Frykberg, R.G. et al. Randomized clinical trial comparing OASIS Wound Matrix to Regranex Gel for diabetic ulcers. Adv. Skin Wound Care 2005, 18(5), p. 258-266.
13. Sixta, B., Herdegen, P., Bém, R. et al. Zkušenosti s xenotransplantáty při hojení diabetické nohy. Chirurgie HPB 2003, 11(1), s. 37-38.
14. Veves, A., Falanga, V., Armstrong, D.G. et al. Graftskin, a Human Skin Equivalent, Is Effective in the Management of Noninfected Neuropathic Diabetic Foot Ulcers. Diabetes Care 2001, 24, p. 290-295.
15. Winters, C.L., Brigido, S.A., Liden, B.A. et al. A multicenter study involving the use of a human acellular dermal regenerative tissue matrix for the treatment of diabetic lower extremity wounds. Adv. Skin Wound Care 2008, 21(8), p. 375-381.
16. Zajíček, R., Brož, L., Klein, L. a kol. Xe-Derma: nový biologický kryt pro léčbu akutních a chronických ran. Hojení ran 2008, 2(2), s. 18-27.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2010 Issue 6-
All articles in this issue
-
Evoluce a evoluční teorie pro lékaře
VI. Evo-devo
(evoluční vývojová biologie) - Etiológia a nová klinicko-etiologicko-anatomicko-patofyziologická (CEAP) klasifikácia končatinovocievnej ischemickej choroby
- Acellulární porcinní dermis v lokální léčbě syndromu diabetické nohy
- Kouření a diabetes mellitus 2. typu
- Cizinci a bezdomovci – nové epidemiologické a sociologické faktory v kontrole tuberkulózy v Praze
- Mezi objektivním a subjektivním, stres pacienta, psychosomatika
- Hazardní hry a pracovní prostředí
- Supervize jako prevence syndromu vyhoření u zdravotníků
- Nežádoucí účinky nesteroidních antiflogistik
- Aktivace procesů změny u mladistvých kuřáků
-
Evoluce a evoluční teorie pro lékaře
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nežádoucí účinky nesteroidních antiflogistik
- Mezi objektivním a subjektivním, stres pacienta, psychosomatika
- Supervize jako prevence syndromu vyhoření u zdravotníků
- Etiológia a nová klinicko-etiologicko-anatomicko-patofyziologická (CEAP) klasifikácia končatinovocievnej ischemickej choroby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

