-
Medical journals
- Career
Účinná hemostáza při bezkrevních chirurgických operacích
Authors: J. Slipac
Authors‘ workplace: Předseda: doc. MUDr. Ivan Čundrle, CSc. ; Česká společnost bezkrevní medicíny, Brno
Published in: Prakt. Lék. 2010; 90(5): 286-290
Category: Various Specialization
Overview
Při chirurgické léčbě pacientů různého stupně naléhavosti došlo k pokroku v stavění krvácení, prováděném hemostatickými chirurgickými přípravky, prostředky a technikami. Hemostatické přípravky pro celkové a lokální podání se používají při obou typech operací, otevřených i minimálně invazivních. V článku jsou stručně popsány mechanismy hemokoagulace a možnosti léčby krvácení při chirurgických zákrocích.
Klíčová slova:
hemostáza, hemostatické přípravky pro celkové podání, lokální hemostatické přípravky.Úvod
Hemostáza je odpověď organismu na poranění cévy, která vede k uzavření defektu v cévě krevní sraženinou a ochraňuje před krevní ztrátou. Vznik krevní sraženiny je komplikovaný proces vzájemných interakcí, kdy na sebe působí řada složek krve v tzv. koagulační kaskádě. Procesu krevního srážení se účastní hlavně krevní destičky a bílkoviny krevní plazmy (koagulační faktory), ale i další látky a enzymy obsažené např. v cévní stěně.
Po poranění cévy dojde nejprve k vazokonstrikci – reakci svalů obsažených v cévní stěně, které průsvit cévy zmenší a sníží tak průtok poraněnou cévou. Do procesu pak vstoupí krevní destičky, které se v místě poranění shluknou, vzájemně k sobě i k cévní stěně přilnou, změní tvar a uvolní další látky, které spustí další děje. Tak je vytvořena tzv. primární zátka. V další fázi se primární zátka „utěsní“ a zpevní bílkovinou sítí, která je výsledkem vzájemné interakce řady koagulačních faktorů. Takové krevní sraženině pak říkáme definitivní zátka.
Zdravý organismus dovede složitými vzájemnými vazbami mezi jednotlivými procesy účinně regulovat míru jednotlivých procesů tak, aby nedošlo k nadbytečné aktivaci srážení a ohrožení vznikem nežádoucích sraženin a zároveň k maximální možné zástavě krvácení. Jakýkoli zásah do rovnováhy těchto procesů se pak může projevit krvácením nebo zvýšenou srážlivostí krve (2, 15).
Hemostatická reakce
Hemostatická reakce má tři části:
- Vazokonstrikci
- Agregaci destiček
- Aktivaci koagulační kaskády
Vazokonstrikce
- Objevuje se jako přímý důsledek poškození cév.
- Je posílena vazokonstrikčními činiteli uvolněnými z destiček.
- Reflexní sympatickou vazokonstrikci může vyvolat také bolest
Agregace destiček
- Krevní destičky jsou tvořeny v kostní dřeni z megakaryocytů.
- Obsahují kontraktilní proteiny aktin a myosin.
- Neobsahují jádra, ale endoplasmatické retikulum a Golgiho aparát, ve kterém se tvoří proteiny.
- Obsahují mitochondrie, které produkují ATP a ADP.
- Mohou také syntetizovat prostaglandiny a tromboxan A2.
- Poločas života v krvi je 8–12 dní.
- V reakci na poranění tkáně procházejí destičky několika změnami.
- Agregace destiček vede k vytvoření zátky z destiček, která uzavírá malá poranění.
- Destičky se přilepují k poškozenému endotelu (prostřednictvím von Willebrandova faktoru).
- Destičky při agregaci uvolňují kyselinu arachidonovou, která se přeměňuje na tromboxan A2.
- Kalciem zprostředkovaná kontrakce aktinu a myosinu vede ke degranulaci.
- Uvolnění ADP, které může indukovat další agregaci a uvolňování v pozitivní zpětné vazbě.
Aktivace koagulační kaskády
- Koagulační kaskáda má dvě částečně nezávislé cesty.
- Vnitřní cesta má všechny komponenty v krvi.
- Zevní cesta je spuštěna poraněním extravaskulárních tkání.
- Tato cesta je aktivována uvolněním tkáňového faktoru.
- Obě cesty vedou k aktivaci protrombinu (faktor II) na trombin
- Trombin se podílí na přeměně fibrinogenu na fibrin monomery, které polymerizují na stabilní fibrin polymer.
- Vnitřní cesta je relativně pomalá (2–6 minut).
- Zevní cesta je dost rychlá (15 sekund).
Přehled hemostatických přípravků, nástrojů a zařízení
Při chirurgické léčbě pacientů různého stupně naléhavosti došlo k pokroku v chirurgických postupech, prováděných hemostatickými chirurgickými prostředky a technikami. Používají se při obou typech operací, otevřené i minimálně invazivní. Hemostatické nástroje snižují krvácení, ulehčují průtok krve cévami zmenšením tlaku okolních tkání, umožňují lepší viditelnost a přístup v operačním poli. Na dosažení a udržení efektivní hemostázy mají významný vliv praktické zkušenosti a preciznost práce chirurga (4, 17). Následuje přehled hemostatických preparátů, prostředků a vybavení (tab. 1 a 2).
Table 1. Hemostatické přípravky 
Table 2. Hemostatické nástroje a zařízení 
Hemostatické přípravky pro celkové podání
Kyselina aminokapronová
Kyselina aminokapronová zpomaluje nebo zastavuje fibrinolýzu. Během syntézy fibrinu se vlivem koagulačních faktorů aktivují homeostatické fibrinolytické mechanismy, které zabraňují hyperfibrinosyntéze. Pokud je mechanismus koagulace narušen, např. při hemofilii nebo trombocytopenii, je třeba rychlost fibrinolýzy kontrolovat, aby se dostatečnou tvorbou sraženiny zabránilo krvácení. U hemofiliků a nemocných s trombopenií je sice vhodné ovlivnit fibrinolýzu, ale je třeba rovněž zlepšit defekty koagulace (chybění faktoru VIII nebo IX) a primární hemostázy (chybění trombocytů), a to většinou substitucí.
Zkušenosti potvrzují účinnost léčby kyselinou aminokapronovou při různých stavech v kardiochirurgii, onkologii, v porodnictví a gynekologii, při transplantaci orgánů, v ortopedii, traumatologii a při různých hematologických poruchách (1).
Kyselina tranexamová
Kyselina tranexamová působí antifibrinolyticky prostřednictvím kompetitivní inhibice aktivace plazminogenu na plazmin. Je také slabým nekompetitivním inhibitorem plazminu. Tyto vlastnosti se využívají při jejím klinickém použití jako antifibrinolytika při léčbě jak celkového, tak lokálního fibrinolytického krvácení. Mechanismus působení na zpomalení nebo zastavení fibrinolýzy je podobný kyselině aminokapronové, ale je asi 10krát silnější. Působí proti rozpadu sraženiny a je užitečný při zastavení závažného krvácení zvýšením tvorby koagula. Používá se při abnormálně silném krvácení během operativního odstranění prostaty a při jiných operacích, při abnormálně těžkém menstruačním krvácení, při závažném krvácení z nosu, při místní hyperfibrinolýze, při extrakci zubů u pacientů s koagulopatiemi (společně s antihemofilickým faktorem) (13).
Vazopresin
Vazopresin je nezbytný pro kardiovaskulární homeostázu, reguluje prostřednictvím ledvin resorpci vody, v cévách reguluje napětí hladkého svalstva a jako neurotransmiter působí modulačně na autonomní činnost mozkového kmene, když je uvolňován v reakci na stres nebo šok. Relativní nedostatek vazopresinu se vyskytuje při dlouhotrvajícím vazodilatačním šoku, např. při těžké sepsi. V tomto stavu má exogenní vazopresin zřetelný vazokonstrikční účinek, a to dokonce v dávkách, které neovlivňují krevní tlak zdravých osob.
Vazopresin je běžně používán k zastavení život ohrožujícího krvácení z jícnových varixů, kdy je podáván s cílem zúžit cévy a tak snížit krevní tok do varixů a zastavit krvácení. Ve velkých dávkách vazopresin působí vazokonstrikci, zvláště kapilár a mírně arteriol, což vede ke snížení průtoku krve slezinou, koronárním řečištěm, gastrointestinálním traktem, slinivkou a kožní a svalovou soustavou. Tento účinek je užitečný v případě potřeby snížit průtok krve v určitých cílových oblastech, a tak snížit krvácení, a také při popáleninách a crush–syndromu.
Desmopresin
Desmopresin (1–deamino–8–D–arginin vazopresin, DDAVP) je syntetickým analogem vazopresinu a je používán při bezkrevní léčbě mírné až střední hemofilie a von Willebrandovy nemoci. Také se prokázal jako účinný pro snížení prodlouženého času krvácení, který často doprovází urémii, cirhózu jater a jiná onemocnění, při kterých se vyskytují poruchy funkce krevních destiček. Hemostatický účinek desmopresinu zahrnuje:
- zvýšení koncentrace koagulačních faktorů v plazmě prostřednictvím endogenního uvolňování faktoru VIII, von Willebrandova faktoru a aktivátoru tkáňového plazminogenu,
- zvýšení adhezivity krevních destiček,
- zúžení průsvitu artérií a tím snížení průtoku krve.
Desmopresin zvyšuje schopnost koagulace u všech pacientů a pomáhá při rychlém zastavení krvácení. Protože je jeho působení krátkodobé (30–60 minut), může se podávat bez obav z navození hypekoagulace (3).
Vitamín K
Vitamín K (Phytonadione) označuje skupinu v tucích rozpustných vitamínů, které jsou potřebné pro potranslační modifikaci určitých proteinů, které jsou nezbytné pro srážení krve. Má tedy klíčovou roli kofaktoru pro tvorbu faktorů stability krevní sraženiny (faktor II, VII, IX a X) v játrech. Vitamín K je normálně tvořen bakteriemi střevní flóry. Příčinou nedostatku může být nedostatečná dietní strava, malá absorpce při závažném poškození střev nebo při interakci s léky (antibiotika, nárazová dávka léčby!). Syntetický přípravek je totožný s endogenní formou vitamínu K.
Vitamin K je indikován u stavů, kdy lze předpokládat jeho deficit nebo při předávkování či zrušení účinku kumarinových antikoagulancií. Není indikován u krvácení z jiných příčin.
Rekombinantní antihemofilické faktory
Rekombinantní antihemofilické faktory jsou biosyntetické formy endogenních humánních koagulačních faktorů. Tyto preparáty jsou získávány rekombinantní DNA technologií (genetickým inženýrstvím) a dosahují stejného biologického účinku jako koagulační faktory získané přímo z plazmy. Biosyntetické antihemofilické preparáty mají ve srovnání s přípravky získanými z krevní plazmy výrazně nižší riziko možné kontaminace patogenními mikroorganismy.
Rekombinantní faktor VIIa
Rekombinantní faktor VIIa se používá k zastavení krvácení u pacientů s hemofilií a přítomností inhibitoru. Úspěšně se používá jako univerzální hemostatikum u všech forem nezvládnutého krvácení v perioperační léčbě. Může se použít u pacientů s onemocněním jater, při krvácení následkem antikoagulace, v chirurgii, při trombocytopenii, při trombastenii, u pacientů s von Willebrandovým onemocněním a při jiných poruchách krvácení (5–7).
Rekombinantní faktor VIII
Použití rekombinantního antihemofilického faktoru je indikováno u hemofilie A k prevenci a zvládnutí krvácení. Není indikován u von Willebrandovy nemoci. Faktor VIII je protein v krvi nezbytný pro tvorbu sraženiny a zástavu krvácení a udržení efektivní hemostázy. Rekombinantní faktor VIII se používá k léčbě pacientů s přechodným nebo trvalým nedostatkem faktoru VIII při prevenci krvácení nebo když se musí provést neodkladný nebo plánovaný zákrok u pacientů s hemofilií A.
Rekombinantní faktor IX
Tento rekombinantní přípravek se používá jako dočasná náhrada za nedostatek faktoru IX při prevenci a zvládnutí nadměrného krvácení u pacientů s hemofilií B včetně těch, u kterých je třeba provést neodkladný nebo plánovaný chirurgický zákrok.
Faktor IX je nezbytný pro tvorbu sraženiny a zástavu krvácení.
Lokální hemostatické přípravky
Tyto přípravky sice nejsou náhražkou precizní pečlivé chirurgické techniky, ale mohou pomoci zkrátit dobu operace a zastavit krvácení. U pacientů s poruchami srážlivosti a krvácivosti ale mohou více pomoci hemostatické přípravky pro celkové podání. Kombinace několika různých hemostatických faktorů může při mnoha operacích hemostázu zlepšit.
Používané látky:
- Trombin sušený.
- Kolagen.
- Karboxycelulóza.
- Želatina.
- Fibrin.
Trombin (FloSeal®)
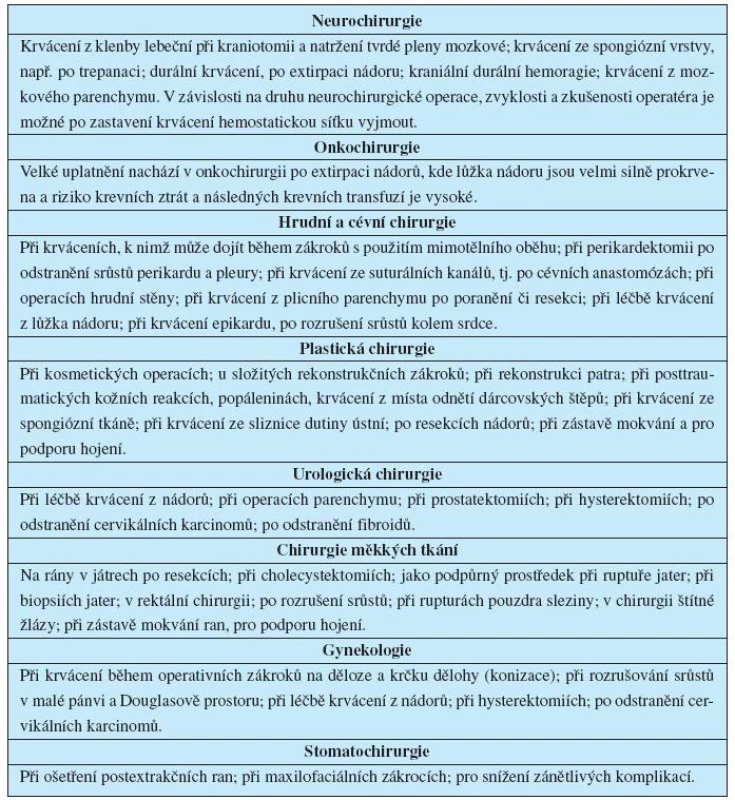
je trombinové lepidlo. Protože obsahuje trombin, je třeba mít na mysli, že může působit antigenně. Trombin je faktor přirozeného mechanismu koagulace. Je izolován ze zdravé plné krve nebo plazmy. Používá se přímo na poraněnou tkáň k zástavě krvácení. Má vlastnosti podložky (síla, lepivost, měkkost, mřížka a speciální obvaz), podílí se na tvorbě sraženiny a může se pro zastavení krvácení z otevřeného poranění používat před operací nebo v době operačního zákroku.
Kolagen (Avitene®)
se používá se v traumatologii, chirurgii, ORL a stomatologii pro zastavení kapilárního a parenchymatózního krvácení a při krytí ploch po popáleninách, atd. Vykazuje nejhorší reakci těla na cizí látku ze všech prostředků. Kontraindikací použití je přecitlivělost na hovězí bílkoviny.
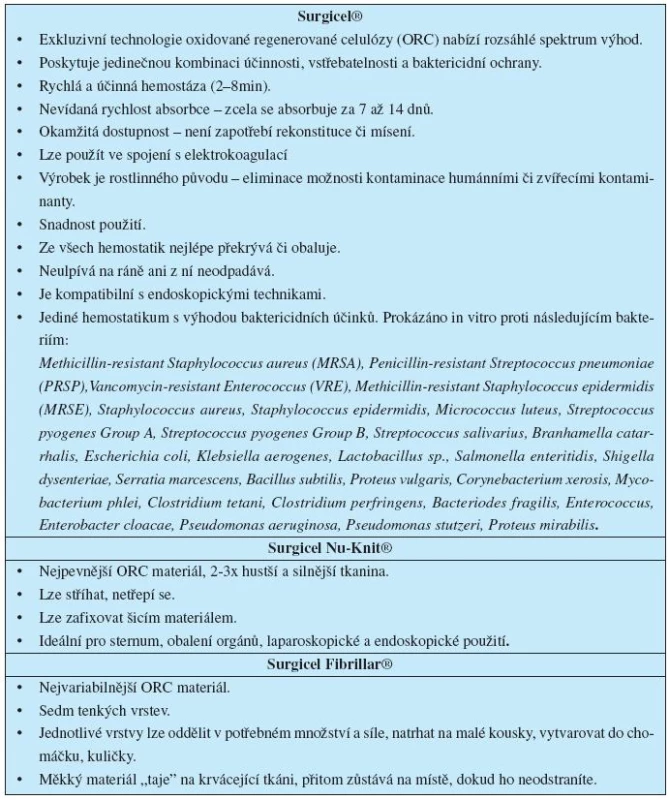
Karboxycelulóza (Surgigel®, Surgicel Nu-Knit®, Surgicel Fibrillar®)
je síťka z oxidované celulózy s rychlým nástupem účinku. Ve srovnání s jinými hemostatickými prostředky má také určitý antimikrobiální účinek. Používá se při kapilárním a parenchymatózním krvácení v traumatologii, všeobecné chirurgii, kardiochirurgii, gynekologii, urologii, ORL, ortopedii, stomatochirurgii (9, 10, 16).
Surgicel®
První a jediné absorbovatelné hemostatikum rostlinného původu s prokázanými baktericidními vlastnostmi a 50-ti letou tradicí, dostupný ve 3 formách, vhodný pro široké spektrum chirurgických výkonů (14) (tab. 3, tab. 4, obr. 1).
Image 1. Koagulační kaskáda a hemostatika/lepidla 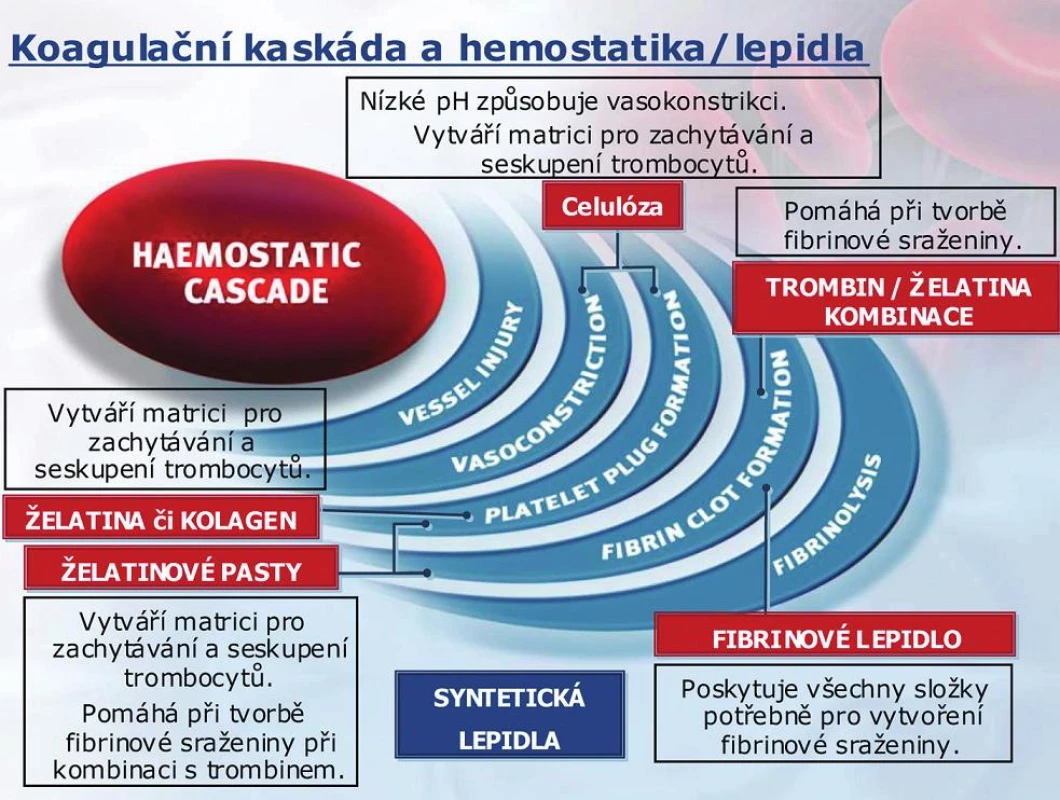
Želatina
je resorbovatelné hemostatikum dostupné v několika formách:
- želatinová houba (Spongostan®, Gelaspon®) je k dispozici v různých rozměrech (7/10/20 x 4/5 x 1 cm) a aplikuje se po navlhčení fyziologickým roztokem.
- želatinový prášek (Spongostan Powder®, Surgiflo®) umožňuje připravit požadovanou konzistence během sekund (prášek, pasta, tekutina). Je možné jej výhodně kombinovat s tekutinami (4–10 ml) – fyziologický roztok, antibiotikum, antiseptikum, roztok trombinu.
Používá se v traumatologii, všeobecné chirurgii, ORL, stomatologii a v intervenční radiologii. Kontraindikacemi je přecitlivělost na želatinu a infikované plochy (11, 12).
Tkáňová adheziva
Fibrinová lepidla jsou deriváty humánních tkáňových adheziv a používají se pro zajištění hemostázy fibrinovými koaguly v místě aplikace. Skládají se z fibrinogenu, trombinu a někdy i přídavku faktoru XIII a antifibrinolytika (aprotininu, kyseliny tranexamové). Tyto substance napodobují poslední fázi fyziologické tvorby koagul.
Tkáňová adheziva mohou být použita lokálně k uzavření poranění nebo ke snížení povrchového pooperačního krvácení, a tak mohou zmenšit nebo vyloučit potřebu švů. Jsou zvláště účinná pro léčbu koncových poranění. Uzavření poranění fibrinem má pro léčbu určité výhody, např. rychlost, menší jizvu a snížení krvácení. Fibrinová lepidla potřebují dost času na přípravu a jsou dražší než jiné hemostatické prostředky (8).
Dr. med. Josip Slipac
Česká společnost bezkrevní medicíny
(Czech Society of Bloodless Medicine)
Brožíkova 581/19a
638 00 Brno
E-mail: csbmcz@tiscali.cz
www.bloodless.wz.cz
Sources
1. Chen, R.H., Frazier, O.H., Cooley, D.A. Antifibrinolytic therapy in cardiac surgery. Tex. Heart Inst. J. 1995, 22(3), p. 211–215.
2. Czinn, E.A., Chediak, J.R. Coagulation and hemostasis. In: Salem MR, editor. Blood Conservation in the Surgical Patient. Baltimore: Williams & Wilkins 1996, p. 45–78.
3. Douglas, J.T., Shaw, J. High-dose desmopressin in bleeding disorders. Eur. J. Anaesthesiol. 1997, 14, (Suppl 14), p. v–vi.
4. Haber, G.P., Gill, I.S. Laparoscopic partial nephrectomy: contemporary technique and outcomes. Eur. Urol. 2006, 49, p. 660–665.
5. Hedner, U., Ezban, M. Tissue factor and factor VIIa as therapeutic targets in disorders of hemostasis. Annu. Rev. Med. 2008, 59, p. 29–41.
6. Hedner, U. Recombinant factor VIIa: its background, development and clinical use. Curr. Opin. Hematol. 2007, 14(3), p. 225–229.
7. Hedner, U. Mechanism of action, development and clinical experience of recombinant FVIIa. J. Biotechnol. 2006, 124(4), p. 747–757.
8. Holcomb, J.B., Pusateri, A.E., Hess, J.R. et al. Implications of new dry fibrin sealant technology for trauma surgery. Surg. Clin. North. Am. 1997, 77(4), p. 943–952.
9. Kasirajan, K., Cornu-Labat, G., Mehta, T. et al. Intracavitary packing with oxidized regenerated cellulose: a therapeutic option following major liver injury. Contemp. Surg. 1998, 52, p. 123-127.
10. Mair, H., Kaczmarek, I., Oberhoffer, M. et al. Surgicel Nu-Knit hemostat for bleeding control of fragile sternum. J. Thorac. Cardiovasc. Surg. 2005, 130, p. 605-606.
11. Ragusa, R., Faggian, G., Rungatscher, A. et al. Use of gelatin powder added to rifamycin versus bone wax in sternal wound hemostasis after cardiac surgery. Interact. CardioVasc. Thorac. Surg. 2007, 6, p. 52-55.
12. Sabel, M., Stummer, W. The use of local agents: Surgicel and Surgifoam. Eur. Spine. J. 2004, 13 (Suppl. 1), S97-S101.
13. Seto, A.H., Dunlap, D.S. Tranexemic acid in oncology. Ann. Pharmacother. Surg. 1996, 30(7–8), p. 868–870.
14. Sharma, J.B., Malhotra, M., Pundir, P. Laparoscopic oxidized cellulose (Surgicel) application for small uterine perforations. Int. J. Gynaecol. Obstet. 2003, 83, p. 271-275.
15. Slipac, J. Bezkrevní medicína. Praha: Triton 2008.
16. Spangler, D., Rothenburger, S., Nguyen, K. et al. In vitro antimicrobial activity of oxidized regenerated cellulose against antibiotic - resistant microorganisms. Surg. Infect. 2003, 4(3), p. 255-262.
17. Trooskin, S.Z., Flancbaum, L., Boyarsky, A.H., Greco, R.S. A simplified approach to techniques of splenic salvage. Surg. Gynecol. Obstet. 1989, 168, p. 546-548.
18. White, B., McHale, J., Ravi, N. et al. Successful use of recombinant FVIIa (NovoSeven®) in the management of intractable post-surgical intra-abdominal haemorrhage. Br. J. Haematol. 1999, 107, p. 677–678.
19. White, G.C., Marder, V.J., Colman, R.W. et al. Approach to the bleeding patient. In: Colman RW, Hirsh J, Marder VJ, George JN, Goldhaber SZ (eds.). Hemostasis and Thrombosis. Basic principles and clinical practice. 3rd ed. Philadelphia: Lippincott Williams & Wilkins 1994; p. 1134–1147.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2010 Issue 5-
All articles in this issue
- Posuzování zdravotního stavu žadatelů pro účely náhradní rodinné péče
- Vliv intervenčního pohybového programu na funkční soběstačnost a manuální zručnost důchodců žijících v domově pro seniory
- Prevence zánětlivých komplikací operace katarakty – výsledky klinické studie lokální aplikace levofloxacinu
- Hodnocení rizikových faktorů pracovního prostředí a nemoci z povolání
- Potřeby rodin dětí se syndromem ADHD
- Existuje bisexualita?
-
Evoluce a evoluční teorie pro lékaře
V. Darwinovy teorie evoluce - Alimentární infekce a intoxikace bakteriálními toxiny
- Profesionální onemocnění hlášená v České republice v roce 2009
- Účinná hemostáza při bezkrevních chirurgických operacích
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Alimentární infekce a intoxikace bakteriálními toxiny
- Existuje bisexualita?
- Účinná hemostáza při bezkrevních chirurgických operacích
- Posuzování zdravotního stavu žadatelů pro účely náhradní rodinné péče
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career