-
Medical journals
- Career
Chylotorax a pseudochylotorax: diferenciální diagnostika a současné terapeutické možnosti
Authors: P. Žáčková; M. Vašáková
Authors‘ workplace: Primářka: MUDr. Martina Vašáková, Ph. D. ; Fakultní Thomayerova nemocnice s poliklinikou ; Přednostka: MUDr. Václava Bártů ; Pneumologická klinika 1. LF UK, Praha
Published in: Prakt. Lék. 2008; 88(6): 352-358
Category: Case Report
Overview
Chylotorax a pseudochylotorax patří do skupiny pleurálních výpotků s vysokým obsahem lipidů. Jejich výskyt je relativně vzácný, představují přibližně 10 % z celého spektra pleurálních výpotků. Vzhledem k tomu, že vznik chylotoraxu i pseudochylotoraxu může být podmíněn celou řadou onemocnění, bývá určení příčiny vzniku obtížné, přestože již samotný makroskopický vzhled výpotku je velmi typický. Přehledný článek je věnován charakteristice, patofyziologii, diferenciální diagnostice a léčbě chylotoraxu a pseudochylotoraxu se zaměřením na terapii v závislosti na zjištěnou etiologii onemocnění.
Klíčová slova:
chylotorax, pseudochylotorax, etiologie, diagnostika, terapie.Úvod
Chylotorax (CHT) a pseudochylotorax (PCHT) jsou pleurální výpotky, pro které je charakteristický vysoký obsah lipidů, což také podmiňuje jejich typický vzhled. Makroskopicky se jeví jako mléčný, mírně zkalený, opaleskující, někdy sanguinolentní sekret. K vysoké koncentraci lipidů v pleurálním sekretu dochází za dvou různých stavů. V prvním případě se chylus dostává do pleurální dutiny jako důsledek postižení ductus thoracicus (DT). Ve druhém případě je podkladem vysoká koncentrace cholesterolu, respektive cholesterolových krystalů a lecitin-globulinových komplexů, k jejichž akumulaci dochází u dlouho trvajících výpotků. Přes makroskopicky identický vzhled se oba tyto stavy liší etiologicky, patofyziologicky, léčbou i prognózou (2).
Chylotorax – patofyziologie
CHT je podmíněn průnikem chylu do pleurálního prostoru na podkladě porušení DT či jeho hlavních větví. Ačkoliv se jedná o poměrně vzácný stav, promptní diagnóza a adekvátní terapie jsou velmi důležité. Morbidita a mortalita vyplývá s malnutrice, dehydratace a rozvoje imunodeficitu, objemný CHT negativně ovlivňuje především kardiopulmonální systém, ale také funkce renální a jaterní. Úmrtnost bez léčby dosahuje dle literárních údajů až 50 % (1).
Většina absorbovaných tuků se do krve dostává prostřednictvím DT ve formě chylomikronů. Chylomikrony vstupují do střevních mízních cév a dále do cisterna chyli, která naléhá na L2 a z níž odstupuje hlavní kmen DT. Je přibližně 2–3 mm silný, délka se pohybuje v rozmezí 37 až 45 cm. DT prostupuje bránicí přes hiatus aorticus a dále probíhá mezi aortou a vénou azygos do zadního mediastina, kde je lokalizován extrapleurálně. Naléhá na pravou stranu obratlových těl přibližně do úrovně esofagu. Mezi 4. a 6. hrudním obratlem se stáčí na levou stranu a vstupuje do horního mediastina meziaortálním obloukem a levou podklíčkovou arterií. Při klíčku se obloukovitě stáčí a ústí do soutoku levé jugulární a podklíčkové vény (2).
DT má řadu variant, často bývá zdvojený, ústí do žilního systému mohou být samostatná či společná. V případě zdvojení v proximální části může jedna část ústit do soutoku pravých žil. Řada chlopní usměrňuje tok lymfy pouze proximálně. Existuje celá řada kolaterál a spojů mezi lymfatickým a venózním systémem především v oblasti DT a vénou azygos, interkostálními a paravertebrálními vénami, což umožňuje ligaci DT bez negativních důsledků.
Vzhledem k tomu, že větší část DT je uložena v pravém hemitoraxu, bývá CHT zpravidla pravostranný, při poškození v úrovni aortálního oblouku pak levostranný, a pokud dochází k jeho porušení v místě, kde přechází přes střední čáru, může být i oboustranný. DT drénuje lymfu prakticky z celého těla s výjimkou pravé poloviny hlavy, krku, pravé plíce, pravé poloviny srdeční, konvexity jater a pravé nadledviny. Většina (95 %) lymfy pochází z oblasti gastrointestinálního traktu a jater.
Denně „proteče“ lymfatickým systémem přibližně 1 500–2 000 ml chylu. Množství může stoupnout 2–10x v závislosti na příjmu potravy (tučné jídlo), rovněž přísun tekutin zvyšuje průtok, zatímco proteiny a uhlohydráty mají jen malý vliv. Chylus obsahuje více než 3 g/dl proteinů, přičemž poměr albuminu ku globulinu je 3 : 1. Koncentrace minerálů odpovídá přibližně sérovým hodnotám. Přítomny jsou také vitaminy rozpustné v tucích. Chylus obsahuje rovněž lymfocyty (90 % T lymfocyty) v množství 400 až 6 000/μl, dále erytrocyty 50–600/μl.
Z toho i jednoznačně vyplývají závažné deplece podmíněné únikem chylu (minerály, lipidy, proteiny, lymfocyty). Chylus sám má bakteriostatické účinky a nemá iritační vlastnosti, takže jeho přítomnost v pleurální dutině neindukuje fibroprodukci, a tím ani rozvoj fibrotoraxu (tab. 1.).
Table 1. Parametry chylotoraxu 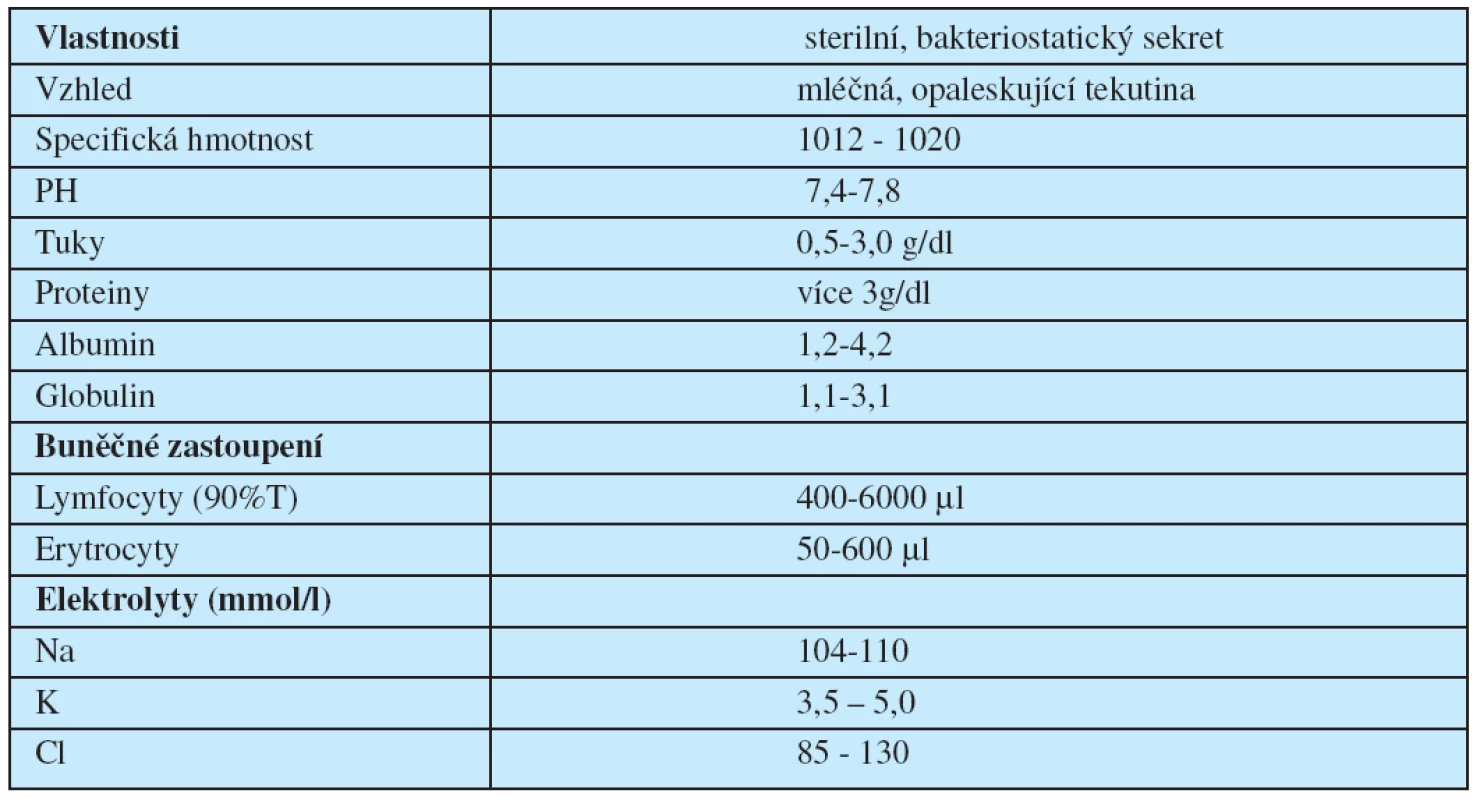
Chylotorax – etiologie
Podle příčiny vzniku můžeme CHT rozdělit do několika základních skupin:
- netraumatický,
- traumatický pooperační,
- traumatický,
- vrozený,
- idiopatický.
Netraumatický chylotorax
Vzniká na podkladě intraluminální obstrukce nádorovými buňkami, infekčními organismy, zánětem nebo lokálně extramurálním útlakem působeným tumorem. Příčin existuje celá řada, podkladem mohou být onemocnění dutiny hrudní i břišní. Ve více než v 50 % případů je podkladem tumor mediastina utlačující nebo invadující do DT, z toho v 75 % se jedná o lymfom a CHT může být prvním příznakem onemocnění, který může předcházet stanovení diagnózy o řadu měsíců a někdy i let (7).
Vznik CHT byl také popsán u nemocných s AIDS a Kaposiho sarkomem. Může vzniknout jako komplikace tuberkulózy, filariózy, pankreatické pseudocysty, tuberózní sklerózy, amyloidózy, sarkoidózy, cirhózy jaterní, srdeční insuficience, syndromu žlutých nehtů a idiopatických lymfangiektazií. Může se vyskytnout u lymfangioleiomyomatózy. Toto onemocnění postihuje pouze ženy, nejčastěji v reprodukčním věku. Podkladem je proliferace hladkých svalových buněk v lymfatických cévách a v plicním parenchymu, kde podmiňuje vznik rychle progredujících retikulonodulárních infiltrátů. Typickým příznakem jsou hemoptýzy a pneumotorax, ke vzniku chylotoraxu dochází až u 28 % nemocných (7). Velmi vzácně se může CHT vyskytnout jako důsledek radioterapie (RT).
Traumatický pooperační chylotorax
Iatrogenní příčina vzniku CHT je druhá nejčastější a zodpovídá přibližně za 25 % případů. Ačkoliv chylotorax může vzniknout v souvislosti s prakticky jakoukoliv operací, nejčastěji vzniká po resekcích jícnu pro karcinom s mediastinální lymfadenektomií, komplikuje přibližně 2 % těchto operací (2). Je vzácnou, ale závažnou komplikací kardiovaskulárních operací. Po operacích hrudní a abdominální aorty je jeho vznik popisován u 0,5–2 % nemocných. Nejčastěji se objevuje po reoperacích descendentní aorty pro aneuryzma (1). Chylotorax byl rovněž popsán po esofagoskopii, po opakované sklerotizaci jícnových varixů, hrudní sympatektomii, blokádě ganglion stellatum, translumbální aortografii a po resekčních plicních výkonech, při trombóze jugulární a podklíčkové žíly a po jejich kanylaci.
Traumatický chylotorax
Příčinou vzniku traumatického CHT jsou penetrující (bodná, střelná) poranění i nepenetrující poranění – fraktura páteře, hyperextenze páteře. Vulnerabilita DT se zvyšuje po jídle, ke vzniku může dojít při kašli, dávení, náhlém úbytku hmotnosti. Častěji bývá pravostranný.
Méně často vzniká CHT na podkladě chylózního peritoneálního výpotku v souvislosti s tupým poraněním břicha. Příčinou vzniku chylózního peritoneálního výpotku, který byl poprvé popsán Mortonem v 17. století, je poškození mezenteria a náhlá komprese mezenteriálních lymfatik. Předpokládá se, že ke vzniku CHT dochází přestupem chylu transdiafragmatickým lymfatickým systémem podobně jako u Meigsova syndromu (12).
Kongenitální chylotorax
Je nejčastější příčinou pleurálního výpotku u novorozenců. U chlapců se vyskytuje 2x častěji a jeho incidence je přibližně 1/10 000–15 000 novorozenců. Poprvé byl popsán Pisekem v roce 1917. Etiologie je zpravidla nejasná. Podkladem může být ruptura DT podmíněná hyperextenzí páteře a vzestupem venózního tlaku v průběhu porodu, častěji je však podkladem vrozená malformace (8). DT může být atretický, či zcela nevyvinutý, mohou existovat četné komunikace mezi DT a pleurální dutinou. Bývá spojen s Downovým a Turnerovým syndromem, tracheoesofageální píštělí či pravostrannou brániční hernií.
Další příčinou mohou být plicní tumory, plicní sekvestrace a vrozená cytomegalovirová a adenovirová infekce (8). Generalizovaná lymfangiomatóza je vzácné postižení lymfatik postihující kosti, měkké tkáně i viscerální orgány. Jedná se o vrozenou malformaci, která je velmi pravděpodobně podmíněna perzistencí dilatace lymfatik ve 14–20 týdnu intrauteriního vývoje. Lokalizovaná intraoseální lymfangiomatóza je poměrně často diagnostikována u dětí a dospívajících. U jedinců s vícečetným kostním postižením je časté postižení měkkých tkání a viscerálních orgánů projevující se chylotoraxem, chyloperikardem, hepatosplenomegalií, lymfedémy a difuzním ztluštěním mezenteria a plicního intersticia. Vznik CHT u těchto nemocných je podmíněn kompresí lymfatik v mediastinu. Velmi pravděpodobně se však na jeho vzniku podílí také postižení viscerální a parietální pleury s přímým průnikem chylu do pleurální dutiny (11).
V dětství vzniká CHT nejčastěji jako pooperační komplikace, respektive jako komplikace trombózy pravé nebo levé podklíčkové vény.
Idiopatický chylotorax
Přibližně 25 % CHT je idiopatických a kauzální příčinu se nepodaří stanovit. Předpokládá se, že ve většině těchto případů je příčinou minitraumatizace podmíněná kašlem, škytavkou či protažením se po požití tučného jídla (2).
Chylotorax – klinická symptomatologie
Klinická symptomatologie závisí na vyvolávající příčině a na objemu sekretu přítomného v pleurální dutině. Pleurální bolest či teploty do klinického obrazu nepatří.
Traumatický CHT se zpravidla rozvíjí v odstupu 2–10 dnů po traumatu. Primárně dochází k průniku lymfy do oblasti zadního mediastina, vzniká tzv. chylom, který lze detekovat rentgenologicky. Chylom může být provázen dramatickým klinickým obrazem – akutně vzniklými silnými bolestmi, kašlem, dušností, tachykardií, které mohou imitovat akutní infarkt myokardu či embolizaci do plicnice. Stejně tak provalení chylomu přes mediastinální pleuru do pleurální dutiny může být doprovázeno obdobnou symptomatologií. Vzácnější variantou je chylomediastinum či chyloperikard, kdy k provalení do pleurální dutiny nedochází.
Místním důsledkem průniku chylu do pleurální dutiny je komprese plíce, přesun mediastina a komprese kontralaterální plíce s rezultujícím kardiorespiračním selháním a šokovým stavem. U nemocných s CHT se rychle rozvíjí malnutrice a dochází k rozvoji imunodeficience, což je podmíněno ztrátami proteinů (především albuminu), tuků, vitamínů. minerálů a T lymfocytů. Deplece T lymfocytů se negativně obráží jak v buněčné, tak humorální imunitě. Nemocní jsou ohroženi bakteriálními i virovými infekty, které mohou rychle vyústit do septického stavu. Jediný benefit z deplece T populace lymfocytů vykazují transplantovaní nemocní, u kterých se díky vzniklé imunosupresi snižuje pravděpodobnost rejekce transplantátu.
Chylotorax – diagnóza
Diagnostický je již samotný vzhled evakuovaného sekretu, který je mléčně zkalený a může mít i sanguinolentní nádech. Diferenciálně diagnosticky přichází z makroskopického pohledu v úvahu CHT, PCHT a hrudní empyém. Narozdíl od empyému je však po centrifugaci supernatant u CHT a PCHT nadále opaleskující.
Suverénní diagnostickou metodou je stanovení koncentrace triacylglycerolů (TAG). Hodnoty nad 110 mg/dl svědčí pro chylotorax, hodnoty pod 50 mg/dl chylotorax vylučují. V případě hodnot TAG v rozmezí 50–110 mg/dl je nutno doplnit lipidovou elektroforézu, přítomnost chilomikronů potvrzuje CHT. Diagnostický je rovněž poměr koncentrace TAG a cholesterolu v pleurálním sekretu a v séru. Poměr koncentrace TAG vyšší než 1 a poměr koncentrace cholesterolu nižší než 1 svědčí pro CHT. Diagnóza může být rovněž potvrzena podáním tučného jídla, respektive smetany per os či nasogastrickou (NG) sondou, což vede k rychle patrné a výrazné změně barvy pleurálního sekretu podmíněné absorbcí tuku lymfatickým systémem.
Pro stanovení diagnózy jsou velmi cenné anamnestické údaje. Sledujeme především v předchorobí proběhlé trauma hrudi či břicha, tuberkulózu, pneumotorax či radioterapii, výskyt hematologických i jiných malignit. Z dalších vyšetření napomáhajících stanovení diagnózy je namístě skiagram hrudníku, který umožní posoudit rozsah a lokalizaci pleurálních změn. CHT neindukuje fibrózu, výpotek má volný charakter. Přítomnost pachypleury – opouzdřený výpotek svědčí pro PCHT.
Computerová tomografie (CT) hrudi a břicha může ozřejmit přítomnost lymfadenopatie či tumorozních změn. Lymfangiografie upřesní lokalizaci a stupeň úniku. Videotorakoskopie (VTS) či videoasistovaná torakotomie (VATS), doplněná o biopsii pleury a plíce, je cenným diagnostickým (lymfangioleiomyomatoza) a často také terapeutickým postupem.
Chylotorax – terapie
Popsaná deplece humorálních a buněčných substancí, kterou CHT způsobuje, ohrožuje nemocného bezprostředně na životě. Terapeutické postupy lze rozdělit na konzervativní, chirurgické a případně jejich kombinaci.
Konzervativní léčba
Léčba základního onemocnění.
Dietní opatření.
- a) dieta obsahující triglyceridy se středně dlouhými řetězci (12 atomů uhlíku), které se absorbují přímo do portálního řečiště (lze podávat jen krátkodobě),
- b) plná parenterální výživa.
Evakuační hrudní punkce.
Hrudní drenáž.
Pleurodéza.
Chirurgická léčba
Ligace DT cestou VATS či torakotomie.
Založení pleuroperitoneálního shuntu.
Aplikace tkáňových lepidel.
Pleurektomie.
Kolem 50 % nemocných s traumatickým chylotoraxem se zhojí konzervativními postupy. Extrémně důležité je snížit tvorbu CHT, a tím i ztrát na minimum. Znamená to absolutní klid na lůžku, výluku perorálního příjmu potravy, zavedení NG sondy k odsávání žaludečního obsahu, inhibice žaludeční sekrece analogy somatostatinu, plnou parenterální výživu (2).
Hrudní drenáž umožňuje trvalé rozvinutí plíce. Alternativou je pleuroperitoneální shunt. Cílem terapie je reexpanze plíce a zamezení ztrát tuků, proteinů, minerálů, vitaminů i buněčných elementů obsažených v chylu. V principu jde o jednocestné subkutánní spojení pleurální a peritoneální dutiny prostřednictvím spojky, která se zakládá za torakoskopické kontroly. Drénovaný chylus se v peri-toneální dutině zpětně resorbuje. Pleuroperitoneální shunt je s úspěchem využíván především u dětských pacientů s perzistujícím chylotoraxem nereagujícím na dietetická opatření a torakocentézu. Efekt evakuace lze kontrolovat skiagraficky nebo ultrasonograficky. Velkou výhodou této léčby je to, že nemocné dítě může být v domácím ošetření, sledováno pouze ambulantně (10).
Obecně je při zvažování terapeutického postupu je cenným vodítkem provedení lymfografie, která ve většině případů umožní lokalizovat místo úniku. V případě, že je místo úniku v oblasti větví DT, lze očekávat , že konzervativní terapie bude úspěšná (9)
Chirurgická intervence je indikována u nemocných s proběhlou resekcí jícnu pro karcinom a u nemocných, u kterých přetrvává denní odpad drénem více než 1 000 ml po dobu 7 dnů. Prostřednictvím torakotomie je možno ozřejmit únik lymfy a provést ligaci DT či jeho větví. Vzhledem k mohutným kolaterálám nevede ligace k problémům s následnou lymfostázou. Najít místo úniku je možno pomocí peroperačně prováděné lymfangiografie či podáním smetany per os hodinu před operací. Pokud se nepodaří místo úniku identifikovat, volí se nejčastěji ligace kmene mezi aortou a vénou azygos.
Chemická pleurodéza talkem představuje alternativní léčbu pro pacienty s vysokým operačním rizikem. Vzhledem k celkově malým zkušenostem se však nedoporučuje provádět ji cestou hrudní drenáže (2).
Úspěšné užití tkáňových lepidel bylo popsáno především u dětí, přesné předoperační stanovení místa úniku prostřednictvím lymfangiografie umožňuje snížit množství užitého tkáňového lepidla.
U nemocných s postesofagotomickým chylotoraxem se doporučuje operační řešení již 5. pooperační den. Někteří doporučující elektivní ligaci jako součást chirurgické intervence, jako prevenci rozvoje pooperačního CHT. Ligace DT by měla být provedena v oblasti horní břišní či dolní hrudní, kde je uložení DT relativně konstantní (2).
Zatím spíše ojediněle použitým terapeutickým postupem je embolizace coily po předchozí perkutánní transabdominální katetrizaci cisterna chyli a lokalizaci místa úniku chylu pomocí kontrastní látky (4).
Terapie netraumatického CHT je podmíněna především zjištěním etiologie onemocnění, základní opatření jsou stejná. Pokud nemá konzervativní postup efekt, je indikována torakotomie, respektive VATS s ligací DT.
Pokud je však podkladem lymfom či metastatický karcinom, je indikována RT na mediastinum, která vede ke kontrole CHT u 70 % nemocných s lymfomem a 50 % nemocných s metastatickým karcinomem. Ve zbývajících případech je indikována chemická pleurodéza cestou hrudní drenáže, i když je obecně známo, že dosažení chemické pleurodézy je u chylotoraxu obtížnější než u maligního fluidotoraxu. Pleurektomie, chemická pleurodéza cestou VATS a ligace je indikována u těchto nemocných v závislosti na aktuálním stavu a předpokládané životní limitaci.
Léčba základního onemocnění může vést v některých případech ke kontrole CHT – systémová kortikoterapie u sarkoidózy a u systémového lupus erytematodes (2). Idiopatický chylotorax bývá úspěšně léčen konzervativními postupy až v 80 % případů, zvláště je li podkladem nerozpoznaná mikrotraumatizace DT. Základem terapie je v těchto případech hrudní drenáž a parenterální nutrice. Nedojde li během 2–3 týdnů k rezoluci výpotku, je indikováno chirurgické řešení.
U kongenitálního CHT je léčba zpočátku vždy konzervativní, většina CHT ustoupí po opakovaných punkcích. Pokud CHT perzistuje i po 3. punkci, je indikováno zavedení pleuroperitoneální spojky – většinou s dobrým efektem. Spojka se zpravidla odstraní po několika měsících. Při neúspěchu je indikována torakotomie s ligací DT. Obecně chirurgické řešení provedené do 10 dnů po stanovení diagnózy zkracuje hospitalizaci. V řadě případů se však efekt konzervativní terapie projeví až za delší dobu – 2–4 týdny, bez nutnosti operačního řešení. Nedoporučuje se však s chirurgickým řešením vyčkávat déle než 4 týdny.
U novorozenců byl také popsán léčivý účinek aplikace somatostatinu na CHT. Mechanismus účinku není detailně znám. Předpokládá se, že dochází k vazokon-strikci ve splanchnické oblasti a z toho vyplývající redukci intestinální perfúze. Předpokládá se také, že lymfatické cévy mají somatostatinové receptory, jejichž stimulace vede ke konstrikci s následným omezením produkce lymfy. Kontinuální infuze somatostatinu je novým terapeutickým postupem v léčbě CHT, který může redukovat nutnost operačního řešení i délku hospitalizace (2).
Méně obvyklé příčiny chylotoraxu
Řada autorů předkládá ve svých sděleních kazuistiky nemocných u kterých se objevil chylotorax v neobvyklém spojení s jiným onemocněním. Patofyziologie vzniku CHT v těchto případech není vždy zcela jasná.
Skupina brazilských lékařů tak popisuje případ ženy s leukémií z vlasatých buněk s negativním nálezem na CT hrudníku, u které se objevil levostranný chylotorax s odstupem tří týdnů po provedené splenektomii. I když po splenektomii nebyl dosud rozvoj CHT popsán, autoři předpokládají etiologickou souvislost spolu s abnormitou lymfatik, podmíněnou základním onemocněním. Nemocná byla úspěšně léčena chemoterapií, opakovanými torakocentézami a enterální výživou s obsahem triglyceridů se středně dlouhými řetězci (6).
Chylotorax spolu s chylosním ascitem byl popsán u chronicky hemodialyzovaného pacienta s konstriktivní perikarditidou. Po provedené perikardektomii došlo u nemocného ke spontánní rezoluci ascitu i CHT. Histopatologický nález resekovaného perikardu prokázal pouze chronické nespecifické zánětlivé změny, předpokládaná tuberkulózní etiologie nebyla potvrzena. Rozvoj CHT je v tomto případě přisuzován zvýšené kapilární filtraci na podkladě vzestupu centrálního žilního tlaku a omezené lymfatické drenáži na podkladě vzestupu tlaku v levé podklíčkové véně (13).
Inflamatorní karcinom, který byl poprvé popsán Kuttnerem v roce 1924, je vzácným typem metastatického kožního postižení u malignity vnitřních orgánů. Projevuje se vznikem erytému, edému a akutních zánětlivých kožních změn charakteru celulitidy. Autoři popisují případ 58 let ženy s anamnézou karcinomu uteru, který byl radikálně řešen hysterektomií. S odstupem 10 let se u nemocné objevil erytém a lymfedém genitálu, který postupně dále progredoval na dolní končetiny, břišní stěnu a dorzální partie trupu. Byla provedena biopsie kůže s nálezem infiltrace kožních lymfatik atypickými buňkami adenokarcinomu, následně byl při gastrofibroskopii verifikován karcinom. Skiagram hrudníku byl bez patologického nálezu. V dalším průběhu došlo u nemocné k rozvoji masivního oboustranného chylotoraxu, v té době už byl také patrný edém a erytém kůže břicha a hrudníku. CT hrudníku neprokázalo lymfadenopatii či přítomnost nitrohrudní tumorózní masy. Autoři předpokládají, že příčinou rozvoje oboustranného objemného chylotoraxu byla masivní infiltrace kožních a podkožních lymfatik hrudní stěny inflamatorním karcinomem spolu s obstrukcí DT v celém jeho rozsahu (14).
Trombotická okluze axilární, podklíčkové, brachiocefalické a horní duté vény se především po zavedení centrálního žilního katetru objevuje poměrně často, v souvislosti s implantací pacemakeru je však popsána zcela ojediněle. Autoři popisují raritní výskyt levostranného CHT, který vznikl na podkladě izolované trombózy levé brachiocefalické žíly u 78 letého muže s odstupem šesti let po implantaci pacemakeru pro sick sinus syndrom. Vzhledem k věku byl CHT ošetřen talkáží pleurální dutiny, trombóza brachiocefalické žíly byla řešena venoplastikou (15).
Gorhamova nemoc (lymfohemangiom) je vzácné onemocnění podmíněné destruktivní proliferací krevních a lymfatických kapilár. V kostní lokalizaci se projevuje masivní osteolýzou s náhradou angiomatózní tkání, postižena může být okolní svalová a pojivová tkáň i vnitřní orgány. Onemocnění může být komplikováno vznikem chyloperikardu či chylotoraxu, které mohou nemocného ohrozit na životě, stejně tak jako destrukce skeletu, zvláště je li onemocněním postižena páteř. Při postižení žeber, lopatek či hrudních obratlů se CHT objevuje až u 17 % nemocných. Podkladem je přímý průnik tumoru do pleurální dutiny nebo invaze do DT. Bez chirurgické intervence je mortalita u těchto nemocných popisována až v 64 %. Nedílnou součástí léčby je také RT (5).
Hyperplazie lymfatické tkáně byla poprvé popsána Castlemanem v roce 1956. Onemocnění může být zcela benigní, lokalizované, asymptomatické, náhodně zachycené na skiagramu hrudníku, kde se projevuje jako mediastinální adenopatie. Multicentrická forma je však agresivní onemocnění se systémovými projevy, která vyžaduje intenzivní chemoterapii, přesto je medián přežití pouze 26 měsíců. Vznik pleurálního i perikardiálního výpotku byl u Castlemanovy choroby popsán opakovaně, výskyt chylotoraxu je však zcela ojedinělý. Nejpravděpodobnější příčinou je lokální komprese lymfatik znemožňující drenáž do DT (3).
Pseudochylotorax – etiologie, patofyziologie
PCHT lze definovat jako přítomnost chyliformního sekretu v pleurální dutině. Makroskopicky se jedná o mléčně zkalený opaleskující sekret, což je podmíněno vysokým obsahem cholesterolu, cholesterolových krystalů a lecitin-globulinových komplexů. Chylomikrony nejsou přítomny. Výskyt PCHT je relativně vzácný.
Nejčastější příčinou vzniku PCHT je tuberkulóza (60 %). S PCHT se nejčastěji setkáváme u nemocných anamnesticky léčených pro tuberkulózu kurativním pneumotoraxem s následným chronickým pleurálním výpotkem. Z toho vyplývá i pokles výskytu PCHT v posledních letech. Vzhledem k tomu, že však celosvětově dochází k nárůstu rezistentních forem tuberkulózy, kdy se v některých případech opět začala k léčbě užívat kolapsoterapie, lze očekávat vzestup počtu PCHT z těchto příčin (7).
Podstatně méně častou příčinou je revmatoidní artritida. Z ostatních příčin se uplatňuje trauma s následných krvácením do pleurální dutiny, chronický a špatně léčený hrudní empyém a v podstatě všechny stavy, které jsou spojeny s chronickým pleurálním výpotkem jako malignity, paragonimóza, syfilis.
Patofyziologie vzniku PCHT není zcela objasněna. U většiny nemocných je přítomna pachypleura a dlouhodobě perzistující fluidotorax. Průměrná doba vzniku PCHT u chronického výpotku je přibližně 5 let, ale jeho vznik byl popsán i po roce. Typicky se jedná o opouzdřený fluidotorax krytý masivní pachypleurou. Vazivo pachypleury je minimálně vaskularizováno, takže vázne absorpce jakýchkoliv součástí sekretu a z toho pravděpodobně vyplývá vysoká koncentrace cholesterolu. Původně se předpokládalo, že cholesterol pochází především z rozpadlých bílých a červených krvinek. V současnosti jsou za jeho hlavní zdroj považovány sérové lipoproteiny (7). Sérové hladiny cholesterolu bývají u nemocných v normě. PCHT bývá většinou jednostranný, bez predilekce, ale popsán byl i bilaterální (tab. 2).
Table 2. Diferenciání diagnóza chylotoraxu a pseudochylotoraxu 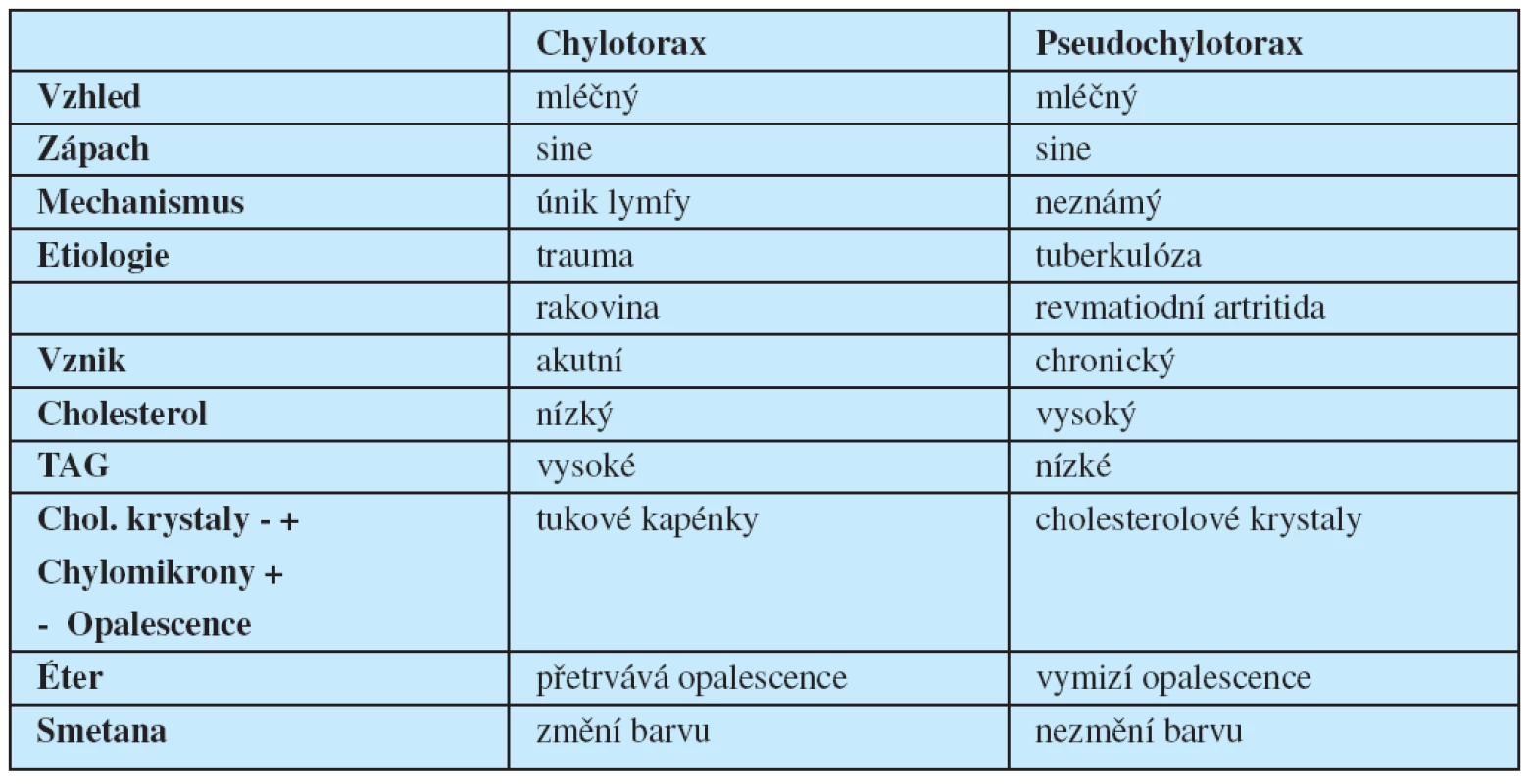
Pseudochylotorax – příznaky, diagnóza
Příznaky jsou podmíněny základním onemocněním a změnami plicních funkcí podmíněnými přítomností chronického výpotku a pachypleury. Diagnóza a diferenciální diagnóza není obtížná. Zcela jednoznačným průkazem je nález cholesterolových krystalů, i když se nemusí ve výpotku vyskytovat vždy. Koncentrace cholesterolu ve výpotku zpravidla několikanásobně převyšuje koncentraci v séru, zatímco hladina TAG bývá nízká. V případě diagnostických rozpaků je na místě provedení lipoproteinové elektroforézy, PCHT neobsahuje chylomikrony.
Pseudochylotorax – terapie
PCHT představuje zpravidla benigní záležitost, často náhodně zjištěnou. Intervence je namístě u symptomatických nemocných, tam, kde dochází k výrazné progresi fluidotoraxu. Namístě je torakocentéza, která může být vzhledem k přítomnosti masivní, často kalcifikované pachypleury obtížná. Pachypleura zabraňuje rozvinutí plíce, dochází ke vzniku podtlaku, doplňování sekretu je běžné. Hrudní drenáž je riziková – rozvinutí plíce nelze vzhledem k masivní, kalcifikované pachypleuře očekávat, a vzniklý defekt bývá podkladem perzistující pleurokutánní píštěle. Dekortikace z již uvedených důvodů prakticky nepřichází v úvahu, rozvinutí plíce a obnovení její funkce nelze očekávat.
Velmi závažné a obtížně kurabilní jsou komplikace:
- rozvoj respirační insuficience,
- nespecifická infekce pleurální dutiny,
- reaktivace tuberkulózy či aspergillová infekce, a
- vznik bronchopleurální a pleurokutánní píštěle.
Namístě je léčba základního onemocnění, možnosti terapie pleurální komplikace jsou výrazně omezené. V úvahu přichází nejspíše torakostomie s možností přímého lokálního ošetření pleurální dutiny a eventuální bronchopleurální píštěle. Torakostomie může být provedena jako výkon definitivní, nebo následně po detoxikaci nemocného a zlepšení klinického stavu může být doplněna o torakoplastiku, která spolu s uzávěrem stomie vede k likvidaci perzistujícího prostoru a vyléčení nemocného. Oba výkony jsou mutilující, výrazně prodlužují morbiditu a vyžadují zpravidla dlouhodobou hospitalizaci.
Léčba antituberkulotiky (AT) je na místě u nemocných s pozitivním nálezem Mykobakteria tuberkulózy, ale také u nemocných s anamnesticky proběhlou plicní tuberkulózou, kteří nikdy nebyli léčeni AT (7).
Vlastní pozorování
Kazuistika č.1
Osmdesáti čtyřletá nemocná byla přijata na naši kliniku v květnu 2006. Před 10 lety byla u nemocné diagnostikovaná chronická lymfatická leukémie. Nemocná byla několik let léčena Leukeranem a systémovými kortikosteroidy, došlo ke stabilizaci stavu, dále již nemocná pouze docházela na pravidelné kontroly na hematologii. Jinak byla osobní anamnéza nemocné negativní.
Koncem dubna prodělala pacientka virový infekt, následně pozorovala postupně progredující dušnost. Pro dušnost a zhoršení celkového stavu byla zprvu hospitalizována na interní klinice, kde byl zjištěn pravostranný fluidotorax. Opakovaně byla provedena hrudní punkce, celkově bylo evakuováno 5 500 ml sekretu. Biochemicky byl výpotek charakteru exsudátu, podrobnější vyšetření nebylo provedeno. Následně byla nemocná k další diagnostice a léčbě přeložena na naši kliniku.
Při přijetí udávala nemocná subjektivně pouze námahovou dušnost, objektivně byla afebrilní, klidově eupnoická, kardiopulmonálně kompenzovaná. Při vyšetření hrudníku bylo vpravo výrazně oslabené dýchání, poklepově ztemnění až k dolnímu úhlu lopatky, zde byla rovněž oslabená bronchofonie a fremitus pectoralis. Vlevo bylo pouze lehce oslabené dýchání při bazi s drobným poklepovým přikrácením.
Laboratorní parametry byly většinou v mezích normy až na nižší hodnotu celkové bílkoviny v séru (56 g/l), hodnota albuminu byla v normě. Sérová hodnota cholesterolu byla snížená (3,1 mmol/l), triglyceridy byly v normě (1,4 mmol/l). Zánětlivé parametry byly nízké C reaktivní protein (CRP) 9,4 mg/l. V krevním obraze byla dosti výrazná anémie (hemoglobin 88 g/l) a trombocytopénie, leukocyty byly v normě včetně diferenciálního rozpočtu. Koagulační parametry byly v normě.
Na skiagramu hrudníku bylo patrno syté zastínění dolního a částečně středního pole vpravo a drobné pleurální zastření nad levou bazí (obr. 1).
Image 1. Vstupní skiagram hrudníku s patrným pravostranným pleurálním zastřením. 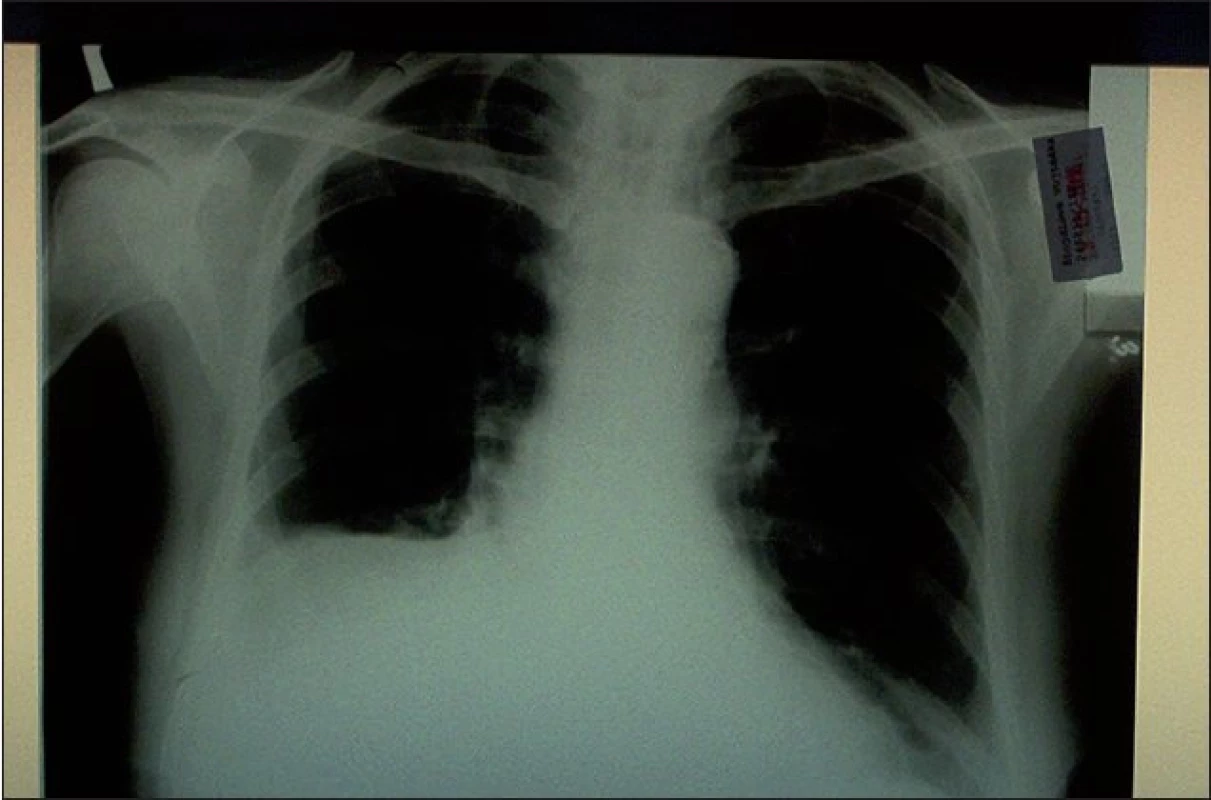
U nemocné byla po probatorní hrudní punkci zavedena hrudní drenáž. Postupně bylo evakuováno značně množství fluidotoraxu (800..700..700..500..300 ml) bělavého, mírně zkaleného, opaleskujícího sekretu (obr. 2). Evakuovaný výpotek byl bakteriologicky negativní, BK mikroskopicky a kultivačně negativní, cytologicky méně buněčný, lymfomesoteliálního typu, biochemicky charakteru exsudátu s obsahem bílkoviny 35 g/l, cholesterolu 1,1 mmol/l a triglyceridů 7,2 mmol/l.
Image 2. Skiagram hrudníku po evakuaci výpotku s patrným zavedeným hrudním drénem. 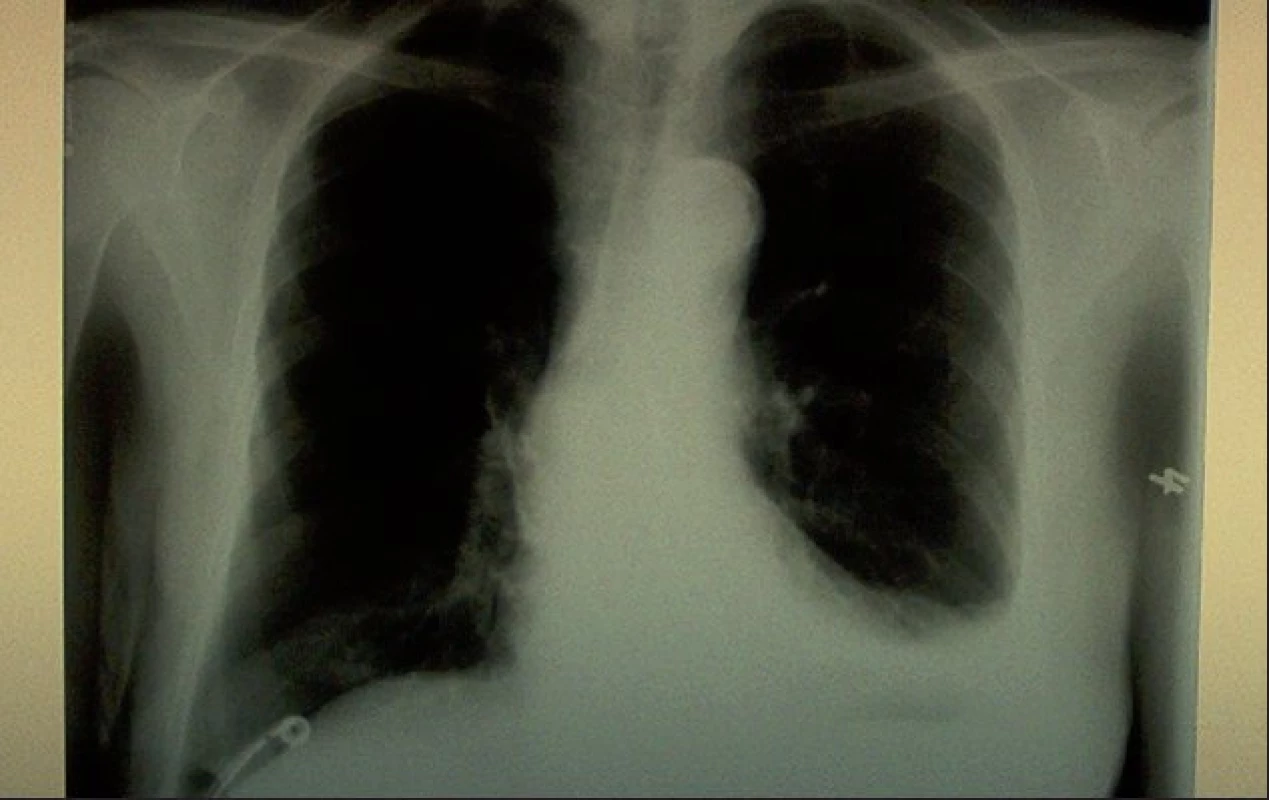
Nemocná byla komplexně přešetřena: respirační parametry byly v mezích normy, při spirometrickém vyšetření byla zachycena středně těžká restriktivní ventilační porucha. Při bronchoskopickém vyšetření byl endobronchiální nález v mezích normy, stejně tak provedené CT vyšetření hrudníku popisovalo pouze pleurální zastření bez dalších patologií. Echokardiografický nález byl normální, ultrasonografie (USG) břicha prokázala mírnou splenomegalii a zvětšenou lymfatickou uzlinu (20 x 16 mm) při hilu jaterním. USG krčních tepen byla bez nálezu významné stenózy, současně však byla zjištěna krční lymfadenopatie – četné uzliny variabilní velikosti.
Vzhledem k makroskopickému vzhledu výpotku, výsledkům biochemického vyšetření pleurálního sekretu a výsledkům provedených vyšetření jsme výpotek hodnotili jako chylotorax, velmi pravděpodobně související se základním hematologickým onemocněním.
Vzhledem k věku a celkovému stavu byl operační výkon (VATS s mechanickou a chemickou pleurodézou) pro nemocnou rizikový, proto byla po evakuaci sekretu provedena pleurodéza intrapleurální instilací suspenze talku zavedeným hrudním drénem (obr. 3).
Image 3. Skiagram hrudníku po provedené talkáži a exdrenáži. 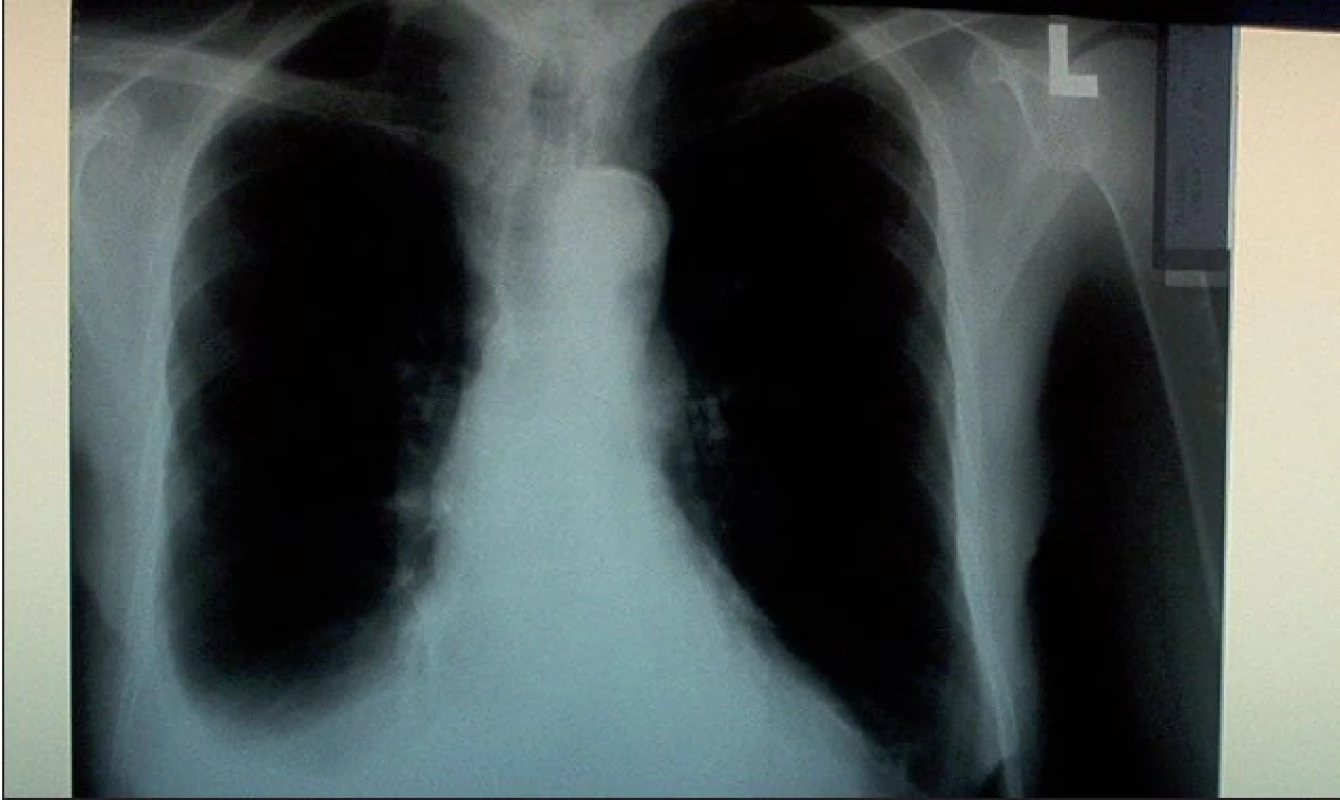
Nemocná byla dimitována v uspokojivém celkovém stavu, kontrolní spirometrické vyšetření prokázalo při dimisi výrazné zlepšení ventilační parametrů (lehká restrikce). Pacientka je nadále sledována v ambulanci pleurálních komplikací naší kliniky. S odstupem 3 měsíců došlo k částečnému doplnění pravostranného fluidotoraxu, vlevo se výpotek spontánně resorboval (obr. 4).
Image 4. Skiagram hrudníku 3 měsíce po dimisi s patrnou progresí pravostranného fluidotoraxu 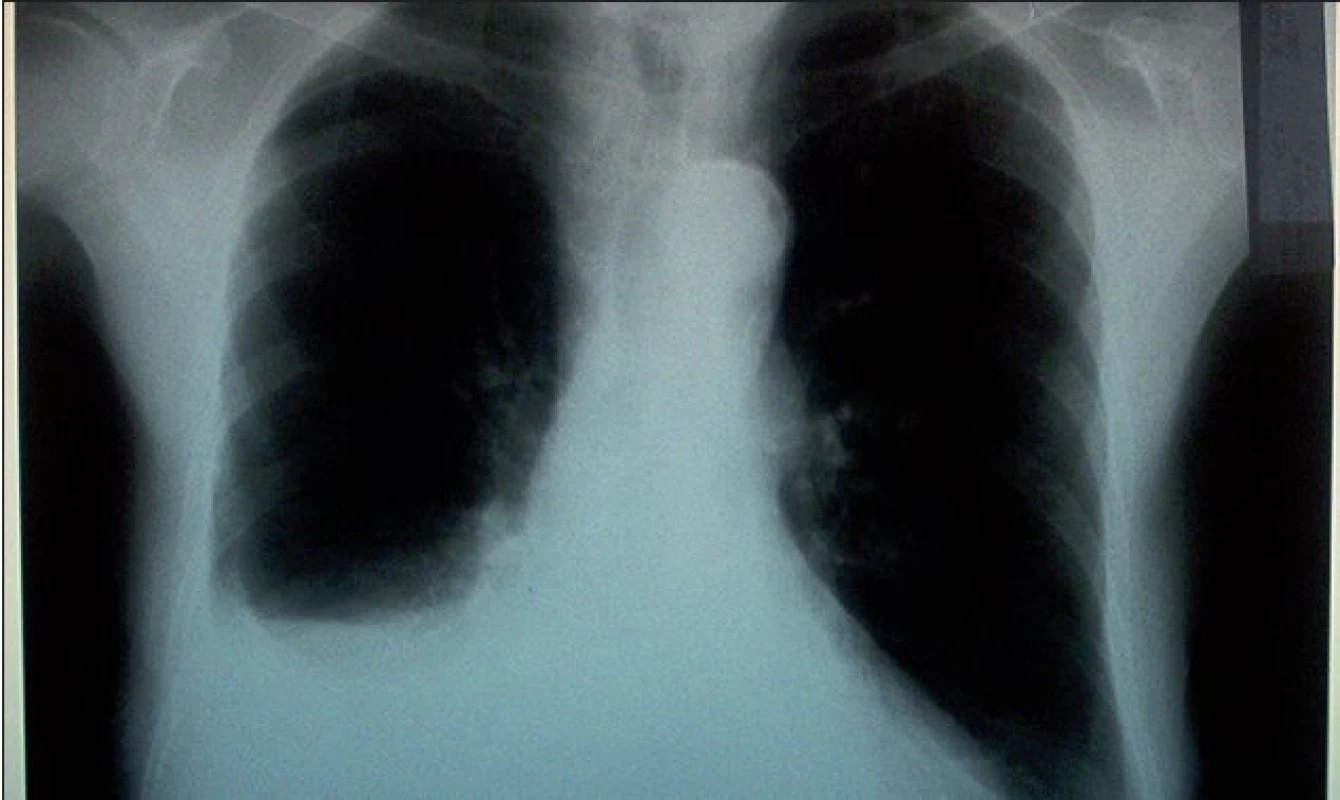
Efekt pleurodézy lze tedy hodnotit pouze jako částečný. Nemocná dochází na evakuační hrudní punkce tč. přibližně v intervalu 3 měsíců, vždy je jednorázově evakuováno 1 200–1 500 ml sekretu. Celkový stav nemocné je dobrý.
Kazuistika č. 2
Sedmdesáti pětiletá, výrazně obézní nemocná s hypertenzní a ischemickou chorobou v anamnéze byla přijata na naši kliniku pro pravostranný fluidotorax nejisté etiologie. Od prosince 2007 pozorovala nemocná postupně progredující dušnost. Na provedeném skiagramu hrudníku bylo vpravo patrno rozsáhlé pleurální zastření, zjištěn objemný fluidotorax, nemocná byla hospitalizována na plicním oddělení. Zde byla provedena hrudní punkce, jednorázově bylo evakuováno 1 600 ml výpotku vzhledu vaječného koňaku, podrobnější vyšetření provedeno nebylo a nemocná byla s diagnózou suspektní hrudní empyém přeložena na naši kliniku.
Při přijetí byla nemocná bez výraznějších subjektivních obtíží, objektivně výrazně obézní, afebrilní, eupnoická, kardiálně kompenzovaná. Poslechově pouze lehce oslabené dýchání nad pravou bazí hrudní, zde i drobné poklepové přikrácení.
Laboratorní parametry byly převážně v mezích normy, lehce snížené byly renální funkce, zánětlivé parametry byly nízké CRP 4,0 mg/l, hodnoty triglyceridů v séru 3,4 mmol/l. Provedený glykemický profil potvrdil čerstvý záchyt diabetu. Krevní obraz byl v mezích normy. Výsledky tumorových markerů byly negativní s výjimkou lehce zvýšené hodnoty beta 2 mikroglobulinu (5,2 mg/l)
Na skiagramu hrudníku bylo patrno pouze drobné zastření v pravém dolním plicním poli. Byla provedena probatorní hrudní punkce, evakuováno bylo 200 ml světle žlutého, opaleskujícího sekretu, výpotek se v průběhu hospitalizace výrazněji nedoplňoval.
Bakteriologická vyšetření sekretu byla negativní, cytologicky byl výpotek lymfocytárního typu, bez záchytu maligních elementů, biochemicky charakteru exsudátu s obsahem bílkoviny 38 g/l a koncentrací triglyceridů 8,9 mmol/l. Vzhledem k vyšší hodnotě beta 2 mikroglobulinu jsme pomýšleli v diferenciální diagnostice především na lymfom, proto byla provedena i průtoková cytometrie výpotku s nálezem 80 % lymfocytů z leukocytů, avšak bez monoklonálního zastoupení. Mantoux ÍI byl negativní stejně jako QuantiFERON TB Gold, rovněž kompletní imunologické vyšetření neprokázalo závažnější patologie. Respirační a ventilační parametry byly v normě.
Nemocná absolvovala celou řadu vyšetření: bronchoskopické vyšetření, CT hrudníku, USG břicha, echokardiografické vyšetření, gynekologické, hematologické a kardiologické vyšetření, nepřímou lymfoscintigrafii, výsledky všech provedených vyšetření však byly negativní nebo z hlediska etiologie nepřínosné (mírná hepatomegalie a hepatopatie charakteru steatózy dle USG břicha).
Na podkladě provedených vyšetření jsme stav hodnotili jako idiopatický chylotorax až do obdržení výsledků CT břicha, kde byl překvapením (vzhledem k negativnímu nálezu nepřímé lymfoscintigrafie a USG břicha) nález rozsáhlé tumorózní expanze 12 x 10 x 8 cm retroperitoneálně vpravo.
Diferenciálně diagnosticky byl na prvním místě dle charakteru nálezu zvažován lymfom. Nemocná byla indikována k provedení transparietální punkce tumoru retroperitonea, následně byl histologicky verifikován velkobuněčný lymfom. V současnosti je nemocná v péči hematologického pracoviště.
Závěr
Chylotorax a pseudochylotorax představují relativně vzácný typ pleurálního výpotku. Přes uniformní makroskopický vzhled je etiopatogeneze velmi pestrá a stanovení příčiny onemocnění obtížné. V řadě případů, zvláště u chylotoraxu, bývá podkladem závažné onemocnění a rovněž samotný chylotorax může nemocného bezprostředně ohrozit na životě. Rychlé komplexní přešetření nemocného se tak stává nezbytné pro volbu optimálního terapeutického postupu.
MUDr. Pavla Žáčková
Pneumologická klinika 1. LFUK
Fakultní Thomayerovy nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4
E mail: pavla.zackova@ftn.cz
Sources
1. Adnan, H., Allaham, M.D., Anthony, L. et al. Chylothorax complicating repais of the descending and thoracoabdominal aorta. Chest 2006, 130, p. 1138-1142.
2. Bakakos, P., Toumbis, M., Rasidakis, A. Chylothorax and pseudochylotorax. In: Pleural Disease. New York: Marcel Dekker, Inc. 2004, p. 943-958. ISBN 0-8247-4027-0.
3. Blankenship, M.E., Rowlet, J., Timby, J.W. et al. giant lymph node hyperplasia (Castleman’s Disease) presenting with chylous pleural effusion. Chest 1997, 112, p. 1132-1133.
4. Bonn, J., Sperling, D., Walinsky, P. et al. Percutaneous embolization of thoracic duct injury. Circulation 2000, 102, p. 268-271.
5. Duffy, B.M., Manon, R., Patel, R. et al. A case of Gorham‘s disease with chylothorax treated curatively with radiation therapy. Clinical Medicine Research, No. 2, p. 83-86.
6. Ferreira Da Cunha, D., Dos Santos, V. M., Freire De Carvalho Da Cunha, S., et al. Chylothorax in hairy cell leukemia. Medicina 1999, 59, p. 83-85.
7. Hillerdal, G. Chylothorax and pseudochylothorax. Eur. Respir. J. 1997, 10, p. 1157-1162.
8. Koksal, N., Demir, S., Okan, M. et al. Congenital chylothorax. Turk. J. Med. Sci. 2000, 30, p. 307-309.
9. Le Pimpec-Barthes, F., D’Attellis, N., Dujon, A. et al. Chylothorax complicating pulmonary resection. J. Pediatr. 2000, 136 p. 653-658.
10. Murphy, M.C., Newman, B.M., Rodgers, B.M. Pleuroperitoneal shunts in the management of persistant chylothorax. Ann. Thorac. Surg. 1989, 48, p. 195-200.
11. Nagar Arpit, M., Bhatgadde Veena, L., Raut Abhíjít, A., Narlawar Ranjeet, S. Skeletal lymphangiomatosis with chylous pleural effusion. J. Radiol. 2003 [on line]. Dostupný na http://www.jra-diology.com/arts/56.pdf [cit. 2008-05-06].
12. Plummer, J. M., Mc Farlane, M., Mc Donald, A. Chylous ascites associated with chylothorax: An unusual sequlae of penetrating abdominal trauma. J. Chin. Clin. Med. 2007, 2(3), p. 178-180.
13. Riza Altiparmak, M., Avar, S., Yanik, S. Chylous ascites and chylothorax due to constrictive pericarditis in a patient undergoing hemodialysis. J. Med. 2004, 2, p. 59-61.
14. Shibata, K., Kitagawa, S., Fujimura, M., Matsuda, T. Chylothorax associated with inflammatory carcinoma. Inter. Med, No. 6, p. 538-541.
15. Thomas, R., Christopher, D.J., Roy, A. et al. Chylothorax following innominate vein thrombosis – a rare complication of transvenous pacemaker implantation. Respiration 2007, 74, p. 338-340.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2008 Issue 6-
All articles in this issue
- Poúrazové degenerativní změny zápěstního kloubu „SLAC (SNAC) wrist“
- Analgetika – současné trendy v léčbě bolestí hlavy
- Zácpa a praktický lékař – fakta a mýty
- Klinické příznaky zhoubných nádorových onemocnění
- Náhlé příhody vyvolané tabákem a praktický lékař
- Riziko kardiovaskulárních příhod při sledování fotbalových zápasů
- Jak se stárne na střední Moravě?
- Chylotorax a pseudochylotorax: diferenciální diagnostika a současné terapeutické možnosti
- Historie prenatální diagnostiky Downova syndromu v České republice
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinické příznaky zhoubných nádorových onemocnění
- Zácpa a praktický lékař – fakta a mýty
- Poúrazové degenerativní změny zápěstního kloubu „SLAC (SNAC) wrist“
- Chylotorax a pseudochylotorax: diferenciální diagnostika a současné terapeutické možnosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

