-
Medical journals
- Career
Akutní toxická hepatitida po bylinném přípravku
Authors: I. Hejlová 1; J. Šperl 1; S. Fraňková 1; D. Kamenář 1; E. Sticová 2; J. Špičák 1
Authors‘ workplace: Klinika hepatogastroenterologie Přednosta: prof. MUDr. Julius Špičák, CSc. ; Pracoviště klinické a transplantační patologie Přednosta: MUDr. Eva Honsová, Ph. D. Institut klinické a experimentální medicíny, Praha Ředitel: doc. MUDr. Jan Malý, CSc. 2
Published in: Prakt. Lék. 2008; 88(2): 108-110
Category: Case Report
Overview
Akutní toxické hepatitidy mohou být následkem užívání řady léků, jsou však popsány i po bylinných přípravcích. V naší kazuistice prezentujeme případ akutní toxické hepatitidy po užívání bylinného doplňku stravy za účelem léčby psoriázy. I přes rozšířený mýtus o neškodnosti mohou bylinné přípravky stejně jako ,,klasické‘‘ léky vyvolávat závažné nežádoucí účinky.
Klíčová slova:
hepatotoxicita, bylinný přípravek.Úvod
Užívání bylinných přípravků je celosvětově velmi rozšířené, zejména proto, že jsou považovány za přírodní, a tedy prosté vedlějších účinků. V literatuře je však popsána celá řada případů jejich hepatotoxicity i dalších toxických účinků (1–11).
Od klasických léků se bylinné přípravky liší v mnoha ohledech. Většinou obsahují směs účinných látek, které jsou přítomny v nečisté formě a nízkých koncentracích, dále jsou v nich často přítomny další složky doplňující léčebný účinek. Složení bylinného přípravku může být problematické při chybné identifikaci byliny či při kontaminaci přípravku mikroorganismy, mykotoxiny, těžkými kovy či pesticidy. Výsledný produkt může být ovlivněn i variabilitou sběru a výroby či nízkou stabilitou účinných látek.
Většina bylinných přípravků spadá do kategorie doplňků stravy, výrobce tedy není povinen prokázat jejich účinnost ani bezpečnost (6). Klinické studie hodnotící účinnost a bezpečnost bylinných doplňků stravy nejsou k dispozici a většina informací o toxicitě bylin je založena na jednotlivých kazuistikách.
Charakter i tíže jaterního poškození vyvolaného toxicitou bylin jsou velmi široké, od mírného asymptomatického zvýšení aktivity jaterních enzymů, přes akutní hepatitidu, cholestázu prostou či doprovázenou hepatitidou, venookluzivní nemoc jater, chronickou hepatitidu s progredující fibrózou až cirhózou jater, až po fulminantní jaterní selhání vyžadující ortotopickou transplantaci jater.
Pro akutní toxickou hepatitidu bývá typická rychlá úprava po vysazení noxy, v tomto případě po skončení užívání bylinného přípravku. Potvrzením příčinné souvislosti mezi užíváním bylinných přípravků a poškozením jater by byla recidiva po opětném užívání přípravku, což samozřejmě nelze pacientovi z etických důvodů doporučit.
V literatuře lze nalézt celou řadu kazuistických sdělení popisujících hepatotoxický účinek mnohých bylin. Nejčastěji bývají zmiňovány čínské bylinné směsi (např. obsahující Lycopodium, Ephedra, Paenia, atd.), byliny obsahující pyrolizidinové alkaloidy vedoucí k rozvoji venookluzivní nemoci jater (např. kostival lékařský), vlaštovičník větší, kava, senna, serenoa repens (součástí směsí určených k léčbě benigní hyperplazie prostaty) a mnohé další. V nedávno publikovaných sděleních (6) bylo popsáno 25 případů akutní toxické hepatitidy v souvislosti s užíváním doplňků stravy za účelem redukce tělesné hmotnosti.
Vlastní pozorování
Šedesátiletý muž byl poprvé vyšetřen na našem pracovišti v únoru 2007. Od mládí se léčil pro psoriázu, před 8 lety prodělal laparoskopickou cholecystektomii pro litiázu. Kromě minimálního množství hydrokortisonové masti na drobná ložiska psoriázy na loktech a hýždích neužíval žádné jiné léky. Mnoho let pil jen 1 pivo denně k jídlu, abúzus alkoholu rezolutně popíral.
V únoru roku 2007 pacient užíval tzv. „léčebnou kůru č. 10“ za účelem léčby lupénky a zlepšení funkce jater. Jednalo se o kombinaci bylinných tinktur a alkoholových extraktů z pupenů bylin ve složení pýr plazivý, bříza, ostropestřec mariánský a jalovec obecný. Množství užívaného přípravku bylo řádově v kapkách, postupně byly zkombinovány všechny složky.
Po 10 dnech užívání přípravku pacient zpozoroval ztmavnutí moči, po dalších 2 dnech se přidal ikterus, pruritus a světlejší stolice. Nejdříve byl pacient vyšetřen na infekčním oddělení jiné nemocnice, kde laboratorně dominoval ikterus (celkový bilirubin 238,0 μmol/l), zvýšená aktivita aminotransferáz (AST 7,0 μμkat/l, ALT 16,0 μμkat/l) i cholestatických enzymů (ALP 4,5 μμkat/l, GMT 13,0 μμkat/l). Ostatní syntetické funkce jater byly normální. Po vyloučení virových hepatitid A, B a C byl pacient dále vyšetřován ambulantně. Po ukončení užívání extraktů došlo k rychlému poklesu aktivity aminotransferáz, ale dále progredoval ikterus až na hodnotu celkového bilirubinu 282,0 μμmol/l, proto byl pacient odeslán k hospitalizaci na naše pracoviště.
Při přijetí na naše pracoviště již byla aktivita aminotransferáz výrazně nižší (AST 0,9 μμkat/l, ALT 2,4 μμkat/l), přetrvávala zvýšená aktivita cholestatických enzymů (ALP 5,8 μμkat/l, GMT 4,2 μμkat/l), ikterus dále progredoval až na hodnotu celkového bilirubinu 296,0 μμmol/l. Kromě virových hepatitid jsme vyloučili i autoimunní hepatitidu (absence hypergamaglobulinémie, negativita autoprotilátek ANA, SMA, LKM, AMA), normální byly i parametry metabolismu železa a onkomarkery (CEA, AFP, CA 19-9). Pozitivní byly pouze ANCA protilátky. Při sonografii epigastria nebyla patrna dilatace žlučových cest, proto jsme ERCP vyšetření neindikovali. Na USG nebyly popsány ani známky portální hypertenze. Provedli jsme necílenou jaterní biopsii, histologický obraz byl patologem uzavřen jako akutní hepatitida s cholestázou a s částečnou destrukcí stěny portálních žlučovodů. Patolog na první místo v diferenciální diagnóze uvedl toxickou etiologii popsaných změn.
Image 1. Mikroskopický obraz biopsie jater. Cholestatická hepatitida s částečnou destrukcí stěny portálních žlučovodů 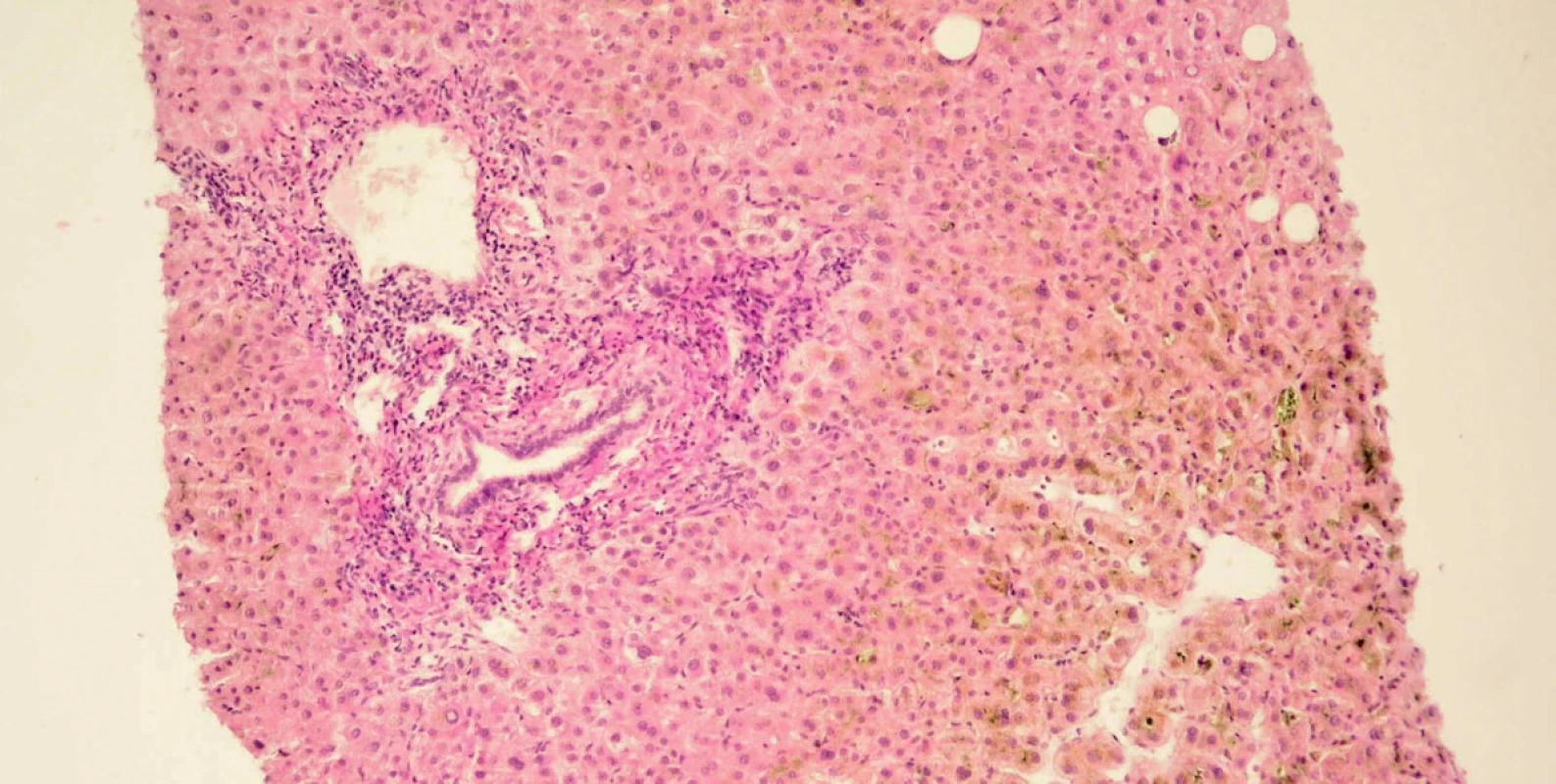
Pacientovi jsme podávali kyselinu ursodeoxycholovou, N-acetylcystein a cholestyramin. Při této terapii dále pokračoval rychlý pokles aktivity aminotransferáz a pozvolný pokles aktivity cholestatických enzymů, postupně regredoval i ikterus a pruritus. Během následného ambulantního sledování došlo během 2 měsíců k normalizaci prakticky všech laboratorních hodnot, která přetrvávala i po 7 měsících, kdy byla mírně zvýšená pouze aktivita GMT.
Table 1. Vývoj aktivity jaterních enzymů a jaterních funkcí v průběhu sledování; den 0 – poprvé vyšetřen po rozvoji ikteru 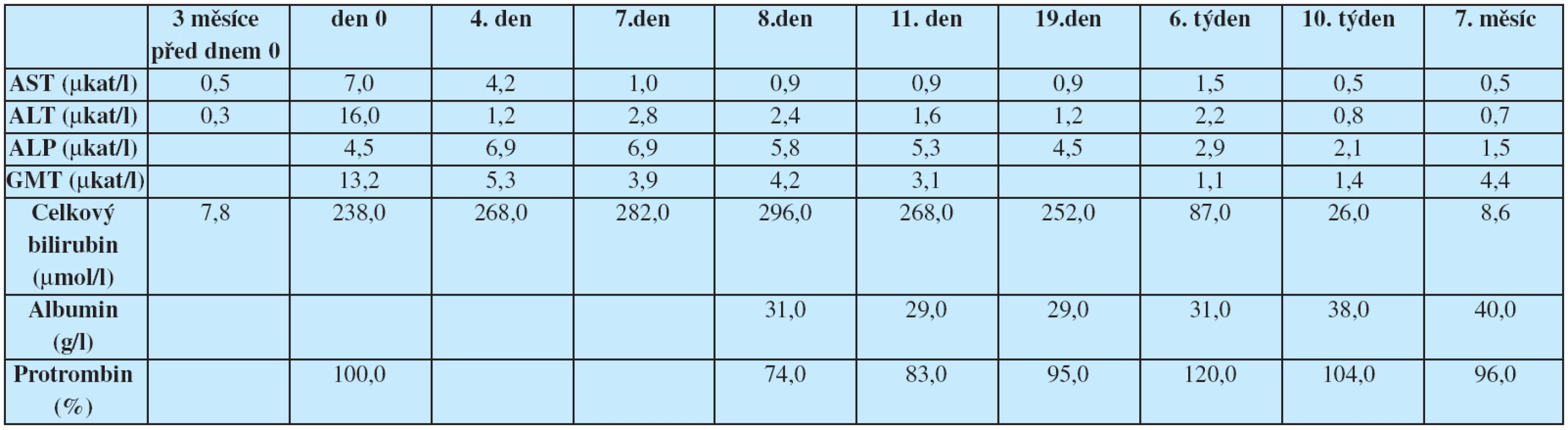
Diskuse
Užívaný bylinný přípravek považujeme u našeho pacienta za příčinu akutní toxické cholestatické hepatitidy. V souladu s mezinárodním konsensem kritérií pro poškození jater indukovaných léky (12) byla i v našem případě přítomna přímá časová souvislost užívání přípravku a rozvoje symptomatologie, ostatní možné příčiny jaterního poškození byly vyloučeny, a po ukončení užívání přípravku došlo k rychlé normalizaci laboratorních nálezů (kauzalita je velmi pravděpodobná při poklesu aktivity ALT o více než 50 % oproti maximu v průběhu 8 dní bez dalšího vzestupu aktivity ALT v průběhu měsíce po vysazení noxy, pravděpodobná při poklesu aktivity ALT o více než 50 % v průběhu měsíce po vysazení noxy při hepatocelulárním poškození, u chole-sta-tic-kého či smíšeného poškození je kauzalita pravděpodobná, pokud pokles aktivity ALP a/nebo celkového bilirubinu minimálně o 50 % nastane do 6 měsíců) (12).
Léky indukované poškození jater lze celkově rozdělit na jisté, pravděpodobné, možné či vyloučené; v našem případě se jednalo o pravděpodobné poškození jater vlivem léku (jiné noxy), o jisté poškození by se jednalo při rozvoji stejné symptomatologie po reexpozici, což jsme samozřejmě z etických důvodů neprováděli. Pro toxické poškození svědčila i jaterní biopsie.
Laboratorně na počátku dominovala vysoká aktivita GMT, která v mírnější podobě přetrvávala i 7 měsíců po ukončení užívání přípravku, což by mohlo vyvolat podezření na poškození jater vlivem užívání alkoholu. Nicméně zkušeným patologem nebyly změny v histologickém obraze popsány jako poškození jater alkoholem, proto tuto možnost považujeme za málo pravděpodobnou.
Jiné současné jaterní onemocnění typu primární sklerózující cholangitidy považujeme i přes pozitivitu ANCA protilátek za málo pravděpodobné pro normalizaci aktivity téměř všech jaterních enzymů po vysazení rostlinného přípavku a normální sonografický obraz jater. Pozitivní autoprotilátky mohou být dle literárních údajů prokazatelné při toxickém jaterním poškození i bez současného autoimunního onemocnění jater či žlučových cest (2, 9, 4).
Rozhodnutí, která z bylin či dokonce účinných látek měla za následek poškození jater, není možné učinit. V literatuře není ani jedna z obsažených bylin spojována s možnou hepatotoxicitou. Vzhledem k tomu, že se jedná o doplněk stravy, u něhož výroba, skladování a distribuce nepodléhá přísným normám standardních u léků, nelze zaručit přítomnost pouze uvedených bylin v požadované kvalitě. Toxicita mohla být zpúsobena příměsí jiných bylin, kontaminací jinými látkami či vznikem rozpadových produktů.
Jelikož většina bylinných přípravků spadá do kategorie doplňků stravy, nevztahuje se na ně zákonem stanovená povinnost hlášení nežádoucích účinků na SÚKL, jako je tomu u léků. Nežádoucí účinky doplňků stravy či podezření na nežádoucí účinek doplňku stravy mají být hlášeny na Státní zemědělskou a potravinářskou inspekci, která je k tomuto kompetentní.
Mnoho pacientů nepřizná užívání bylin, někdy dokonce ani po opakovaném cíleném dotazování, buď z důvodu, že byliny nepovažují za léky, nebo mají obavy, aby lékař jejich alternativní způsob léčby nezlehčoval. Řada případů hepatotoxicity bylin tak zůstává nepoznána (9).
Závěr
I přes rozšířený mýtus o neškodnosti mohou bylinné přípravky stejně jako ,,klasické‘‘ léky vyvolávat závažné nežádoucí účinky. V naší kazuistice prezentujeme případ akutní toxické hepatitidy po užívání zdánlivě neškodného bylinného doplňku stravy. Z důvodu nedostatečně standardizovaného složení a kvality bylinných doplňků stravy by lékař jejich užívání neměl doporučovat. Na trhu je dnes již řada bylinných přípravků registrovaných jako léky, jejichž složení i potenciální nežádoucí účinky jsou standardně sledovány, ty mohou být vhodnou alternativou pro pacienty vyžadující bylinné přípravky.
MUDr. Mgr. Irena Hejlová
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Víděňská 1958/9
140 21 Praha 4
E-mail: irena.hejlova@ikem.cz
Sources
1. Chitturi, S., Farrell, G.C. Herbal hepatotoxicity: An expanding but poorly defined problem. J. Gastroenterol. Hepatol. 2000, 15, p. 1093-1099.
2. Elinav, E., Pinsker, G., Safadi, R. et al. Association between consumption of Herbalife nutritional suplements and acute hepatotoxicity. J. Hepatol. 2007, 47, p. 514-520.
3. Ioannides, C. Pharmacokinetic interactions between herbal remedies and medicinal drugs. Xenobiotika 2002, 32, p. 451-478.
4. Kasper, H-U., Drebber, U., Hirsch, I., Dienes, H.P. Morphologische Veränderungen der medikamenteninduzierten Leberschädigung. Pathologe. 2006, 27, s. 175-181.
5. Pak, E., Esrason, T., Wu, Victor H. Hepatotoxicity of herbal remedies: an emerging dilemma. Prog. Transplant. 2004, 14, p. 91-96.
6. Schoepfer, A.M., Engel. A., Fattinger, K. Herbal does not mean innoculous: Ten cases of severe hepatotoxicity associated with dietary supplements from Herbalife products. J. Hepatol. 2007, 47, p. 521-526.
7. Shad, J.A, Chinn, C.G., Brann, O.S. Acute hepatitis after ingestion of herbs. South Med. J. 1999, 92, p. 1095-1097.
8. Stedman, C. Herbal hepatotoxicity. Semin. Liver. Dis. 2002, 22, p. 195-206.
9. Stickel, F., Egerer, G., Seitz, H.K. Hepatotoxicity of botanicals. Public Health Nutrition 2000, 3, p. 113-124.
10. Stickel, F., Patsenker, E., Schuppan, D. Herbal hepatotoxicity. J. Hepatol. 2005, 43, p. 901-910.
11. Willett, K.L., Roth, R.A., Walker, L. Hepatotoxicity assesment for botanical dietary supplements. Toxicol. Sci. 2004, 79, p. 4-9.
12. Benichou, C. Criteria of drug-induced liver disorders. Report of an International consensus meeting. J. Hepatol.1990, 11, p. 272-276
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2008 Issue 2-
All articles in this issue
- Transparentní zodpovědnost (accountability) v medicíně a zodpovědnost etických komisí
- Současné možnosti a problémy antiretrovirové terapie
- Etiopatogeneze autismu z pohledu buněčné a molekulární biologie
- Paměť a její poruchy
- Metalothionein a jeho vztah k protinádorové léčbě na bázi platinových komplexů
- Hodnocení dynamiky transportní funkce a remodelace levé srdeční síně po úspěšné endoskopické mikrovlnné epikardiální izolaci plicních žil. Pilotní studie.
- O lidech, kteří hromadí věci a zvířata
- Současné přístupy k očkování konjugovanou pneumokokovou vakcínou
- Akutní toxická hepatitida po bylinném přípravku
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Paměť a její poruchy
- Současné možnosti a problémy antiretrovirové terapie
- O lidech, kteří hromadí věci a zvířata
- Akutní toxická hepatitida po bylinném přípravku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

