-
Medical journals
- Career
Stručný přehled radioterapie karcinomu rekta
Authors: M. Foldyna; E. Voršilková; T. Büchler; J. Abrahámová
Authors‘ workplace: Fakultní Thomayerova nemocnice s poliklinikou, Praha ; Primář: Prof. MUDr. Jitka Abrahámová, DrSc. ; Onkologické oddělení
Published in: Prakt. Lék. 2008; 88(12): 718-721
Category: Of different specialties
Overview
Radioterapie je efektivní léčebnou karcinomu rekta. Předoperační ozáření v indikovaných případech snižuje riziko lokální recidivy a pravděpodobně vede k prodloužení celkového přežití o 10 %. Není však žádný důkaz toho, že k prodloužení přežití vede též ozáření pooperační. Zda-li je radiochemoterapie účinnější než samotná radioterapie, není plně prokázáno, protože výsledky publikovaných malých studiích jsou částečně konfliktní. V léčbě se záměrem paliativním poskytuje radioterapie signifikantní benefit.
Klíčová slova:
karcinom rekta, radioterapie, chemoradioterapie.Úvod
Radioterapie představuje stále nezastupitelnou metodu v léčbě karcinomu rekta. Oproti minulosti došlo však k posunu v sekvenci léčebných metod uplatňovaných v kurativní terapii rektálního karcinomu. Pooperační radioterapie uplatňovaná u nádorů T3 nebo N+ byla na základě klinických studií vytlačena radioterapií předoperační, poskytující oproti pooperačnímu ozáření signifikantní benefit.
Kromě předoperační radioterapie prováděné s kurativním záměrem se v klinické praxi uplatňuje též radioterapie paliativní v podobě ozáření pánve u lokálně pokročilých inoperabilních tumorů rekta nebo v podobě paliativního ozáření (analgetického, hemostyptického) inoperabilních metastáz.
Vedle nejčastěji prováděné teleterapie (zevního ozáření) přichází v úvahu též intraoperativní ozáření (v ČR neprováděné) a brachyterapie (ozáření z krátké vzdálenosti), která může být indikovaná k lokálnímu zvýšení dávky u inoperabilních nádorů.
Role radioterapie v léčbě karcinomu rekta
Systematickou revizí studií účinků radioterapie u karcinomu rekta provedl The Swedish Council of Technology Assessment in Health Care (SBU) (1). Tato syntéza literárních výsledků radioterapie karcinomu rekta vychází z údajů ze 42 randomizovaných studií a 3 meta-analýz. Navíc byla použita data 7 retrospektivních studií a 17 článků. Celkem byly zpracovány výsledky léčby 25 351 pacientů. Tyto výsledky byly srovnány s výsledky předchozí revize z r. 1996, zahrnující 15 042 pacientů.
Uvedené rezultáty mohou být sumarizovány takto:
Výsledky chirurgické léčby karcinomu rekta se zlepšily za posledních 10 let. Počet lokálních recidiv při 5-letém sledování poklesl z 28 % na 10–15% v nemocnicích, které přijaly koncept TME (total mesorectal excision). Předoperační ozáření biologickou dávkou nad 30 Gy snižuje relativní riziko lokální recidivy o více než polovinu (50–70 %). Pooperační ozáření snižuje riziko recidivy o 30–40% při použití dávek vyšších než dávek používaných předoperačně.
Jsou silné důkazy, že předoperační radioterapie je efektivnější než pooperační. Jsou důkazy, že předoperační radioterapie snižuje počet lokálních recidiv (z 8 na 2 % po 2 letech sledování) také při TME. Jsou silné důkazy, že předoperační radioterapie zlepšuje celkové přežití (o 10 %).
Naproti tomu nejsou žádné důkazy, že pooperační radioterapie zlepšuje celkové přežití. Jsou některé doklady, že pooperační radioterapie kombinovaná s konkomitantní chemoterapií vede k prodloužení přežití.
Předoperační radioterapie v adekvátních dávkách může být podána s malou akutní toxicitou. Vyšší a neakceptovatelná toxicita byla pozorována u předoperační radioterapie používající suboptimální techniky. Také pooperační radioterapie může však být podána s akceptovatelnou toxicitou. Dlouhodobé vedlejší účinky radioterapie jsou velmi omezené při použití adekvátní ozařovací techniky.
Peroperační radioterapie (přednostně předoperační) je rutinně doporučována pro většinu pacientů s karcinomem rekta, protože podstatně snižuje riziko lokální recidivy a zlepšuje přežití. U primárně inoperabilních tumorů předoperační radioterapie může způsobit regresi nádoru umožňující následnou operaci. Tato léčba je rutinně indikovaná. Předoperační radioterapie často kombinovaná s chemoterapií se používá ke zvýšení šance na sfinkter šetřící operace u nízko umístěných tumorů. V posledních evropských trialech týkajících se neoadjuvantní (předoperační) radioterapie u inoperabilních nádorů vedlo přidání chemoterapie na bázi 5-Fu (5-fluorourancilu) k signifikantně vyššímu nádorovému downstagingu, vyššímu počtu CR (kompletní remise) (<10 % se samostatnou radioterapií, 15–30 % s chemoradioterapií) a lepší lokální kontrole než samostatná radioterapie.
Tyto výsledky se ale nepromítly v benefit ve smyslu prodloužení DFS (disease free survival) a OS (overall survival), ani ve zvýšeném počtu sfinkter šetřících operací. Přidání další účinné látky k 5-Fu (mitomycin C, oxaliplatina, irinotecan) zvýšilo počet CR, ale ani tato strategie nevedla k prodloužení OS nebo DFS. Žádné alternativní frakcionační schéma se neukázalo lepší nežli radiochemoterapie a není žádný důkaz o benefitu dávek > 45 Gy (2).
Předoperační radioterapie
Zevní radioterapie je dle standardu SROBF (Společnost radiační onkologie, biologie a fyziky) indikována pro nádory rekta a rektosigmatu (3) s proximální hranicí ve vzdálenosti 20–25 cm od anu. Cílem předoperační radioterapie je zmenšení nádorového objemu (downstaging), zlepšení lokální kontroly a celkového přežití oproti pacientům s pooperační aplikací radioterapie.
Předoperační, neoadjuvantní radioterapie standardní frakcionací (tzn. 5x1,8–2,0 Gy/týden) je indikována u lokálně pokročilých nádorů T3 – T4 (Dukes B, C), v případě postižení lymfatických uzlin, u nízce sedících tumorů a dále u hraničně operabilních nebo inoperabilních nádorů. Operace má být provedena za 4–6 týdnů po skončení radioterapie, po zhojení akutní reakce a dříve, než se začne vytvářet tzv. late-effect (pozdní účinky záření – např. poradiační fibróza) a dříve, než dojde k opětovné progresi ozářeného nádoru. Ozáření se provádí obvykle do celkové dávky 44–50 Gy ve 22–25 frakcích. Cílový objem zahrnuje primární tumor s bezpečnostním lemem a se spádovými lymfatickými uzlinami (perirektální, presakrální, vnitřní ilické). Při šíření tumoru ventrálně (do prostaty, močového měchýře, dělohy, pochvy) mají být zahrnuty zevní, eventuálně společné ilické uzliny. U nádorů anorektálního přechodu a dolní 1/3 pochvy má cílový objem zahrnovat také inguinální uzliny, u nádorů s kaudální hranicí do 6 cm od anu též perineum (obr. 1–6).
Image 1. Plánovací CT vyšetření – předoperační ozáření karcinomu rekta cT3 NO MO – transverzální rovina 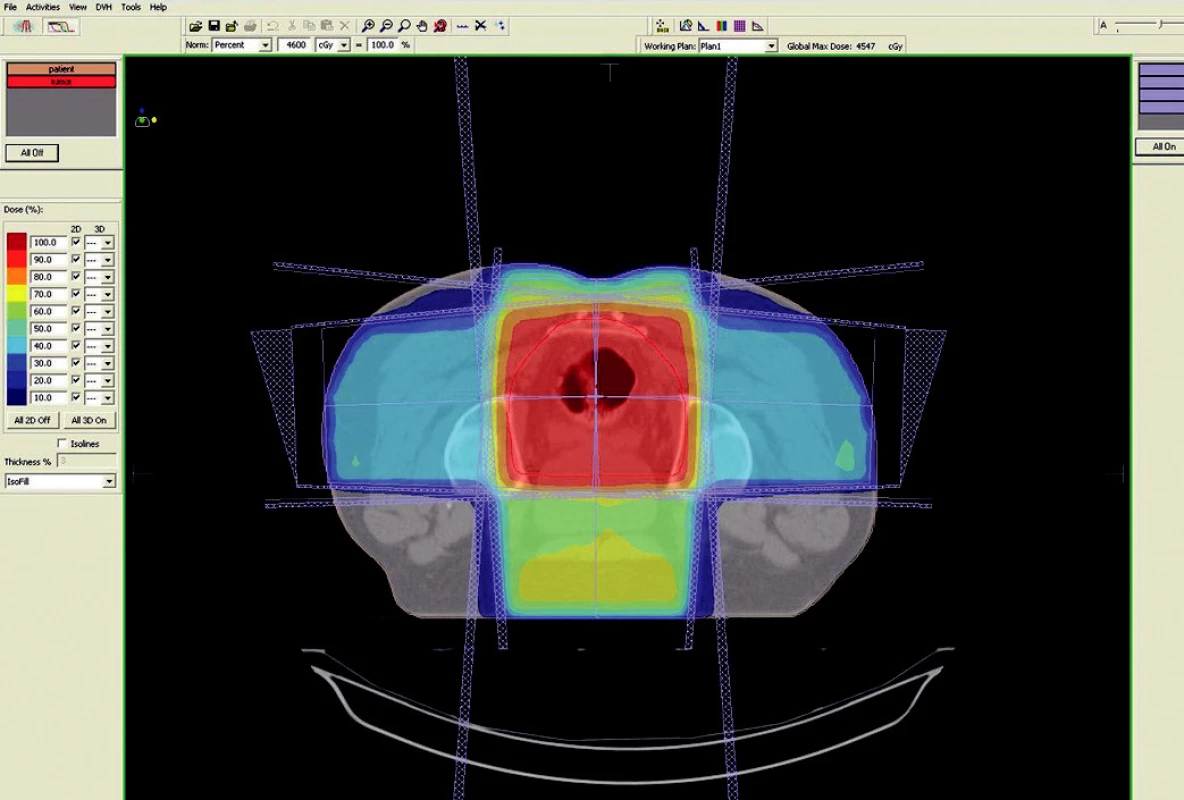
Image 2. Plánovací CT vyšetření – předoperační ozáření karcinomu rekta cT3 NO MO – frontální rovina 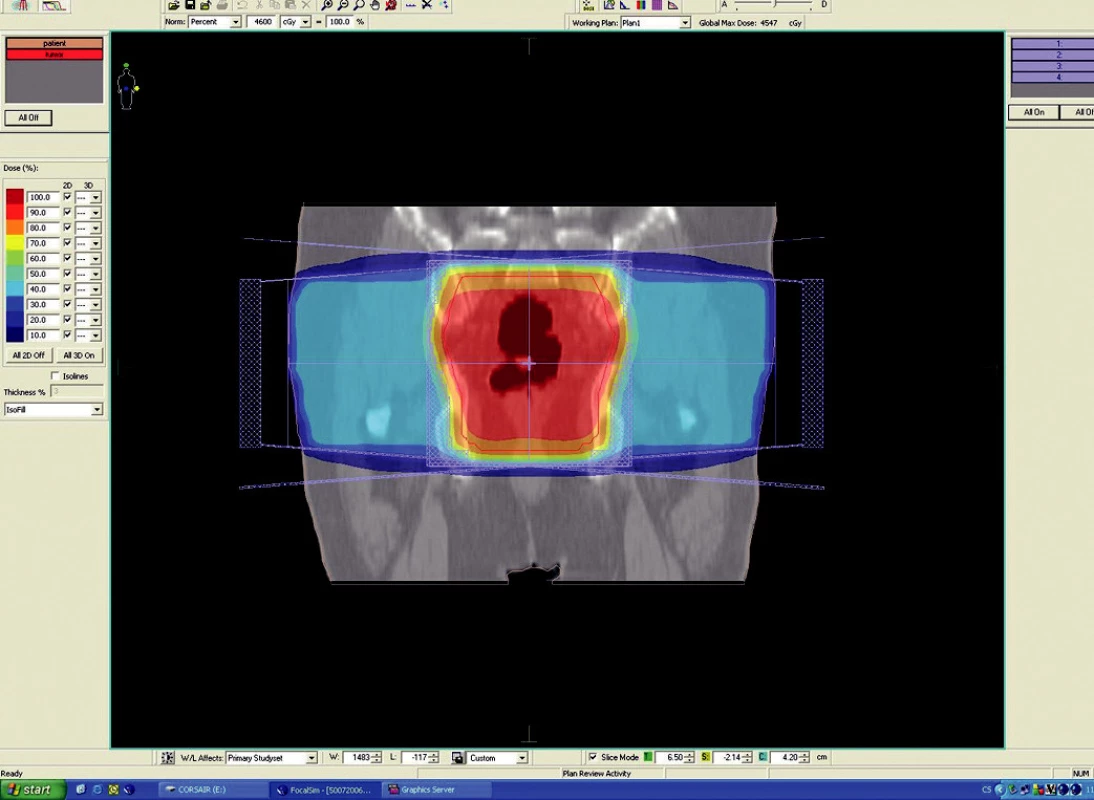
Image 3. Plánovací CT vyšetření – předoperační ozáření karcinomu rekta cT3 NO MO – sagitální rovina 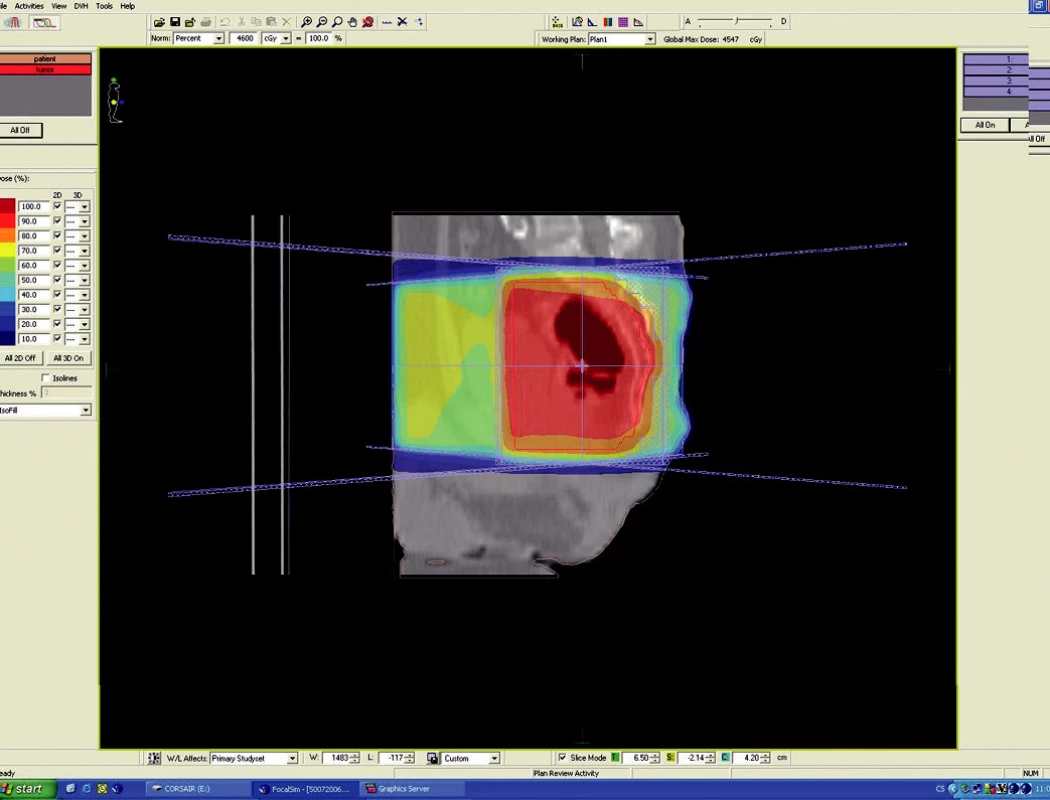
Image 4. Ozařovací plán - předoperační ozáření karcinomu rekta cT3 NO MO – transverzální rovina 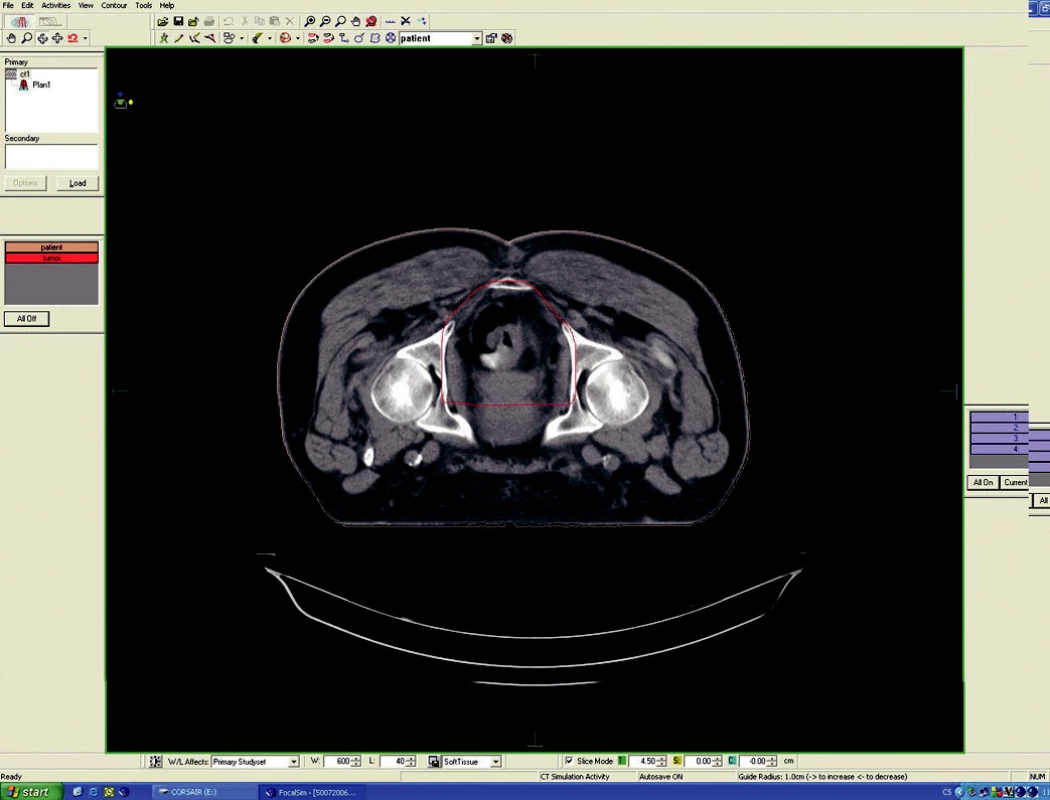
Image 5. Ozařovací plán – předoperační ozáření karcinomu rekta cT3 NO MO – frontální rovina 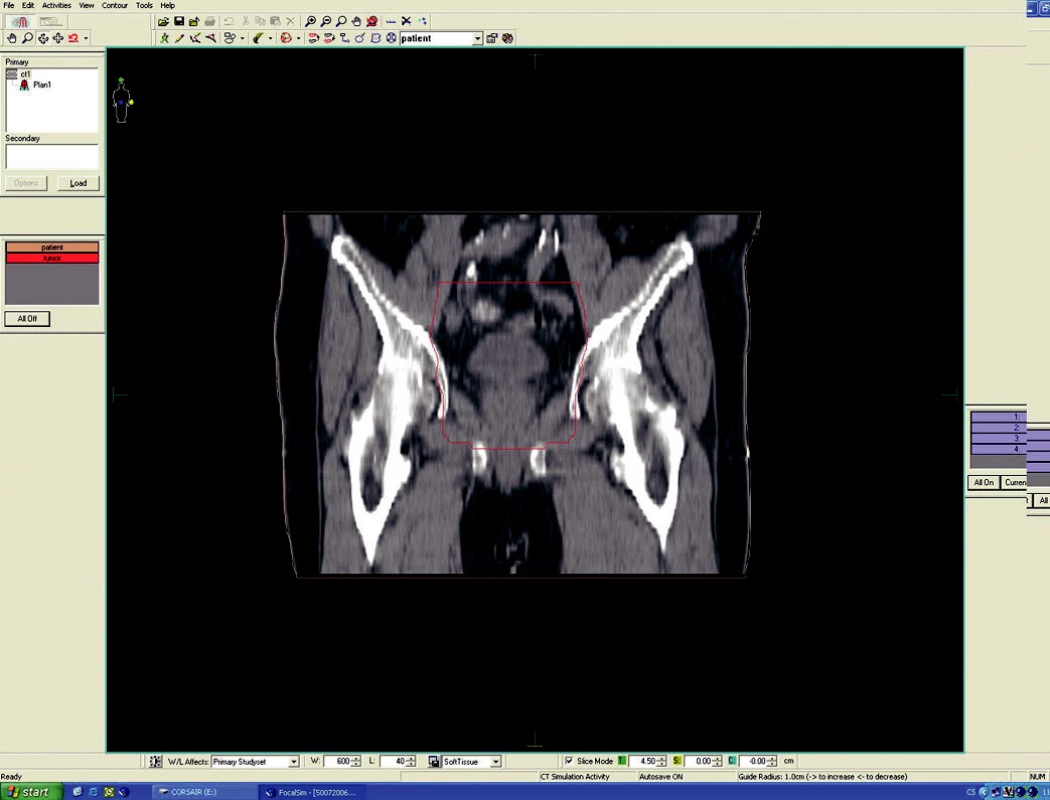
Image 6. Ozařovací plán – předoperační ozáření karcinomu rekta cT3 NO MO – sagitální rovina 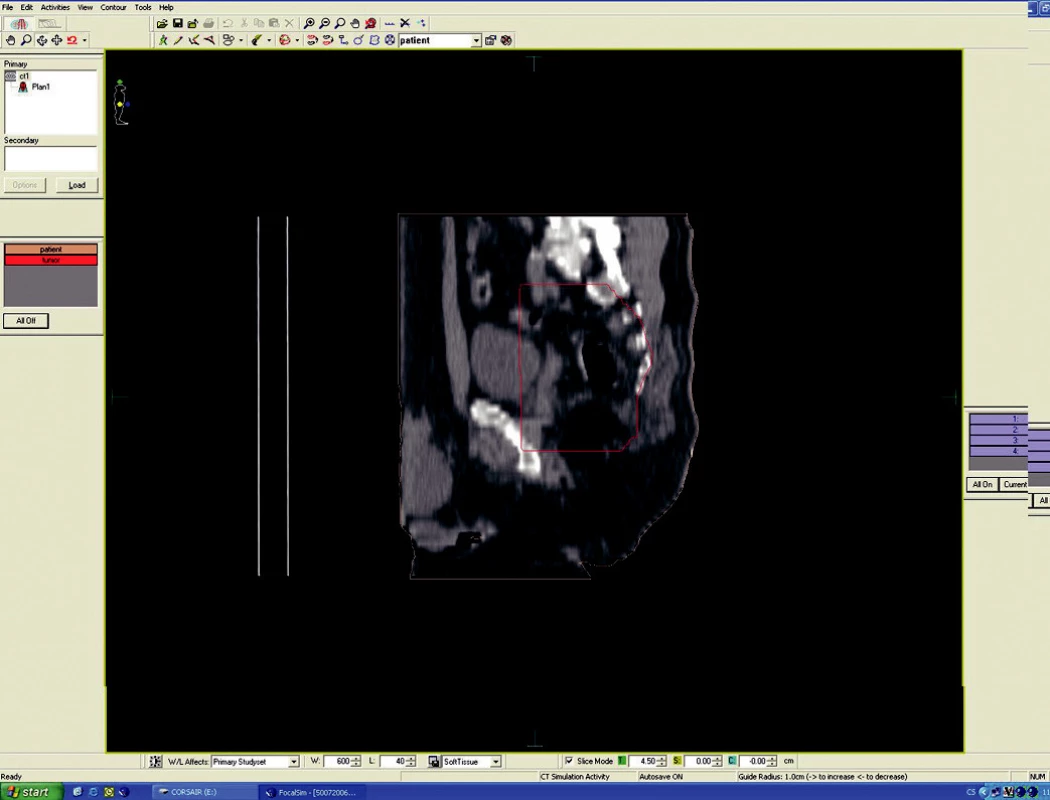
Akcelerované režimy radioterapie (5 x 4,0–5,0 Gy/týden) mohou být indikovány z důvodu vysokého věku a špatného klinického stavu pacienta se špatnou celkovou prognózou, u krvácejícího tumoru, aj.) Nejsou vhodné u hraničně operabilních tumorů, protože u zrychlených režimů s nižším biologickým ekvivalentem dávky (5 x 4 Gy přibližně odpovídá dávce 30 Gy normofrakcionací) se nedá očekávat downstaging. Další nevýhodou akcelerované radioterapie je vyšší riziko vzniku late-effectu (pozdních ireverzibilních změn v oblasti pánve). Operaci je zapotřebí provést do 72 hodin od ukončení ozáření.
Neoadjuvantní konkomitantní chemoradioterapie
Přidáním systémové chemoterapie k předoperační radioterapii se zvyšuje míra kompletních patologických remisí i dosažení downstagingu tumoru. Radioterapie je aplikována standardní frakcionací 5 x 1,8–2,0 Gy/týden. K potenciaci účinku radioterapie se obvykle využívá kontinuálně aplikovaný intravenozní 5-fluorouracil (225 mg/m2 každý den), dále přichází v úvahu konkomitantní capecitabin (Xeloda) 825 mg/m2 2 x denně perorálně.
Pooperační radioterapie
Pooperační ozáření je indikováno v případě neprovedení předoperační radioterapie u nádorů pT3 a pT4, při postižení lymfatických uzlin a při neradikální resekci, má být zváženo u pT2 tumorů s rizikovými faktory (G3, lymfangioinvaze, angioinvaze). Ozařovaný objem i dávky záření jsou obdobné radioterapii předoperační, u pacientů po amputaci rekta má cílový objem zahrnovat také perineum. V případě pozitivních resekčních okrajů, pokud nelze provést radikální reresekci, lze aplikovat boost (lokální zvýšení dávky záření) do celkové dávky 50–56 Gy.
Kombinace předoperační a pooperační radioterapie vede pouze ke zvýšení toxicity léčby. Adjuvantní chemoterapie po pooperační radioterapii naproti tomu zvyšuje lokální kontrolu i celkové přežití.
Brachyradioterapie
Brachyradioterapie přichází v úvahu u povrchových nádorů T1, T2, bez invaze do perirektálního tuku, bez postižení lymfatických uzlin. Může být kombinována s lokální excizí i zevním ozářením u pacientů nevhodných k operaci. U krvácejících tumorů může být použita s hemostyptickým záměrem. Může být interstitiální, nebo intraluminální.
Toxicita radioterapie pánve
Toxické účinky záření v oblasti pánve jsou akutní a pozdní (late effect). Jejich velikost je dána velikostí cílového objemu, velikostí jednotlivé dávky, velikostí celkové dávky, distribucí dávky (homogenitou ozáření), celkovou dobou léčby zářením, použitou energií záření, technikou záření.
K akutním komplikacím patří především poradiační proktitida, enteritida, průjem, malabsorbce, zvýšená frekvence defekace, poradiační cystitida a dysurie, leukopenie, trombocytopenie, anémie.
Sigmoideoskopie odhalí inflamatorní změny a edém sliznice. Akutní komplikace závisí více na frakcionaci a velikosti jednotlivé dávky než na celkové dávce, vznikají hlavně na podkladě deplece aktivně se dělících buněk, jsou přechodné a odeznívají v průběhu několika týdnů (1–3 měsíce) po skončení radioterapie.
Pozdní vedlejší účinky radioterapie (late effect) se začínají vyvíjet 6 měsíců po skončení léčby zářením, jsou méně časté, ale závažnější. Pozdní vedlejší účinky radioterapie zahrnují pozdní hojení ran, chronickou proktitidu, persistující průjem/zvýšenou frekvenci defekace, chronickou enteritidu, obstrukci tenkého střeva nevyžadující/vyžadující chirurgickou korekci, močovou inkontinenci, atrofii močového měchýře a krvácení z močového měchýře. Hlavním patofyziologickým podkladem je poradiační poškození vaskularizace a cévního zásobení stromatu.
K nejzávažnějším pozdním účinkům patří poradiační poškození tenkého střeva, adheze a obstrukce tenkého střeva vyžadující chirurgickou intervenci. Incidence poškození tenkého střeva je udávána v rozmezí 4–12 %, v historických přehledech byla udávána incidence až 17 %.
Redukce toxicity radioterapie
Cesty ke snížení toxicity radioterapie jsou obecně akceptovány, ověřeny a používány. Principy platné pro předoperační ozáření pánve platí stejně pro léčbu recidivy. K základním mechanismům redukce toxicity patří:
- použití vysokoenergetického záření (lineární akcelerátor s vyšší energií),
- ozáření z většího počtu polí s homogenní distribucí dávky,
- technika 3 polí –jedno pole postero-anteriorní a dvě pole latero-laterální, a to ke snížení dávky na tenké střevo,
- tvarování polí bloky nebo přítomnost MLC (multi leaf collimator) či 3D plánovaní.
Důležitá je i pronační poloha, plný močový měchýř, imobilizační pomůcky, belly board (4, 5).
Použití pronační polohy a belly-boardu redukuje dávku na tenké střevo o 66 % oproti poloze supinační (6.) Dávka záření na celou pánev by neměla překročit 45–46,8 Gy. Standardní doporučená frakcionace je 1,8–2,0 Gy/d při samostatné radioterapii, při kombinované léčbě (chemoradioterapie) je standardní denní dávka 1,8 Gy.
Boost na oblast tumoru by neměl překročit dávku 50–50,4 Gy, pokud je tenké střevo v ozařovaném objemu. Dávka na tenké střevo by neměla překročit 45 Gy. Pokud není tenké střevo v ozařovaném objemu, boost může být plánován do dávky 54 Gy. V případě objemného tumoru mohou být potřebné vyšší dávky (55–60 Gy), tyto jsou spojeny s vyšší toxicitou (4, 5).
Paliativní radioterapie
Léčba zářením dokáže účinně zmírnit symptomy pokročilého nádorového onemocnění. Crane et al. udávají po paliativním ozáření pánve u pacientů s metastatickým onemocněním kompletní ústup symptomů v 94 % a 2-letou kontrolu symptomů v 82 % (7). Brierley et al. udávají podobné výsledky dosažené v 6–8 týdnech po dokončení paliativního ozáření pánve dávkou >45 Gy: kontrola bolesti 89 %, krvácení 79 % (8).
Také v případě reiradiace lze dosáhnout účinné paliace. Lingareddy et al. (9) dosáhli kompletního ústupu bolesti v 65 %, částečného ústupu bolesti v 28 %, kontroly krvácení ve 100 % případů. Trvání paliativního efektu bylo 8–10 měsíců.
V případě paliativní léčby se neprovádí profylaktické ozáření spádových lymfatických uzlin, ozařuje se obvykle pouze oblast vlastního nádoru působícího klinického potíže. Dávky záření mají být úměrné očekávané době dožití, uplatňují se zkrácené frakcionace (10 x 3,0 Gy, 5 x 4,0 Gy, 1 x 10 Gy) umožňující rychlé dosažení zmírnění symptomů.
Lokální recidiva karcinomu rekta u pacienta po předchozím ozáření pánve
Kombinace ozáření a TME (total mesorectal excision) signifikantně snižuje incidenci lokální recidivy. Problémem je recidiva karcinomu rekta v pánvi po předchozí radioterapii. V takovém případě je recidiva obvykle obtížně resekabilní a reiradiace je spojena s vysokým rizikem pozdní toxicity. Možnou volbou je předoperační hyperfrakcionovaná chemoradioterapie.
Ve studii Valentini et al. (10) bylo léčeno 55 pacientů s recidivujícím karcinomem rekta hyperfrakcionovanou radioterapií do dávky 30 Gy na GTV (gross tumor volume) s lemem 4 cm (1,2 Gy 2 x denně s minimálním intervalem 6 hodin mezi frakcemi) s boostem na GTV s lemem 2 cm v dávce 10,8 Gy při stejné frakcionaci s konkomitantní chemoterapií (5-fluorouracil v protrahované intravenózní infuzí 225 mg/m2/den, 7 dnů týdně); 8,5 % pacientů dosáhlo kompletní remise (CR), 35,6 % pacientů dosáhlo parciální remise (PR), 52,6 % pacientů mělo onemocnění beze změny (no change – NC) a pouze 3,4 % mělo progresi onemocnění (PD). Resekce tumoru byla provedena u 50,8 % pacientů.
Závěr
Předoperační radioterapií lze doporučit pro většinu pacientů s karcinomem rekta T3-4 N+ bez vzdálených metastáz, protože signifikantně snižuje riziko lokální recidivy a vede k prodloužení přežití o cca 10 %. Předoperační ozáření dokáže snížit relativní riziko lokální recidivy o více než polovinu (50–70%), zatímco pooperační ozáření o 30–40 %. Na rozdíl od dřívějších názorů pravděpodobně předoperační radioterapie zlepšuje celkové přežití (o 10 %), nejsou však doklady svědčící o prodloužení celkového přežití u pooperační radioterapie.
V paliativní intenci radioterapie přináší signifikantní zmírnění symptomů a zlepšení kvality života.
Univerzitní 685/10
Praha 10-Malešice
E-mail: martin.foldyna@ftn.cz
Sources
1. Glimelius, B., Grönberg, H., Järhult, J., et al. A systematic overview of radiation therapy effects in rectal cancer. Acta Oncol. 2003, 42(5-6), p. 476-492.
2. Glynne-Jones, R., Harrison, M. Locally advanced rectal cancer: what is the evidence for induction chemoradiation? Oncologist 2007, 12(11), p. 1309-1318.
3. Doleželová, H., Ondrová, B., Šlampa, P. Standard radioterapie karcinomů konečníku. Dostupné na WWW: http://www.srobf.cz/cz/StandardyRT/
4. Gunderson, L.L., Russell, A.H., Llewellyn, H.J. et al. Treatment planning for colorectal cancer. Int. J. Radiat. Oncol. Biol. Phys. 1985, 11, p. 1379-1393.
5. Minsky, B.D., Cohen, A.M. Minimising the toxicity of pelvic radiation therapy. Oncology 1988, 2, p. 21-25, 28-29.
6. Shanahan, T.G., Mehta, M.P., Bertelrud, K.L. et al. Minimization of small bowel volumes within treatment fields using customized „belly boards“. Int. J. Radiat. Oncol. Biol. Phys. 1990, 19, p. 469-476.
7. Crane, C.H., Janjan, N.A., Abbruzzese, J.L. et al. Effective pelvic symptom control using initial chemoradiation without colostomy in metastatic rectal cancer. Int. J. Radiat. Oncol. Biol. Phys. 2001, 49, p. 107-116.
8. Brierley, J.D., Cummings. B.J., Wong, C.S. et al. Adenocarcinoma of the rectum treated by radical external radiation therapy. Int. J. Radiat. Oncol. Biol. Phys. 1995, 31, p. 255-259.
9. Lingareddy, V., Ahmad, N.R., Mohiuddin ,M. Palliative reirradiation for recurrent rectal cancer. Int. J. Radiat. Oncol. Biol. Phys. 1997, 38, p. 785-790.
10. Valentini, V., Morganti, A.G., Gambacorta, M.A. et al. Study Group for Therapies of Rectal Malignancies (STORM). Preoperative hyperfractionated chemoradiation for locally recurrent rectal cancer in patients previously irradiated to the pelvis: A multicentric phase II study. Int. J. Radiat. Oncol. Biol. Phys. 2006, 15, 64(4), p. 1129-1139.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2008 Issue 12-
All articles in this issue
- Stručný přehled radioterapie karcinomu rekta
- Poskytování spirituální péče v českých nemocnicích
- Biologická léčba revmatoidní artritidy
- Problémy působené alkoholem – interakce rizikových a ochranných činitelů
- Volvulus sigmoidea – netypické onemocnění v dětském věku
- Kardiorehabilitace – účinná, ale opomíjená léčba
- Idiopatická trombocytopenická purpura
- Kandidové biofilmy – súčasný problém klinickej praxe
- Současné způsoby osteosyntézy dětských zlomenin
- Nádorové markery u karcinomu prostaty, blýská se na lepší časy?
- Perkutánní endoskopická gastrostomie – zkušenosti Centra pro PEG v letech 2002–2008
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Idiopatická trombocytopenická purpura
- Perkutánní endoskopická gastrostomie – zkušenosti Centra pro PEG v letech 2002–2008
- Současné způsoby osteosyntézy dětských zlomenin
- Volvulus sigmoidea – netypické onemocnění v dětském věku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

