-
Medical journals
- Career
Možnosti použitia neinvazívnych metód pri nealkoholovej tukovej chorobe pečene
Authors: M. Fedelešová 1; V. Kupčová 1; M. Szántová 1; J. Bulas 2; L. Turecký 3
Authors‘ workplace: III. interná klinika LF UK a UN Bratislava, Slovenská republika 1; I. interná klinika LF UK a UN Bratislava, Slovenská republika 2; Ústav lékarskej chémie, biochémie a klinickej biochémie, LF UK Bratislava, Slovenská republika 3
Published in: Gastroent Hepatol 2017; 71(4): 325-332
Category: Hepatology: Review article
doi: https://doi.org/10.14735/amgh2017325Overview
Nealkoholová tuková choroba pečene (NAFLD – non-alcoholic fatty liver disease) zahrňuje celé spektrum ochorení od jednoduchého stukovatenia pečene, cez nealkoholovú steatohepatitídu (NASH) až po progresiu do cirhózy pečene. NAFLD je považovaná za celosvetovo najčastejšie chronické ochorenie pečene so stúpajúcou prevalenciou a predpokladá sa, že v budúcnosti bude najčastejšou indikáciou transplantácie pečene. Nakoľko NAFLD postihuje stále väčšiu časť populácie a biopsia pečene je invazívny diagnostický zákrok, je nutné rozvíjať neinvazívne diagnostické a screeningové modality. Biochemické ukazovatele zahrňujúce markery zápalu, oxidačného stresu, apoptózy, fibrogenézy a skórovacie systémy na detekciu steatózy a fibrózy majú svoj význam v diagnostike NAFLD. Pretože izolované biochemické parametre neboli dostatočne špecifické a senzitívne pre predikciu prítomnosti NASH a fibrózy, je tendencia použitia rôznych markerov a kombinovať ich v matematických algoritmoch. Bolo vyvinutých viacero prediktívnych modelov a skórovacích systémov. Podľa najnovších štúdií skupiny viacerých parametrov (NAFLD fibrosis skóre, FIB-4, BARD skóre) sú diagnosticky najvýpovednejšie a môžu minimalizovať nutnosť biopsie pečene. Zobrazovacie metódy ako ultrasonografia, tranzientná elastografia, real-time elastografia, dynamická shear waves elastografia, elastografia s ultrazvukovým tlakovým impulzom (metóda ARFI – acoustic radiation force imaging) zohrávajú významnú úlohu v diagnostike NAFLD. Nové trendy neinvazívnej diagnostiky sa stále diskutujú a prehodnocuje sa ich klinická využiteľnosť. Práca prehľadne pojednáva o aktuálnych biochemických a zobrazovacích metódach, vyhodnocuje ich diagnostickú presnosť a použitie v klinickej praxi.
Kľúčové slová:
nealkoholová tuková choroba pečene – steatóza – nealkoholová steatohepatitída – fibróza – sérologické metódy – neinvazívna diagnostikaÚvod
Nealkoholová tuková choroba pečene (NAFLD – non-alcoholic fatty liver disease) nepredstavuje len jednu chorobu. Je to celé rozpätie porúch od jednoduchého stukovatenia pečene až po pečeňovú cirhózu, vrátane komplikácií, ako je hepatocelulárny karcinóm. NAFLD je najčastejšou príčinou chronického hepatálneho poškodenia u dospelej populácie vo vyspelých krajinách. Časť nealkoholových steatóz pečene sa rozvinie do nealkoholovej steatohepatitídy (NASH) a časť NASH do ťažkej fibrózy, resp. cirhózy pečene [1]. NAFLD je úzko prepojená s metabolickým syndrómom (MS). Je dôležité detekovať pacientov s NAFLD, u ktorých je vysoké riziko prechodu do NASH a fibrózy pečene, keďže títo sú viac ohrození kardiovaskulárnymi ochoreniami, transplantáciou pečene a v konečnom dôsledku vyššou mortalitou. Odhalenie spomínaných patologických procesov vyžaduje histologizáciu, a teda aj biopsiu pečene, čo je invazívny výkon s malým, ale významným rizikom, a rozhodnutie, kedy ju realizovať, je stále kontroverzné. Potreba menej invazívnych metód screeningu, diagnostiky jednotlivých štádií NAFLD a ich progresie narastá, preto sa neustále pátra po vhodných neinvazívnych metodikách s dostatočnou senzitivitou, špecificitou a výpovednosťou. Zistenie zápalového procesu a fibrózy pečene má nielen prediktívnu hodnotu, ale tiež význam v terapeutickom postupe.
Patofyziológia NAFLD/NASH
Patogenéza NAFLD nie je celkom objasnená. Hypotéza dvoch úderov zostáva stále podstatnou zložkou v etiopatogenéze NASH. V súčasnosti je obohatená o teóriu „mnohonásobných inzultov“, kde viacero zásahov pôsobí spoločne u jedincov s genetickou predispozíciou. Medzi tieto inzulty patria napr. inzulínová rezistencia (IR), hormóny tukového tkaniva, výživové faktory, črevný mikrobióm, genetické a epigenetické faktory. Obezita má kľúčovú úlohu v rozvoji NAFLD, aj keď NAFLD sa vyskytuje tiež u chudých jedincov. Obezita môže viesť k MS a IR, na druhej strane IR môže byť zodpovedná za rozvoj NAFLD u neobéznych pacientov. Základné patofyziologické mechanizmy sú zobrazené na schéme 1.
Schéma 1. Základné patofyziologické mechanizmy vzniku NAFLD. Scheme 1. Basic pathophysiological mechanisms of NAFLD. 
Prvý úder predstavuje nahromadenie tuku v hepatocytoch v podobe tukových kvapiek v cytoplazme, čo spôsobuje jednoduchú steatózu pečene. Tento stav je reverzibilný a spojený s abnormálnym skladovaním triacylglycerolov (TAG). TAG sú vyrábané z voľných mastných kyselín (VMK). Hlavným zdrojom VMK sú plazmatické neesterifikované mastné kyseliny (NMK), de novo lipogenéza a tuk z potravy vo forme chilomikrónov. NMK sú produktom lipolýzy tukového tkaniva, ktorá je indukovaná IR a v priebehu hladovania. VMK v pečeni sú využité troma rôznymi spôsobmi – beta-oxidácia v mitochondriách, tvorba veľmi nízkodenzitního lipoproteínu v krvi za pomoci apolipoproteínu B a syntéza triglyceridov. Predpokladá sa, že nadmerný intraabdominálny tuk môže spôsobiť nadmerný reflux VMK do pečene cez portálne riečisko. Ukladančisko. Ukladanie triglyceridov vo forme tukových kvapiek, čo sa deje pri steatóze pečene, môže predstavovať exponovaný stav pre ďalšie údery spôsobujúce zápalovú reakciu, nekrózu až fibrózu, resp. cirhózu pečene. Nadmerná oxidácia mastných kyselín môže viesť k oxidačnému stresu s tvorbou voľných radikálov a mitochondriálnej dysfunkcii, teda k stavu známemu ako lipotoxicita. Imunitná odpoveď na lipotoxický účinok zahŕňa zápalové a regeneračné procesy, ktoré môžu potencovať fibrogenézu a progresiu NAFLD. Na jednej strane – zápalové mechanizmy sú aktivované v pečeni, najmä aktiváciou Kupfferových buniek (KB), neutrofilov, NK (natural killers) buniek a ich produkciou prozápalových cytokínov (IL-6, TNF-α, IL-1), na druhej strane, lipotoxicita potencuje zápalovú reakciu v tukovom tkanive a dereguluje syntézu adipocytokínov, najmä inhibíciu adiponektínu a indukciu leptínu. Druhý úder zahŕňa apoptózu a endotoxémiu spôsobenú baktériami z hrubého čreva, ktorá má dôležitú úlohu v patofyziológii NAFLD. Mikrobióm môže spôsobiť zmeny lipidového metabolizmu v celom organizme, môže vymeniť ich oxidáxiu za de novo produkciu. NAFLD môže byť spojená s prerastaním baktérií do tenkého čreva, čím sa zvyšuje permeabilita steny čreva a dochádza k endotoxinémii, a teda aktivácii KB. Nekroticko-zápalový proces typický pre NASH vedie k aktivácii hviezdicovitých buniek (HB) zodpovedných za pečeňovú fibrogenézu a karcinogenézu. Aktuálne sa IR považuje za promotora proliferácie HB a aktivátora produkcie kolagénu. Ďalší úder predstavuje genetický faktor. Rôzne štúdie poukazujú na rodinný výskyt a rasové rozdiely v prevalencii NAFLD, teda na genetickú predispozíciu NAFLD [2]. V poslednom období sa zdôrazňuje význam genetiky pri NAFLD a jej dôležitosť v patogenéze a diagnostike.
Klinický obraz NAFLD
Klinické príznaky NAFLD nie sú špecifické a často chýbajú. Pacienti sa môžu sťažovať na únavu, neurčitý dyskomfort pod pravým rebrovým oblúkom. Fyzikálnym vyšetrením môžeme zistiť hepatomegáliu, často je prítomná obezita. S progresiou ochorenia sa mení aj klinický obraz, môžu sa objaviť príznaky hepatálnej dekompenzácie, napr. ikterus, ascites, edémy, gastrointestinálne krvácanie a encefalopatia. Keďže sa klinická manifestácia rozvíja so závažnosťou ochorenia, klinické symptómy nie sú vhodné na diagnostiku skorších štádií NAFLD. Je potrebné myslieť a pátrať aj po príznakoch MS, ako napr. vyššie hodnoty tlaku krvi, diabetes mellitus, abdominálna obezita, ktoré nás môžu naviesť k diagnóze NAFLD.
Laboratórna diagnostika NAFLD
Všeobecné parametre MS a pečeňového poškodenia
Väčšina pacientov s NAFLD sú klinicky asymptomatickí počas tzv. precirhotického štádia. Obvykle nachádzame abnormálnu aktivitu hepatálnych enzýmov, najčastejšie zvýšené hodnoty alanínaminotransferázy (ALT), aspartátaminotransferázy (AST) a γ-glutamyltranspeptidázy (GMT). Hepatálne enzýmy nie sú spoľahlivým markerom NAFLD, pretože nemusia byť zvýšené ani v pokročilom štádiu ochorenia. Pomer AST/ALT všeobecne stúpa so závažnosťou zápalovo-nekrotických a fibrotických zmien. Taktiež hodnoty protrombínového času, bilirubínu a sérového albumínu sú v norme, okrem cirhotického štádia NAFLD. Hladina sérového feritínu môže byť elevovaná u 20–50 % pacientov s NAFLD a môže byť prediktorom progresie ochorenia a zvýšenej mortality [3]. C reaktívny proteín (CRP), najmä hs-CRP (high sensitivity CRP) je všeobecný zápalový parameter, avšak tiež koreluje s NASH. Porucha glukózovej tolerancie, zvýšená glykémia nalačno, hyperinzulinémia, dyslipidémia (hypertriacylglycerolémia, hypercholesterolémia) sú asociované s metabolickými poruchami spojenými s NAFLD, nekorelujú s histologickým štádiom choroby, avšak sú dobrým ukazovateľom kardiovaskulárnej morbidity a mortality.
Parametre zápalu
NAFLD je tiež spojená so subklinickou systémovou zápalovou reakciou a z toho vyplývajúcou koreláciou s viacerými cytokínmi a adiponektínmi.
Dlhodobo známym prozápalovým cytokínom je tumor nekrotizujúci faktor α (TNF-α), ktorý je produkovaný tukovým tkanivom obéznych jedincov, hepatocytmi, KB a inými bunkami. TNF-α je zvýšene vylučovaný u NASH a podporuje zápal, nekrózu, apoptózu a fibrózu. Je to jeden z najštudovanejších cytokínov a viaceré štúdie potvrdili jeho úlohu v patogenéze NAFLD. Iné dôležité cytokíny sú interleukin (IL) -6, IL-1, IL-8, IL-18. Z nich IL-6 sa zdá byť najviac asociovaný s NASH. Viacero štúdií potvrdilo dôležité postavenie cytokínov v patologických procesoch NAFLD, avšak ich presná úloha ešte nie je objasnená. Vzťah ich hladín a jednotlivých štádií NAFLD je stále kontroverzný, a teda ako jednoduché markery sú nepoužiteľné. Rozvoj NAFLD a MS je v úzkej súvislosti s chemokínmi tvorenými tukovým tkanivom – adipokínmi, ktoré sú tiež zodpovedné za subklinickú zápalovú odpoveď u obéznych jedincov. Adipokín sa javí ako protektívny cytokín, je tvorený len viscerálnym tukovým tkanivom a má protizápalový, antiproliferatívny, antiaterogénny, antidiabetický účinok. Adiponektín je kľúčový cytokín v patogenéze NAFLD a reguluje pečeňovú steatózu, IR, zápalové a fibrotické zmeny. Hladiny adiponektínu sú nízke u pacientov s NAFLD a je to negatívny prediktor NASH v dospelej populácii [4]. Iné pozoruhodné adipocytokíny sú leptín, ghrelin, visfatín, rezistín, retinol viažucí proteín 4 (RBP4). Hodnoty leptínu korelujú s celkovým telesným tukom a leptínová rezistencia je významná v hepatálnej fibrogenéze. Ghrelin je peptid produkovaný najmä žalúdkom a stimuluje príjem potravy, koreluje s IR a obézni jedinci majú nižšie koncentrácie deacylovaného ghrelinu. Rezistín a visfatín majú význam v patogenéze obezity, pretože ich vyššie sérové hladiny boli prítomné u obéznych pacientov, avšak ich presná úloha nie je zatiaľ objasnená. V konečnom dôsledku je dôležité poznamenať, že cytokíny spojené s pečeňovými patologickými procesmi v rámci NAFLD nie sú dostatočne špecifickými a senzitívnymi markermi jednotlivých štádií, teda je nutný ďalší vedecký výskum.
Novšie parametre akútnej fázy zápalu, ako napr. plazma-pentraxin 3 (PTX 3), sa zdajú byť nádejné v odlíšení jednotlivých variant NAFLD, pričom PTX 3 je vyšší u pacientov s NASH [5].
Parametre oxidačného stresu
Niektoré štúdie potvrdzujú asociáciu markerov oxidačného stresu s NASH a fibrózou pečene. Je známe, že zvýšená produkcia reaktívnych foriem kyslíka (kyslíkových radikálov) je zodpovedná za peroxidáciu lipidov, ktorá vedie k zápalu a fibrogenéze prostredníctvom aktivácie HB. Hladiny reaktívnych foriem kyseliny tiobarbiturovej, oxidu dusnatého, superoxid dismutázy, malondialdehydu, vitamínu E sú potenciálnymi markermi NAFLD. Niektoré štúdie potvrdzujú asociáciu markerov oxidačného stresu s NASH a fibrózou pečene [6].
Parametre apoptózy
Bunková smrť súvisí s poškodenou permeabilitou mitochondriálnej membrány a uvoľnením proteínov do cytozolu. Hlavnou bielkovinou intermediárneho vlákna cytozolu hepatocytov je cytokeratín 18 (CK 18). Viaceré štúdie potvrdili vzťah sérovej hladiny fragmentov cytokeratínu 18 so závažnosťou NAFLD. Hodnoty CK 18 a jeho sérových fragmentov majú AUROC (area under receiving-operating characteristics curve) 0,9 pre steatózu pečene a 0,8 pre NASH [6]. Napriek tomu, že CK 18 sa javí ako spoľahlivý marker hepatocelulárneho poškodenia, ešte nie je využívaný v bežnej klinickej praxi. Ďalšia bielkovina vylučovaná počas apoptózy je tkanivový špecifický polypeptidový antigén, ktorý by mohol byť potenciálnym ukazovateľom fibrózy.
Parametre fibrogenézy
Fibrogenetický proces alebo premena extracelulárnej matrix predstavujú typické zmeny pre pokročilé pečeňové poškodenie. Jeden z najviac skúmaných komponentov matrix je kyselina hyaluronová (HA), ktorá je syntetizovaná HB. Viacero štúdií potvrdilo, že sérová hladina HA je spoľahlivým markerom pečeňovej fibrózy [7]. HA je súčasťou skórovacieho systému – Enhanced Liver Fibrosis Panel, ktorý ešte zahŕňa tkanivový inhibítor metaloproteinázy 1 (TIMP1), aminoterminálny peptid prokolagénu III (PNP3). Iné markery fibrogenézy sú transformujúci rastový faktor β (TGF-β), typ IV kolagén 7S doména, endotelín-1. Analýzy proteómu odhalili aj iné komponenty, ako laminín a lumikan. Avšak ani tieto parametre sa zatial nedostali do rutinnej praxe.
Algoritmy odlišujúce steatózu, steatohepatitídu a fibrózu
Spomínané jednotlivé biochemické parametre nie sú dostatočne špecifické a senzitívne na odlíšenie NASH a fibrózy. Preto je tendencia používať viaceré markery a kombinovať ich do matematických algoritmov a tým predísť invazívnym diagnostickým metódam. Bolo vyvinutých viacero prediktívnych modelov a skórovacích systémov a je stále diskutované ich uplatnenie v klinickej praxi.
Algoritmy vhodné na diagnostiku pečeňového stukovatenia
Často využívaným algoritmom na zhodnotenie stukovatenia pečene je fatty liver index, ktorý zahŕňa body mass index (BMI), obvod pásu a sérové hladiny GMT a TAG a má AUROC 0,834 pre NAFLD [8]. Borman et al opísali jeho limitované použitie u obéznych pacientov, u ktorých mal AUROC len 0,67 [9].
Menej zložitý model LAP (lipid accumulation product), ktorý zohľadňuje pohlavie, obvod pásu a TAG, má AUROC 0,79 pre detekciu steatózy pečene [10].
Hepatic steatosis index predstavuje ďalšiu skupinu parametrov – pohlavie, prítomnosť diabetes mellitus 2. typu, BMI, ALT, AST a ich AUROC je 0,81 [11].
Novším prediktívnym modelom stukovatenia pečene je Zhejiang University index, ktorý bol validovaný na čínskej populácii a zahrňuje BMI, glykémiu nalačno, TAG, ALT/AST pomer má AUROC 0,82 pre diagnostiku NAFLD a 0,896 pre steatózu pečene [12].
SteatoTest je založený na hodnotách α-2 makrogobulínu, apolipoproteínu A1, haptoglobínu, celkového bilirubínu, GMT, ALT, glykémie nalačno, TAG, cholesterolu, veku, pohlavia a BMI. Tento algoritmus mal najhoršie AUROC 0,71, teda nie je považovaný za efektívny [13].
Algoritmy vyhodnocujúce pokročilé pečeňové poškodenie – steatohepatitídu, fibrózu
Pomer AST/ALT (AAR) je najjednoduchší test na vyhodnotenie NAFLD a predvídanie fibrózy. AAR > 1 naznačuje pokročilú fibrózu a cirhózu.
AST to platelet ratio index – pomer AST/trombocyty index – APRI je ďalší jednoduchý test a pôvodne je využívaný v klinickej praxi na zhodnotenie pokročilej hepatálnej fibrózy u pacientov s chronickou hepatitídou C. APRI je senzitívny marker pokročilej fibrózy, ktorého použitím môžeme predísť biopsii pečene.
Iniciály BARD skóre nám napovedajú, ktoré komponenty sú zahrnuté v tomto algoritme – BMI, AAR a prítomnosť diabetes mellitus 2. typu. BARD skóre validovali na kohorte kaukazských pacientov a malo AUROC 0,82 a vysokú negatívnu prediktívnu hodnotu 97 % [14].
NAFLD fibrosis skóre (NFS) je zložený zo šiestich premenných (vek, hyperglykémia, BMI, počet trombocytov, albumín, AAR) a bol vyvinutý počas veľkej multicentrickej štúdie. Prítomnosť fibrózy bola stanovená s veľkou presnosťou (pozitívna prediktívna hodnota 82–90 %), biopsii pečene by sa mohlo vyhnúť až 75 % pacientov [15]. Najvyššia hodnota AUROC 0,96 bola dosiahnutá v štúdii realizovanej Demirom et al na kohorte 267 pacientov [16].
Nippon skóre (N skóre) predstavuje konečné číslo rizikových faktorov – vek, pohlavie, prítomnosť diabetes mellitus 2. typu alebo hypertenzie a má AUROC 0,78 na kohorte 182 japonských pacientov, ktorí mali biopticky potvrdenú NAFLD [17].
BAAT skóre je kombináciou BMI, veku, ALT, TAG a má AUROC pre stredne ťažkú fibrózu 0,75 a pre ťažkú fibrózu 0,92 [18].
FIB-4 (Fibrosis 4) test obsahuje ukazovatele ako vek, počet trombocytov, ALT, AST a pôvodne bol vyvinutý pre staging fibrózy u pacientov s chronickou hepatitídou C a HIV koinfekciou. Viaceré porovnávacie štúdie potvrdili, že FIB-4 je najsľubnejším panelom neinvazívnej diferenciácie NASH od jednoduchej steatózy. AUROC pre FIB-4 bol vyšší ako AUROC iných skórovacích systémov (NFS, APRI, AAR, BAARD, Nippon skóre) pre odlíšenie ľahkej fibrózy od pokročilých štádií. Najvyšší AUROC pre FIB-4 0,96 bol dosiahnutý v štúdii so 165 kaukazskými pacientmi [16].
Demir et al vyvinuli a validovali ďalší neinvazívny algoritmus – Koeln-Essen index, ktorý zahrňuje vek AAR, AST, bilirubín a má AUROC 0,97 v porovnaní s FIB-4 0,93. Neprítomnosť ťažkej fibrózy môže byť potvrdená s vysokou presnosťou (99–100 %) [16].
The HAIR skóre obsahuje hypertenziu, ALT a IR a preukázalo sa ako nezávislý marker NAFLD.
Fibrometer je kombináciou veku, hmotnosti, glykémie nalačno, AST, ALT, feritínu, a počtu trombocytov. Rovnako ako niektoré spomínané testy aj tento bol vyvinutý pre odlíšenie jednotlivých štádií fibrózy u pacientov s hepatitídou C a má výbornú presnosť aj pre staging fibrózy u pacientov s NAFLD.
Fibrotest (FT) je patentovaný vzorec piatich markerov – haptoglobín, apolipoproteín A1, α2-makroglobulín, celkový bilirubín a GMT. FT bol validovaný Poynardom et al na kohorte 761 obéznych pacientov s NAFLD a má AUROC 0,85 [13].
NASH test zahŕňa pohlavie, vek, hmotnosť, výšku, TAG, celkový cholesterol, ALT, AST, GMT, celkový bilirubín, apolipoproteín A1, α2-makroglobulín.
Kombinácia viacerých komerčných testov známa ako FibroMAX (Biopredictive, Paris, France) sa používa u pacientov s rizikom chronických hepatopatií. Testy od francúzskej spoločnosti ako FibroTest, SteatoTest, NashTest kvantitatívne stanovujú fibrózu, steatózu, steatohepatitídu, v USA sú známe ako NASH-FibroSURE.
Antverpský skórovací model signifikantnej fibrózy u pacientov s NAFLD obsahuje parametre ako obvod pásu, AST, C-peptid nalačno, sonografické zhodnotenie steatózy a bol vyvinutý belgickými hepatológmi.
Enhanced Liver Fibrosis Panel (ELF) bol už spomínaný v súvislosti s HA. Tento algoritmus bol zjednodušený Guhom et al a bol validovaný ako Original European Liver panel. ELF panel mal AUROC pre nezávažnú fibrózu 0,82, pre ťažkú fibrózu 0,9 a 0,76 pre neprítomnosť fibrózy [19].
NAFIC skóre je ďalším modelom navrhnutým japonskou skupinou a zahrňuje hodnoty feritínu, inzulínu, kolagénu 7S typ IV.
Genetika NAFLD
Rozvoj NAFLD je s istotou ovplyvnený vonkajšími faktormi, ako napr. diétne zvyky, sedavý spôsob života, ale tiež vyžaduje náchylné genetické pozadie. Dedičnosť rovnako vysvetľuje interindividuálne a rasové rozdiely vo výskyte NAFLD a progresie do NASH. Nedávne štúdie demonštrovali 26–27% dedičnosť NAFLD [7].
V posledných rokoch sú diskutované epigenetické mechanizmy a ich vplyv na expresiu génov a patogenézu NAFLD. Epigenetické mechanizmy sú dedičné, reverzibilné a prostredím modulované stimuly, ktoré zahŕňajú acetyláciu a deacetyláciu histónov, DNA metyláciu, remodeláciu microRNA a chromatínu. MicroRNA je najdôležitejšia, pretože reguluje génovú expresiu a transláciu proteínov, tiež by sme tieto RNA mohli nazvať onkogénmi alebo tumor supresormi, pretože zohrávajú významnú úlohu v karcinogenéze. Najviac exprimovaná microRNA v ľudskej pečeni je miRNA-122 zapojená do patogenézy NAFLD a hepatocelulárneho karcinómu [20]. Epigenetika predstavuje do budúcnosti potenciálny diagnostický, prognostický a terapeutický cieľ.
„Multióm“ zahrňuje genóm, proteóm, metabolóm, lipidóm, glykóm, ktorých spoločnou charakteristikou je, že sa jedná o nehypotetické rozsiahle analýzy špecifických tkanivových a sérových produktov produkovaných počas ochorenia. Tieto sú následne využívané ako nové markery.
Zobrazovacie metódy a nález NAFLD
Rôzne zobrazovacie modality sa používajú na potvrdenie NAFLD a ich miesto v diagnostike je nesporne významné. Ultrasonografia (USG), počítačová tomografia (CT), magnetická rezonancia (MR), MR spektroskopia sú najvhodnejšie zobrazovacie techniky na vyhľadávanie pacientov s NAFLD.
K novším metódam okrem klasickej tranzientnej elastografie (TE) patrí real-time elastografia, shear waves elastografia, magnetická elastografia a elastografia s ultrazvukovým tlakovým impulzom (ARFI – acoustic radiation impulse force imaging), ktoré sú schopné merať pečeňovú tuhosť a sú vhodnými metodikami na odlíšenie jednoduchej steatózy od NASH. Do popredia z vyšetrovacích možností sa dostáva shear waves elastografia a MR elastografia (MRE) pečene.
Klasické zobrazovacie metódy (USG, CT, MR) môžu poukázať na steatózu pečene, avšak nedokážu spoľahlivo vyhodnotiť fibrózu a prítomnosť NASH. Neinvazívny odhad miery pečeňovej fibrózy a NASH umožňuje tranzientná elastografia pečene. Na podobnom principe je tč. založených viacero metód, ktoré zahŕňajú tranzientnú elastografiu, ako je elastografia pomocou nadzvukových priečnych vĺn (shear waves elastografia), odhad fibrózy na základe ARFI a real-time tkanivová elastografia [10].
Real-time elastografia
Real-time elastografia využíva ultrazvukový prístroj s poskytnutím farebného dvojrozmerného obrazu vyšetrovaného tkaniva. Podobne ako tranzientná elastografia sleduje ultrazvukové impulzy pri pôsobení tlaku na tkanivo pečene. Pri ultrazvukovom vyšetrení sú registrované echosignály pred pôsobením tlaku a po ňom, pričom pomocou tzv. kombinovanej autokumulatívnej metódy sa vypočíta relatívna elasticita tkaniva. Výsledok sa zobrazí v šedej škále alebo farebnej škále a udáva sa v kPa alebo v iných jednotkách [21]. Pri farebnom zobrazení sú popisované tri základné obrazy. Vyššiu diagnostickú presnosť je môžné dosiahnuť pri kombinácii elastografie a dvoch bežných laboratórnych markerov (trombocyty a GMT).
Elastografia s ultrazvukovým tlakovým impulzom
ARFI využíva veľký akustický tlak fokusovaného ultrazvuku ku kompresii tkaniva. Vyšetruje sa štandardným ultrazvukovým prístrojom doplneným o tzv. virtual touch tissue quantification. Umožňuje kvalitatívne a kvantitatívne vyhodnotiť elasticitu tkaniva pečene. Impulzy, ktoré vznikajú pri šírení vlny v tkanive pečene, sa využívajú k meraniu rýchlosti šírenia vĺn. Rýchlosť narastá priamo úmerne s tuhosťou pečene.
Dynamická elastografia (shear waves)
Shear waves elastografiu možno používať na vyhodnotenie pečeňovej fibrózy rôznorodej etiológie. Ide o dvojrozmernú techniku, ktorá umožňuje lepší výkon pre hodnotenie pečeňovej fibrózy v porovnaní s konvenčnou tranzientnou elastografiou. Je schopná zmerať tuhosť pečene prostredníctvom priečnych vĺn generovaných pomocou ultrazvuku.
MRE pečene
MRE pečene podobne ako tranzientná elastografia meria rýchlosť šírenia mechanických vĺn pečenou, čo umožňuje kvantifikáciu elasticity pečene. Čím väčšia je tuhosť pečene, tým rýchlejšie je šírenie akustických vĺn. Výhodou je stanovenie tuhosti pečene v kontexte NAFLD s kvantifikáciou tuku v pečeni. Na rozdiel od tranzientnej elastografie má MRE potenciál posúdiť väčší objem pečene a poskytnúť úplné trojrozmerné informácie o vysokoelastických vlastnostiach tkanív. Okrem toho je možné ho aplikovať aj u pacientov s ascitom a obezitou. Štandardné kontraindikácie MR (kovové implantáty, pacemaker, klaustrofóbia) a vysoké náklady predstavujú obmedzenie tejto techniky. Nevýhodou je aj to, že sa nedá vykonať u pacientov s vysokým obsahom železa v pečeni z dôvodu obmedzenia signálu [10].
Každá zobrazovacia modalita má svoje výhody a nevýhody, ktoré ju predurčujú na klinické využitie, tieto sú zhrnuté v tab. 1.
Table 1. Použitie niektorých zobrazovacích metód v diagnostike NAFLD. Tab. 1. Use of some imaging methods in NAFLD diagnostics. 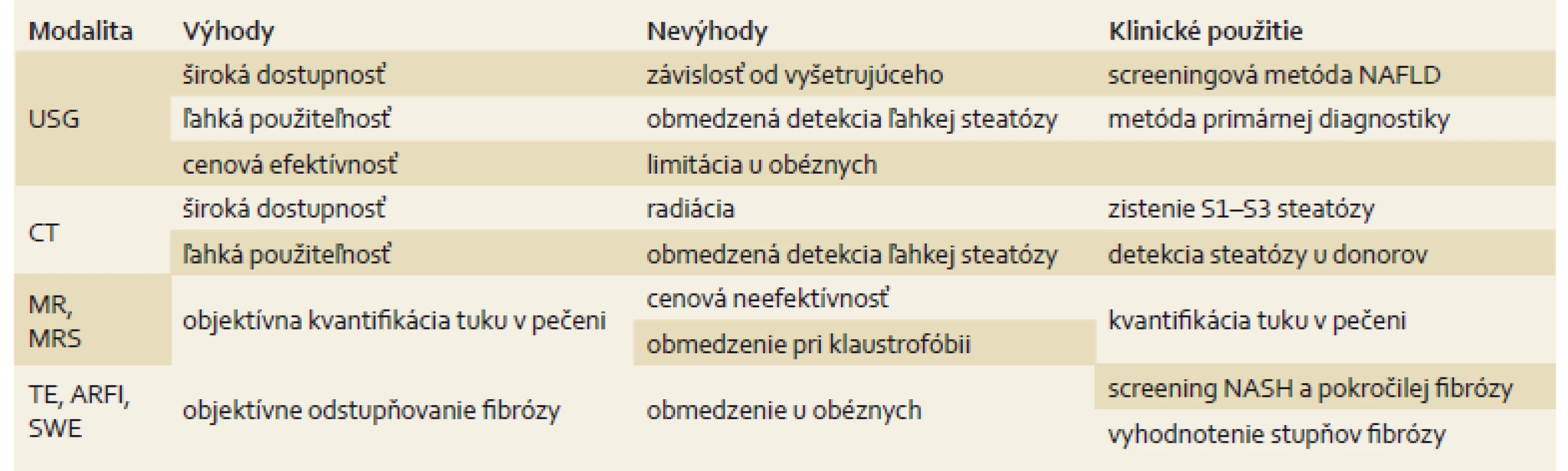
USG – ultrasonografia, CT – počítačová tomografia, MR – magnetická rezonancia, MRS – magnetická rezonančná spektroskopia, TE – tranzientná elastografia, ARFI – acoustic radiation impulse force imaging, SWE – shear waves elastography, NAFLD – nealkoholová tuková choroba pečene, NASH – nealkoholová steatohepatitída Zobrazovacie metódy majú nezastupiteľné postavenie v diagnostike NAFLD. Nutné je však zdôrazniť, že USG je najvhodnejšou screeningovou metódou a elastografia je zobrazovaciou modalitou schopnou oddiferencovať jednoduchú steatózu od jednotlivých štádií fibrózy [10].
Záver
Rôzne neinvazívne diagnostické metódy boli vypracované na odhalenie jednotlivých štádií NAFLD, ale iba niektoré z nich sú senzitívnymi a špecifickými pomocnými metodikami na diferenciáciu steatohepatitídy, stratifikáciu fibrózy a kvantifikáciu stukovatenia pečene, čo ukazuje tab. 2.
Table 2. Markery detekcie steatózy, NASH a fibrózy pečene. Tab. 2. Markers of steatosis detection, NASH and liver fibrosis. 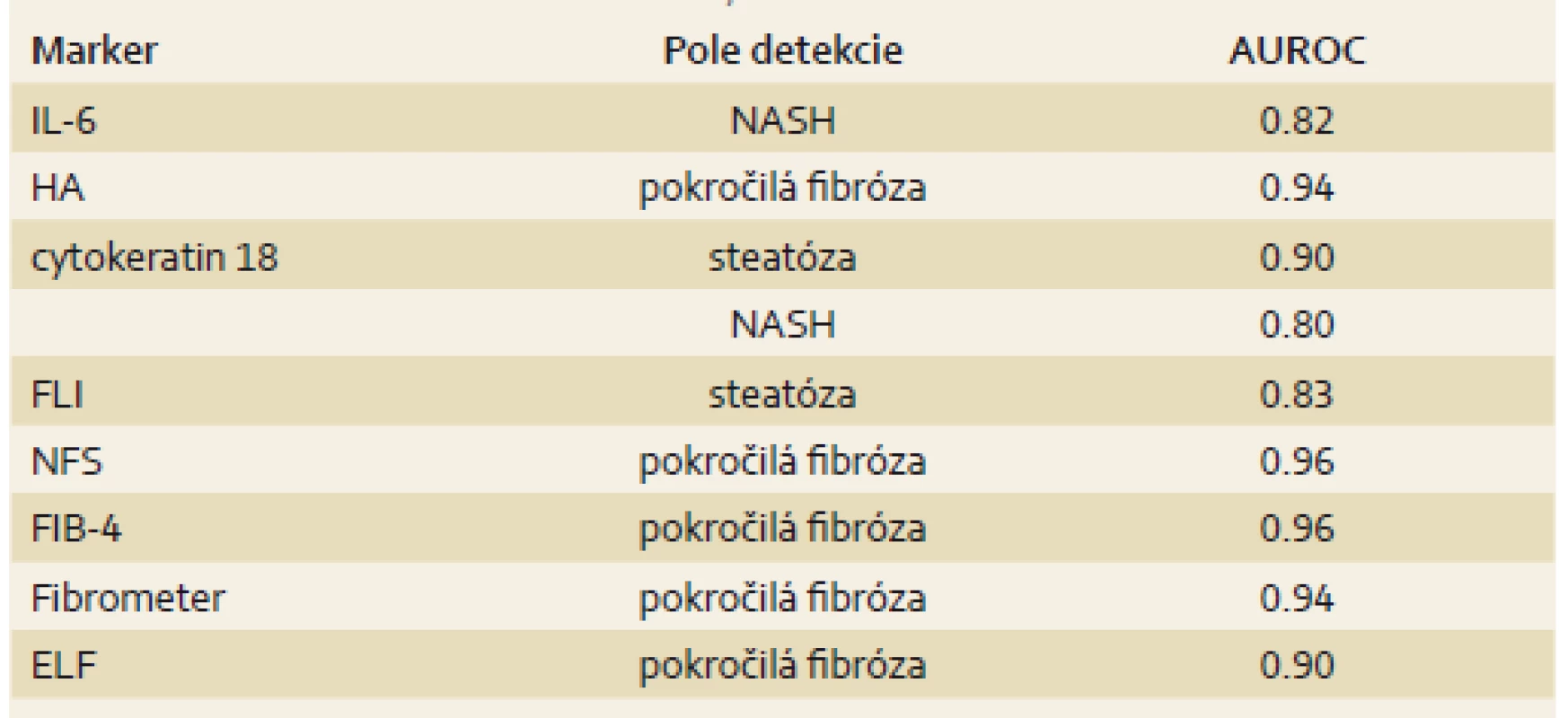
IL – interleukín, HA – kyselina hyaluronová, FLI – fatty liver index, NFS – NAFLD fibrosis score, FIB-4 – Fibrosis 4 index, ELF – Enhanced liver fibrosis panel, NASH – nealkoholová steatohepatitída Najsľubnejšími, široko použiteľnými a ľahko aplikovateľnými biochemickými markermi na vylúčenie pokročilej fibrózy sa zdajú byť FIB-4, NFS skóre a BARD skóre. Kedže prevalencia NAFLD vo svetovej populácii stúpa a NAFLD je spojená s vyšším kardiovaskulárnym rizikom a mortalitou, je nutné vyhľadávanie pacientov s NAFLD. Najspoľahlivejšou je kombinácia screeningových metodík – aktivita hepatálnych enzýmov a USG pečene. Necielená biopsia pečene stále zostáva zlatým štandardom v diagnostike jednotlivých štádií NAFLD. Neinvazívna diagnostika vyžaduje ďalší výskum metodík a ich overenie v klinickej praxi.
Práca bola riešená v rámci VEGA grantu č. 1/0808/15.
Článok vznikol za podpory spoľočnosti Gilead Sciences Slovakia s. r. o.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 27. 6. 2017
Přijato: 8. 7. 2017
prof. MUDr. Viera Kupčová, CSc.
III. interná klinika LF UK a UN Bratislava
Nemocnica akad. L. Dérera
Limbová 5
833 05 Bratislava
Slovenská republika
kupcova@vnet.sk
Sources
1. Sanal MG. Biomarkers in nonalcoholic fatty liver disease-the emperor has no clothes? World J Gastroenterol 2015; 21 (11): 3223–3231. doi: 10.3748/wjg.v21.i11.3223.
2. Speliotes EK, Yerges-Armstrong LM, Wu J et al. Genome-wide association analysis identifies variants associated with nonalcoholic fatty liver disease that have distinct effects on metabolic traits. PLoS Genet 2011; 7 (3): e1001324. doi: 10.1371/journal.pgen.1001324.
3. Hagström H, Nasr P, Bottai M et al. Elevated serum ferritin is associated with increased mortality in NAFLD after 16 years of follow-up. Liver Int 2016; 36 (11): 1688–1695. doi: 10.1111/liv.13144.
4. Boyraz M, Cekmez F, Karaogu A et al. Serum adiponectin, leptin, resistin and RBP4 levels in obese and metabolic syndrome children with nonalcoholic fatty liver disease. Biomark Med 2013; 7 (5): 737–745. doi: 10.2217/bmm.13.13.
5. Yoneda M, Uchiyama T, Kato S et al. Plasma Pentraxin3 is a novel marker for nonalcoholic steatohepatitis (NASH). BMC Gastroenetrol 2008; 8 : 53. doi: 10.1186/1471-230X-8-53.
6. Shen J, Chan HL, Wong GL et al. Assessment of non-alcoholic fatty liver disease using serum total cell death and apoptosis markers. Aliment Pharmacol Ther 2012; 36 (11–12): 1057–1066. doi: 10.1111/ apt.12091.
7. Dvorak K, Stritesky J, Petrtyl J et al. Use of non-invasive parameters of non-alcoholic steatohepatitis and liver fibrosis in daily practice – an exploratory case-control study. PloS One 2014; 9 (10): e111551. doi: 10.1371/journal.pone.0111551.
8. Huang X, Xu M, Chen Y et al. Validation of the Fatty Liver Index for Nonalcoholic fatty liver disease in middle-aged and elderly Chinese. Medicine (Baltimore) 2015; 94 (40): e1682. doi: 10.1097/MD.0000000000001682.
9. Borman MA, Ladak F, Crotty P et al. The Fatty Liver Index has limited utility for the detection and quantification of hepatic steatosis in obese patients. Hepatol Int 2013; 7 (2): 592–599. doi: 10.1007/ s12072-012-9401-4.
10. Cuthbertson DJ, Weickert MO, Lythgoe D et al. External validation of the fatty liver index and lipid accumulation product indices, using 1H-magnetic resonance spectroscopy, to identify hepatic steatosis in healthy controls and obese, insulin-resistant individuals. Eur J Endocrinol 2014; 171 (5): 561–569. doi: 10.1530/EJE-14-0112.
11. Lee JH, Kim D, Kim HJ et al. Hepatic steatosis index: a simple screening tool reflecting nonalcoholic fatty liver disease. Dig Liver Dis 2010; 42 (7): 503–508. doi: 10.1016/j.dld.2009.08.002.
12. Wang J, Xu C, Xun Y et al. ZJU index: a novel model for predicting nonalcoholic fatty liver disease in a Chinese population. Sci Rep 2015; 5 : 16494. doi: 10.1038/srep16494.
13. Poynard T, Lassailly G, Diaz E et al. Performance of biomarkers FibroTest, ActiTest, SteatoTest, and NashTest in patients with severe obesity: meta analysis of individual patient data. PLoS One 2012; 7 (3): e30325. doi: 10.1371/journal.pone.003 0325.
14. Raszeja-Wyszomirska J, Szymanik B, Ławniczak M et al. Validation in of the BARD scoring system in Polish patients with nonalcoholic fatty liver disease (NAFLD). BMC Gastroenterol 2010; 10 : 67. doi: 10.1186/1471-230X-10-67.
15. Angulo P, Hui JM, Marchesini G et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007; 45 (4): 846–854.
16. Demir M, Lang S, Schlattjan M et al. A new inexpensive and non-invasive scoring system to exclude advanced fibrosis in patients with NAFLD. PLoS One 2013; 8 (3): e58360. doi: 10.1371/journal.pone.0058360.
17. Miyaaki H, Ichikawa T, Nakao K et al. Clinicopathological study of nonalcoholic fatty liver disease in Japan: the risk factors for fibrosis. Liver Int 2008; 28 (4): 519–524.
18. Ratziu V, Giral P, Charlotte F et al. Liver fibrosis in overweight patients. Gastroenterology 2000; 118 (6): 1117–1123.
19. Guha IN, Parkes J, Roderick P et al. Noninvasive markers of fibrosis in nonalcoholic fatty liver disease: Validating the European Liver Fibrosis Panel and exploring simple markers. Hepatology 2008; 47 (2): 455–460.
20. Salvoza NC, Klinzing DC, Gopez-Cervantes J et al. Association of Circulating Serum miR-34a and miR-122 with Dyslipidemia among Patients with Non-Alcoholic Fatty Liver Disease. PLoS One 2016; 11 (4): e0153497. doi: 10.1371/journal.pone.0153497.
21. Koller T, Rác M. Neinvazívne, semiinvazívne a invazívne diagnostické modality v diagnostike portálnej hypertenzie a cirhózy na Slovensku. Gastronterol Prax 2015; 14 (1): 18–22.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2017 Issue 4-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Vplyv nitroglycerínu na manometrické parametre u pacientov s achaláziou
- Protézoduodenální píštěl – příčina masivního krvácení do gastrointestinálního traktu
- Možnosti použitia neinvazívnych metód pri nealkoholovej tukovej chorobe pečene
- Adenokarcinom tenkého střeva jako neobvyklý zdroj hypochromní anémie
- Akutní apendicitida – vzácná komplikace koloskopie
- Epidemiologická studie obezity v populaci rozdílného rasového, kulturního, ekonomického a dietního prostředí
- 35th Slovak and Czech Gastroenterological Congress and 39th Slovak and Czech Endoscopic Days
-
Komentář k lékovému profilu
Rifaximin – terapeutické vlastnosti - Výběr z mezinárodních časopisů
- Remsima® – první biosimilární infliximab CT-P13
- Sérové koncentrace S100P proteinu u pacientů s kolorektálním karcinomem
- Samoexpandibilní potahovaný metalický stent Daniš jako bridging k transplantaci jater
- Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
- Současné postavení telemedicíny v péči o pacienty s idiopatickými střevními záněty
-
Komentář k článku
Biosimilární infliximab v terapii anti-TNF naivních pacientů s IBD – jednoleté klinické sledování -
Endoscopic achievements in the upper gastrointestinal tract and small bowel
Christian Ell Lecture – Gastro Update Europe 2017, Vienna
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
- Samoexpandibilní potahovaný metalický stent Daniš jako bridging k transplantaci jater
- Akutní apendicitida – vzácná komplikace koloskopie
- Protézoduodenální píštěl – příčina masivního krvácení do gastrointestinálního traktu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

