-
Medical journals
- Career
Protézoduodenální píštěl – příčina masivního krvácení do gastrointestinálního traktu
Authors: J. Maceček 1; B. Staňka 1; J. Šťastný 1,2
Authors‘ workplace: Gastroenterologické oddělení, Nemocnice Prostějov, Středomoravská nemocniční a. s. 1; Chirurgické oddělení, Nemocnice Prostějov, Středomoravská nemocniční a. s. 2
Published in: Gastroent Hepatol 2017; 71(4): 310-314
Category: Clinical and Experimental Gastroenterology: Case Report
doi: https://doi.org/10.14735/amgh2017310Overview
Patologická komunikace mezi aortou a trávicím traktem je velmi závažná, má vysokou mortalitu a řadí se mezi náhlé příhody břišní nebo také náhlé příhody cévní. Prvním projevem je nejčastěji krvácení do horní části gastrointestinálního traktu. Aortoenterální píštěl je patologické spojení mezi aortou a tenkým střevem, nejčastěji duodenem. Jde o vzácný patologický stav, který bez akutní kauzální terapie vždy končí smrtí nemocného. Problematická je včasná diagnostika, která je ale podmínkou úspěšné terapie. Častěji se v klinické praxi jedná o sekundární, tzv. protézoenterální (duodenální) píštěl. Primární aortoenterální (duodenální) píštěl je vzácná a je vždy spojena s patologií aorty, jako jsou aneuryzma nebo zánětlivé změny aorty. Stejně tak raritní je komunikace mezi stentgraftem po předchozím endovaskulárním řešení aneuryzmatu břišní aorty a trávicím traktem. Uvádíme kazuistiku pacienta, u kterého byla úspěšně diagnostikována píštěl, jejíž první manifestací byly intermitentní enteroragie, které později progredovaly v masivní krvácení, a pacient tak musel být akutně operován. Vzhledem k závažnosti stavu a věku zmírá pacient v časném pooperačním období. Tento případ poukazuje na nutnost pečlivého odebrání anamnézy, včasné a správně vedené diagnostiky, které jsou klíčem k úspěšné terapii, která je ale velice svízelná.
Klíčová slova:
enteroragie – aortoenterální píštěl – protézoenterální píštělPopis případu
Uvádíme kazuistiku 82letého muže, hypertonika, po operaci aneuryzmatu břišní aorty s implantací bifurkační aortobiilické protézy v roce 2012, jinak bez komorbidit. Byl hospitalizován na chirurgickém oddělení pro tři epizody enteroragie během 1 dne. Podobné obtíže udával již 4 dny před přijetím, vč. slabosti a vertiga. Ambulantní chirurg provedl vyšetření per rectum, které neprokázalo rezistenci v dosahu prstu a na rukavici ulpívalo nevelké množství čerstvé krve.
Fyzikální nález a laboratorní vyšetření – TK 112/50, TF 52/min (vstupně hemodynamicky stabilní s nevýznamným krvácením, užívání β-blokátorů), akce srdeční pravidelná, pacient bez dušnosti, afebrilní, břicho klidné, jizva po operaci aneuryzmatu abdominální aorty klidná, patrna volná diskrétní hernie v jizvě, břicho bylo palpačně nebolestivé, jinak fyzikální nález fyziologický. Laboratorně přítomna normocytární, normochromní anémie, hemoglobin 93 g/l, erytrocyty 2,94 × 1012/l, leukocyty v normě, C reaktivní protein 21 mg/l, urea 9 mmol/l, kreatinin 105 μmol/l, trombocyty 121 × 109/l, jinak bez pozoruhodností. Vstupně byla provedena ezofagogastroduodenoskopie s průkazem refluxních změn aborálního jícnu, v lumen žaludku detekováno jezírko s příměsí hematinu a prokázána lehká bulbopatie. Oblast žaludku a duodena byla špatně přehledná pro zbytky stravy.
Pacient byl hospitalizován s nasazením terapie inhibitory protonové pumpy parenterálně. Na oddělení docházelo epizodicky k hematochezii s poklesem v krevním obraze, leukocytózou, celkovým dyskomfortem pacienta, ale oběhovou stabilitou. Následoval překlad na chirurgickou jednotku intenzivní péče (JIP) a po klasické přípravě byla indikována koloskopie. Již při přípravě hojně odcházela čerstvá krev. Koloskopie verifikovala čerstvou krev v celém tračníku vč. terminálního ilea, bez jednoznačného zdroje krvácení do dolního gastrointestinálního traktu (GIT). Byla provedena opět endoskopie horního GIT s průkazem čerstvé krve v žaludku s verifikací krvácejícího pahýlu cévy v D3 duodenu charakteru Dieulafoyovy léze (obr. 1 a 2). Endoskopista provedl hemostázu nasazením hemoklipů a opichem okolí ředěným adrenalinem. Krvácení jednoznačně ustalo, ale vzhledem k anamnéze operace břišní aorty lékař indikoval ještě CT angiografii (CTA), kde byly v D3 duodenu patrny klipy po předchozím endoskopickém výkonu, leak kontrastní látky do střevního lumen nebyl prokázán, ale lumen abdominální aorty se v této lokalizaci (cca 2 cm pod odstupem renálních tepen) vyklenovalo a plus v náplni prominovalo do stěny duodena a směřovalo ke klipům (obr. 3–5). CT vyšetření podporovalo diagnózu sekundární aortoduodenální píštěle. Pacient byl přeložen na pracoviště cévní chirurgie a týž den byl pro pokračující krvácení do GIT akutně operován. Peroperační nález prokázal infikovanou cévní protézu, sterkorální peritonitidu a aortoduodenální píštěl v oblasti proximální části protézy. Pacienti v pokročilém věku mohou mít i při takto závažném nálezu překvapivě chudou břišní symptomatologii ve smyslu peritoneálního dráždění. Z laparotomie byla provedena replantace protézy, sutura aorty, zrekonstruován axilofemorální bypass a resekována část postiženého duodena. Pacient byl po operaci umístěn na JIP a druhý pooperační den i přes masivní inotropní podporu a intravenózní aplikaci širokospektrých antibiotik zmírá. Příčinou úmrtí byl dle pitevního nálezu septický stav při akutní sterkorální peritonitidě a velké množství krve v tenkém i tlustém střevě, ale již bez známek aktivního krvácení do GIT.
Image 1. Ústí protézoenterální píštěle v duodenu. Fig. 1. Prosthetic-enteral fistula orifice into the duodenum. 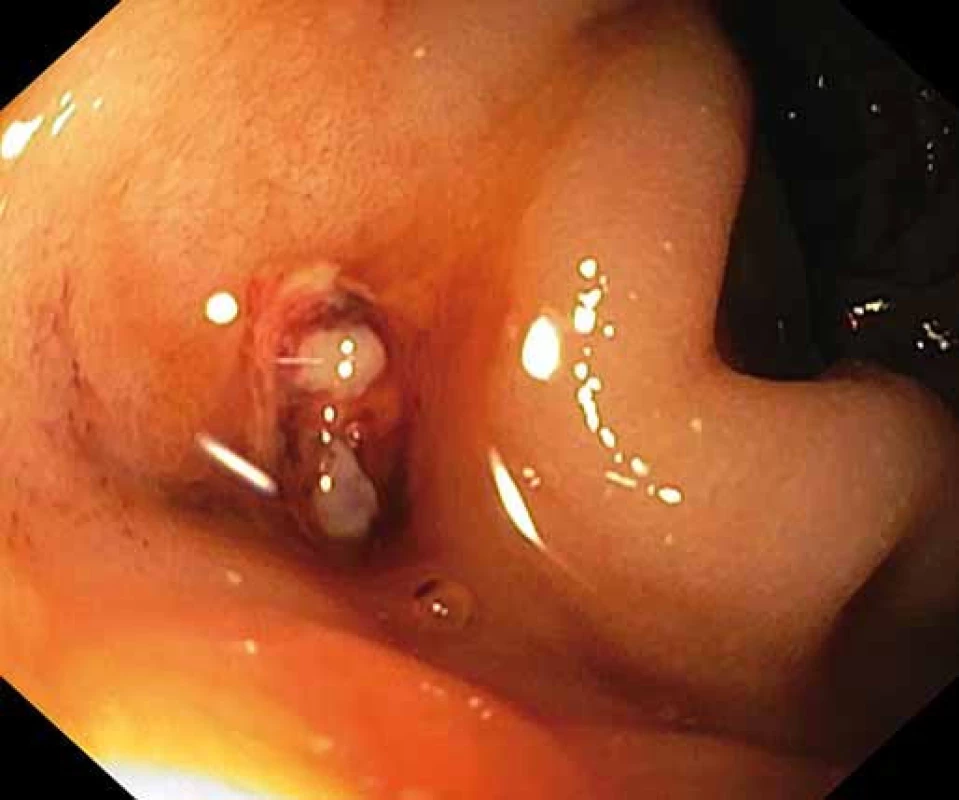
Image 2. Hemoklipy umístěné do oblasti ústí píštěle. Fig. 2. Hemoclips located in the fistula orifice. 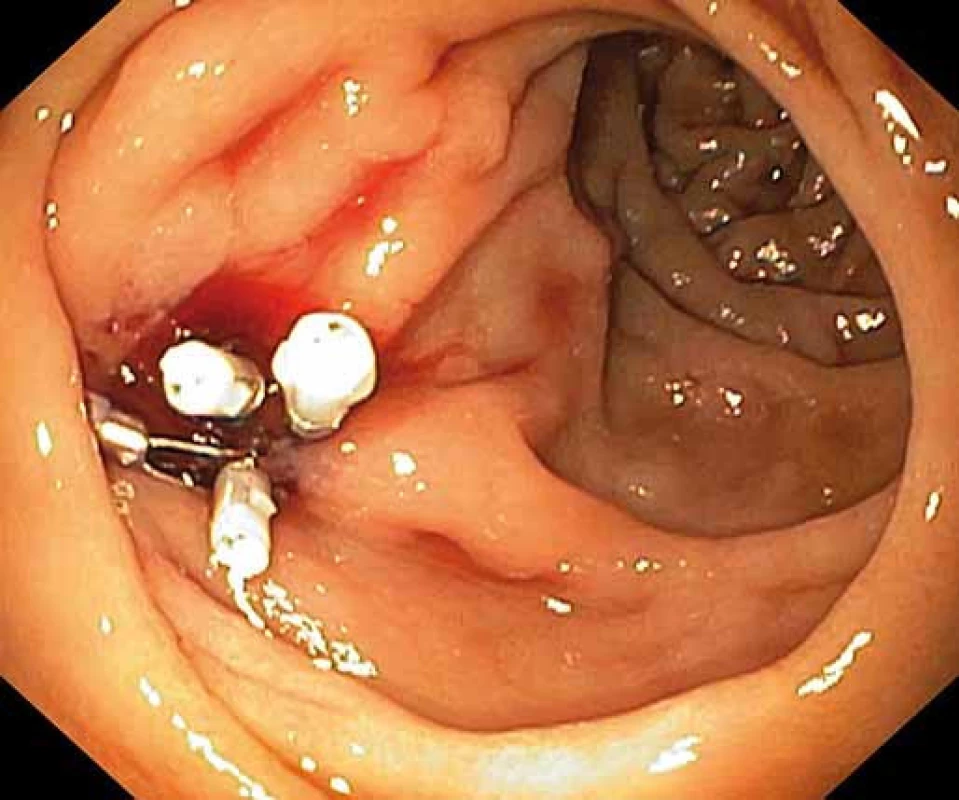
Image 3. CT angiografie, transverzální zobrazení, arteriální fáze (šipka ukazuje píštěl). Fig. 3. CT angiography, transversal view, arterial phase (the arrow points to the fistula). 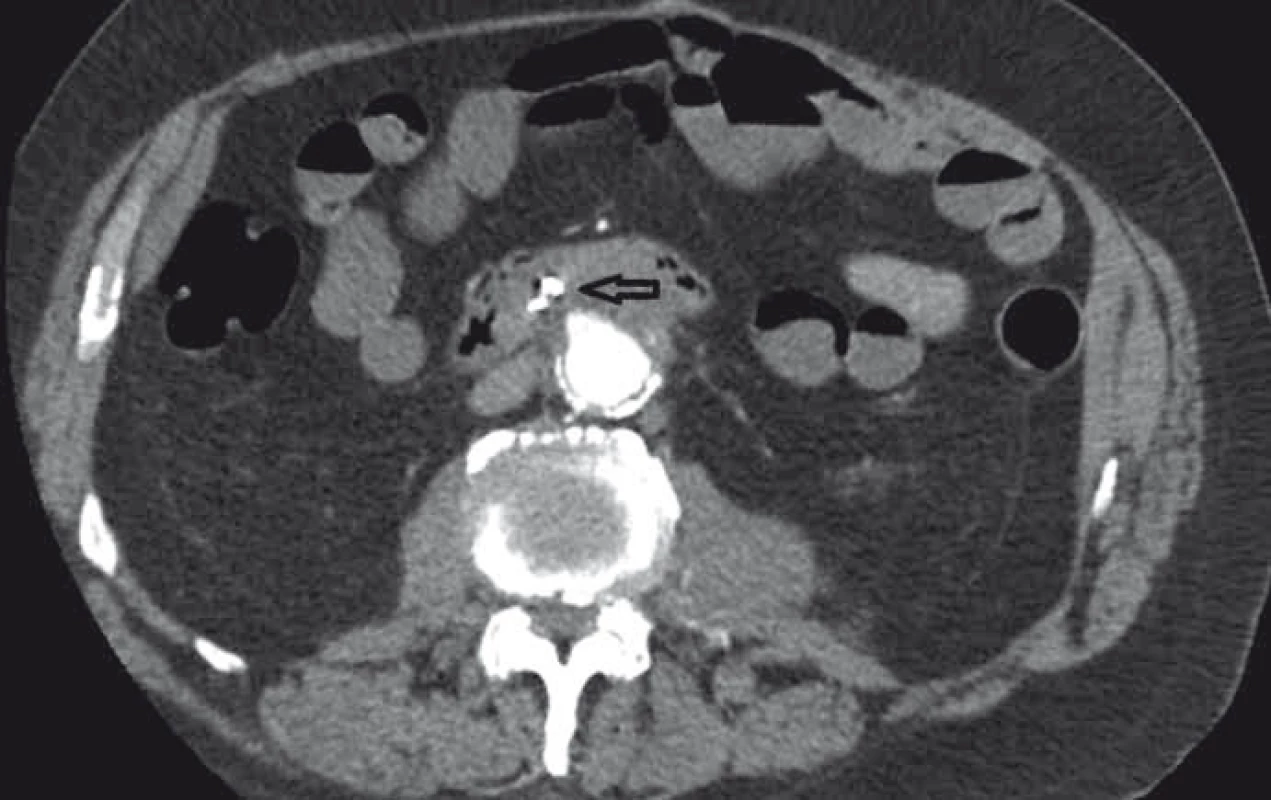
Image 4. CT angiografie, boční zobrazení, arteriální fáze (šipka ukazuje píštěl). Fig. 4. CT angiography, lateral view, arterial phase (the arrow points to the fistula). 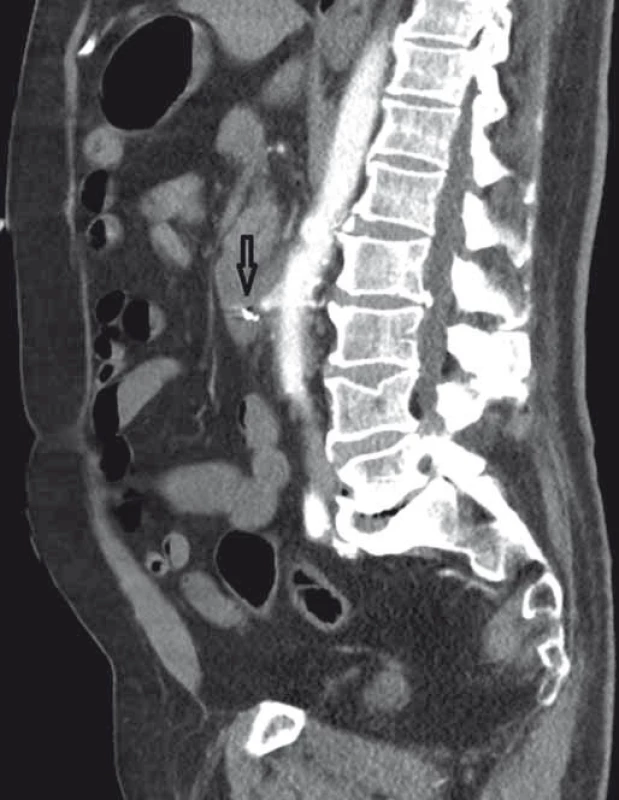
Image 5. CT angiografie, frontální zobrazení, venózní fáze (šipka ukazuje píštěl). Fig. 5. CT angiography, frontal view, venous phase (the arrow points to the fistula). 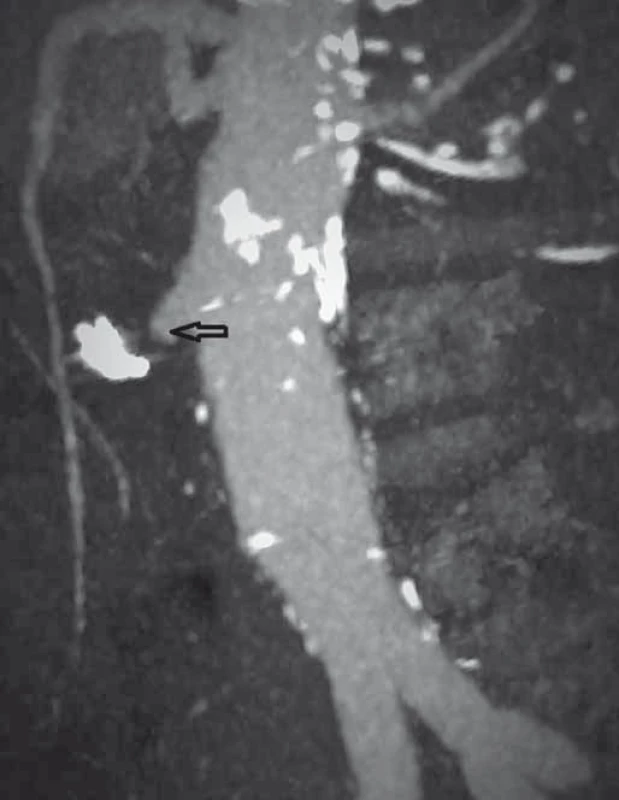
Diskuze
Krvácení do horní nebo dolní části GIT je častým patologickým stavem, který musí gastroenterolog prakticky denně řešit ať už ve smyslu primárních příčin nebo jako komplikaci terapeutických endoskopických metod. Krvácení do horní části trávicí trubice je klinicky závažnější a vyžaduje multioborový přístup. Existuje celá řada diagnóz s lokálními nebo systémovými příčinami, které vyústí v krvácení do horní části trávicího traktu. Nejčastější příčinou, i když s klesajícím podílem, je vředová choroba gastroduodena (21–55 %), dále jsou to jícnové a žaludeční varixy (10–14 %), erozivní či hemoragické gastropatie (9–19 %), v menší míře pak gastritidy, ezofagitidy a Mallory-Weissův syndrom [1]. Cévní malformace, např. Dieulafoyova choroba, jsou méně časté, ale mohou způsobovat masivní krvácení. Aortoenterální píštěl patří mezi raritní, ale mnohdy letální příčiny. Důvodem zejména chronických krevních ztrát bývají žaludeční antrální vaskulární ektazie, portální hypertenzní gastropatie, Cameronovy eroze a vředy a nádory horní části GIT [2]. Nejvzácnější jsou hemobilie nebo hemosuccus pancreaticus při akutní nebo chronické pankreatitidě [3].
Z klinického pohledu je velice důležité, že až 80 % případů nevarikózního krvácení má lehký průběh a zastaví se spontánně nebo konzervativně a úspěšnost endoskopické hemostázy je až 90 %. Potenciálně život ohrožujících stavů je zbývajících 20 % nevarikózního krvácení a i přes nesporný pokrok v diagnostice a léčbě těchto pacientů zůstává celkové ovlivnění mortality prakticky beze změn. Příčinou tohoto „neúspěchu“ jsou zejména závažné přidružené choroby, které vedou k periprocedurálním komplikacím [4].
Jedním z nejzávažnějších patologických stavů je krvácení do horního GIT způsobené komunikací mezi aortou a trávicí trubicí. Tento stav se řadí mezi náhlé příhody břišní nebo také náhlé příhody cévní. Aortoenterální píštěl je patologické spojení mezi aortou a tenkým střevem. Ve 3/4 případů se jedná o spojení s duodenem [5]. Jde o vzácnou diagnózu, která bez akutní kauzální terapie končí smrtí nemocného.
Primární aortoenterální píštěl je vzácná, její incidence se pohybuje kolem 0,05 % a je vždy spojena s patologií aorty, jako jsou aneuryzma břišní aorty (AAA) nebo aortitida [6]. Mezi extrémně vzácné příčiny zodpovědné za vznik píštěle patří tumory a pseudocysty pankreatu, divertikl duodena, poradiační změny nebo spolknutí cizího tělesa [7]. Tuto píštěl poprvé popsal Astley Cooper v roce 1822 [8].
Častěji se v klinické praxi setkáváme se sekundární aortoduodenální, resp. protézoduodenální píštělí (náš případ). Její incidence se pohybuje od 0,4 do 1,4 % [9]. Jedná se o jednu z nejzávažnějších pozdních pooperačních komplikací. Poprvé byla popsána Brockem v roce 1953 [10]. Časový interval mezi operací a vznikem píštěle je různý, pohybuje se v rozpětí od několika dnů do 20 let, s průměrem okolo 6 let [11]. V našem případě byl interval od operace do vzniku píštěle 4 roky. Častěji se vyskytuje u rekonstrukčních výkonů pro okluzi v aortoilické oblasti s end-to-side anastomózou než po resekci AAA. Je to zřejmě dáno mechanickou iritací duodena naléhajícího na cévní protézu při zachování nedostatečně silné vrstvy interpolované tkáně. Svůj podíl má zřejmě i vliv nadbytečné aortální komponenty graftu, a tím příliš otevřený úhel mezi aortou a graftem [12]. Sekundární píštěl je rozdělována na I. a II. typ, kdy I. typ je dokonaná píštěl a II. typ je označován jako „graft-enteric erosion“. První typ se dělí na dvě subkategorie IA a IB dle přítomnosti pseudoaneuryzmatu [13].
Nejčastěji je postižena 3.–4. část duodena (75–90 %) komunikací s proximální částí anastomózy v místě často přítomného pseudoaneuryzmatu (typ IA). Rizikovým faktorem je lokální infekce. Čím déle je graft implantován, tím je odolnější vůči infekci. Zcela raritní je komunikace mezi aortou a tračníkem, asi 5–6 % případů [11]. Stejně tak raritní je komunikace mezi stentgraftem po předchozím endovaskulárním řešení AAA a trávicím traktem, kdy je příčinou nejčastěji technické selhání stentgraftu [14].
Hlavními symptomy aortoduodenální píštěle jsou hemateméza, enteroragie, meléna, bolesti břicha a febrilie. Vzácnější jsou pak bolesti vystřelující do zad nebo pulzující rezistence. Běžně se objevuje nejprve ne příliš velké krvácení (herald bleeding), které často spontánně ustává uzávěrem píštěle trombem a až při recidivě dochází k masivnímu krvácení a nezřídka k rozvoji hemoragického šoku [15]. Díky tomu získáváme časové okno k diagnostice a následné terapii, nicméně diagnóza aortoenterální píštěle zůstává i tak často pozdní.
V diagnostice se kromě fyzikálního vyšetření, které může odhalit hmatnou pulzující rezistenci, melénu, hematemezu nebo enteroragii (hematochezii), uplatňuje CTA, která odhalí prosáknutí kolem aorty a setřelou hranici mezi cévou a GIT, může být patrný také únik kontrastní látky z aorty do duodena nebo přítomnost plynu v okolí aorty. Nicméně CT je diagnostické zhruba v 1/3 případů [11]. Endoskopické vyšetření horního GIT (ezofagogastroduodenoskopie) často přichází jako první v celém algoritmu vyšetřovacího procesu, ale senzitivita pro detekci aortoenterální píštěle je jen 25 % [11]. Píštěl imponuje spíše jako Dieulafoyova léze (vlastní zkušenost), ale ústí může být malé, kryté koagulem nebo skryté ve slizniční řase, v některých případech je vzácně patrný i materiál cévní protézy v defektu sliznice [16]. Úloha endoskopie spočívá jednak ve vyloučení jiných příčin krvácení do GIT a problémem je, že může být i nebezpečná, neboť vlastní insuflace vzduchu může vést k otevření píštěle a vzniku masivního krvácení. Kruciální je v tomto ohledu osobní anamnéza prodělané cévní intervence v oblasti aorty. Další metodou v diagnostickém algoritmu je aortografie, ale i ta má diagnostickou senzitivitu asi 20 % [11]. Ve sporných případech je možno indikovat u stabilních nemocných pozitronovou emisní tomografii CT. Největší senzitivitu, asi 62 %, má explorativní laparoskopie nebo laparotomie.
V případě úspěšné diagnózy je nutno chirurgicky intervenovat s cílem co nejrychlejší zástavy krvácení. Bez radikální léčby končí všechny případy smrtí nemocného, a proto je třeba operace i u nevýznamného krvácení s ohledem na možnost rozvoje masivního krvácení. Principem chirurgické léčby je resekce postižené aorty, v případě sekundárních píštělí pak kompletní replantace protézy, následná tepenná rekonstrukce a ošetření defektu duodena. Výkon má vysokou mortalitu a morbiditu. Třicetidenní mortalita se pohybuje okolo 50–70 %. Druhou možností je slepý uzávěr aorty pod odstupem renálních tepen, débridement a založení extraanatomické rekonstrukce, nejčastěji aortobifemorální bypass. Tento výkon je dvoudobý, v první době se provádí rekonstrukce a ve druhé době resekce aorty a ošetření duodena (resekce s end-to-end anastomózou nebo slepý uzávěr duodena a rekonstrukce trávicího traktu pomocí exkludované Y-kličky dle Rouxe) [17]. Kontroverzní možností je endovaskulární výkon s implantací stentu a je používán spíše jako přemosťující terapie k chirurgickému zákroku. Samozřejmostí je dlouhodobé podávání širokospektrých antibiotik.
Závěr
Krvácení do horní části trávicího traktu je v gastroenterologii poměrně častou patologií, která ale vyžaduje multidisciplinární přístup. Existuje řada patologických stavů, které jsou velmi časté, jako je vředová choroba gastroduodena, záněty, nádory, jícnové varixy atd. Na druhé straně však musíme uvažovat i o patologických stavech vyloženě raritních, ale o to více nebezpečných, hůře diagnostikovatelných a ještě hůře léčitelných. Mezi tyto stavy patří aortoenterální píštěl, která bez cílené a rychlé diagnostiky a včasné terapie rychle vede ke smrti postiženého z exsangvinace a hemoragického šoku.
V případě aortoduodenálních píštělí je důležitá kvalitní a rychlá diagnostika, jež zde vychází zejména z poctivé a kvalitně provedené osobní anamnézy, která odhalí předchozí cévní operaci. Z praktického hlediska, pokud provedeme endoskopii horního GIT, která neodhalí zdroj krvácení, a pacient objektivně krvácí (makroskopicky, pokles hemoglobinu) a je u něj přítomna osobní anamnéza cévní rekonstrukce v oblasti břišní aorty, pak je potřeba v druhém kroku provést CTA a nikoli opakovat endoskopické vyšetření, které v této fázi může být spíše nebezpečné v důsledku iatrogenního otevření píštěle z důvodu insuflace a masivního krvácení do GIT. Typický průběh zahrnuje nejprve nevelké, hemodynamicky nevýznamé krvácení (herald bleeding), na které navazuje masivní krvácení. Toto časové okno otevírá možnost provedení diagnostiky a rychlé odeslání na chirurgické pracoviště.
Na cévní příčiny krvácení do horního GIT je potřeba myslet, a to i na raritní stavy, jakými jsou právě arterioenterální píštěle. Jejich diagnostika je obtížná a kurativní terapie, zvláště u letitých a polymorbidních nemocných, je často nemožná.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 4. 5. 2017
Přijato: 8. 7. 2017
MUDr. Mgr. Jaroslav Maceček, Ph.D.
Gastroenterologické oddělení
Nemocnice Prostějov
Středomoravská nemocniční a. s.
Mathonova 291/1
796 04 Prostějov
jaroslav.macecek@smn.agel.cz
Sources
1. Procházka V, Konečný M. Krvácení do horní části trávicího traktu. Postgrad Med 2013; 15 (3): 74.
2. Cameron AJ. Incidence of iron deficiency anemia in patients with large diaphragmatic hernia. A controlled study. Mayo Clin Proc 1976; 51 (12): 767–769.
3. Janík V, Pádr R, Keil R et al. Léčba hemosuccus pancreaticus embolizací obou gastrických tepen. Cas Lek Cesk 2008; 147 (10): 538–541.
4. Svoboda P, Konečný M, Hrabovský V et al. Přínos centralizace péče o pacienty s akutním krvácením do horního trávicího traktu. Vnitř Lék 2012; 58 : 191–195.
5. Barry PA, Molland JG, Falk GL. Primary aortoduodenal fistula. Aust N Z J Surg 1998; 68 (3): 243–244.
6. Alzobydi AH, Gurava SS. Primary aortoduodenal fistula: a case report. World J Gastroenterol 2013; 19 (3): 415–417. doi: 10.3748/wjg.v19.i3.415.
7. Başer M, Arslantürk H, Kisli E et al. Primary aortoduodenal fistula due to a swallowed sewing needle: a rare cause of gastrointestinal bleeding. Ulus Travma Acil Cerrahi Derg 2007; 13 (2): 154–157.
8. Cooper A. The lectures of Sir Astley Cooper on the Principles and Practice of Surgery with Additional Notes and Cases by F. Tyrell. 5th ed. Philadelphia: PA Haswell, Barrington and Haswell 1939.
9. O’Brien S, Ernst C. Aorto-enteric fistulas. In: Rutherford R (ed). Vascular surgery. 5th ed. Philadelphia: Saunders 2000 : 763–775.
10. Brock RC. Aortic homografting: a report of six successful cases. Guys Hosp Rep 1953; 102 : 204–228.
11. Pipinos II, Carr JA, Haithcock BE et al. Secondary aorto-enteric fistula. Ann Vasc Surg 2000; 14 (6): 688–696.
12. Moláček J, Třeška V, Čertík B et al. Aortoenterální a protézoenterální píštěl – závažná náhlá příhoda břišní. Cor et Vasa 2015; 57 : 108–114.
13. Marolt U, Potrc S, Bergauer A et al. Aorto-duodenal fistula three years after aorto-bifemoral bypass: case report and literature review. Acta Clin Croat 2013; 52 (3): 363–368.
14. Janne d’Othée B, Soula P, Otal P et al. Aortoduodenal fistula after endovascular stent-graft of an abdominal aortic aneurysm. J Vasc Surg 2000; 31 (1): 190–195. doi: 10.1016/S0741-5214 (00) 70081-4.
15. Grassia R, Staiano T, Iiritano E et al. Gastrointestinal hemorrhage caused by secondary aorto-duodenal fistula: a case report. Eur Rev Med Pharmacol Sci 2009; 13 : 147–150.
16. Felt V, Röhling S et al. Neobvyklá příčina krvácení do trávicího ústrojí – píštěl mezi duodenem a aortobifemorálním bypassem. Čes slov gastroenterol 1998; 52 (4): Abstrakt 7.
17. Bergqvist D, Björck M. Secondary arterioenteric fistulation – a systemic literature analysis. Eur J Vasc Endovasc Surg 2009; 37 (1): 31–42. doi: 10.1016/j.ejvs.2008. 09.023.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2017 Issue 4-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Vplyv nitroglycerínu na manometrické parametre u pacientov s achaláziou
- Protézoduodenální píštěl – příčina masivního krvácení do gastrointestinálního traktu
- Možnosti použitia neinvazívnych metód pri nealkoholovej tukovej chorobe pečene
- Adenokarcinom tenkého střeva jako neobvyklý zdroj hypochromní anémie
- Akutní apendicitida – vzácná komplikace koloskopie
- Epidemiologická studie obezity v populaci rozdílného rasového, kulturního, ekonomického a dietního prostředí
- 35th Slovak and Czech Gastroenterological Congress and 39th Slovak and Czech Endoscopic Days
-
Komentář k lékovému profilu
Rifaximin – terapeutické vlastnosti - Výběr z mezinárodních časopisů
- Remsima® – první biosimilární infliximab CT-P13
- Sérové koncentrace S100P proteinu u pacientů s kolorektálním karcinomem
- Samoexpandibilní potahovaný metalický stent Daniš jako bridging k transplantaci jater
- Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
- Současné postavení telemedicíny v péči o pacienty s idiopatickými střevními záněty
-
Komentář k článku
Biosimilární infliximab v terapii anti-TNF naivních pacientů s IBD – jednoleté klinické sledování -
Endoscopic achievements in the upper gastrointestinal tract and small bowel
Christian Ell Lecture – Gastro Update Europe 2017, Vienna
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
- Samoexpandibilní potahovaný metalický stent Daniš jako bridging k transplantaci jater
- Akutní apendicitida – vzácná komplikace koloskopie
- Protézoduodenální píštěl – příčina masivního krvácení do gastrointestinálního traktu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

