-
Medical journals
- Career
LÉČBA KARCINOMU PROSTATY V ČESKÉ REPUBLICE V ROCE 2016 – VÝSTUPY ZE SEMINÁŘŮ O METASTATICKÉM KASTRAČNĚ REFRAKTERNÍM KARCINOMU PROSTATY (MCRPC)
Authors: Michaela Matoušková 1,4,5; Marko Babjuk 2,4; Jan Krhut 3,4; Veronika Črepová 4
Authors‘ workplace: Urocentrum Praha 1; Urologická klinika 2. LF a FN Motol, Praha 2; Urologické oddělení FN Ostrava 3; Česká akademie urologie, Česká urologická společnost ČLS JEP 4; Onkologická klinika FTN a 1. LF UK, Praha 5
Published in: Ces Urol 2017; 21(1): 85-95
Category: Information
Overview
V průběhu jara 2016 proběhlo 13 workshopů ve větších městech České republiky za velké účasti urologů i onkologů na téma léčba metastatického kastračně refrakterního karcinomu prostaty (mCRPC). Na všech místech byl obdobný scénář, úvodní sdělení o mCRPC a diskutovaná kazuistika s hledáním konsenzu ve skupince onkologů a urologů rozdělených do týmu vedených lokálními specialisty (urologem a onkologem) a srovnání výstupu obou skupin. Závěry konsenzuálních výstupů workshopů nyní předkládáme ve sdělení.
KLÍČOVÁ SLOVA:
Zhoubné nádory prostaty, hormonálně senzitivní karcinom prostaty, metastatický kastračně refrakterní karcinom prostaty.ÚVOD
Vysoká incidence, narůstající prevalence i příchod nových možností farmakoterapie karcinomu prostaty přitahují velkou pozornost odborné veřejnosti. Přes vysokou kvalitu onkologických populačních dat v ČR nejsou k dispozici přesné údaje o počtu žijících pacientů s metastatickým kastračně refrakterním karcinomem prostaty (mCRPC). Důvodem je skutečnost, že tato fáze onemocnění netvoří samostatné stadium v TNM klasifikaci, ale je zařazována do kategorie generalizovaných onemocnění. Odhadem předpokládáme, že v ČR žije kolem 1 000 mužů s mCRPC.
Česká urologická společnost věnuje mCRPC i novým možnostem léčby trvalou pozornost. V roce 2016 proběhlo na 12 místech republiky celkem 13 seminářů na téma „Problematika kastračně refrakterního karcinomu prostaty“. Mezi přednášejícími se vystřídalo 35 odborníků z řad urologů a onkologů. Mezi účastníky pak bylo více než 300 lékařů, z nich 2/3 tvořili urologové, téměř třetina pak byli onkologové či radioterapeuti. Diskuze v pracovních skupinách kopírovala rozhodování multidisciplinárních týmů (MDT), kam by měli být pacienti s pokročilými nádorovými onemocněními referováni, v doporučeních jsou explicitně jmenováni pacienti s mCRPC (1).
DEFINICE A SOUČASNÉ MOŽNOSTI LÉČBY
Náplní úvodních sdělení na seminářích byl současný pohled na diagnostiku a léčbu mCRPC. Nová definice mCRPC zásadním způsobem mění náhled na dobu rozvoje kastračně refrakterního onemocnění. Podle Doporučení Evropské urologické společnosti považujeme onemocnění za kastračně refrakterní, pokud má muž se zhoubným nádorem prostaty kastrační hladinu testosteronu (<50 ng/dl, resp. 1,7 nmol/l v séru) spolu s jedním z následujících kritérií – biochemická progrese (tři po sobě následující vzestupy PSA s odstupem minimálně jednoho týdne, s hodnotou o 50 % nad nadir a současně PSA>2 μg/l) nebo radiologická progrese, tj. dvě nebo více nových kostních lézí prokazatelných na kostním scanu nebo progrese lézí měkkých tkání dle RECIST kritérií (1). Tím se mění i pohled na okamžik, kdy by měl být pacient referován multidisciplinárnímu týmu se zvážením další terapie.
Koncem 90. let minulého století se rozšířilo armamentárium léčebných možností mCRPC o chemoterapii. Do té doby byly nádory prostaty s výjimkou neuroendokrinního karcinomu považovány za chemorezistentní. Ke kombinovanému estramustinfosfátu tak přibyl mitoxantron, antracenoid s výraznou kumulativní kardiotoxicitou. Standardem léčby pak začátkem tisíciletí začalo být podání docetaxelu s prednisonem (DOC+P), optimálně ve třítýdenním režimu. Tento režim jako první prokázal prodloužení přežití u symptomatických pacientů s mCRPC (2). Přestože patří režim k celkem dobře tolerovaným typům cytotoxické léčby, je zatížen nežádoucími účinky hematologickými i nehematologickými, především neurotoxicitou, alopecií, změnami nehtů. Obvykle bývá podáno 8–10 cyklů. Logicky se pak otevírá otázka, co dělat po selhání režimu DOC+P. Odpovědi nám přinesly výstupy z kontrolovaných klinických studií. Na jejich podkladě byly následně schvalovány regulačními agenturami nové přípravky, ať již cytotoxický kabazitaxel (3), nové generace hormonálních přípravků (abirateron, enzalutamid) (4, 5, 6, 7), v Evropě nedostupná imunoterapie (sipuleucel T) (8) nebo látky ovlivňující kostní metabolizmus (bisfosfonáty, denosumab) (9) a nejnověji alfazářič 223-Radium (10). Studie nám také naznačily, ve které fázi onemocnění konkrétní léčbu zahájit. Při iniciaci zvažujeme množství ukazatelů, abychom maximálně individualizovali léčbu pro konkrétního pacienta (přítomnost symptomů, performance status, komorbidity, ukazatele tumoru – zejména Gleasonovo skóre (GS), hladiny nádorových markerů, odpověď i trvání vůči předchozí terapii a další). Léčebné režimy se vyvíjejí, podání chemoterapie může předcházet aplikace ARTA.O optimální sekvenci léčby však zatím máme k dispozici jen málo údajů a ta bude předmětem dalších studií.
Image 1. Přehled možností léčby CRPC (upraveno podle Ferlay [13]) Fig. 1 Overview of treatment options for CRPC (adapted according to Ferlay [13]) ![Přehled možností léčby CRPC (upraveno podle Ferlay [13])
Fig. 1 Overview of treatment options for CRPC (adapted according to Ferlay [13])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2be0255f5276e45335fb0f1df7e4f9dc.png)
Začleňování nových léčivých přípravků do algoritmu léčby a způsob úhrady z veřejného zdravotního pojištění stanovuje a upravuje regulační agentura. Tím mění i rozsah péče poskytované urologem. Jeho doménou zůstává péče o urologický stav pacienta a z větší části léčba hormonálně senzitivního onemocnění. Na podkladě studií CHAARTED a STAMPEDE i u pacientů s velkým metastatickým objemem postižení může být chemohormonoterapie, tedy iniciální přidání šesti cyklů docetaxelu ve třítýdenním podání k hormonální supresi (11, 12), zařazena mezi standardní postupy v primární léčbě high volume hormonálně (kastračně) senzitivního karcinomu prostaty (CSPC) (1). Výstupy budou jistě revidovány, budeme se snažit jasně definovat skupinu pacientů, která bude mít jednoznačný benefit.
V současné době je podání docetaxelu pacientům s CSCP off label, při indikaci a podání se můžeme opřít o doporučení EAU i Modrou knihu ČOS.
ZHODNOCENÍ KAZUISTIKY
Součástí semináře byla kazuistika pacienta. Byla diskutována ve dvou skupinách, první byla vedena urologem, druhá onkologem. Závěrem byly shrnuty postupy doporučené pracovním „MDT“ a komentovány vedoucím semináře. Pacient byl stejný, výstupy na různých místech odlišné. Nicméně zvyklosti v regionu ukazovaly na velmi těsnou spolupráci mezi urologickými a onkologickými pracovišti, někde dobře fungující, jinde spíše na bázi individuálního přístupu.
Diskutovaným pacientem byl 65letý muž, který přišel s otoky zevního genitálu a dolních končetin a s tím spojenými mikčními obtížemi. Pacient byl technik, majitel firmy, ženatý, aktivní sportovec – golfista, fotbalista, plavec. V osobní anamnéze bez větších zvláštností, měl běžné dětské nemoci, v roce 1983 parotitidu s orchitidou vpravo, recentně zjištěnou hypertenzi, současně jej trápí dlouhodobě vertebrogenní obtíže, především v oblasti krční páteře. Nikdy nebyl operován, ani neutrpěl závažnější úraz. Pravidelně užívá perindopril/amlodipin a hydrochlorothiazid na hypertenzi. Alergie žádné během života nezjistil. Nekuřák, přestal v roce 1989, alkohol si dopřává pouze příležitostně. V rodinné anamnéze je bratr po operaci pro zhoubný nádor prostaty.
Graph 1. Zhodnocení navržené hormonální léčby Graph 1 Evaluation of the proposed hormonal therapy 
Při vyšetření sděluje mikční obtíže, nykturie 4–5 krát, oslabení proudu moči, váhový úbytek v posledním ½ roce 7 kg, což vnímal spíše pozitivně, intermitentně hematurie, otok v podbřišku a slabinách v posledních deseti dnech. Febrilie nejsou. Při somatickém vyšetření zjištěn otok dolních končetin a zevního genitálu s atrofickým varletem vpravo, při vyšetření per rectum prostata tuhá, kamenná, ostatní nález bez pozoruhodností. V laboratorních nálezech zjištěna urea 12 mmol/l, kreatinin 240 μmol/l, jaterní testy v normě, PSA 2243 ug/l, 1CTP 18,97 μg/l a testosteron 19,38 nmol/l. Na ultrasonografickém vyšetření je zřejmá dilatace dutého systému ledviny mírného stupně vpravo, středního stupně vlevo, játra bez patologie, prostata cca 50 g, močový měchýř bez rezidua.
Graph 2. Navržené podání látek modifikujících kostní metabolizmus Graph 2 The proposed administration of drugs affecting bone metabolism 
Další postup byl hodnocen auditoriem. Nabídnuté odpovědi zněly:
- diuretická léčba
- derivační výkony – nefrostomie, stent, permanentní katétr…
- biopsie prostaty a její rozsah
- stanovení IgG4
- nefrologická péče…
V naprosté většině byla doporučena biopsie prostaty. Diskutován byl její rozsah, tedy zda je dostatečné odebrat k verifikaci tumoru např. čtyři vzorky nebo provést standardní biopsii s osmi a více vzorky. Je zjevné, že verifikace tumoru je pro další postup důležitá, ale rozsah biopsie nebyl účastníky hodnocen jednoznačně. V cca 72 % byla doporučena derivace moči, především nefrostomií. Ve 20 % byla doporučena diuretická léčba.
V dalším kroku pacient podstoupil biopsii prostaty. Patolog stanovil diagnózu adenokarcinomu prostaty GS7 (3+4), bez perineurálního šíření. Současně byla zahájena diuretická léčba kaliumšetřícím diuretikem. Proveden staging onemocnění, kde při TRUS je patrná neohraničená nehomogenní žláza, váčky fixovány. Na scintigrafii skeletu prokázáno mnohočetné kostní postižení; na CT (po úpravě renálních funkcí) zjištěna výrazná retroperitoneální lymfadenopatie, v pánvi lymfadenopatie podél ilických cév, opožděné vylučování kontrastní látky ledvinami, velká neohraničená prostata, zasahující až k ústím ureterů, mnohočetné postižení skeletu. Hodnotili jsme jako stadium IV – pT4 N1 M1a, b GS7(3+4).
Graph 3. Navržený typ primární léčby mCRPC Graph 3 The proposed type of primary treatment of mCRPC 
Další postup byl hodnocen auditoriem. Nabídnuté odpovědi zněly:
- hormonální léčba
- hormonální léčba + chemoterapie
- BMA a jaká?
Všechny skupiny se shodly na hormonální terapii pro pacienta, v šesti skupinách pak pro rozsah onemocnění byla spíše preferována chemohormoterapie, při vědomí „off‑label“ podání docetaxelu v této indikaci. Jako metodu androgenní deprivace byla všude volena kastrace, ve většině případů farmakologická, ale regionálně na dvou místech byla navrhována i chirurgická kastrace. Mezi farmakologickou kastrací jednoznačně převažuje podání LHRH analog, pouze na jediném místě převážil GnRH antagonista – degarelix. Na žádném semináři nebyly k provedení farmakologické kastrace doporučeny antiandrogeny.
Graph 4. Navržená léčba po selhání ABI v primární léčbě mCRPC Graph 4 The proposed treatment after failure of ABI in the primary treatment of mCRPC 
Látky modifikující kostní metabolizmus jsou standardní součástí léčby pacientů s kostním postižením. Proto bylo překvapením, že přes 30 % pacientů by celkem jednoduchou BSC vůbec neobdrželo. Podání antiresorpční léčby je doporučeno obecně u metastatického kostního postižení v prevenci kostních příhod. Pro nemocného jednoznačně převažuje podání monoklonální protilátky denosumabu. Jeho aplikaci u pacienta s tangovanými renálními funkcemi považujme za logické.
Při diuretické léčbě došlo ke zmenšení otoků a pacient udával i zlepšení mikce. Zahájena léčba goserelinem s úvodním podáním cyproteron acetátu s dobrou odpovědí a současně léčba denosumabem, včetně suplementace Ca2+ a vitaminem D3. Během devíti měsíců došlo k poklesu PSA na 17 μg/l, zaznamenali jsme snížení 1CTP. Rovněž zobrazovací metody prokázaly regresi počtu ložisek na scintigrafii skeletu, na CT zmenšení lymfadenopatie o více než 50 %, na ultrasonografii pak nález bez dilatace KPS.
Medián odpovědi vůči hormonální terapii se pohybuje mezi 12–18 měsíci. Náš pacient po 18 měsících byl asymptomatický, bez urologických obtíží, nykturie 2*, močil uspokojivým proudem, bez bolesti. Váhově stabilní. Zapojen do pracovního procesu, sportuje, dokonce je schopen se sildenafilem uspokojivé erekce a sexuálního života. Přesto v laboratorních nálezech detekujeme vzestup PSA na 79 μg/l a na CT výraznější lymfadenopatie a zmnožení metastatických ložisek na scintigrafii skeletu.
CRPC (1):
kastrační hladina testosteronu (<50 ng/dl, resp. 1,7 nmol/l v séru) spolu s jedním z následujících kritérií
- biochemická progrese: tři po sobě následující vzestupy PSA s odstupem minimálně jednoho týdne, s hodnotou o 50 % nad nadir a současně PSA>2 μg/l nebo
- radiologická progrese: dvě nebo více nových kostních lézí prokazatelných na kostním scanu nebo progrese lézí měkkých tkání dle RECIST
Tím podle definice pacient splňuje kritéria mCRPC. Další postup byl hodnocen auditoriem.
Nabídnuté odpovědi zněly:
- ARTA (Androgen‑Receptor Targeted Agents) – abirateron acetát (6), enzalutamid (7)
- chemoterapie (2, 14)
- estramustin
- Ra-223 (10)
- kortikosteroidy
- radioterapie
Prakticky všechny týmy se shodly na diagnóze mCRPC. Nejčastěji navrhovaným dalším léčebným krokem bylo podání hormonální léčby nové generace (ARTA). Pro sekundární manipulaci antiandrogeny v rámci stávajících možností terapie se rozhodlo 12 % respondentů. Dvojnásobek by podal primárně chemoterapii (24 %).
Náš pacient pokračuje v léčbě LHRH analogy (goserelin) a BMA denosumab se suplementací. Pacientovi nasazen ARTA – abirateron acetát spolu s 10 mg prednisonu. Laboratorně došlo během šesti měsíců k poklesu PSA na 4,6 μg/l. Na CT regrese nálezu, na scintigrafii skeletu stabilizace nálezu. Pacient bez výraznějších klinických obtíží, váhově stabilní. Stav mu umožňuje chodit do práce, vykonávat běžné aktivity i sportovat.
Dlouze byla na některých místech diskutována nutnost pravidelných odběrů PSA. Při léčbě mCRPC nepřináší informaci o stavu nemocného. U většiny diskutujících účastníků převažoval názor, že vyšetření není třeba, ale pacient dlouhodobě navyklý hladiny sledovat si jej vyžádá na jiném místě a stejně s informací bude pracovat. Častá vyšetření zobrazovacími metodami jsou dána dikcí úhrady.
Image 2. Léčba mCRPC podle Guidelines EAU (1) Fig. 2 Treatment of mCRPC according to the EAU Guidelines (1) 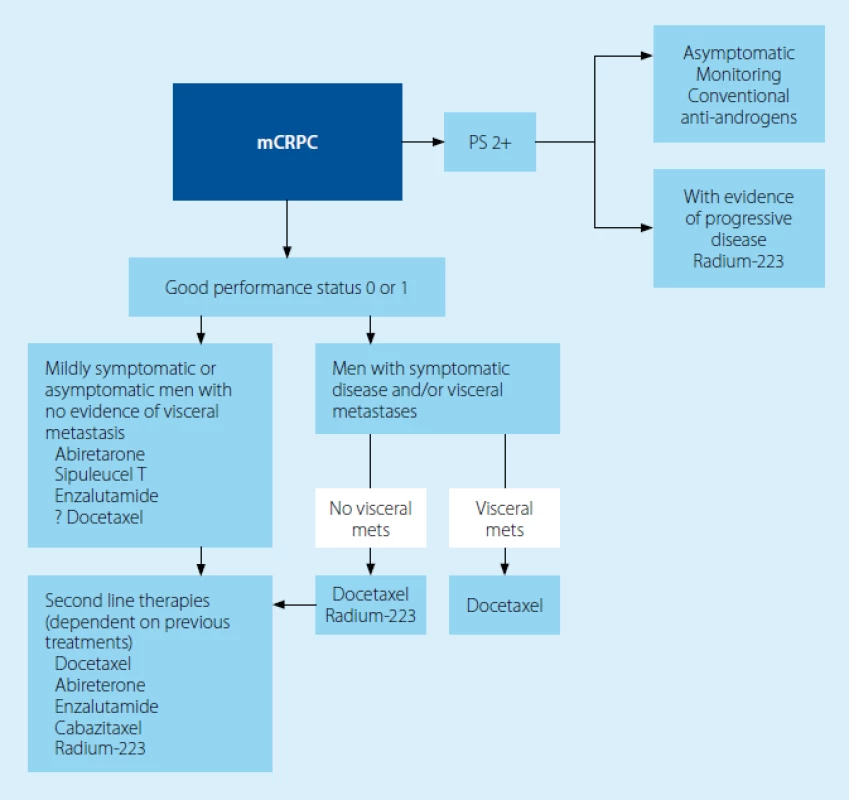
Odpověď k léčbě ABI byla dosti dlouhá, přesto po 24 měsících dochází k progresi na zobrazovacích metodách, na scintigrafii skeletu zvětšení počtu ložisek o 15 %, na CT je progrese lymfadenopatie, suspektní ložisko v játrech, nárůst PSA na 19,6 μg/l. Klinicky pacient udával pobolívání v oblasti bederní páteře, dobře odpovídající na NSA, pociťuje větší únavu, ale stále pracuje, vypustil fotbal, ale hraje golf, raději na golfovém vozíku, snad by i hřiště ušel, plave, váhově je stabilní. Zvolna narůstají mikční obtíže, nykturie 2–3*, občas musí zatlačit, užívá tamsulosin, lumbalgie nejsou, v posledním půl roce 2* ataka infekce dolních močových cest, přeléčen nitrofurantoinem a ciprofloxacinem.
Další postup byl hodnocen auditoriem. Nabídnuté odpovědi zněly:
- změna ARTA
- chemoterapie (3)
- estramustin fosfát (16, 17)
- orchiektomie
- radioterapie
- kortikoidy
Na většině seminářů došlo ke konsenzu pro II. linii léčby. Obvyklým navrženým postupem byla chemoterapie. Na jednom z míst byl zvažován estramustin fosfát, na většině podání docetaxelu s prednisonem. Na třech místech byla navržena změna ARTA. Na dvou místech by u pacienta byla navržena změna hormonální suprese z LHRH na chirurgickou kastraci.
Podle doporučení EAU jsou pacienti rozděleni podle výkonnostního stavu (1). Ten je pak vodítkem pro pokračování léčby, resp. pro volbu mezi dříve standardní léčbou a volbou mezi novými přípravky. V našich podmínkách je další rozhodování podmíněno úhradou a její limitací u jednotlivých přípravků.
ZÁVĚR
Semináře a společné řešení postupu u pacienta měly obohatit vztahy mezi odborníky různých specializací. I pro klinického onkologa je farmakologické řešení pokročilého karcinomu prostaty spíše záležitost novější. Z modelové kazuistiky je zjevné, že pacient nestoná s jedinou chorobou a na řešení problémů se musí podílet specialisté obou odborností. Diskuze na všech místech prokázala, že téma je aktuální a živé. Zásadních korekcí od vedoucích seminářů nebylo třeba, a to ukazuje na dobré znalosti z terénu. Z nich může dobře profitovat pacient s pokročilým karcinomem prostaty.
Děkujeme všem, kteří se seminářů zúčastnili. Věříme, že pro ně byly informace zajímavé, což vyplynulo i z evaluačních dotazníků.
SEZNAM ZKRATEK
ABI – abirateron acetát
BSC – best suppotive care
ČOS – Česká onkologická společnost
ENZA – enzalutamid
HSCP – hormonálně senzitivní karcinom prostaty
mCRPC – metastický kastračně refrakterní karcinom prostaty
MDT – multidisciplinární tým
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Došlo: 8. 2. 2017
Přijato: 5. 3. 2017
Kontaktní adresa:
MUDr. Michaela Matoušková
Urocentrum Praha
Karlovo nám. 3, 120 00 Praha 2
e-mail: matouskova@urocentrum.cz
FOTOGRAFIE ZE SEMINÁŘŮ
Obr. 1 MUDr. Zdeněk Polák během praktické části semináře (Ostrava, 17. 2. 2016) Fig. 1. Zdeněk Polák, M.D. during the practical part of the seminar (Ostrava, 17 February 2016) 
Obr. 2. Prim. MUDr. Jan Mečl a prim. MUDr. PharmDr. Jan Dvořák při prezentaci kazuistiky v rámci workshopu (Liberec, 23. 2. 2016) Fig. 2. Head physician Jan Mečl, M.D. and head physician Jan Dvořák, M.D., PharmDr. presenting a case report at the workshop (Liberec, 23 February 2016) 
Obr. 3. MUDr. Hana Šiffnerová, Ph.D., as. MUDr. Aleš Petřík, Ph.D., a prof. MUDr. Milan Hora, Ph.D., MBA v závěru semináře při hodnocení kazuistik (České Budějovice, 29. 2. 2016) Fig. 3. Hana Šiffnerová, M.D., Ph.D., Aleš Petřík, M.D., Ph.D., and prof. Milan Hora, M.D., Ph.D., MBA evaluating case reports at the end of the seminar (České Budějovice, 29 February 2016) 
Obr. 4. MUDr. Kateřina Kubáčková (Kopečková) a MUDr. Pavel Dušek prezentují výsledky workshopů (Praha, 2. 3. 2016) Fig. 4. Kateřina Kubáčková (Kopečková), M.D. and Pavel Dušek, M.D. presenting workshop outcomes (Prague, 2 February 2016) 
Obr. 5. As. MUDr. Michaela Matoušková v úvodní teoretické části semináře (Hradec Králové, 8. 3. 2016) Fig. 5. Michaela Matoušková, M.D. during the theoretical section of the seminar (Hradec Králové, 8 March 2016) 
Obr. 6. Doc. MUDr. Vladimír Študent, Ph.D., a MUDr. Milan Král, Ph.D., při poslechu přednášky MUDr. Hany Študentové, Ph.D. (Olomouc, 5. 4. 2016) Fig. 6. Associate professor Vladimír Študent, M.D., Ph.D. and Milan Král, M.D., Ph.D. listening to a lecture by Hana Študentová, M.D., Ph.D. (Olomouc, 5 April 2016) 
Obr. 7. As. MUDr. Michaela Matoušková přednáší modelovou kazuistiku, za předsednickým stolem prim. MUDr. Martin Drábek a prim. MUDr. Lubomír Slavíček, Ph.D. (Jihlava, 12. 4. 2016) Fig. 7. Michaela Matoušková, M.D. presenting a model case report, with head physicians Martin Drábek, M.D. and Lubomír Slavíček, M.D., Ph.D. sitting at the chairman’s table (Jihlava, 12 April 2016) 
Obr. 8. Doc. MUDr. Roman Zachoval, Ph.D., MBA spolu s vedoucími workshopů MUDr. Lukášem Holubem a MUDr. Miroslavem Hodkem (Pardubice, 20. 4. 2016) Fig. 8. Associate professor Roman Zachoval, M.D., Ph.D., MBA together with workshop leaders Lukáš Holub, M.D. and Miroslav Hodek, M.D. (Pardubice, 20 April 2016) 
Obr. 9. MUDr. Ivo Kocák, Ph.D., předseda semináře a prim. MUDr. Milan Kohoutek a prim. MUDr. Jaroslav Hynčica, vedoucí workshopů (Zlín, 18. 5. 2016) Fig. 9. Ivo Kocák, M.D., Ph.D., seminar chairman, and head physicians Milan Kohoutek, M.D. and Jaroslav Hynčica, M.D., workshop leaders (Zlín, 18 May 2016) 
Obr. 10 Prof. MUDr. Jindřich Fínek, Ph.D., MHA a prof. MUDr. Milan Hora, Ph.D., MBA po úspěšném zakončení semináře (Plzeň, 31. 5. 2016) Fig. 10. Professor Jindřich Fínek, M.D., Ph.D., MHA and professor Milan Hora, M.D., Ph.D., MBA after a successful conclusion of the seminar (Pilsen, 31 May 2016) 
Obr. 11 Doc. MUDr. Tomáš Büchler, Ph.D., prim. MUDr. Martina Chodacká a prim. MUDr. Jan Schraml, Ph.D., v závěru semináře při hodnocení výstupů z workshopů (Ústí nad Labem, 1. 6. 2016) Fig. 11. Associate Professor Tomáš Büchler, M.D., Ph.D., head physician Martina Chodacká, M.D., and head physician Jan Schraml, M.D., Ph.D. evaluating workshop outcomes at the end of the seminar (Ústí nad Labem, 1 June 2016) 
Obr. 12. Prof. MUDr. Tomáš Hanuš, DrSc., jako předseda semináře hodnotí výsledky workshopů vedených MUDr. Otakarem Čapounem, FEBU a MUDr. Miladou Zemanovou, Ph.D. (Praha, 13. 6. 2016) Fig. 12. Professor Tomáš Hanuš, M.D., DrSc., seminar chairman, evaluating the outcomes of workshops led by Otakar Čapoun, M.D., FEBU and Milada Zemanová, M.D., Ph.D. (Prague, 13 June 2016) 
Obr. 13. Prof. MUDr. Dalibor Pacík, CSc. při úvodní teoretické přednášce (Brno, 14. 6. 2016) Fig. 13. Professor Dalibor Pacík, M.D., CSc. during the introductory theoretical lecture (Brno, 14 June 2016) 
Sources
1. Mottet N, Bellmunt J, Briers E, et al. Guidelines on prostate cancer EAU 2017 © Copyright 2017 Uroweb http://uroweb.org/guideline/prostate‑cancer/.
2. Tannock IF, de Witt R, Berry WR, et al. Docetaxel plus prednisone or Mitoxantrone plus prednisone for advanced prostate cancer. New Engl J Med 2004; 351 : 1502–1512.
3. De Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration‑resistant
prostate cancer progressing after docetaxel treatment: a randomised open‑label trial. Lancet 2010; 376 : 1147–1154.
4. Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration‑resistant
prostate cancer: final overall survival analysis of the COU‑AA-301 randomised, double‑blind, placebo‑controlled phase 3 study Lancet 2012; 13(10): 983–992.
5. Scher HI, Fizzazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. NEJM 2012; 367(13): 1187–1197.
6. Ryan CJ, Smith MR, Fizazi, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy‑naive men with metastatic castration‑resistant prostate cancer (COU‑AA-302): final overall survival analysis of a randomised, double‑blind, placebo‑controlled phase 3 study. Lancet 2015; 16(2): 152–160.
7. Beer TM, Armstrong AJ, Rathkopf DE, et al. Enzalutamide in Metastatic Prostate Cancer before Chemotherapy. N Engl J Med 2014; 371 : 424–433.
8. Kantoff PW, Gitano CS, Shore ND, et al. Sipuleucel‑T Immunotherapy for Castration‑Resistant Prostate Cancor. N Engl J Med 2010; 363 : 411–422.
9. Fizazi K, Carducci M, Smith M, et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double‑blind study. Lancet 2011; 377 : 813–822.
10. Parker C, Nilsson S, Heinrich D, et al. Alpha Emitter radium-223 and Survival in Metastatic prostate Cancer.N Engl J Med 2013; 369 : 213–223.
11. James ND, Spears MR, Clarke NW, et al. Survival with Newly Diagnosed Metastatic Prostate Cancer in the ‘‘Docetaxel Era’’: Data from 917 Patients in the Control Arm of the STAMPEDE Trial (MRC PR08, CRUK/06/019). Eur Urol 2015; 67 : 1028–1038.
12. Sweney MB, Yu‑Hui BS, Carducci M, el al. Chemohormonal Therapy in Metastatic Hormone‑Sensitive Prostate Cancer. N Engl J Med 2015; 373 : 737–746.
13. Ferlay J, Parkin DM, Steliarova‑Foucher E. Estimates of cancer incidence and mortality in Europe in 2008 € J Cancer, 2010; 46(4): 765–781.
14. Berthold DR, Pond GR, Roessner M, et al. TAX-327 investigators. Treatment of hormone‑refractory prostate cancer with docetaxel or mitoxantrone: relationships between prostate‑specific antigen, pain, and quality of life response and survival in the TAX-327 study. Clinical Cancer Research 2008; 14 : 2763–2767.
15. Parker C, Nilsson S, Heinrich D, et al. Alpha Emitter radium-223 and Survival in Metastatic prostate Cancer.N Engl J Med 2013; 369 : 213–223.
16. Newling DW, Fossa SD, Tunn UW, el al. Mitomycin C versus estramustine in the treatment of hormone resistant metastatic prostate cancer: the final analysis of the European Organization for Research and Treatment of Cancer, genitourinary group prospective randomized phase III study (30865). J Urol. 1993 Dec; 150(6): 1840–1844.
17. Mohan R, Panda D. Kinetic Stabilization of Microtubule Dynamics by Estramustine Is Associated with Tubulin Acetylation, Spindle Abnormalities, and Mitotic Arrest. Cancer Res 2008; 68 : 6181–6189. Published online August 1, 2008.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2017 Issue 1-
All articles in this issue
- RETROPERITONEOSKOPICKÁ RESEKCE TUMORU LEDVINY – VIDEO
- Varianty laparoskopické reimplantace močovodu
- Doporučení pro diagnostiku a léčbu symptomů dolních močových cest u pacientů s roztroušenou sklerózou v České republice - mezioborový konsenzus expertů dle metodiky DELPHI
- Komentář k článku Krhut, et al. Doporučené postupy včera, dnes a zítra
- Úloha psychosomatiky v urologii
- Peyronieho choroba
- LITOTRYPSE EXTRAKORPORÁLNÍ RÁZOVOU VLNOU – PRVNÍ ZKUŠENOSTI S ELEKTROMAGNETICKÝM LITOTRYPTOREM SIEMENS
- POUŽITÍ PROPLACHOVÉHO SYSTÉMU SUBY G U PACIENTŮ S NEUROGENNÍ DYSFUNKCÍ DOLNÍCH MOČOVÝCH CEST A DLOUHODOBĚ ZAVEDENÝM PERMANENTNÍM KATÉTREM
- VZÁCNÝ CYSTADENOKARCINOM PROSTATY, KLINICKÉ PROJEVY, DIAGNOSTIKA A LÉČBA
- SPONTÁNNÍ RUPTURA MOČOVÉHO MĚCHÝŘE: DVA PŘÍPADY Z NAŠEHO PRACOVIŠTĚ
- LÉČBA KARCINOMU PROSTATY V ČESKÉ REPUBLICE V ROCE 2016 – VÝSTUPY ZE SEMINÁŘŮ O METASTATICKÉM KASTRAČNĚ REFRAKTERNÍM KARCINOMU PROSTATY (MCRPC)
- THE AUTHORS REPORT ON THE 13,sup>TH WINTER UROLOGY SYMPOSIUM IN SPINDLERUV MLYN
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Varianty laparoskopické reimplantace močovodu
- Peyronieho choroba
- Úloha psychosomatiky v urologii
- VZÁCNÝ CYSTADENOKARCINOM PROSTATY, KLINICKÉ PROJEVY, DIAGNOSTIKA A LÉČBA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

