-
Medical journals
- Career
Novelizovaná klasifikace nádorů ledvin 2013 (International Society of Urological Pathology Vancouver Classification of Renal Neoplasia)
Authors: Milan Hora 1; Tomáš Ürge 1; Kristýna Kalusová 1; Michal Michal 2; Zdeněk Chudáček 3; Jiří Ferda 4; Ondřej Hes 2
Authors‘ workplace: Urologická klinika LF UK a FN, Plzeň 1; Šiklův patologicko-anatomický ústav LF UK a FN, Plzeň 2; Radiodiagnostické oddělení FN, Plzeň 3; Klinika zobrazovacích metod FN, Plzeň 4
Published in: Ces Urol 2014; 18(1): 9-20
Category: Review article
Overview
Úvod:
Nádory ledvin představují široké spektrum histopatologických jednotek. Jejich aktuální klasifikace WHO se datuje do roku 2004, tedy je již 10 let stará. Nicméně v říjnu 2013 byla vydána aktualizace vytvořená ISUP (International Society of Urological Pathology). V článku přinášíme přehled podstatných změn pohledem klinika.Přehled podstatných změn:
Bylo přidáno pět nových epiteliálních tumorů: tubulocystický renální karcinom RK, RK spojený se získanou cystózou ledvin, světlobuněčný (tubulo-) papilární RK, MiT translokační RK (zejména t(6;11) RK) a syndrom hereditární leiomyomatózy a renálního karcinomu. Tři další renální karcinomy jsou přidány jako provizorní jednotky: thyroid-like follicular renal cell carcinoma (RCC); succinate dehydrogenase B deficiency-associated RCC; ALK translocation RCC.V rámci existujících jednotek byly provedeny dílčí změny:
Multicystický světlobuněčný RK (SRK) (dříve multilokulární cystický renální karcinom) byl logicky zařazen pod SRK jako jeho podjednotka s nízkým maligním potenciálem. Onkocytický papilární RK (PRK) nebyl zatím uznán jako další podjednotka PRK. Hybridní onkocytický chromofobní tumor existující ve třech klinicko-patologických situacích (Birt-Hogg-Dubé syndrom, renální onkocytóza a sporadický) je řazen jako podjednotka chromofobního RK. Byly doplněny nové poznatky o RK ze sběrných kanálků, medulárním RK, mucinózní tubulární a vřetenobuněčný RK. K angiomyolipomu přidána cystická varianta AML a upraven byl pohled na epitelioidni variantu AML. Cystický nefrom a smíšený epiteliální a stromální tumor zařazeny do jedné společné skupiny. Synoviální sarkom byl přesunut mezi sarkomy.
Pracovní skupiny doporučuje tuto klasifikaci nazývat jako ISUP vancouverská klasifikace.Závěr:
S ISUP vancouverskou klasifikací nádorů ledvin by se měli urologové seznámit, neboť přináší řadu podstatných změn a lze předpokládat, že bude základem nové WHO klasifikace.Klíčová slova:
nádory ledvin, klasifikace.ÚVOD
Nádory ledvin představují široké spektrum histopatologických jednotek. Jejich aktuální klasifikace WHO se datuje do roku 2004 (1), tedy je již 10 let stará. Nicméně v říjnu 2013 byla vydána aktualizace vytvořená ISUP (International Society of Urological Pathology, http://www.isuporg.org/) (2) a lze předpokládat, že bude základem nové WHO klasifikace. V článku přinášíme přehled podstatných změn pohledem klinika. Ne všechny anglické termíny lze přesně přeložit do češtiny, proto je v článku často používáno originální anglické názvosloví. Kompletní přehled klasifikace přináší tabulka.
Table 1. Přehled novelizované Vancouverské klasifikace nádorů ledvin 2013 dle ISUP (International Society of Urological Pathology) Table 1. ISUP Vancouver Modification of WHO (2004) Histologic Classification of Kidney Tumors 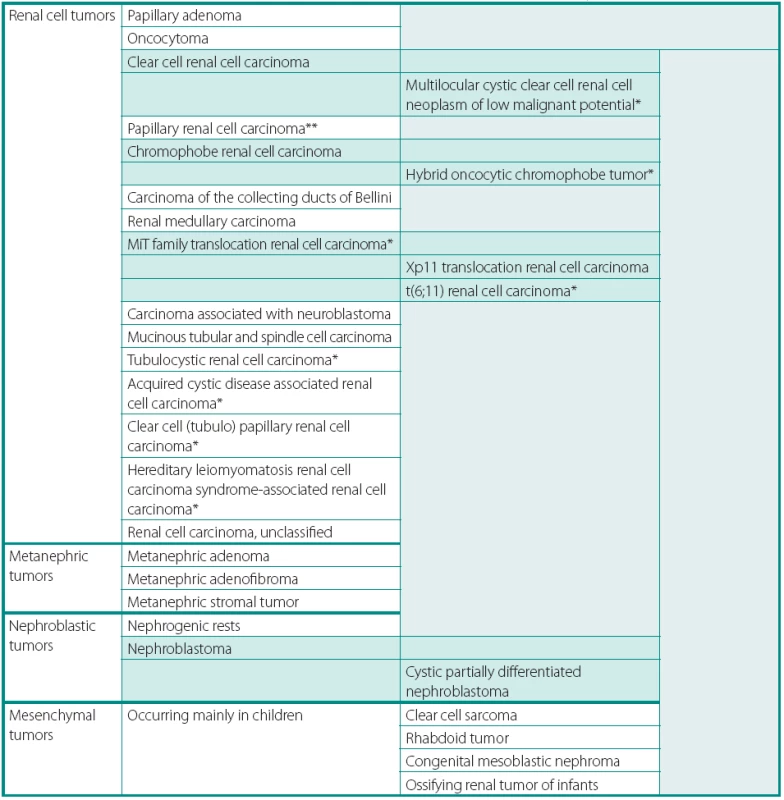

*Additions and changes in terminology or position in classification. **The majority of consensus attendees subtype papillary carcinoma (type 1, type 2 or not otherwise specified) PŘEHLED ZMĚN V KLASIFIKACI NÁDORŮ LEDVIN
Bylo přidáno pět nových epiteliálních tumorů: tubulocystický renální karcinom (RK), RK spojený se získanou cystickou chorobou ledvin, světlobuněčný (tubulo-) papilární RK, MiT translokační RK – zejména typ t(6;11) a syndrom hereditární leiomyomatózy a renálního karcinomu. Tři další renální karcinomy jsou přidány jako provizorní jednotky: thyroid-like follicular RCC (renal cell carcinoma); succinate dehydrogenase B deficiency-associated RCC; ALK translocation RCC. Základní typy renálních karcinomů (RK) (světlobuněčný, papilární, chromofobní a ze sběrných kanálků) (3) zůstávají beze změn. Podstatná změna je v rámci světlobuněčného renálního karcinomu (SRK). Multicystický SRK, dříve multilokulární cystický renální karcinom, byl logicky zařazen pod SRK jako jeho podjednotka s nízkým maligním potenciálem. U některých dalších jednotek došlo k dílčím změnám pouze však v rámci jednotky (2) (obr. 1). Zde dovolte některé změny krátce komentovat.
Image 1. Muž 29 let, tubulocystický renální karcinom horního pólu pravé ledviny T1bN0M1 s metastázami do skeletu. Na obrázku je vidět preparát tumoru po translumbální resekci jednak se solidní částí (na FDG PET v pravém dolním rohu tato část vychytává FDG), tak s cystickou (na preparátu vpravo). Na FDG PET CT patrná i metastáza do obratle. Fig. 1. Twenty nine year old man, tubulocystic renal cell carcinoma of the upper pole of the right kidney T1bN0M1 with bone metastases. CT showing a tumour specimen during surgery with the translumbar approach: with solid part (on FDG PET CT in the right lower corner there is FDG uptake) and cystic part (on specimen on the right side). On FDG PET CT, metastasis to spinal column is visible as well. 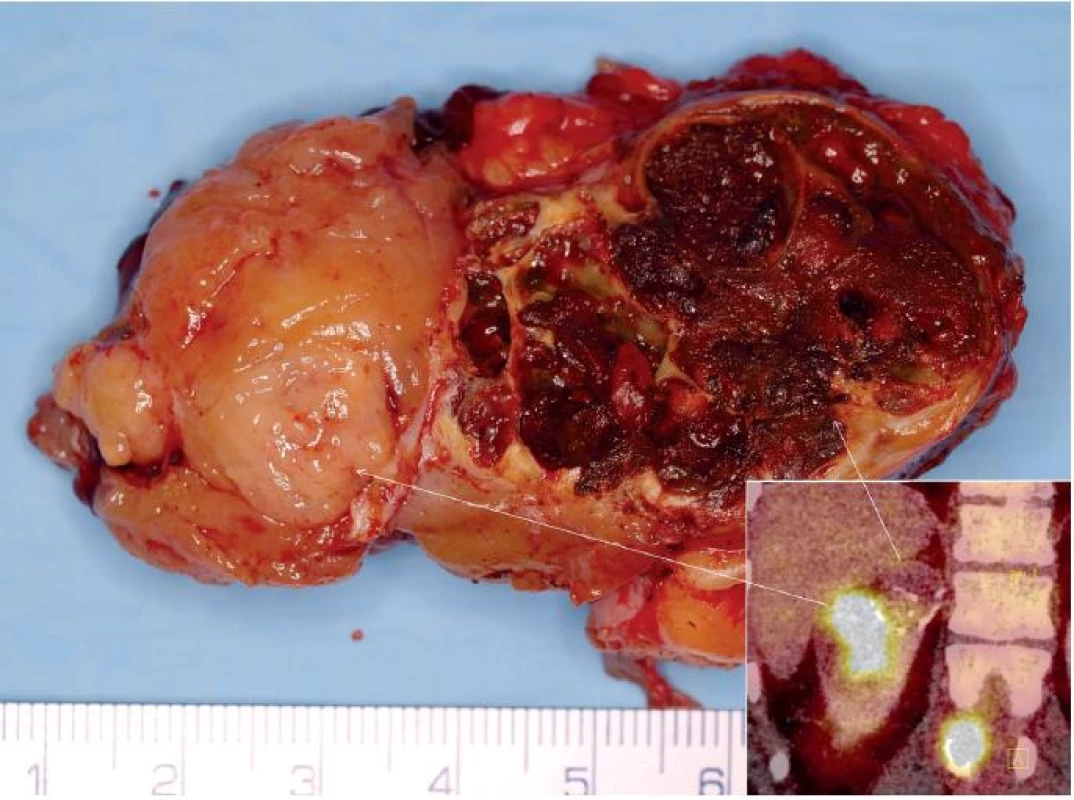
Tubulocystický renální karcinom
Tento tumor byl původně nazýván jako nízce maligní RK ze sběrných kanálků. Diskutuje se jeho vztah k papilárnímu RK (obr. 1, 2). Vyskytuje se častěji u dospělých mužů různých věkových skupin. Často obsahuje cystickou komponentu, takže se může v CT a MRI obraze jevit jako léze Bosniak III či IV. Má maligní potenciál (4). Klinicky byl sice popsán efekt inhibitorů tyrosinkinázy (4), ale v detailní analýze nebyl prokázán podklad pro tuto efektivitu (5).
Image 2. Muž 68 let, tumor levé ledviny T1bN0M0, histologicky se jednalo o tubulocystický renální karcinom s jasně odděleným ložiskem papilárního renálního karcinomu, což bylo možné zpětně identifikovat na CT (vpravo dole). Fig. 2. Sixty eight year old man, tumour of the left kidney T1bN0M0. Histologically, tubulocystic RCC with clearly visible locus of papillary RCC. The tumour could be retrospectively identified on CT as well. 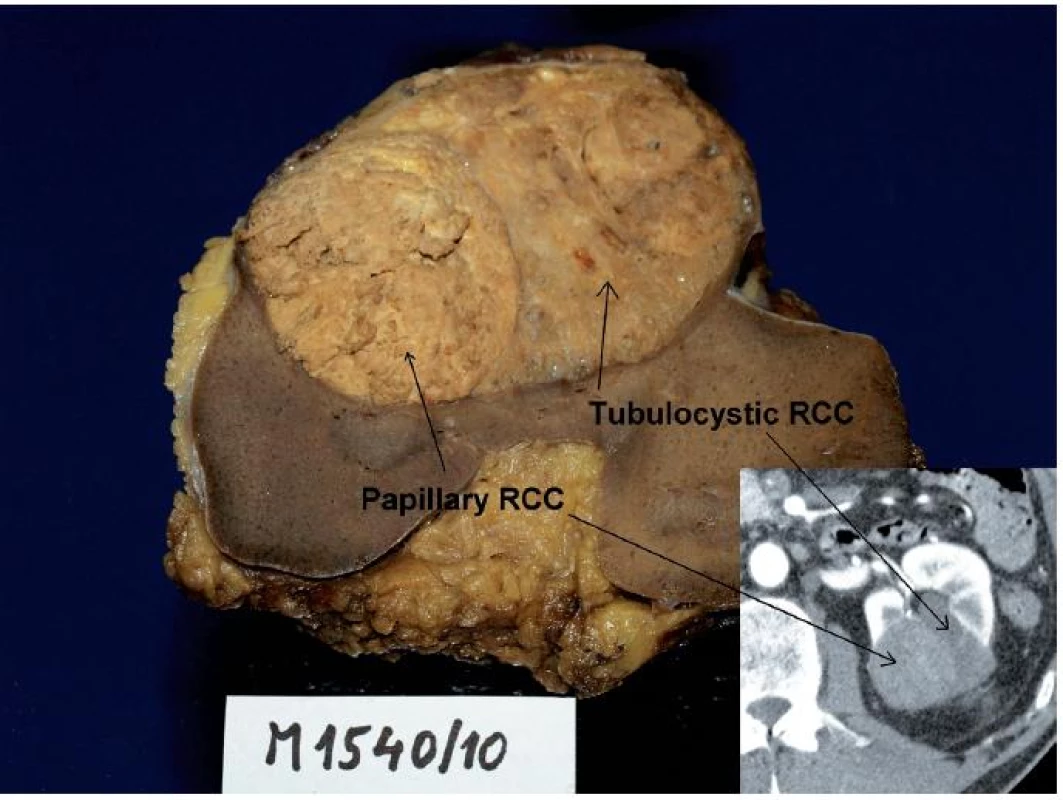
RK spojený se získanou cystózou ledvin (acquired cystic disease-associated RCC)
Dle některých (2) se jedná o nejčastější nádor u pacientů s terminálním selháním ledvin (ESKD – end-stage kidney disease), sami jsme se s tímto nádorem nesetkali (6). Jedná se o tumor s dobrou prognózou (2), ale je pravda, že je většinou zachycen velmi časně díky pečlivé dispenzarizaci lidí se selháním ledvin nefrology. Je poměrně častý např. v Japonsku, kde jsou lidé s ESKD dlouhodobě dialyzováni.
Světlobuněčný (tubulo-) papilární renální karcinom (clear cell (tubulo) papillary RCC – CPRCC)
Název vyjadřuje podstatu histologického obrazu. Pro klinika je podstatné, že se jedná o vzácný tumor s minimálním maligním potenciálem. V literatuře je popsán velmi podobný tumor – tzv. RAT (renal angiomyoadenomatous tumor) (7). Patology je diskutována otázka, zda jsou RAT a CPRCC jedna či dvě skupiny byť velmi podobných nádorů (8). Z pohledu klinika by bylo jistě vhodné dát obojí do jedné jednotky.
MiT translokační renální karcinom (TRK)
Jedná se o tumory, které tvoří 15 % tumorů u lidí s tumorem ledviny do 40 let. Nad 40 let věku nalézáme pouhou čtvrtinu všech TRK. Kromě jednotky TRCC (translocation renal cell carcinoma) Xp11.2 (9), která byla již ve WHO klasifikaci 2004, byla přidána druhá skupina TRK – „6p21 TRCC“, označovaného též jako „t(6;11) TRCC“ čí dle typického obrazu v HE (hematoxylin-eosin) a imunohistochemickém barvení jako „rosette-like forming“, „HMB45-positive renal tumour“ a „TFEB RCC“ (10–12). Zatímco TFEB RCC má relativně malý maligní potenciál, tak Xp11.2 TRCC se chová výrazně agresivněji (10) (obr. 3, 4).
Image 3. Translokační RK Xp11.2 ASPL-TFE3 na konvexitě prvé ledviny T1bN0M0 u 75leté ženy. A – CT ve venózní fázi, poměrně homogenní tumor s denzitou kolem 70 HU, B – preparát resekátu Fig. 3. Translocation RCC Xp11.2 ASPL-TFE3 on the convexity of the right kidney T1bN0M0 in 75-year-old woman. A – CT in venous phase, relatively homogenous tumour with a density of about 70 HU, B – specimen at the time of surgery. 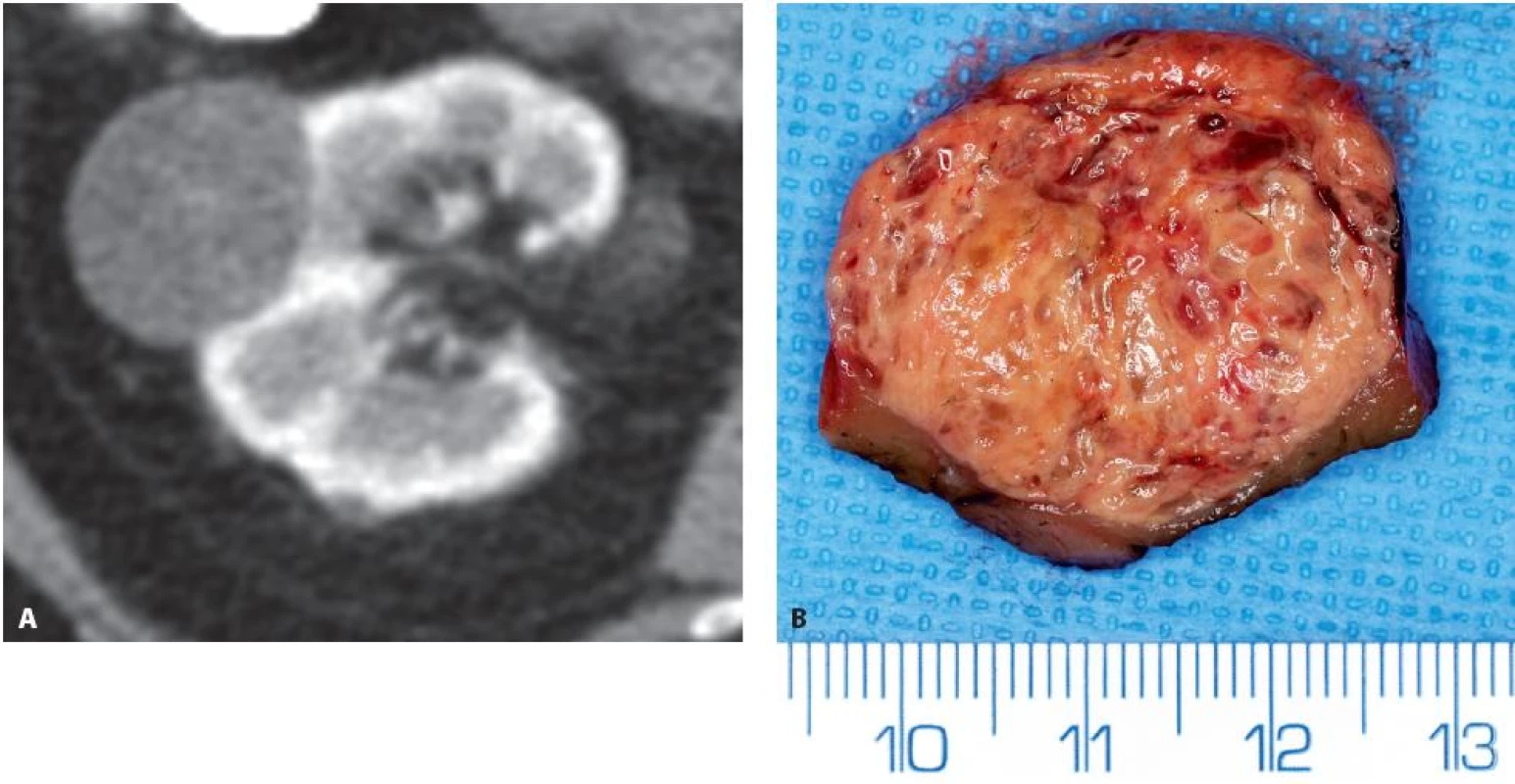
Image 4. Případ 24leté ženy ve 4. měsíci gravidity, dle MRI. A – objemný tumorem pravé ledviny T3aN0M0 (11), provedena transperitoneální nefrektomie vpravo, B – disekovaný operační preparát), následný spontánní porod v řádném termínu. Šest let od operace bez recidivy tumoru. Fig. 4. Twenty four year old woman, 4 months pregnant. A – a large tumour of the right kidney T3aN0M0 (11) seen on MRI. Transperitoneal nephrectomy performed, B – surgical specimen). Patient delivered a healthy baby. Patient is without recurrence of disease on the 6 years follow-up examination. 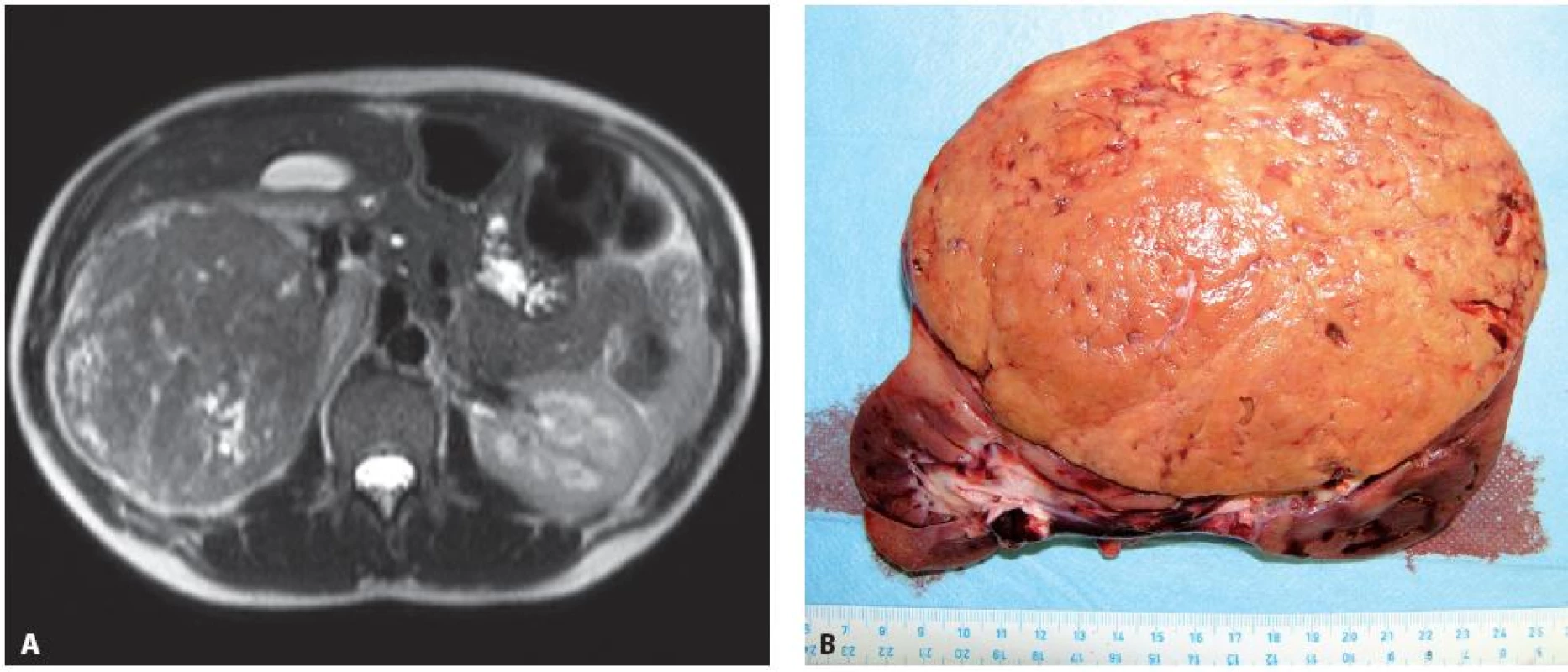
Syndrom hereditární leiomyomatózy a renálního karcinomu (hereditary leiomyomatosis RCC syndrome-associated RCC – HLRCC)
Hereditární nádory ledvin představují zvláštní zajímavou a stále doplňovanou skupinu, zde je uveden jen krátký přehled: von Hippel-Lindau syndrom, hereditární papilární RK, Birt-Hogg-Dubé syndrom (viz níže hybridní onkocytický/chromofobní tumor), syndrom hereditární leiomyomatózy a renálního karcinomu, komplex tuberózní sklerózy, „germline succinate dehydrogenase (SDH) mutation“, „nonpolyposis colorectal cancer syndrome“, „hyperparathyroidism-jaw tumour syndrome“, „PTEN hamartoma syndrome“, „constitutional chromosome 3 translocation“ a „familial nonsyndromic clear cell RCC“. Z formálního hlediska by sem patřil i medulární RK, protože je spojen s hereditární hemoglobinopatií – srpkovitou anémií (2, 13).
Syndrom hereditární leiomyomatózy a renálního karcinomu je autozomálně dominantní familiárně se vyskytující syndrom, pro nějž je typická tvorba leiomyomů na kůži a v děloze společně se vznikem renálních tumorů, konkrétně PRK (histologický typ 2). U tohoto syndromu byla identifikována mutace genu pro fumarát hydratázu (FH, 1q42.3-q43) (14). Na rozdíl od jiných hereditárních renálních karcinomů bývá solitární, diagnostikovaný v pokročilých stadiích a je poměrně agresivní a většina postižených na něj umírá (2, 15).
PROVIZORNÍ NÁDOROVÉ JEDNOTKY
Patří sem „thyroid-like follicular RCC“, „succinate dehydrogenase B deficiency-associated RCC“ a „ALK translocation RCC“ a jsou v současnosti teprve diskutovány patology. „Succinate dehydrogenase B deficiency-associated RCC“ je někdy agresivní tumor zejména u mladších jedinců (16–18). Špatnou prognózu má i „ALK translocation RCC“ (19).
A nyní přidáváme ještě komentář k novinkám, které byly přidány k zavedeným histopatologickým jednotkám:
Světlobuněčný RK
Jak je zmíněno výše, byl do této jednotky logicky zařazen multicystický světlobuněčný renální karcinom (2). Dříve byl označovaný jako multilokulární cystický renální karcinom a byl uváděný jako samostatná jednotka (20). V klinické praxi tvoří asi 4 % všech světlobuněčných RK (obr. 5). Nikdy nebyla popsána metastazující varianta. Jeho hodnocení patologem podléhá přísným kritériím. Jestliže už i klinik vidí na preparátu cystického tumoru byť jen drobná ložiska typického světlobuněčného renálního karcinomu, již se nemůže jednat o multicystickou variantu, ale pouze o světlobuněčný RK byť extenzivně cysticky změněný (obr. 6).
Image 5. Multicystický světlobuněčný renální karcinom zadního rtu pravé ledviny. A – MRI, B – nativní preparát Fig. 5. Multicystic clear cell renal cell carcinoma. A – MRI, B – specimen at operation 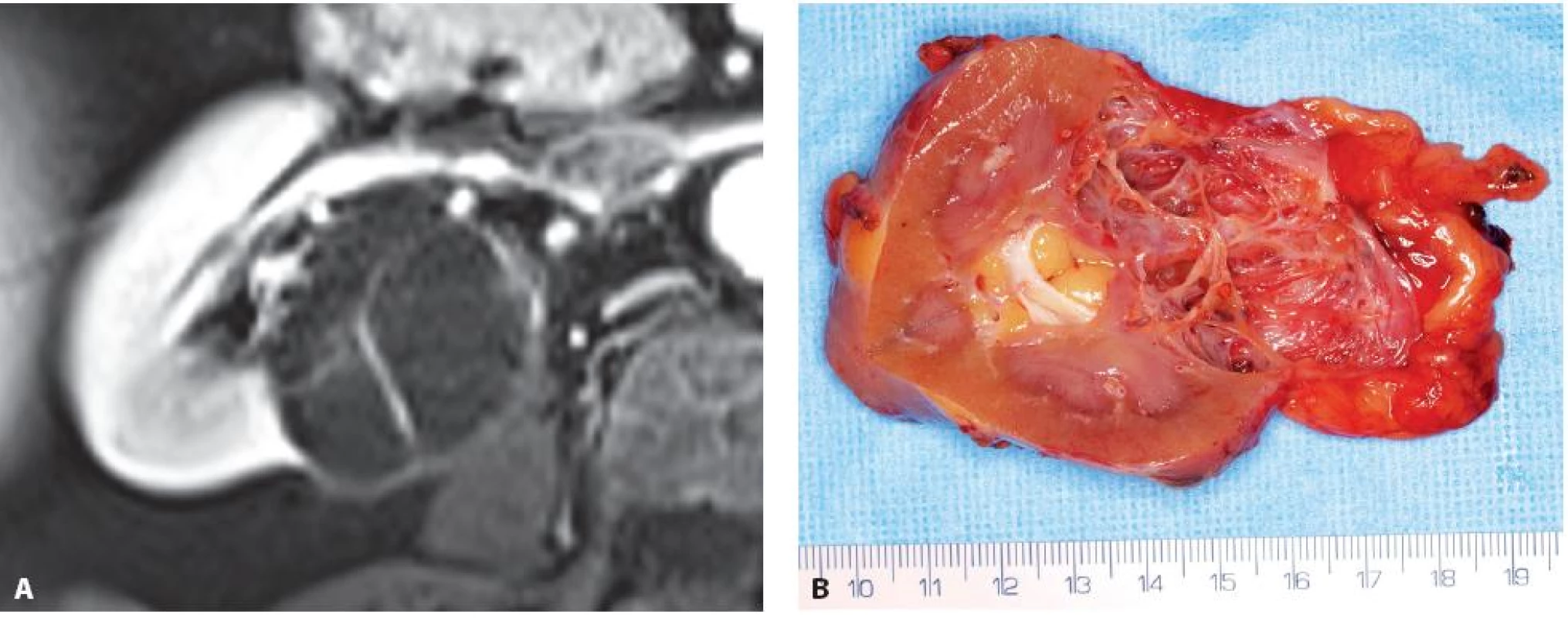
Image 6. Extenzivně cysticky změněný světlobuněčný renální karcinom s drobnými ložisky solidní tumorózní tkáně (na snímku preparátu označeno) Fig. 6. Extensively cystic clear RCC with small solid nodules of tumorous tissue 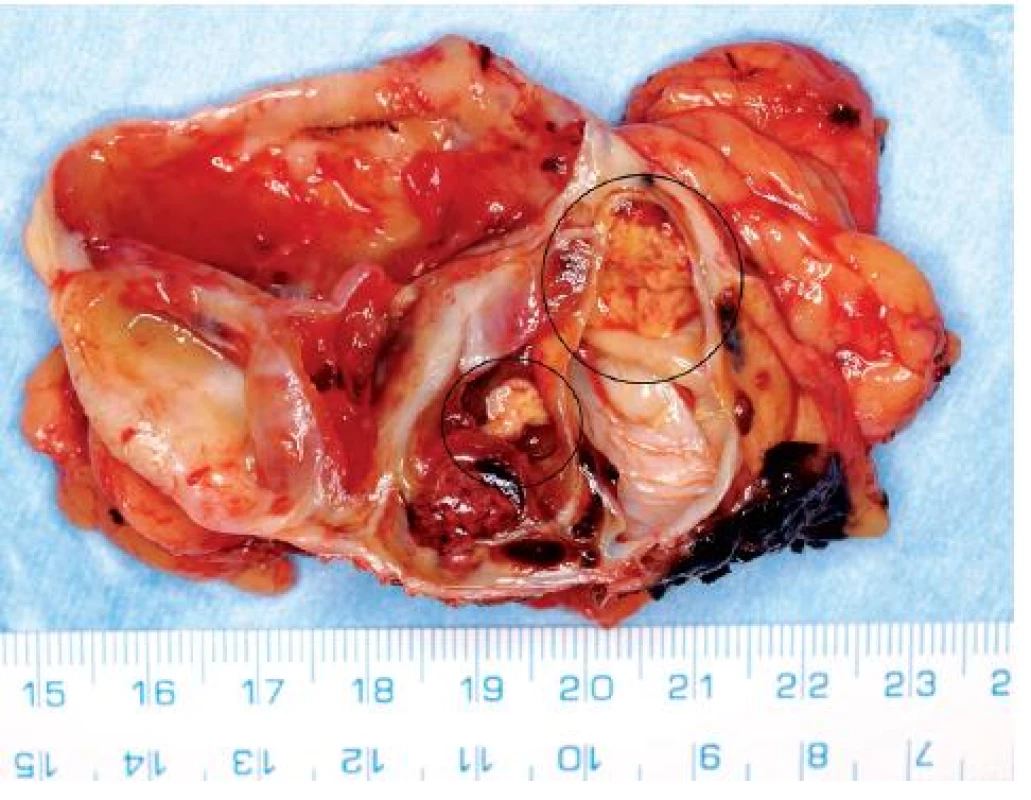
Papilární RK
Zde zaslouží pozornost onkocytický PRK, který je řadou patologů považován za jasně definovanou variantu PRCC a dá se označit jako typ 3 PRK (21). Po hlasování na vancouverské patologické konferenci nebyl tento typ však jako samostatná jednotka uznán a zůstávají nadále jen typ I a II a „PRCC NOS“ (no other specified – blíže nespecifikovaný) (obr. 7).
Image 7. Onkocytický papilární renální karcinom (21) horního pólu pravé ledviny T3aN0M0 u 76letého muže, provedena nefrektomie s adrenalektomií (tumor naléhal na nadledvinu – na preparátu nadledvina označena šipkou) Fig. 7. Oncocytic papillary RCC (21) of upper pole of the right kidney T3aN0M0 in a 76-year-old-man. Nephrectomy with adrenalectomy performed (arrows show adrenal gland related to tumour). 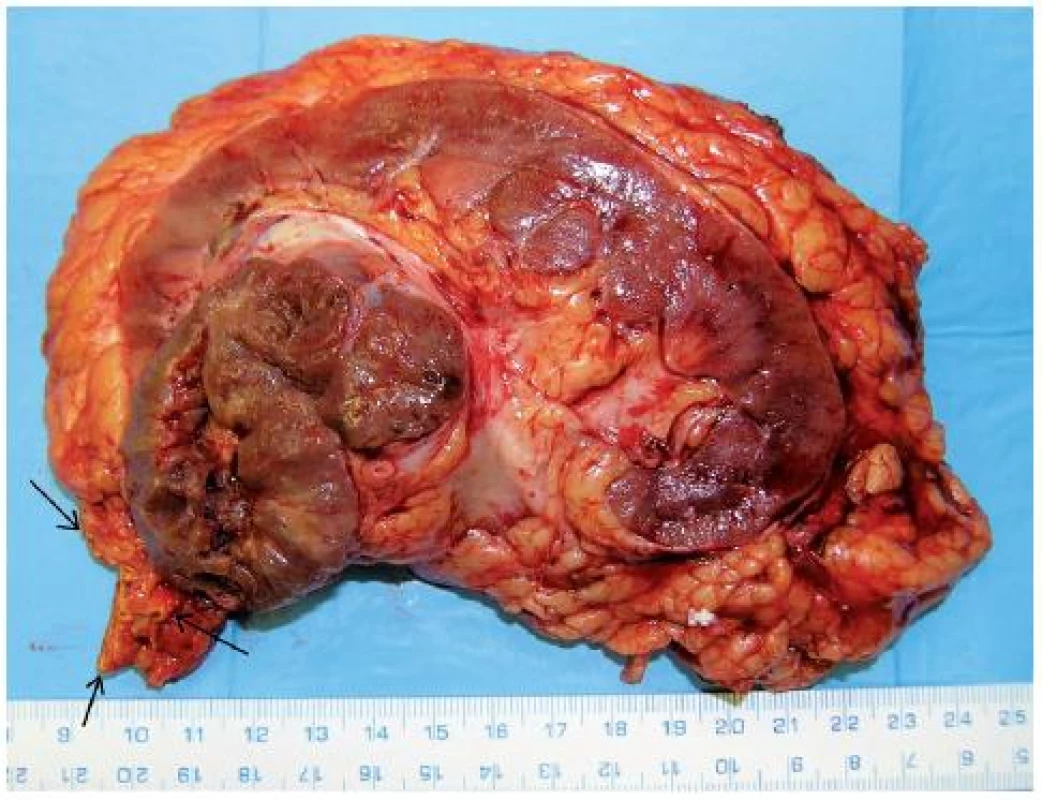
Hybridní onkocytické chromofobní tumory
Jedná se o indolentní tumor a vyskytuje se ve třech formách: v rámci Birt-Hogg-Dubé syndromu, při renální onkocytóze a jako sporadický nádor (22). Z pohledu klinika byl logicky zařazen jako podjednotka chromofobního RK. Vzhledem k možné přítomnosti složky chromofobního RK v nádoru (histologická stavba je poměrně komplikovaná a detailní popis je mimo rámec tohoto sdělení) je na něj nutno pohlížet jako na tumor s rizikem určitého byť minimálního maligního potenciálu. V současné době však není ve světovém písemnictví znám jediný agresivní případ (obr. 8).
Image 8. Muž 77 let, tumor dolního pólu pravé ledviny, histologicky sporadický hybridní onkocytický chromofobní tumor Fig. 8. Seventy seven year old male with a tumour of the lower pole of the left kidney T1bN0M0, histology hybrid oncocytic chromophobe tumour 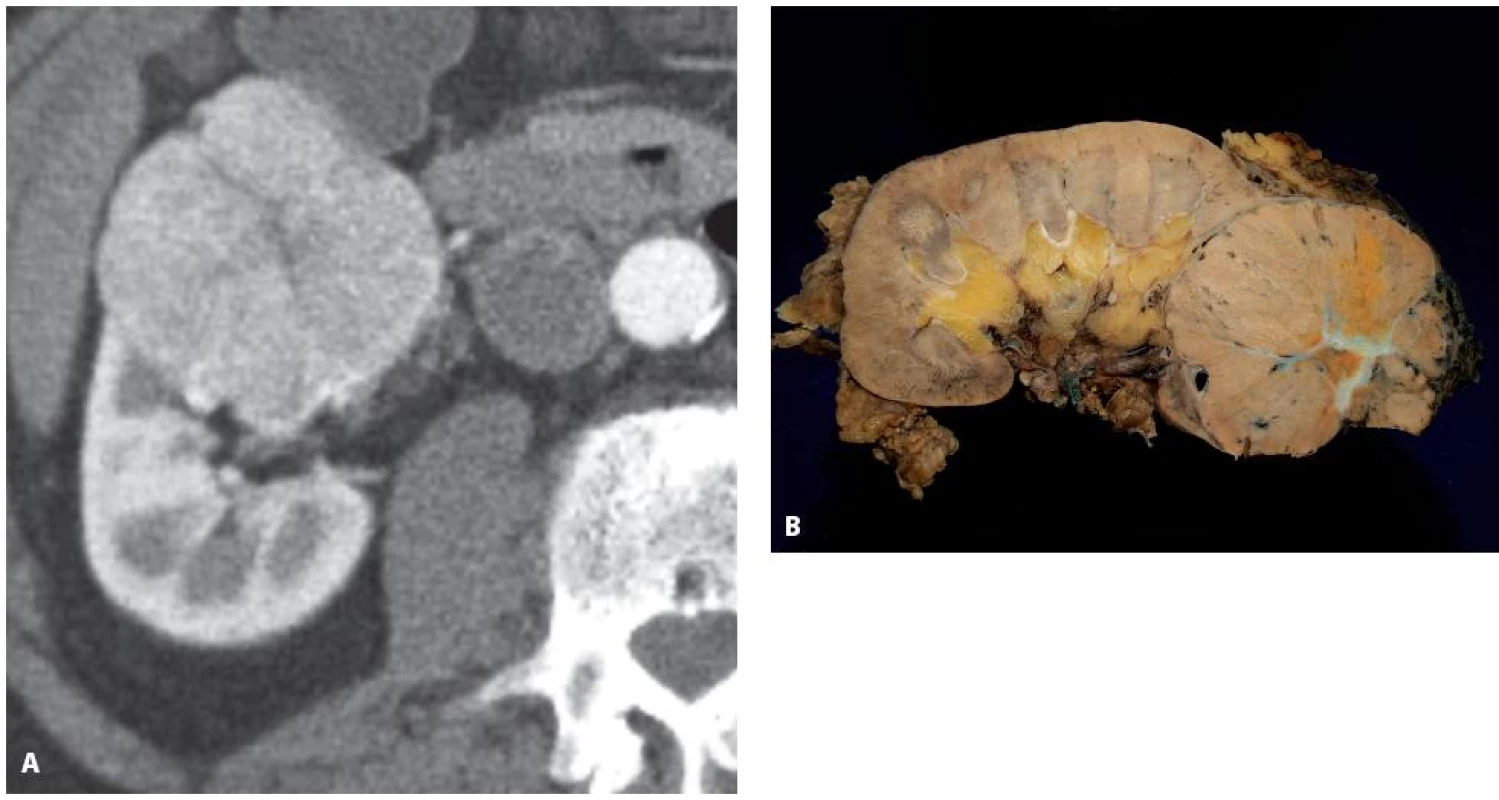
Karcinom ze sběrných kanálků a medulární RK
Zda jsou diskutovány zejména otázky histopatologické diferenciální diagnostiky karcinomu ze sběrných kanálků a vztah k uroteliálnímu karcinomu. Medulární RK je nadále považován za variantu karcinomu ze sběrných kanálků, ale může se dle posledních prací vyskytnout i bez srpkovité anémie (2).
Mucinózní tubulární a vřetenobuněčný RK (mucinous tubular and spindle cell RCC)
Tumor připomíná svojí cytologickou stavbou strukturu Henleyho kličky (23). Jedná se o tumor s minimálním maligním potenciálem, přesto jsou popsány léze agresivní i sarkomatoidně diferencované (2, 23, 24) (obr. 9).
Image 9. Muž 70 let, tumor levé ledviny T1b, mnohočetné paraaortální metastázy a metastáza nadledviny, provedena radikální levostranná nefrektomie s extenzivní paraaortální lymfadenketomií a adrenalektomií. Histologicky se jednalo o mucinózní tubulární a vřetenobuněčný renální karcinom. Metastázy však nebyly z renálního karcinomu, ale z dosud nediagnostikovaného karcinomu žaludku. A – CT ledviny axiální ve venózní fázi, B – preparát tumoru ledviny, C – preparát nadledviny s metastázami Fig. 9. Seventy year old male, tumour of the left kidney T1b, paraaortic lymph node and adrenal gland metastases. Radical nephrectomy, adrenalectomy and lymph node dissection performed. Histology of renal tumour: mu-C cinous Tubular and Spindle Cell RCC. Metastases were from stomach cancer. A – axial CT in venous phase, B – specimen of kidney tumour, C – specimen of adrenal gland with metastases 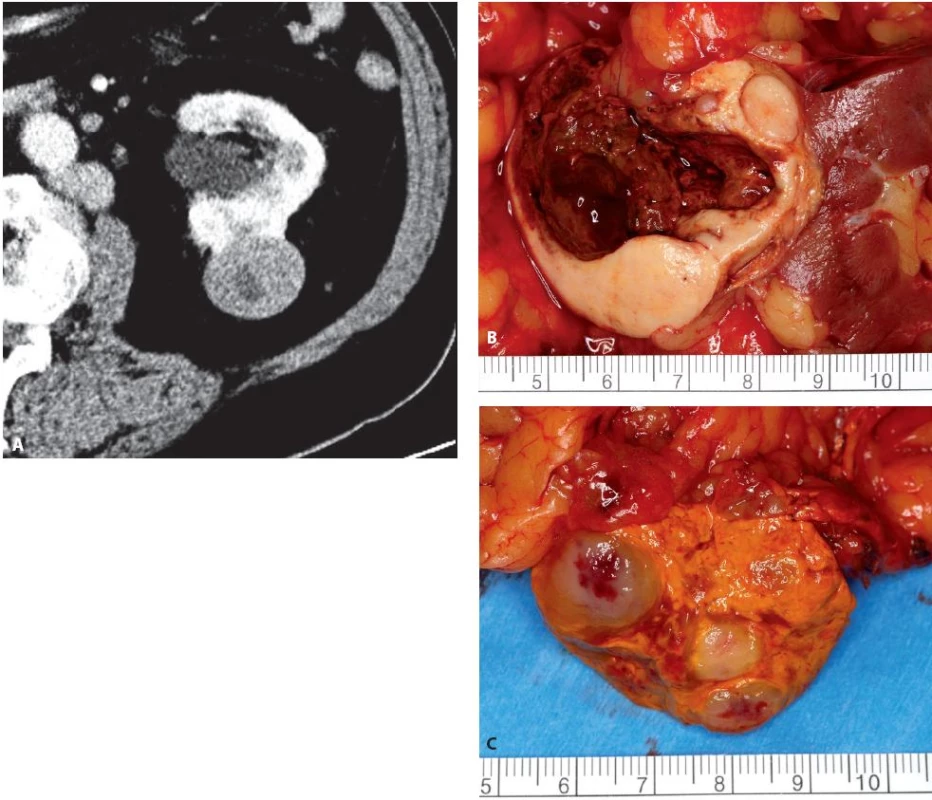
Epiteloidní angiomyolipom
Angiomyolipom (AML) patří do skupiny tzv. PEComů (perivascular epithelioid cell tumor – PEComa) (25). AML je klinikům dobře znám. Stejně tak potenciálně maligní epiteloidní va-rianta. Ve vancouverské klasifikaci jsou doplněny znalosti o další stratifikaci této jednotky včetně snahy o lepší predikci biologického chování, zařazení dalších podvariant – onkocytický AML, AML s epiteloidními cystami (obr. 10).
Image 10. Epiteloidní angiomyolipom levé ledviny 71 mm v největším rozměru u 44letého muže. CT obraz ani operační preparát z resekce ledviny nepřipomíná klasický angiomyolipom. Fig. 10. Epithelioid angiomyolipoma of the left kidney 71 mm in a 44-year-old man 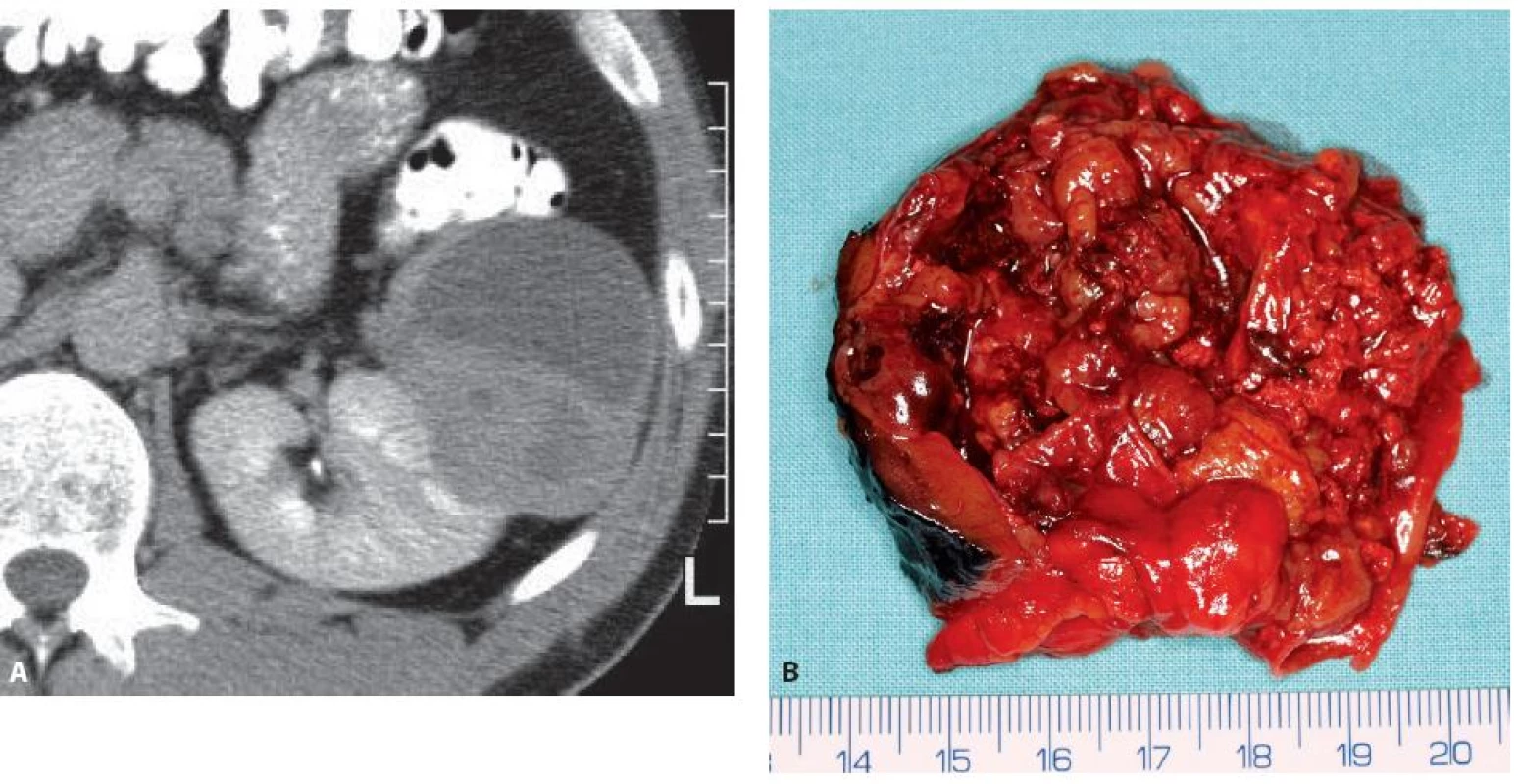
Smíšené mezenchymální a epiteliální tumory
Dřívější dvě podjednotky cystický nefrom a smíšený epiteliální stromální tumor ledviny (mixed epithelial stromal tumour) byly z pohledu klinika logicky zařazeny do stejné skupiny a dokonce byl již dříve navržen jednotný termín pro celou skupinu – REST (renal epithelial and stromal tumour) (26), termín REST však ve vancouverské klasifikaci není. Oba tumoru jsou rozsáhle cystické, nelze je předoperačně od sebe odlišit, oba se chovají benigně a jediný rozdíl mezi nimi je v histopatologickém nálezu (20, 27) a i to je stále otázkou diskuze patologů, pro klinickou práci však tato stratifikace nemá v současnosti žádný význam.
Další změna v této skupině (smíšené mezenchymální a epiteliální tumory) je čistě otázkou systematizace. Nově z této skupiny nádorů byl odstraněn primární renální synoviální sarkom ledviny a přesunut do skupiny sarkomů.
ZÁVĚR
Výzkum v histopatologii nádorů ledvina je poměrně intenzívní, kromě patologů se na ni podílejí též zejména cytogenetici. Klasifikace zavedených jednotek se dále propracovává, objevují se stále nové jednotky a podjednotky. V čase dochází k přesunům některý podjednotek do nově vznikajících kategorií, někdy se naopak (pod-)jednotky slučují. Pro kliniky (urology, radiology, onkology a další) je často poměrně obtížné se v tomto vyznat a snaha zjednodušovat si klasifikaci vede/může vést v jejich vědecké práci k řadě systematických chyb. Příkladem může být hodnocení CT obrazu všech papilárních RK, což je vcelku poměrně heterogenní skupina. Dalším zdrojem systematických chyb v klinické vědecké práci je retrospektivní zpracovávání souborů dle starších klasifikací nádorů ledvin. Základem klinického výzkumu v oblasti nádorů ledvin musí být podrobná znalost nových poznatků v histopatologii nádorů ledvin, jejich využití v aktuálním výzkumu a trvalá a těsná spolupráce s patologem a genetikem. V běžné klinické práci je naopak vítané co největší zjednodušení klasifikace nádorů ledvin s ohledem na aplikaci relativně omezených léčebných modalit jdoucí často napříč histopatologickým spektrem nádorů ledvin.
Došlo: 15. 12. 2013.
Přijato: 5. 1. 2014.
Střet zájmů: žádný.
Vznik práce podpořen grantem IGA NT 12010-4, projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00669806 – FN Plzeň a Programem rozvoje vědních oborů Karlovy Univerzity (projekt P36).
Kontaktní adresa
prof. MUDr. Milan Hora, Ph.D.
Urologická klinika LF UK a FN
E. Beneše 13, 305 99 Plzeň
e-mail: horam@fnplzen.cz
Sources
1. Eble JN SG, Epstein JI, et al. (eds.) Pathology and genetics of tumours of the urinary system and male genital organs. In: World Health Organization Classification of Tumours. Lyon: IARC Press 2004.
2. Srigley JR, Delahunt B, Eble JN, Egevad L, Epstein JI, Grignon D, et al. The International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia. The American journal of surgical pathology 2013; 37(10): 1469–1489.
3. Hora M, Hes O. Histologie nádorů ledvin dospělých. Ces Urol 1998; 2(5): 29–32.
4. Hora M, Urge T, Eret V, Stransky P, Klecka J, Kreuzberg B, et al. Tubulocystic renal carcinoma: a clinical perspective. World journal of urology 2011; 29(3): 349–354.
5. Steiner P, Hora M, Stehlik J, Martinek P, Vanecek T, Petersson F, et al. Tubulocystic renal cell carcinoma: is there a rational reason for targeted therapy using angiogenic inhibition? Analysis of seven cases. Virchows Archiv: an international journal of pathology 2013; 462(2): 183–192.
6. Hora M, Hes O, Reischig T, Urge T, Klecka J, Ferda J, et al. Tumours in end-stage kidney. Transplant Proc 2008; 40(10): 3354–3358.
7. Michal M, Hes O, Nemcova J, Sima R, Kuroda N, Bulimbasic S, et al. Renal angiomyoadenomatous tumor: morphologic, immunohistochemical, and molecular genetic study of a distinct entity. Virchows Archiv: an international journal of pathology 2009; 454(1): 89–99.
8. Michal M, Hes O, Kuroda N, Kazakov DV, Hora M. Difference between RAT and clear cell papillary renal cell carcinoma/clear renal cell carcinoma. Virchows Archiv: an international journal of pathology 2009; 454(6): 719.
9. Hora M, Hes O, Eret V, Ürge T, Klečka J, Ferda J, et al. Translokační renální karcinom Xp11. 2 typu ASPL/TFE3 (kidney carcinoma associated with Xp11.2 translocation type ASPL/TFE3). Ces Urol 2008; 12(3): 186–193.
10. Kalusová K, Hora M, Ürge T, Trávníček I, Eret V, Ferda J, et al. C03 MiT translocation renal cell carcinoma – a subset of tumours with translocation 6p21 [t (6; 11)] or Xp11. 2 [t (X; 1 or X or 17)]. European Urology Supplements 2013; 12(4): e1111, C03.
11. Hora M, Hes O, Ürge T, Eret V, Klečka J, Michal M. A distinctive translocation carcinoma of the kidney [„rosette-like forming“ t(6;11), HMB45-positive renal tumor]. Int Urol Nephrol 2009; 41(3): 553–557.
12. Petersson F, Vanecek T, Michal M, Martignoni G, Brunelli M, Halbhuber Z, et al. A distinctive translocation carcinoma of the kidney; „rosette forming“ t(6;11), HMB45-positive renal tumor: a histomorphologic, immunohistochemical, ultrastructural, and molecular genetic study of 4 cases. Human pathology 2012; 43(5): 726–736.
13. Przybycin CG, Magi-Galluzzi C, McKenney JK. Hereditary syndromes with associated renal neoplasia: a practical guide to histologic recognition in renal tumor resection specimens. Adv Anat Pathol 2013; 20(4): 245–263.
14. Branžovský J, Martínek P, Baulet K, Trávníček I, Stránský P, Vaneček T, et al. Využití molekulární genetiky v diferenciální diagnostice nádorů ledvin. Ces Urol 2012; 16(4): 214–221.
15. Grubb RL, 3rd, Franks ME, Toro J, Middelton L, Choyke L, Fowler S, et al. Hereditary leiomyomatosis and renal cell cancer: a syndrome associated with an aggressive form of inherited renal cancer. The Journal of urology 2007; 177(6): 2074–2079; discussion 9–80.
16. Ricketts CJ, Shuch B, Vocke CD, Metwalli AR, Bratslavsky G, Middelton L, et al. Succinate dehydrogenase kidney cancer: an aggressive example of the Warburg effect in cancer. The Journal of urology 2012; 188(6): 2063–2071.
17. Gill AJ, Pachter NS, Clarkson A, Tucker KM, Winship IM, Benn DE, et al. Renal tumors and hereditary pheochromocytoma-paraganglioma syndrome type 4. The New England journal of medicine 2011; 364(9): 885–886.
18. Gill AJ, Pachter NS, Chou A, Young B, Clarkson A, Tucker KM, et al. Renal tumors associated with germline SDHB mutation show distinctive morphology. The American journal of surgical pathology 2011; 35(10): 1578–1585.
19. Sukov WR, Hodge JC, Lohse CM, Akre MK, Leibovich BC, Thompson RH, et al. ALK alterations in adult renal cell carcinoma: frequency, clinicopathologic features and outcome in a large series of consecutively treated patients. Modern pathology: an official journal of the United States and Canadian Academy of Pathology Inc. 2012; 25(11): 1516–1525.
20. Hora M, Hes O, Michal M, Boudová L, Chudáček Z, Kreuzberg B, et al. Extensively cystic renal neoplasms in adults (Bosniak classification II or III)-possible „common“ histological diagnoses: multilocular cystic renal cell carcinoma, cystic nephroma, and mixed epithelial and stromal tumor of the kidney. Int Urol Nephrol 2005; 37(4): 743–750.
21. Ürge T, Hes O, Ferda J, Chudáček Z, Eret V, Michal M, et al. Typical signs of oncocytic papillary renal cell carcinoma in everyday clinical praxis. World journal of urology 2010; 28(4): 513–517.
22. Petersson F, Gatalica Z, Grossmann P, Perez Montiel MD, Alvarado Cabrero I, Bulimbasic S, et al. Sporadic hybrid oncocytic/chromophobe tumor of the kidney: a clinicopathologic, histomorphologic, immunohistochemical, ultrastructural, and molecular cytogenetic study of 14 cases. Virchows Archiv: an international journal of pathology 2010; 456(4): 355–365.
23. Hes O, Hora M, Perez-Montiel DM, Suster S, Curík R, Sokol L, et al. Spindle and cuboidal renal cell carcinoma, a tumour having frequent association with nephrolithiasis: report of 11 cases including a case with hybrid conventional renal cell carcinoma/spindle and cuboidal renal cell carcinoma components. Histopathology 2002; 41(6): 549–555.
24. Ürge T HM, Hes O, Eret V, Stransky P, Travnicek I, Chudacek Z, Betlach J, Curik R, Rousarova M, Petersson F. Spindle and cuboidal renal cell carcinoma: Clinical results and long term follow up. Eur Urol Suppl 2013; 14(4): e1111.
25. Ürge T, Hora M, Hes O, Chudáček Z. Renal angiomyolipoma, histology, diagnostics and therapy. Čas. Lék. čes. 2005; 144(12): 821–823; 4.
26. Hora M, Michal M, Hes O. Re: Rodolfo Montironi, Roberta Mazzuccelli, Antonio Lopez-Beltran, et al. Cystic nephroma and mixed epithelial and stromal tumour of the kidney: opposite ends of the spectrum of the same entity? Eur Urol 2008; 54 : 1237–1346. European urology 2009; 56(1): e3.
27. Michal M, Hes O, Kuroda N, Kazakov DV, Petersson F, Hora M, et al. What is a cystic nephroma? The American journal of surgical pathology 2010; 34(1): 126–127.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2014 Issue 1-
All articles in this issue
- Novelizovaná klasifikace nádorů ledvin 2013 (International Society of Urological Pathology Vancouver Classification of Renal Neoplasia)
- Přínos stanovení [-2]proPSA v diferenciální diagnostice karcinomu prostaty
- Radikální prostatektomie – analýza 191 případů vyšetřovaných metodikou celoplošných řezů (whole-mount section)
- Monitorace ztráty botulinumtoxinu při aplikaci do detruzoru – výsledky pilotní fáze studie
- Benigní schwannom retroperitonea
- Synchronní triplicita urologických malignit
- Solitární metastáza uroteliálního karcinomu do parenchymu ledviny napodobující primární nádor ledviny
- Dlaždicobuněčný karcinom ledvinné pánvičky
- Embolus krevního koagula renální tepny jako příčina infarktu ledviny
- Tumor z Leydigových buněk
- Nádor varlete z Leydigových buněk
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Tumor z Leydigových buněk
- Benigní schwannom retroperitonea
- Nádor varlete z Leydigových buněk
- Embolus krevního koagula renální tepny jako příčina infarktu ledviny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

