-
Medical journals
- Career
Hodnocení významu klinicko-patologických prognostických faktorů u nádorů močového měchýře neinfiltrujících svalovinu
Authors: Michael Pešl 1; Viktor Soukup 2; Marko Babjuk 3; Pavel Dundr 4; Otakar Čapoun 2; Zuzana Vaľová 2
Authors‘ workplace: Urologické oddělení 1. LF UK a FNB, Praha 1; Urologická klinika 1. LF UK a VFN, Praha 2; Urologická klinika 2. LF UK a FNM, Praha 3; Patologický ústav 1. LF UK a VFN, Praha 4
Published in: Ces Urol 2011; 15(4): 222-228
Category: Original article
Overview
Cíl:
Cílem práce je ověřit význam jednotlivých vybraných prognostických faktorů na vlastním souboru pacientů s TaT1 tumory močového měchýře.Metoda:
Do studie bylo zařazeno 178 mužů a 68 žen, průměrný věk 66,8 let (18–90 let). Pacienti byli rozděleni do skupin podle stupně nádorové invaze, míry histopatologické diferenciace, mnohočetnosti a dle přítomnosti carcinoma in situ (CIS). U jednotlivých skupin jsme hodnotili riziko recidivy a progrese.Výsledky:
Tumor T1 byl přítomen u 98 (33 %) pacientů, Ta u 119 (48 %) pacientů. Tumor G1 byl přítomen u 80 (33 %), G2 u 105 (43 %) a G3 u 42 (17 %) pacientů. Ve 107 (43 %) případech se jednalo o mnohočetný tumor, ve 139 (57 %) o solitární tumor. Přítomnost CIS patolog popsal u šesti (2 %) pacientů. Jako signifikantní prognostický faktor střední doby do recidivy se ukázala nádorová diferenciace (p = 0,0464) a mnohočetnost tumoru (p = 0,0459). Signifikantním rizikovým faktorem progrese jsme prokázali hloubku nádorové invaze (p = 0,001) a buněčná diferenciace (p = 0,001).Závěry:
Na základě hodnocení klinicko-patologických prognostických faktorů můžeme pacienty s TaT1 tumory močového měchýře zařadit do jednotlivých prognostických skupin, které se liší ve sledování i léčbě. Výsledky naší studie odpovídají údajům uváděným ostatními autory.Klíčová slova:
močový měchýř, prognostické faktory, progrese, recidiva, uroteliální nádory.Úvod
Uroteliální nádory močového měchýře jsou častým onemocněním. Podle NOR ČR (1) se jedná o šesté nejčastější maligní onemocnění u mužů a třinácté u žen. Jeho incidence u nás, podobně jako v ostatních vyspělých zemích, trvale vzrůstá. Podle histologického typu dělíme nádory močového měchýře na uroteliální (přes 90 %), dále epidermoidní karcinomy (6–7 %) a adenokarcinomy (do 2 %). Ostatní typy, jako např. sarkomy, malobuněčné karcinomy, feochromocytomy či lymfomy nalézáme vzácně (2). Podle stupně nádorové invaze dělíme uroteliální karcinomy na svalovinu detruzoru neinfitrující (TIS, Ta a T1) a dále svalovinu infiltrující (T2–4). Neinfiltrující tumory měchýře tvoří v době diagnózy 70 až 80 % všech uroteliálních tumorů (3).
Charakteristickými vlastnostmi neinfiltrujících uroteliálních tumorů je multifokální výskyt a vysoké riziko recidivy onemocnění v průběhu sledování (až 80 %). V případě recidivy onemocnění může dojít k progresi z neinfiltrující do infiltrující formy. Toto riziko kolísá mezi 2 a 50 % dle typu primárního nádoru. Z důvodu vysokého rizika recidiv onemocnění jsou pacienti doživotně dispenzarizováni. Sledování spočívá v pravidelných cytologických vyšetřeních moči a cystoskopiích.
V současné době není znám spolehlivý prognostický faktor, který by dokázal přesně předpovědět budoucí chování této malignity. Mezi rutinně využívané prognostické faktory patří stupeň nádorové invaze dle TNM klasifikace, stupeň buněčné diferenciace, velikost nádoru, počet předchozích recidiv, přítomnost konkomitantního TIS a výsledek první kontrolní cystoskopie po 3 měsících. Tyto klinicko-patologické faktory nám umožňují zařadit pacienty do rizikových skupin, mezi kterými jsou rozdíly v doporučeném sledování i následné léčbě (4). Doporučení hodnotit tyto faktory a stratifikovat léčbu pacientů dle rizikových skupin je uvedeno v Guidelines EAU (5).
V naší prospektivní studii jsme hodnotili význam klasických prognostických faktorů, jakými jsou nádorová invaze, stupeň buněčné diferenciace, mnohočetnost nádoru a přítomnost CIS pro odhad rizika recidivy, resp. progrese onemocnění.
Soubor pacientů a metodika
V období od srpna 2001 do září 2006 (střední doba sledování 22 měsíců) bylo na Urologické klinice 1. LF UK a VFN ošetřeno celkem 379 pacientů s nově diagnostikovaným (primozáchytem) tumorem močového měchýře. Z tohoto celkového množství bylo 246 (178 mužů a 68 žen) pacientů s neinfiltrujícím (TaT1) karcinomem. Znamená to, že týdně byl zachycen zhruba jeden pacient s tímto onemocněním. Průměrný věk v době diagnózy byl 66,8 let (18–90 let). U mužů byl průměrný věk o málo nižší – 66,4 let oproti ženám 67,4 let.
Všichni pacienti s prokázaným nádorem močového měchýře podstoupili transuretrální resekci tumoru (TUR), nádory byly histologicky verifikovány a hodnoceny dle TNM klasifikace z roku 1997. Random biopsie nebyly prováděny. V indikovaných případech jsme s odstupem 2 až 6 týdnů provedli druhou dobu transuretrální resekce (re-TUR). Pacienti, u nichž byl při re-TUR prokázán svalovinu infiltrující tumor, byli z dalšího sledování vyřazeni. Intravezikální instilační léčba byla indikována dle aktuálně platných doporučení Guidelines EAU (5). Pacienti byli rozděleni do skupin dle hloubky nádorové invaze na Ta a T1 tumory, dle stupně buněčné diferenciace (G1, G2 a G3), dle multifokality (solitární a mnohočetné) a dle toho, zda byl či nebyl zároveň přítomen i CIS. Charakteristiku skupiny pacientů shrnuje tabulka 1. Patologem nebyl stanoven stupeň buněčné diferenciace u 19 (8 %) pacientů a stupeň nádorové invaze u 23 (9 %) pacientů. V těchto případech však měly nádory při makroskopickém hodnocení typický papilární vzhled charakteristický pro tumory neinfiltrující svalovinu.
Table 1. Charakteristika souboru Table 1. Characteristics of cohort of patients 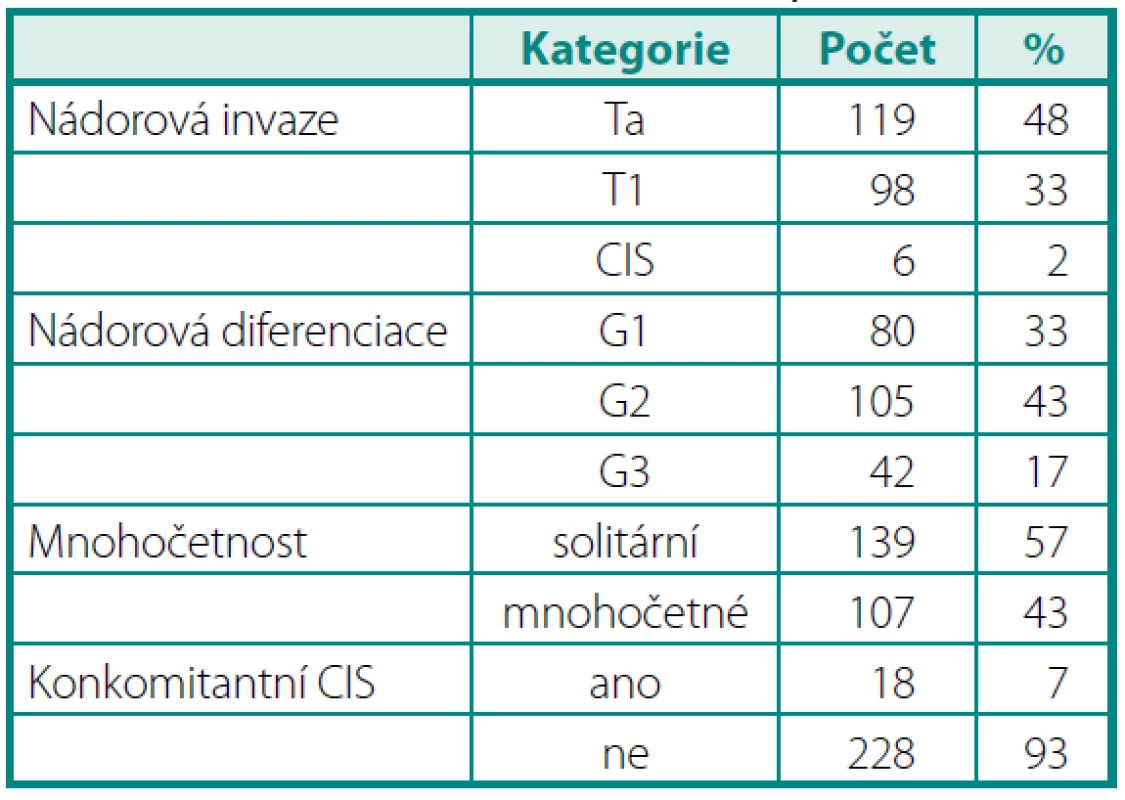
Při statistickém hodnocení byl použit program S.A.S. Software release 8.2 (SAS Inc., Cary, USA). Hladina statistické významnosti byla stanovena p = 0,05. Všechny recidivy byly histologicky verifikovány. Za progresi byl považován histologický průkaz tumoru infiltrujícího detruzor.
Výsledky
Prognostické faktory ve vztahu k riziku recidivy
Přežívání do recidivy – nádorová invaze
Z celého souboru (246 pacientů) jsme v průběhu sledování zjistili recidivu onemocnění u 99 pacientů. Průměrná doba přežívání bez recidivy byla u pacientů s Ta tumory 28 měsíců a s T1 tumory 16 měsíců. Tento rozdíl nebyl statisticky signifikantní (Log rank p = 0,44). Blíže viz Kaplanovy - Mayerovy křivky v grafu 1.
Graph 1. Přežívání do recidivy – nádorová invaze Graph 1. Recurrence free survival – tumour stage 
Log rank p = 0,44 Přežívání do recidivy – buněčná diferenciace
Při hodnocení času přežívání do recidivy v závislosti na stupni buněčné diferenciace byly rozdíly mezi jednotlivými skupinami statisticky signifikantní (graf 2). Průměrná doba přežívání do recidivy byla u pacientů s G1 tumory 28 měsíců, s G2 tumory 22 měsíců a s g3 tumory 10 měsíců. Tento rozdíl byl statisticky signifikantní (Log rank p = 0,0464).
Graph 2. Přežívání do recidivy – buněčná diferenciace Graph 2. Recurrence free survival – tumour grade 
Log rank p = 0,0464 Přežívání do recidivy – nádorová multiplicita
Při hodnocení času přežívání do recidivy v závislosti na nádorové multiplicitě byly rozdíly mezi jednotlivými skupinami statisticky signifikantní (graf 3). Průměrná doba přežívání bez recidivy byla u pacientů se solitárními tumory 28 měsíců, zatímco s mnohočetnými tumory to bylo pouze 14 měsíců (Log rank p = 0,0015).
Graph 3. Přežívání do recidivy – nádorová multiplicita Graph 3. Recurrence free survival – tumour multiplicity 
Přežívání do recidivy – přítomnost CIS
Při hodnocení vlivu přítomnosti CIS na délku přežívání bez recidivy jsme prokázali rozdíl ve smyslu kratšího beznádorového intervalu u pacientů s CIS. Tento rozdíl však nebyl statisticky signifikantní (Log rank p = 0,2827).
Při použití mnohonásobného Coxova regresního modelu a stepwise Coxova regresního modelu jako nejsilnější a jediný nezávislý prognostický faktor předpovědi rizika recidivy byla nádorová multiplicita (p = 0,0008).
Prognostické faktory ve vztahu k riziku progrese
Z celkového počtu 246 pacientů jich v průběhu sledování zprogredovalo (nádor při recidivě infiltroval svalovinu měchýře) pouze 8 (3 %).
Přežívání do progrese – nádorová invaze
Celkem jsme zaznamenali progresi u sedmi pacientů s T1 tumory a pouze u jednoho pacienta s Ta tumorem. Tento rozdíl byl statisticky signifikantní (Log rank p = 0,0001). Rozdíl dobře znázorňují Kaplanovy-Mayerovy křivky v grafu 4.
Graph 4. Přežívání do progrese – nádorová invaze Graph 4. Progression free survival – tumour stage 
Log rank p = 0,0001 Přežívání do progrese – buněčná diferenciace
Při hodnocení času přežívání do progrese v závislosti na stupni buněčné diferenciace byly rozdíly mezi jednotlivými skupinami statisticky významné (graf 5). K progresi došlo pouze u jednoho (1 %) pacienta s G1 tumorem, u čtyř (4 %) pacientů s G2 tumory a u pěti (12 %) pacientů s G3 tumory.
Graph 5. Přežívání do progrese – buněčná diferenciace Graph 5. Progression free survival – tumour grade 
Log rank p = 0,0039 Přežívání do progrese – nádorová multiplicita
Při hodnocení času přežívání do progrese v závislosti na nádorové multiplicitě byly rozdíly mezi jednotlivými skupinami statisticky signifikantní (graf 6). K progresi došlo pouze u jednoho (1 %) pacienta se solitárním tumorem a u sedmi (5 %) pacientů s mnohočetnými tumory.
Graph 6. Přežívání do progrese – nádorová multiplicita Graph 6. Progression free survival – tumour multiplicity 
Log rank p = 0,0042 Přežívání do progrese – přítomnost CIS
Při hodnocení času přežívání do progrese v závislosti na přítomnosti CIS (graf 7) jsme zjistili, že k progresi došlo u šesti (3 %) pacientů bez přítomnosti CIS a u dvou (11 %) pacientů s prokázaným konkomitantním CIS. Tento rozdíl byl statisticky signifikantní.
Graph 7. Přežívání do progrese – přítomnost CIS Graph 7. Progression free survival – concomitant CIS 
Log rank p = 0,0888 Při použití mnohonásobného Coxova regresního modelu se jako jediný nezávislý prognostický faktor předpovědi rizika progrese jevil stupeň nádorové diferenciace (p = 0,0064).
Diskuse
Výsledky naší práce potvrzují již dříve publikovaný fakt, že pacienti s neinfiltrujícími uroteliálními tumory močového měchýře tvoří velmi heterogenní skupinu stran prognózy jejich onemocnění. V této skupině se na jedné straně setkáváme s pacienty s relativně velmi příznivým průběhem s malým rizikem recidivy a téměř nulovým rizikem progrese a na druhé straně zde máme pacienty s vysokým rizikem recidivy i progrese. Hodnocení klasických klinicko - patologických prognostických faktorů nám umožňuje zařadit tyto pacienty do prognostických skupin, na základě čehož jsou následně rozdílně sledováni i léčeni.
Při hodnocení délky přežívání bez recidivy onemocnění jsme prokázali signifikantní rozdíly mezi jednotlivými skupinami pacientů při hodnocení nádorové invaze, buněčné diferenciace a multiplicity. Přítomnost konkomitantního CIS neprokázalo signifikantně kratší interval bez recidivy, což odpovídá údajům prezentovaným ostatními autory (5, 6). V multivariantní analýze byla jako nezávislý prognostický faktor odhadu rizika recidivy vyhodnocena pouze nádorová multiplicita.
Vzhledem k tomu, že jsme do naší studie zařadili pouze pacienty s primozáchytem povrchového tumoru močového měchýře, nehodnotili jsme další důležitý prognostický faktor – počet předchozích recidiv. Tento faktor spolu s výsledkem první kontrolní cystoskopie po 3 měsících od TUR dobře koreluje s délkou přežívání bez recidivy onemocnění (7).
Pokud jsme hodnotili dobu přežívání do progrese onemocnění, tak statisticky významné rozdíly byly zaznamenány u všech testovaných prognostických faktorů (nádorová invaze, diferenciace, multiplicita i přítomnost CIS. Z osmi pacientů, kteří zprogredovali, bylo sedm pacientů s t1 tumorem, pouze v jednom případě se jednalo o Ta tumor, zároveň málo diferencovaný – G3. Tumory Ta progredují velmi zřídka a téměř nikdy se nejedná o dobře diferencované (G1) tumory. V mnohonásobné analýze byl jako jediný nezávislý prognostický faktor odhadu rizika progrese označen stupeň buněčné diferenciace. Sedm pacientů z osmi, kteří zprogredovali, mělo G2 nebo G3 tumor, pouze v jednom případě se jednalo o G1 tumor.
Relativně vysoký počet pacientů s CIS nejspíše souvisí s využíváním fotodynamické diagnostiky (PDD). Přesto přítomnost konkomitantního CIS neprokázala signifikantně kratší beznádorový interval.
Závěr
Na základě hodnocení klinicko-patologických prognostických faktorů můžeme pacienty s neinfiltrujícími tumory močového měchýře zařadit do jednotlivých rizikových skupin, což umožňuje jejich rozdílné sledování a různou následnou léčbu. Výsledky naší studie stran významu prognostických faktorů odpovídají údajům uváděným ostatními autory.
Došlo: 13. 6. 2011.
Přijato: 30. 8. 2011.
Práce byla podpořena granty IGA MZ NC 8095-3, VZ MSM 0021620808 a IGA MZ č. 8934-3/2006.
Kontaktní adresa
MUDr. Michael Pešl, FEBU
Urologické oddělení 1. LF UK a FNB
Budínova 2,
180 00 Praha 8
e-mail: pesl_m@hotmail.com
Sources
1. Národní onkologický registr. http://ksrzis.cz/registry-pro-odborniky/narodni-zdravotni-registry/nor/nor.html.
2. Babjuk M. Nádory močového měchýře. In: Dvořáček J, a kol. Urologie II, 1. vyd. Praha: ISV 1998; 965–1033.
3. Palou J. Patient risk profiles: Prognostic factors of recurrence and progression. Eur Urol Suppl 2006; 5 : 648–653.
4. Sylvester RJ, van der Meiden AP, Oosterlink W, et al. Predicting recurrence and progression in individual patients with stage TaT1 bladder cancer using EORTC rick tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49 : 466–477.
5. Babjuk M, Oosterlink W, Sylvester RJ, Kaasinen E, Bohle A, Palau J. The European Association of Urology (EAU) Working group on Oncological urology. Guidelines on TaT1 (nonmuscle invasive) bladder cancer. EAU 2008.
6. Herr HW, Badalament RA, Amato DA, Laudone VP, fair WR, Whitmore Jr WF. Superficial bladder cancer treated with baccilus Calmette-Guérin: a multivariate analysis of factors affecting tumor progression. J Urol 1989; 141 : 22–29.
7. Millán Rodriguez F, Chéchile-Toniolo G, Salvador-Bayarri J, Palou J, Vincente-Rodriguez J. Multivariate analysis of the prognostic factors of primary superficial bladder cancer. J Urol 2000; 163 : 73–78.
8. Parmar MK, Freedman LS, Hargreave TB, Tlley DA. Prognostic factors for recurrence and followup policies in the treatment of superficial bladder cancer: report from the British Medical research Council Subgroup on Superficial Bladder Cancer (Urological Cancer Working party). J Urol 1989; 142 : 284–288.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2011 Issue 4-
All articles in this issue
- EUROPEAN BOARD OF UROLOGY
- Hodnocení významu klinicko-patologických prognostických faktorů u nádorů močového měchýře neinfiltrujících svalovinu
-
Čistá intermitentní katetrizace v léčbě neurogenních dysfunkcí dolních močových cest po spinálním poranění
Porovnání výsledků při použití hydrofilních a standardních PVC katétrů - RADIKÁLNÍ CHIRURGICKÁ LÉČBA HIDRADENITIS SUPPURATIVA POSTIHUJÍCÍ PENIS A SKROTUM
- Karcinom urachu
- Strangulační traumata penisu – naše zkušenosti s kovovými materiály
- INFORMACE PRO UROLOGY O EUNI – INTERNETOVÉM VZDĚLÁVÁNÍ LÉKAŘŮ V ROCE 2011
- RENÁLNÍ ONKOCYTOM: VYHODNOCENÍ SOUBORU PACIENTŮ A JEJICH CT NÁLEZŮ
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- EUROPEAN BOARD OF UROLOGY
- Karcinom urachu
-
Čistá intermitentní katetrizace v léčbě neurogenních dysfunkcí dolních močových cest po spinálním poranění
Porovnání výsledků při použití hydrofilních a standardních PVC katétrů - RADIKÁLNÍ CHIRURGICKÁ LÉČBA HIDRADENITIS SUPPURATIVA POSTIHUJÍCÍ PENIS A SKROTUM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

