-
Medical journals
- Career
Karcinom urachu
: Lubomír Janiš; Miroslav Štursa; Tomáš Vágner; Jakub Fejfar
: Komplexní onkologické centrum Nový Jičín ; Urologické oddělení Nemocnice s poliklinikou Nový Jičín, p. o.
: Ces Urol 2011; 15(4): 251-255
: Case report
Uvádíme kazuistiku pojednávající o raritním nádorovém onemocnění – karcinomu urachu. Jedná se o onemocnění se špatnou prognózou, na které je třeba myslet při atypicky vyhlížejících nádorech ve vrcholu či ve střední čáře přední stěny močového měchýře. Standardním léčebným postupem je operační řešení formou resekce části močového měchýře s nádorem či radikální cystektomie, vždy se současnou exstirpací urachu a umbiliku. Role adjuvantní léčby není dosud dostatečně prostudována. Na našem případu demonstrujeme, že u lokálně pokročilého onemocnění ani včasná radikální chirurgická léčba nemusí znamenat vyléčení pacienta.
Klíčová slova:
karcinom urachu, parciální cystektomie, urachus.Úvod
Urachus je vazivový pruh spojující vrchol močového měchýře s pupkem fixující močový měchýř k břišní stěně. Jedná se o původně průchodnou spojku mezi extraembryonální alantois a kraniální vezikouretrální částí sinus urogenitalis. V průběhu embryogeneze bývá obliterován a přeměněn ve vazivové ligamentum umbilicale medianum (1). Pokud není urachus zcela obliterován, mohou se v jeho průběhu vyskytnout různé anomálie – perzistující urachus, vezikourachální divertikl, cysta urachu nebo sinus urachu (2). V epiteliích a žlázkách zbytků urachu může též dojít ke vzniku malignity. Histologicky se jedná nejčastěji o adenokarcinom (téměř 90 %), dále o karcinom dlaždicobuněčný, z přechodního epitelu či o sarkom. Zřídka je současně přítomen adenokarcinom a ještě jiný histologický typ nádoru (3, 4). Adenokarcinom postihuje typicky pacienty v 5. až 7. dekádě věku, přibližně 2,5× častěji jsou postiženi muži (1, 3, 5).
Vzácnost onemocnění nejlépe dokládá fakt, že v anglicky psaných zdrojích je celkem popsáno méně než 350 případů tohoto onemocnění. K nejrozsáhlejším souborům z nedávné doby patří práce autorů z Mayo clinic prezentující 66 případů onemocnění (1). Relativně vyšší výskyt choroby je v oblasti Dálného východu, japonští autoři již v roce 1983 zpracovali soubor 157 případů (6).
Klinické symptomy onemocnění nebývají specifické, nejčastějším příznakem bývá hematurie. Dále se může objevit obtížné, bolestivé močení, polakisurie, nespecifické bolesti v podbřišku, urgence nebo výtok z pupku, je-li urachus perzistující. Někdy lze vyhmatat rezistenci v podbřišku. K diagnostice onemocnění se používají endoskopické a zobrazovací metody. V endoskopickém obraze může být patrná pouze extravezikální expanze ve vrcholu nebo ve střední čáře přední stěny měchýře, s neporušeným slizničním krytem. Při pokročilejším onemocnění lze v těchto lokalitách nalézt ulcerující nebo nekrotický tumor s relativně ostrým přechodem do okolní neporušené sliznice. Ze zobrazovacích vyšetření lze využít ultrasonografii (USG), výpočetní tomografii (CT) či magnetickou rezonanci (MR).
Sonografie je spíše orientační vyšetření, které může identifikovat patologickou expanzi, ale neposkytne dostatečné informace o stagingu. Pro upřesnění charakteru procesu a staging je obvykle rozhodující CT nebo MR (2, 3). Přínos literárně uváděné cystografie je ve srovnání s předchozími metodami minimální (2). V rámci diferenciální diagnostiky je také vhodné vzít do úvahy endometriózu, Meckelův enterolith, absces, malakoplakii, xantogranulomatózní zánět, tumor tenkého nebo tlustého střeva, aktinomykózu, divertikulitidu a další (7).
Kazuistika
Tato práce navazuje na sdělení prezentované v roce 2009 (8). Žena ve věku 58 let, zdravotní sestra, nekuřačka, s anamnézou hypertenze a hypotyreózy, byla vyšetřena ve spádové urologické ambulanci pro několik týdnů trvající ataky bezbolestné makroskopické hematurie. V rámci došetření byla provedena cystoskopie s nálezem tumorózní formace v oblasti vertexu, o průměru 25–30 mm, s nekrotickým povrchem a jen ojedinělými papilárními změnami. Z těchto změn byla provedena studená biopsie. Histologie prokázala jen sporadické buněčné elementy maligního novotvaru, pravděpodobně high-grade uroteliálního karcinomu močového měchýře. Následně bylo doplněno CT, které identifikovalo solidní expanzi velikosti 30 × 22 × 31 mm nasedající na ventrální stěnu močového měchýře. Útvar měl širokou bázi, která prominovala do měchýře a klkatě vybíhal extravezikálně, infiltrujíce i perivezikální tuk, bez známek infiltrace břišní stěny. Spádové uzliny nebyly zvětšené (obr. 1). Případ byl konzultován s naším pracovištěm a na podkladě nálezů bylo indikováno operační řešení s plánem provedení parciální cystektomie, vzhledem k lokalizaci ve vrcholu měchýře a možném zdroji v urachu. Peroperačně byl nalezen tumor velikosti 3 cm ve vrcholu měchýře a přecházející na urachus.
1. Karcinom urachu – CT scan Fig. 1. Urachal carcinoma – CT scan 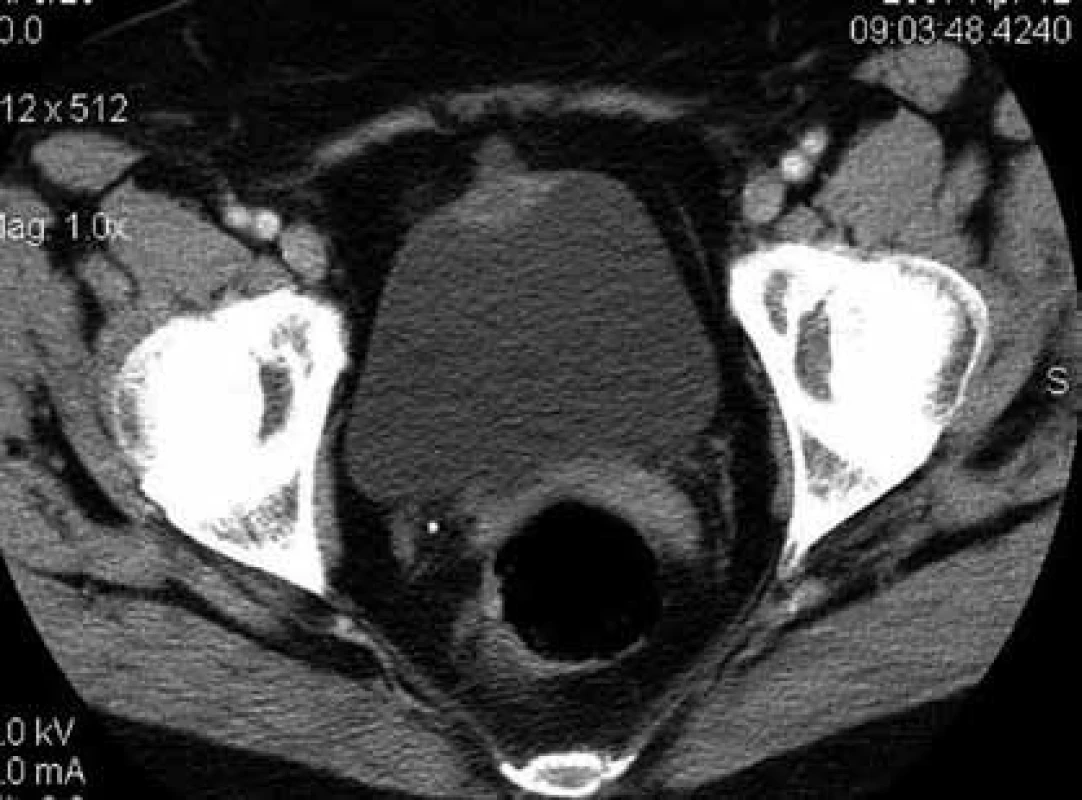
Dle plánu byla provedena vrcholová resekce měchýře s exstirpací urachu až k pupku (obr. 2, 3, 4). Lymfadenektomie nebyla provedena vzhledem k absenci postižení uzlin na CT. Patolog následně popsal invazivní urachální mucinózní karcinom vrcholu močového měchýře infiltrující stěnou až do subserózy. Imunohistochemie nebyla provedena. Tumor nedosahoval resekční linie a nález byl hodnocen jako pT3a, což odpovídá stadiu IIIa dle Sheldona a stadiu II dle Henlyho (Mayo staging system) (3). Diference mezi histologií ze studené biopsie a definitivním preparátem pravděpodobně vychází z malého rozsahu původního vzorku, který byl obtížně hodnotitelný.
2. Peroperační nález – tumor lokalizovaný ve vrcholu měchýře Fig. 2. Intraoperative finding – tumor localized in the bladder dome 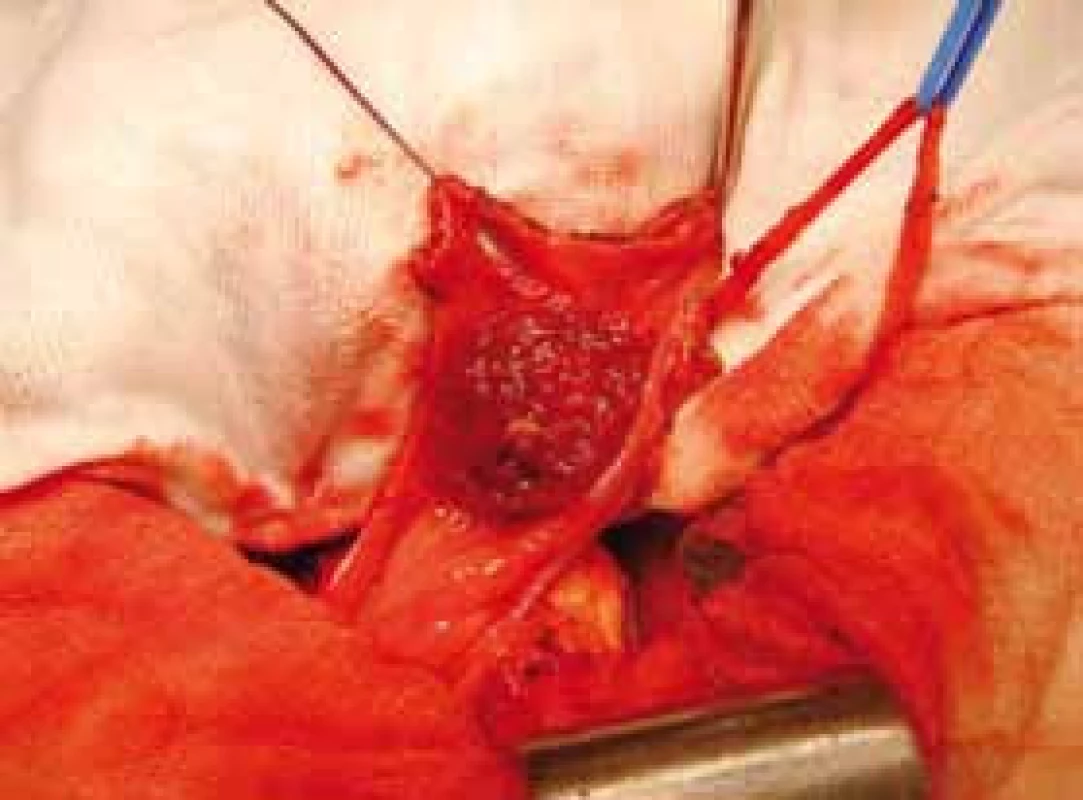
3. Peroperační nález – preparace urachu Fig. 3. Intraoperative finding – urachal dissection 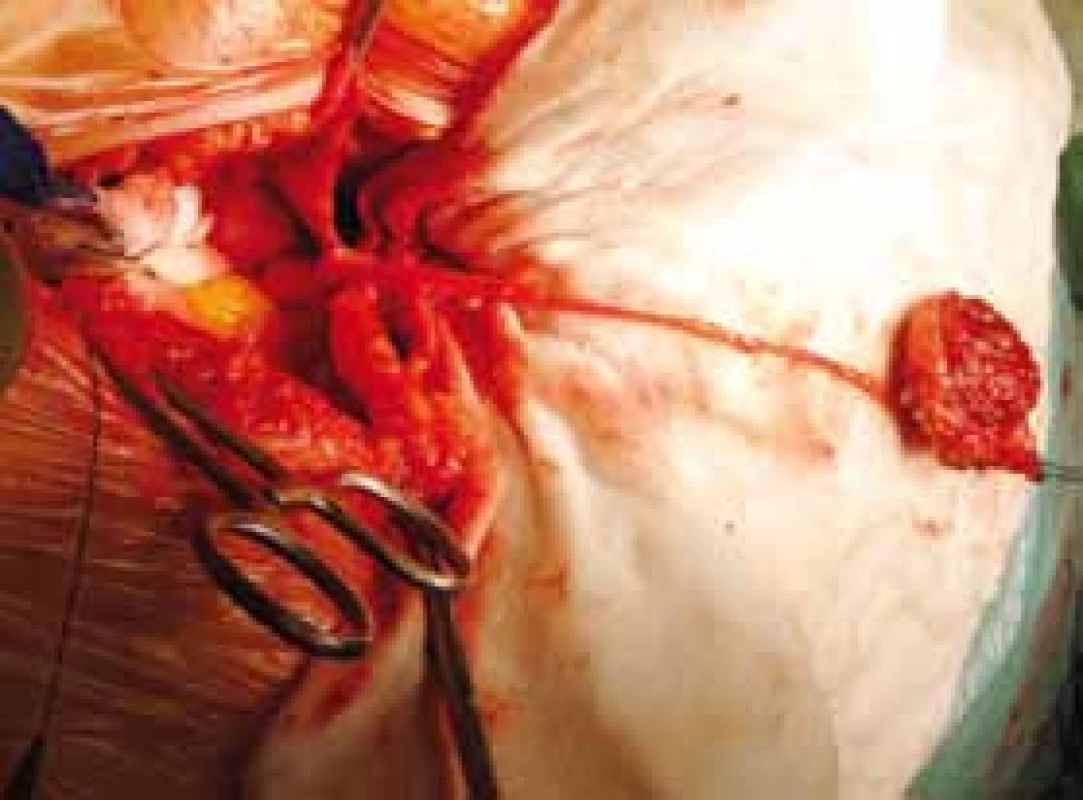
4. Excidovaný tumor s urachem – preparát Fig. 4. Excised tumor with urachus – specimen 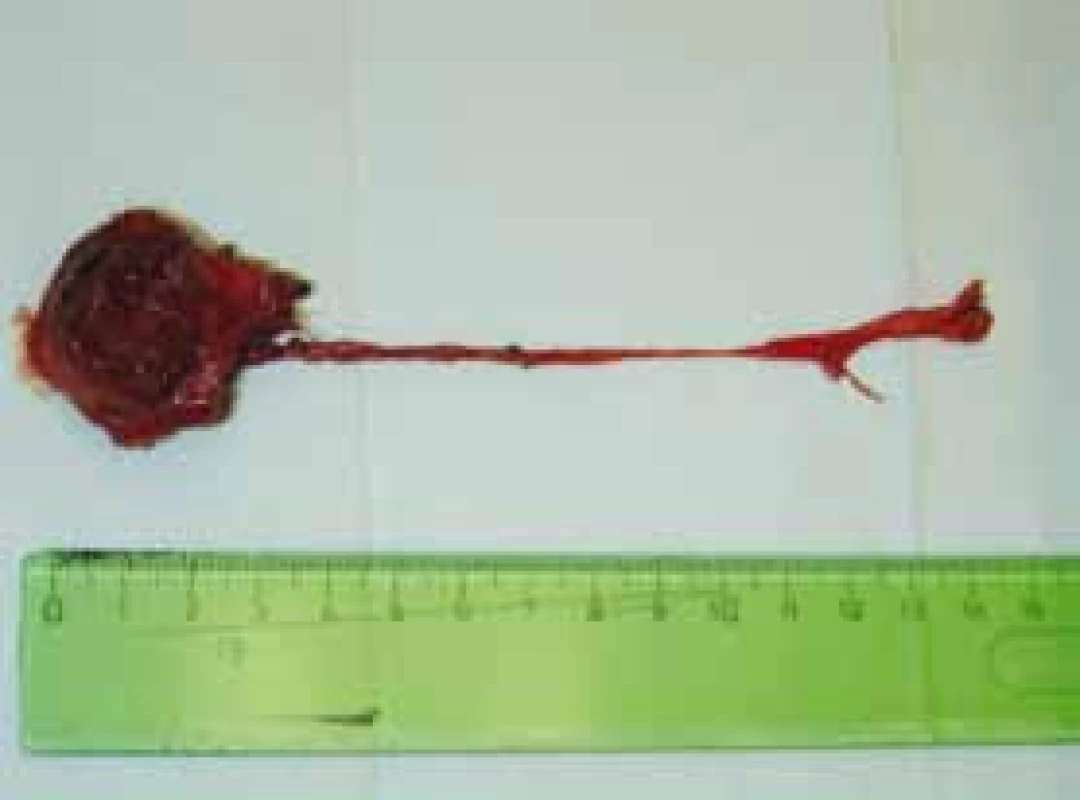
Pooperační průběh byl nekomplikovaný, pacientka byla dále sledována ve spádové urologické ambulanci včetně pravidelných endoskopických kontrol každé tři měsíce. V odstupu 21 měsíců od operace byl endoskopicky nalezen suspektní nekrotický okrsek sliznice v oblasti vertexu. Bylo doplněno CT vyšetření, které zobrazilo recidivu vpravo na přední stěně měchýře s extravezikální propagací. Její velikost byla 3 cm v maximálním rozměru, lymfadenopatie opět nebyla patrná. Proto bylo opět zvoleno chirurgické řešení a byla provedena resekce stěny měchýře s tumorem. V rámci radikality výkonu byla provedena i excize z oblasti symfýzy a resekce distální partie přímých břišních svalů. Byla prokázána recidiva urachálního mucinózního karcinomu, symfýza a břišní svaly nebyly nádorem infiltrovány. Pacientka byla indikována k adjuvantní radioterapii pánve s podáním celkem 45 Gy na malou pánev a boostem 10 Gy na oblast tumoru, záření dávkováno celkem ve 30 frakcích. Pacientka byla nadále dispenzarizovaná ve spádové urologické ambulanci. CT vyšetření 12 měsíců od ukončení radioterapie ukázalo jen diskrétní zesílení přední stěny měchýře, které bylo hodnoceno jako postradiační, případně pooperační změny, jinak bez známek generalizace, bez lymfadenopatie. Na skeletu zachyceném na CT byly patrné jen degenerativní změny.
Při kontrolní cystoskopii byl na sliznici přední stěny měchýře opět nalezen okrsek sliznice nekrotického charakteru. Biopticky byla z tohoto ložiska i tentokrát prokázána přítomnost buněk urachálního adenokarcinomu a pacientka byla indikována k dalšímu operačnímu výkonu. Tumor byl nalezen na přední stěně, blíže k hrdlu. Provedli jsme širokou excizi přední stěny měchýře s recidivou tumoru, jehož odstranění se peroperačně makroskopicky jevilo kompletní, což následně patolog potvrdil. Nádorové buňky prostupovaly pod urotelem celou stěnou močového měchýře, byla zachycena lymfangioinvaze a perineurální permeace. Nádor nedosahoval okrajů resekátu. Vzhledem k recidivujícímu lokálně pokročilému onemocnění byla onkologem indikována systémová léčba. Pacientka proto zahájila chemoterapii FUFA (5-fluorouracil + leukovorin).
Přes tuto terapii došlo po dvou cyklech k prudké akceleraci choroby a zhoršení celkového stavu. U pacientky bylo scintigraficky prokázáno mnohočetné metastatické postižení skeletu s ložisky v obou lopatách kostí kyčelních, levé části kosti křížové a hlavici humeru, mnohočetným postižením obratlových těl hrudní a bederní části páteře, žeber. Pro kompresivní frakturu obratle L5 podstoupila pacientka dekompresní operaci, histologicky i zde byla prokázána přítomnost mucinózního karcinomu. Poté indikována paliativní radioterapie na oblast bederní páteře, do medikace nasazeny bisfosfonáty. I přes aplikaci radioterapie zůstala pacientka dále algická, s iradiací bolesti do dolních končetin. Úlevy od bolesti bylo dosaženo až po nasazení opiátů. Dále se objevují intermitentní stavy dezorientace, proto bylo v rámci diferenciální diagnostiky doplněno CT mozku, které metastázy nepotvrdilo. Onkolog konstatoval vyčerpání léčebných možností a pacientka byla 4 roky od stanovení diagnózy přeložena s infaustní prognózou do hospicové péče.
Diskuse
Karcinom urachu je raritním onemocněním s nepříznivou prognózou. To je důsledkem často pozdě se manifestujících příznaků a obtížné diagnostiky, je-li cystoskopický nález netypický nebo minimální. Onemocnění má tendenci k časné lokální recidivě, která se objevuje často do 6 měsíců od operace (1). Vzdálené metastázy se objevují nejčastěji v játrech, plicích, skeletu nebo mozku (9). Na pozoru musíme proto být zejména u netypicky vyhlížejících tumorů lokalizovaných ve vertexu měchýře, potažmo na jeho přední stěně ve střední čáře.
Nejpřínosnější diagnostickou metodou se jeví CT vyšetření, které tumor přesně lokalizuje a umožňuje lokální staging (2, 3). K diagnostice vzdálených ložisek lze využít PET nebo PET/CT, k hodnocení lokálního rozsahu tumoru větší přínos nemá (10). Standardní metodou řešení je chirurgická léčba formou otevřené nebo laparoskopické operace. Provést lze parciální nebo radikální cystektomii, vždy s excizí urachu a umbiliku. Parciální cystektomie je upřednostňována vzhledem k lepší kvalitě života a obdobným onkologickým výsledkům u srovnatelných stadií onemocnění (1, 3, 9, 11). Popsána byla i možnost řešení formou roboticky asistované operace (12). Role lymfadenektomie při parciálních cystektomiích není standardizovaná a u pacientů s urachálním karcinomem není její terapeutický benefit jasný (13, 14). Postavení adjuvantní léčby (chemoterapie i radioterapie) nebylo dosud dostatečně prostudováno (1, 9). Lokální recidivy lze často úspěšně vyřešit opakovanou parciální cystektomií (9). Účinnost radioterapie ve stejné indikaci se nezdá dostatečná (1). Generalizované onemocnění má extrémně špatnou prognózu i proto, že dosud neexistuje zavedený protokol chemoterapie. V literatuře je zaznamenáno použití kombinace gemcitabinu s cisplatinou (15), 5-fluorouracilu s cisplatinou (16) či MVAC (metotrexát, vinblastin, doxorubicin, cisplatina). Vzhledem k imunohistochemické příbuznosti s kolorektálním karcinomem je zkoušena terapie účinná na toto onemocnění, např. FOLFOX (oxaliplatina v kombinaci s fluorouracilem a leukovorinem) (17).
Prognózu pacienta ovlivňují především lokální rozsah onemocnění, grading nádoru a dosažení negativního okraje při operaci (1, 3, 9, 11, 16). Jako dostatečná šíře okrajů k zajištění radikality výkonu se udává 1,5–2 cm (18). U tohoto onemocnění je uváděno 5leté přežívání 34 % (3) až 40 % (16), průměrná doba přežití od diagnózy 46 měsíců (16) až 62 měsíců (3). Podstatným prognostickým faktorem pro přežívání je stadium onemocnění. Při užití klasifikace dle Sheldona je u stadií I/II medián přežití 10,8 roku, u stadií III/IV je to jen 1,3 roku (3).
Závěr
Na našem případu vidíme, že ani relativně dlouhý bezpříznakový průběh onemocnění nemůže vyloučit následnou recidivu s možným letálním koncem. Hlavními prognostickými faktory jsou lokální rozsah onemocnění, grade nádoru a kompletnost resekce. Parciální cystektomie je preferovaným řešením vzhledem k lepší kvalitě života a srovnatelným onkologickým výsledkům v porovnání s radikální cystektomií. Radioterapie nebo chemoterapie formou adjuvance nebo léčby recidivujícího onemocnění neprokázaly dosud přesvědčivé výsledky.
Došlo: 29. 8. 2011.
Přijato: 20. 10. 2011.
Kontaktní adresa
MUDr. Lubomír Janiš
Urologické oddělení NsP Nový Jičín
K Nemocnici 76,
741 01 Nový Jičín
e-mail: lubomir.janis@nspnj.cz
Sources
1. Ashley RA, Inman BA, Sebo TJ, et al. Urachal carcinoma: Clinicopathologic features and long-term outcomes of an aggressive malignancy. Cancer 2006; 107(4): 712–720.
2. Nimmonrat A, Na-ChiangMai W, Muttarak M. Urachal abnormalities: clinical and imaging features. Singapore Med J 2008; 49(11): 930–935.
3. Molina JR, Quevedo JF, Furth AF, et al. Predictors of survival from urachal cancer. Cancer 2007; 110 : 2434–2440.
4. Gopalan A, Sharp DS, Fine SW, et al. Urachal carcinoma: a clinicopathologic analysis of 24 cases with outcome correlation. Am J Surg Pathol 2009; 33(5): 659–668.
5. Besarani D, Purdie CA, Townell NH. Recurrent urachal adenocarcinoma. J Clin Pathol 2003; 56(11): 882.
6. Ghazizadeh M, Yamamoto S, Kurokawa K. Clinical features of urachal carcinoma in Japan: review of 157 patients. Urol Res 1983; 11(5): 235–238.
7. Mainer K, Čuřík R. Zánětlivé komplikace cysty urachu. Ces Urol 2000; 4(4): 35–38.
8. Janiš L, Štursa M, Vágner T, et al. Karcinom urachu – kazuistika. Ces Urol 2009; 13(1): 133.
9. Hong SH, Kim JC, Hwang TK. Laparoscopic partial cystectomy with en bloc resection of the urachus for urachal adenocarcinoma. Int J Urol 2007; 14(10): 963–965.
10. Lu YY, Chen JH, Liang JA, et al. Clinical value of FDG PET or PET/CT in urinary bladder cancer: A systemic review and meta-analysis. Eur J Radiol 2011; (v tisku) doi:10.1016/j.ejrad. 2011.07.018
11. Lughezzani G, Sun M, Jeldres C, et al. Adenocarcinoma versus urothelial carcinoma of the urinary bladder: comparison between pathologic stage at radical cystectomy and cancer-specific mortality. Urology 2010; 75(2): 376–381.
12. Spiess PE, Correa JJ. Robotic assisted laparoscopic partial cystectomy and urachal resection for urachal adenocarcinoma. Int Braz J Urol 2009; 35(5): 609.
13. Fahmy N, Aprikian A, Tanguay S, et al. Practice patterns recurrence after partial cystectomy for bladder cancer. World J Urol 2010; 28(4): 419–423.
14. Siefker-Radtke A. Urachal carcinoma: surgical and chemotherapeutic options. Expert Rev Anticancer Ther 2006; 6(12): 1715–1721.
15. Miyata Y, Sagara Y, Matsuo T, et al. Response of Recurrent Urachal Cancer to Gemcitabine and Cisplatin Therapy: A Case Report and Literature Review. Anticancer Res 2011; 31(6): 2335–2338.
16. Siefker-Radtke AO, Gee J, Shen Y, et al. Multimodality management of urachal carcinoma: the M. D. Anderson Cancer Center experience. J Urol 2003; 169 : 1295–1298.
17. Tran B, McKendrick J. Metastatic urachal cancer responding to FOLFOX chemotherapy. Can J Urol 2010; 17(2): 5120–5123.
18. Mirandolino MB, Marcos TV. Laparoscopic partial cystectomy in bladder cancer: initial experience. Int Braz J Urol 2004; 30(3): 192–198.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2011 Issue 4-
All articles in this issue
- EUROPEAN BOARD OF UROLOGY
- Prognostic value of clinico-pathological factors in patiens with TaT1 bladder carcinoma
-
Clean intermittent catheterization in the treatment of neurogenic dysfunctions of the lower urinary tract after spinal cord injury – comparison of the results of hydrophilic
Coated and standard PVC catheters - RADICAL SURGICAL TREATMENT OF HIDRADENITIS SUPPURATIVA OF PENIS AND SCROTUM
- Urachal carcinoma
- Strangulation injury of the penis – our experience with metallic materials
- THE ACTUAL INFORMATION FOR UROLOGISTS ABOUT EUNI – E-LEARNING EDUCATION OF PHYSICIANS IN 2011
- RENAL ONCOCYTOMA: EVALUATION OUR FILE OF PATIENTS AND CT FINDINGS
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- EUROPEAN BOARD OF UROLOGY
- Urachal carcinoma
-
Clean intermittent catheterization in the treatment of neurogenic dysfunctions of the lower urinary tract after spinal cord injury – comparison of the results of hydrophilic
Coated and standard PVC catheters - RADICAL SURGICAL TREATMENT OF HIDRADENITIS SUPPURATIVA OF PENIS AND SCROTUM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

