-
Medical journals
- Career
Vitamin D a imunita
Authors: Látalová Vendula; Kopřiva František; Dvořák Denis; Karásková Eva
Authors‘ workplace: Dětská klinika, Lékařská fakulta, Univerzita Palackého v Olomouci a FN Olomouc
Published in: Čes-slov Pediat 2024; 79 (2): 77-80.
Category:
doi: https://doi.org/10.55095/CSPediatrie2024/016Overview
Role vitaminu D je klasicky spojována především s kalcium-fosfátovým metabolismem. V posledních letech však máme stále více informací o jeho významném imunoregulačním vlivu, a to jak na vrozenou, tak adaptivní imunitu. Vitamin D má svůj význam při ochraně před patogenními mikroorganismy i v udržení imunotolerance a jeho nedostatek bývá spojován s infekcemi, autoimunitními či nádorovými chorobami.
Klíčová slova:
autoimunita – vitamín D – infekce – vrozená imunita – kalcitriol – 1,25(OH)2D – adaptivní imunita
Vitamin D je prohormon, jenž se vyskytuje v mírně odlišných formách u rostlin i živočichů. V živočišné říši se jeho prekurzor 7-dehydrocholesterol mění v kůži po expozici ultrafialovému záření na vitamin D3 (cholekalciferol), který je následně hydroxylován v játrech na 25-hydroxy-vitamin D3 (kalcidiol).(1,2) Kalcidiol má poločas 3 týdny a dobře odráží zásoby vitaminu D v organismu, protože zohledňuje jak exogenní příjem, tak endogenní tvorbu vitaminu D. Působením 1-α-hydroxylázy vzniká aktivní hormon 1,25(OH)2D (kalcitriol). Tato hydroxylace probíhá v největší míře v proximálním tubulu ledvin, je kontrolována parathormonem, hladinami vápníku a fosfátů a výsledkem je udržení kostní homeostázy.(3) Aktivace kalcidiolu na kalcitriol však probíhá i v dalších tkáních (buňky imunitního systému, epiteliální buňky, placenta atd.) s následnými „neskeletálními“ účinky vitaminu D, kam patří ovlivnění sekrece hormonů, buněčné proliferace a diferenciace a v neposlední řadě regulace imunitních reakcí.(4) Mimo ledviny není aktivace vitaminu D řízena parathormonem, ale lokálními mediátory, jako jsou TNF-α, IL-6 a IFN-γ, a je potlačována zralými dendritickými buňkami.(5)
Imunitní systém zajišťuje obranu proti cizorodým mikroorganismům při zachování tolerance k vlastním tkáním a orgánům, udržuje homeostázu celého organismu a má významnou schopnost adaptace. Vrozená imunita má za úkol především identifikovat nebezpečnou situaci a iniciovat obrannou zánětlivou reakci. Nemá paměť na konkrétní antigen, ale její reakce jsou rychlé a po „rozpoznávací“ fázi má i efektorové mechanismy schopné problém vyřešit. Zahrnuje dendritické buňky, fagocyty, NK buňky, komplementový systém a úzce s ní souvisí i obranné bariéry našeho těla. Mechanismy vrozené imunity jsou také nepostradatelné pro specifickou imunitu, která je reprezentována T a B lymfocyty a produkovanými protilátkami. Naprosto zásadní populací imunitních buněk jsou T lymfocyty, které úzce spolupracují s prvky vrozené imunity a zpětně ji regulují, podílí se na diferenciaci B lymfocytů a tvorbě protilátek, mohou mít cytotoxickou funkci, podporují fagocytózu a produkcí cytokinů ovlivňují všechny fáze imunitní reakce. Specifická imunita má také imunologickou paměť.
Receptor pro vitamin D (VDR) patří do rodiny steroidních nukleárních receptorů a reguluje expresi až 500 genů.(6) Význam vitaminu D pro regulaci vrozené i adaptivní imunity je dán již tím, že VDR je přítomen na všech buňkách imunitního systému (obr. 1).(7) Exprese VDR je závislá na úrovni aktivace imunitních buněk. U T lymfocytů se po aktivaci exprese VDR mnohonásobně zvyšuje, naopak monocyty v průběhu diferenciace na makrofágy či dendritické buňky VDR ztrácejí.(5,8)
Image 1. 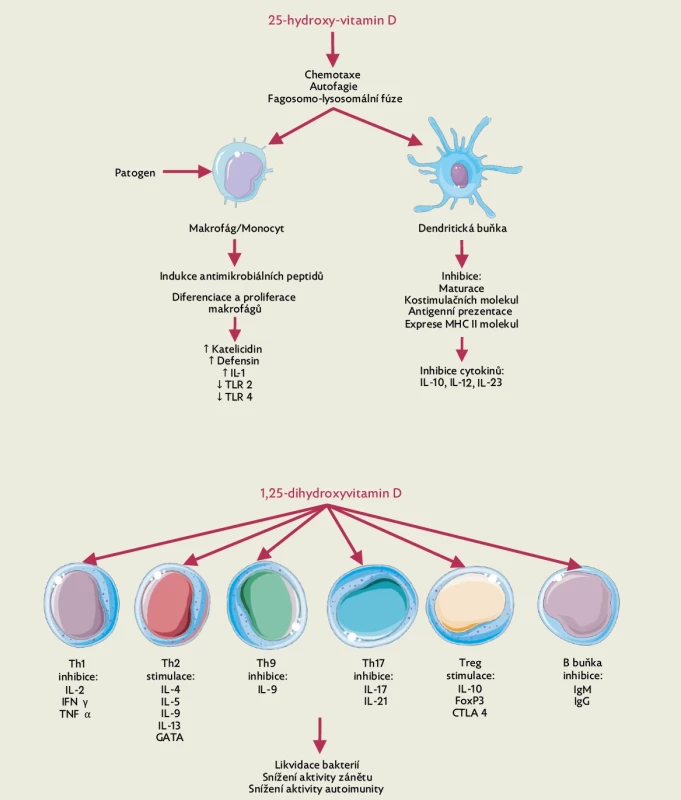
Imunomodulační efekt vitaminu D na vrozenou a adaptivní imunitu, upraveno dle(16). Kalcitriol, vznikající účinkem 1-𝛂-hydroxylázy produkované buňkami imunitního systému, uplatňuje svůj účinek vazbou na VDR. Antimikrobiální účinek souvisí především se syntézou katelicidinu, antiinflamatorní účinek začíná již ovlivněním diferenciace APC a sníženou expresí MHC molekul II. třídy. V oblasti adaptivní imunity dochází vlivem kalcitriolu k tolerogennější imunitní odpovědi přes indukci Th2 a regulačních T lymfocytů a downregulaci Th1, Th17 a Th9 lymfocytů. Význam vitaminu D pro vrozenou imunitu
Při rozpoznávání bakteriálních patogenů hrají významnou roli toll-like receptory (TLR), patřící do skupiny PRRs (pattern recognition receptors). Jedná se o transmembránové receptory, které se váží na specifické membránové molekuly na patogenech (pathogen-associated molecular patterns – PAMPs) a řídí syntézu různých cytokinů a antibakteriálních peptidů.(9) Toll-like receptory indukují expresi VDR u monocytů a makrofágů i aktivaci 1-α-hydroxylázy, čímž dochází ke konverzi na aktivní vitamin D – kalcitriol. Kalcitriol vazbou na VDR antigen prezentujících buněk (APC) aktivuje signální dráhu s následnou produkcí katelicidinu s přímým antimikrobiálním efektem na bakterie, kvasinky i viry.(10,11) Například u RSV infekce blokuje antimikrobiální peptid LL37 (aktivní forma katelicidinu) vstup viru do buňky, čímž brání nejen buněčné smrti, ale i dalšímu šíření infekce.(12) Katelicidin je zásadní i v rámci imunitních reakcí na granulomatózní zánětlivé procesy(13) a vitamin D byl historicky používán k léčbě infekcí způsobených Mycobacterium tuberculosis. Kromě antiinfekční imunity má vitamin D vliv i na rozvoj autoimunitních onemocnění (např. sníženou expresí TLR-9 na monocytech, což ovlivňuje produkci IL-6).(14)
Kalcitriol ovlivňuje diferenciaci a funkci APC (např. dendritických buněk), které se díky snížené expresi molekul hlavního histokompatibilního komplexu II (MHC II) na svém povrchu stávají více tolerogenními.(15)Význam vitaminu D pro adaptivní imunitu
Kalcitriol ovlivňuje T lymfocyty nepřímo a přímo. Nepřímý vliv spočívá v modulaci stimulační funkce APC (downregulace povrchových molekul MHC II a kostimulačních molekul) a z toho plynoucí snížená antigenní prezentace. Dochází k potlačení proliferace autoreaktivních T lymfocytů a nárůstu populace regulačních T lymfocytů (Treg).(17) Cytokiny produkované dendritickými buňkami za přítomnosti kalci-
triolu mohou ovlivnit diferenciaci Th pomocných lymfocytů. Zvýšení Th2 imunitní odpovědi vede ke snížení diferenciace Th1 a Th17 lymfocytů,(18) což může snížit riziko rozvoje autoimunitních onemocnění.(19) Přímý vliv kalcitriolu na T lymfocyty je podmíněn jeho aktivací, při které dochází k mnohonásobně vyšší expresi VDR.(20) Kalcitriol snižuje produkci Th1 cytokinů (např. IL-2, IFN-γ) a Th17 cytokinů (např. IL-17, IL-21).(21) Také u B lymfocytů dochází k vyšší expresi VDR při jejich aktivaci a stejně jako ostatní lymfocyty mají schopnost aktivace 1-α-hydroxylázy, potřebné k syntéze aktivní formy vitaminu D. Předpokládá se, že vliv kalcitriolu na produkci protilátek má svůj význam především u těch autoimunitních onemocnění, jejichž podstatou je proliferace B lymfocytů (např. systémový lupus erythematodes).(22) Kalcitriol indukuje apoptózu aktivovaných B lymfocytů, brání v diferenciaci na plazmatické buňky i paměťové B lymfocyty (u kterých inhibuje přesmyk jednotlivých tříd imunoglobulinů).(23) Kalcitriol dále stimuluje tvorbu IL-10 B lymfocyty, a podílí se tak na imunoregulaci.(24)Hypovitaminóza D
Dle americké Endocrine Society i středoevropského expertního panelu je cílová hladina 25OH-vitaminu D minimálně 75 nmol/l (75–125 nmol/l ve středoevropském doporučení).(25,26) Deficit vitaminu D nastává při hodnotách pod 50 nmol/l a potenciálně toxická je hladina nad 250 nmol/l.(26) Vitamin D má významné imunoregulační účinky a jeho deficit bývá spojován se zvýšeným rizikem řady onemocnění. Jedná se především o orgánově specifické autoimunity (např. Hashimotova tyreoiditida, diabetes mellitus I. typu, Addisonova choroba aj.), systémová autoimunitní onemocnění (např. revmatoidní artritida, systémový lupus erythematodes, roztroušená skleróza aj.) i nádorová onemocnění.(16) Doporučené dávkování vitaminu D v dětském věku shrnuje Doporučený postup České pediatrické společnosti a Odborné společnosti praktických dětských lékařů ČLS JEP pro suplementaci dětí a dospívajících vitaminem D.(27)
Vitamin D má kromě udržení kostní homeostázy i důležitý imunomodulační efekt. Vzhledem k opakovaně prokázaným nízkým hodnotám vitaminu D u pacientů s imunitně podmíněnými chorobami je v posledních letech kladen důraz na udržování optimálních hladin vitaminu D. V závislosti na zeměpisné šířce, věku a ev. komorbiditách je nutné zvažovat suplementaci tímto vitaminem.
Sources
1. Holick MF. Vitamin D deficiency. N Engl J Med 2007; 357(3): 266–281.
2. Czaja AJ, Montano-Loza AJ. Evolving role of vitamin D in immune-mediated disease and its implications in autoimmune hepatitis. Dig Dis Sci 2019; 64(2): 324–344.
3. Rosen Y, Daich J, Soliman I, et al. Vitamin D and autoimmunity. Scand J Rheumatol 2016; 45(6): 439–447.
4. Bikle D. Nonclassic actions of vitamin D. J Clin Endocrinol Metab 2009; 94(1): 26–34.
5. Hewison M, et al. Differential regulation of vitamin D receptor and its ligand in human monocyte-derived dendritic cells. J Immunol 2003; 170(11): 5382–5390.
6. Norman AW. From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health. Am J Clin Nutr 2008; 88(2).
7. Veldman CM, Cantorna MT, DeLuca HF. Expression of 1,25-dihydroxyvitamin D(3) receptor in the immune system. Arch Biochem Biophys 2000; 374(2): 334–338.
8. Baeke F, et al. Human T lymphocytes are direct targets of 1,25-dihydroxyvitamin D3 in the immune systém. J Steroid Biochem Mol Biol 2010; 121(1–2): 221–227.
9. Trinchieri G, Sher A. Cooperation of Toll-like receptor signals in innate immune defence. Nat Rev Immunol 2007; 7(3): 179–190.
10. Liu PT, Stenger S, Tang DH, Modlin RL. Cutting edge: vitamin D-mediated human antimicrobial activity against Mycobacterium tuberculosis is dependent on the induction of cathelicidin. J Immunol 2007; 179(4): 2060–2063.
11. Barlow PG, et al. Antiviral activity and increased host defense against influenza infection elicited by the human cathelicidin LL-37, PLoS One 2011; 6(10).
12. Currie SM, et al. The human cathelicidin LL-37 has antiviral activity against respiratory syncytial virus. PLoS One 2013; 8(8).
13. Sharma OP. Hypercalcemia in granulomatous disorders: a clinical review. Curr Opin Pulm Med 2000; 6(5): 442–447.
14. Dickie LJ, Church LD, Coulthard LR. Vitamin D3 down-regulates intracellular Toll-like receptor 9 expression and Toll-like receptor 9-induced IL-6 production in human monocytes, Rheumatology (Oxford) 2010; 49(8): 1466–1471.
15. Széles L, et al. 1,25-dihydroxyvitamin D3 is an autonomous regulator of the transcriptional changes leading to a tolerogenic dendritic cell phenotype. J Immunol 2009; 182(4): 2074–2083.
16. Sîrbe C, Rednic S, Grama A, Pop TL. An update on the effects of vitamin D on the immune system and autoimmune diseases. Int J Mol Sci 2022; 23(17).
17. Van Halteren AGS, Tysma OM, Van Etten E, et al. 1alpha,25-dihydroxyvitamin D3 or analogue treated dendritic cells modulate human autoreactive T cells via the selective induction of apoptosis, J Autoimmun 2004; 23(3): 233–239.
18. Baeke F, Takiishi T, Korf H, et al. Vitamin D: modulator of the immune system. Curr Opin Pharmacol 2010; 10(4): 482–496.
19. Hewison M. An update on vitamin D and human immunity. Clin Endocrinol (Oxf) 2012; 76(3): 315–325.
20. Mahon BD, Wittke A, Weaver V, Cantorna MT. The targets of vitamin D depend on the differentiation and activation status of CD4 positive T cells. J Cell Biochem 2003; 89(5): 922–932.
21. Jeffery LE, et al. 1,25-dihydroxyvitamin D3 and IL-2 combine to inhibit T cell production of inflammatory cytokines and promote development of regulatory T cells expressing CTLA-4 and FoxP3. J Immunol 2009; 183(9): 5458–5467.
22. Skrobot A, Demkow U, Wachowska M. Immunomodulatory role of vitamin D: a review. Adv Exp Med Biol 2018; 1108 : 13–23.
23. Chen S, Sims GP, Chen XX, et al. Modulatory effects of 1,25-dihydroxyvitamin D3 on human B cell differentiation. J Immunol 2007; 179(3): 1634–1647.
24. Heine G, et al. 1,25-dihydroxyvitamin D(3) promotes IL-10 production in human B cells. Eur J Immunol 2008; 38(8): 2210–2218.
25. Pludowski P, et al. Clinical practice in the prevention, diagnosis and treatment of vitamin D deficiency: a Central and Eastern European expert consensus statement. Nutrients 2022; 14(7).
26. Holick MF, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011; 96(7): 1911–1930.
27. Bronský J, et al. Doporučený postup České pediatrické společnosti a Odborné společnosti praktických dětských lékařů ČLS JEP pro suplementaci dětí a dospívajících vitaminem D. Ces-slov Pediat 2019; 74(8): 473–482.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2024 Issue 2-
All articles in this issue
- Vitamin D in enteral and parenteral nutrition
- Vitamin D and immunity
- The role of vitamin D in children with chronic kidney disease
- Vitamin D in children with inflammatory bowel disease
- Vitamin/hormone D in pediatric rheumatology – minireview and summary for clinical practice
- Pathophysiology in paediatrics: What laboratory parameters are suitable for nutrition status assessment?
- Impact of celiac disease on adolescent’s quality of life
- Bartter syndrome in children: a series of eight cases from the Czech Republic and Slovakia
- Cardiovascular and metabolic complications of childhood obesity
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pathophysiology in paediatrics: What laboratory parameters are suitable for nutrition status assessment?
- Vitamin D and immunity
- Cardiovascular and metabolic complications of childhood obesity
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

