-
Medical journals
- Career
Syndromy mnohočetné endokrinní neoplazie v dětském věku
Authors: Pomahačová Renata; Paterová Petra; Nykodýmová Eva; Polák Petr; Sýkora Josef
Authors‘ workplace: Dětská klinika, Lékařská fakulta a Fakultní nemocnice v Plzni, Univerzita Karlova v Praze
Published in: Čes-slov Pediat 2023; 78 (S3): 17-21.
Category: Comprehensive Report
doi: https://doi.org/10.55095/CSPediatrie2023/057Overview
Syndromy mnohočetné endokrinní neoplazie (MEN syndromy) jsou vzácná autozomálně dominantně dědičná onemocnění s přítomností nádorů dvou a více endokrinních žláz s možnou manifestací v časném dětském věku. Pozdní diagnóza MEN syndromu může být pro jedince fatální. Časná identifikace rizikových jedinců je proto klíčová pro prevenci a léčbu potenciálně život ohrožujících endokrinních a neendokrinních neoplazií. Z MEN syndromů má nejzávažnější prognózu MEN 2B syndrom, a to vzhledem k vysoce agresivnímu medulárnímu karcinomu štítné žlázy s časným postnatálním vývojem a vysokému zastoupení de novo mutací. Znalost neendokrinních projevů u tohoto syndromu proto může vést k časné diagnóze před rozvojem pokročilého maligního onemocnění. Popisujeme nejnovější poznatky o MEN syndromech se zaměřením na klinické symptomy, genetické pozadí, korelaci genotyp–fenotyp u MEN 2 syndromů, guidelines Americké tyreoidologické asociace pro screening vývoje nádorů a jejich léčbu u dětí.
Klíčová slova:
mnohočetná endokrinní neoplazie, medulární karcinom štítné žlázy, primární hyperparatyreóza, inzulinom, gastrinom, neendokrinní projevy MEN 2B
ÚVOD
Syndromy mnohočetné endokrinní neoplazie (MEN syndromy) jsou vzácná autozomálně dominantně dědičná onemocnění s přítomností nádorů dvou a více endokrinních žláz. Onemocnění mají vysoký stupeň penetrance genetické vlohy, ale variabilní expresivitu. Mohou se manifestovat v jakémkoli věku symptomy, které souvisí s postižením endokrinních a neendokrinních orgánů.
MEN syndromy se dělí na MEN typu 1, MEN typu 2 (podtypy 2A a 2B) a MEN typu 4. MEN 1 syndrom je způsoben mutací tumor supresorového genu MEN 1 s vývojem nádorů příštítných tělísek, pankreatu a hypofýzy. MEN 2 syndromy jsou způsobeny mutací RET proto-onkogenu s vývojem medulárního karcinomu štítné žlázy (MTC) a feochromocytomu u obou podtypů MEN 2. Součástí MEN 2A jsou současně nádory příštítných tělísek a pro MEN 2B jsou typické neendokrinní projevy onemocnění. Podle guidelines Americké tyreoidologické asociace (ATA) z roku 2015 je za variantu MEN 2A nyní považován familiární MTC s klesající penetrancí primární hyperparatyreózy a feochromocytomu. MEN 4 syndrom má klinický obraz podobný MEN 1, ale odlišné genetické pozadí.(1,2)
Předkládáme vlastní zkušenosti a nejnovější poznatky o MEN syndromech se zaměřením na klinické symptomy, genetické pozadí, korelaci genotyp–fenotyp, guidelines pro screening vývoje jednotlivých nádorů a jejich léčbu u dětí. Časná identifikace rizikových jedinců je klíčová pro prevenci a léčbu potenciálně život ohrožujících endokrinních a neendokrinních neoplazií.
SYNDROM MEN 1 (Wermerův syndrom)
MEN 1 syndrom je způsoben mutací tumor supresorového genu MEN 1, lokalizovaného na 11. chromozomu (11q13), kódujícího protein menin. Celosvětová prevalence syndromu se pohybuje v rozmezí 3–20 : 100 000 obyvatel s převahou familiárních forem onemocnění v 92 % nad sporadickými formami. Součástí MEN 1 je v 95 % primární hyperparatyreóza (PHPT) při adenomu nebo hyperplazii příštítných tělísek, nádory Langerhansových ostrůvků v 70–80 % a nádory adenohypofýzy ve 30–50 %. Z dalších nádorů se mohou u MEN 1 vyskytovat nádory nadledvin, štítné žlázy, karcinoidy nebo lipomy.(1)
PHPT se vyvíjí většinou ve 3. dekádě života (věk 20–25 let). Postižení u obou pohlaví se neliší. PHPT je nejčastější manifestací MEN 1 u dětí, v 75 % s vývojem po 10. roce života. PHPT bývá často, přes přítomnou hyperkalcemii, asymptomatická. Symptomatická hyperkalcemie se může projevit žaludeční nevolností, polyurií, polydipsií nebo renálními kolikami při nefrolitiáze.(1)
Z nádorů Langerhansových ostrůvků, s vývojem většinou po 40. roce života, převažuje gastrinom ve 40 %, inzulinom v 10 %, méně častý je vipom nebo glukagonom. Gastrinomy se 3× častěji vyskytují v duodenu než v pankreatu, secernují gastrin s rozvojem Zollingerova–Ellisonova syndromu se známkami žaludeční hypersekrece s peptickými komplikacemi a průjmy. U gastrinomu pankreatu je 50% riziko vzniku jaterních metastáz. U dětí s MEN 1 jsou gastrinomy vzácné, ale pokud se vyskytnou, jsou vysoce agresivní. Naopak inzulinom, s typickými hypoglykemickými symptomy v době lačnění, je nejčastější první manifestací MEN 1 před 20. rokem života. Nejnižší popsaný věk klinické manifestace inzulinomu v rámci MEN 1 je 5 let.(1)
Příčinou až 50% mortality pacientů se syndromem MEN 1 jsou endokrinní nádory pankreatu (gastrinom, inzulinom). Klíčové je proto časné zahájení pravidelného screeningu vývoje jednotlivých MEN 1 nádorů u pacientů s mutací MEN 1 genu (tab. 1). Laboratorní screening je doporučováno provádět 1× ročně a MR hypofýzy k posouzení vývoje adenomu hypofýzy po 3 letech.(1,2)
Table 1. Doporučený věk zahájení screeningu nádorů u pacientů s MEN 1 syndromem 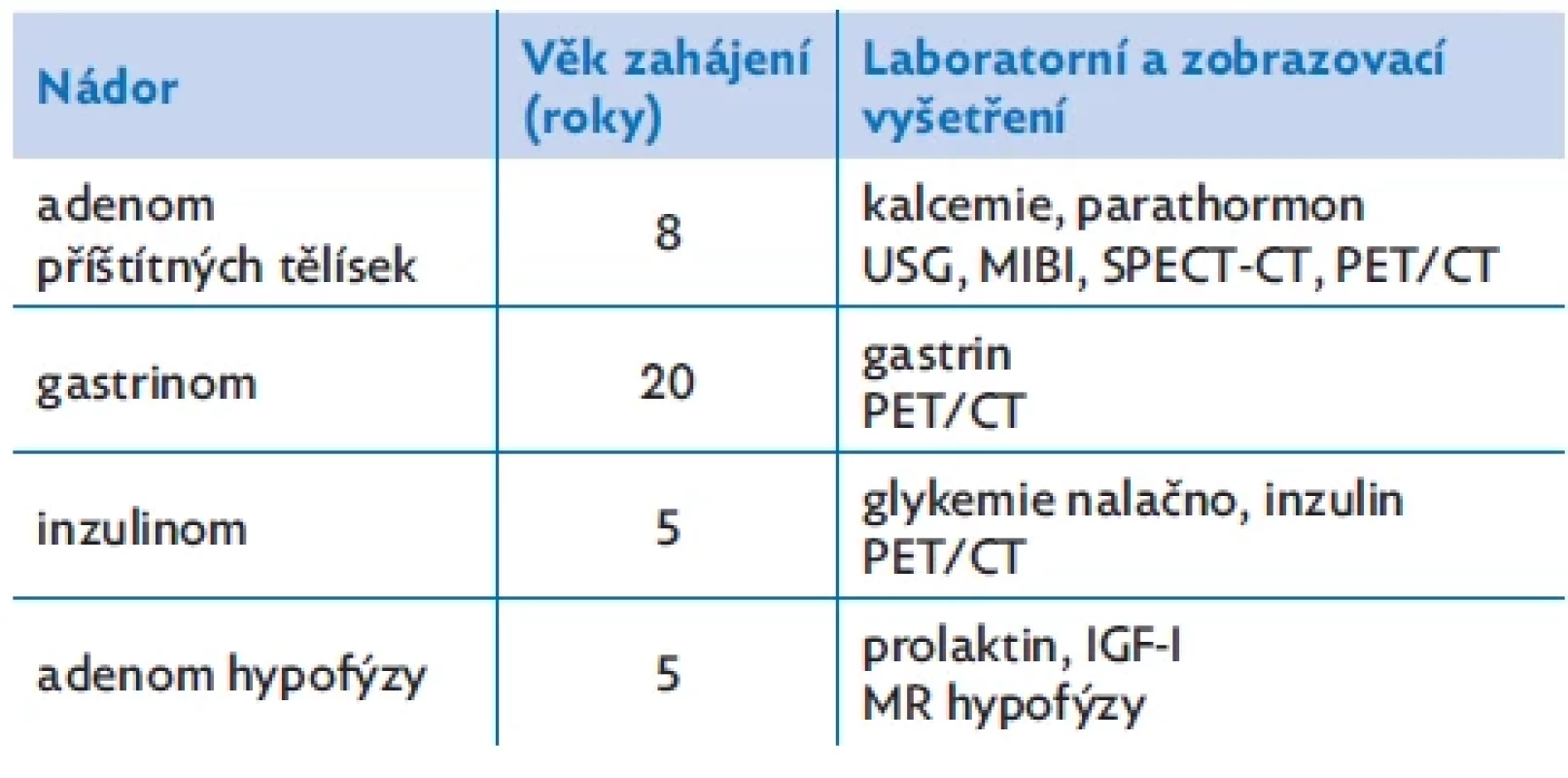
SYNDROMY MEN 2
MEN 2 syndromy jsou způsobeny mutací RET proto-onkogenu, lokalizovaného na 10. chromozomu (10q11.2). RET proto-onkogen se exprimuje v tkáních odvozených z neurální lišty a kóduje transmembránový tyrosinkinázový receptor, který se uplatňuje v růstu a diferenciaci buněk. Společným rysem MEN 2A a MEN 2B je MTC a feochromocytom. Součástí MEN 2A je současně PHPT a pro MEN 2B jsou typické neendokrinní projevy onemocnění. Symptomy tedy vyplývají z postižení buněk a tkání vycházejících z neurální lišty. Vedle parafolikulárních buněk štítné žlázy s vývojem MTC a buněk dřeně nadledvin s vývojem feochromocytomu to jsou buňky enteritického systému s vývojem střevní ganglioneuromatózy, ale také vazivo, chrupavky, kosti obličeje a lebky, dermis obličeje, krku nebo odontoblasty odpovědné za typický fenotyp pacientů s MEN 2B. Na rozdíl od MEN 1 je u MEN 2 syndromů těsná korelace mezi genotypem a fenotypem.(1)
SYNDROM MEN 2A (Sippleův syndrom)
Prevalence syndromu MEN 2A se pohybuje v rozmezí 1 : 36 000 až 1 : 200 000 živě narozených dětí. Součástí MEN 2A je MTC ve 100 %, feochromocytom v 50 % a PHPT při adenomu nebo hyperplazii příštítných tělísek v 25 %. Ve srovnání s MEN 1 není PHPT konstantní a vyskytuje se v pozdní fázi onemocnění. Součástí MEN 2A může být Hirschsprungova choroba nebo lichen amyloidosus, vzácné kožní onemocnění, které může předcházet klinické manifestaci MTC.(1)
Nádorovým markerem MTC, který může metastázovat do lymfatických uzlin, jater, plic, kostí a vzácně do mozku, je hormon kalcitonin. MTC je prvním příznakem MEN 2A s vývojem většinou ve 3. dekádě života. V dětském věku může k jeho vývoji dojít již před 6. rokem života s nejnižším popsaným věkem manifestace 2 roky.(1)
Feochromocytom u MEN 2A je lokalizován v nadledvinách bilaterálně a vzácně metastázuje. Mezi typické klinické symptomy patří záchvatovité bolesti hlavy, pocení, palpitace, prchavé vyrážky kůže a hypertenze. K vývoji feochromocytomu dochází většinou ve 2.–3. dekádě života. V dětském věku byl jeho vývoj popsán již ve věku 8 let.(1)
Průměrný udávaný věk manifestace PHPT je 34 let s věkovým rozmezím 12–34 let, s nejnižším popsaným věkem manifestace 2 roky.(1)
Tabulka 2 uvádí doporučený věk zahájení pravidelného laboratorního screeningu vývoje jednotlivých MEN 2A nádorů u presymptomatických jedinců s potvrzenou mutací RET proto-onkogenu 1× ročně. Vzhledem ke známé korelaci genotyp–fenotyp u MEN 2A syndromu se liší doporučený věk zahájení screeningu podle typu mutace.(1,2) 85 % pacientů s MEN 2A jsou nositeli mutace s vysokým rizikem (ATA-H category) časného vývoje MTC (kodon 634, exon 11 RET proto-onkogenu). U těchto jedinců ATA doporučuje provedení totální tyreoidektomie (TTE) do 5 let věku a zahájení screeningu od 3 let věku (hladina kalcitoninu, USG štítné žlázy). U mutací s mírným rizikem (ATA-MOD category; např. kodon 768, 790, 791, exon 13, 14 a 15 RET proto-onkogenu) je MTC méně agresivní s vývojem v pozdějším věku, proto ATA doporučuje provedení TTE později v dětství podle vývoje hladiny kalcitoninu a zahájení screeningu od 5 let věku. Prognóza MEN 2A tedy souvisí s genotypem, který určuje agresivitu MTC.(1,2)
Table 2. Doporučený věk zahájení screeningu nádorů u pacientů s MEN 2A syndromem v závislosti na rizikové mutaci RET proto-onkogenu 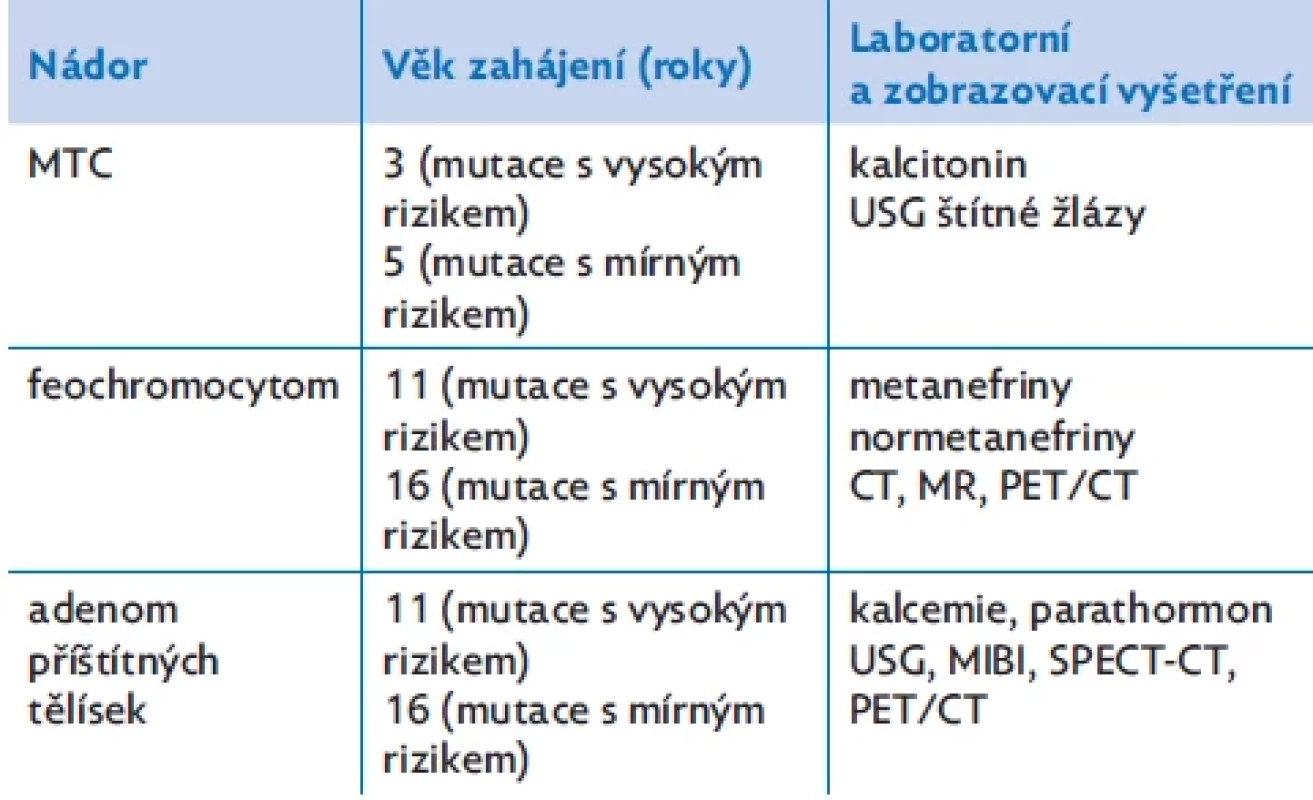
SYNDROM MEN 2B
Prevalence syndromu MEN 2B se pohybuje v rozmezí 1 : 600 000 až 1 : 4 000 000 obyvatel.(1) MEN 2B je charakterizován, na rozdíl od MEN 2A, časným vývojem vysoce agresivního MTC ve 100 %, feochromocytomu v 50 % a typickými neendokrinními projevy zahrnujícími marfanoidní habitus a další skeletální abnormality (skolióza, lordóza, kyfóza, pes cavus, pectus excavatum, gotické patro, epifyzeolýza hlavice femuru, kloubní hypermobilita, svalová hypotonie), slizniční neurinomy postihující jazyk, rty, bukální sliznici a spojivku, oční symptomy s ptózou a evertovanými horními víčky, malpozici zubů s centrální diastemou, dále alacrimii a střevní ganglioneuromatózu vedoucí ke gastrointestinálním potížím, typicky k zácpě a/nebo průjmu. Vzácně byl u dětí popsán malý vzrůst s růstem pod 3. percentilem. Marfanoidní habitus a slizniční neurinomy s typickými silnými malinovitými rty se v průběhu dětství postupně vyvíjejí (obr. 1 a 2), naopak alacrimie a střevní ganglioneuromatóza, vedoucí k zácpě a/nebo průjmu, patří mezi časné příznaky MEN 2B od novorozeneckého a kojeneckého věku.(1,3–7)
Více než 95 % pacientů jsou nositeli mutace s nejvyšším rizikem M918T v exonu 16 RET proto-onkogenu (ATA-HST category) s časným postnatálním vývojem agresivního MTC. 2–3 % pacientů jsou nositeli mutace A883F s vysokým rizikem časného vývoje MTC (ATA-H category).(1,2)
Prognóza pacientů s MEN 2B závisí na časném záchytu MTC, kdy je nádor chirurgicky ještě plně kurabilní. ATA doporučuje u pacientů se známou prevalentní mutací M918T RET proto-onkogenu profylaktickou TTE již v prvních 6 měsících života. 90 % pacientů s MEN 2B je však nositelem de novo mutace RET proto-onkogenu, s pozdní diagnózou v průměru ve 14 letech věku, kdy je MTC již metastatický a není chirurgicky plně kurabilní. U mutace s vysokým rizikem se doporučuje, stejně jako u MEN 2A, provedení TTE do 5 let věku. Screening vývoje feochromocytomu by měl být zahájen ve věku 11 let.(1,2)
SYNDROM MEN 4
Syndrom MEN 4 je způsoben mutací genu pro inhibitory cyklin-dependentních kináz (CDKI). Klinický obraz je podobný MEN 1 syndromu s rozvojem symptomů především ve 3. dekádě života.(1)
DISKUSE
MEN syndromy jsou sice vzácná autozomálně dominantně dědičná onemocnění, ale důsledkem jejich pozdní diagnózy je vysoká morbidita a v některých případech také mortalita jedince. Podle literárních údajů může k vývoji MEN nádorů dojít již v časném dětském věku, u MEN 2B syndromu dokonce časně postnatálně.(1,3–7)
Příčinou morbidity a mortality pacientů se syndromem MEN 1 je jednak gastrinom s možnými závažnými peptickými komplikacemi a s rizikem jaterních metastáz, jednak inzulinom s rizikem život ohrožujících hypoglykemií a neurologického postižení při opakovaných hypoglykemiích. Prevencí těchto závažných komplikací je časné zahájení pravidelného screeningu vývoje jednotlivých nádorů u pacientů se známou mutací MEN 1 genu (tab. 1).(1,2) Pacienti s inzulinomem, PHP nebo gastrinomem by měli podstoupit genetické vyšetření na přítomnost mutace MEN 1 genu k vyloučení syndromu MEN 1 a pacienti s PHP současně na přítomnost mutace RET proto-onkogenu k vyloučení syndromu MEN 2A.
U MEN 2 syndromů je oproti MEN 1 známá korelace mezi genotypem a fenotypem. Prognosticky nejzávažnějším nádorem u MEN 2A a především u MEN 2B je MTC. Doporučený věk zahájení screeningu vývoje MTC, feochromocytomu, PHP a věk provedení TTE u MEN 2A syndromu souvisí s typem mutace RET proto-onkogenu (tab. 2).(1,2) Feochromocytom může být prvním projevem syndromu MEN 2A, proto by tito pacienti a pacienti s Hirschsprungovou chorobou měli podstoupit genetické vyšetření RET proto-onkogenu.(1)
U všech pacientů s diagnózou MTC by mělo být provedeno genetické vyšetření RET proto-onkogenu a při potvrzení mutace vyšetřeny osoby v riziku onemocnění.(1,2)
Z MEN syndromů má nejzávažnější prognózu MEN 2B, vzhledem k vysoce agresivnímu MTC a vysokému zastoupení de novo mutací RET proto-onkogenu. Převažující mutace M918T u těchto jedinců je odpovědná za časný postnatální vývoj MTC a v případě pozdní diagnózy je hlavní příčinou úmrtí.(1) Mezinárodní retrospektivní studie publikovaná v roce 2019 potvrdila signifikantní rozdíly v remisi onemocnění, pokud byla TTE provedena před 1. rokem (83 %), nebo po 1. roce života (15 %).(8) U pacientů se známou mutací RET proto-onkogenu se proto v současné době doporučuje provedení profylaktické TTE již v prvních měsících života.(2) Většina pacientů je však nositelem de novo mutace s obvykle pozdní diagnózou MEN 2B v dětství nebo adolescenci, kdy je nádor již metastatický a není plně chirurgicky kurabilní. Pro prognózu onemocnění je proto zásadní časná diagnóza s možností radikální chirurgické léčby. Právě znalost typických neendokrinních projevů onemocnění může vést k časnému odhalení těchto dětí.
Fotodokumentace našich pacientů s pozdní diagnózou MEN 2B potvrzuje, ve shodě s literárními údaji, postupný vývoj typického marfanoidního habitu a slizničních neurinomů se silnými malinovitými rty v průběhu dětství (obr. 1 a 2). Alacrimie a obstipace v důsledku střevní ganglioneuromatózy byly naopak časnými příznaky MEN 2B od novorozeneckého a kojeneckého věku. Diagnóza MEN 2B u obou pacientů byla pozdní, ve 2. dekádě života, kdy MTC u jednoho z pacientů byl již metastatický a nebyl plně chirurgicky kurabilní.
Upozorňujeme na možnost růstové retardace, deficitu růstového hormonu a ovariálního teratomu u pacientů s MEN 2B.(7)
Při klinickém podezření na MEN 2B by měla být stanovena hladina sérového kalcitoninu a při jeho zvýšené hladině genetické vyšetření na přítomnost mutace RET proto-onkogenu.
Image 1. 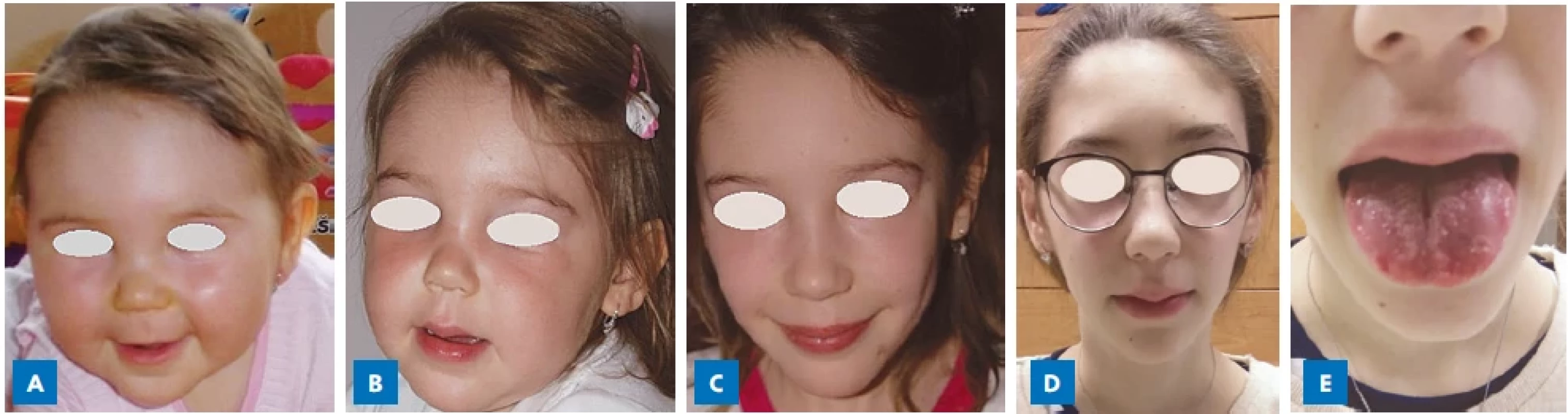
Pacientka s MEN 2B syndromem s postupným vývojem typického marfanoidního habitu v průběhu dětství s protáhlým, úzkým obličejem a malinovitými rty v 10 letech věku (C, D). Alacrimie, jako časný symptom MEN 2B, byla přítomna od novorozeneckého věku a obstipace při střevní ganglioneuromatóze od kojeneckého věku. V době stanovení diagnózy ve 13 letech věku byl MTC již metastatický a nebyl plně chirurgicky kurabilní. A – kojenecký věk; B – 5 let; C – 10 let; D – 13 let (diagnóza MEN 2B); E – slizniční neurinomy na jazyku a na rtech.
(Foto: archiv autorů)Image 2. 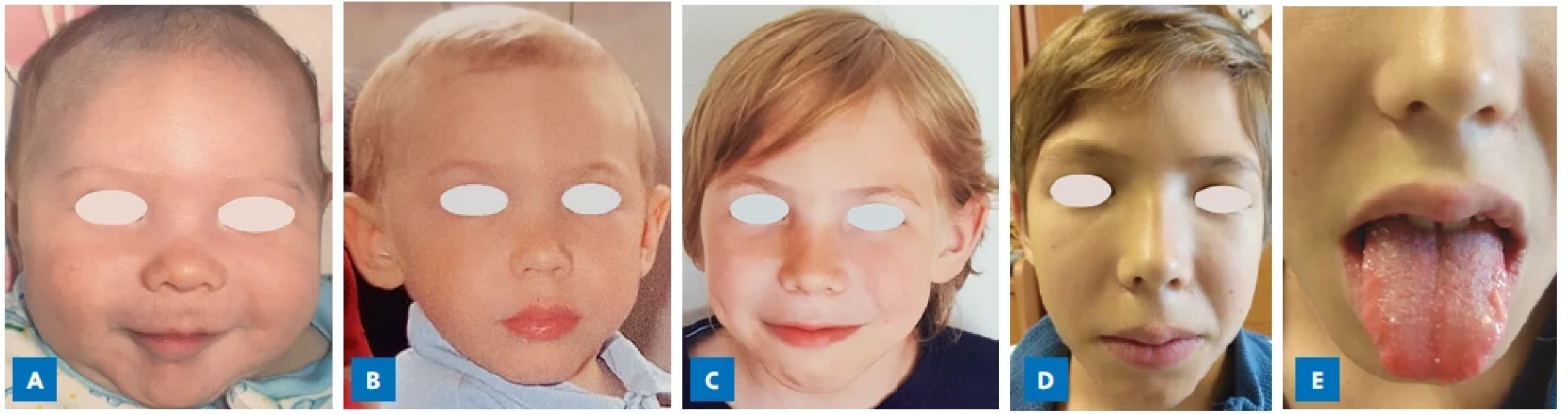
Pacient s MEN 2B syndromem s postupným vývojem typického marfanoidního habitu v průběhu dětství s protáhlým, úzkým obličejem a malinovitými rty v 11 letech věku (D). Alacrimie, jako časný symptom MEN 2B, byla přítomna od novorozeneckého věku. V době stanovení diagnózy v 11 letech věku nebyl MTC metastatický a byl plně chirurgicky kurabilní. A – kojenecký věk; B – 2 roky; C – 8 let; D – 11 let (diagnóza MEN 2B); E – slizniční neurinomy na jazyku a na rtech. (Foto: archiv autorů) ZÁVĚR
Časná genetická diagnostika MEN syndromu a vyhledávání rizikových jedinců v takto postižených rodinách jsou klíčové pro screening vývoje a léčbu potenciálně život ohrožujících jednotlivých neoplazií. Z MEN syndromů má nejzávažnější prognózu MEN 2B vzhledem k vysoce agresivnímu MTC a vysokému zastoupení de novo mutací RET proto-onkogenu. Znalost neendokrinních projevů MEN 2B proto může vést k časné diagnóze před rozvojem pokročilého maligního onemocnění. V tomto směru je proto nutno zvyšovat povědomí nejen pediatrů, ale také dětských chirurgů, ortopedů, oftalmologů a stomatologů.
Korespondenční adresa:
doc. MUDr. Renata Pomahačová, Ph.D.
Dětská klinika FN a LF UK Plzeň
Alej Svobody 80
323 00 Plzeň
pomahacova@fnplzen.cz
Sources
1. Jacob M, Rowland D, Lekarev O, et al. Multiple endocrine neoplasia in childhood: an update on diagnosis, screening, management and treatment. Endocrines 2022; 3(1): 76–91.
2. Wells SA, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 2015; 25(6): 567–610.
3. Brauckhoff M, Machens A, Hess S, et al. Premonitory symptoms preceding metastatic medullary thyroid cancer in MEN 2B: an exploratory analysis. Surgery 2008; 144 : 1044–50.
4. Castinetti F, Moley J, Mulligan L, et al. A comprehensive review on MEN2B. Endocr Relat Cancer 2018; 25: T29–39.
5. Redlich A, Lessel L, Petrou A, et al. Multiple endocrine neoplasia type 2B: Frequency of physical stigmata-Results of the GPOH-MET registry. Pediatr Blood Cancer 2020; 67: e28056.
6. Cohen MS, Phay JE, Albinson C, et al. Gastrointestinal manifestations of multiple endocrine neoplasia type 2. Ann Surg 2002; 235(5): 648–
654.
7. Pomahacova R, Paterova P, Nykodymova E, et al. Cystic ovarian teratoma as a novel tumor and growth hormone deficiency as a new condition presenting in multiple endocrine neoplasia type 2B: Case reports and review of the literature. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2022; 166(1): 105–111.
8. Castinetti F, Waguespack SG, Machens A, et al. Natural history, treatment, and long-term follow up of patients with multiple endocrine neoplasia type 2B: an international, multicentre, retrospective study. Lancet Diabetes Endocrinol 2019; 7(3): 213–220.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2023 Issue S3-
All articles in this issue
- Alois Wachsman: Žena v křesle
- Editorial
- Současný pohled na diagnostiku deficitu růstového hormonu u dětí a dospívajících
- Mentální anorexie z pohledu endokrinologa
- Syndromy mnohočetné endokrinní neoplazie v dětském věku
- Dospělá výška dětí, které se narodily malé na svůj gestační věk (SGA), s malou výškou v dětství (SGA-SS). Výsledky léčby růstovým hormonem z dat české národní databáze REPAR
- Pubertální růst dětí, které se narodily malé na svůj gestační věk (SGA), s malou výškou v dětství (SGA-SS). Výsledky léčby růstovým hormonem z dat české národní databáze REPAR
- Příběh sv. Starosty: Legenda, historie a endokrinní kontext jednoho zázraku
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mentální anorexie z pohledu endokrinologa
- Syndromy mnohočetné endokrinní neoplazie v dětském věku
- Současný pohled na diagnostiku deficitu růstového hormonu u dětí a dospívajících
- Pubertální růst dětí, které se narodily malé na svůj gestační věk (SGA), s malou výškou v dětství (SGA-SS). Výsledky léčby růstovým hormonem z dat české národní databáze REPAR
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

