-
Medical journals
- Career
Pubertální růst dětí, které se narodily malé na svůj gestační věk (SGA), s malou výškou v dětství (SGA-SS). Výsledky léčby růstovým hormonem z dat české národní databáze REPAR
Authors: Kodytková Aneta 1,LedjonaToni 1; Plachý Lukáš 1; Jírová Barbora 1; Hainerová Aldhoon Irena 2; Aleksijevi Darina 3; Černá Jana 4; Dvořáková Marcela 5; El-Lababidi Eva 2; Kalvachová Božena 5; Kocourková Kamila 6; Kotvalová Ivana 7; Magnová Olga 8; Novotná Dana 8; Obermannová Barbora 1; Pomahačová Renata 9; Průhová Štěpánka 1; Souček Ondřej 1; Strnadel Jiří 4; Šíchová Lucie 10; Škvor Jaroslav 10; Šnajderová Marta 1; Šumník Zdeněk 1; Zapletalová Jiřina 3; Šilar Jiří 11; Koloušková Stanislava 1; Lebl Jan 1
Authors‘ workplace: Pediatrická klinika, 2. lékařská fakulta, Univerzita Karlova a Fakultní nemocnice v Motole, Praha 1; Klinika dětí a dorostu, 3. lékařská fakulta, Univerzita Karlova a Fakultní nemocnice Královské Vinohrady, Praha 3 Dětská klinika, Lékařská fakulta, Univerzita Palackého a Fakultní nemocnice Olomouc 2; Klinika dětského lékařství, Lékařská fakulta, Ostravská univerzita a Fakultní nemocnice Ostrava 4; Endokrinologický ústav, Praha 5; Dětské oddělení, Nemocnice České Budějovice 6; Dětská klinika, Lékařská fakulta, Univerzita Karlova a Fakultní nemocnice Hradec Králové 7; Pediatrická klinika, Lékařská fakulta, Masarykova univerzita a Fakultní nemocnice Brno 8; Dětská klinika, Lékařská fakulta, Univerzita Karlova a Fakultní nemocnice Plzeň 9; Dětská klinika, Masarykova nemocnice, Krajská zdravotní, a. s., Ústí nad Labem 10; Institut biostatistiky a analýz, s. r. o., Brno, #tyto dvě autorky přispěly kevzniku článku stejným dílem 11
Published in: Čes-slov Pediat 2023; 78 (S3): 30-36.
Category: Original Papers
doi: https://doi.org/10.55095/CSPediatrie2023/058Overview
O úspěchu léčby růstovým hormonem a dosažení optimální dospělé výšky rozhoduje jednak růst před zahájením puberty a jednak vydatnost pubertálního růstového výšvihu.
U kohorty 397 dětí (221 chlapců) z české národní databáze příjemců růstového hormonu REPAR, které se narodily malé na svůj gestační věk, měly malou výšku v dětství (SGA-SS) a již dosáhly své téměř dospělé výšky, jsme vyhodnotili vliv prepubertální a pubertální složky růstu na celkový efekt léčby růstovým hormonem. Odděleně jsme posoudili děti také podle výšky rodičů (oba nad −2 SD výšky, jeden pod −2 SD výšky, oba pod −2 SD výšky) a podle porodních parametrů – nízké porodní hmotnosti, nízké porodní délky či kombinace obojího.
Léčba růstovým hormonem vedla do okamžiku ukončení léčby k průměrnému přírůstku ht-SDS o 1,59, z toho za prepubertální období o 1,57. Během puberty se již výška při pokračující léčbě nezlepšila. Po adjustaci na ht-SDS v 18 letech věku stoupla výška ve srovnání se stavem při zahájení léčby o 0,91 ht-SDS (všechny tři parametry p < 0,0001 proti výšce před léčbou). Významně více vyrostly děti s oběma rodiči vyššími než −2 SD a také děti, které měly sníženou výlučně porodní hmotnost, nikoliv porodní délku.
Výsledky analýzy z databáze REPAR prokazují účinnost léčby růstovým hormonem u dětí SGA-SS. O efektu léčby rozhoduje především prepubertální složka růstu, proto důsledné sledování růstu dětí narozených SGA a včasné zahájení léčby v časném dětství má pro ně klíčový význam.
Klíčová slova:
small-for-gestational-age, SGA-SS, růstový hormon, puberta, pubertální růstový výšvih, dospělá výška
Pubertální růstové období je závěrečnou fází tělesného růstu člověka.(1) Přispívá konečnými 12–18 % k celkové dospělé výšce – více u chlapců (v průměru 26 cm) než u dívek (v průměru 20 cm).(2–4) Finální dospělou výšku ovlivňují tři parametry spojené s pubertou: (a) věk při nástupu puberty, (b) výška při nástupu puberty a (c) vydatnost pubertálního růstového výšvihu.
Pubertální růstové období se podílí na úspěchu léčby růstovým hormonem. Některé děti narozené malé na svůj gestační věk (small for gestational age; SGA), které neprošly fází postnatálního růstového výšvihu (catch-up růstu), měly malou výšku v dětství (small for gestational age – short stature; SGA-SS) a dostávaly růstový hormon,(5) ukončily růst s nižší výškou, než se očekávalo podle výšky ve středním dětství.(6–9) Příčinou může být časnější nástup puberty, málo vydatný pubertální růstový výšvih nebo kombinace obou faktorů.
V kohortě českých dětí SGA-SS, které dosáhly své finální výšky po léčbě růstovým hormonem, jsme analyzovali parametry pubertálního růstu s cílem zjistit jejich vliv na dospělou výšku a celkový příspěvek k úspěchu podávání růstového hormonu.
Pacienti a metodika
Do studie pubertálního růstu byly zařazeny děti SGA-SS vedené v české národní databázi příjemců růstového hormonu REPAR, u kterých byl ke dni 13. 3. 2023 již k dispozici údaj o finální dospělé výšce. Geneze celé kohorty, detailní popis zařazovacích kritérií, podávaná léčba i definice finální výšky jsou uvedeny v souběžném sdělení.(5) Celkem bylo analyzováno 397 pacientů (221 chlapců, 176 dívek).
V této studii jsme se zaměřili na posouzení efektivity prepubertálního a pubertálního růstu dětí SGA-SS při léčbě růstovým hormonem a na jejich příspěvek k celkovému účinku léčby. Jako klíčové ukazatele jsme hodnotili:
výšku v čase zahájení léčby růstovým hormonem vyjádřenou jako skóre směrodatné odchylky tělesné výšky (ht-SDS);
výšku (vyjádřenou jako ht-SDS) při prvním záznamu o počínající pubertě – stadium B2 (dívky) nebo objem testes více než 3 ml (chlapci);
finální výšku (vyjádřenou jako ht-SDS) – poslední známou výšku jedince s plnou pohlavní zralostí (u chlapců stadium P5 G5, u dívek stav po menarché) a současně s růstovou rychlostí pod 2 cm za rok (přepočítáno z časového úseku 6–12 měsíců, při měření v ambulanci dětského endokrinologa s využitím stadiometru upevněného na stěně).
Pro posouzení adnátních parametrů na průběh růstu před začátkem dospívání, na vydatnost pubertálního růstu a na dospělou výšku jsme studijní kohortu 397 dětí rozdělili na podskupiny jednak podle výšky rodičů, jednak podle porodní hmotnosti a porodní délky ve vztahu ke gestačnímu věku. Odděleně jsme také zhodnotili ukazatele růstu u dětí narozených předčasně a u dětí narozených v očekávaném termínu porodu.
Výsledky
Jak uvádíme v souběžné studii,(5) léčba růstovým hormonem vedla k průměrnému přírůstku ht-SDS o 1,59 a k dosažení průměrné téměř finální výšky (near-final height) ht-SDS −1,62 (SD: 0,97; p < 0,001 proti výšce před léčbou). Po adjustaci výšky při ukončení léčby na 18 let věku dosáhli pacienti na prahu dospělosti ht-SDS −2,30 (SD: 1,09; p < 0,001 proti výšce před léčbou). Významná část chlapců i dívek tedy při skončení léčby dosáhla výšky v rozmezí hodnot běžné populace, tj. nad −2 ht-SDS.
Tabulka 1 a obrázek 1 ukazují odděleně výsledky prepubertálního a pubertálního růstu u tří podskupin dětí rozdělených podle výšky rodičů – u skupiny s oběma rodiči s výškou v obvyklém rozmezí (nad −2 ht-SDS), s jedním rodičem pod −2 ht-SDS a s oběma rodiči pod −2 ht-SDS.
Zatímco před léčbou se děti svojí výškou ve všech skupinách významně nelišily, na počátku puberty, při ukončení léčby i na prahu dospělosti byly děti rodičů obvyklé výšky významně vyšší než děti s jedním nebo oběma rodiči pod −2 ht-SDS. Za přírůstek výšky během léčení tedy plně zodpovídala prepubertální fáze růstu. Během puberty se již výška vyjádřená jako ht-SDS u žádné z podskupin dětí významně nezměnila.
Tabulka 2 ukazuje odděleně výsledky prepubertálního a pubertálního růstu u tří podskupin dětí rozdělených podle perinatálních parametrů – u dětí, které se narodily s porodní délkou (PD) pod −2 SD ke gestačnímu věku, s porodní hmotností (PH) pod −2 SD ke gestačnímu věku a s oběma parametry pod −2 SD ke gestačnímu věku.
Zatímco před léčbou, na počátku puberty a při ukončení léčby se výška dětí v těchto třech skupinách nelišila, adjustovaná dospělá výška je významně vyšší u podskupiny s výlučně nízkou porodní hmotností. Tato podskupina se tedy vymyká obecnému trendu a jako jediná má předpoklad i během puberty ještě zlepšit svoje ht-SDS.
Nebyl prokázán významný rozdíl změny ht-SDS během trvání léčby mezi dětmi narozenými předčasně (před začátkem 37. gestačního týdne; n = 64) a dětmi narozenými v termínu (ve 37. gestačním týdnu a později; n = 333).
Table 1. Prepubertální a pubertální růst u dětí SGA-SS při léčbě růstovým hormonem. Skupiny jsou rozděleny podle výšky rodičů. Výsledky ukazují vliv výšky rodičů na prepubertální a pubertální složku růstu. 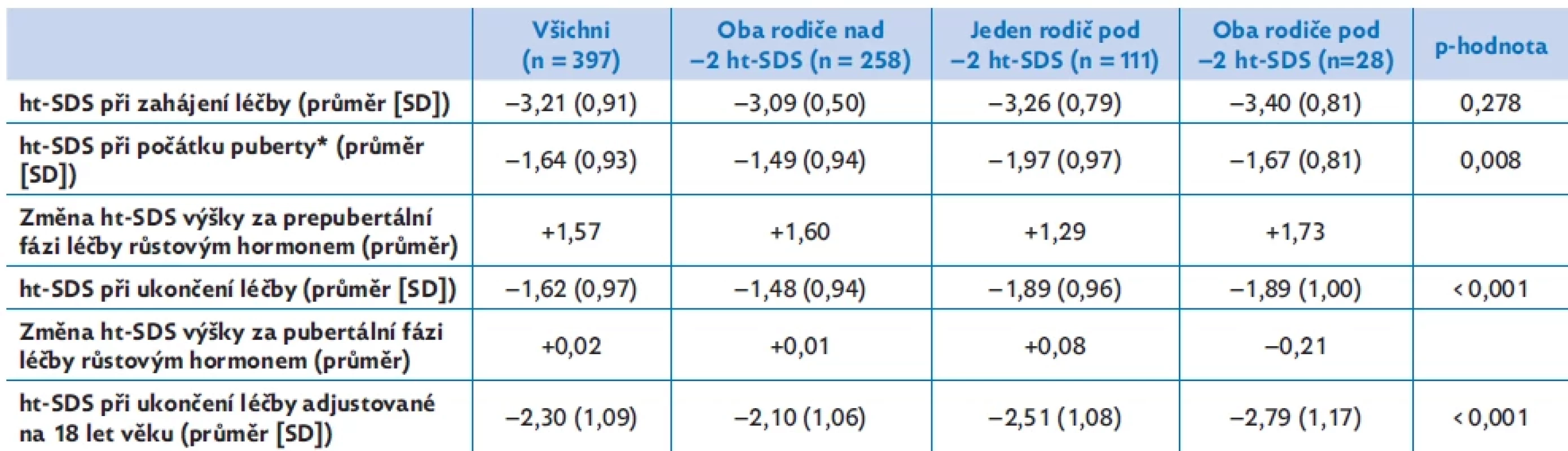
ht-SDS – skóre směrodatné odchylky tělesné výšky
*Počátek puberty je definován jako věk při prvním záznamu o B2 u dívek nebo testes více než 3 ml u chlapců. Statistické hodnocení bylo provedeno Kruskalovým–Wallisovým testem.Image 1. 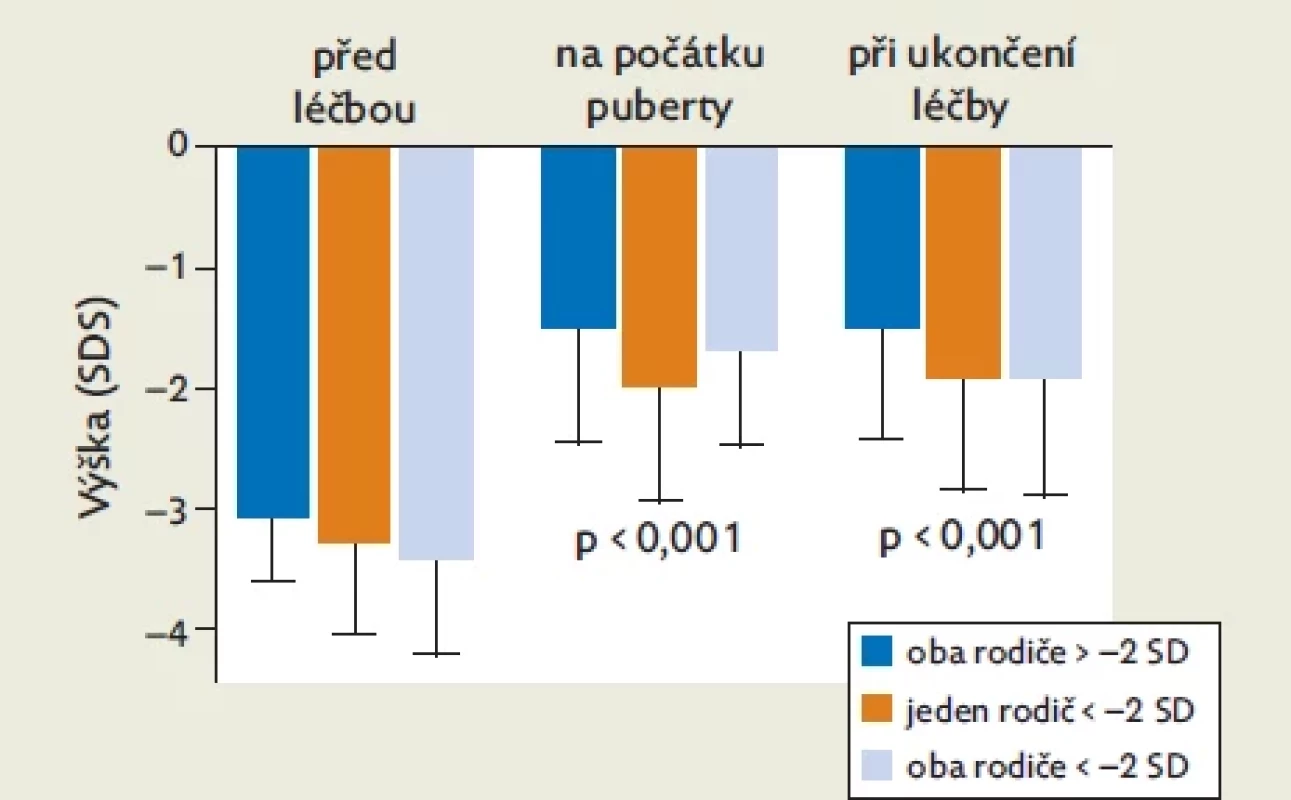
Výška dětí SGA-SS (vyjádřená jako skóre směrodatné odchylky [SDS] tělesné výšky) před zahájením léčby růstovým hormonem, na počátku puberty a při ukončení léčby. Samostatně je hodnocena skupina dětí, jejichž oba rodiče mají tělesnou výšku v obvyklém rozmezí (nad −2 SDS), skupina dětí s jedním rodičem pod −2 SDS a skupina dětí s oběma rodiči pod −2 SDS. Zatímco před léčbou byla výška dětí ve všech skupinách srovnatelná, děti rodičů obvyklé výšky byly na počátku puberty i na prahu dospělosti významně vyšší než děti s jedním nebo oběma rodiči pod −2 SD. Table 2. 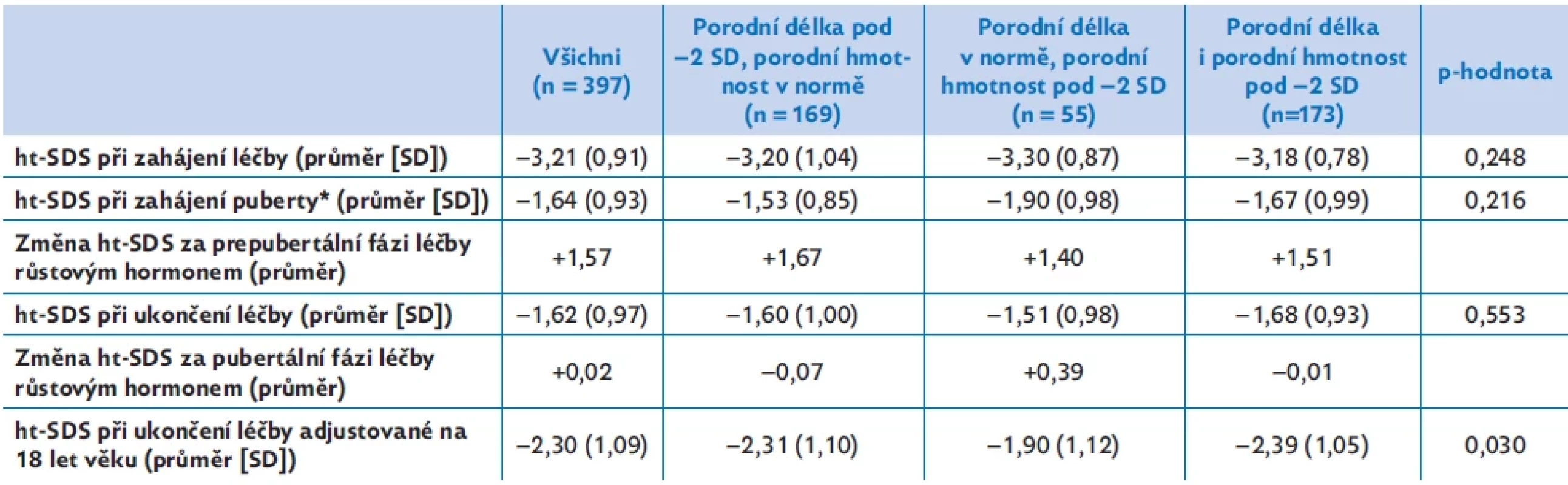
Prepubertální a pubertální růst u dětí SGA-SS při léčbě růstovým hormonem. Skupiny jsou rozděleny podle porodní délky a porodní hmotnosti. Výsledky ukazují rozdílný vliv snížené porodní hmotnosti a snížené porodní délky na prepubertální a pubertální složku růstu i na adjustovanou dospělou výšku.
ht-SDS – skóre směrodatné odchylky tělesné výšky
*Počátek puberty je definován jako věk při prvním záznamu o B2 u dívek nebo testes více než 3 ml u chlapců. Statistické hodnocení provedeno Kruskalovým–Wallisovým testem.Image 2. Tři zóny epifyzární růstové chrupavky – klidová zóna, zóna proliferace a zóna hypertrofie 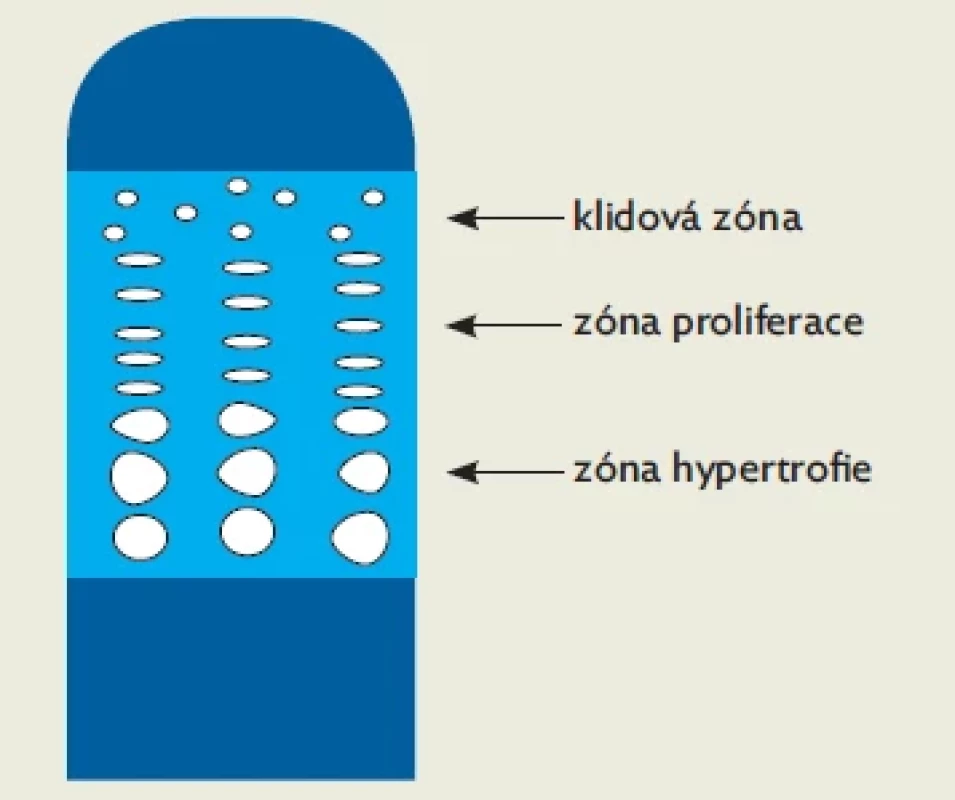
Image 3. Produkce pohlavních hormonů u fétu, novorozence a kojence a ve vlastní „skutečné“ pubertě 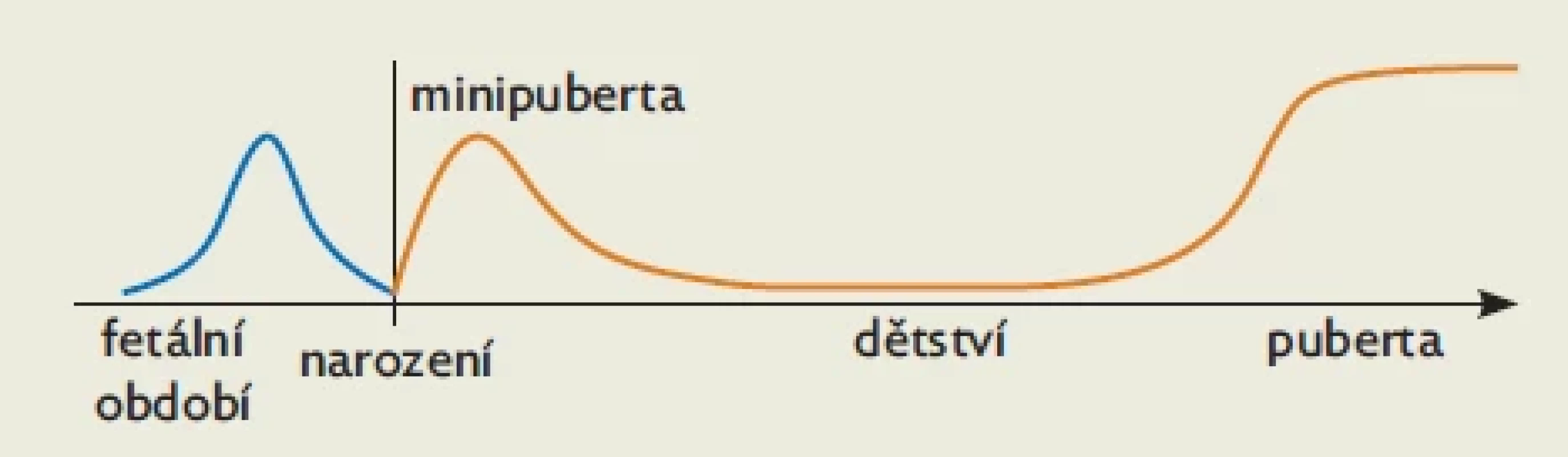
Image 4. 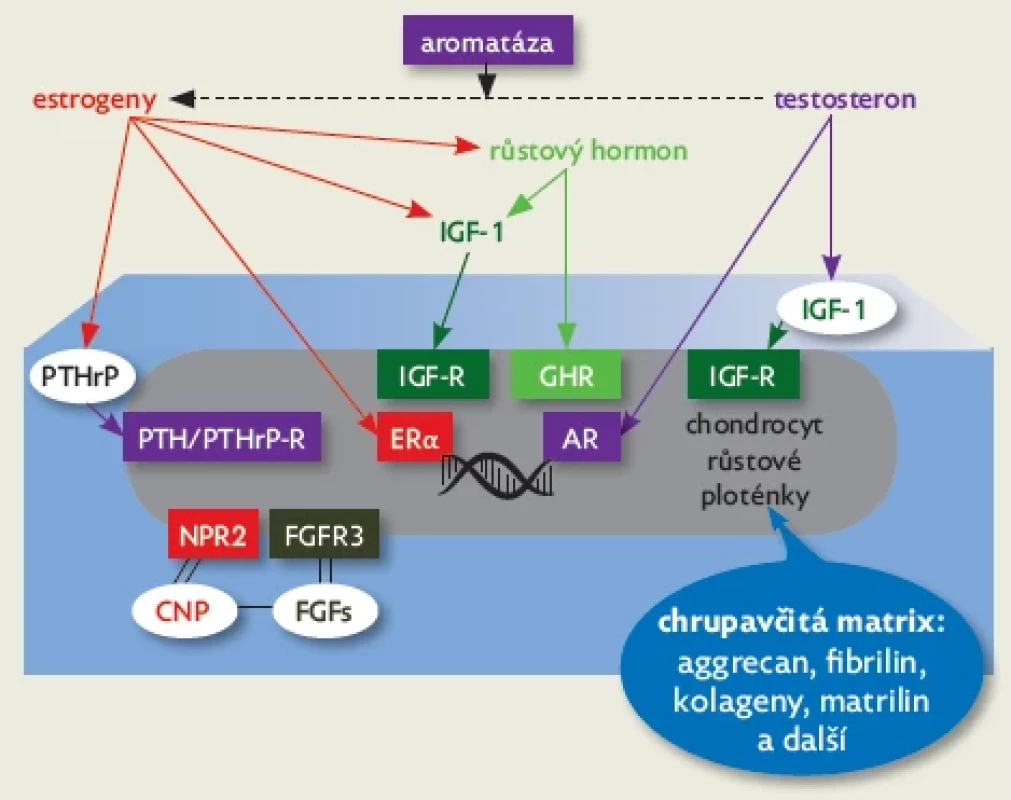
Schematické znázornění regulace chondrocytu v pubertálním růstovém období. Estrogeny jsou klíčovým hormonálním regulátorem pubertální růstové akcelerace i závěrečné fúze růstové ploténky, která vede k ukončení růstu. Estrogeny působí přímo vazbou na estrogenní receptor 𝛂 (ER𝛂) i zprostředkovaně – posílením endokrinní sekrece růstového hormonu a IGF-1 a parakrinní sekrece parathormon-related peptidu (PTHrP). Chondrocyty exprimují membránové receptory pro růstový hormon (GHR), pro IGF-1 (IGF-R), pro parathormon-related peptid (PTH/PTHrP-R) a nukleární receptory pro estrogeny a androgeny. Testosteron je aromatázou konvertován na estrogeny, navíc posiluje parakrinní sekreci IGF-1 a vazbou na androgenní receptor (AR) přímo působí na chondrocyty. Vedle hormonální regulace je i v pubertálním růstovém období pro aktivitu chondrocytu důležitá parakrinní regulace, např. spřaženými systémy natriuretického peptidu C (CNP) s receptorem NPR2 a fibroblastových růstových faktorů (FGFs) s jejich receptorem 3. typu (FGFR3). Na regulaci chondrocytu a aktivitu růstové chrupavky mají i v pubertě významný vliv složky chrupavčité matrix, např. aggrecan, fibrilin, kolageny a matrilin.
Upraveno dle(11), zdrojová data dle(12)Diskuse
Švédský auxolog Karlberg před téměř 40 lety matematicky analyzoval růstovou křivku člověka a doložil její tři oddělené, aditivní a částečně se překrývající složky. Označil je „I“ (infancy), „C“ (childhood) a „P“ (puberty). Bylo zřejmé, že každá z těchto složek lidského růstu má jinou regulaci. Karlberg usuzoval, že složka „I“ je řízena oběma inzulinu podobnými růstovými faktory (IGF-1 a IGF-2), složka „C“ osou růstový hormon – IGF-1 a složka „P“ pohlavními hormony.(1,10)
V současné době považujeme za klíčovou složku regulace lidského růstu aktivitu chondrocytů. Chondrocyty se aktivují v klidové zóně epifyzární růstové chrupavky konverzí z nezralých chondroprogenitorů. Vyzrávající chondrocyty se organizují do sloupců v zóně proliferace a následně se mění ve velké chondrocyty utvářející zónu hypertrofie (obr. 2).(11) V zóně hypertrofie dochází k postupné mineralizaci chrupavčité extracelulární matrix, na rentgenovém snímku vidíme zónu provizorní kalcifikace. Do osifikační zóny přiléhající k diafýze prorůstají cévy a vzniká nová kostní tkáň. Hypertrofické chondrocyty podléhají apoptóze a jsou nahrazeny osteoblasty.(12,13) Tento proces je řízen humorálně, ovšem komplexněji, než navrhl Karlberg před čtyřmi desítkami let.
Pohlavní hormony se produkují ve třech vývojových fázích člověka: u fétu od 21. gestačního týdne, u novorozence a kojence v prvních měsících po narození („minipuberta“) a po klidném období dětství následně ve stoupajícím množství od počátku „skutečné“ puberty (obr. 3). Těmto obdobím života s produkcí pohlavních hormonů odpovídají tři fáze růstové akcelerace: rychlý fetální růst ve 2. trimestru, infantní (kojenecké) růstové období po narození a pubertální růstový výšvih, který přechází do definitivního ukončení růstu.(12) Z tohoto výčtu je zřejmé, že růstová urychlení jsou navázána na produkci pohlavních hormonů.
Zásadními regulátory kostního růstu a mineralizace jsou estrogeny (obr. 4). Přispívají ke zrání růstové ploténky, vedou k epifyzární fúzi (zániku růstové ploténky) a stimulují akumulaci kostního minerálu.(14)
Na růstovou chrupavku působí především pohlavní hormony gonadálního původu. Jde tedy o endokrinní působení. Estrogeny vznikají díky enzymu aromatáze i lokálně v růstové chrupavce konverzí z testosteronu a dalších androgenů. Tento mechanismus označujeme jako intrakrinní působení. Androgeny stimulují růst kosti i přímo, bez konverze na estrogeny. Vliv pohlavních hormonů na růst zprostředkují také další mediátory – růstový hormon, IGF-1 a parathormon-related peptid (PTPrP), jejichž sekrece v pubertálním období stoupá. Chondrocyty exprimují jak membránové receptory pro tyto tři proteohormony, tak jaderné receptory pro estrogeny a androgeny (viz obr. 4).(13)
I v pubertálním období řídí aktivitu chondrocytů parakrinní mechanismy – spřažené systémy natriuretického peptidu C (CNP) s receptorem NPR2 a fibroblastových růstových faktorů (FGFs) s jejich receptorem 3. typu (FGFR3),(15–18) významný vliv mají složky chrupavčité matrix – aggrecan, fibrilin, kolageny, matrilin a další (viz obr. 4).(19)
Naše analýza růstových dat u dětí SGA-SS léčených růstovým hormonem ukázala, že o úspěchu léčení se rozhoduje v prepubertálním období. Mezi časem zahájení léčby a prvními známkami fyzické puberty skóre směrodatné odchylky tělesné výšky (ht-SDS) významně stoupá – dítě se výškou sbližuje s vrstevníky. Mezi počátkem puberty a finální výškou už v celé skupině ke zlepšení ht-SDS nedochází. Z podrobnější analýzy ale vyplývá, že děti SGA-SS nejsou homogenní skupinou a že mezi jednotlivými podskupinami se pubertální růst odlišuje.
Děti SGA-SS lze rozčlenit podle parametrů při narození – na skupinu se sníženou výlučně porodní délkou (pod −2 SD ke gestačnímu věku), se sníženou výlučně porodní hmotností (pod −2 SD ke gestačnímu věku) a se sníženými oběma parametry. V prepubertálním období rostou tyto tři skupiny podobně, v pubertálním období ale dojde k diferenciaci: lepší finální výšky dosáhnou děti se sníženou výlučně porodní hmotností, nikoliv porodní délkou. Pro tyto děti je příznačný normální růst do délky in utero. To může signalizovat normální funkci růstové ploténky a pravděpodobně exogenní příčinu intrauterinního strádání – environmentální, maternální či placentární. Léčba růstovým hormonem těmto dětem zlepší prepubertální i pubertální růst. Naopak děti se sníženou porodní délkou (bez ohledu na porodní hmotnost) méně rostly do délky in utero a chyběl jim catch-up růst po narození. Následně sice zlepšily svoji výšku na léčbě růstovým hormonem, ale mechanismy pubertálního růstového období jim nedovolily růst v pubertě dále akcelerovat. Můžeme spekulovat, že tyto děti mají endogenní příčinu růstové poruchy, která může být monogenně podmíněná a může zasahovat dynamiku růstové ploténky nebo další endogenní mechanismy řídící růst.(15)
Dále lze děti SGA-SS rozdělit také podle výšky rodičů. Některé mají oba rodiče normální výšky, některé jednoho rodiče pod −2 SD výšky, jiné mají oba rodiče pod −2 SD výšky. Pubertální růst nezlepší výšku v žádné z těchto tří skupin. Přesto nejlepší finální dospělé výšky dosahují děti s rodiči normální výšky, a to díky svému prepubertálnímu růstu. To jsou děti, u kterých mohla mít intrauterinní růstová restrikce exogenní příčinu. Právě tyto děti mají znatelně lepší šanci na úspěch léčení růstovým hormonem. Naopak děti s alespoň jedním rodičem menším než −2 SD mají zřetelnou endogenní vlohu pro malý vzrůst, která může být monogenně podmíněná s vertikálním (dominantním) přenosem. Dopad této vlohy na tělesný růst léčba růstovým hormonem zmírní, ale nedokáže jej zcela překonat.
Jinými slovy: familiárně malý vzrůst zhoršuje vyhlídky na optimální úspěch léčby růstovým hormonem. Do odpovědi na růstový hormon tedy zasahuje genetika, která se u dětí SGA-SS projevuje jednak sníženou porodní délkou (častěji bez snížené porodní hmotnosti), jednak nižší výškou jednoho nebo obou rodičů. Nerozhoduje přitom, zda výšku pod −2 SD má jeden rodič, nebo oba rodiče. Tato pozorování do jisté míry narušují Tannerův axiom o vlivu střední rodičovské výšky na růst dítěte,(20) přinejmenším ve skupině dětí SGA-SS, a naznačují, že rozhodující vliv má dominantní vloha právě od jednoho z rodičů. Zatímco nízká výška jednoho nebo obou rodičů limituje odpověď na léčbu zejména v prepubertální fázi růstu, nízká porodní délka zhoršuje odpověď na léčbu v období pubertálního růstového výšvihu a rozhoduje o úspěchu více než porodní hmotnost. Naše skupina v předešlých studiích prokázala, že právě dominantně dědičné monogenní poruchy zasahují často regulaci růstové ploténky a genealogicky se projevují jako familiárně malý vzrůst.(15,21,22)
Co je tedy důvodem menšího efektu léčby v pubertálním růstovém období? Nedostatečná výška při nástupu puberty, příliš časná puberta, nebo nedostatečný pubertální růstový výšvih?
Podle většiny studií puberta u celé skupiny dětí SGA-SS začíná v obvyklém věkovém rozmezí, i když poměrně časně vzhledem k aktuální tělesné výšce.(23–27) Metaanalýza Denga se spolupracovníky ale ukázala, že nástup puberty je zejména u dívek přece jen časnější, než je průměr ostatních dětí.(28)
Puberta nastává jednoznačně časně u obou podskupin dětí se syndromem Silvera–Russella – zejména u nositelů maternální uniparentální disomie na 7. chromozomu (mUPD7), ale také u dětí se ztrátou metylace v oblasti 11p15 (11p15 LOM).(29)
Naše výsledky prokazují, že hlavní příčinou menšího úspěchu pubertálního růstového období je nedostatečný pubertální růstový výšvih. Léčba růstovým hormonem již nedává většině dětí s endogenní příčinou SGA šanci v pubertě výšku dále zlepšit. Tyto nálezy odpovídají jiným obdobným pozorováním.(22,30,31) Prioritní je zjištění, že v pubertě svoji výšku relativně zlepší jen děti se zřejmou exogenní příčinou SGA. To může znamenat, že hlavní překážkou růstové akcelerace v pubertě jsou patogenní varianty genů důležitých pro funkci růstové chrupavky.
Některé pracovní týmy navrhovaly překonat relativní rezistenci k růstovému hormonu v pubertě zvýšením dávky, což v některých studiích skutečně poněkud zlepšilo dospělou výšku.(32,33) Později se ale ukázalo, že dávka růstového hormonu má na dospělou výšku malý vliv a důležitějšími prediktory jsou věk a výška na počátku puberty, kostní věk a střední rodičovská výška.(8,9)
Další možností jak farmakologicky modulovat pubertální období je oddálení puberty podáváním analogů gonadotropin-releasing hormonu. Při extrémně malé výšce na prahu puberty může být tato léčba prospěšná a může zlepšit dospělou výšku. Důkazy pro efekt takového postupu u jiných dětí s SGA-SS chybějí.(2,6,7)
Racionální odpovědí na nedostatečný pubertální růst je prodloužit fázi prepubertálního růstu včasným zahájením léčby, a zlepšit tak výšku na prahu puberty. Recentní metaanalýza robustních retrospektivních dat potvrdila, že věk při zahájení léčby je silným prediktorem konečného úspěchu.(34,35) Pro klinickou pediatrickou praxi z toho vyplývá úkol pravidelně sledovat růst u dětí narozených SGA. Jakmile jejich výška klesne pod −2,5 SD počínaje věkem 3 roky, je třeba odeslat je k posouzení do centra pro léčbu růstovým hormonem.
Naše studie má limitace podobné jako jiné studie z dat multicentrických databází. Vzhledem k hlášení údajů o léčených dětech nejvýše dvakrát ročně může být údaj o věku při nástupu puberty nepřesný. První databázový záznam o počátku pubertálního vývoje znamená, že první známky puberty se objevily v časovém intervalu 0–6 měsíců předtím, v průměru tedy 3 měsíce. Skutečný nástup puberty byl tedy dřívější oproti záznamům, což ve svém důsledku může změnit podíl prepubertálního a pubertálního růstu. Proto jsme také nehodnotili ukazatel věku při začátku pubertálního vývoje. Vzhledem k posunu záznamu o začátku puberty v průměru o tři měsíce je ale vliv nepřesnosti na hodnocení jednotlivých fází růstu málo významný. O limitaci v hodnocení finální tělesné výšky hovoříme podrobněji v paralelním článku.(5) Možná nepřesnost i v tomto ukazateli však nemůže podle názoru autorů výsledky hodnocení obou fází růstu podstatně ovlivnit.
Závěr
Léčba růstovým hormonem je u dětí SGA s malou výškou v dětství (SGA-SS) účinná.(5) Proto doporučujeme jejich pečlivé sledování. Pokud dojde k selhání růstu a dítě splní indikační kritéria, je pro optimální efekt dobré zahájit léčbu co nejdříve po 3. roce věku – protože u většiny dětí rozhoduje o celkovém úspěchu právě výškový přírůstek před nástupem pubertálního vývoje.
Korespondenční adresa:
Mgr. Aneta Kodytková
Pediatrická klinika UK 2.LF a FN v Motole
V Úvalu 84
150 06 Praha 5
aneta.kodytkova@gmail.com
Sources
1. Karlberg J. On the modelling of human growth. Stat Med 1987; 6 : 185–92.
2. Carel JC. Management of short stature with GnRH agonist and co-treatment with growth hormone: a controversial issue. Mol Cell Endocrinol 2006; 254–255 : 226–233.
3. Carrascosa Lezcano A, Fernández García JM, Fernández Ramos C, et al. Spanish cross-sectional growth study 2008. Part II. Height, weight and body mass index values from birth to adulthood. An Pediatr 2008; 68 : 552–569.
4. Bláha P, Vignerová J, Riedlová J, et al. VI. celostátní antropologický výzkum dětí a mládeže 2001. Ces-Slov Pediat 2003; 58 : 766–770.
5. Toni L, Kodytková A, Plachý L, et al. Dospělá výška dětí, které se narodily malé na svůj gestační věk (SGA) s malou výškou v dětství (SGA-SS). Výsledky léčby růstovým hormonem z dat české národní databáze REPAR. Ces-Slov Pediat 2023; 78 (S3): S22–29.
6. Adler E, Lambert A-S, Bouvattier C, et al. Determinants of final height in patients born small for gestational age treated with recombinant growth hormone. Horm Res Paediatr 2021; 94 : 52–62.
7. van der Steen M, Lem AJ, van der Kaay DC, et al. Puberty and pubertal growth in GH-treated SGA children: effects of 2 years of GnRHa versus no GnRHa. J Clin Endocrinol Metab 2016; 101 : 26964733.
8. Tanaka T, Yokoya S, Seino Y, et al. Onset of puberty and near adult height in short children born small for gestational age and treated with GH: interim analysis of up to 10 years of treatment in Japan. Clin Pediatr Endocrinol 2015; 24 : 15–25.
9. de Ridder MAJ, Stijnen T, Hokken-Koelega ACS. Prediction model for adult height of small for gestational age children at the start of growth hormone treatment. J Clin Endocrinol Metab 2008; 93 : 477–483.
10. Lebl J, Krásničanová H. Růst dětí a jeho poruchy. Praha: Galén 1996
11. Newton PT, Li L, Zhou B, et al. A radical switch in clonality reveals a stem cell niche in the epiphyseal growth plate. Nature 2019; 567(7747): 234–238.
12. Lebl J, Plachý L, Toni L, et al. Mysteria skeletálního růstu: Jak růstová chrupavka určuje tělesnou výšku. In: Onemocnění skeletu u dětí. Motolské pediatrické semináře 4. Praha: Galén 2019 : 99–115.
13. Emons J, Chagin AS, Sävendahl L, et al. Mechanisms of growth plate maturation and epiphyseal fusion. Horm Res Paediatr 2011; 75 : 383–391.
14. Weise M, De-Levi S, Barnes KM, et al. Effects of estrogen on growth plate senescence and epiphyseal fusion. Proc Natl Acad Sci USA 2001; 98 : 6871–6876.
15. Plachy L, Strakova V, Elblova L, et al. High prevalence of growth plate gene variants in children with familial short stature treated with growth hormone. J Clin Endocrinol Metab 2019; 104 : 4273–4281.
16. Shuhaibar LC, Robinson JW, Vigone G, et al. Dephosphorylation of the NPR2 guanylyl cyclase contributes to inhibition of bone growth by fibroblast growth factor. eLife 2017; 6: pii: e31343.
17. Vasques GA, Arnhold IJ, Jorge AA. Role of the natriuretic peptide system in normal growth and growth disorders. Horm Res Paediatr 2014; 82 : 222–229.
18. Wang SR, Jacobsen CM, Carmichael H, et al. Heterozygous mutations in natriuretic peptide receptor-B (NPR2) gene as a cause of short stature. Hum Mutat 2015; 36 : 474–481.
19. Hodax JK, Quintos JB, Gruppuso PA, et al. Aggrecan is required for chondrocyte differentiation in ATDC5 chondroprogenitor cells. PLoS One 2019; 14: e0218399.
20. Tanner JM, Goldstein H, Whitehouse RH. Standards for children’s height at age 2–9 years allowing for height of parents. Arch Dis Child 1970; 45 : 755–762.
21. Plachy L, Dusatkova P, Maratova K, et al. Familial short stature-a novel phenotype of growth plate collagenopathies. J Clin Endocrinol Metab 2021; 106 : 1742–1749.
22. Plachy L, Dusatkova P, Maratova K, et al. NPR2 variants are frequent among children with familiar short stature and respond well to growth hormone therapy. J Clin Endocrinol Metab 2020; 105: dgaa037.
23. Ruiz RA, Pérez AB, Leiva-Gea I, et al. Factors influencing height gain in children born small for gestational age treated with recombinant growth hormone: what extent is puberty involved? Ther Adv Endocrinol Metab 2022; 13 : 1–14.
24. Renes JS, Willemsen RH, Mulder JC, et al. New insights into factors influencing adult height in short SGA children: results of a large multicentre growth hormone trial. Clin Endocrinol 2015; 82 : 854–861.
25. Boguszewski MCS, Carlsson M, Lindberg A, et al. Near-adult height after growth hormone treatment in children born prematurely – data from KIGS. J Clin Endocrinol Metab 2020; 105 : 2457–2463.
26. Gaddas M, Périn L, Le Bouc Y. Evaluation of IGF1/IGFBP3 molar ratio as an effective tool for assessing the safety of growth hormone therapy in small-for-gestational-age, growth hormone-deficient and Prader-Willi children. J Clin Res Pediatr Endocrinol 2019; 11 : 253–261.
27. Persson I, Ahlsson F, Ewald U, et al. Influence of perinatal factors on the onset of puberty in boys and girls: implications for interpretation of link with risk of long term diseases. Am J Epidemiol 1999; 150 : 747–755.
28. Deng X, Li W, Luo Y, et al. Association between small fetuses and puberty timing: a systematic review and meta-analysis. Int J Environ Res Public Health 2017; 14 : 1377.
29. Patti G, Malerba F, Calevo MG, et al. Puberetal timing in children with Silver Russell syndrome compared to those born small for gestational age. Front Endocrinol (Lausanne) 2022; PMID: 36093089.
30. Vicens-Calvet E, Espadero RM, Carrascosa A, et al. Longitudinal study of the pubertal growth spurt in children born small for gestational age without postnatal catch-up growth. J Pediatr Endocrinol Metab 2002; 15 : 381–388.
31. Lazar L, Pollak U, Kalter-Leibovici O, et al. Pubertal course of persistently short children born small for gestational age (SGA) compared with idiopathic short children born appropriate for gestational age (AGA). Eur J Endocrinol 2003; 149 : 425–432.
32. Mauras N, Attie KM, Reiter EO, et al. High dose recombinant human growth hormone (GH) treatment of GH-deficient patients in puberty increases near-final height: a randomized, multicenter trial. Genentech, Inc., Cooperative Study Group. J Clin Endocrinol Metab 2000; 85 : 3653–3660.
33. Lem AJ, van der Kaay DC, de Ridder MA, et al. Adult height in short children born SGA treated with growth hormone and gonadotropin releasing hormone analog: results of a randomized, dose-response GH trial. J Clin Endocrinol Metab 2012; 97 : 4096–4105.
34. Juul A, Backeljauw P, Cappa M, et al. Early growth hormone initiation leads to favorable long-term growth outcome in children born small for gestational age. J Clin Endocrinol Metab 2023; 108 : 1043–1052.
35. de Bruin C, Dauber A. Growth hormone therapy in the short SGA child: Does time matter? J Clin Endocrinol Metab 2023; 108: e495–e496.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2023 Issue S3-
All articles in this issue
- Alois Wachsman: Žena v křesle
- Editorial
- Current view on the diagnostics of growth hormone deficiency in childhood and adolescence
- Anorexia nervosa from an endocrinologist's point of view
- Multiple endocrine neoplasia in childhood
- Adult height in children born small for gestational age (SGA) with persistent short stature (SGA-SS). Growth hormone treatment outcomes from data of the Czech countrywide REPAR database
- Pubertal growth in children born small for gestational age (SGA) with persistent short stature (SGA-SS). Growth hormone treatment outcomes from data of the Czech countywide REPAR database
- Příběh sv. Starosty: Legenda, historie a endokrinní kontext jednoho zázraku
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Anorexia nervosa from an endocrinologist's point of view
- Multiple endocrine neoplasia in childhood
- Current view on the diagnostics of growth hormone deficiency in childhood and adolescence
- Pubertal growth in children born small for gestational age (SGA) with persistent short stature (SGA-SS). Growth hormone treatment outcomes from data of the Czech countywide REPAR database
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

