-
Medical journals
- Career
Mentální anorexie z pohledu endokrinologa
Authors: Novotná Dana 1; Móriová Barbora 2
Authors‘ workplace: Pediatrická klinika, Fakultní nemocnice Brno a Masarykova univerzita 1; Psychiatrická klinika, Fakultní nemocnice Brno a Masarykova univerzita 2
Published in: Čes-slov Pediat 2023; 78 (S3): 11-16.
Category: Comprehensive Report
doi: https://doi.org/10.55095/CSPediatrie2023/060Overview
Mentální anorexie je komplexní psychiatricko-metabolicko-endokrinní onemocnění, které má z psychiatrických onemocnění nejvyšší úmrtnost. Při mentální anorexii dochází k alteraci téměř všech orgánů a systémů. Změny endokrinního systému představují většinou adaptaci organismu na hladovění a po znovunabytí potřebné hmotnosti a tukové hmoty dochází k jejich spontánní úpravě. Ale neplatí to pro všechny změny. Dochází k poruše hypothalamo-hypofyzární osy s projevy hypogonadotropního hypogonadismu a hyperkortizolemie, k rezistenci k růstovému hormonu, poruše tyroidální funkce, hyponatremii a hypooxytocinemii. Může být narušena i produkce antidiuretického hormonu a poměrně brzy lze diagnostikovat poruchu kostního metabolismu, která často přetrvává i po vyléčení mentální anorexie. V poslední době byly popsány i změny ve střevním mikrobiomu, v lipidovém metabolismu, poruchy produkce cytokinů s rozvojem autoimunity a poruchy imunitních funkcí.
Klíčová slova:
mentální anorexie, osteoporóza, hypothalamická dysfunkce, euthyroid sick syndrom, regulace příjmu potravy
Úvod
Mentální anorexie (MA) je jednou z variant poruch příjmu potravy. Jde primárně o psychiatrické onemocnění, které vede k narušení regulace příjmu potravy vedoucímu k omezování energetického příjmu záměrnou restrikcí stravy a/nebo purgativnímu chování (zvracení, užívání laxativ). Současně je u pacientů výrazně narušen sebeobraz nabádající k dalšímu hubnutí. Schopnost regulovat příjem potravy a následný úbytek hmotnosti je spojován s příjemnými prožitky, dojmy silné vůle a kontroly. Naopak porušení této schopnosti a asketického chování s sebou nese pocit viny, selhání a sebenenávisti.(1)
Epidemiologie
Četnost poruch příjmu potravy je nejvyšší ve vyspělých zemích Evropy a Ameriky a nejčastěji se projeví u dívek v adolescentním věku. V posledních letech obecně narůstá četnost psychických onemocnění a mezi nimi i poruch příjmu potravy, což bývá také dáváno do souvislosti s epidemií covidu-19. Výskyt závažné deprese a suicidálního chování vzrostl mezi lety 2017 a 2020 v České republice na trojnásobek a prevalence úzkostné poruchy se v populaci téměř zdvojnásobila.(2)
Prevalence poruch příjmu potravy za posledních pět let vzrostla téměř o dvě třetiny, v nejvyšší míře v adolescentní populaci, a jejich manifestace se posouvá do mladšího věku. Zajímavá je také souvislost epidemie covidu-19 a záchytu pacientek v závažnějším stavu a s vyšší četností rehospitalizace než v období před epidemií (obr. 1).(3) Celosvětově se prevalence poruch příjmu potravy mezi lety 2000 a 2018 zvýšila z 3,5 na 7,8 %.(4) Výrazný úbytek hmotnosti vede k poruše vnitřního prostředí a rozvoji závažných endokrinologických poruch. MA v důsledku závažných somatických komplikací, které mohou postihnout téměř každý orgán, vykazuje nejvyšší mortalitu ze všech psychiatrických onemocnění (10 %), pacienti umírají v průměru v 25 letech. Mortalita je dvojnásobná oproti ostatním psychiatrickým diagnózám a desetinásobně vyšší ve srovnání s obecnou populací. Nezanedbatelnou příčinou mortality je také suicidální jednání, které souvisí s četnými psychiatrickými komorbiditami. Riziko sebevražd je až 200násobně zvýšené.(5)
Endokrinní poruchy
Endokrinní poruchy představují většinou adaptační procesy na hladovění. Většina těchto změn je reverzibilní s nárůstem hmotnosti, ale ne všechny změny se takto upraví. Asi u pětiny pacientek MA dlouhodobě přetrvává jako chronické onemocnění, a proto je důležité mít na mysli také důsledky těchto endokrinních poruch (obr. 2, tab. 2).(6) Při mentální anorexii je narušena většina fyziologických hormonálních regulací. Dochází k poruše hypothalamo-hypofyzární osy s projevy hypogonadotropního hypogonadismu (HH) a hyperkortizolemie, k rezistenci k růstovému hormonu, poruše tyroidální funkce, hyponatremii a hypooxytocinemii. Může být narušena i produkce antidiuretického hormonu. U rozvinuté MA bývá přítomna porucha neurohumorální regulace příjmu potravy. Mentální anorexie představuje také zvýšené riziko poruchy kostního metabolismu, dochází ke zmnožení tukové složky kostní dřeně a poruše integrity kostí.(1) Většina těchto hormonálních změn je reakcí těla na nedostatečný příjem energie, ale HH, nízká hladina oxytocinu, leptinu, fT3 a zvýšená hladina kortizolu a peptidu YY (PYY) přispívají u MA také k neurokognitivním změnám a další psychopatologii – depresi, anxietě.(7)
Osa hypothalamus–hypofýza–gonády
Rozvoj hypogonadotropního hypogonadismu je individuální, nelze asociovat přímo s určitou hodnotou body mass indexu (BMI) či velikostí nebo rychlostí hmotnostního úbytku ani délkou trvání anorexie. 66–84 % žen s MA má amenoreu, 6–11 % oligomenoreu. U 15 % žen, u kterých přetrvává psychopatologie navzdory hmotnostnímu přírůstku, může dokonce amenorea přetrvávat.(6,8,9) Dlouhodobě byla diskutována hmotnost, která by již byla dostatečná k obnovení menstruačního cyklu. Z četných studií na toto téma vyplývá, že pro dospělé ženy je to dosažení BMI 19 kg/m2, pro adolescentky dosažení hmotnosti mezi 15. a 20. percentilem Z skóre BMI.(10) Nízká hladina leptinu, která je projevem úbytku tukové hmoty, signalizuje nedostatečné energetické zásoby a tlumí reprodukční funkce. To vede ke snížení hladiny luteotropního hormonu a porušení jeho pulzatilní sekrece.(11) Je známo, že při kongenitálním deficitu leptinu je součástí klinických projevů centrální hypogonadismus.(12)
Nízká hladina leptinu u MA je příčinou snížené signalizace kisspeptinu, který je důležitým regulátorem hypothalamického gonadotropin-releasing hormonu a tím i reprodukčních funkcí. Zvýšený ghrelin a kortizol také mohou přispívat k funkčnímu HH, jehož důsledkem je nejen pokles estrogenů, ale také hypoandrogenemie (60 % testosteronu u žen je ovariálního původu a 40 % je syntetizováno v kůře nadledvin). Je prokázáno, že hladina androgenů u MA nepřímo koreluje s tíží depresí a anxiety. Dlouhodobý efekt podávání androgenů na zlepšení psychiatrických komorbidit však dosud prokázán nebyl.(4,12) Nejlepší léčbou HH je nárůst hmotnosti minimálně k hodnotě před ztrátou menzes. Přístup gynekologa musí být individuální a po dohodě s psychiatrem, pediatrem, endokrinologem (růst). U adolescentek s perzistující MA a ukončeným růstem, které současně mají historii fraktur nebo Z skóre BMD < −2 SD, nebo v případě, že po 6–12 měsících po úpravě hmotnosti přetrvává amenorea, je indikováno krátkodobé podávání transdermálních estrogenů v nízké dávce (17-β-estradiol 50–100 µg denně) s cyklicky podávaným šetrným gestagenem.(5,6,12) U premenarchálních dívek je volbou miniestrogenizace.(12) Hladiny antimülleriánského hormonu, který je ukazatelem ovariální rezervy, se u MA neliší od zdravé populace.(13)Osa hypothalamus–hypofýza–nadledviny
Pacienti s MA mívají hyperkortizolemii se zvýšenou hladinou kortikotropin releasing hormonu (CRH) a adrenokortikotropního hormonu (ACTH), která negativně koreluje s BMI a množstvím tuku. Hladiny kortizolu zřídka přesahují dvojnásobek horní hranice normy. Na zvýšení hladiny kortizolu se kromě jeho vyšší produkce podílí i snížená renální clearance.(14) Bývá zvýšena i noční hladina kortizolu v séru, odpověď kortizolu na stimulaci cosyntropinem, je nedostatečná suprese hladiny kortizolu po podání 1 mg dexamethasonu. Nejedná se však o patologii nadledvin, nýbrž o reakci organismu na hladovění a stres. Klinické projevy hyperkortizolismu při současném nedostatečném příjmu energie a živin jsou patrné jen diskrétně. Například při nárůstu hmotnosti v remisi MA bývá výraznější ukládání tuku v abdominální oblasti.(8) Je zvažována také role vysoké hladiny CRH a ACTH v patofyziologii MA, protože vysoká hladina CRH má silně anorexigenní působení.(11) Kortizol je do vyšetřovacího schématu MA zařazen k vyloučení insuficience nadledvin, která se také může projevit nechutenstvím a úbytkem hmotnosti.
Rezistence k růstovému hormonu
Již od roku 1963 je známo, že hladovění stimuluje sekreci růstového hormonu. U MA bývá jeho bazální hladina až 20× vyšší než v běžné populaci. Mohla by se na tom podílet také vyšší hladina ghrelinu (sekretagogum pro růstový hormon). Vysoká hladina růstového hormonu může u MA sloužit zvýšením glukoneogeneze a lipolýzy k udržení normoglykemie.(15) Po podání glukózy nedochází u MA k supresi hladiny růstového hormonu, jak je u zdravých osob obvyklé. Hladina inzulinu podobného růstového faktoru (IGF-1), jehož produkce je stimulována růstovým hormonem, je však překvapivě nízká, v průměru dosahuje asi 50 % populační normy. Jde pravděpodobně o snahu strádajícího organismu snížit energetický výdej pomocí navození rezistence jaterních receptorů k působení růstového hormonu.(16) Podstatou rezistence k růstovému hormonu může být zvýšená hladina fibroblastového růstového faktoru FGF-21, který je tvořen v játrech, adipocytech a myocytech v důsledku nedostatečného příjmu bílkovin. FGF-21 následně zvyšuje příjem bílkovin cestou zpětnovazebného ovlivnění hypothalamických jader. FGF-21 se tedy jako neurotransmiter podílí na regulaci příjmu bílkovin, které jsou nezbytné pro růst, metabolické a imunitní funkce.(17) Současně FGF-21 antagonizuje intracelulární působení růstového hormonu včetně produkce IGF-1. Na rezistenci k růstovému hormonu se u MA také může podílet nízká hladina inzulinu, která v játrech snižuje expresi receptorů pro růstový hormon, nízká hladina leptinu a fT3.(16)
S úpravou hmotnosti se normalizuje i osa růstový hormon IGF-1.(6) U premenarchálních dívek vede MA k významné redukci růstové rychlosti. Rezistence je tak závažná, že ani podávání růstového hormonu v suprafyziologické dávce (5× vyšší, než je substituční dávka u deficitu růstového hormonu) nevede k vzestupu hladiny IGF-1. Léčba růstovým hormonem může vést k redukci tukové masy, což není pro pacientky s MA žádoucí.(9,16)
Table 1. Výsledky základního hormonálního vyšetření 106 pacientů FN Brno 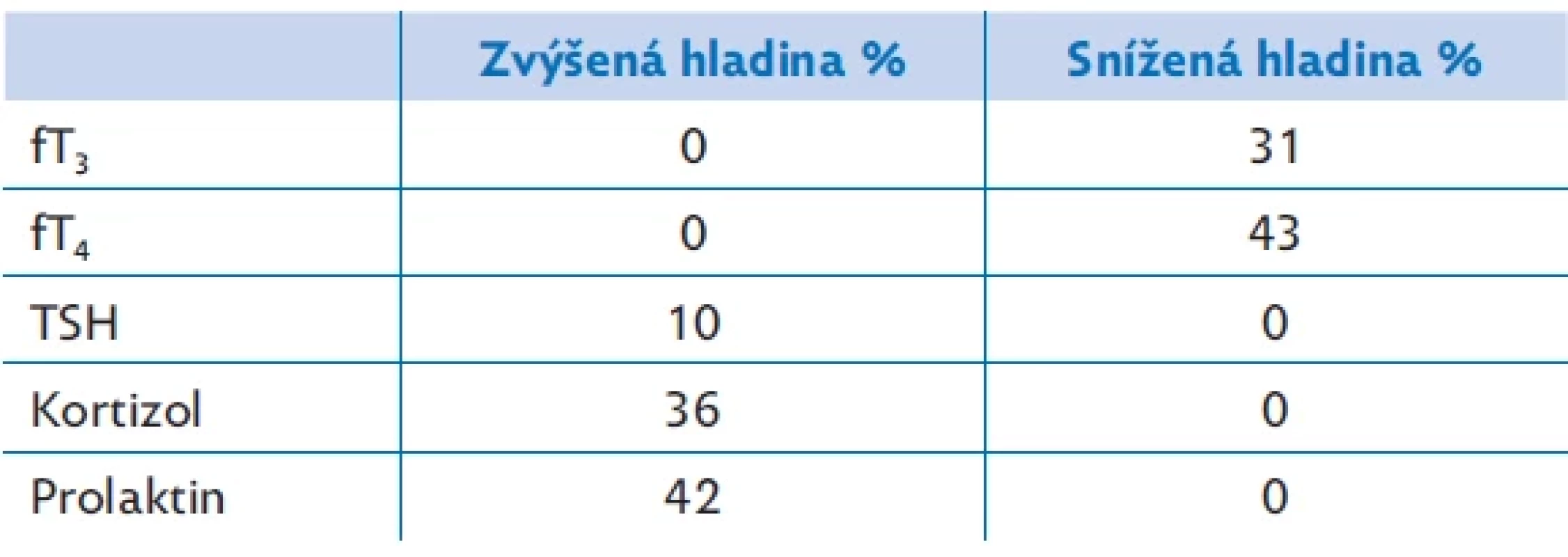
Tyreoidální osa
Při hladovění dochází ke snížení periferní konverze tyroxinu (T4) na účinný hormon trijodtyronin (T3) a místo T3 vniká neúčinný tzv. reverzní T3, což při nedostatečném příjmu energie vede ke snížení energetického výdeje. U nejtěžších případů MA klesá i hladina TSH a volného tyroxinu (fT4). Nejde vlastně o poruchu funkce štítné žlázy, ale jen o adaptaci organismu na hladovění s obrazem tzv. euthyroid sick syndromu (= reakce štítné žlázy na závažné non-tyroidální onemocnění), u kterého není indikována léčba tyroxinem. S nízkou koncentrací T3 souvisí i závažnost depresí. S restitucí hmotnosti se upravuje hladina TSH a fT4, hladina fT3 bývá nižší dlouhodobě.(6)
Pro ilustraci prezentujeme údaje vlastního souboru 106 adolescentních pacientů a pacientek ve věku 10–17 let hospitalizovaných na Psychiatrické klinice FN Brno v období 1/2019–7/2023 (tab. 1). Jedná se o základní hormonální vyšetření na začátku hospitalizační léčby. Snížená hladina trijodtyroninu byla zachycena u 43 %, z toho u více než poloviny pacientů byla provázena i sníženou hladinou fT4, v 85 % případů bez elevace hladiny TSH. Zvýšená hladina kortizolu byla pozorována u více než třetiny pacientů, hyperprolaktinemie u 42 %. Hladiny hormonů štítnice a kortizolu lze těžko porovnávat mezi jednotlivými soubory, protože vždy jde o individuální stupeň reakce na závažnost MA a stresové situace. Přítomnost zvýšeného kortizolu byla námi zachycena v menší míře, než je udáváno v literatuře (42 % versus 80 %).(18)
Četnost pacientů s nízkou hladinou fT4 byla srovnatelná, ale nízký fT3 jsme prokázaly méně často než Wronská,(19) která současně prokázala nepřímou úměru tíže deprese a hladiny fT3. Naprostá většina pacientek (88 %) v době vyšetření trpěla amenoreou, což je údaj srovnatelný s publikovanými daty.(9)Image 1. Vývoj incidence poruch příjmu potravy během epidemie covidu- 19 od ledna 2020 do ledna 2021. Relativní riziko je porovnáno s rokem 2019. Upraveno dle(25) 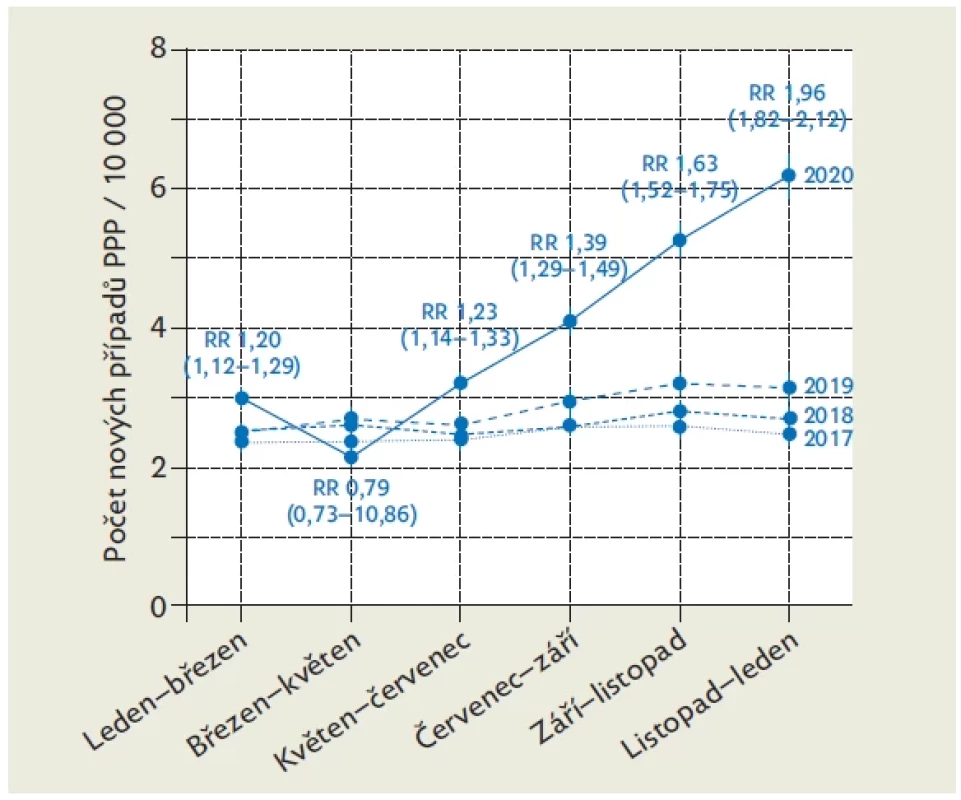
Image 2. Porucha endokrinních regulací u MA. Upraveno dle(19) 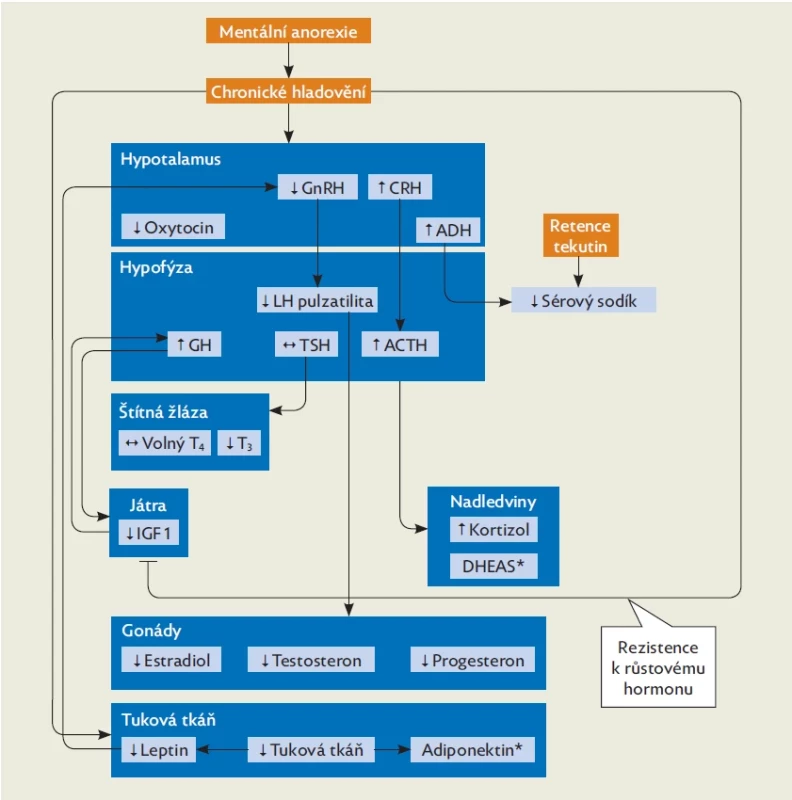
*hladiny mohou být dle různých autorů u MA sníženy, v normě, nebo zvýšeny Table 2. monální změny u mentální anorexie (MA), upraveno dle(6) 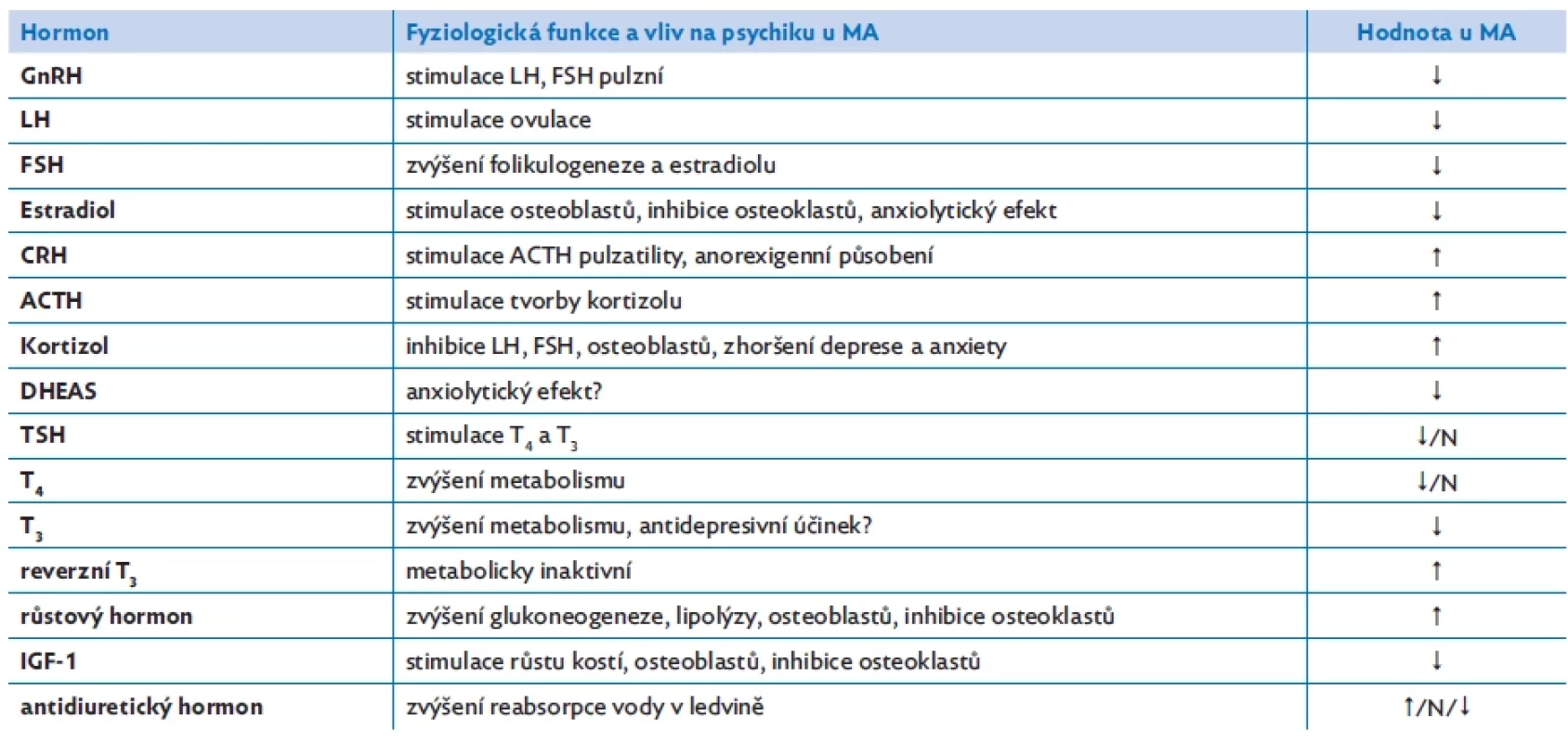
Zadní lalok hypofýzy
Zadní lalok hypofýzy produkuje antidiuretický hormon (ADH). U 20 % žen s MA bývá přítomna hyponatremie. Částečně je její příčinou zvýšený příjem bezsolutové vody, zvracení, používání laxativ a diuretik, jindy jde o syndrom inadekvátní sekrece antidiuretického hormonu. Jsou však publikovány i studie, kde je hladina ADH snížena s obrazem diabetes insipidus a hypernatremií. V zadním laloku hypofýzy je produkován také hormon oxytocin, který moduluje řadu psychologických procesů včetně sociálního chování, mírní úzkost a depresi, udržuje energetickou rovnováhu a kostní metabolismus. Ženy s MA mají hypooxytocinemii, která může být příčinou zvýšení anxiety a depresí. Nízká hladina oxytocinu také může tlumit pocit hladu.(7,18)
Peptidy regulující příjem stravy
U MA bychom vzhledem k energetickému deficitu očekávali zvýšení orexigenních a snížení anorexigenních působků, ale je to pravda jen částečně. Sice je snížený anorexigenní leptin, ale zvýšený také anorexigenní peptid YY produkovaný L buňkami střeva. U hladovějící MA by fyziologicky PYY měl mít také nízkou hladinu. Jeho zvýšená hladina tedy není adaptací na hladovění, ale spíše lze zvažovat jeho roli v patogenezi MA. Různé studie prokazují rozdílné hladiny tohoto peptidu, ale lze předpokládat, že jeho zvýšená hladina může vyvolávat pocit sytosti po požití minimálního množství stravy. V souladu s předpokladem bývá u MA zvýšená hladina ghrelinu, orexigenního peptidu produkovaného v žaludku, a současně sekretagoga růstového hormonu a ACTH, inhibitoru sekrece gonadotropinů. Hlavním účinkem acylované formy ghrelinu je stimulace orexigenních faktorů agouti-related proteinu a neuropeptidu Y. Hyperinzulinemie však u MA vykazuje na hladinu ghrelinu mnohem větší supresivní účinek. Nabízí se tedy otázka, zda toto nemůže u MA krátce po požití stravy navodit předčasný pocit sytosti.(14) Do budoucna je zvažována také možnost terapie analogy ghrelinu.(9) U MA je zvýšen také anorexigenní peptid obestatin, který vzniká odštěpením z acylované formy ghrelinu a tlumí příjem stravy a motilitu žaludku.(11) Pacientky s MA mívají nízkou hladinu inzulinu, což snižuje glukoneogenezi, lipolýzu a glykogenolýzu. Amylin je peptid produkovaný slinivkou, bývá u MA také snížen a spolu s nízkou hladinou inzulinu udržují euglykemii, ale přispívá také k poklesu minerální denzity kostí (BMD).(9,18)
Kost
Pokles BMD, porucha mikroarchitektury a geometrie kostí jsou závažné komplikace MA, které jsou detekovatelné časně po začátku onemocnění. Maximum postižení je v trabekulární kosti. Alarmující je významný nárůst zlomenin již krátce po diagnóze MA.(19) Pacientky s MA mají výraznější úbytek BMD než dívky s prostým hypothalamickým hypogonadismem, protože k nedostatku estrogenů se u MA přidává ještě nutriční karence a rezistence k růstovému hormonu, zvýšený kortizol, PYY a snížený testosteron, leptin a oxytocin.(11) 40 % dospělých pacientek má pokles BMD pod −2 SD, přičemž průměrný roční úbytek BMD u nich představuje 2,5 %.(14) Adolescence je však fyziologicky obdobím nárůstu BMD a zvýšeného kostního obratu. Proto některé dívky s MA manifestovanou v adolescentním věku nedosáhnou maximální BMD ani po úpravě hmotnosti a gonadální funkce. Rizikovým faktorem pro nízkou BMD je tedy adolescentní věk, delší trvání MA, HH, malá svalová hmota, příjem vápníku pod 600 mg/den, nízká hladina vitaminu D, vysoký kortizol, nízký estradiol a IGF-1. Neexistují guidelines pro screening úbytku BMD, ale dle Endocrine Society Clinical Guidelines pro funkční hypothalamickou amenoreu z roku 2017 je vhodné provést denzitometrii již po 6 měsících amenorey. Je zřejmé, že délka trvání amenorey je přímo úměrná úbytku BMD. Podle FDA není pro adolescentky s MA indikována terapie bisfosfonáty ani orálními kontraceptivy. Orální estrogeny mohou suprimovat hladinu IGF-1 a dále prohloubit ztrátu BMD.(20,21) Jedinou efektivní léčbou je léčba základního onemocnění, normalizace hmotnosti a menstruačního cyklu. Vzhledem k velmi krátké době, kdy je v adolescenci fyziologicky budována maximální kostní denzita, je u pacientek s perzistující MA a ukončeným růstem, které současně mají historii fraktur nebo Z skóre BMD < −2 SD, nebo v případě, že po 6–12 měsících po úpravě hmotnosti přetrvává amenorea, indikováno krátkodobé podávání transdermálních estrogenů v nízké dávce (17-β-estradiol 50–100 µg denně s cyklicky podávaným mikronizovaným progesteronem 100–200 mg denně 12 dní ve zvyšující se dávce).(6,7,16,21–24) U MA dochází také ke zmnožení tukové tkáně v kostní dřeni, jejíž množství negativně koreluje s BMD. Osteoblast a adipocyt pocházejí ze stejné kmenové buňky, proto zmnožení tukové tkáně v kostní dřeni může znamenat poruchu osteoblastogeneze.
Závěr
MA je závažné psychiatrické onemocnění s multisystémovým postižením organismu a globální endokrinní dysregulací. Většina endokrinologických změn je adaptací na nutriční deficit, po úpravě hmotnosti a získání potřebného množství tukové složky dochází k úpravě spontánně. Zcela jistě by měla být vyšší pozornost věnována kostní problematice, zejména u premenarchálních dívek, u kterých je fyziologicky vysoký kostní obrat s převahou osteoprodukce díky MA výrazně zpomalen. Je vhodné zařadit kostní denzitometrii do vyšetřovacích metod u MA. Pokud se onemocnění projeví v době předpokládaného růstového spurtu, vede MA často i ke zhoršení finální výšky. Dosud není vytvořen doporučený postup k řešení kostní problematiky MA, základem je stále psychiatrická, psychologická a nutriční intervence. Samotná substituce vápníku a vitaminu D není prevencí úbytku BMD, protože dívky s MA mají většinou příjem dostatečný. Bisfosfonáty jsou u premenarchálních dívek vzhledem k povaze kostního metabolismu zcela neúčinné, stejně jako perorální hormonální substituce, která může BMD a finální výšku dokonce zhoršovat. V individuálních případech by mohla být benefitem aplikace malých dávek transdermálních estrogenů, ev. dle pubertálního vývoje v kombinaci s malou dávkou progestinu. Optimální léčba a hledání rizikových faktorů a etiologie MA však zůstávají stále ještě otázkou dalšího výzkumu.
Korespondenční adresa:
MUDr. Dana Novotná, Ph.D.
Pediatrická klinika FN Brno a LF MU
Černopolní 9
613 00 Brno
novotna.dana@fnbrno.cz
Sources
1. Navrátilová M, Kalendová M. Poruchy příjmu potravy – mentální anorexie a bulimie, nejzávažnější somatické a metabolické komplikace. Způsoby realimentace. Shrnutí 30leté praxe z metabolického pohledu internisty. Čes-slov Pediat 2019; 74 (5): 290–300.
2. Kohoutek J, Kocourková J. Vliv koronavirové epidemie na vývoj a léčbu poruch příjmu potravy v dětském a adolescentním věku. Psychiatr praxi 2021; 22(2): 116–118.
3. Datta N, Van Wye E, Citron K, et al. The COVID-19 pandemic and youth with anorexia nervosa: A retrospective comparative cohort design. Int J Eat Disord 2023; 56(1): 263–268.
4. Galmiche M, Déchelotte P, Lambert G, Tavolacci MP. Prevalence of eating disorders over the 2000-2018 period: a systematic literature review. Am J Clin Nutr 2019; 109(5): 1402–1413.
5. https://www.lf1.cuni.cz/poruchy-prijmu-potravy-v-cechach
6. Haines MS. Endocrine complication of anorexia nervosa. J Eating Disord 2023. doi: 10.1186/s40337-023-00744-9
7. Lawson EA, Miller KK. Anorexia nervosa: endocrine complications and their management. In: Barbieri RL, Yager J, Martin KA (eds). UptoDate. 2023. Dostupné na: https://www.uptodate.com/contents/anorexia-nervosa-endocrine-complications-and-their-management?csi=cac4ca4f-eb4f-4800-8967-4cc0b69964e6&source=contentShare
8. Miller KK. Endocrine dysregulation in anorexia nervosa update. J Clin Endocrinol Metab 2011; 96(10): 2939–2949.
9. Støving RK. Mechanisms in endocrinology: Anorexia nervosa and endocrinology: a clinical update. Eur J Endocrinol 2019; 180(1): R9–R27.
10. Dempfle A, Herpertz-Dahlmann B, Timmesfeld N, et al. Predictors of resumption menses in adolescent anorexia nervosa. BMC Psychiatry 2013; 13 : 308.
11. Misra M, Klibanski A. Endocrine consequences of anorexia nervosa. Lancet Diabetes Endocrinol 2014; 2 : 581–592.
12. Poncová R, Skřenková J, Fanta M. Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající. Ceska Gynekol 2021; 86(1): 46–53.
13. Miller KK, Wexler TL, Zha AM, et al. Androgen deficiency: association with increased anxiety and depression symptom severity in anorexia nervosa. J. Clin Psychiatry 2007; (68): 959–963.
14. Saldanha N, Fisher M. Menstrual disorders in adolescents and young adults with eating disorders. Curr Probl Pediatr Adolesc Health Care 2022; 52 : 101240.
15. Miller KK. Endocrine dysregulation in anorexia nervosa update. J Clin Endocrinol Metab 2011; 96(10): 2939–2949.
16. Miller KK. Endocrine effects of anorexia nervosa. Endocrinol Metab Clin North Am 2013; 42(3): 515–28.
17. Sjögren M. Endocrine disturbances in anorexia nervosa. In: Patel VB, Preedy VR (eds). Eating disorders. 1st ed. London: Springer 2023 : 569–584.
18. Larson KR, Chaffin AT, Goodson ML, et al. Fibroblast growth factor-21 controls dietary protein intake in male mice. Endocrinology 2019; 160(5): 1069–1080.
19. Schorr M, Miller KK. The endocrine manifestations of anorexia nervosa: mechanisms and management. Nat Rev Endocrinol 2017; 13(3): 174–186.
20. Wronski ML, Tam FI, Seidel M, et al. Associations between pituitary-thyroid hormones and depressive symptoms in individuals with anorexia nervosa before and after weight-recovery. Psychoneuroendocrinology 2022; 137 : 105630.
21. Bulik CM, Carroll IM, Mehler P. Reframing anorexia nervosa as a metabo-psychiatric disorder. Trends Endocrinol Metabolism 2021. doi: 10.1016/j.tem.2021.07.010
22. Tichá Ľ, Payer J, Killinger Z, Podracká Ľ. Porucha kostného metabolizmu pri mentálnej anorexii. Čes-slov Pediat 2016; 71(5–6): 287–292.
23. Thavaraputta S, Fazeli PK. Estrogen for the treatment of low bone mineral density in anorexia nervosa. J Psychiatr Brain Sci 2022; 7(3): e220004.
24. Misra M, Katzman D, Miller KK, et al. Physiologic estrogen replacement increases bone density in adolescent girls with anorexia nervosa. J Bone Miner Res 2011; 26(10): 2430–8.
25. Taquet M, Geddes JR, Luciano S, Harrison PJ. Incidence and outcomes of eating disorders during the COVID-19 pandemic. Br J Psychiatry 2021; 220(5): 1–3.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2023 Issue S3-
All articles in this issue
- Alois Wachsman: Žena v křesle
- Editorial
- Současný pohled na diagnostiku deficitu růstového hormonu u dětí a dospívajících
- Mentální anorexie z pohledu endokrinologa
- Syndromy mnohočetné endokrinní neoplazie v dětském věku
- Dospělá výška dětí, které se narodily malé na svůj gestační věk (SGA), s malou výškou v dětství (SGA-SS). Výsledky léčby růstovým hormonem z dat české národní databáze REPAR
- Pubertální růst dětí, které se narodily malé na svůj gestační věk (SGA), s malou výškou v dětství (SGA-SS). Výsledky léčby růstovým hormonem z dat české národní databáze REPAR
- Příběh sv. Starosty: Legenda, historie a endokrinní kontext jednoho zázraku
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mentální anorexie z pohledu endokrinologa
- Syndromy mnohočetné endokrinní neoplazie v dětském věku
- Současný pohled na diagnostiku deficitu růstového hormonu u dětí a dospívajících
- Pubertální růst dětí, které se narodily malé na svůj gestační věk (SGA), s malou výškou v dětství (SGA-SS). Výsledky léčby růstovým hormonem z dat české národní databáze REPAR
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

