-
Medical journals
- Career
Bezpečnosť a zmeny vybraných laboratórnych parametrov u detí s alergiou na jed blanokrídleho hmyzu liečených venómovou imunoterapiou
Authors: Kapustová Daniela 1; Bánovčin Peter 1; Kapustová Lenka 1; Petrovičová Otília 1; Malicherová Jurková Eva 1; Mikler Ján 1; Šlenker Branislav 1; Suchá Pavlína 1; Jeseňák Miloš 1,2,3
Authors‘ workplace: Klinika detí a dorastu, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin 1; Klinika pneumológie a ftizeológie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin 2; Oddelenie klinickej imunológie a alergológie, Univerzitná nemocnica Martin 3
Published in: Čes-slov Pediat 2023; 78 (6): 308-314.
Category: Original Papers
doi: https://doi.org/10.55095/CSPediatrie2023/051Overview
Úvod: Alergia na jed blanokrídleho hmyzu je druhou najčastejšou príčinou anafylaxie detského veku. V súčasnosti jediná kauzálna terapia, ktorá môže navodiť toleranciu, je venómová imunoterapia (VIT).
Ciele: V našej práci sme sa zamerali na analýzu vybraných klinických a laboratórnych charakteristík v skupine pediatrických pacientov s alergiou na jed blanokrídleho hmyzu liečených VIT.
Materiál a metódy: Vytvorili sme prospektívnu štúdiu, do ktorej bolo postupne zaradených 20 detských pacientov (13 chlapcov, 7 dievčat), ktorí spĺňali indikačné kritéria pre VIT. Dáta boli zberané od roku 2015 do roku 2022. Definovali sme základnú charakteristiku súboru, zamerali sme sa na celkovú toleranciu liečby u pediatrických pacientov a výskyt vedľajších účinkov počas podávania VIT, taktiež sme vykonali odber krvi na stanovanie dynamiky laboratórnych imunologických parametrov v presne stanovených časových intervaloch.
Výsledky: Priemerný vek bol 11 ± 4,37 rokov, pričom priemerný vek prvej systémovej reakcie po bodnutí bol 9,15 ± 3,58 rokov. Z 20 zaradených pacientov bolo 14 alergických na jed včely a 6 na jed osy. VIT bola priemerne začatá vo veku 10 ± 3,86 rokov, z toho 2 pacienti ju začali ešte pred dovŕšením piateho roku života. Medzi najčastejšie zastúpené klinické prejavy systémovej reakcie v našom súbore patrili angioedém tváre (70 %), dyspnoe (65 %), urtikária (55 %) a celotelový pruritus (45 %). Výskyt vedľajších príhod po VIT sme najčastejšie pozorovali počas úvodnej fázy podávania v zmysle lokálnych reakcií, pričom u žiadneho pacienta nedošlo k rozvoju systémovej reakcie. Prirodzená reexpozícia počas VIT sa vyskytla u 25 % pacientov, pričom u žiadneho sa nerozvinula systémová reakcia. V priebehu VIT sme zaznamenali aj dynamické zmeny jednotlivých hodnotených laboratórnych parametrov s postupným poklesom špecifických IgE proti extraktu a alergénovým komponentom hmyzieho jedu a vzostup špecifických IgG4 proti alergénovému extraktu.
Záver: Alergiu na jed blanokrídleho hmyzu radíme medzi závažný až život ohrozujúci stav, pričom v súčasnosti jediná možná terapia, ktorou môžeme predchádzať vzniku systémovej reakcie a zlepšiť kvalitu života pacientom je VIT. U detských pacientov je udávaná vyššia účinnosť VIT a taktiež nižšie riziko zlyhania liečby. Naše skúsenosti dokladujú účinnosť aj bezpečnosť VIT v detskom veku a zároveň potvrdzujú pozitívne zmeny v laboratórnych parametroch naznačujúce indukciu imunitnej tolerancie.
Úvod
Pri alergii na jed blanokrídleho hmyzu patrí každé bodnutie hmyzom medzi potenciálne závažnú až život ohrozujúcu situáciu.(1) U detských pacientov patrí alergia na jed blanokrídleho hmyzu medzi druhú najčastejšiu príčinu anafylaktickej reakcie.(2) Liečbou, ktorá dokáže výrazne znížiť riziko vzniku závažných či fatálnych príhod po bodnutí blanokrídlym hmyzom a má zásadný benefit na kvalitu života pacientov a ich rodičov, je venómová alergénová imunoterapia (VIT).(1) VIT je indikovaná obvykle u detí (> 5 rokov), ktoré prekonali systémovú alergickú reakciu s príznakmi presahujúcimi generalizované kožné prejavy po bodnutí blanokrídlym hmyzom. Účinnosť venómovej imunoterapie je u detských pacientov vysoká, pri včelom jede 84,4 % a u pacientov liečených osím jedom 94,1 %. Dlhotrvajúca imunitná tolerancia navodená VIT je u detských pacientov vyššia oproti dospelým a len u 5 % pacientov dochádza k relapsu do 20 rokov od ukončenia alergénovej imunoterapie.(2)
Akokoľvek doteraz nepoznáme spoľahlivý biomarker pre sledovanie účinnosti VIT. Jedinou spoľahlivou metódou sledovania účinnosti VIT radíme expozičný test (v SR ani v ČR sa rutinne nerobí), preto je dôležité u pacientov sledovať výskyt a druh reakcie po prirodzenej reexpozícii blanokrídlym hmyzom v prostredí počas ako aj po ukončení VIT.(3)Materiál a metódy
V našej práci sme zostavili prospektívny súbor detských pacientov sledovaných na Ambulancii klinickej imunológie a alergológie Kliniky detí a dorastu v Univerzitnej nemocnici Martin, ktorí spĺňali diagnostické kritéria systémovej formy alergie na jed blanokrídleho hmyzu a boli indikovaní na VIT. Dáta boli zozbierané z rokov 2015–2022. Písomný informovaný súhlas s terapiou a s účasťou na štúdii bol podpísaný zákonným zástupcom každého pacienta. Finálna skupina pacientov pozostávala z 20 pediatrických pacientov (13 chlapcov, 7 dievčat), z toho 14 pacientov malo alergiu na včelí jed a 6 na osí jed. V súbore nebolo dieťa s alergiou na oba alergény. U každého pacienta bola podrobne odobratá anamnéza o prebehnutej systémovej reakcii, výskyt alergických ochorení, rodinná anamnéza, vyhodnotené komorbidity pacienta, chronická terapia, výskyt a druh reakcie pri reexpozícii po bodnutí blanokrídlym hmyzom počas podávania VIT. Všetci pacienti boli zaradení do klastrového režimu a chodili na aplikáciu VIT podľa predpísaného protokolu s jedom blanokrídleho hmyzu (Alutard® SQ včelí jed, Alutard SQ® osí jed, ALK Horsholm, Dánsko). U každého pacienta bola v pravidelných intervaloch (pred začatím VIT, po iniciálnej fáze, po 6. mesiaci, po 1. roku, po 2. roku) odoberaná krv na vyšetrenie krvného obrazu a diferenciálneho leukogramu, celkových IgE, špecifických IgE (šIgE) voči včeliemu/osiemu jedu – extrakt ako aj alergénové komponenty, bazálnej sérovej tryptázy, eozinofilného kationického proteínu (ECP, biomarker aktivácie mastocytov), špecifických IgG4 (šIgG4) voči včeliemu/osiemu extraktu. U pacientov sme taktiež monitorovali výskyt vedľajších príhod počas a po podaní VIT.
Náš súbor tvorilo celkovo 20 detských a adolescentných pacientov alergických na jed blanokrídleho hmyzu liečených VIT. V súbore boli zastúpené obe pohlavia: 13 chlapcov (65 %) a 7 dievčat (35 %). Z toho 14 pacientov (70 %) bolo zaradených na imunoterapiu s jedom včely a 6 pacientov (30 %) s jedom osy. Základná charakteristika nášho súboru je uvedená v tabuľke 1. Priemerný vek pacientov v našom súbore (k decembru 2022) bol 11 ± 4,37 rokov. Vek prvej systémovej (anafylaktickej) reakcie po bodnutí jedom blanokrídleho hmyzu bol 9,15 ± 3,58 rokov; z čoho 9 ± 3,96 rokov u chlapcov, 9,42 ± 3,04 rokov u dievčat. VIT bola začatá priemerne vo veku 10 ± 3,86 rokov (chlapci 10 ± 4,40 rokov, dievčatá 10 ± 2,91 rokov). Zároveň boli v skupine 2 pacienti (10 % zo súboru), ktorí mali prvé príznaky alergie na jed blanokrídleho hmyzu a boli zaradení na alergénovú imunoterapiu jedom blanokrídleho hmyzu pred piatym rokom života, z čoho obaja boli mužského pohlavia. Častejšie sme pozorovali výskyt alergie na jed včely – 70 % pacientov (61,5 % chlapcov, 85,7 % dievčat). Na porovnanie alergia na jed osy bola diagnostikovaná u 30 % pacientov (z toho 38,5 % chlapcov a len 14,3 % dievčat). Z celkového súboru prekonali 4 deti (20 % pacientov) viac ako 1 systémovú reakcie pred začatím VIT. U všetkých pacientov bola realizovaná iniciálna fáza aplikácie VIT v režime klaster.
P-skóre sme získavali porovnávaním hodnôt pred začatím VIT so všetkými získanými hodnotami po jej začatí (po iniciálnej fáze podávania, po 1. mesiaci, po 6. mesiaci, po 1. roku, po 2. roku), pričom za štatisticky signifikantnú zmenu sme považovali p ≤ 0,05. Dáta boli vyhodnocované programom MedCalc Version 20.211. Normalita distribúcie údajov bola kontrolovaná pomocou Shapiro-Wilkovho testu. Porovnanie medzi kontrolnou a testovacou skupinou bolo hodnotené pomocou t-testu alebo Mann-Whitney testu v závislosti od spôsobu distribúcie parametrov. Na porovnanie údajov, ktoré neboli parametrické sme použili Mann-Whitney test, do ktorého boli zaradení všetci naši pacienti.
Table 1. Základná charakteristika detských pacientov s alergiou na jed blanokrídleho hmyzu 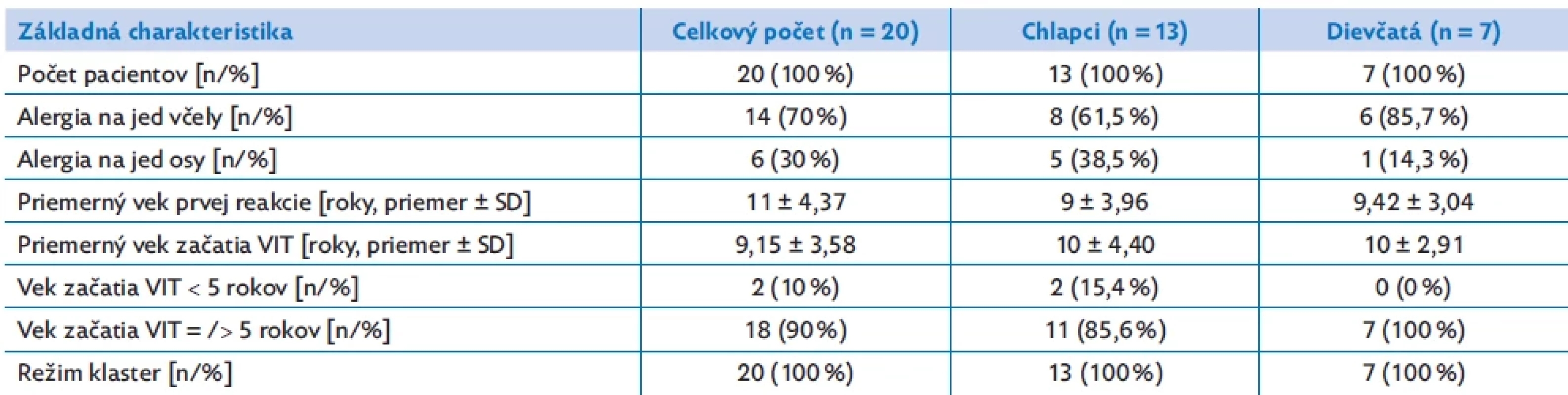
Výsledky
Charakteristika klinických prejavov alergie na jed blanokrídleho hmyzu
Z celkového súboru malo 95 % pacientov kompletne vyjadrený priebeh anafylaktickej reakcie po bodnutí blanokrídlym hmyzom (100 % chlapcov, 85,7 % dievčat). U jedného pacienta (5 %) bola indikácia na VIT zvážená individuálne, pričom po opakovanom bodnutí blanokrídlym hmyzom mal prejavy čoraz väčšej progredujúcej veľkej lokálnej reakcie komplikovanej flegmónou v mieste bodnutia a splnil laboratórne kritéria alergie na jed blanokrídleho hmyzu.
Medzi najčastejšie zastúpené klinické prejavy systémovej reakcie v našom súbore boli angioedém tváre (70 %), dyspnoe (65 %), urtikária (55 %), generalizovaný pruritus (45 %). Menej často sa klinicky manifestovali gastrointestinálne prejavy – nauzea, emesis, hnačka (20 %), vertigo (15 %), cefalea (10 %), kašeľ (5 %), hypotenzia (5 %), porucha vedomia (5 %) a úzkosť (5 %). Prehľad jednotlivých klinických symptómov je spracovaný v tabuľke 2. V prípade alergie na jed včely sme najčastejšie pozorovali u detí dyspnoe (71,4 %), angioedém (64,3 %), urtikáriu (42,9 %) a pruritus (42,9 %). Naopak, pri alergii na jed osy to bola urtikária (83,3 %), angioedém (83,3 %), dyspnoe (50 %) a pruritus (50 %). V závislosti od pohlavia sa u chlapcov najčastejšie systémové prejavy manifestovali angioedémom (92,3 %), dyspnoe (69,2 %), urtikáriou (69,2 %), pruritom (53,8 %) a u dievčat dyspnoe (57,1 %) a v rovnakom zastúpení urtikária, pruritus, angioedém a gastrointestinálne prejavy (28,6 %).
Tolerancia liečby pediatrickými pacientami
Tolerancia liečby a výskyt vedľajších príhod bol detailne monitorovaný a zaznamenávaný u všetkých našich pacientov počas subkutánneho podávania alergénu v iniciálnej aj udržiavacej fáze VIT (tab. 3). V priebehu podávania alergénovej imunoterapie jedom blanokrídleho hmyzu sme doposiaľ u detských pacientov nezaznamenali žiaden prípad systémovej (anafylaktickej) reakcie počas a ani v časovom odstupe od podania. Najčastejšie sa vyskytujúcim nežiaducim účinkom bola lokálna reakcia v mieste podania v zmysle pruritu, miernej indurácie, erytému a u jedného pacienta sa na druhý deň od podania objavila mierna rinitída a kašeľ. Najvzšší výskyt vedľajších reakcií sme pozorovali počas iniciálnej fázy pri 4. sedení (100 000 SQ, 0,2 – 0,4 – 0,8 ml prípravku VIT podaného s.c.) u 45 % pacientov.
V prípade 1. sedenia s aplikáciou prvej koncentrácie imunoterapie (100 SQ) a 2. sedenia s druhou koncentráciou (1000 SQ) bol výskyt nežiaducich účinkov nízky, rovnako ako aj v prípade udržiavacej fázy terapie s plnou dávkou zo 4. koncentrácie prípravku (100 000 SQ). Porovnaním výskytu nežiaducich účinkov pri extraktoch podávaných jedov (Alutard SQ® osí jed a Alutard SQ® včelí jed) sme zistili, že sú percentuálne približne rovnako zastúpené. Počas VIT liečby prekonalo prirodzenú reexpozíciu bodnutím blanokrídlym hmyzom 5 pacientov (25 % z celkového súboru); z toho 3 pacienti (60 %) nemali žiadnu pozorovanú reakciu po bodnutí a u 2 pacientov (40 %) bola táto reakcia len lokálna bez rozvoja anafylaktickej reakcie. Ani u jedného exponovaného pacienta nebolo potrebné podať adrenalín.
Table 2. Analýza klinických prejavov alergie na jed blanokrídleho hmyzu v našom súbore pacientov 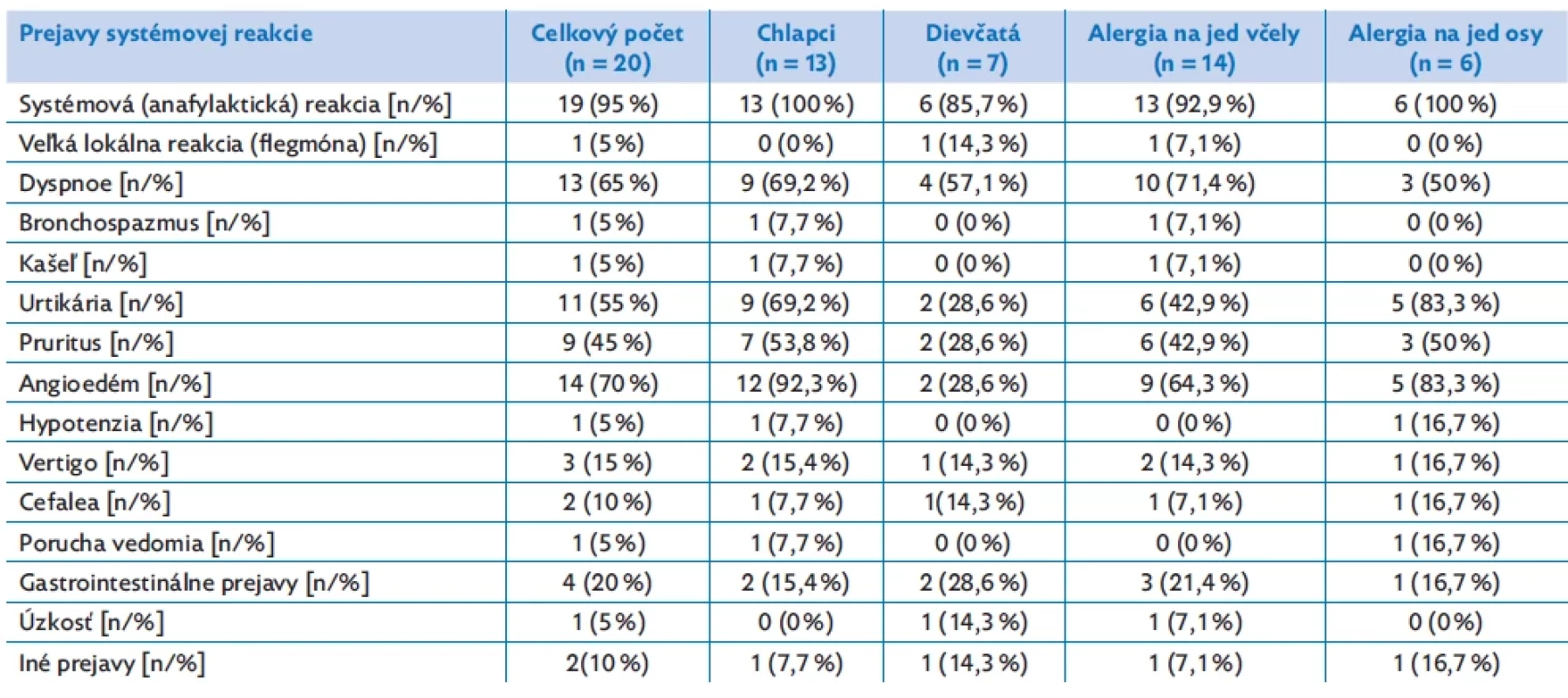
Table 3. Výskyt vedľajších príhod počas venómovej imunoterapie v klastrovom režime podávania 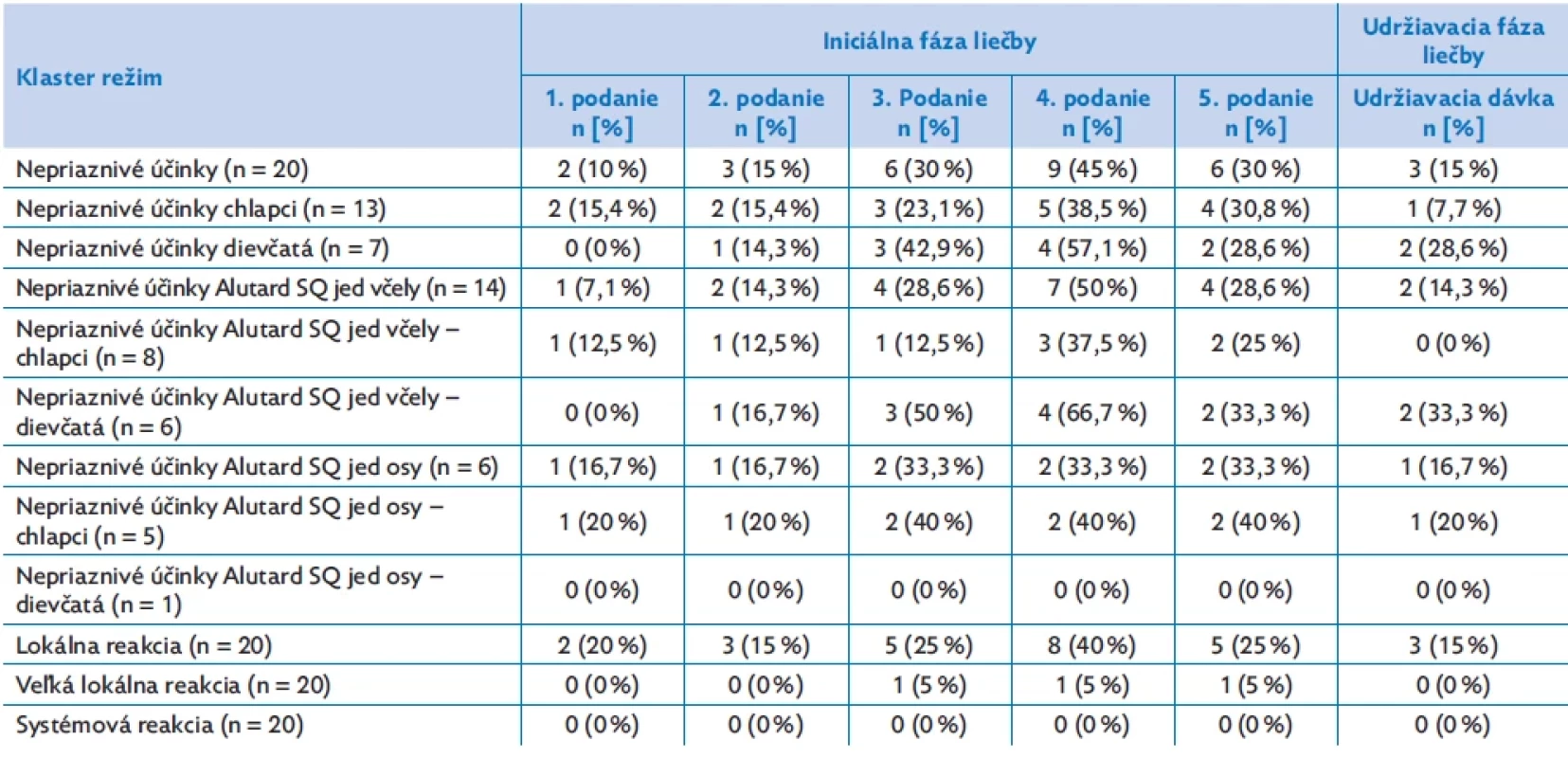
Schéma podávania:(1)
1. podanie – koncentrácia 100 SQ prípravku Alutard®, 3 dávky – 0,2 ml, 0,4 ml, 0,8 ml s odstupom 45 minút
2. podanie – koncentrácia 1000 SQ prípravku Alutard®, 3 dávky – 0,2 ml, 0,4 ml, 0,8 ml s odstupom 45 minút
3. podanie – koncentrácia 10 000 SQ prípravku Alutard®, 3 dávky – 0,2 ml, 0,4 ml, 0,8 ml s odstupom 45 minút
4. podanie – koncentrácia 100 000 SQ prípravku Alutard®, 3 dávky – 0,2 ml, 0,4 ml, 0,8 ml s odstupom 45 minút
5. podanie – koncentrácia 100 000 SQ prípravku Alutard®, 1 dávka – 1,0 ml
Udržiavacia dávka – koncentrácia 100 000 SQ prípravku Alutard®, 1,0 mlZmeny vybraných laboratórnych parametrov
V skupine našich pacientov sme analyzovali vybrané laboratórne parametre, ktoré boli pacientom odoberané v presne stanovených časových intervaloch (pred začatím VIT, po iniciálnej fáze podávania, po 6. mesiaci, po 1. roku, po 2. roku podávania VIT). Pre nedostatočný počet pacientov, u ktorých by imunoterapia trvala dlhšie ako 2 roky, sme spracovali výsledné údaje len do tohto časového obdobia.
Pozorovali sme nesignifikantný pokles celkových IgE po 6. mesiaci podávania VIT oproti výsledkom pred podávaním imunoterapie (pred začatím VIT – 151,49 IU/l vs. po 6. mesiaci – 59,91 IU/l, p = 0,38) s následným opätovným zvýšením hodnôt do 2. roka podávania (po 2. roku – 130,93 IU/l, p = 0,90) (obr. 1); hodnoty eozinofilného kationického proteínu (ECP) po iniciálnej fáze podávania mierne stúpli (pred začatím VIT – 11,69 μg/l vs. po 1.mesiaci – 14,91 μg/l, p = 0,81) a postupne klesali od 6. mesiaca do 2. roku podávania VIT (pred začatím VIT – 11,69 μg/l vs. po 6. mesiaci – 6,72 μg/l, p = 0,41; po 2. rokoch – 6,50 μg/l, p = 0,21) (obr. 2).
Z hľadiska celkovej tryptázy nepozorujeme v našej skupine pacientov výraznú eleváciu hodnôt počas 2 rokov podávania imunoterapie (obr. 3). Vyhodnotené zmeny týchto parametrov neboli štatisticky signifikantné. Z hľadiska zmien špecifických IgE sme zaznamenali signifikantný vzostup po iniciálnej fáze podávania VIT (pred začatím VIT – 6,49 IU/ml vs. po iniciálnej fáze podávania – 8,58 IU/ml, p = 0,03; po 1. roku – 7,88 IU/ml, p = 0,09) s postupným poklesom po 2. rokoch podávania (po 2. roku – 3,43 IU/ml, p = 0,86) (obr. 4); špecifické IgG4 mali menlivý charakter počas podávania VIT, signifikantný vzostup sme pozorovali počas prvého roku podávania (pred VIT – 2,92 mgA/l vs. po iniciálnej fáze podávania – 11,85 mgA/l, p = 0,01; po 1. roku – 26,07 mgA/l, p = 0,003) a s následným miernym poklesom po 2 rokoch podávania (po 2. roku – 11,8 mgA/l, p = 0,02) (obr. 5). V priebehu liečby došlo postupne k poklesu pomeru šIgE : šIgG4, čo môže naznačovať postupné navodenie imunitnej tolerancie v priebehu VIT (obr. 6).
Image 1. Zmena celkových IgE počas podávania VIT [IU/l] ![Zmena celkových IgE počas podávania VIT [IU/l]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f2a82b7a2eddd37e5b03bbccf47a690e.png)
Image 2. Zmena ECP počas podávania VIT [μg/l] ![Zmena ECP počas podávania VIT [μg/l]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/89c4e4b6e1f703db82a19fc1aea10509.png)
Image 3. Zmena bazálnej tryptázy počas podávania VIT [μg/l] ![Zmena bazálnej tryptázy počas podávania VIT [μg/l]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/48ea8fd694437d91d09479168d43d020.png)
Image 4. Zmena šIgE proti extraktu jedu osy a včely počas podávania VIT [IU/ml] (*p < 0,05) ![Zmena šIgE proti extraktu jedu osy a včely počas podávania VIT [IU/ml] (*p < 0,05)](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8e959e036bfce153231b025f8aaeaf57.png)
Image 5. Zmena šIgG4 proti extraktu jedu osy a včely počas podávania VIT [mgA/l] (*p < 0,05, **p < 0,01) ![Zmena šIgG4 proti extraktu jedu osy a včely počas podávania VIT [mgA/l] (*p < 0,05, **p < 0,01)](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8e7e6e542ca1890c0bee16487fabc560.png)
Image 6. Zmena pomeru šIgE : šIgG4 proti extraktu jedu osy a včely počas podávania VIT 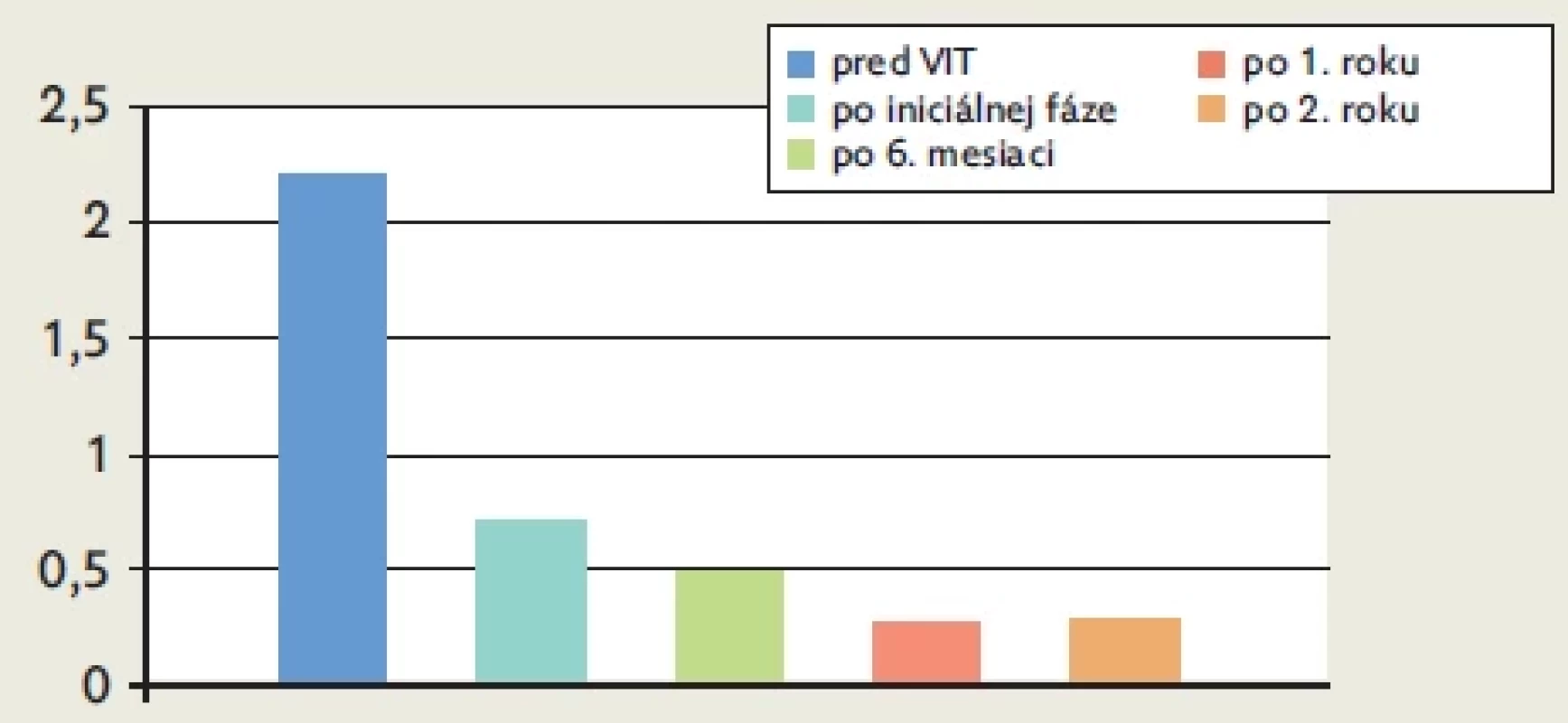
Diskusia
Alergia na jed blanokrídleho hmyzu patrí medzi jednu z najčastejších potenciálne život ohrozujúcich alergických reakcii detského veku. V porovnaní s dospelými sú systémové prejavy po bodnutí blanokrídlym hmyzom u detských pacientov menej často pozorované a obvykle aj menej závažné (vrátane veľkej lokálne reakcie, angioedému, urtikárie).(4,5) V európskych epidemiologických štúdiách sa udáva prevalencia veľkej lokálnej reakcie okolo 0,9 – 20,5 %(5) a systémovej reakcie do 3,4 % po bodnutí blanokrídlym hmyzom u detí.(6)
Podľa izraelskej kohortovej štúdie, ktorú vytvoril Hershko a kol. (2019), je väčšina detských pacientov alergická na bodnutie jedom včely (88,7 % pacientov) v porovnaní s jedom osy (10,7 % pacientov).(7) Získané údaje sme porovnali s našou štúdiou, kde sme taktiež zaznamenali častejší výskyt alergie na jed včely ako na jed osy. Priemerný vek prvej reakcie našich pacientov bol 11 ± 4,37 rokov a v celkovom súbore bolo viacej chlapcov ako dievčat. Medzi najčastejšie klinické prejavy patrili angioedém, dyspnoe, urtikária a pruritus. Na porovnanie Yavuz a kol. (2013) vytvorili štúdiu, kde boli zaradení pediatrickí pacienti alergickí na jed blanokrídleho hmyzu. V tomto súbore bol priemerný vek prvej reakcie 9,8 ± 3,4 rokov, z toho väčšinu pacientov tvorili chlapci (75 %) a častejšie sa vyskytovala alergia na jed osy (76 % prípadov). Medzi najčastejšie systémové prejavy patrilo postihnutie kožného, respiračného, gastrointestinálneho a kardiovaskulárneho systému. Medzi najčastejšie klinické prejavy patril angioedém, generalizovaná urtikária, erytém, dyspnoe, wheezing a nauzea.(8) Samotné postihnutie kože môže byť jediný príznak alergie na jed blanokrídleho hmyzu, a to až u 60 % detských pacientov. (9)
VIT patrí medzi jedinú kauzálnu terapiu alergie na jed blanokrídleho hmyzu, celková dlhodobá ochrana (t.j. navodenie tolerancie) je pri VIT včelím jedom až do 84 % a pri VIT osím jedom až do 96 %.(10) Podľa odporúčaní spoločnosti Európskej akadémie pre alergológiu a klinickú imunológiu (EAACI) je VIT bezpečná a efektívna u detských pacientov a môže významne zlepšiť ich kvalitu života ako aj ich príbuzných.(11) Alergia na jed blanokrídleho hmyzu sa môže objaviť v ktoromkoľvek veku, pričom bodnutie blanokrídlym hmyzom je častejšie zaznamenané u chlapcov.(12) VIT je obvykle indikovaná u detí starších ako 5 rokov, ktoré dokázateľne prekonali systémovú reakciu po bodnutí blanokrídlym hmyzom s prejavmi väčšími ako generalizovaná kožná reakcia.(2) Na bezpečnosť a efektívnosť VIT u detí pod 5 rokov stále nemáme dostatok údajov, avšak pri jasnej anamnéze systémovej reakcie je možné VIT indikovať aj pred dovŕšením 5. roku života.(13) Aj my sme indikovali VIT u dvoch detských pacientov mladších ako 5 rokov, bez rozdielov v tolerancii a výskyte nežiaducich účinkov v porovnaní s deťmi staršími ako 5 rokov.
Priemerná prevalencia výskytu vedľajších príhod je 28,9 %, z toho v 50,4 % ide o systémovú reakciu, v 10 % o veľkú lokálnu reakciu a v 35,8 % o lokálnu reakciu.(11) Viacej nežiaducich účinkov je zaznamenaných počas úvodnej fázy (s eskaláciou dávky) podávania VIT oproti pokračujúcej fáze (1,9 % vs. 0,5 % podaných injekcii).(14) V našom súbore sme zaznamenali najvyšší výskyt vedľajších príhod tiež počas podávania úvodnej fázy terapie (26 % pacientov z celkového súboru), pričom išlo najmä o lokálne reakcie v mieste vpichu (23 % pacientov počas úvodnej fázy; najvyššia prevalencia bola počas 4. podávania VIT, 40 % pacientov), veľkú lokálnu reakciu sme zaznamenali len u 1 pacienta, bez pozorovanej systémovej reakcie. Počas udržiavacej fázy VIT v našom súbore mali len 3 pacienti pozorovanú lokálnu reakciu (15 %), pričom veľká lokálna ani systémová reakcia sa nevyskytla.
Z hľadiska zmien koncentrácií celkových IgE v sére sa ukázalo ich zvýšenie po začatí a v prvých mesiacoch VIT s následným postupným poklesom, avšak až u 30 % pacientov zostávajú zvýšené aj po 3 rokoch trvania VIT.(15,16) V našom súbore pacientov došlo počas 6 mesiacov podávania taktiež ku poklesu celkových IgE, avšak na rozdiel od týchto zistení sme pozorovali opätovaný, hoci nesignifikantný nárast do konca druhého roka podávania VIT. Varga a kol. (2009) vytvorili skupinu pediatrických pacientov, u ktorých sledovali zmenu koncentrácii špecifických IgG4 (považovaných za tzv. blokujúce protilátky) počas 2 rokov podávania VIT a po jej ukončení. V tejto skupine pacientov bol signifikantný nárast špecifických IgG4 protilátok za 2 roky podávania VIT, ale neudržali sa trvalo zvýšené po jej ukončení. Tento signifikantný nárast špecifických IgG4 sme zaznamenali aj v našom súbore pacientov do 1. roku podávania, s následným miernym poklesom po 2. roku. Doposiaľ však nebolo dokázané, že by zvýšená koncentrácia špecifických IgG4 jednoznačne korelovala s klinickou odpoveďou na VIT a rozvojom tolerancie.(16) Koncentrácia špecifických IgE protilátok stúpa počas prvých mesiacov podávania VIT s návratom na bazálnu hodnotu okolo 1. roka podávania, v ďalšom priebehu podávania VIT majú tendenciu klesať (dokonca aj po ukončení VIT či bodnutí blanokrídlym hmyzom).(17) V našom súbore koncentrácia špecifických IgE (proti extraktom ako aj alergénovým komponentom) taktiež stúpala v priebehu 1. roku podávania s následným poklesom. Práve pokles koncentrácie špecifických IgE, ktorý je obvykle spojený s konkomitantným vzostupom špecifických IgG4, nám môže poskytnúť určitú orientáciu o zmene imunologickej reaktivity.(3) Koncentrácia eozinofilného kationického proteínu (ECP) v sére by mohla odrážať stupeň aktivácie cirkulujúcich eozinofilov.(18) V našom súbore detských pacientov sme pozorovali pokles koncentrácií ECP do konca druhého roka podávania VIT. Doposiaľ v literatúre nie je publikovaná žiadna štúdia, ktorá by odrážala zmenu koncentrácie ECP počas VIT. Je známa ale štúdia pri liečbe alergickej rinitídy klasickou alergénovou imunoterapiou, kde koncentrácia ECP počas imunoterapie klesala.(18) Naše výsledky nie je možné preto relevantne korelovať s publikovanými dátami. Predpokladáme však podobný pokles ECP aj pri VIT, čo by vychádzalo z podstaty mechanizmu alergénovej imunoterapie vo všeobecnosti.
Limitáciou našej štúdie a jej výsledkov je jednak menší súbor detských pacientov, z čoho môžu vyplývať rozdiely vo výsledkoch medzi našimi a porovnávanými skupinami pacientov, ako aj v súčasnosti nedostatočný počet pacientov, ktorí už ukončili VIT, pri ktorých by sme vedeli zhodnotiť jej dlhodobú pretrvávajúcu účinnosť.
Záver
Alergia na jed blanokrídleho hmyzu patrí v detskom veku medzi život ohrozujúce stavy. Jediná kauzálna terapia, ktorou môžeme pomôcť pacientovi a eliminovať riziko vzniku systémovej (anafylaktickej) reakcie, je VIT. V súčasnej dobe máme limitovaný počet štúdii, ktoré by zahŕňali dostatočný počet detských pacientov a zameriavali sa na efektivitu, toleranciu a zmenu laboratórnych parametrov počas podávania VIT, pričom väčšina odporúčaní vychádza z výsledkov pre dospelých pacientov. Ako prví na Slovensku sme charakterizovali skupinu pediatrických pacientov alergických na jed blanokrídleho hmyzu, ktorí boli nastavený na liečbu VIT. Naše skúsenosti podporujú dôležitosť využitia VIT u detských pacientov alergických na jed blanokrídleho hmyzu. Liečba je bezpečná ako aj účinná a vedie k pozitívnym zmenám laboratórnych imunologických parametrov naznačujúcich postupné navodenie imunitnej tolerancie. Každý detský pacient, u ktorého bola zaznamenaná systémová alergická reakcia po bodnutí blanokrídlym hmyzom, má byť odoslaný na špecializované alergologické vyšetrenie s posúdením indikácie a vhodnosti liečby venómovou imunoterapiou.
Korešpondenčná adresa:
prof. MUDr. Mgr. Miloš Jeseňák, PhD., FAAAAI
Klinika detí a dorastu JLF UK a UNM
Kollárova 2
036 01 Martin
milos.jesenak@uniba.sk
Sources
1. Hochmuth L, et al. Štandardné postupy diagnostiky, liečby a prevencie alergie na jed blanokrídleho hmyzu. Ministerstvo zdravotníctva Slovenskej republiky 2021. ŠP 0200.
2. Alvaro-Lozano M, et al. EAACI Allergen Immunotherapy User‘s Guide. Pediatr Allergy Immunol. 2020; 31(S25): 1–101.
3. Rybníček O, Seberová E. Průvodce alergenovou imunoterapií. Doporučení České alergologie a klinické imunologie ČLS JEP. Praha: Tigis 2021 : 58–64.
4. Golden DB. Insect allergy in children. Curr Opin Allergy Clin Immunol 2006; 6(4): 289–293.
5. Tan JW, Campbell DE. Insect allergy in children. J Paediatr Child Health 2013; 49(9): E381–E387.
6. Bilo MB, Bonifazi F. Epidemiology of insect-venom anaphylaxis. Curr Opin Allergy Clin Immunol 2008; 8(4): 330–337.
7. Hershko AY, et al. Hymenoptera-venom allergy in a single-center Israeli cohort: Clinical and laboratory characteristics. J Allergy Clin Immunol 2019; 7(8): 2898–2900.
8. Yavuz ST, et al. Clinical features of children with venom allergy and risk factors for severe systemic reactions. Int Arch Allergy Immunol 2013;160(3): 313–321.
9. Schuberth KC, et al. An epidemiologic study of insect allergy in children. I. Characteristics of the disease. J Pediatr 1982; 100 : 546–51.
10. Rueff F, et al. Predictors of clinical effectiveness of Hymenoptera venom immunotherapy. Clin Exp Allergy 2014; 44(5): 736–746.
11. Dhami S, et al. Allergen immunotherapy for insect venom allergy: a systematic review and meta‐analysis. Allergy 2017; 72(3): 342–365.
12. Lockey RF, et al. The Hymenoptera venom study. I. 1979–1982: demographic and history-sting data. J Allergy Clin Immunol 1988; 82 : 370–381.
13. Golden DB. Insect allergy in children. Curr Opin Allergy Clin Immunol 2006; 6 : 289–293.
14. Mosbech H, Mueller U. Side-effects of insect venom immuntherapy: results from an EAACI multicenter study. Allergy 2000; 55 : 1005–1010.
15. Durham SR, Till SJ. Immunologic changes associated with allergen immunotherapy. J Allergy Clin Immunol 1988; 102(2): 157–164.
16. Varga EM, et al. Time course of serum inhibitory activity for facilitated allergen-IgE binding during bee venom immunotherapy in children. Clin Experiment Allergy 2009; 39(9): 1353–1357.
17. Graft DF, et al. Assessment of prolonged venom immunotherapy in children. J Allergy Clin Immunol 1987; 80 : 162–169.
18. Nakai Y, et al. Effect of immunotherapy on serum levels of eosinophil cationic protein in perennial allergic rhinitis. Ann Otol Rhinol Laryngol 1997; 106(10): 848–853.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2023 Issue 6-
All articles in this issue
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Editorial
- Krátká a spontánně ustupující nevysvětlitelná zdravotní událost u novorozence a kojence (BRUE)
- Emočně nestabilní adolescenti – současná výzva dětské psychiatrie i pediatrie
- Zlepšila se prenatální ultrazvuková diagnostika vrozených vad ledvin?
- Bezpečnosť a zmeny vybraných laboratórnych parametrov u detí s alergiou na jed blanokrídleho hmyzu liečených venómovou imunoterapiou
- Současný stav zobrazení plodu magnetickou rezonancí
- Hypofosfatázie: Vzácné onemocnění s jednoduchou diagnostikou a dostupnou terapií
- Renální postižení u pediatrických pacientů se zánětlivým střevním onemocněním
- Prehypertenze a hypertenze u dětí a dospělých: vliv nadměrné konzumace soli a cukru
- Udělení Brdlíkovy ceny 2023
- Vzpomínka na Zdenku Misařovou a její rodinu
- Rodiny dětí s postižením mohou využívat bezplatnou službu rané péče
- Pediatrická poezie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Krátká a spontánně ustupující nevysvětlitelná zdravotní událost u novorozence a kojence (BRUE)
- Emočně nestabilní adolescenti – současná výzva dětské psychiatrie i pediatrie
- Současný stav zobrazení plodu magnetickou rezonancí
- Hypofosfatázie: Vzácné onemocnění s jednoduchou diagnostikou a dostupnou terapií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

