-
Medical journals
- Career
Imunitní trombocytopenie – zkušenosti jednoho centra
Authors: V. Fiamoli 1; J. Blatný 1; P. Ovesná 2
Authors‘ workplace: Oddělení dětské hematologie a biochemie, Fakultní nemocnice Brno 1; Institut biostatistiky a analýz s. r. o., Brno 2
Published in: Čes-slov Pediat 2021; 76 (8): 431-439.
Category: Original Papers
Overview
Cíl: Seznámení s možnostmi léčby a její úspěšností u pacientů s imunitní trombocytopenií z pohledu jednoho centra.
Pacienti a metody: V letech 2009 až 2019 bylo v ambulanci Oddělení dětské hematologie a biochemie FN Brno léčeno 153 dětí s imunitní trombocytopenií ve věku od 4 měsíců do 17 let, 79 chlapců a 74 dívek. Nově diagnostikovanou formu mělo 101 dětí (66 %), u 21 (14 %) dětí došlo k přechodu na formu perzistentní a u 31 (20 %) dětí ve formu chronickou.
Výsledky: U 52 (34 %) dětí byla dostačující léčba „watch and wait“. V době diagnózy bylo monoterapií intravenózními imunoglobuliny léčeno 72 (47 %) pacientů, steroidy 20 (13 %) dětí, konsekutivní léčbou intravenózními imunoglobuliny a steroidy 9 (6 %) dětí. Kompletní odpovědi dosáhlo 128 (84 %) pacientů, pouze částečné odpovědi 12 (8 %) pacientů a 13 (8 %) pacientů bylo bez odpovědi. Nebyly zaznamenány významné rozdíly v nejlepší dosažené odpovědi u chlapců a dívek, ani u dětí různého věku. Při hodnocení efektivity léčby steroidy versus intravenózními imunoglobuliny nebyl prokázán významný rozdíl v nejlepší dosažené odpovědi mezi těmito dvěma skupinami (p = 0,793). U 38 (25 %) pacientů došlo alespoň k jednomu relapsu onemocnění.
S perzistentní či chronickou imunitní trombocytopenií bylo léčeno trombopoetinovými analogy 14 (9 %) pacientů, rituximabem 4 (3%) pacienti, mykofenolát mofetilem 2 (1%) děti, sirolimem 2 (1 %) děti. Ke splenektomii jsme museli přistoupit pouze u tří (2 %) pacientů s chronickou imunitní trombocytopenií.
Závěr: Imunitní trombocytopenie je poměrně častá hematologická diagnóza dětského věku. Většina pacientů dosáhla alespoň parciální remise již po léčbě první linie. Pro děti s chronickou imunitní trombocytopenií v současné době existuje široké spektrum léčebných možností – trombopoetinová analoga, rituximab, mykofenolát mofetil, sirolimus a další imunosupresiva. Ke splenektomii se pro zvýšené riziko vzniku závažné infekce přistupuje jako k nejzazšímu řešení.
Klíčová slova:
deti – možnosti léčby – imunitní trombocytopenie
ÚVOD
Imunitní trombocytopenie (ITP) je definována jako pokles trombocytů pod 100 000/μl [1]. Patofyziologie tohoto onemocnění zahrnuje fixaci komplementu k destičkám pomocí antitrombocytárních protilátek [2], destrukci způsobenou cytotoxickými T lymfocyty, abnormality T a B lymfocytů s poruchou distribuce cytokinů a postiženou megakaryopoézu [3–5].
Podle etiologie lze rozdělit ITP na dvě základní skupiny: primární ITP a sekundární ITP. Primární ITP, původně klasifikovaná jako idiopatická, následuje po virové infekci nejčastěji respirační či gastrointestinální, popřípadě infekcích typu EBV, CMV, parvovirus, varicella [6, 7]. Příčinou sekundární ITP může být mnoho různých faktorů. Řadí se mezi ně specifické infekce, jako např. HIV, hepatitida C, Helicobacter pylori [8–10], léky – některá antibiotika, antivirotika, nesteroidní antiflogistika a vakcíny [11], dále může být sekundární ITP součástí imunodeficitů [12], autoimunitních onemocnění [13], autoimunitního lymfoproliferativního syndromu, ale i malignit – zejména lymfomů [14]. Vzácně se může projevit po opakovaných transfuzích [15] a také může být součástí Evansova syndromu – imunitní bi/tricytopenie [16].
Odhadovaná incidence primární ITP u dětí je 2 až 5 případů na 100 000 doposud zdravých dětí [17]. Podle doby trvání rozlišujeme ITP na nově diagnostikovanou, která trvá do 3 měsíců od stanovení diagnózy, perzistentní trvající 3–12 měsíců a chronickou trvající déle než rok. ITP se v dětském věku vyskytuje nejčastěji mezi 2.–8. rokem. Kojenci tvoří 10 % pacientů s ITP, dětí starších 10 let je přibližně 20 % [18].
Mezi nejčastější klinické projevy patří zejména kožní a slizniční krvácení. Epistaxe a metroragie jsou popisovány asi u 20 % dětí [19], závažná krvácení včetně melény a makroskopické hematurie se vyskytují u 3 % pacientů a pouze 0,5 % pacientů s ITP krvácí do centrální nervové soustavy (CNS) [20].
Pro stanovení diagnózy ITP neexistuje zcela specifický či jednoznačný laboratorní test. U pacientů s nově diagnostikovanou ITP se odebírá krevní obraz s mikroskopickým diferenciálním rozpočtem leukocytů a IPF (immature platelet fraction), základní biochemické vyšetření, včetně hladiny imunoglobulinů a koagulační screening. U pacientů s perzistentní a chronickou ITP je nutno doplnit sérologie EBV, CMV, Parvoviru B19, hepatitid, HIV HHV6, HSV, antigen Helicobacter pylori, protilátky proti trombocytům, v případě podezření na systémové onemocnění antinukleární protilátky anti-ENA, ANA, revmatoidní faktor, antifosfolipidové protilátky, protilátky proti štítné žláze a přímý i nepřímý antiglobulinový test a protilátky proti leukocytům k vyloučení autoimunitních cytopenií. Dále lze doplnit vyšetření kostní dřeně k vyloučení hematologické malignity [21, 22].
Podle nových mezinárodních doporučení mohou být pacienti s lehkým kožním krvácením pouze sledováni – strategie „watch and wait“ (tab. 1) buď za hospitalizace (např. při horší dostupnosti zdravotního zařízení či zvýšené úzkostlivosti rodičů), nebo ambulantně s pravidelnými kontrolami krevního obrazu, nejčastěji 1–2krát týdně. Děti se slizničním či jiným závažným krvácením by měly být léčeny za hospitalizace [22]. První linií léčby jsou intravenózní imunoglobuliny (IVIG) a kortikosteroidy. Mezi druhou linii léčby, kterou využíváme u pacientů s perzistující či chronickou ITP, patří trombopoetinová (TPO) mimetika (romiplostin a eltrombopag), rituximab a jiné imunosupresivní léky, např. mykofenolát mofetil, sirolimus či cyklosporin (tab. 2) [21, 22]. U pacientů rezistentních na medikamentózní léčbu, s nízkým počtem trombocytů a krvácivými projevy je další možností splenektomie, která se vzhledem k nezralosti imunitního systému a vysokému riziku infekcí nedoporučuje u dětí mladších 5 let [21, 22].
Table 1. Škála krvácení (zdroj: citace [22]). ![Škála krvácení (zdroj: citace [22]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/24b8a854264701989174e5b34bcde44e.jpg)
Hb – hemoglobin Table 2. Léčba ITP (upraveno volně dle citace [21, 22]). ![Léčba ITP (upraveno volně dle citace [21, 22]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f677c737058f004266734bc72ac2db22.jpg)
ITP – imunitní trombocytopenie, IVIG – intravenózní imunoglobuliny, TPO mimetika – trombopoetinová mimetika, RTX – rituximab,
MMF – mykofenolát mofetilSOUBOR A METODY
V letech 2009 až 2019 bylo v naší ambulanci léčeno 153 dětí s ITP ve věku od 4 měsíců do 17 let, 79 chlapců (52 %) a 74 dívek (48 %) viz graf 1. Průměrný věk v době stanovení diagnózy byl 5,8 let, medián 5 let. Kojenci tvořili 14 % pacientů, batolata a děti předškolního věku 46 % a děti starší 10 let 16 %.
Nově diagnostikovanou formu ITP manifestovalo 101 dětí (66 %), u 21 (14 %) došlo k přechodu na formu perzistentní a u 31 (20 %) dětí ve formu chronickou (graf 2). V našem souboru jsme retrospektivně posuzovali účinnost léčby při stanovení diagnózy a při prvním relapsu (pokles PLT pod 10x109/l). Parametrem hodnocení efektivity léčby bylo zvoleno dosažení kompletní (KO) či parciální odpovědi (PO). U pacientů s přístupem „watch and wait“ bylo hodnoceno pouze dosažení KO. U léčby druhé linie jsme posuzovali, zda léčba vedla u pacienta ke KO či PO, dlouhodobé remisi s možností úplného ukončení terapie, či v době sledování došlo opět k relapsu (pokles PLT pod 30x109/l), který vyžadoval další léčbu. Dále byly hodnoceny nežádoucí účinky jednotlivých léčebných modalit.
Graph 2. Typy ITP, ITP – imunitní trombocytopenie. 
Podle doporučení Americké hematologické společnosti pro léčbu ITP byla KO definována jako vzestup trombocytů nad 100x109/l, PO jako vzestup nad 30x109/l. Rychlost odpovědi na léčbu byla definována jako časná do 1 týdne od stanovení diagnózy, iniciální do 1 měsíce od stanovení diagnózy [23].
Kategoriální proměnné byly sumarizovány jako absolutní a relativní četnosti. K hodnocení a vizualizaci času do dosažení odpovědi byl použit Kaplanův-Meierův model; děti prozatím bez kompletní odpovědi byly cenzorovány k datu poslední návštěvy. Srovnání doby do dosažení odpovědi u více skupin bylo provedeno log-rank testem. Všechny testy byly provedeny jako oboustranné na 5% hladině významnosti. Analýza byla zpracována v programu R.
VÝSLEDKY
Iniciálně bylo léčeno monoterapií IVIG v dávce 1 g/kg 72 (47 %) pacientů, 45 (69 %) pacientů bylo léčeno 1 dávkou IVIG, 27 (41 %) pacientů 2 dávkami, pulzy methylprednisolonu (30 mg/kg) a následně prednison (1–2 mg/kg) per os byl podán 3 (2 %) dětem, pouze vysoce dávkovaný (4 mg/kg) p. o. prednison 8 (5 %) dětem a monoterapií prednison v dávce 1–2 mg/kg per os bylo léčeno 9 (6 %) pacientů. Konsekutivní léčbu IVIG a steroidy vyžadovalo 9 (6 %) dětí. Přístup „watch and wait“ byl dostačující u 52 (34 %) dětí.
Při léčbě nově diagnostikované ITP dosáhlo KO celkem 128 (84 %) pacientů, z nich 33 (26 %) již během týdne, 47 (37 %) během měsíce. Pouze PO dosáhlo 12 (8 %) pacientů – 10 (83 %) během týdne a 2 (17 %) během měsíce. Třináct (8 %) pacientů bylo bez odpovědi. Průměrný čas do KO byl 21 dní (minimum 1 den, maximum více než 6 let) (tab. 3, graf 3). Nebyly zaznamenány významné rozdíly v nejlepší dosažené odpovědi u chlapců a dívek ani dětí různého věku (tab. 4).
Table 3. Dosažená odpověď při léčbě nově diagnostikované ITP. 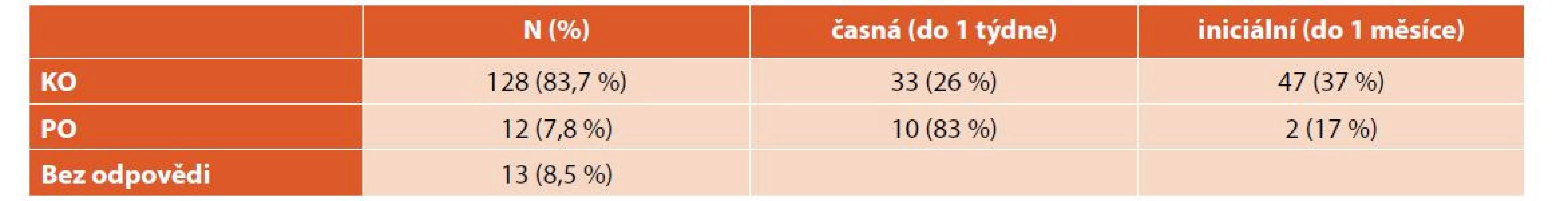
ITP – imunitní trombocytopenie, KO – kompletní odpověď, PO – parciální odpověď Graph 3. Dosažená odpověď při léčbě nově diagnostikované ITP. 
ITP – imunitní trombocytopenie, KO – kompletní odpověď, PO – parciální odpověď Table 4. Odpověď na léčbu nově diagnostikované ITP podle pohlaví a věku. 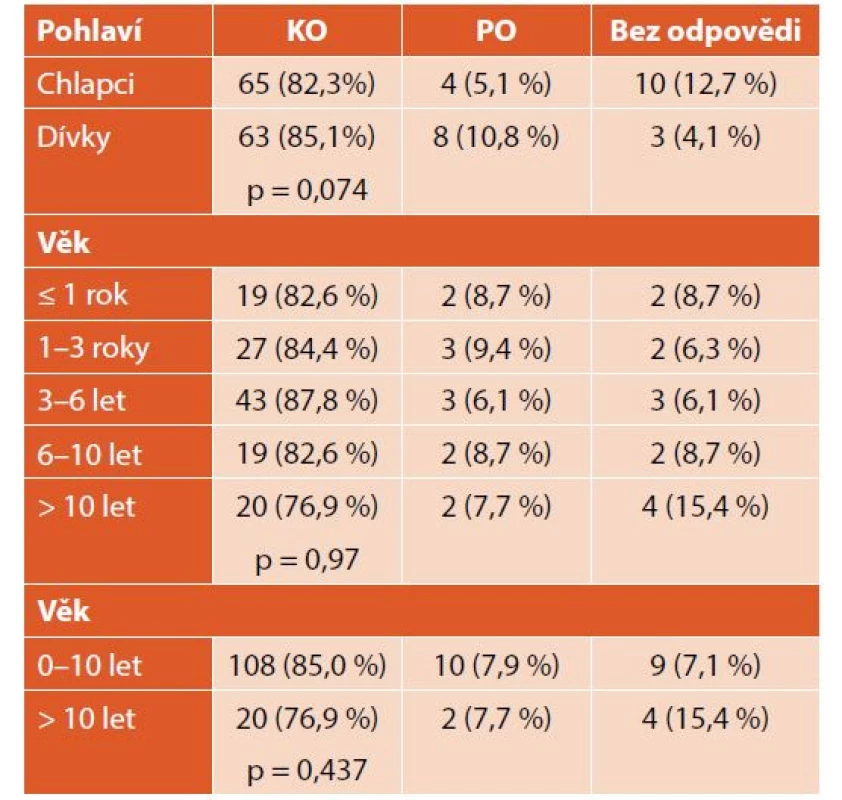
ITP – imunitní trombocytopenie, KO – kompletní odpověď, PO – parciální odpověď Při hodnocení efektivity léčby steroidy versus IVIG nebyl prokázán významný rozdíl v nejlepší dosažené odpovědi mezi těmito dvěma skupinami (p = 0,793), viz graf 4. Rozdílný byl ale medián času do dosažení KO, u IVIG byl 12,5 (8–18) dní, zatímco u steroidů 27,5 (13–285) dní. Rozdíl však nebyl statisticky významný.
Graph 4. Srovnání efektivity léčby steroidy a IVIG u nově diagnostikované ITP. 
ITP – imunitní trombocytopenie, KO – kompletní odpověď, PO – parciální odpověď,
IVIG – intravenózní imunoglobulinyU 38 (25 %) pacientů došlo alespoň k jednomu relapsu onemocnění. První relaps jsme léčili přípravky první linie (tab. 5). Pacienti s relapsem dosáhli při léčbě první linie častěji pouze PO než pacienti bez relapsu (p < 0,001), podrobněji v tabulce 6. Při léčbě prvního relapsu dosáhlo KO 25 (66 %), PO 6 (16 %) a bez odpovědi zůstalo 7 (18 %) pacientů (graf 5). Dva a více relapsů mělo 16 (11 %) pacientů, 4 (3 %) děti měly více jak 10 relapsů, nejvyšší počet relapsů byl 13.
Table 5. Léčba 1. linie prvního relapsu ITP. 
ITP – imunitní trombocytopenie, IVIG – intravenózní imunoglobuliny Table 6. Srovnání dosažené odpovědi u pacientů s relapsem a bez relapsu. 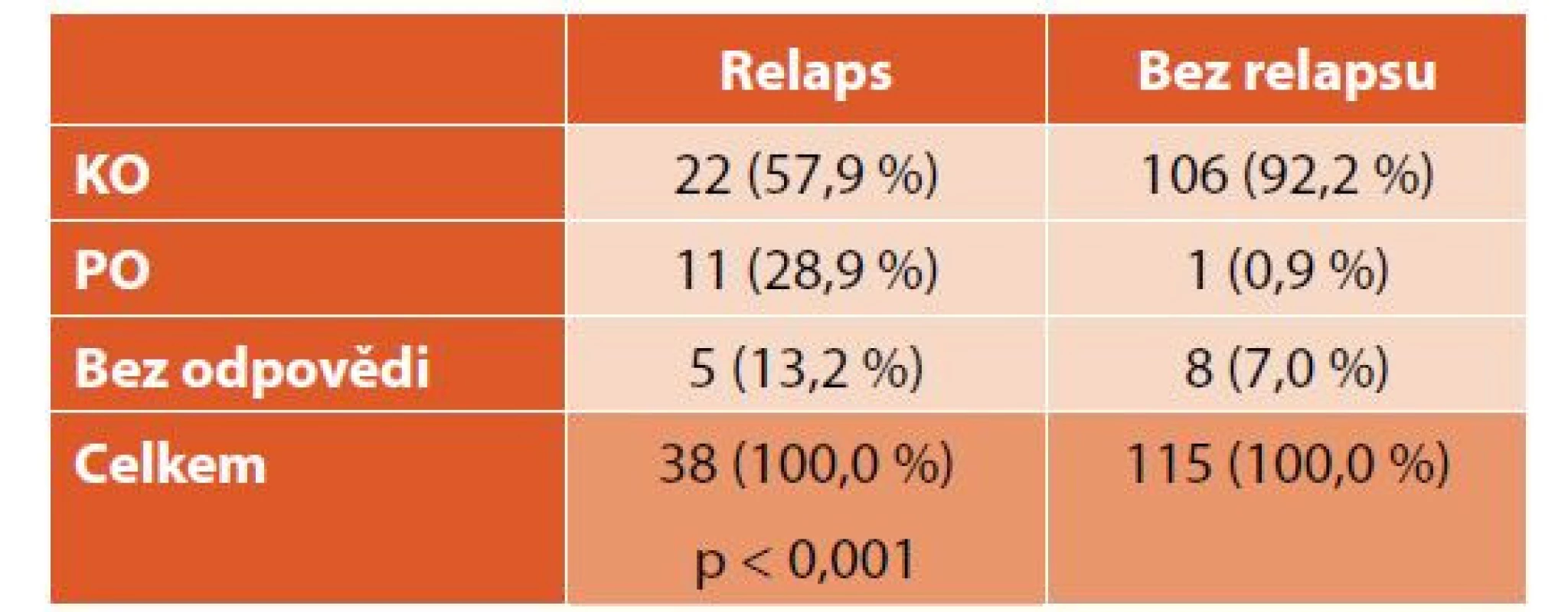
KO – kompletní odpověď, PO – parciální odpověď Graph 5. Odpověď na léčbu prvního relapsu. 
KO – kompletní odpověď, PO – parciální odpověď TPO analogy bylo léčeno celkem 14 (9 %) dětí, z toho 9 (64 %) romiplostinem a 5 eltrombopagem (36 %). Na léčbě romiplostinem 4 (44 %) děti dosáhly KO a léčba u nich mohla být ukončena, u 4 (44 %) pacientů měl přechodný efekt a 1 (12 %) dívka byla zcela bez odpovědi. Léčba eltrombopagem vedla ke KO a dlouhodobé remisi u 1 (20 %) pacienta, u 3 (60 %) pacientů měla přechodný efekt a 1 (20 %) pacientka na tuto léčbu vůbec nereagovala. Imunosupresivy bylo léčeno 8 (5 %) dětí, 4 (50 %) rituximabem, 2 (25 %) mykofenolát mofetilem a 2 (25 %) sirolimem. Léčba rituximabem vedla u jedné pacientky (25 %) ke KO a 5měsíční remisi, u 3 (75 %) pacientů neměla žádný efekt. Při léčbě sirolimem 1 (50 %) pacient dosáhl KO a 1 (50 %) PO. U obou pacientů byl efekt léčby pouze přechodný na dobu 2–3 měsíců. Léčba mykofenolát mofetilem nevedla u našich pacientů k žádné odpovědi.
Tři (2 %) z našich pacientů podstoupili splenektomii. U všech tří pacientů (jedna dívka a dva chlapci) byla splenektomie indikována pro závažnou formu ITP s hladinami trombocytů dlouhodobě nižšími než 5x109/l, a to i přes léčbu TPO mimetiky a imunosupresivy. U dívky vedla splenektomie k dlouhodobé remisi (déle jak 5 let), u jednoho chlapce k remisi na 2 roky, následně došlo opět k poklesu trombocytů vyžadujícímu léčbu a u jednoho chlapce neměla splenektomie žádný efekt (tab. 7).
Table 7. Léčba 2. linie. 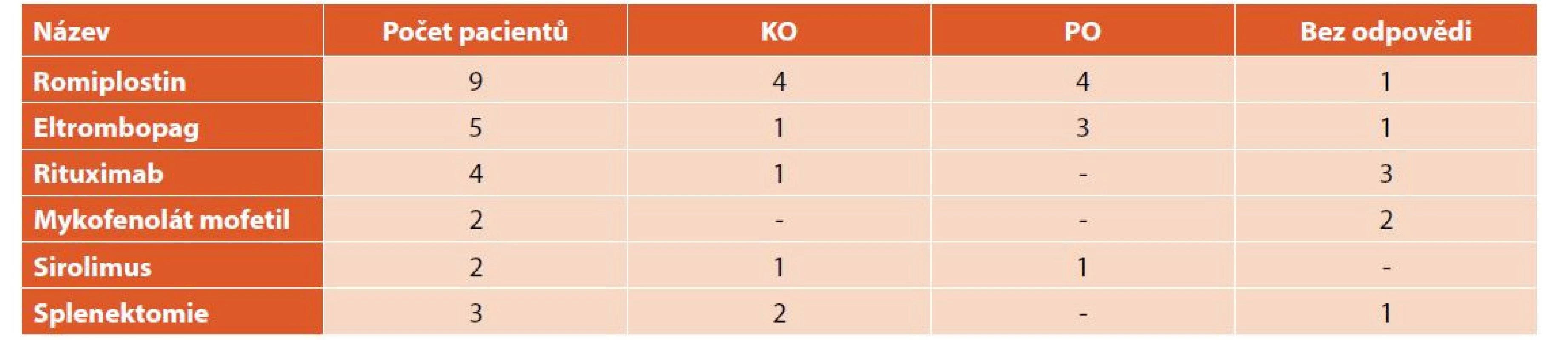
KO – kompletní odpověď, PO – parciální odpověď Závažné nežádoucí účinky léčby jsme zaznamenali pouze u 6 (4 %) pacientů léčených IVIG, jednalo se o bolesti hlavy či meningeální příznaky a 1 (1 %) pacientka na eltrombopagu měla zvýšené jaterní transaminázy.
DISKUSE
ITP je v dětské populaci relativně časté hematologické onemocnění, postihující převážně mladší děti mezi 2. a 8. rokem a v této věkové skupině je častější u chlapců [24]. V našem souboru byla četnost výskytu mezi dívkami a chlapci srovnatelná, ale stejně jako v práci publikované Terrelem, která se zabývala incidencí ITP [24], se i u našich pacientů ITP nejčastěji vyskytovala v kojeneckém, batolecím a předškolním věku. Tyto děti tvořily celkem 61 % všech pacientů. Chronická forma se vyvinula u 31 % dětí, což je na horní hranici publikovaných dat, která uvádí přechod do chronické formy u 20–30 % pacientů [24, 25]. I přes pokročilé diagnostické možnosti zůstává diagnostika ITP stále diagnózou „per exclusionem“. K vyloučení jiné příčiny trombocytopenie je důležitá pečlivá anamnéza a v úvodu zmiňovaná laboratorní vyšetření. Dříve bylo doporučováno vyšetřit kostní dřeň před zahájením léčby steroidy. S ohledem na recentní mezinárodní doporučení se od tohoto vyšetření, pokud klinický a laboratorní nález odpovídá ITP, ustupuje [22]. Na našem pracovišti u všech pacientů vstupně provádíme flowcytometrické vyšetření periferní krve k vyloučení potenciální hematologické malignity. Nová doporučení pro diagnostiku a léčbu ITP zavedla také změny v rozhodování o zahájení léčby, kdy se spíše přikláníme k posuzování krvácivých projevů než hladiny trombocytů [22]. V pediatrické populaci se závažná krvácení popisují u méně jak 10 % dětí a většinou mají tyto děti hladinu trombocytů nižší než 20 000/μl [26]. V našem souboru se závažná krvácení (epistaxe, makroskopická hematurie) vyskytla zcela raritně a vždy pouze při první atace ITP. Všichni tito pacienti měli hladiny trombocytů nižší než 5000/μl. Krvácení do zažívacího traktu či CNS jsme nezaznamenali vůbec. Dokonce ani u pacientů, kteří byli rezistentní na veškerou medikamentózní léčbu a několik let se jejich hodnota trombocytů pohybovala mezi 0–5000/μl, nedošlo k závažnějším krvácivým projevům, vyjma rozsáhlejšího kožního krvácení, a to zejména po inzultu. U jednoho z těchto pacientů docházelo po celou dobu onemocnění spontánně pouze ke zcela diskrétnímu výsevu petechií na bércích.
Standardem léčby nově diagnostikované ITP jsou IVIG a steroidy. Po podání IVIG by mělo dojít k rychlejšímu vzestupu hodnot trombocytů než při podání steroidů. Nicméně dlouhodobý efekt jejich léčby je srovnatelný [27]. Naši pacienti s nově diagnostikovanou ITP, kteří byli léčeni steroidy či IVIG, dosáhli ve více než 90 % minimálně PO. Rozdílný byl ale jejich medián času do dosažení KO, který byl u IVIG 12,5 (8–18) dní, zatímco u steroidů 27,5 (13–285) dní.
Za první volbu terapie druhé linie u perzistentní a chronické ITP jsou pro svou efektivitu, ale i bezpečnost s minimem nežádoucích účinků v současné době považována TPO mimetika [22]. Léčba romiplostinem je schválena pro dětské pacienty s chronickou ITP, revolade lze využít již pro pacienty s perzistující ITP.
Podle dostupných studií má 40 % dětí dlouhodobou (nad 6 měsíců) odpověď na léčbu eltrombopagem [28, 29] a 50 % na léčbu romiplostinem [30]. U většiny našich pacientů (80 % u eltrombopagu a 90 % u romiplostinu) vedla léčba TPO mimetiky k vzestupu trombocytů. Dlouhodobý efekt léčby v rozmezí 2–5 let jsme pozorovali u jednoho pacienta na eltrombopagu a u 4 pacientů na romiplostinu. Všichni naši pacienti na eltrombopagu vyžadovali maximální dávku 75 mg. Průměrná dávka romiplostinu u pacientů dobře odpovídajících na tento lék byla 7,5 μm/kg. Odlišný způsob podávání eltrombopagu a romiplostinu vyhovuje různým věkovým skupinám. Menší děti spíše preferují perorální podávání eltrombopagu. Větší děti, u nichž je již překonán strach ze subkutánní aplikace, upřednostňují romiplostin, který je aplikován pouze jednou týdně. Dietní opatření spojená s užíváním eltrombopagu výrazně nelimitovala ani jednoho pacienta.
Monoklonální protilátka rituximab je u ITP stále léčbou off label, na kterou zareaguje 23–69 % dětí [31–33], relaps do jednoho roku od zahájení léčby se vyskytuje u 14 až 42 % pacientů, dlouhodobá odpověď je zaznamenána pouze u 26 % pacientů [32–34]. Podle dat publikovaných Mianem v roce 2016 má mykofenolát mofetil lepší odpověď u pacientů s Evansovým syndromem než u pacientů s ITP, pravděpodobně na podkladě možné přídatné imunologické poruchy, u které by tento typ léčby mohl být přínosný [35].
Dalším z dobře tolerovaných imunosupresivních léků je sirolimus. Podle retrospektivních studií vede ke kompletní odpovědi u 60 až 83% dětských pacientů [36,37], nebyly u něj zaznamenány žádné zásadní nežádoucí účinky a navíc byla tato léčba úspěšná i u pacientů rezistentních na mykofenolát mofetil [37]. V našem centru jsme imunosupresivy léčili jen 8 (5 %) dětí. Tři z nich dosáhly alespoň parciální remise, ale u všech byl efekt léčby přechodný s maximem 5 měsíců. U 5 dětí nevedlo podání imunosupresiv k jakémukoliv vzestupu trombocytů.
Nežádoucí účinky léčby ITP u pacientů v našem souboru nebyly závažného charakteru. Při dlouhodobé léčbě steroidy jsme u většiny pacientů pozorovali pouze standardní nežádoucí účinky [38] – cushingoidní habitus, část dospívajících děti měla akné a u jednoho předškolního chlapce maminka zaznamenala změny nálad s většími emočními výkyvy. IVIG vyvolaly nežádoucí reakci pouze u 4 % pacientů. Jednalo se o bolesti hlavy a třesavku, 2 dívky měly i meningeální příznaky. I přesto, že se u podávání rituximabu popisuje možnost vzniku četných nežádoucích účinků od alergické reakce, přes horečku, atralgii, pneumonii, meningoencefalitidu, až po možnost vzniku běžného imunodeficitu s prolongovanou hypogamaglubilinemií a rizikem vzniku závažných infekcí [39], ani jeden z našich pacientů žádný z těchto nežádoucích účinků neměl. Podle studie PETIT může dojít při léčbě eltrombopagem ve 4,7 % k elevaci alaninaminotransferázy (ALT) [40]. Pětinásobné zvýšení ALT vedlo u jedné naší pacientky k ukončení léčby eltrombopagem. U jedné dívky užívající mykofenolát mofetil, u jednoho chlapce na sirolimu a u jednoho pacienta při užívání eltrombopagu jsme během léčby zaznamenali subjektivní pocit osobního diskomfortu. Současné možnosti léčby ITP umožňují u dětí volit splenektomii až jako poslední léčebnou možnost, a to pouze u pacientů, jejichž krvácivé projevy je ohrožují na zdraví či na životě.
Snažíme se tímto vyvarovat riziku rozvoje závažných infekcí u pacientů po splenektomii a při našem rozhodování hrají nezanedbatelnou roli i obavy rodičů či pacienta z operačního zákroku a jeho možných komplikací. Na našem pracovišti jsme splenektomii indikovali pouze u 3 pacientů rezistentních na dostupnou medikamentózní léčbu a dlouhodobě úspěšná byla pouze u 1 dívky. Dalo by se spekulovat, že i díky výběru pacientů je efekt splenektomie u našich pacientů horší než v publikované literatuře, která uvádí úspěšnost splenektomie u dětí mezi 65–75 % [41].
ZÁVĚRY
Možnosti léčby ITP u dětí jsou v současné době široké. Z našich dat vyplývá, že léčba ITP steroidy a IVIG je dostatečná u více než 70 % pacientů a srovnatelně efektivní. V minulých deseti letech se léčebné spektrum u dětí rozšířilo o TPO mimetika, která mají velmi dobrý efekt u většiny pacientů. Limitujícím faktorem je, že dle souhrnu údajů o léčivém přípravku lze romiplostin podat pouze u dětí s chronickou ITP a revolade sice již u dětí s perzistentní ITP, ale nejdříve 6 měsíců od stanovení diagnózy. Imunosupresivní léčbu, respektive splenektomii, ponecháváme jako poslední léčebnou možnost.
I přesto, že je počet pacientů, kteří jsou rezistentní vůči veškeré dostupné léčbě, ze statistického pohledu zanedbatelný, dopad neúspěšnosti léčby na psychiku těchto pacientů a jejich rodin je mnohdy velmi závažný a vyžaduje péči psychologa. Naději v další léčbě vidíme u léků, které jsou nyní dostupné pouze pro léčbu ITP u dospělých, např. Avatrombopag či Fostamatinib.
Nezanedbatelnou součástí péče o pacienty s ITP je kvalita jejich života. Naším cílem je dosáhnout bezpečné hladiny trombocytů, tj 50 000/μl, čímž se sníží riziko krvácení při běžných aktivitách na minimum.
Zkratky:
ALT – alaninaminotransferáza
CNS – centrální nervový systém
ITP – imunitní trombocytopenie
IVIG – intravenózní imunoglobuliny
KO – kompletní odpověď
PO – parciální odpověď
TPO – trombopoetin
Došlo: 20. 4. 2021
Přijato: 22. 9. 2021
Korespondující autorka:
MUDr. Veronika Fiamoli, Ph.D.
Oddělení dětské hematologie a biochemie
Dětská nemocnice Fakultní nemocnice Brno
Černopolní 9
613 00 Brno
e-mail: fiamoli.veronika@fnbrno.cz
Sources
1. Consolini R, legitimo A, Caparello MC. The cebtenary of imune thrombocytopeniea – Part 1: Revising nomenclature and pathogenesis. Front Pediatr 2016; 4 : 102.
2. Kuwana M. Dysregulated negative immune regulators in immune thrombocytopenia. VOX 2014; 9 : 217–222.
3. Cooper N, Bussel J. The pathogenesis of immune thrombocytopaenic purpura. Br J Haematol 2006; 133 (4): 364–374.
4. Johnsen J. Pathogenesis in immune thrombocytopenia: new insights. Hematology Am Soc Hematol Educ Program 2012; 2012 : 306–312.
5. Olsson B, Andersson PO, Jernas M. T-cell mediated cytotoxicity towards platelets in chronic idiopathic thrombocytopenic purpura. Nat Med 2003; 9 (9): 1123–1124.
6. Yenicesu I, Yetgin S, Ozyurek E, Aslan D. Virus-associated immune thrombocytopenic purpura in childhood. Pediatr Hematol Oncol 2002; 19 (6): 433–437.
7. Smalisz-Skrzypczyk K, Romiszewski M, Matyasiak M, et al. The influence of primary cytomegfalovirus or Epstein-Barr virus infection on course of idiopathic trombocytopenic purpura. Adv Exp Med Biol 2016; 878 : 83–88.
8. Shah I. Immune thrombocytopenic purpura: a presentation of HIV infection. J Int Assoc Provid AIDS Care 2013; 12 (2): 95–97.
9. Pacifico L, Osborn JF, Tromba V, et al. Helicobacter pylori infection and extragastric disorders in children: a critical update. Worl J Gastroenterol 2014; 20 (6): 1379–1401.
10. Sakuraya N, Murakami H, Uchiumi H, et al. Steroid-refractory chronic idiopathic thrombocytopenic purpura associated with hepatitis C virus infection. Eur J Haematol 2002; 68 (1): 49–53.
11. Reese JA, Nguyen LP, Buchanan GR, et al. Drug-induced thrombocytopenia in children. Pediatr Blood Cancer 2013; 60 (12): 1975–1981.
12. Notarangelo LD. Primary immunodeficiencies (PIDs) presenting with cytopenias. Haematology Am Soc Hematol Educ Program 2009; 1 : 139–143.
13. Liu Y, Chen S, Sun Y, et al. Clinical characteristic of immune thrombocytopenia associated with autoimmune disease: a restrospective study. Medicine 2016; 95 (50): e5565.
14. Stern M, Buser AS, Lohri A, et al. Autoimmunity and malignancy in hematology – more than an association. Crit Rev Oncol Hematol 2007; 63 (2): 100–110.
15. Kashyap E, Venkatesh S, Chouldry VP. Post transfusion purpura in thalassemic child. Indian Pediatr 1997; 34 (3): 246–247.
16. Jaime-Perez JC, Aguilar-Calderon PE, Salazar-Cavazos L, Gomez-Almaguer D. Evans syndrome: clinical perspectives, biological insights and treatment modalities. J Blood Med 2018; 9 : 171–184; 3 : 158–169.
17. Consolini R, Legitimo A, Caparello MC. The centenary of immune thrombocytopenia – Part 2: Revising diagnostic and therapeutic approach. Front Pediatr 2017; 5 : 179.
18. Neunert C, Buchanan GR, Imbach P, et al. Intercontinental childhood ITP study Group Registry II Participants. Severe hemorrage in children with newly diagnosed immune thrombocytopenic purpura. Blood 2008; 112 (10): 4003–4008.
19. Imbach P, Kuhne T, Muller D, et al. Childhood ITP: 12 months follow-up data from prospective registry I of the Intercontinental Childhood ITP Study Group (ICIS) Pediatr Blood Cancer 2006; 46 (3): 351–356.
20. Rosthoj S, Rajante J, Treutiger I, et al. NOPHO ITP working group. Duration and morbidity of chronic immune thrombocytopenic purpura in children: five years follow-up of a Nordic cohort. Acta Paediatr 2012; 101 (7): 761–766.
21. Kozák T, Čermák J, Červinek L, et al. Doporučení ČHS pro diagnostiku a léčbu imunitní trombocytopenie. Transfuze Hematol Dnes 2017; 3 : 158–169.
22. Provan D, Arnold DM, Bussel JB, et al. Updated international consensus report on the investigation and management of primary immune thrombocytopenia. Blood Adv 2019; 3 (22): 3780–3817.
23. Neunert C, Terrell DR, Arnold AM, et al. American Society of Hematology 2019 guidelines for immune thrombocytopenia. Blood Adv 2019; 3 (23): 3829–3866.
24. Terell DR, Beebe LA, Vesely SK, et al. The incidence of immune thrombocytopenic purpura in children and adults: A critical review of published reports. Am J Hematol 2010; 85 (3): 174–180.
25. Heitink-Polle KM, Nijsten J, Boonacker CW, et al. Clinical and laboratory predictors of chronic immune thrombocytopenia in children: a systematic review and meta-analysis. Blood 2014; 124 (22): 3295.
26. Kühne T. Diagnosis and management of immune thrombocytopenia in childhood. Hämostaseologie 2017; 37 : 36–44.
27. Celik M, Bulbul A, Aydogan G, et al. Comparison of anti-D immunoglobulin, methylprednisolone, or intravenous immunoglobulin therapy in newly diagnosed pediatric immune thrombocytopenic purpura. J Thromb Thrombolysis 2013; 35 (2): 228–233.
28. Bumess CB, Keating GM, Garnock-Jones KP. Eltrombopag: A review in pediatric chronic immune thrombocytopenia. Drugs 2016; 76 (8): 869–878.
29. Grainger JD, Locatelli F, Chotsampancharoen T, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet 2015; 386 (10004): 1649–1658.
30. Bussel JB, Hsieh L, Buchanan GR, et al. Long-term use of thrombopoietin mimetic romiplostim in children with severe chronic thrombocytopenia (ITP). Pediatr Blood Cancer 2015; 62 : 208–213.
31. Grace RF, Bennett CM, Ritchey AK, et al. Response to steroids predicts response to rituximab in pediatric chronic immune thrombocytopenia. Pediatr Blood Cancer 2012; 58 (2): 221–225.
32. Parodi E, Rivetti E, Amendola G, et al. Long-term follow-up analysis after rituximab therapy in children with refractory symptomatic ITP: identification of factors predictive of a sustained response. Br J Haematol 2009; 144 (4): 5 52–558.
33. Mueller BU, Bennett CM, Feldman HA, et al. Glaser Pediatric Research Network. One year follow-up of children and adolescents with chronic immune thrombocytopenic purpura (ITP) treated with rituximab. Pediatr Blood Cancer 2009; 52 (2): 259–262.
34. Patel VL, Mahevas M, Lee SY, et al. Outcomes 5 years after response to rituximab therapy in children and adults with immune thrombocytopenia. Blood 2012; 119 (25): 5989–5995.
35. Miano M, Ramenghi U, Russo G, et al. Mycophenolat mofetil for the treatment of children with immune thrombocytopenia and Evans syndrome. A retrospective data review from the Italian Association of Paeditatric Haematology/Oncology. Br J Haematol 2016; 175 : 490–495.
36. Jasinski S, Weinblatt ME, Glasser CL. Sirolimus as an effective agent in the treatment of immune thrombocytopenia (ITP) and Evans syndrome (ES): a single institution’s experience. J Pediatr Hematol Oncol 2017; 39 (6): 420–424.
37. Miano M, Scalzone M, Perri K, et al. Mycophenolate mofetil and sirolimus as second or further line treatment in children with chronic refractory primitive or secondary autoimmune cytopenias: a single centre experience. Br J Haematol. 2015; 171 : 247–253.
38. Rudolf K, Malý J. Kortikosteroidy a imunosupresiva v chronické léčbě. Prakt Lékáren 2011; 7 (5): 228–231.
39. Bennet CM, Rogers ZR, Kinnamon DD, et al. Prospective phase ½ study of rituximab in childhood and adolescent chronic immune thrombocytopenic purpura. Blood 2006; 107 : 2639–2642.
40. Bussel JB, de Miguel PG, Despotovic JM, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo - controlled study. Lancet Haematol 2015 Aug; 2 (8): e315–e325.
41. Rubin LG, Schaffner W. Clinical practice. Care of asplenic patient. N Engl J Med 2014; 371 (4): 349–356.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 8-
All articles in this issue
- Imunitní trombocytopenie – zkušenosti jednoho centra
- Langerhansova histiocytóza v dětském věku
- Zemřel MUDr. František Schneiberg
- Pneumokoková infekční endokarditida nativní aortální chlopně u 5letého chlapce očkovaného pneumokokovou vakcínou
- Genu recurvatum congenitum
- Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
- História invazívneho merania tlaku krvi
- Česká lékařská společnost Jana Evangelisty Purkyně k elektronizaci zdravotnictví
- Správa o 36. Celoštátnej konferencii Spoločnosti dorastového lekárstva s medzinárodnou účasťou a 2. Šašinkovom memoriáli v dňoch 17.–18. septembra 2021 na Starých Horách
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
- História invazívneho merania tlaku krvi
- Genu recurvatum congenitum
- Imunitní trombocytopenie – zkušenosti jednoho centra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


