-
Medical journals
- Career
Vrozená plicní malformace dýchacích cest
Authors: J. Micherová 1; P. Rejtar 2; B. Frýbová 3; Hubert Vaníček 1
Authors‘ workplace: Dětská klinika LF a FN Hradec Králové 1; Radiologická klinika LF a FN Hradec Králové 2; Klinika dětské chirurgie 2. LF UK a FN Motol, Praha 3
Published in: Čes-slov Pediat 2021; 76 (5): 240-245.
Category: Original Papers
Overview
Vrozená plicní malformace dýchacích cest se svou incidencí 1 : 25–35 000 řadí mezi nejčastější vrozené anomálie plic. V menší míře je zastoupena plicní sekvestrace. Někdy se navzájem kombinují jako léze hybridní. Patří do diferenciální diagnostiky nejasných plicních lézí v každém věku. Lze je snadno diagnostikovat prenatálně ultrazvukem. Klinická manifestace je různá, od asymptomatických vad po respirační selhání dítěte. Terapeutický přístup se liší v závislosti na symptomech, velikosti a druhu vady či zvyklosti daného pracoviště.
Klíčová slova:
vrozená plicní malformace dýchacích cest – CPAM – vrozené cystické adenomatoidní malformace – CCAM – kongenitální hrudní malformace – CTM – kongenitální plicní masy – CLM – plicní sekvestrace – PS
ÚVOD
Vrozená malformace plic a dýchacích cest (congenital pulmonary airway malformations, CPAM), dříve nazývaná vrozená cystická adenomatoidní malformace (congenital cystic adenomatoid malformation, CCAM), dnes používaný termín pouze po histologické verifikaci [1], se řadí do skupiny kongenitálních hrudních malformací (congenital thoracic malformation, CTM) [2], jinde nazývané kongenitálními plicními masami (congenital lung masses, CLM) [3]. Ty dále zahrnují plicní sekvestraci (pulmonary sequestration, PS), cystu předního střeva (foregut cyst, FC), která se dále dělí na bronchogenní cystu a vlastní cystu předního střeva [2]. Mezi CTM také někdy řadíme kongenitální lobární emfyzém (congenital lobar overinflation, CLO) [3]. Klasifikace není dodnes jednotná.
Ve svém dělení se vady mohou navzájem kombinovat, vznikají tzv. hybridní léze (nejčastěji CPAM-PS), nebo-li také vady tzv. sekvestračního spektra, jejichž podmínkou je cévní zásobení ze systémového oběhu. Text shrnuje dosavadní informace o diagnostice a léčbě/řešení CPAM a PS.
PRENATÁLNÍ DIAGNOSTIKA A MANAGEMENT
Velkou většinu vad lze diagnostikovat prenatálně na základě ultrazvuku (UZ). Jedná se o hyperechogenní heterogenní tkáň s anechogenními cystami. Takto diagnostikovanou vadu by měl sonografista popsat následovně:
1. Lokalizace a velikost vady s porovnáním některého z dalších fetálních rozměrů. Nejčastěji se používá poměr objemu masy vztažené k obvodu hlavy (congenital pulmonary airway malformation volume ratio, CVR) [3].
2. Struktura (velikost cyst, které se do 0,5 cm popisují jako léze mikrocystické či solidní, nad 0,5 cm jako makrocystické).
3. Cévní zásobení vady pomocí dopplerovského monitorování.
4. Okolní struktury, ev. přesun mediastina.
Diferenciální diagnostiku fetálních nitrohrudních lézí shrnuje tabulka 1 [2]. Samozřejmostí je záznam a pátrání po přidružených vadách v jiných orgánech. Význam prenatální magnetické rezonance nad UZ je v diagnostice obstrukce velkých dýchacích cest (DC) [2], dále v případě malformace vyplňující celou plíci, bilaterálních lézí, hydropsu a nejasnostech. Optimálním načasováním je 20.–22. týden gestace tak, aby byl dostatek času pro konzultaci dalšího postupu. Postnatální zobrazení umožňuje většinou podrobnější analýzu vady. Nadále platí, že radiologická „diagnóza“ je popisná, měli bychom se vyvarovat předčasným závěrům – určení druhu vady je záležitostí až histologického vyšetření, tedy po chirurgickém odstranění malformace. Názvosloví rozlišující klinickou a patologickou jednotku je shrnuto v tabulce 2 [2].
Table 1. Diferenciální diagnostika fetálních nitrohrudních lézí (převzato z Kendig and Chernick‘s Disorders of the Respiratory Tract in Children, 9th ed.). 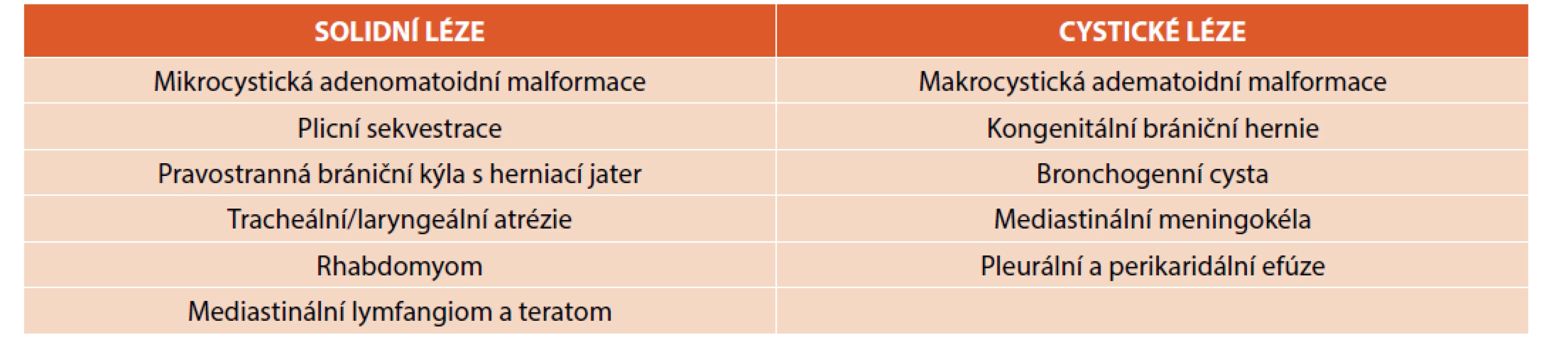
Table 2. Porovnání nové (klinické) a staré (patologické) nomenklatury vrozených vývojových vad plic (upraveno z Kendig and Chernick‘s Disorders of the Respiratory Tract in Children, 9th ed.). 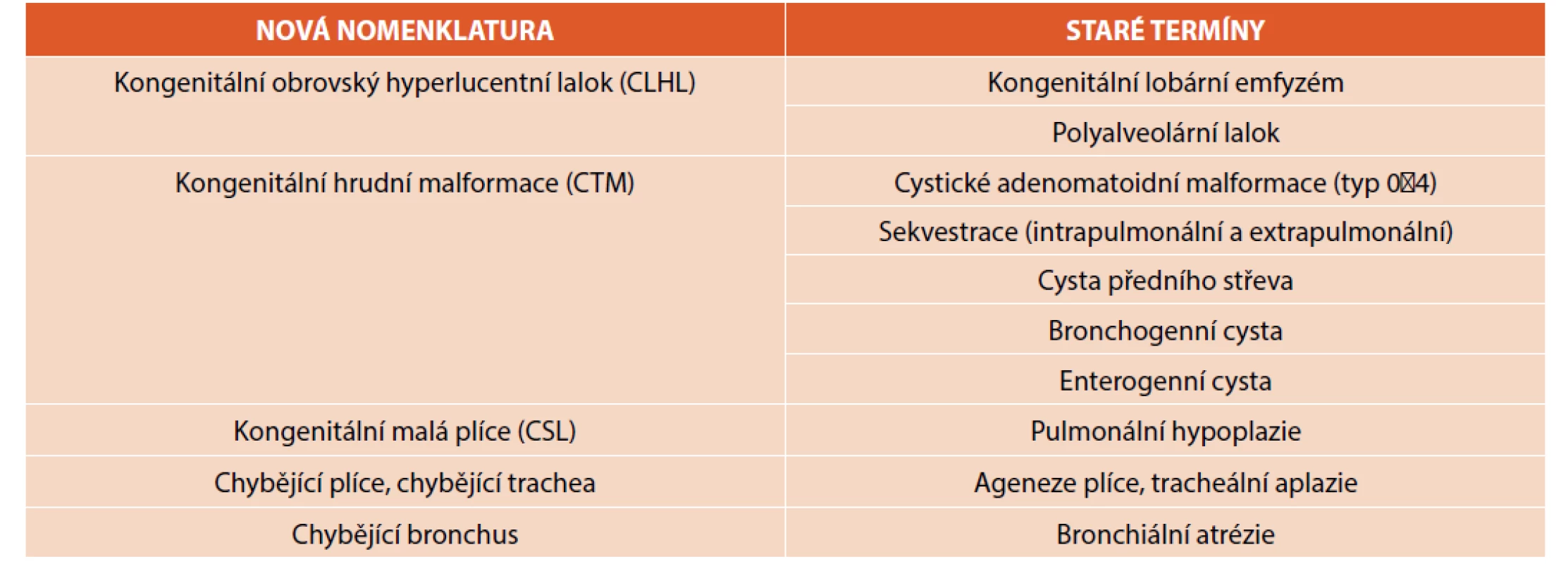
Incidence CTM je dle The European Surveillance of Congenital Anomalies (EUROCAT) 4,44 : 10 000 (zahrnující živě narozené děti, úmrtí in utero a přerušená těhotenství) [2].
Klinický obraz je variabilní. Prenatálně se vada nemusí manifestovat vůbec, je pouze zachycena UZ vyšetřením plodu v rámci screeningu. Současně může být přítomen pleurální výpotek (většinou na straně vady), oligohydramnion (sekundárně), polyhydramnion (při útlaku jícnu malformací) až hydrops fetalis a úmrtí plodu (při významném cévním útlaku, např. v. cava inferior, hemodynamických změnách při přesunu mediastina nebo významném cévním zkratu). Postnatálně může být malformace také asymptomatická, nebo se může projevit různou závažností od stridoru při útlaku DC po těžkou dušnost s cyanózou při významném útlaku DC a/nebo plicního parenchymu či při jeho hypoplazii způsobenou malformací/výpotkem aj. Dušností se může manifestovat i významný nejčastěji arteriovenózní (aortopulmonální) zkrat některých vad vedoucí k srdečnímu selhávání. Ostatní projevy sdružených cévních anomálií se odvíjejí od typu a významnosti zkratu. Cystické abnormality se mohou již časně postnatálně komplikovat infekcí v místě malformace nebo se mohou chovat expanzivně a připomínat vrozený plicní emfyzém.
Ve starším věku se na vadu většinou přijde náhodně při zobrazení hrudníku z jiného důvodu nebo se opět manifestuje infekcí, tedy pneumonií v místě malformace, kdy nedojde ke zhojení a ústupu radiologického nálezu ani po klinické úzdravě a následně dochází k recidivám pneumonií ve stejném místě. Někdy se může v místě vyvinout plicní absces, atelektáza či bronchiektázie. Výjimečně se vada manifestuje hemoptýzou při systémovém cévním zásobení nebo pneumothoraxem. Zcela ojediněle dochází v dětském, ale i dospělém věku k malignímu zvratu a projevům z plicního nádoru.
Etiologie těchto vad je málo známa, nejčastěji se jedná o izolovanou vadu, někdy v kombinaci s extrapulmonálními vadami, aneuploidie se s CTM nepojí. Může dojít k hydropsu plodu a úmrtí in utero. Zjištěný hydrops, oligohydramnion či polyhydramnion, eventrace bránice, cystická predominance a CVR > 1,6 jsou špatnými prognostickými známkami [3–6]. Na druhou stranu není ale neobvyklá ani spontánní involuce vady in utero (až v 50 % [1]), která je častější u PS, zejména extralobární, kde jsou popsány i případy postnatální involuce [1]. Jinak je postnatální involuce cystické vady neobvyklá, pravděpodobněji se jedná o obraz tranzientní bronchiální obstrukce [1].
Prenatální management CTM se odvíjí od gestačního stáří, velikosti malformace, závažnosti přesunu mediastina, fetální hemodynamiky a zjištěných přidružených vad [3]. U většiny malformací postačí sledování, prenatální UZ se doporučuje každé 1–4 týdny podle velikosti malformace a gestačního stáří. Ze studií sledujících růst vady (CPAM) vyplývá, že nejrychlejšího růstu dosahují mezi 20.–26. týdnem gestace, poté většinou svou velikost nemění nebo regredují, až zcela vymizí (až 15 %) [3], výjimečně se ještě zvětšují, rozvoj hydropsu je ale po 28. týdnu neobvyklý. Makrocystické léze rostou rychleji než mikrocystické či solidní [3, 5, 6].
Jako nejméně invazivní prenatální zásah při zjištěném či hrozícím hydropsu plodu a metoda první volby je podání betametazonu matce s dobrou odpovědí cca v 50 % případů [2]. Jiná pracoviště indikují betametazon pouze u mikrocystických lézí pro nedostatečný efekt u makrocystických [1]. Z dalších možností připadá v úvahu intrauterinní torakocentéza nebo zavedení shuntu k dekompresi většinou objemné cysty, fetální skleroterapie pomocí ethanolamin oleátu nebo aethoxysklerolu a/nebo radiofrekvenční ablace [2]. Jsou popsány i pokusy o úplné odstranění malformace in utero. Tyto metody jsou ale zatíženy vysokou mortalitou plodu. Samozřejmostí je genetické vyšetření fetu před chirurgickou prenatální intervencí. V případě výskytu rizikových faktorů se porody směřují do perinatologických center ke komplexní postnatální péči. Publikovány byly i vcelku příznivé výsledky chirurgického řešení intra partum (EXIT – ex utero intrapartum treatment) [3, 6, 7]. Hydropické plody starší 32.–34. týdne gestace jsou indikovány k předčasnému porodu a následné časné chirurgické intervenci, postnatální nebo EXIT s možností zajištění extrakorporální membránové oxygenace (ECMO). S hydropsem mortalita stoupá až k 90 %, nejčastější příčinou úmrtí je plicní hypoplazie [7].
POSTNATÁLNÍ DIAGNOSTIKA A MANAGEMENT
Po narození je vždy indikováno zobrazení hrudníku, i v případě „sonografické“ spontánní involuce malformace in utero. K přesnému zobrazení CTM je optimální metodou volby CT hrudníku s angiografií. Otázkou zůstává timing vyšetření. Zde se jednotlivá pracoviště liší. Někteří provádějí CT již po narození [2, 8], jinde ve 3–4 měsících věku [9–11], v 6 měsících věku [7, 12] a následně vadu resekují. Pražská škola, kde tyto postupy zaváděl prof. Šnajdauf, doporučuje u neurgentních stavů CT až ve 4 letech s následnou torakotomií či torakoskopickou operací [4]. Do té doby dítě dispenzarizujeme v ordinaci dětského pneumologa a provádíme UZ vyšetření nebo RTG hrudníku alespoň 1x ročně, pokud se neobjeví symptomy.
I po úspěšném chirurgickém řešení CTM se doporučuje trvalá dispenzarizace pneumologem s kontrolami funkce plic, monitorováním případných změn v hrudníku souvisejících s růstem, dohlížením nad řešením interkurentních respiračních infekcí apod. Důležitou úlohu má respirační fyzioterapie [4]. Děti po nitrohrudních operacích do 2 let věku jsou indikovány k RSV (respirační syncytiální virus) profylaxi palivizumabem [13, 14]. Od 2 let věku při ponechání vady in situ doporučujeme každoroční očkování proti chřipce. Po dosažení dospělosti by měly děti s anamnézou závažnějších vrozených vad respiračního traktu být předány do péče dospělého pneumologa.
VROZENÁ PLICNÍ MALFORMACE DÝCHACÍCH CEST (CPAM)
Tyto vady představují 25–30 % všech CTM. Jsou výsledkem abnormálního vývoje DC a plicní tkáně s rozvojem cystické přestavby plicního parenchymu [4]. Cévní zásobení je z plicního oběhu. Incidence se odhaduje na 1 : 25 000 až 1 : 35 000 [2, 15]. Z jiných zdrojů je častější, 1–2 : 10 000 porodů [3]. Jedná se tedy o nejčastější vrozenou plicní vadu. Je obvykle sporadická a izolovaná a nemá familiární výskyt. Vzniká během organogeneze dysbalancí mezi proliferací buněk a apoptózou [12], a/nebo obstrukcí lumen přívodného bronchu s následnou cystickou přestavbou parenchymu [2, 3, 5, 7, 8, 10, 16–18]. Jako jedna z možných příčin se uvádí porucha v genu HOXB5 (homeobox B5) [5, 12]. Je propojena s tracheobronchiálním stromem a vyskytuje se bez rozdílu v četnosti v obou plicích, ve všech lalocích. Dělí se dle Stockerovy klasifikace z roku 2002 na 5 typů (0–4), tab. 3 [2, 4, 8, 19].
Table 3. Typy CPAM (převzato z Durell J, Thakkar H, Gould S, et al. Pathology of asymptomatic, prenatally diagnosed cystic lung malformations. J Pediatr Surg 2016; 51: 231–235). 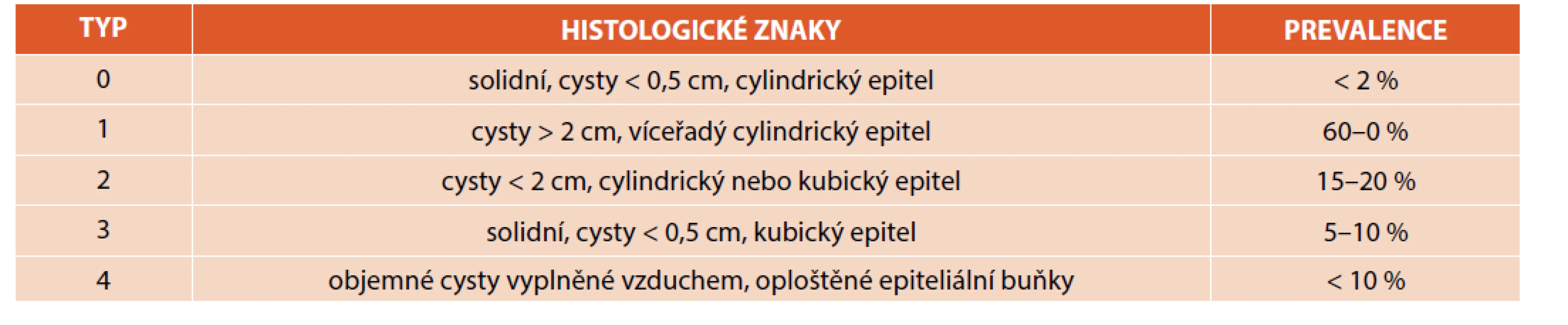
Typ 0 je vzácný, neslučitelný se životem, typicky asociovaný s dalšími abnormitami. Plíce jsou malé a tuhé. Vyskytující se cysty jsou do velikosti 0,5 cm. Histologicky odpovídají strukturou průdušnici nebo bronchům s mezenchymálními buňkami.
Typ 1 je nejčastější (50–70 % CPAM) a s nejlepší prognózou. Důvodem je ostré ohraničení malformace, zaujímající většinou pouze část jednoho laloku plic. Cysty jsou obvykle mnohočetné, v průměru mají více než 2 cm, svoji velikost s věkem dítěte nemění. Jsou vystlány víceřadým řasinkovým cylindrickým epitelem, na rozdíl od ostatních typů bývá přítomna hyperplazie mucinózních buněk a chrupavka. Tento typ má maligní potenciál, ale riziko malignity není stanoveno.
Typ 2 je druhým nejčastějším typem (20–25 % CPAM) a pojí se s renální agenezí, kardiovaskulárními vadami, atrézií jícnu, intestinální atrézií, dalšími pulmonálními vadami, brániční hernií a syringomyelií. Makroskopicky se jeví jako houbovitá tkáň složená z malých cyst do 2 cm v průměru, které odpovídají strukturou cysticky dilatovaným bronchiolům. Jsou lemované řasinkovým kubickým nebo cylindrickým epitelem. Tento typ vady se nepojí se vznikem malignity.
Typ 3 je vzácný (do 8 % CPAM), postihuje výlučně kojence mužského pohlaví, typicky zasahuje celý lalok nebo i více laloků, chová se expanzivně, způsobuje tedy hypoplazii okolní plicní tkáně, projevuje se respirační tísní novorozence. Makroskopicky se léze jeví jako solidní, mikroskopicky se jedná o acinární struktury oddělenými vzdušnými okrsky fetální plíce.
Typ 4 je také vzácný. Obsahuje periferně tenkostěnné cysty s maximálním průměrem 7 cm, vystlané alveolárními buňkami typu 1 a 2, obklopené stromatem z mezenchymální tkáně. Tento typ léze se někdy překrývá s pleuropulmonálním blastomem typu 1, pokud v lézi nalezneme fokální hypercelularitu. Někteří autoři považují dokonce tento typ za spontánně zregredovaný pleuropulmonální blastom. Má tedy nejvyšší maligní potenciál. Pojí se také se spontánním pneumothoraxem postnatálně, proto u novorozence s pneumothoraxem a CTM bychom vždy měli myslet na malignitu [12].
Nejčastější komplikací CPAM je infekce. Je známo, že infekce v malformaci nastává spíše v cystických lézích. Infekce je však velmi nepravděpodobná v kojeneckém, batolecím, předškolním i časném školním věku (do 10 %) [12], riziko výskytu infekce u CPAM se v literárních zdrojích velmi liší (od 3 do 30 % v dětském věku). Prodělaná pneumonie v místě malformace může zkomplikovat diagnostiku a chirurgické odstranění vady.
PLICNÍ SEKVESTRACE (PS)
PS je definována jako ohraničená plicní tkáň nekomunikující s tracheobronchiálním stromem zásobená systémovou arterií s anomální žilní drenáží. Je o dost vzácnější, zaujímá jen asi 6 % všech vrozených plicních malformací [20]. Rozlišuje se na intralobární, která je součástí normální plicní tkáně, a extralobární, oddělenou pleurou. Může být spojena také s jícnem nebo žaludkem, obsahovat pankreatickou tkáň. Intralobární PS se prakticky vždy nalézá v dolních lalocích nad bránicí, nejčastěji v bazálním posteriorním segmentu levého dolního laloku. Extralobární PS se nachází výlučně vlevo, v dolních lalocích, 15 % z nich v břišní dutině, někdy v retroperitoneu, kde může být zaměněna za neuroblastom [20]. Intralobární PS bývá asymptomatická až do adolescentního věku, poté se většinou manifestuje infekcí (není zřejmé, zda infekce vzniká šířením per continuitatem přes Kohnovy póry či hematogenně) nebo hemoptýzou. Extrémně vzácné jsou maligní změny jako mezoteliom a karcinom, které byly nlezeny v PS s histologickou strukturou CPAM, tedy v hybridních lézích [21]. Extralobární PS je vzácná (10–25 % PS), častější je u chlapců, obvykle se diagnostikuje již v kojeneckém věku v rámci screeningu přidružených vrozených vad, jinak zůstává asymptomatická.
V obou typech PS se nalézají velké cysty, neorganizovaně nevzdušné alveoly, bronchy, chrupavky, respirační epitel a systémové arterie. Často se zde nalézají sekundární infekční změny, bronchiektázie, atelektázy. Přívodná tepna odstupuje z hrudní nebo břišní části aorty a tkáň je drénována do plicního oběhu. V případě intralobární PS bývá přívodná tepna velká, způsobující významnější levo-levý zkrat s možným rozvojem hypertrofie levé komory, proto je potřeba v rámci sledování vady alespoň 1x ročně provést UZ srdce k vyloučení této komplikace. Extralobární PS mívá zkrat levo-pravý (vv. azygos), nevýznamný. Většinou nedochází k významné plicní hypertenzi. Řešením je chirurgická resekce +/ - s embolizací aortopulmonálních kolaterál. Jsou popsány případy řešení vady katetrizační embolizací, s větším úspěchem u solidních a menších lézí [2, 3].
ZÁVĚR
Vrozená malformace plic a dýchacích cest a plicní sekvestrace se řadí do diferenciálně diagnostických úvah nejasných plicních lézí v každém věku. Lze je dobře diagnostikovat již prenatálně. Mohou spontánně regredovat nebo vyžadovat časné chirurgické řešení. Zobrazovacími metodami volby jsou UZ, RTG, CT a MR hrudníku. Většinou se začíná od méně invazivního, jednoduchého a levného zobrazení, jako je UZ a RTG, se kterými vystačíme při asymptomatické vadě v rámci konzervativního postupu, tj. observaci vady. CT hrudníku s angiografií stále nejdetailněji zobrazí vadu, její strukturu, ohraničení a cévní zásobení s možností 3D rekonstrukce. Proto se volí vždy před plánovaným chirurgickým výkonem.
Při potřebě opakovaných zobrazovacích vyšetření je akceptovatelné tzv. low dose CT hrudníku s angiografií, radiační zátěží ekvivalentní několikanásobku RTG hrudníku. MR, donedávna ne zcela vhodná zobrazovací metoda plic, je dnes stále více využívaná pro její nulovou radiační zátěž, s novými technickými možnostmi, které umožňují velmi kvalitní zobrazení plic. Je metodou volby radiologa, nevýhodou je u nespolupracujících dětí nutnost sedace/anestezie. Definitivním řešením vady je chirurgická resekce, jejíž načasování se na jednotlivých pracovištích ve světě liší.
Došlo: 19. 4. 2021
Přijato: 14. 5. 2021
Korespondující autorka:
MUDr. Jana Micherová
Dětská klinika LF a FN Sokolská 581
500 05 Hradec Králové
e-mail: jana.micherova@fnhk.cz
Sources
1. Egloff A, Bulas D. Congenital pulmonary airway malformation: Prenatal diagnosis and management. UpToDate, 2020.
2. Oermann Ch. Bronchopulmonaly sequestration. UpToDate. 2020.
3. Wilmott WR, Chernick V, Boat FT, et al. Kendig and Chernick‘s Disorders of the Respiratory Tract in Children. 8th ed. Philadelphia: Saunders, an imprint of Elsevier Inc., 2012 : 317–376. ISBN: 978-1-4377-1984-0.
4. Pohunek P, Koťátko P, Tuková J. Dětská pneumologie. Praha: Mladá fronta a.s., 2018 : 284–301. ISBN 978-80-204-4912-2.
5. Bulas D, Egloff A. Prenatal diagnosis and management of bronchopulmonary sequestration. UpToDate, 03 2020.
6. Oermann Ch. Congenital pulmonary airway (cystic adenomatoid) malformation. UpToDate, 2020.
7. Mafalda D, Ruben L, Tiago H. Prenatal and postnatal management of congenital pulmonary airway malformation. Neonatology 2016; 110 : 101–115.
8. Lau CT, Kan A, Shek N, et al. Is congenital pulmonary airway malforamtion really a rare disease? Result of prospective registry with universal antenatal screening program. Pediatr Surg Int 2017; 33 : 105–108.
9. Min JY, Won HS, Lee MY, et al. Intrauterine therapy for macrocystic congenital cystic adenomatoid malformation of the lung. Obstet Gynecol Sci 2014; 57 (2): 102–108.
10. Fievet L, Natale C, D´Journo XB, et al. Congenital pulmonary airway malformation and sequestration: Two standpoints for a single condition. J Minim Access Surg 2015; 11 (2): 129–133.
11. Casagrande A, Pederiva F. Association between congenital lung malformations and lung tumors in children and adults: a systematic review. J Thorac Oncol 2016; 11 : 1837–1845.
12. Balkanli S, Özturk A, Köse M, et al. A report of adenocarcinoma in situ and congenital pulmonary airway malformation in a three-day-old infant with a review of the literature. Turk J Pediatr 2014; 56 : 299–302.
13. Bagrodia N, Cassel S, Liao J, et al. Segmental resection for the treatment of congenital pulmonary malformation. J Pediatr Surg 2014; 45 : 905–909.
14. Baird R, Puligandla P, Laberge J. Congenital lung malformations: Informing best practise. Semin Pediatr Surg 2014; 23 : 270–277.
15. Laberge J, Puligandla P, Flageole H. Asymptomatic congenital lung malformations. Semin Pediatr Surg 2005; 14 : 16–33.
16. Durell J, Lakhoo K. Congenital cystic lesions of lungs – best practice guidelines. Early Hum Dev 2014; 90 : 935–939.
17. Li J, Chen G, Zhang X, et al. Congenital cystic adenomatoid malformation with associated mucinous bronchioalveolar carcinoma in a neonate. Fetal Pediatr Pathol 2014, 33 : 29–34.
18. Barikbin P, Roehr Ch, Wilitzki S, et al. Postnatal lung function in congenital cystic malformation of the lung. Ann Thorac Surg 2015; 99 : 1164–1169.
19. Kapralik J, Wayne C, Chan E, Nasr A. Surgical versus conservative management of congenital airway malformation in children: a systematic review and meta-analysis. J Pediatr Surg 2016; 51 : 508–512.
20. Kunisaki S, Ehrenberg-Buchner S, Dillman J, et al. Vanishing fetal lung malformations: Prenatal sonographic characteristics and posnatal outcomes. J Pediatr Surg 2015; 50 : 978–982.
21. Parikh D, Rasiah S. Congenital lung lesions: Postnatal management and outcome. Semin Pediatr Surg 2015; 24 : 160–167.
22. Durell J, Thakkar H, Gould S, et al. Pathology of asymptomatic, prenatally diagnosed cystic lung malformations. J Pediatr Surg 2016;51 : 231–235.
23. Feinberg A, Hall N, Williams G, et al. Can congenital pulmonary airway malformation be distinguished from type I pleuropulmonary blastoma based on clinical and radiologic features? J Pediatr Surg 2016;51 : 33–37.
24. Výbor České společnosti dětské pneumologie JEP. Dětská pneumologie. Česká společnost dětské pneumologie. [Online] 2020. https://www.detskapneumologie.cz/pro-odborniky/doporuceni - a-informace-pro-praxi.
25. Straňák Z. Imunoprofylaxe závažných forem RSV infekce neovlivňuje očkování u dětí - nová indikační kritéria. Pediatr praxi 2015; 16 (4): 247–250.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 5-
All articles in this issue
- Vrozená plicní malformace dýchacích cest
- Popôrodná vzťahová väzba medzi matkou a dieťaťom z aspektu prevencie zlého zaobchádzania s deťmi
- Objemný gastroduodenální trichobezoár (Rapunzelův syndrom) jako příčina bolestí břicha a nechutenství u devítileté dívky
- Sideropenická anémie malnutriční etiologie
- Vrozené plicní malformace dýchacích cest a plicní sekvestrace na Dětské klinice FNHK za 15leté období
- Fatální důsledky syndromu CAN – scoping review
- Rozloučení s naším milovaným primářem
- Kniha: Předčasně narozené dítě
- Podíl českých dětských chirurgů na globální studii o přežití dětí s vrozenými vývojovými vadami
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozená plicní malformace dýchacích cest
- Sideropenická anémie malnutriční etiologie
- Objemný gastroduodenální trichobezoár (Rapunzelův syndrom) jako příčina bolestí břicha a nechutenství u devítileté dívky
- Vrozené plicní malformace dýchacích cest a plicní sekvestrace na Dětské klinice FNHK za 15leté období
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

