-
Medical journals
- Career
Sideropenická anémie malnutriční etiologie
Authors: A. Palátová; B. Ludíková; D. Pospíšilová; S. Kaprálová
Published in: Čes-slov Pediat 2021; 76 (5): 262-266.
Category:
Overview
Sideropenická anémie je hypochromní mikrocytární anémie způsobená nedostatkem železa v organismu. Je vůbec nejčastějším typem anémie u dětí v celosvětovém měřítku, a to jak v rozvojových, tak i v rozvinutých státech. U dětské populace má dva vrcholy výskytu – kojenecký věk, ve kterém je výskyt u obou pohlaví stejný, a pubertální věk s převahou dívek. Kazuistika popisuje případ ročního chlapce odeslaného k hospitalizaci pro anémii. Během hospitalizace byla diagnostikována těžká sideropenická anémie spolu s deficitem vitaminu B12. Příčinou anémie bylo výlučné kojení dítěte bez příjmu jakýchkoliv jiných složek stravy.
Jsou shrnuty současné poznatky o etiologii, diagnostice a léčbě sideropenické anémie. Dále je diskutován význam kojení, nutnost včasného zavedení příkrmů do stravy kojenců a zdůrazněno optimální složení stravy s ohledem na množství železa v potravinách.
Klíčová slova:
kojení – anémie – sideropenie – železo ve stravě
KAZUISTIKA
Roční chlapec byl odeslán k hospitalizaci ošetřujícím praktickým lékařem (PLDD) pro těžkou mikrocytární anémii s hemoglobinem (Hb) 61 g/l. Matka se s dítětem k hospitalizaci dostavila až o 10 dní později od vydání doporučení – pozdní příchod nezdůvodnila. Při přijetí byl chlapec objektivně adaptovaný na nízkou hladinu hemoglobinu, byl čilý, pobíhal po ambulanci. Matka u něj nepozorovala v minulých dnech únavu či dušnost, přítomnost B symptomů (horečky, noční pocení, váhový úbytek) negovala.
Jednalo se o dítě z 3. fyziologické gravidity, narozené v 38. týdnu gravidity císařským řezem, porodní hmotnost 2270 g, délka 49 cm. Pro ztíženou poporodní adaptaci bylo nutno podat 5 inflačních vdechů. V časném novorozeneckém období byla zjištěna přechodně hypoglykemie a trombocytopenie. Byl plně kojen, řádně očkován s minimální nemocností. Matka dítěte byla hepatitis C pozitivní, sérologie hepatitidy C u dítěte byla negativní.
Při přijetí byl chlapec výrazně bledý, bez teploty, bez nápadnější alterace stavu, aktivně se bránící vyšetření, eupnoický. Hmotnost byla 8,1 kg (pod 3. perc., Z-skóre = -2,12); délka 73 cm (13. perc., Z-skóre = -1,15). Skléry byly bílé, kůže bez ikteru, uzliny nezvětšeny. Dýchání bylo čisté, sklípkové, bez vedlejších fenoménů, tepová frekvence 100/min, přítomny 2 ozvy, poslechově systolický šelest 1/6. Břicho bylo měkké, volně prohmatné, bez hepatosplenomegalie. Kůže bez krvácivých projevů.
Laboratorní vyšetření při přijetí potvrdilo těžkou hypochromní mikrocytární anémii. Byla zjištěna výrazně nízká hodnota hemoglobinu 53 g/l, hematokritu 0,21, snížení středního objemu erytrocytů (MCV 51,9 fl, norma 70–86) a obsahu hemoglobinu (MCH 13,4 pg, norma 23–31) i koncentrace hemoglobinu v erytrocytech (MCHC 25,7 g/dl, norma 30–36). Šíře distribuce erytrocytů svědčila pro anizocytózu (21 %, norma 11,5–14,5), počet retikulocytů byl normální. Byla rovněž přítomna leukopenie (3,77 x 109l) s neutropenií (ANC = 0,51/l), trombocyty byly v normě.
Při biochemickém vyšetření byly zjištěny typické parametry svědčící pro výrazný deficit železa v organismu: nízká hladina sérového železa (2,1 μmol/l, norma 7,2–29), zvýšená hodnota transferinu (4,37 g/l, norma 2–3,6), zvýšená volná kapacita pro železo (89,2 μmol/l, norma 24,2–70,1) a zvýšená celková vazebná kapacita séra pro železo (91,3 μmol/l, norma 22,3–61,7), snížený feritin (3 μg/l, norma 21,8–275), vysoká hladina solubilních (35,4 mg/l, norma 1,8–4,7) i volných transferinových receptorů (74,2 mg/l, norma 1–3,9). Zároveň byla zjištěna nízká hladina vitaminu B12 (151 ng/l, norma 187–883). Hladina folátu i CRP byla normální.
Sérologickým vyšetřením byly vyloučeny EBV, CMV, HIV, Parvovirus B19, mykoplazmová i chlamydiová infekce. Metodou PCR byla vyloučena hepatitida C. Při podrobnějším rozhovoru matka přiznala, že je dítě pouze kojené a občas jí rohlík, příkrmy dosud nezavedla. Stav byl tedy uzavřen jako těžká sideropenická anémie s deficitem vitaminu B12, způsobená zcela neadekvátní výživou.
Vzhledem k těžké anémii bylo první den hospitalizace indikováno podání deleukotizované erytrocytární masy, její aplikace proběhla bez komplikací. Byla zahájena intramuskulární substituce vitaminu B12 a perorální substituce železa. Kontrolní odběry provedené 3. den hospitalizace ukázaly významný nárůst hodnot hemoglobinu (97 g/l, Hct 0,32). Rodiče byli poučeni o nutnosti okamžitého zahájení běžné kojenecké stravy a zařazení potravin bohatých na železo. Chlapec byl 4. den hospitalizace v dobrém klinickém stavu propuštěn do domácí péče. Při časné kontrole v hematologické ambulanci byla hladina hemoglobinu (96 g/l) a hematokritu (0,32) bez poklesu, hodnoty MCV (60,3 fl), MCH (18,4 pg) i MCHC (30,5 g/dl) byly s nárůstem hodnot. Nadále bylo pokračováno v substituci železa i vitaminu B12, postupně došlo k úplné normalizaci krevního obrazu.
DISKUSE
Anémie je jedno z nejčastějších onemocnění postihujících populaci rozvojových i rozvinutých zemí. Dle WHO je u dětí definována jako hodnoty koncentrace hemoglobinu < -2 SD průměrných normálních hodnot vzhledem k věku a pohlaví. Prevalence anémie v ČR u dětí do 5 let je 25,8 % [1], přičemž sideropenická anémie neboli anémie z nedostatku železa je nejčastějším typem vyskytujícím se v dětském věku [2]. Odhaduje se, že pokud by byl deficit železa korigován, prevalence u dětí a žen by klesla o 50 %, [3]. Incidence je nejvyšší v kojeneckém věku, u dětí ve školním a prepubertálním věku se vyskytuje méně často. Druhý vrchol výskytu je v období puberty s jasnou převahou ženského pohlaví [4].
Sideropenie neboli deficit železa je stav, kdy snížené množství železa v organismu brzdí produkci hemoglobinu a ostatních strukturálních látek, ve kterých je obsaženo [4]. Železo je kromě syntézy hemoglobinu klíčovým prvkem mnoha buněčných a tkáňových funkcí zahrnujících buněčné dýchání, mitochondriální funkce, produkci energie, buněčnou proliferaci a opravu DNA [5]. Současně je nezbytným prvkem pro správný psychomotorický vývoj dítěte – je potřebné pro správnou myelinizaci neuronů, neurogenezi a diferenciaci nervových buněk zapojených do procesů učení, vytváření paměti, senzoriky a chování [2]. Možný vztah mezi sideropenickou anémií a opožděným psychomotorickým vývojem je předmětem řady studií. Většina z nich tuto souvislost prokázala [6].
Příčinou vzniku sideropenické anémie v kojeneckém a batolecím věku bývá nedostatečný příjem železa potravou (dlouhodobě výhradně kojené děti, děti na vegetariánské dietě), zvýšené požadavky na jeho přísun (prematurita, rychlý růst), porucha jeho vstřebávání (celiakie) nebo krevní ztráty (předčasný podvaz pupečníku, ztráty krve z GIT) [7]. Ve vzácných případech může jít o vrozené poruchy metabolismu železa, jako jsou mutace genů kódujících proteiny důležité pro transport a vstřebávání a transport železa (DMT1, transferin, TMPRSS6) [8]. Během třetího trimestru se vytváří 60–80 % zásob železa novorozence [2]. Termínoví novorozenci se rodí s vysokou hladinou hemoglobinu (nižší nabídka kyslíku u plodu) a s velkým objemem krve v poměru k tělesné hmotnosti. Po porodu dochází postupně k destrukci erytrocytů obsahujících fetální hemoglobin v monocyto-makrofágovém systému v rámci změny produkce fetálního hemoglobinu na hemoglobin adultní. Železo z destruovaných erytrocytů je ukládáno do monocyto-makrofágového systému a slouží jako zásoba železa v období rychlého růstu kojence. Zásoby jsou obvykle spotřebovány mezi 4.–6. měsícem života [6]. Během prvních 6 měsíců života tedy čerpá kojenec železo ze zásob a z mateřského mléka (popř. umělé formule). Po 6. měsíci věku jsou zásoby prakticky vyčerpány a současně rostou nároky těla na potřebu železa vlivem nárůstu objemu krve a rychlého růstu tkání [3]. Po půlroce kojení klesá i obsah železa v mateřském mléce. Rychlejší snížení zásob železa hrozí především u dětí předčasně narozených a u dětí matek trpících sideropenií během těhotenství, přičemž suplementace železa u matky nevede ke zvýšení jeho koncentrace v mateřském mléku [9]. Nedonošené děti, zejména narozené před 32. týdnem těhotenství, mohou mít nedostatek železa již ve 2 měsících věku i dříve, protože se rodí s nižšími zásobami železa [10]. Riziko deficitu železa může být sníženo pozdním podvazem pupečníku, z čehož profitují i děti s nízkou porodní hmotností [9].
K typickým projevům závažné anémie patří bledost kůže a sliznic, únava, slabost, tachykardie, dušnost, zejména ponámahová, palpitace, závrať. Pacienti s pomalu vznikající anémií mohou být dobře adaptovaní i na významně snížené hodnoty hemoglobinu [7]. Známky tkáňové sideropenie vídáme v podobě zvýšeného padání vlasů, snížené kvality nehtů až k obrazu koilonychie. Na jazyku můžeme pozorovat atrofii papil, často jsou přítomny známky stomatitidy [11]. Dále může být dítě více náchylné k rozvoji infekcí zejména respiračního traktu. U kojenců vede sideropenická anémie k opoždění psychomotorického vývoje, u starších dětí je popisováno snížení intelektuální výkonosti či poruchy pozornosti [4]. Stav může být potencován současným deficitem vitaminu B12.
Sideropenická anémie je mikrocytární anémie, kdy střední objem erytrocytu (MCV), barvivo v erytrocytu (MCH) i střední koncentrace hemoglobinu v erytrocytu (MCHC) jsou snížené pod normu. V krevním obraze nacházíme sníženou hodnotu hemoglobinu, počet erytrocytů může být normální i zvýšený. Diagnózu potvrzuje snížení hladiny sérového železa, zvýšená celková vazebná kapacita pro železo a snížení hladiny feritinu [7]. Feritin je spolehlivý ukazatel celkových zásob železa a současně je prvním laboratorním parametrem klesajícím při deficitu železa. Svou výpovědní hodnotu ztrácí u pacientů s infekcí či zánětlivým onemocněním, protože se současně jedná o reaktant akutní fáze a při zánětu se jeho hladina zvyšuje. Zvýšení šíře distribuce erytrocytů (RDW) může být také dobrým parametrem k odlišení od ostatních typů mikrocytárních anémií [2]. Zvýšená hladina solubilních transferinových receptorů v séru (sTfR) může být rovněž známkou deficitu železa, bývá ale zvýšena i u hemolytických anémií. Časnou laboratorní známkou deplece železa je zvýšení volného protoporfyrinu v erytrocytech (FEP – free erythrocyte protoporphyrin). Jeho zvýšení signalizuje několik týdnů trvající sideropenickou erytropoézu, vrací se k normě pomalu po úpravě krevního obrazu [4] (tab. 1). Tento parametr je pro diagnostiku deficitu železa používán méně často.
Table 1. Laboratorní známky sideropenické anémie. 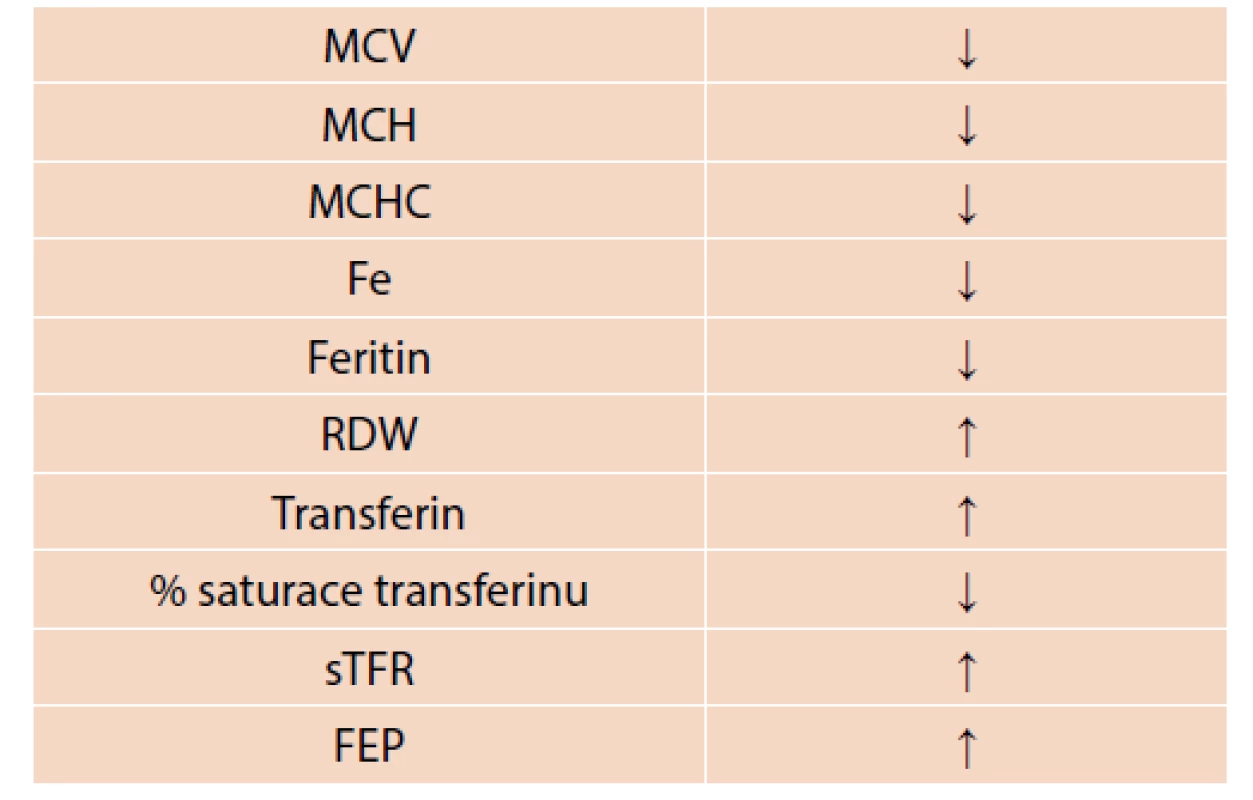
Železo je absorbováno v duodenu. Absorpce železa a jeho recyklace je řízena hormonem hepcidinem. Jeho snížená hladina se jeví jako velmi citlivý indikátor nedostatku železa ještě před rozvojem anémie. Zvýšená hladina plazmatického a zásobního železa stimuluje produkci hepcidinu, který zpětnou vazbou blokuje vstřebání železa z potravy ve střevě a jeho uvolňování ze zásob. Při nedostatku železa je naopak syntéza hepcidinu suprimována, zvýší se příjem železa ve střevě a rovněž dojde k jeho uvolnění ze zásob [12]. Hladina hepcidinu se vždy zvyšuje při zánětu v důsledku zvýšení hladiny IL-6, proto je jeho výpovědní hodnota pro diagnostiku deficitu železa při zánětu zkreslená.
Kojení je nejlepší způsob výživy kojenců. WHO doporučuje výlučné kojení do 6 měsíců věku, po 6. měsíci věku je ale výlučné kojení asociováno se zvýšeným rizikem rozvoje sideropenické anémie. Průměrný obsah železa v mateřském mléku je 0,35 mg/l [6], nejvyšší je v přechodném mléku a postupně během laktace jeho koncentrace klesá. Ačkoli je jeho koncentrace v mateřském mléce nízká, biologická dostupnost je vysoká – uvádí se mezi 12 až 56 % [3]. Pokud děti nemohou být kojeny, jsou živeny formulemi fortifikovanými železem (6–7 mg/l) ve formě ferosulfátu, který se velmi dobře vstřebává [13]. Konzumace velkého množství železem nefortifikovaného kravského mléka zvyšuje riziko deficitu železa [2]. Zdravý novorozenec vyžaduje relativně malé množství železa (zhruba 0,27 mg/den) [6]. Po 6. měsíci věku dochází k nárůstu objemu krve a rychlému růstu tkání, přičemž zásoby jsou většinou již vyčerpány. Mateřské mléko se po 6 měsících kojení stává nedostatečným zdrojem železa i vzhledem k postupnému poklesu jeho hladiny. Plně kojené děti jsou proto ohroženy rozvojem anémie [3] a je nezbytné zahájit podávání příkrmů s dostatečným zastoupením potravin bohatých na železo.
Požadavky dětského organismu na dodávku železa se dále mění v průběhu růstu. Odhadovaná denní potřeba železa mezi 6. a 12. měsícem se pohybuje mezi 0,9 a 1,3 mg/kg/den [3]. Doporučený příjem železa u batolat je 0,5 mg/kg/den – ideálně přijaté z potravin bohatých na železo [4] (tab. 2).
Table 2. Obsah železa ve vybraných potravinách v syrovém stavu [13]. ![Obsah železa ve vybraných potravinách v syrovém
stavu [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f0abe3b75624b864404d7f5c36febc1f.png)
Zdrojem železa v potravě jsou hlavně živočišné bílkoviny, kde je nacházíme v podobě vázané na hem a jako nehemové železo. Vstřebávání hemového železa je pro organismus nejsnadnější [11], přičemž jeho přítomnost ulehčuje vstřebávání nehemového železa. Nehemové železo je obsaženo v zelenině (nejvíce v listové), ovoci a cereálních produktech [4]. Hlavními faktory, usnadňujícími resorpci železa, jsou kyselina askorbová a bílkoviny masa, s resorpcí nehemového železa výrazněji interferují například vaječný bílek, kravské mléko a hlavně fytáty, obsažené v rostlinné dietě. Polyfenoly, obsažené v čaji, rovněž inhibují vstřebávání železa. Vysoký příjem fytátů při jednostranně rostlinné dietě může vést k poruše vstřebávání železa tvorbou těžko rozpustných sloučenin železa [11].
U pacientů se sideropenickou anémií zahajujeme většinou léčbu perorálním podáváním preparátů železa v dávce 5 mg/kg/den po dobu 6–8 týdnů, při těžké sideropenii i déle. Pokud není perorální podání možné nebo se jedná o pacienta s malabsorbcí, je indikováno parenterální podání v dávce 1,5 mg/kg/den 3x týdně. Úprava anémie po parenterálním podání není rychlejší než po perorálním. Poslední možností léčby těžké anémie, tedy v případě nutnosti rychlejší korekce hemoglobinu než lze dosáhnout cestou perorální, je podání transfuze erytrocytární masy [4].
Podle AAP (American Academy of Pediatrics) je vhodné zjišťovat případný nedostatek železa u donošených dětí v 6. měsíci, u nedonošených již ve 2. až 4. měsíci věku. Doporučená denní dávka železa je u kojených donošených dětí 1 mg/kg/den. U nekojených je vhodné používat mléčné formule bohaté na železo. Pro nedonošené novorozence je doporučená denní dávka železa 2 až 4 mg/kg [10]. V některých zemích se provádí fortifikace mléka nebo jiných potravin železem, ozývají se však i hlasy proti této paušální prevenci, jelikož frekvence hereditární hemochromatózy prvého typu v bílé evropské populaci se odhaduje mezi 1 : 200–1 : 400 [11].
ZÁVĚR
Sideropenická anémie je nejčastějším typem anémie v celosvětovém měřítku. Je nejzávážnějším projevem sideropenie, tedy deficitu železa. Její prevalence v posledních desetiletích výrazněla klesla, hlavně díky propagaci kojení a fortifikaci umělého mléka.
I přes všechny nesporné výhody kojení je nutné připomínat, že časné zavedení příkrmů (tj. nejdříve po ukončeném 4. měsíci a nejpozději po 6. měsíci věku) do stravy kojence je důležitou součástí prevence jejího rozvoje. Řada studií se shoduje, že sideropenie může negativně ovlivnit vývoj dítěte, proto je důležité informovat i rodiče např. v rámci preventivních prohlídek o významu zařazení potravin bohatých na železo do stravy dítěte. Vždy je nutno vyloučit i současný deficit vitaminu B12.
Práce byla zpracována s grantovou podporou IGA_LF_2020_045.
Došlo: 20. 1. 2021
Přijato: 24. 2. 2021
Korespondující autorka:
MUDr. Alžběta Palátová
Dětská klinika LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: alzbeta.palatova@fnol.cz
Sources
1. WHO. Prevalence of anemia among children under 5 years. https://www.who.int/data/maternal-newborn-child-adolescent-ageing/ indicator-explorer-new/mca/prevalence-of-anemia-amongchildren - under-5-years-(-).
2. Wang M. Iron deficiency and other types of anemia in infants and children. Am Fam Physician 2016; 93 (4): 270–278.
3. Wang F, Liu H, Wan Y, et al. Prolonged exclusive breastfeeding duration is positively associated with risk of anemia in infants aged 12 months. J Nutr 2016; 146 : 1707–1713.
4. Pospíšilová D. Sideropenická anémie v dětském věku. Pediatr praxi 2001; 6 : 269–273.
5. Cappellini MD, Musallam KM, Taher AT. Iron deficiency anaemia revisited (review). J Intern Med 2020; 287 : 153–170.
6. Baker RD, Greer FR, The Committee on Nutrition. Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0–3 years of age). Pediatrics 2010; 126 : 1040.
7. Smíšek P. Diferenciální diagnostika anémie v dětském věku. Pediatr praxi 2014; 15 (6): 330–333.
8. Priwitzerova M, Pospisilova D, Prchal JT, et al. Severe hypochromic microcytic anemia caused by a congenital defect of the iron transport pathway in erythroid cells. Blood 2004; 103 : 3991–3992.
9. Pérez-Escamilla R, Buccini GS, Segura-Pérez S, et al. Perspective: Should exclusive breastfeeding still be recommended for 6 months? Adv Nutr 2019; 10 : 931–943.
10. Šebková S, Zach J, Janota J. Terapeutické přístupy v léčbě novorozenecké anémie z nezralosti. Čes-slov Pediat 2009; 64 (7–8): 352–358.
11. Novotný J. Sideropenická anémie. Med praxi 2007; 4 (11): 390–394.
12. Bělohlávková P. Postavení hepcidinu v diagnostice a léčbě anémií. Med praxi 2011; 8 (3): 127–129.
13. Bělohlávková S, Bronský J, Burianová I, a kol. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro výživu kojenců a batolat. Čes-slov Pediat 2014; 69 (S1).
14. Databáze složení potravin ČR. https://www.nutridatabaze.cz/ vyhledavani-potravin/podle-nutrientu/?id=35.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 5-
All articles in this issue
- Vrozená plicní malformace dýchacích cest
- Popôrodná vzťahová väzba medzi matkou a dieťaťom z aspektu prevencie zlého zaobchádzania s deťmi
- Objemný gastroduodenální trichobezoár (Rapunzelův syndrom) jako příčina bolestí břicha a nechutenství u devítileté dívky
- Sideropenická anémie malnutriční etiologie
- Vrozené plicní malformace dýchacích cest a plicní sekvestrace na Dětské klinice FNHK za 15leté období
- Fatální důsledky syndromu CAN – scoping review
- Rozloučení s naším milovaným primářem
- Kniha: Předčasně narozené dítě
- Podíl českých dětských chirurgů na globální studii o přežití dětí s vrozenými vývojovými vadami
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozená plicní malformace dýchacích cest
- Sideropenická anémie malnutriční etiologie
- Objemný gastroduodenální trichobezoár (Rapunzelův syndrom) jako příčina bolestí břicha a nechutenství u devítileté dívky
- Vrozené plicní malformace dýchacích cest a plicní sekvestrace na Dětské klinice FNHK za 15leté období
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

