-
Medical journals
- Career
Primárna pľúcna hemosideróza – skúsenosti z Banskej Bystrice
Authors: I. Gondová 1,2; B. Takáč 1; E. Bubanská 3; S. Dluholucký 1,4; K. Králinský 1,4; K. Novotná 5; J. Koňarčík 6; M. Ducár 6
Authors‘ workplace: II. Detská klinika SZU, DFNsP, Banská Bystrica, Slovensko 1; Vysoká škola zdravotníctva a sociálnej práce sv. Alžbety, Bratislava, Slovensko 2; Klinika pediatrickej onkológie a hematológie SZU a DFNsP, Banská Bystrica, Slovensko 3; Fakulta zdravotníctva, Slovenská zdravotnícka univerzita, Banská Bystrica, Slovensko 4; Oddelenie rádiológie FNsP FDR, Banská Bystrica, Slovensko 5; Martinské bioptické centrum, s. r. o, Banská Bystrica, Slovensko 6
Published in: Čes-slov Pediat 2019; 74 (3): 176-181.
Category: Case Report
Overview
Primárna pľúcna hemosideróza je raritné intersticálne ochorenie s udávanou incidenciou 6,3 detí na
1 000 000 detských pacientov v Slovenskej republike. Ochorenie má chronický charakter s obdobiami relapsov a remisie. Etiológia nie je jasná, predpoklad dysfunkcie imunitného systému naznačuje autoimunitný pôvod. Určenie diagnózy je založené na kombinácii recidivujúcej hemoptýzy v klinickom obraze, anémie v laboratórnych odberoch a pľúcnych infiltrátov na RTG vyšetrení pľúc. Vzhľadom na neskorú diagnostiku a progresívny priebeh, sa prognóza nepovažuje za priaznivú.Od začiatku vzniku našej nemocnice sa u nás objavili dva prípady idiopatickej pľúcnej hemosiderózy. Prvý v roku 2004, v liečbe bola použitá aplikácia rekombinantného ľúdskeho erytropoetínu. Druhý sa vyskytol o 13 rokov neskôr – v roku 2017.
Autori v nasledujúcom článku približujú obidve kazuistiky. Došlo k zmene v pohľade na hemosiderózu
za uplynulé obdobie?Klíčová slova:
idiopatická pľúcna hemosideróza – anémia
ÚVOD
Idiopatická pľúcna hemosideróza (IPH) je raritné intersticiálne ochorenie s udávanou incidenciou 6,3 detí na 1 000 000 detských pacientov v Slovenskej republike [1]. V zahraničí výskyt varíruje od 0,24–1,26 na 1 000 000 pacientov [2]. Doposiaľ bolo v medicínskej literatúre popísaných okolo 500 prípadov IPH [3].
Prvé príznaky sa objavujú už v prvej dekáde života, maximum sa udáva medzi 1.–7. rokom, vyskytuje sa však aj u mladých dospelých (20 % zo všetkých), častejšie je prítomné u dievčat. Prvá zmienka o IPH sa datuje na rok 1931, kedy bola popísaná ako trias príznakov – sideropenická anémia, hemoptýza a prítomnosť pľúcnych infiltrátov na RTG hrudníka. Ochorenie má chronický charakter s obdobiami relapsov a remisie. Vzhľadom na ojedinelosť výskytu pri izolovanom idiopatickom type pľúcnej hemosiderózy ani v súčasnosti etiólogia nie je úplne objasnená, zatiaľ čo u sekundárnej formy má spojitosť s inými ochoreniami (tab. 1). Na rozvoji sa podieľajú genetické (doteraz nebol objavený gén), environmentálne, alergické (BKM, gliadín), metabolické a autoimunitné faktory. Keďže sa v terapii dosahuje úspech imunosupresívnou liečbou, autoimunitný mechanizmus je veľmi pravdepodobný. V niektorých prípadoch sa za triger považuje bielkovina kravského mlieka (Heinerov syndróm), gliadín (asociácia s celiakiou ako Lane-Hamilton syndróm), plesne (Stachybotrys atra). Je známa aj spojitosť s myokarditídou, ochorením pankreasu, čoraz častejšie aj s prítomnosťou morbus Down a selektívnym deficitom imunoglobulínu A.
Table 1. Rozdelenie hemosiderózy. 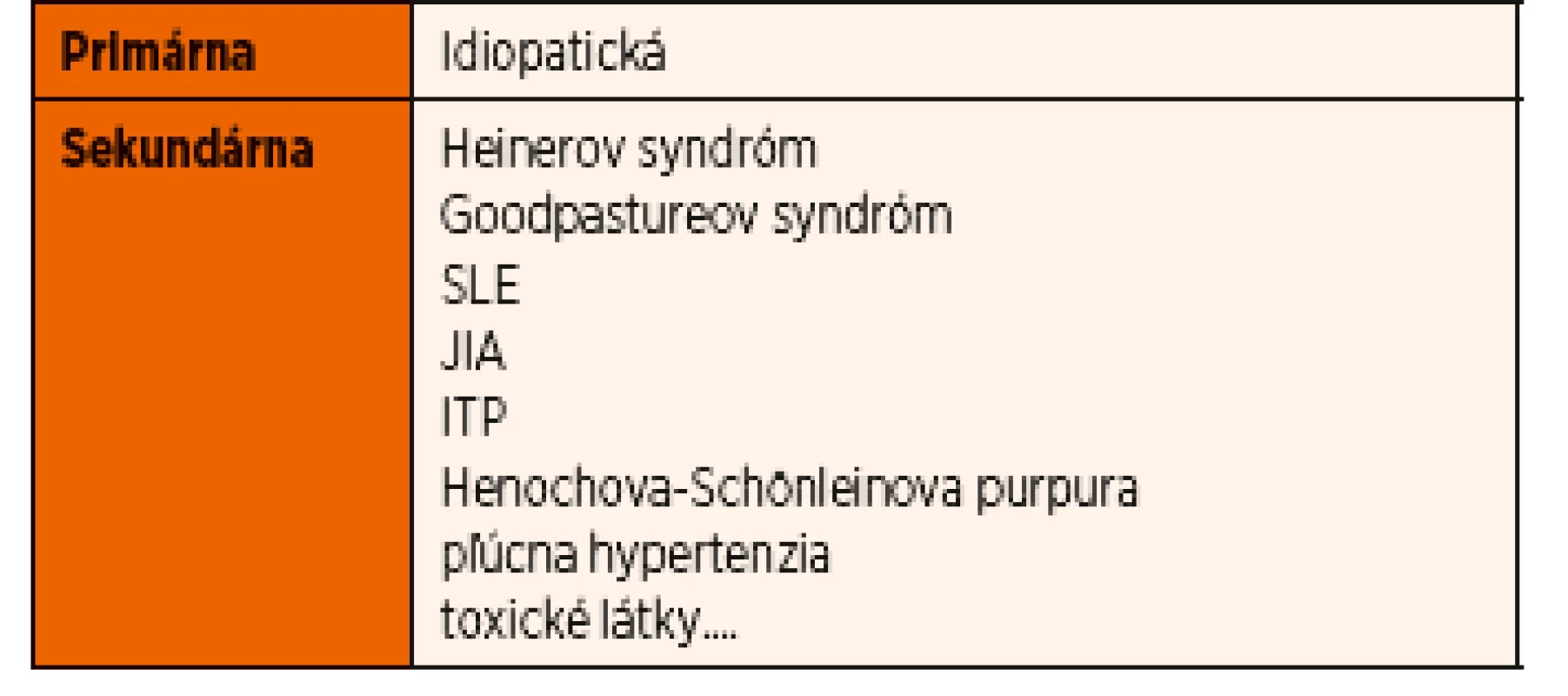
Z hľadiska patofyziológie sa jedná o poruchu bazálnej membrány pľúcnych kapilár, tzv. kapilaritída (mikrovaskulitída), ktorá vedie k difúznej alveolárnej hemorágii. V alveoloch sú prítomné najskôr erytrocyty, v nasledujúcich 2–3 dňoch dochádza k premene železa obsiahnutého v červených krvinkách na jeho zásobnú formu – hemosiderín. Makrofágy kumulujúce hemosiderín sa nazývajú sideroblasty a majú prozápalovú aktivitu. Pokiaľ je ochorenie neliečené, chronický zápal spôsobí stenčenie alveolárnej bazálnej membrány, čím ochorenie progreduje do pľúcnej fibrózy prejavujúcej sa reštrikčnou ventilačnou poruchou.
DIAGNOSTIKA
Neexistuje laboratórny marker, špecifický test, či zobrazovacia metóda, ktoré by jednoznačne a výlučne potvrdzovali diagnózu IPH. Tým možno vysvetliť, prečo viacerí autori popisujú vo svojich prácach pomerne dlhý časový úsek od výskytu prvých príznakov až po správne stanovenie diagnózy (od 6–36 mesiacov). Skutočnosť, že klasický trias nemusí byť plne vyjadrený a jednotlivé symptómy sa vyskytujú v rôznej intenzite spolu s raritnosťou, ochorenie komplikuje diagnostiku. Tá je založená na komplexnom prešetrení pacienta, konečná diagnóza je však diagnózou per exclusionem (po vylúčení iných príčin krvácania do pľúc – infekcia, kardiologické ochorenie...).
Laboratórnym príznakom vyskytujúcim sa u 100 % pacientov je anémia, spravidla sideropenická. Recidivujúca a závažná anémia môže byť jediným príznakom. Vo viacerých publikovaných kazuistikách sa hodnoty feritínu líšia od jeho nízkej, normálnej až po zvýšenú hodnotu. Markery zápalovej aktivity (FW, CRP) môžu, ale nemusia byť zvýšené, v závislosti od štádia ochorenia. V laboratórnych výsledkoch je vhodné doplniť protilátky proti bielkovine kravského mlieka (Heinerov syndróm), ako aj protilátky proti tkaninovej transglutamináze a antigliadinové protilátky, doplnené o 100% diagnostický štandard celiakie – biopsiu, čím sa potvrdí Lane-Hamilton syndróm. Pozitivita autoimunitných markerov (ANA, ANCA) nie je jednoznačná, francúzska lekárka Jessica Taytard v roku 2013 publikovala súbor 25 pacientov s IPH, v ktorom boli protilátky prítomné až u 17 pacientov na začiatku sledovania, u ďalších 6 sa vyvinula v priebehu času [2]. U 50 % pacientov bola zaznamenaná pozitivita SMA, u 45 % pacientov prítomnosť ANA, u 40 % pacientov ANCA. Keďže sa u 10 pacientov potvrdila prítomnosť reumatoidného faktora, za úvahu stojí vyšetrovania anti-CCP u pacientov so suspekciou na IPH.
Dá sa tvrdiť, že okrem anémie z laboratórnych markerov neexistuje žiaden, o ktorý by sa lekár mohol 100% oprieť, preto sa v diagnostickom procese pokračuje spirometrickým vyšetrením. Ak sa pacient nachádza v štádiu fibrózy, základné funkčné vyšetrenie pľúc potvrdí reštrikčnú poruchu pľúc, inak môže byť nález fyziologický. Difúzna kapacita pľúc je znížená. Za nevyhnutné na stanovenie diagnózy sa považuje realizácia flexibilného bronchoskopického vyšetrenia s bronchoalveolárnou lavážou. Cytologické vyšetrenie tekutiny získanej pri laváži potvrdí prítomnosť sideroblastov – inak nazývané aj hemosiderín-laden makrofágy. Senzitivita je 92 %, v gastrickom aspiráte 30 % [4]. V diferenciálnom rozpočte buniek sú prítomné polymorfonukleáry a mierne eozinofily, imunologický rozbor potvrdí znížený pomer CD4/CD8 [1].
Na základe maďarskej štúdie publikovanej v roku 2015 sa ako možný marker intersticálnych pľúcnych ochorení a najmä IPH ukazuje tzv. zníženie VEGF (vascular endothelial growth factor) v BAL [5]. Ďalším krokom je pľúcna biopsia, považovaná za zlatý štandard diagnostiky. Aby bola dostatočne reprezentatívna (vo vzorke sa musí nachádzať bronchiolus, minimálne 20 pľúcnych alveolov a malá pľúcna cievna kresba), uprednostňuje sa odber otvoreným prístupom transtorakálne, vzhľadom na detský vek a invazívnosť sa častejšie uplatňuje transbronchiálna biopsia [6]. Histologické vyšetrenie zahŕňa nález hemosiderofágov, kapiliaritídy, pľúcnej fibrózy a hyperplázie alveolárneho epitelu. Na RTG hrudníka môže byť obraz retikulonodulácii, aj napriek tomu, že pacient nemá klinické príznaky. Zmeny sa nachádzajú centrálne v stredných a dolných pľúcnych poliach, sú difúzne a bilaterálne. Vždy je potrebné doplniť aj HRCT pľúc, kde sa zobrazujú známky intersticiálneho pľúcneho procesu – tzv. opacity mliečneho skla, v akútnom štádiu obraz pľúcnej hemorágie.
KLINICKÝ OBRAZ A DIFERENCIÁLNA DIAGNOSTIKA
Ochorenie môže byť dlhú dobu klinicky nemé, prebieha formou remisií a relapsov. Symptómy vyplývajú z podstaty ochorenia – difúznej alveolárnej hemorágie. V rozvinutom štádiu nachádzame slabosť, únavu, horúčku, tachykardiu, typické sú najmä kašeľ, hemoptýza, dyspnoe, tachypnoe a zlá kapilárna náplň. Príznaky sa objavujú v atakoch s dramatickým priebehom pod obrazom febrilného stavu s vykašliavaním krvi a tachydyspnoe.
Presné určenie diagnózy je založené na kombinácii recidivujúcej hemoptýzy v klinickom obraze, anémie v laboratórnych odberoch a pľúcnych infiltrátov na RTG vyšetrení pľúc. Nie sú prítomné známky renálného (Goodpastureov syndróm) ani systémového (SLE, vaskulitída) postihnutia, ako je tomu u sekundárnej hemosiderózy. V diferenciálnej diagnostike sa zameriavame na vylúčenie sekundárnych príčin pulmonálnej hemorágie (mikroskopická polyangiitída, Wegenerova granulomatóza, Churgov-Straussovej syndróm, JIA, antifosfolipidový syndróm), ako aj akútnym stavom, ktoré ju môžu spôsobiť (cytostatiká, ARDS, drogy...).
LIEČBA A PROGNÓZA
Po stanovení diagnózy sú prvou voľbou inhalačné a perorálne kortikosteroidy (2 mg/kg/deň). Pri akútnej exacerbácii je indikované podávanie pulznou formou parenterálne (10 mg/kg/deň). Ak je efekt nedostatočný, je možné siahnuť po iných imunosupresívach (azatioprin, cyklofosfamid, hydrochlorochin, mykofenolát mofetil). Vo všeobecnosti sa pri rezistencii na kortikosteroidy odporúča do liečby zaradiť hydrochlorochin alebo mykofenolát mofetil. Pri dobrom efekte (stabilizovanom stave bez aták hemoptýzy, normálnej hodnote hemoglobínu a zlepšení RTG nálezu) sa liečba ukončuje, avšak to nevylučuje, že po čase dôjde k vzniku novej ataky. Za včasný marker relapsu sa považuje febrilný stav s leukemoidnou reakciou a lymfopéniou [1].
Na našom pracovisku sme v terapii využili aj podávanie rekombinantného ľudského erytropoetínu. V súčasnosti sú už publikované prvé priaznivé skúsenosti s použitím liposteroidov [7]. Koncom roka 2017 boli zverejnené výsledky práce poukazujúce na pozitívny efekt liečebnej kombinácie kortikoid - leflunomid - mezenchymálne kmeňové bunky [8]. U pacientov v kritickom stave je možné použitie vysoko frekvenčnej ventilácie. Gutierrez a kol. publikovali prípad 5-týždňového pacienta s úspešným využitím ECMO, aj napriek tomu, že krvácanie sa považuje za kontraindikáciu k tejto liečebnej modalite a dokazuje relatívnosť tohto tvrdenia [9].
Keďže je ochorenie raritné, neumožňuje vznik randomizovanej štúdie, preto sa stretávame s rôznymi liečebnými schémami. Problémom je aj fakt, že v Slovenskej republike neexistuje databáza pacientov so zriedkavými pľúcnymi diagnózami, ako je tomu napr. vo Francúzsku. Prognóza sa považovala za nepriaznivú, pri prechode ochorenia do pľúcnej fibrózy je stav ireverzibilný s postupnou progresiou reštrikčnej ventilačnej poruchy. Akútna pľúcna hemorágia v pediatrickom veku akejkoľvek etiológie má mortalitu od 30–75 % [9]. V posledných štúdiách sa 5-ročné prežívanie na imunosupresívnej terapii udáva na 86 % [3].
KAZUISTIKA 1
Išlo o 9,5-ročné dievčatko rómskeho etnika, bez pozoruhodností v anamnéze, v roku 1993 opakovane liečené antibiotikami pre suchý záchvatovitý kašeľ. Do spádovej nemocnice ju priviedla bledosť kože, šelest a subikterus.
Na základe laboratórnych vyšetrení bola vylúčená hepatitída, prekvapil však nález závažnej mikrocytárnej anémie s hodnotou Hg 77 g/l. Napriek substitučnej terapii železom sa hodnota hemoglobínu neupravovala (Hg 55 g/l), stav dokonca progredoval a pacientka vyžadovala podanie transfúzie erytrocytov. V tomto období už bola prijatá na naše oddelenie za účelom diagnostiky.
Klinický stav pri príjme zahŕňal tachykardiu a bledosť, miernu hepatosplenomegáliu (+2 cm). Auskultačne bolo dýchanie vezikulárne. Dodatočne matka uviedla hemoptoe pri atakoch kašľa. Rozbor krvného obrazu priniesol nasledovné výsledky: Hg 106 g/l, Er 4,3x1012/l, Hct 0,329, železo 11,76 µmol/l, plazmatický feritín
985,9 ng/ml. Ostatné parametre (Ig, α1-antitrypsín, CIK, CH-50, bielkoviny, albumín, bilirubín, kyselina močová, kreatinín a glukóza) boli vo fyziologickom rozmedzí. LD a CK mali mierne zvýšené hodnoty. Stolica na okultné krvácanie bola negatívna, ale pre nález vajíčok Enterobius vermicularis bola pacientka preliečená pyrvíniom. V diagnostike sa pokračovalo USG vyšetrením brucha, ezofagoskopiou, fibrotickou bronchoskopiou a spirometriou – všetko s primeraným nálezom. Pri ORL vyšetrení bol ošetrený locus Kisselbachi. RTG hrudníka ukázal nález perihilóznych opacít, v žalúdočnom aspiráte sa potvrdil dôkaz sideroblastov, čo viedlo k suspícii na IPH, preto bola pri zhoršení stavu doporučená rehospitalizácia, čo sa udialo o mesiac neskôr. Dráždivý neproduktívny kašeľ, slabosť a nechutenstvo v klinickom obraze, na RTG sa opäť našli perihilózne opacity, v žalúdočnom aspiráte sideroblasty.Definitívne potvrdenie diagnózy priniesla transbronchiálna biopsia pľúc. Počas hospitalizácie bola laboratórnymi vyšetreniami vylúčená sekundárna príčina hemosiderózy (LE bunky, protilátky proti BMK, glomerulárna filtrácia...). Vyšetrenie kostnej drene potvrdilo aktívnu erytropoézu so zhlukmi železa v makrofágoch, počet sideroblastov bol v norme. S hodnotou hemoglobínu 84 g/l rodičia dieťaťa podpisujú negatívny reverz, je prepustené do domácej starostlivosti. Do nemocnice sa vrátilo už na 2.deň, dôvodom bolo zhoršenie klinického stavu (závažné tachydyspnoe, bledosť, únava), sprevádzané nielen poklesom Hg na 60 g/l, ale aj rozšírením opacít do stredných a dolných pľúcnych polí. Indikované bolo podanie metylprednizonu pulznou formou počas 3 dní (dávka 10 mg/kg/deň), následne sa pokračovalo perorálnym prednizonom.
Aj keď bol priebeh ochorenia komplikovaný rozvojom bronchopneumónie s ATB liečbou (chránený aminopenicilín), liečba kortiosteroidmi bola úspešná, čo dokazoval zlepšený RTG nález hrudníka a úprava krvného obrazu. Anémia bola hyporegeneratívna (nízka hladina retikulocytov a normálne hodnoty železa), liečba bola preto fortifikovaná rekombinantným ľudským erytropoetínom, podávaným 1x denne, 3x týždenne do 10 dávok (100 µ/kg) v kombinácii s nízkou dávkou prednizonu (5 mg/deň). V jej priebehu sme zaznamenali rýchlu úpravu anémie so súbežným zvýšeným saturácie transferínu a znížením hodnôt sérového transferínu [10]. Na uvedenej liečbe remisia trvala viac ako 5 mesiacov.
KAZUISTIKA 2
Jednalo sa o 4-ročnú pacientku, casus socialis, patriacej k rómskemu etniku, ktorá bola prvýkrát hospitalizovaná na našej klinike v marci roku 2017. Dôvodom bola kritická hodnota zložiek červenej krvnej zložky (Hg 29 g/l, Hct 0,1, SoEr 63,9, retikulocytóza 10,4 %). Stav podľa všetkého vznikal dlho so zapájaním kompenzačných mechanizmov pri tolerancii kriticky nízkych hodnôt. Zvýšená hladina celkového, ale aj konjugovaného bilirubínu, vyššia LD, pritom normálna hladina haptoglobínu pri predpokladanej hemolytickej zložke nás naviedla k domnienke o extravaskulárnej hemolýze. Počas tejto hospitalizácie jej bola podaná transfúzia erytrocytov, príčina stavu bola uzatvorená ako multifaktoriálna. Na anémii sa podieľal deficit železa spojený s podávaním kravského mlieka v dojčenskom veku, deficit nutrientov pri sociálnom pozadí dieťaťa, askaridóza aj s Löfflerovým infiltrátom, eozinofília – 6,6 %, diskrétna erytrocytúria a infekt horných dýchacích ciest. Vzhľadom na efektívnosť transfúzie bolo dieťa prepustené do domácej starostlivosti.
Rovnaký scenár sa však opakoval o 2 mesiace, kedy bola hospitalizovaná pre hladinu Hg 48 g/l, uzlinovú formu toxoplazmózy a mykoplazmovú infekciu dýchacích ciest v spádovej nemocnici. Ďalšia laboratórna diagnostika vtedy nebola realizovaná. Nasledovala znova substitučná liečba transfúziou erytrocytov. O 1 mesiac na to sa opäť ocitla na našej klinike s hodnotou Hg 78 g/l. Jedinou udávanou ťažkosťou pri príjme bol kašeľ.
V objektívnom náleze boli prítomné nízky vzrast a malnutrícia, krčná lymfadenopatia, auskultačne piskoty a vrzoty, eupnoe, jemný systolický šelest, tachykardia. Pacientku kompletne laboratórne prešetrujeme, vstupne Hg 82 g/l, Hct 0,25, sideropénia. Rezorbčný test železa potvrdzuje primeraný vzostup po jeho podaní. Osmotická rezistencia erytrocytov bola v norme, čím sme vylúčili hereditárnu sférocytózu. V rámci diferenciálnej diagnostiky doplňujeme HRCT pľúc, kde sa zobrazuje mozaikovitá perfúzia pľúcneho parenchýmu, zmeny v zmysle ground glass opacít (obr. 3 a 4). Realizovali sme bronchoskopické vyšetrenie s bronchoalveolárnou lavážou, makroskopicky s primeraným nálezom, ale odsatá tekutina mala neobvyklú tehlovú farbu (obr. 5). Z hľadiska cytologického rozboru bolo prítomné 96% zástupenie makrofágov, z toho 100 % vyplnené hemosiderínom (obr. 1 a 2), čím bola potvrdená diagnóza pľúcnej hemosiderózy. Vzhľadom na vylúčenie sekundárnych príčin (Goodpasterov syndrom a i.), sme stav uzatvorili ako idiopatickú formu.
Image 1. Cytologické vyšetrenie materiálu z bronchoalveolárnej laváže – farbenie na železo zachytávajúce histiocyty naplnené hemosiderínom, zväčšené 40x.
Fig. 1. Cytological examination of material from bronchoalveolar lavage – pigmentation on iron capturing histiocytes filled with hemosiderin, increased 40x.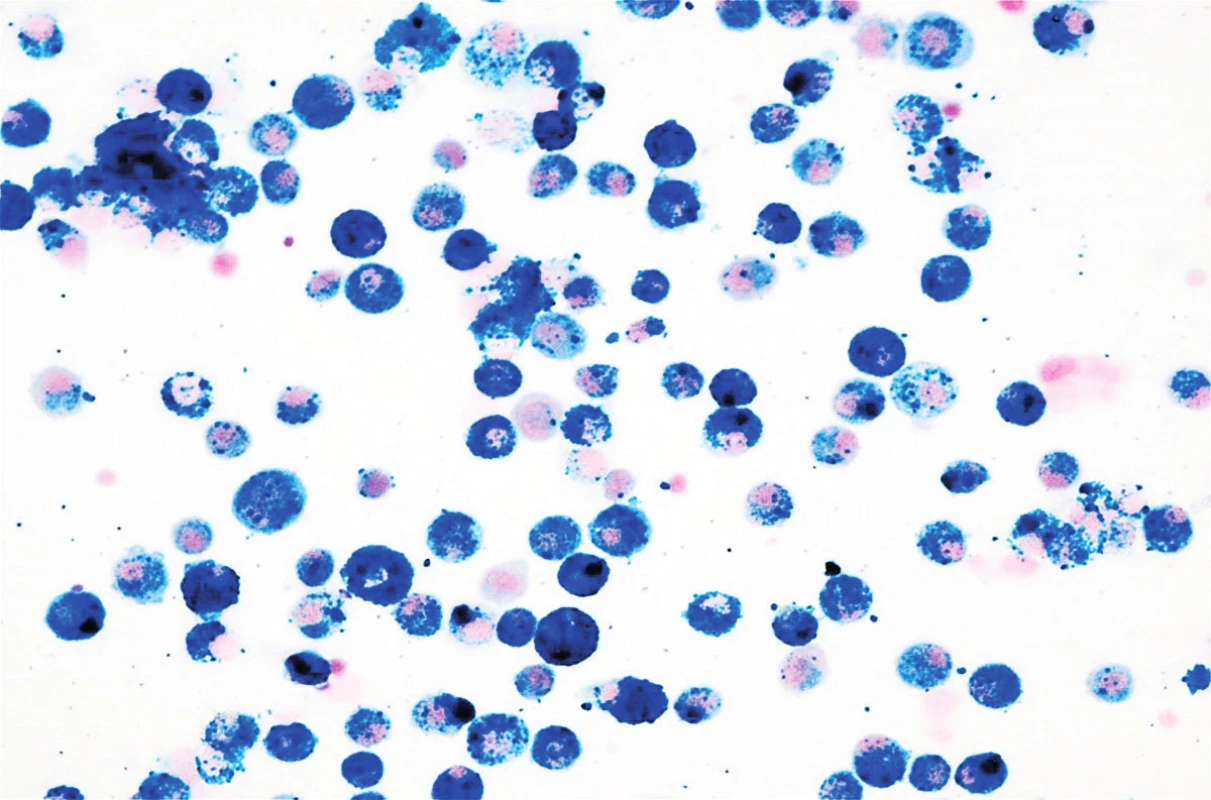
Image 2. Cytologické vyšetrenie materiálu z bronchoalveolárnej laváže. Farbenie podľa Giemsa.
Fig. 2. Cytological examination of material from bronchoalveolar lavage. Coloring by Giems.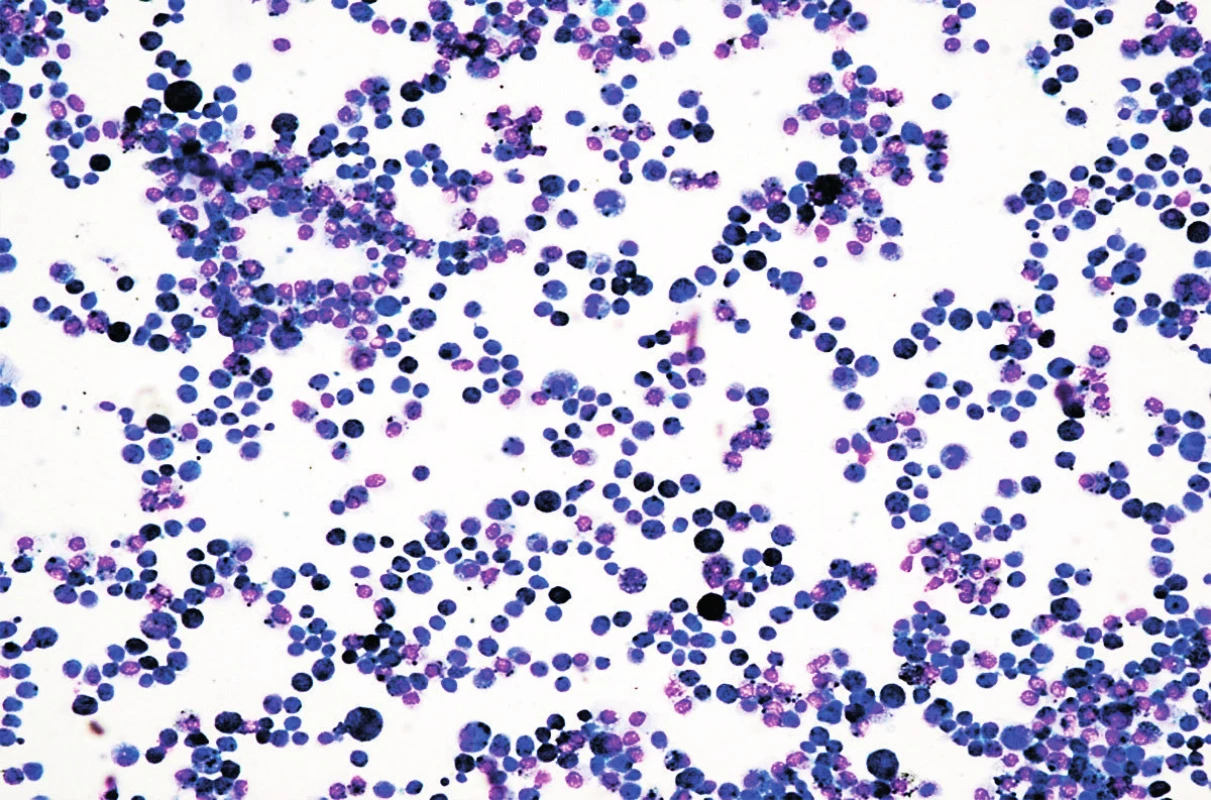
Image 3. HRCT pľúc u našej 4-ročnej pacientky, mozaikovitá perfúzia pľúc ako známka intersticiálneho postihnutia.
Fig. 3. HRCT examination of lung in our 4-year patient, mosaic lung perfusion as a sign of interstitial disability.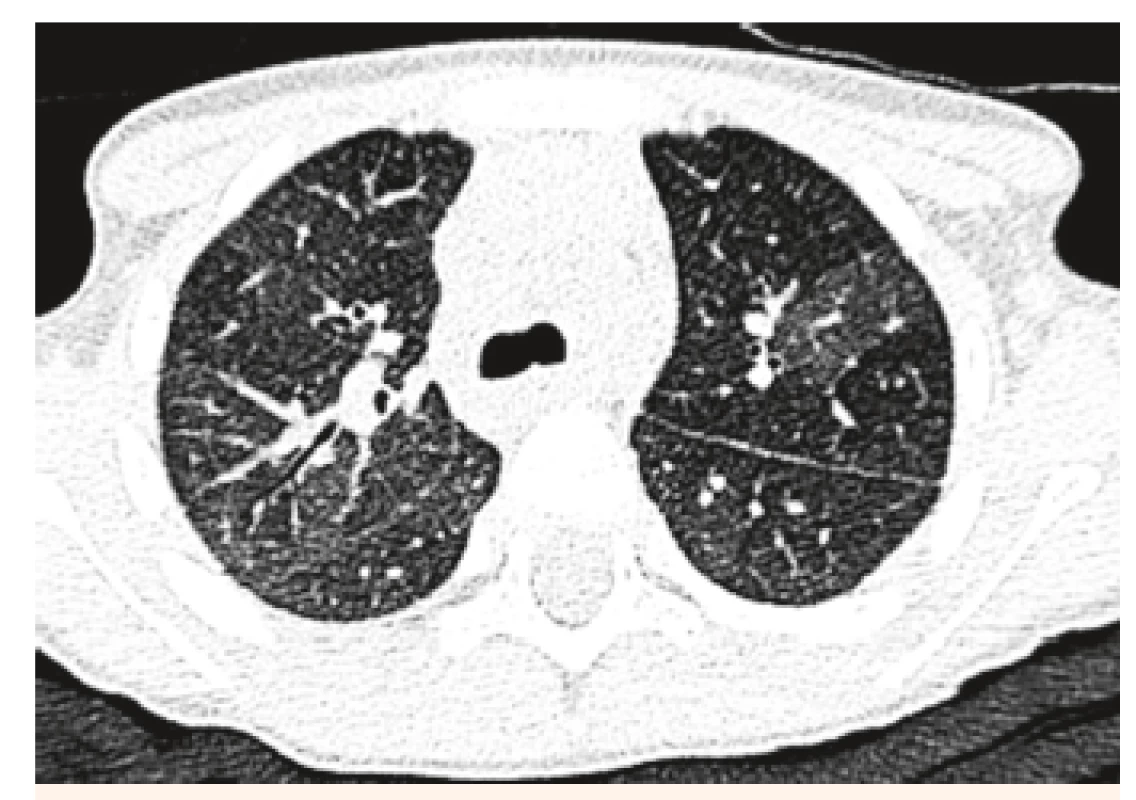
Image 4. HRCT pľúc – vľavo parakadiálne hemoragické ložisko u 4-ročnej pacientky.
Fig. 4. HRCT examination of lung – left paracardial haemorrhagic bearing in a 4-year patient.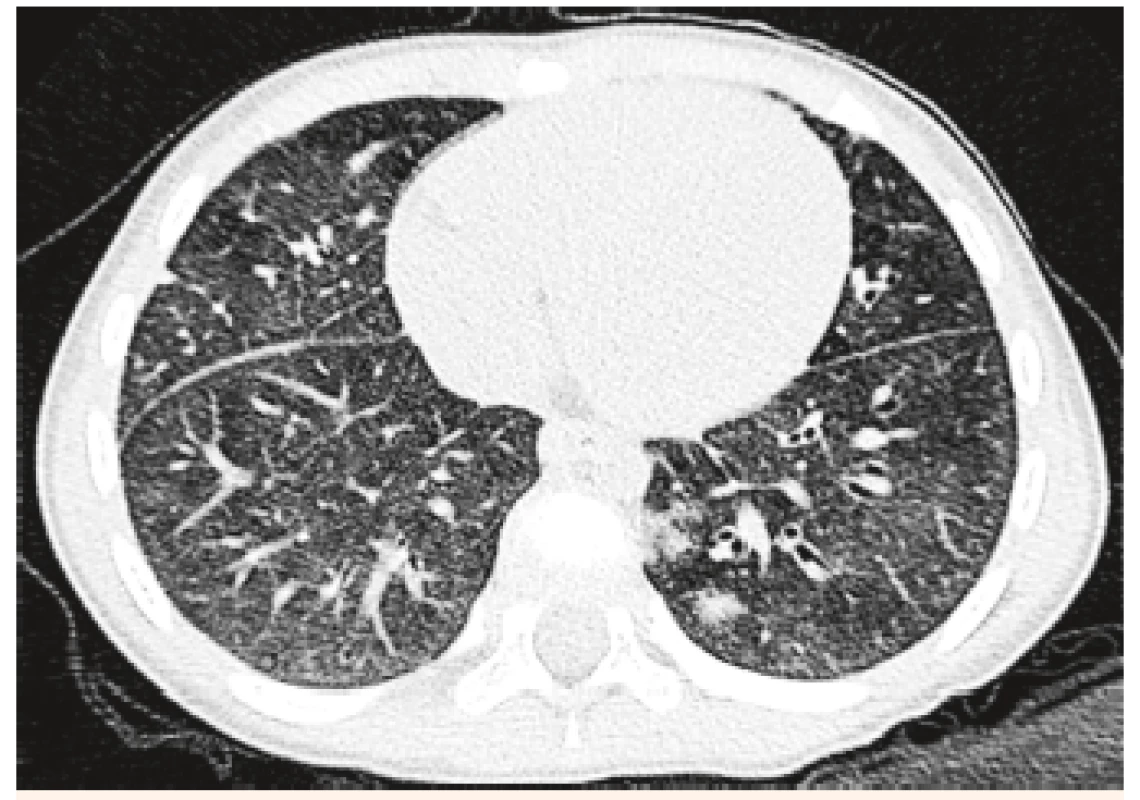
Image 5. Tehlové zafarbenie materiálu z bronchoalevolárnej laváže.
Fig. 5. Brick color of bronchoalveolar lavage material.
V terapii sme zvolili podávanie kortikosteroidov perorálnou formou s postupnou detrakciou v priebehu asi 6 mesiacov. Po uplynutí tohto obdobia sme si pacientku predvolali na rehospitalizáciu za účelom posúdenia efektivity podávanej liečby. V tomto období nevyžadovala substitúciu červenej krvnej zložky. Napriek uspokojivej hladine hemoglobínu (kedy nedochádzalo k ďalšiemu poklesu) a faktu, že na HRCT pľúc došlo k miernej regresii uvedených nálezov, cytologické vyšetrenie aj žalúdočný aspirát opäť potvrdili 100% prítomnosť sideroblastov. Následne liečbu fortifikujeme pridaním azatioprinu, s dobrou toleranciou. V pláne je opätovné prešetrenie s odstupom času a posúdením remisie ochorenie.
ZÁVER
Idiopatická pľúcna hemosideróza aj v súčasnej dobe predstavuje jednu z mála prebádaných diagnóz. Dôvodom je nepochybne nízky výskyt pacientov, čím je výrazne limitovaná možnosť realizovať rozsiahlejšie štúdie a hodnotiť efekt podávanej liečby. Je potrebné na túto diagnózu myslieť pri stave spojených s opakovanou anemizáciou v krvnom obraze sprevádzanou symptomatológiou zo strany respiračného systému vo variabilnej forme.
Napriek obrovskému pokroku na poli medicíny a dokazaným novým medikamentóznym možnostiam však stále ostáva ťažko liečiteľnou chorobou s nejasnou prognózou. V budúcnosti sa vkladá nádej do objavenia nových liečebných možností so zabránením vzniku pľúcnej fibrózy.
Zoznam použitých skratiek
ANA – antinukleárne protilátky
ANCA – protilátky proti cytoplazme neutrofilov
ARDS – syndróm akútnej respiračnej tiesne
BAL – bronchoalveolárna laváž
BKM – bielkovina kravského mlieka
CIK – cirkulujúce imunokomplexy
CK – kreatínkináza
CRP – C-reaktívny proteín
ECMO – extrakorporálna membránová oxygenácia
Er – erytrocyty
FW – sedimentácia erytrocytov
Hg – hemoglobín
HRCT – high-resolution CT
IPH – idiopatická pľúcna hemosideróza
ITP – idiopatická trombocytopenická purpura
JIA – juvenilná idiopatická artritída
LD – laktátdehydrogenáza
RTG – röntgen
SLE – systémový lupus erythematodes
SMA – protilátky proti hladkým svalom
USG – ultrasonografia
VEGF – vascular endothelial growth factor
Došlo: 28. 2. 2018
Přijato: 12. 9. 2018
MUDr. Ivana Gondová , PhD.
Detská klinika SZU
DFNsP
Nám. L. Svobodu 4
974 01 Banská Bystrica
Slovenská republika
e-mail: ivanagondovaa@gmail.com
Sources
1. Rosipal Š, Mikolajová M, Kovalčíková A, et al. Primárna pľúcna hemosideróza. Čes-slov Pediat 2000; 8 : 492–497.
2. Taytard J, Nathan N, de Blic J, et al. New insight into pediatric idiopathic pulmonary hemosiderosis. Orfanet journal of rare disease 2013; 8 : 161.
3. Potalivo A, Finessi L, Facondini F, et al. Severe respiratory distress in a child with pulmonary idiopathic hemosiderosis initially presenting with iron-deficiency anemia. http://dx.doi.org/10.1155/2015/876904.
4. Koker S, Gözmen S, Oymak Y, et al. Idiopathic pulmonary hemosiderosis mimicking iron deficiency anemia: a delayed diagnosis? Hematology Reports 2017; 9 : 7048.
5. Papp Á, Bene Z, Gáspár I, et al. Decreased VEGF level is associated with elevated ferritin concetration in bronchoalveolar lavage fluid of children with interstitial lung disease. Respiration 2015; 90 : 443–450.
6. Šelest M, Herout V, Doležel L, et al. Kvalita diagnostiky a rozdelenie detí liečených v OLÚ s intersticiálnym pľúcnym ochorením. Slovenský Lekár 1997; 4 : 30–32.
7. Doi T, Ohga S, Ishimura M, et al. Long-term liposteroid therapy for idiopathic pulmonary hemosiderosis. Eur J Pediatr 2013; 11 : 1475–1481.
8. Xu L, Ou R, Wu B, et al. Corticosteroid in combination with leflunomide and mesenchymal stem cells for treatment of pediatric idiopathic pulmonary hemosiderosis. Journal of Tropical Pediatrics 2017; 5 : 389–394.
9. Gutierrez S, Shaw S, Huseni S, et al. Extracorporal life support for a 5-week-old infant with idiopathic pulmonary hemosiderois. Eur J Pediatr 2014; 12 : 1573–1576.
10. Dluholucký S, Jakubička J, Králinský K. Humánny rekombinantný erytropoetín v liečbe idopatickej pľúcnej hemosiderózy. Lek Obz 2005; 6 : 263–266.
11. Rosipal Š, Kapellerová A, Tamášová M. Prognóza idiopatickej pľúcnej hemosiderózy v detskom veku. Čes-slov Pediat 2005; 1 : 14–18.
12. Eldem I, Íleri T, Ince F, et al. Idiopathic pulmonary hemosiderosis with allergic asthma diagnosis in a pediatric patient. J Pediatr Hematol Oncol 2015; 37 : 7.
13. Šelest M, Doležel L, Herount V, et al. Fibrobronchoskopia, bronchoalveolárna laváž a transbronchiálna biopsia v diagnostike chorôb pľúcneho interstícia u detí. Čes-slov Pediat 2000; 4 : 230–235.
14. Castellazi L, Patria M, Frati G, et al. Idiopathic pulmonary hemosiderosis in paediatric patients: how to make an early diagnosis. Ital J Pediatr 2016; 42 : 86.
15. Siu K, Li R, Lam S. Unexplained childhood anaemia: idiopathic pulmonary hemosiderosis. Hong Kong Med J 2015; 21 : 172–174.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2019 Issue 3-
All articles in this issue
- Přehled nových, a ještě novějších léků na Duchennovu svalovou dystrofii a spinální svalovou atrofii
- Možnosti nefarmakologické léčby epilepsie u dětí
- Novorozenecké záchvaty
- Fibromuskulárna dysplázia u 2-ročného dieťaťa – kazuistika
- Klinické a laboratórne charakteristiky detí s orálnym alergickým syndrómom
- Primárna pľúcna hemosideróza – skúsenosti z Banskej Bystrice
- Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC
- Editorial: Dětská neurologie
- PUBLIKACE ČESKÝCH PEDIATRICKÝCH NEFROLOGŮ ZA POSLEDNÍ 4 ROKY V ČASOPISECH (HOME PUBMED)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC
- Primárna pľúcna hemosideróza – skúsenosti z Banskej Bystrice
- Přehled nových, a ještě novějších léků na Duchennovu svalovou dystrofii a spinální svalovou atrofii
- Fibromuskulárna dysplázia u 2-ročného dieťaťa – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

