-
Medical journals
- Career
Fibromuskulárna dysplázia u 2-ročného dieťaťa – kazuistika
: J. Surgošová 1; M. Kolníková 1; Ľ. Podracká 2; T. Dallos 2; S. Jakešová 3; P. Talarčík 4
: Klinika detskej neurológie LFUK, NÚDCH, Bratislava, Slovensko 1; Pediatrická klinika LFUK, NÚDCH, Bratislava, Slovensko 2; Rádiologické oddelenie NÚDCH, Bratislava, Slovensko 3; Cythopatos, s. r. o., Bratislava, Slovensko 4
: Čes-slov Pediat 2019; 74 (3): 161-167.
:
Fibromuskulárna dysplázia je nezápalová arteriopatia s fokálnou prestavbou cievnej steny, ktorá vyúsťuje do stenóz, oklúzií, disekcií či aneuryziem. Ochorenie môže postihnúť prakticky každé arteriálne povodie. V dospelej populácii sa vyskytuje najmä v skupine mladých žien a postihuje prevažne renálne povodie.
Autori prezentujú prípad dieťaťa so závažnou perinatálnou anamnézou, u ktorého sa rozvinul klinický obraz rýchlo progredujúceho ischemického postihnutia CNS, sprevádzaný farmakorezistentnou hypertenziou, stenózou renálneho, karotického aj vertebrálneho riečiska a veľmi pravdepodobne aj splanchnických a končatinových artérií. Ochorenie malo u dieťaťa malígny priebeh s fatálnym koncom, čo nie je typický obraz ochorenia u dospelých, ale býva prítomný v detskej populácii.
U dospelých ide síce o raritné, ale dobre opísané ochorenie. V detskom veku však zriedkavosť ochorenia a jeho špecifiká môžu naznačovať, že by napriek rovnakým histopatologickým nálezom mohlo ísť o samostatnú nozologickú jednotku.
Klíčová slova:
fibromuskulárna dysplázia – ischemická cievna mozgová príhoda – arteriálna stenóza – hypertenzia – „ šnúra perál“ – cutis marmorata – hemihypotrofia
ÚVOD
Ischemické cievne mozgové príhody sú v detskom veku vzácne, často sú ale príčinou doživotnej neurologickej morbidity. Etiologicky v tejto vekovej kategórii prevládajú arteriopatie, diferenciálna diagnostika zahŕňa aj disekcie alebo moyamoya syndróm. Objavujú sa aj parainfekčné či zápalové jednotky: fokálne alebo tranzientné cerebrálne arteriopatie, primárna CNS angiitída, či arteriopatia po prekonanej varicele.
Fibromuskulárna dysplázia (FMD) patrí do skupiny idiopatických nezápalových arteriopatií s charakteristickými patologickými aj angiografickými nálezmi [1]. Najčastejšie sa vyskytuje vo forme mediálnej fibroplázie lokalizovanej v renovaskulárnom a cerebrálnom povodí s typickým angiografickým nálezom „šnúry perál“ (string of beads), sprevádzanej refraktérnou hypertenziou a cievnou mozgovou príhodou [1–4].
FIBROMUSKULÁRNA DYSPLÁZIA (FMD) – DEFINÁCIA A KLASIFIKÁCIA
FMD je idiopatické, nezápalové, neaterosklerotické ochorenie artérií, pri ktorom dochádza k fokálnej prestavbe cievnych stien a následne k stenózam, oklúziám, disekciám či tvorbe aneuryziem. Postihuje prakticky všetky arteriálne povodia, predilekčne renálne (58–75 %), karotické a vertebrálne povodie (32 %) a môže postihnúť každú vrstvu arteriálnej steny [5–7]. V dospelej populácii postihuje hlavne ženy vo fertilnom veku [8]. Prevalencia nie je presne známa. Familiárny výskyt sa uvádza v 7–11 %, pričom v tejto skupine ide pravdepodobne o vrodené abnormity cievnej steny, s viazanosťou k špecifickému riečisku [9,10]. Histopatologický obraz FMD korešponduje s dominantným postihnutím jednotlivých vrstiev cievnej steny (média, intima, adventícia). Nahromadenie fibrotického tkaniva v intime sa angiograficky prejaví ako fokálna stenóza. Média je u dospelých postihovaná najčastejšie vo forme: 1. mediálnej fibroplázie, ktorá sa prejavuje striedaním úsekov zúženej médie a úsekov zhrubnutí, v ktorých je normálne svalstvo nahradené fibropláziou s voľným kolagénom – tieto striedania vytvárajú typický angiografický obraz FMD, tzv. „string of beads“ – šnúra perál. Ide o najčastejší variant, typicky sa vyskytuje medzi distálnou tretinou artérie a jej vetvením. 2. Fibroplázia lokalizovaná perimediálne sa angiograficky prejaví nerovnosťou cievnej steny s menšími úsekmi dilatácie. 3. Najmenej častá je hyperplázia hladkého svalstva médie. Pri postihnutí adventície môžu depozity kolagénu presahovať až na periarteriálne tkanivo.
Súčasná klasifikácia FMD sa odvíja od angiografického nálezu a nahradila histopatologickú klasifikáciu. Podľa novej binárnej nomenklatúry sa rozlišujú dva podtypy ochorenia: fokálna a multifokálna FMD [11, 12]. Fokálna FMD je charakterizovaná angiografickým nálezom koncentrickej stenózy zapríčinenej hyperpláziou intimy. Multifokálne ochorenie sa manifestuje klasickým obrazom „šnúry perál“ (string of beads) a zvyčajne korešponduje s mediálnou hyperpláziou [8, 12].
Klinické prejavy FMD závisia od lokalizácie a závažnosti vaskulárnych lézií. V USA registri sa nachádza len 5,6 % asymptomatických pacientov. Postihnutie renálnych artérií sa prejavuje závažnou hypertenziou. Pri izolovanej renálnej FMD sú často prítomné denné bolesti hlavy [5]. Najzávažnejším prejavom cerebrovaskulárneho postihnutia je tranzitórna ischemická ataka alebo cievna mozgová príhoda ( TIA/CMP) a subarachnoidálne krvácanie (SAK). FMD je tiež príčinou spontánnej cervikálnej disekcie u 15–20 % mladých dospelých [1, 2, 8]. Z ďalších príznakov je častá cefalea, v 50 % migrenózna [8, 6], pulzatilný tinnitus, nerotačné vertigo, pocit plnosti uší a hlavy [1, 2]. Z ostatných povodí bývajú postihnuté viscerálne/mesenteriálne artérie, ale aj napr. a. illiaca externa, a. brachialis s obrazom klaudikačných bolestí [1, 2, 5, 13–15]. Postihnutie koronárnych artérií sa môže prejaviť ako akútny koronárny syndróm [1, 8, 16, 17]. Podobné nálezy ako pri FMD sa našli aj v nodálnych artériách SA a AV uzloch v prípadoch náhlej zástavy srdca či SIDS. Aneuryzmy v akejkoľvek lokalite u FMD nachádzame v cca 17 %, najčastejšie v renálnom a karotickom povodí [8, 19–21].
V detskej populácii je FMD veľmi zriedkavá a od dospelej populácie sa líši určitými znakmi. U detí dominuje postihnutie intimy (až v 89 %), s fokálnymi alebo segmentálnymi stenózami, nie sú typické „string of beads“. Obe pohlavia sú postihnuté prakticky rovnako. Kirton v r. 2013 spracoval retrospektívne súbor kanadských detí z registra cievnych mozgových príhod a publikoval štúdiu 81 detí s CMP so suspektnou FMD, ktorá sa histopatologicky potvrdila v 27 prípadoch. V tejto skupine bolo 59 % chlapcov [4]. V r. 2015 R. Green et al. prezentovali retrospektívnu štúdiu 33 pediatrických pacientov z USA registra FMD, v ktorej mierne dominovali dievčatá 57,6 % [3]. Až 1/3 všetkých prípadov sa klinicky prejaví pred 1. rokom života. Podľa Kirtona prevažovala neurologická symptomatológia (70 %) vo forme ischemickej CMP (82 %), a až v 40 % multifokálnej, v 43 % recidivujúcej, na podklade fokálnych stenóz artériálneho karotického povodia (70 %), často viacnásobných (44 %), renálna patológia bola potvrdená v 15 z 27 patologicky dokázaných prípadov FMD (56 %) [4]. Hemoragický stroke je zriedkavý (16 %), častejšie ide o SAK pri aneuryzme alebo intraparenchýmové krvácanie do ischémie. Ďalším rozdielom voči dospelej populácii je pozitívny skríning systémovej arteriopatie (v 76 %) s postihnutím aorty (50 %), mesenterických (43 %), končatinových (21 %) či pľúcnych artérií (14 %). Zistí sa aj postihnutie splenických, hepatických či pankreatických artérií. Prognóza je u detí nepriaznivá, v priemere za 42 mesiacov od začiatku ochorenia dosahuje mortalita 44 % [4, 15].
V diagnostike FMD je zlatým štandardom katetrizačná angiografia, schopná detekovať zmeny menšie ako 0,1 mm. Je najcitlivejšia v zobrazení vetvenia renálnych artérií. Vzhľadom na jej invazívnosť sa preferuje skôr CT-Ag [1, 2, 17, 18, 19]. MR-Ag je viac senzitívna v detekcii „string of beads“ (97 %), v protiklade s detekciou stenóz (50–68 %), najmä pre pohybové/respiračné artefakty [1, 21]. Duplexná USG sa využije buď priamo na meranie šírky lumenu cievy, alebo nepriamo meraním indexu rezistencie, rýchlosti a turbulencie toku.
Kauzálna terapia FMD nie je známa. Symptomatická liečba zahŕňa medikamentóznu: antitrombotickú, antikoagulačnú, antihypertenznú a chirurgickú intervenciu: perkutánnu transluminálnu angioplastiku (PTA), revaskularizáciu, coiling, stenting, clipping. Preventívna antitrombotická liečba ASA v plnej dávke sa odporúča pri symptomatickej aj asymptomatickej cerebrovaskulárnej forme [5, 14]. Antikoagulačná liečba je indikovaná pri disekcii renálnej artérie – podáva sa nízkomolekulový frakcionovaný heparín (LMWH) s následným prechodom na perorálne antikoagulanciá a tiež pri disekcii iných artérií sprevádzaných trombózou. V prípadoch cervikálnej disekcie, štúdia CADISS (The Cervical Artery Dissection In Stroke Study) u pacientov s CMP/TIA nepreukázala významný rozdiel v riziku opakovanej cievnej mozovej príhody pri použití antitrombotickej (2,6 %) verzus antikoagulačnej liečby (1,8 %) [1, 20]. Hypertenzia pri renálnej fibromuskulárnej dysplázii vzniká najmä aktiváciou systému renín – angiotenzín – aldosterón v obličkách [1], odporúčanou antihypertenznou liečbou sú ARB, blokátory kalciových kanálov a diuretiká. Liečba ACEI je v prípade stenózy renálnych ciev kontraindikovaná [6, 21].
Revaskularizácia/PTA je plne indikovaná pri renoarteriálnej forme a farmakorezistentnej hypertenzii a má dôležitý význam pri ochrane renálnych funkcií. Intervencie na karotických a vertebrálnych artériách sú vyhradené len pre symptomatických pacientov. Riešenie aneuryziem podlieha rovnakým kritériám ako u pacientov bez FMD [21].
Pri typickom angiografickom náleze „string of beads“ je diagnóza relatívne jednoznačná. Pri nálezoch stenóz a/alebo miernych nerovnostiach cievnej steny v diferenciálnej diagnostike treba odlíšiť: aterosklerotické postihnutie (okrem veku a prítomnosti rizikových faktorov je tu však aj odlišná distribúcia zmien, pri ateroskleróze hlavne v proximálnom úseku), prechodný spazmus artérie pri katetrizácii alebo po podaní kontrastu (stending waves), Takayasovu arteritídu a veľkobunkovú arteritídu (pri vaskulitídach je zhrubnutie a edém cievnej steny, stenózy, aneuryzmy, disekcie, aj akcelerovaná hypertenzia, klinicky ICMP a TIA, ale aj pozitívne markery systémového zápalu – FW, CRP) [1, 21].
Segmentálna arteriálna mediolýza je tiež vzácne, nezápalové ochorenie artérií, so spontánnymi disek-
ciami, sakulárnymi či fusiformnými aneuryzmami, najmä v oblasti abdominálnej aorty, ale aj v iných povodiach. [1, 22]. Zapríčinená je vakuolárnou degeneráciou buniek hladkého svalstva vonkajšej medie s ich progresívnou stratou [1]. Podobné vaskulárne zmeny ako pri FMD boli opísané aj pri neurofibromatóze I. typu, Ehlersovom--Danlosovom sy, Williamsovom syndróme, vzácnom syndróme reverzibilnej cerebrálnej vazokonstrikcie. Diferenciálna diagnostika zahŕňa tiež moyamoya sy, parainfekčné alebo zápalové ochorenia ciev (napr. fokálna/tranzientná cerebrálna arteriopatia, primárna angiitída, post varicelová angiopatia atď.) [1, 21–24].V článku prezentujeme kazuistiku dieťaťa s fibromuskulárnou dyspláziou a fatálnym koncom.
KAZUISTIKA
Uvádzame dieťa z prvej gravidity, s negatívnou rodinnou anamnézou, ale so závažnou pre - a perinatálnou anamnézou (placenta previa a opakované krvácanie). Gravidita bola ukončená sekciou v 27. týždni s pôrodnou hmotnosťou dieťaťa 850 g a AS 3/5/5 so záverom IRDS II–III. Dieťa bolo následne sledované vo viacerých odborných ambulanciách – pneumologickej pre bronchopulmonálnu dyspláziu s prechodnou podpornou oxygenoterapiou, kardiologickej pre FoA s minimálnou pľúcnou hypertenziou, oftalmologickej pre retinopatiu nedonosených a v neurologickej ako prematurita s VAS.
V 8. mesiaci veku sa objavili epileptické záchvaty charakteru fokálnych motorických záchvatov (hemikonvulzií) s prechodnou pozáchvatovou hemiparézou. CT vyšetrenie preukázalo hypodenznú, pravdepodobne postischemickú léziu F vpravo, na EEG bolo len spomalenie základnej aktivity nad pravou hemisférou (obr. 1). Indikované MRI mozgu okrem ľahkého oneskorenia myelinizácie zobrazilo multifokálne ischemické lézie kortexu F a P vpravo. Nálezy pri širokom skríningu zameranom na vylúčenie metabolického ochorenia z okruhu mitochondropatií, vírusovej encefalitídy, cerebrálnej vaskulitídy, vyšetrení likvoru a genetické na MELAS boli negatívne. Dieťa malo ľahký hypotonický syndróm s dolichocefáliou a mierne oneskorený PMV. V liečbe bol ordinovaný valproát, pri ktorom sa epileptické záchvaty neopakovali. Postupne sa rozvíjala hypotrofia pravostranných končatín a cutis marmorata vpravo. V laboratórnom obraze pretrvávala od 14 mesiacov života konštantná leukocytóza s neutrofíliou nejasnej etiológie (v počte 20–35 tisíc) a postupne sa prehlbujúca anemizácia.
1. CT mozgu (vo veku 8 mes.) – vpravo frontálne, nehomogénna škvrnitá hypodenzná area veľkosti 2,5 x 2 cm.
Fig. 1. Brain CT (age 8 months) – non-homogenous spotty hypodense area 2.5 x 2 cm in the right frontal lobe.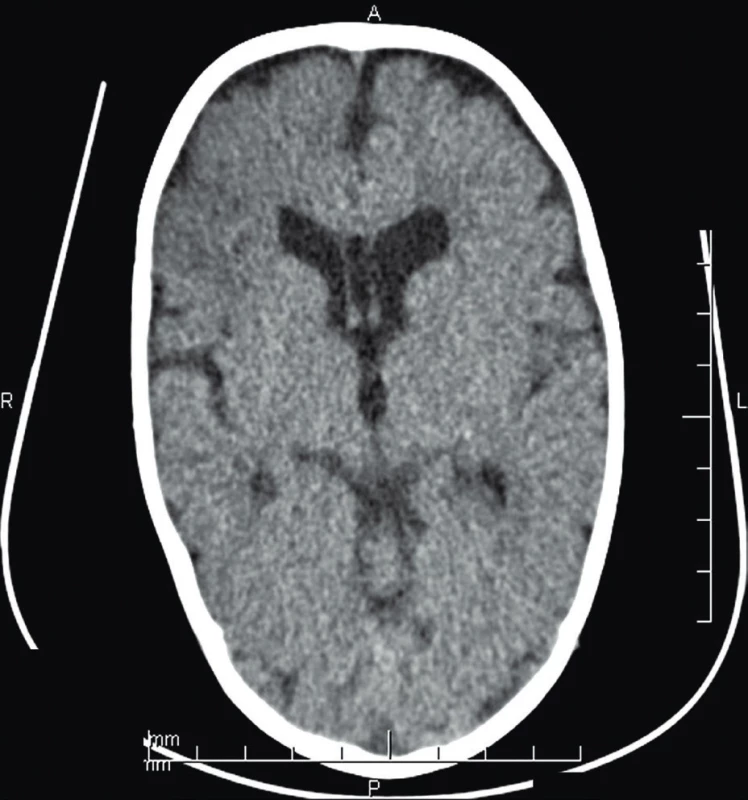
Po dlhšom bezzáchvatovom období vo veku 2 rokov a 3 mesiacov došlo k ich recidíve vo forme status epilepticus ľavostranných hemikonvulzií s pozáchvatovou hemiparézou a respiračným zlyhaním spôsobeným aspiráciou. Následne sme nasadili kombinovanú antiepileptickú liečbu. Na CT mozgu (obr. 2) bola difúzna atrofia pravej hemisféry. RTG hrudníka okrem bronchopneumónie preukázal hraničný kardiotorakálny index.
2. CT mozgu (vo veku 2 r. 3 mes.) – difúzna kortikálna atrofia pravej mozgovej hemisféry, so sekundárne priestrannejším komorovým systémom, progresia nálezu.
Fig. 2. Brain CT (age 2 years 3 months) – diffuse cortical atrophy of the right brain hemisphere with ventricular enlargement, progression of findings.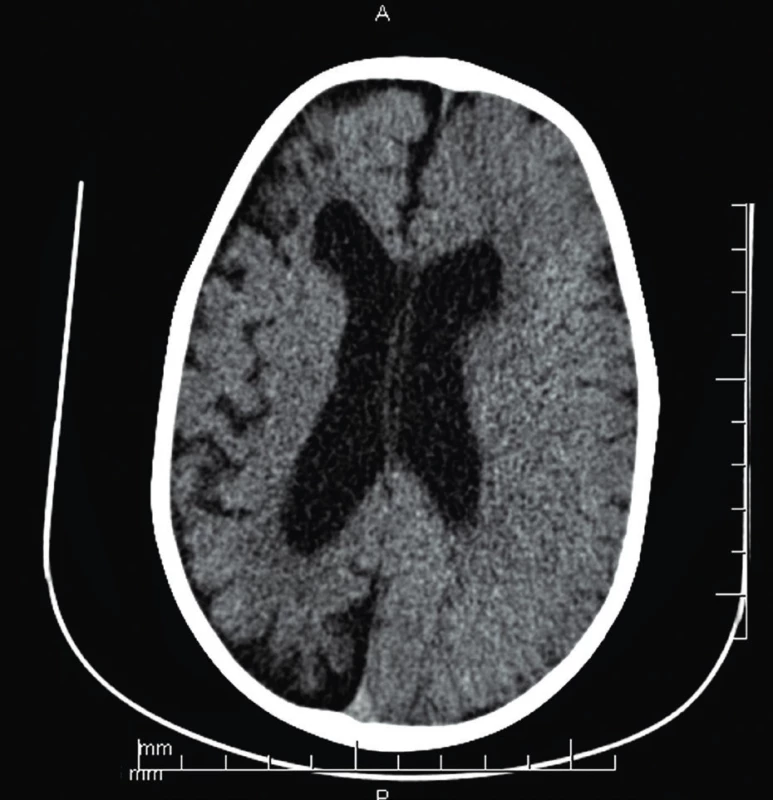
3. CT mozgu (2 r. 4 mes.) – stav po ischémii pravej mozgovej hemisféry vo vývoji s prechodom do malácie. Difúzne akútne ischemické zmeny ľavej mozgovej hemisféry s jej edémom a presunom stredočiarových štruktúr.
Fig. 3. Brain CT (age 2 years 4 months) – post ischaemic lessions of the right brain hemisphere, with development in encephalomalacia. Acute left hemisphere ischemic changes with edema with midline shift.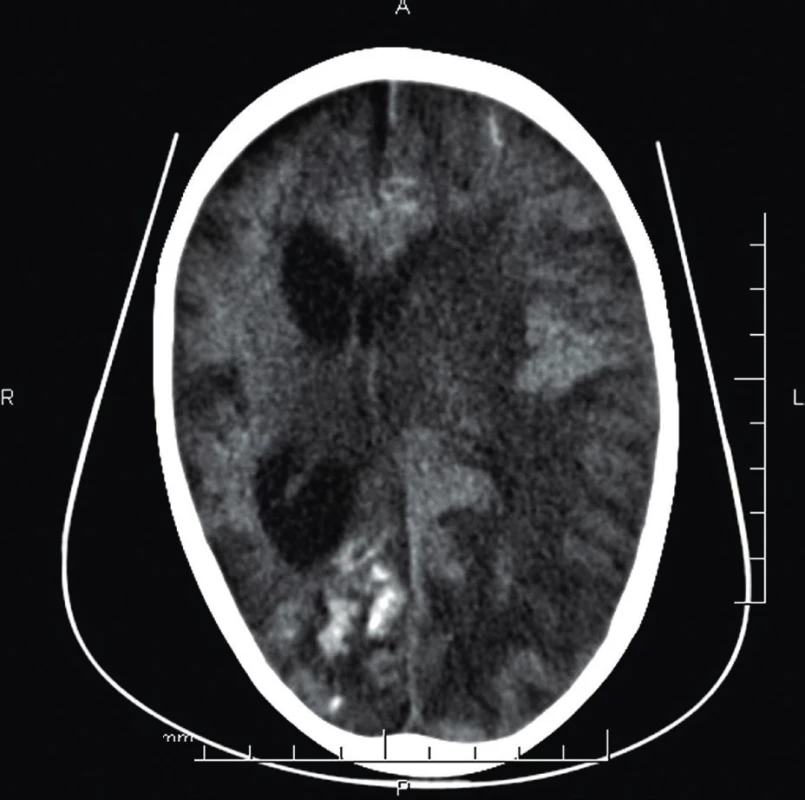
4. CT mozgu (vo veku 2 r. 6 mes.) – významná progresia nálezu s rozsiahlym krvácaním okcipitálne vľavo, hyperdenzity v subarachnoidálnych priestoroch nad pravou hemisférou a okcipitálne obojstranne – kalcifikáty po zakrvácaní. Asymetrický komorový systém, rozšírené III. a IV. komora, presun stredočiarových štruktúr.
Fig. 4. Brain CT (age 2 years 6 months) – significant progression of findings, extensive intraparenchymal heamorage in the left occipital lobe, hyperintesities in the subarachnoid space over the right hemisphere – calcificates after heamorrhage. Asymetric ventricular enlargement of the III and IV ventricle and midlines shift.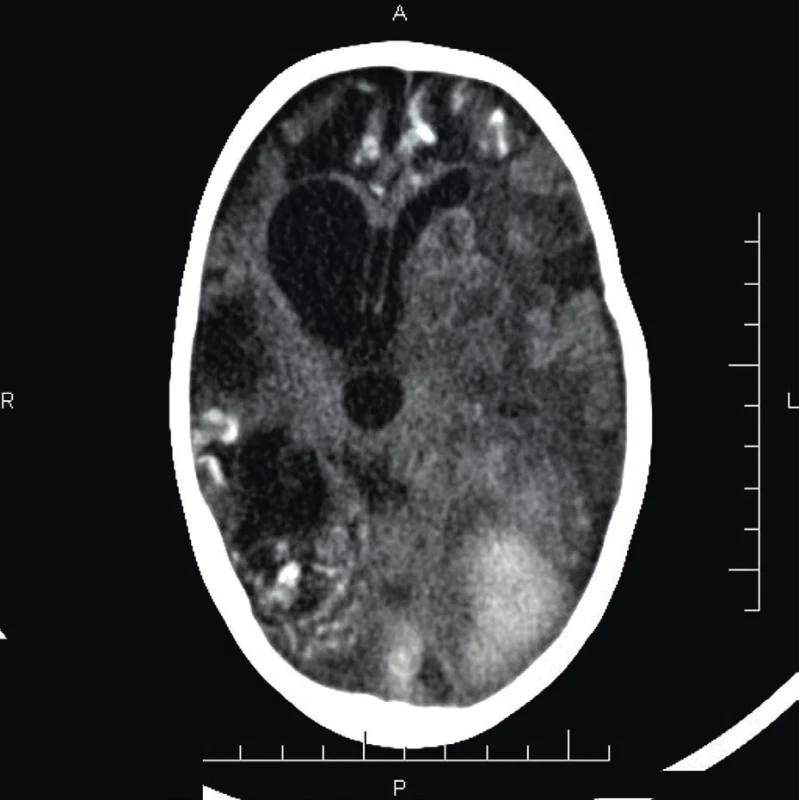
Laboratórne parametre svedčili pre rozvinuté poškodenie renálnych tubulov (hyponatriémia, hypokaliémia, hypokalciémia, hypofosfatémia, hyperurikémia pri referenčných hodnotách kreatinínu). USG obličiek potvrdilo uretrohydronefrózu pravej obličky a zmazanú echoštruktúru ľavej obličky. Klinicky u dieťaťa dominovala závažná hypertenzia s maximom hodnôt systémového tlaku 270/187 mm Hg, rezistentná na intenzívnu kombinovanú antihypertenznú terapiu. Predpokladala sa renoarteriálna etiológia a následné CT-Ag renálnych artérií potvrdilo hypoplastickú až filiformnú a. renalis l. dx (obr. 6). Na ECHO srdca bol nález hypertrofickej kardiomyopatie (LVPW 10–11 mm) ako následek dlhotrvajúcej hypertenzie. Pre život ohrozujúcu hypertenziu (v liečbe blokátory Ca kanála, antagonisti alfa adrenoreceptorov, tiazidové diuretiká, ACEI, intermitentná sedácia) nefrológ odporučil pravostrannú nefrektómiu, ale efekt na pokles systémového krvného tlaku trval len 2 dni. Stav sa komplikoval trombózou pravostrannej v. femoralis (v.s. indukovanej CVK), preto bola ordinovaná terapeutická antikoagulačná liečba LMWH, neskôr s kombináciou antiagregačnej terapie ASA.
V rámci skríningu systémovej arteriopatie sa doplnilo CT-Ag, ktoré zobrazilo normálny nález na hrudnej a brušnej aorte, ale difúznu stenózu pravého karotického riečiska. MRI mozgu (obr. 5) vykazovalo výraznú progresiu akútnych aj subakútnych multifokálnych ischemických zmien s maximom v pravej hemisfére a frontoparietálne vľavo, v kombinácii s chronickými ischemickými zmenami kortexu a bielej hmoty. MR-Ag potvrdila globálnu redukciu arteriálneho riečiska vpravo – filiformná a. vertebralis, absencia signálu ACI vpravo, výrazne redukovaný prietok ACM, ACA vpravo, chýbajúci signál vetiev ACP vpravo. V tom čase sa u dieťaťa vzhľadom na klinický obraz farmakorezistentnej renovaskulárnej hypertenzie, stenotizáciu karotického riečiska vpravo a hemihypotrofiu vyslovilo podozrenie na FMD.
5. MR-Ag (vo veku 2 r. 3 mes.) – zmeny v cievnom riečisku pravej hemisféry: filiformná pravá vertebrálna artéria, chýba prietokový signál ACI l. dx, výrazne redukovaný prietok pravej strany Willisovho okruhu – ACM l. dx, ACA dx, chýba prietokový signál periférnych vetiev ACP dx.
Fig. 5. MR-Ag (age 2 years 3 months) – cerebral arteries changes in the right hemisphere: filiform stenosis of the right vertebral artery, missing flow signal of the right ACI, significantly reduced flow in the right side of the Willis circle – ACM dx, ACA dx, missing flow signal of peripheral branches of the ACP dx.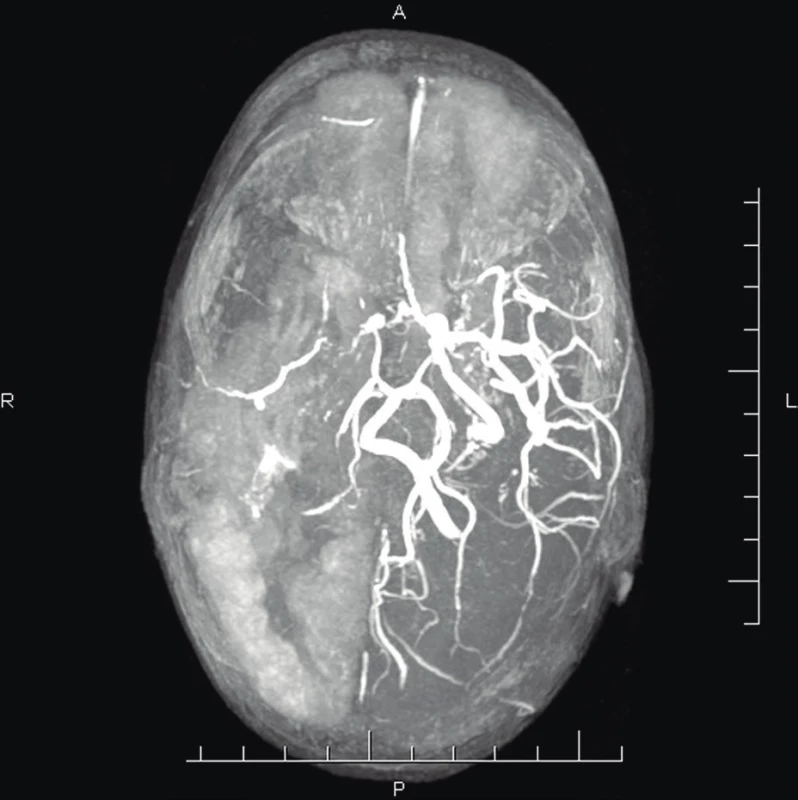
6. CT-Ag renálnych ciev vo veku 2 r. 3 mes. – vpravo renálna artéria výrazne zúžená, vľavo renálna artéria primeranej šírky, bez známok stenózy.
Fig. 6. CT-Ag of renal blood vessels at 2 years 3 months – severe right renal artery stenosis, left renal artery with normal diameter.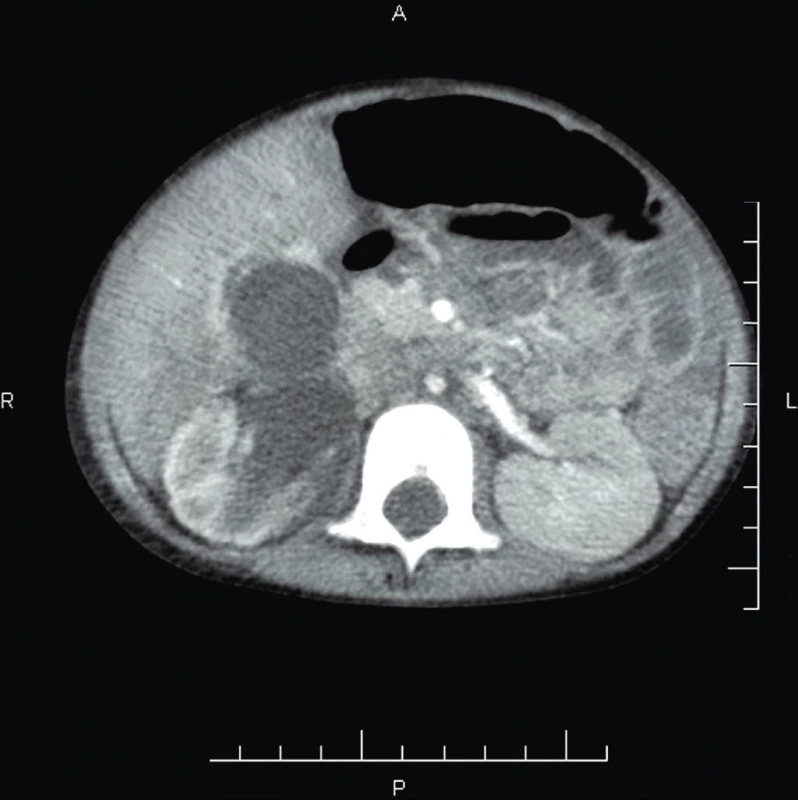
7. String of beads“ (retiazka korálok) – typický nález v renálnej artérii [25].
Fig. 7. String of beads – typical findings in renal artery [25].![String of beads“ (retiazka korálok) – typický nález
v renálnej artérii [25].<br>
Fig. 7. String of beads – typical findings in renal artery [25].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/14cac23ea77aad250cd0304cfa126fea.jpeg)
Vo veku 2 rokov a 4 mesiacov došlo k zhoršeniu stavu dieťaťa a recidíve ľavostranných hemikonvulzií, v akútnom CT mozgu (obr. 3) sa k progresii ischemických zmien pravej hemisféry pridružil výrazný edém ľavej hemisféry s presunom stredočiarových štrukúr a s vývojom herniácie. Po masívnej antiedémovej a antiepiletickej liečbe (fenytoín + kyselina valproová + levetiracetam) sa stav dieťaťa stabilizoval, pretrvávala porucha vedomia (GSC 10–11 bb) a ľavostraná hemiparéza. Prechodne sa objavilo krvácanie do GIT na podklade ischemizácie čreva. Naďalej pretrvávala hypertenzná kríza s TK 218/135 – 184/114 mm Hg, aj napriek kombinácií antihypertenzív v maximálnych dávkach (nitroprusid sodný, metoprolol, hydrochlorothiazid, prazosin, ebrantil, vasocardin, amlodipin, doxazosín, furosemid, catapresan). Kontrolné MRI mozgu po stabilizácii stavu potvrdilo ďalšiu progresiu difúznych ischemických zmien s parciálnou hemoragickou infraceráciou, laminárnymi nekrózami, kortikálnou atrofiou vpravo s vývojom do malácií v bielej hmote a difúzny edém ľavej hemisféry s presunom stredočiarových štruktúr, nález, ktorý je typický pre generalizovanú angiopatiu. CT angiografia potvrdila ďalšiu redukciu pravostranného karotického riečiska ACC a ACI (filiformná).
Kompletné histologické vyšetrenia nefrektomovanej obličky odhalilo difúznu atrofiu kortexu obličky a drene vaskulárneho charakteru, so sporadickými klinovitými akútnymi ischemickými infarktami, zánikom glomerulov a tubulointersticiálnou fibrózou. Cievy a interstícium nevykazovali histologické známky zápalu, v oblasti sínusového tuku boli zachytené drobné a stredne veľké artérie s obrazom fibromuskulárnej dysplázie, fokálne s extrémnym zúžením lúmenu ciev. Histologický nález potvrdil diagnózu multifokálnej fibromuskulárnej dysplázie.
Pri základnej diagnóze dieťaťa, vzhľadom na klinický obraz, zmeny v CNS a pri neexistujúcej kauzálnej a vyčerpanej symptomatickej terapie bolo dieťa po dohovore s rodičmi odovzdané do paliatívnej starostlivosti Detského hospicu Plamienok. Posledné CT vyšetrenie mozgu vo veku 2 rokov a 6 mesiacov (obr. 4) zobrazilo okrem progredujúcich ischemických zmien aj objemné akútne zakrvácanie do ischémie okcipitálne vľavo, subakútne až chronické krvácanie parietálne vľavo a drobné kalcifikáty. Klinicky bolo dieťa naďalej soporózne, bez epileptických záchvatov. Vo veku 2 roky a 8 mesiacov exitovalo za príznakov multisystémového zlyhania.
DISKUSIA
Prvým identifikovaným pacientom s FMD bol 5,5-ročný chlapec s ťažkou hypertenziou pri oklúzii renálnej artérie hladkým svalstvom a s kuratívnym efektom nefrektómie, ktorý opísali v r. 1938 Leadbetter a Burkland. V literatúre sa však s prípadmi FMD u detí stretávame len ojedinele. Podrobnejšiu analýzu predložila retrospektívna kanadská štúdia Kirtona a spol. z roku 2013 [4]. Zo skupiny všetkých detí s ischemickou cievnou mozgovou príhodou autori analyzovali 81 detí so suspektnou FMD (menej ako 1 %). Len 27 prípadov bolo histologicky potvrdených. Táto analýza preukázala zjavné rozdiely v klinickej prezentácii ochorenia medzi detskou a dospelou populáciou. Demonštruje to aj dramatický polymorfný klinický priebeh našho pacienta [4].
Po sumarizácii všetkých nálezov zodpovedá prípad nášho pacienta obrazu FMD – išlo o rizikové dieťa so závažnou pre - a perinatálnou anamnézou, s recidivujúcim a rýchlo progredujúcim ischemickým postihnutím CNS na podklade progredujúcich multifokálnych stenóz pravostranného arteriálneho riečiska a so sekundárnou život ohrozujúcou renovaskulárnou hypertenziou. Klinicky bolo priekazné aj postihnutie iných arteriálnych povodí – opakovaná ischemizácia GIT s obrazom sub - až ileózneho stavu a krvácania, hypotrofia končatín pri susp. stenóze končatinových artérií a cutis marmorata vpravo. Ochorenie prebiehalo malígne s fatálnym koncom. Diagnostické rozpaky nám robili opakované ischemické príhody, CT a MR obraz na mozgu nasvedčoval na vaskulopatiu, ale až histopatologický nález nefrektomovanej obličky priniesol svetlo do neurorádiologického nálezu a objasnil početné recidivujúce ischémie so zakrvácaním a kalcifikátmi. Z neurologického pohľadu náš prípad názorne dokumentuje etiologickú rozmanitosť cerebrálnch cievnych príhod v detskom veku a potvrdzuje významný podiel arteriopatií.
Častý výskyt FMD u detí mladších ako 1 rok, postihnutie viacerých povodí, klinicky dominujúce multifokálne a recidivujúce ischemické postihnutie CNS so závažným priebehom a vysokou mortalitou podporuje úvahu, že ide o vrodenú arteriopatiu. Rovnako sú popisované prípady rýchlo progredujúcich foriem s vývojom ťažkého arteriálneho oklúzneho ochorenia, s postihnutím renálnych a mesenteriálnych artérií, ischemizáciou obličiek a čreva a častými intrakraniálnymi stenózami u detí s pozitívnou perinatálnou anamnézou.
ZÁVER
Fibromuskulárna dysplázia je idiopatická, nezápalová arteriopatia, s raritným výskytom v detskom veku. Napriek tomu, že v dospelej populácii ide o dobre opísanú a známu jednotku, u detí môže byť pre jej vzácny výskyt a odlišnosti od typickej dospelej formy diagnostika komplikovaná. Klinicky by nás kombinácia farmakorezistentnej renovaskulárnej hypertenzie a ischemického postihnutia CNS u detí mala viesť tiež k diferenciálnej diagnostike fibromuskulárnej dysplázie.
Skratky:
- ACC – arteria carotis communis
- ACEI – inhibítor angiotenzín konvertujúceho enzýmu
- ACI – a. carotis interna
- ACP – a. carotis posterior
- ARB – blokátory receptora pre angiotenzín
- AS – Apgarovej skóre
- ASA – kyselina acetylsalicylová
- AV – arteria vertebralis
- CMP – cievna mozgová príhoda
- CT-Ag – CT angiografia
- EEG – elektroencefalografia
- FoA – foramen ovale patens
- g. t. – gestačný týždeň
- IRDS – Infant respiratory distress syndrome
- KTI – kardiotorakálny index
- LEV – levetiracetam
- LMWH – nízkomolekulárny heparín
- LVPW – left ventricular posterior wall
- MR-Ag – MRI angiografia
- NF I. typu – neurofibromatóza I. typu
- PMV – psychomotorický vývoj
- PTA – perkutánna angioplastika
- RCVS – syndróm reverzibilnej cerebrálnej vazokonstrikcie
- TIA – tranzitórny ischemický atak
- VAS – včasný asfyktický syndróm
MUDr. Jana Surgošová
Klinika detskej neurológie LFUK
NÚDCH
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: janka.rokytova@gmail.com
Sources
1. Slovut DP, Olin JW. Fibromuscular dysplasia. N Engl J Med 2004; 350 : 1982–1971.
2. Touze E, Oppemheim C, Trystram D, et al. Fibromuscular dyspalsia of cervical and intracranial arteries. Int J Stroke 2010; 5 : 296–305.
3. Green R, Gu X, Kline-Rogers E, et al. Differences between the pediatric and adult presentation of fibromuscular dysplasia: results from US Registry. Pediatr Nephrol 2015 April; 14. doi 10.1007/s00467-015-3234-z.
4. Kirton A, Crone M, Benseler S, et al. Fibromuscular dysplasia and childhood stroke. Brain 2013; 136 (6): 1846–1856.
5. Plouin PF, Perdu J, La Batide-Alanore A, et al. Fibromuscular dysplasia. Orphanet J Rare Dis 2007; 2 : 28.
6. Tsioufis C, Andrikou I, Siasos G, et al. Anti-hypertensive treatment in periferal artery dinase. Current Opinion in Pharmacology April 2018; 39 : 35–42. https://doi.org/10.1016/j.coph.2018.01.009
7. Cragg AH, Smith TP, Thompson BH, et al. Incidental fibromuscular dysplasia in potential renal donors: long-term clinical follow-up. Radiology 1989; 172 : 145–147.
8. Olin JW, Froehlich J, Gu X, et al. The United States Registry for Fibromuscular Dysplasia: results in the first 447 patients. Circulation 2012; 125 : 3182–3190.
9. Perdu J, Boutouyrie P, Bourgain C, et al. Inheritance of arterial lesions in renal fibromuscular dysplasia. J Hum Hypertens 2007; 21 : 393–400.
10. Grimbert P, Fiquer-Kempf B, Coudol P, et al. Genetic study of renal artery fibromuscular dysplasia [in French]. Arch Mal Coeur Vaiss 1998; 91 : 1069–1071.
11. Persu A, Touze E, Mousseaux E, et al. Diagnosis and management of fibromuscular dysplasia: an expert consensus. Eur J Clin Invest 2012; 42 : 338–347.
12. Savard S, Steichen O, Azarine A, et al. Association between 2 angiographic subtypes of renal artery fibromuscular dysplasia and clinical characteristics. Circulation 2012; 126 : 3062–3069.
13. Debette S, Leys D. Cervical-artery dissections: predisposing factors, diagnosis, and outcome. Lancet Neurol 2009; 8 : 668–678.
14. Touze E, Oppenheim C, Trystram D, et al. Fibromuscular dysplasia of cervical and intracranial arteries. Int J Stroke 2010; 5 : 296–305.
15. Mettinger KL, Ericson K. Fibromuscular dysplasia and the brain. I: Observations on angiographic, clinical and genetic characteristics. Stroke 1982; 13 : 46–52.
16. Yoshimuta T, Akutsu K, Okajima T, et al. Images in cardiovascular medicine: „string of beat“ appearance of bilateral brachial artery in fibromuscular dysplasia. Circulation 2008; 117 : 2542–2543.
17. Pate GE, Lowe R, Buller CE. Fibromuscular dysplasia of the coronary and renal arteries? Catheter Cardiovasc Interv 2005; 64 : 138–145.
18. Sabharwal R, Vladica P, Coleman P. Multidetector spiral CT renal angiography in the diagnosis of renal artery fibromuscular dysplasia. Eur J Radiol 2007; 61 : 520–527.
19. Lu L, Zhang LJ, Poon CS, et al. Digital subtraction CT angiography for detection of intracranial aneurysms: comparison with three-dimensional digital subtraction angiography. Radiology 2012; 262 : 605–612.
20. Kennedy F, Lanfranconi S, Hicks C, et al.; CADISS Investigators. Antiplatelets vs anticoagulation for dissection: CADISS nonrandomized arm and meta-analysis. Neurology 2012; 79 : 686–689.
21. Olin JW, et al. Fibromuscular dysplasia: State of the science and critical unanswered questions. Circulation 2014; 129 : 1048–1078. https://doi.org/10.1161/01. cir.0000442577.96802.8c. Originally published March 3, 2014.
22. Michael M, Widmer U, Wildermuth S, et al. Segmental arterial mediolysis: CTA findings at presentation and follow-up. AJR Am J Roentgenol 2006; 187 : 1463–1469.
23. Schievink WI, Limburg M. Angiographic abnormalities mimicking fibromuscular dysplasia in a patient with Ehlers-Danlos syndrome, type IV. Neurosurgery 1989; 25 : 482–483.
24. Waishaupt J, Herzig R, Krajíčková D, et al. Disekce všech čtyř přívodných mozkových tepen v terénu fibromuskulární dysplazie – kazuistika. Cesk Slov Neurol N 2017; 80/113 (4): 470–473.
25. Plouin PF, Perdu J, Batide-Alanore A, et al. Fibromuscular dysplasia. Orphanet J Rare Dis 2007; 2 : 28.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2019 Issue 3-
All articles in this issue
- Overview of new and even newer drugs for Duchenne muscular dystrophy and spinal muscular atrophy
- Non-pharmacological treatment methods in children with epilepsy
- Neonatal seizures
- Fibromuscular dysplasia in a 2 years old child – casuistics
- Clinical and laboratory characteristics in children with oral allergy syndrome
- Primary pulmonary hemosiderosis – experiences from Banska Bystrica
- Early diagnosis of severe primary immunodeficiencies, TREC/KREC assay
- Editorial: Dětská neurologie
- PUBLIKACE ČESKÝCH PEDIATRICKÝCH NEFROLOGŮ ZA POSLEDNÍ 4 ROKY V ČASOPISECH (HOME PUBMED)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Early diagnosis of severe primary immunodeficiencies, TREC/KREC assay
- Primary pulmonary hemosiderosis – experiences from Banska Bystrica
- Overview of new and even newer drugs for Duchenne muscular dystrophy and spinal muscular atrophy
- Fibromuscular dysplasia in a 2 years old child – casuistics
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

