-
Medical journals
- Career
Volumometrické korekcie vertebrálnych DXA scanov u detí s juvenilnou idiopatickou artritídou
Authors: L. Turoňová 1; K. Kubejová 2; J. Vojtková 1; K. Vorčáková 3; E. Hyrdelová 1
Authors‘ workplace: Klinika detí a dorastu JLF UK a UNM, Martin 1; Klinika detí a dorastu DFN, Košice 2; Dermatovenerologická klinika JLF UK a UNM, Martin 3
Published in: Čes-slov Pediat 2017; 72 (6): 333-340.
Category: Original Papers
Overview
Cieľ:
Stanovením volumometrických DXA parametrov korigovať zmeny BMD súvisiace s predpokladaným rastovým zaostávaním detí s juvenilnou idiopatickou artritídou (JIA) za predpokladu, že vBMD (objemová BMD) dieťaťa s chronickým ochorením aj pri nižšom vzraste môže byť za určitých podmienok ideálna a stanoviť odhady týchto parametrov pre jednotlivé štádiá puberty.Metódy:
Predpokladaný pokles aBMD (areálna BMD) vo vzťahu k oneskorenému rastu a maturácii skeletu detí s JIA bol korigovaný stanovením BMAD (bone mineral apparent density) a WA BMD (width-adjusted BMD), ktoré boli získané prepočtom z vertebrálnych parametrov PA DXA scanov (Hologic) a z párovaných PA a laterálnych DXA scanov (L2–L4). Výstupy boli hodnotené u 60 detí s JIA v porovnaní s kontrolnou skupinou zdravých detí (n = 60).Výsledky:
Zaznamenali sme signifikantné zníženie priemernej hodnoty PA BMD u skupiny detí s JIA (0,206 ± 0,06) v porovnaní s kontrolným súborom (0,602 ± 0,08, p <0,005). Po stanovení volumometrických DXA korekcií sa však priemerné hodnoty BMAD a WA BMD medzi skupinou detí s JIA a skupinou zdravých detí od seba nijako signifikantne neodlišovali (BMAD u pacientov s JIA 0,12 ± 0,06 vs. skupina zdravých detí 0,13 ± 0,07, p = 0,73, WA BMD v skupine detí s JIA 0,19 ± 0,05 vs. kontrolná skupina zdravých detí 0,20 ± 0,07, p = 0,86). Vo výstupoch tiež uvádzame, že hoci sme zaznamenali pokles PA BMD Z–skóre <-2 SD až u 17 (28,3 %) detí s JIA, po stanovení volumometrických prepočtov sme identifikovali iba 8 (13,33 %) JIA subjektov so signifikantným znížením vBMD voči kontrolnej skupine, vyhodnotenej ako na základe PA scanov (BMAD), tak z párovania PA a laterálnych DXA scanov (WA BMD). Zároveň, pri porovnaní Tanner štádií 1–5, prezentujeme WA BMD ako parameter citlivejší na zmeny súvisiace s rastom a sexuálnou maturáciou v porovnaní s BMAD, pričom deklarujeme prudšie tempo jeho nárastu v jednotlivých Tanner štádiách.Záver:
Zníženie BMD založené výlučne na ohodnotení PA DXA scanov môže predstavovať u dieťaťa s chronickým ochorením limitujúcim rast diagnózu významne nadhodnotenú, stanovenú často nesprávne, t.j. aj za predpokladu ideálnej hodnoty vBMD.KĽÚČOVÉ SLOVÁ:
aBMD, BMAD, WA BMD, rast, juvenilná idiopatická artritídaÚVOD
Vzťah zníženia kostnej minerálovej denzity (BMD) a juvenilnej idiopatickej artritídy (JIA) je dlhodobo poznaný. Dvojenergetická röntgenová absorbciometria (DXA) však pri svojej dvojrozmernej projekcii nemôže dostatočne reflektovať skutočnú (volumometrickú) úroveň BMD s ohľadom na reálny stav mineralizácie kosti chronicky chorého organizmu. Nakoľko DXA kalkulácia BMD sa zakladá na stanovení quocientu obsahu kostného minerálu (BMC) v projikovaných areách (g/cm2), jej vplyv na zohľadnenie skutočnej mineralizácie kosti sa zdá byť len parciálny, t.j. nezohľadňujúci hĺbku stavcov [1–3]. S ohľadom na existenciu významných korelácií plošnej BMD v oblasti bedrovej chrbtice voči telesnej výške [4], tak bez volumometrického prepočtu (g/cm3) môžu byť výsledky štúdií reflektujúce v našich geografických podmienkach pomerne vysokú prevalenciu zníženia PA BMD (BMD z posteroanteriórneho scanu) u detí s JIA (t.j. u detí s chronickým ochorením, ktorých konečná výška môže byť vo všeobecnosti nižšia), výrazne nadhodnotené. Zmätočný efekt veľkosti kosti pri vyhodnotení DXA scanov je dlhodobo známy a bolo už navrhnutých viacero analytických stratégií pre odhad vBMD (objemová BMD) tela stavca z premietaného PA alebo AP scanu pomocou matematických výpočtov vychádzajúcich z rozmerov kostí (bone area) a BMC [5, 6]. Odhady založené na spárovaných PA a bočných scanoch sú vypočítané prirovnaním tela stavca k eliptickému valcu. Výsledky týchto meraní boli publikované vo viacerých významných publikáciách [7].
Za účelom korekcie predpokladaného falošného poklesu PA BMD pri očakávanom zaostávaní v raste u chronicky chorého dieťaťa boli ciele práce definované takto: 1) u detí s JIA stanoviť nevolumometrické aj volumometrické parametre z vertebrálnych DXA scanov a porovnať ich voči kontrolnej skupine zdravých detí, 2) stanovením volumometrických DXA parametrov korigovať zmeny aBMD (areálna BMD) súvisiace s predpokladaným rastovým zaostávaním detí s JIA za predpokladu, že vBMD dieťaťa pri nižšom vzraste môže byť za určitých podmienok aj ideálna, 3) stanoviť odhady objemových parametrov pre jednotlivé štádiá puberty, 4) ohodnotiť korelácie DXA parametrov voči niektorým charakteristikám odzrkadľujúcim aktivitu a disabilitu choroby a voči charakteru liečby (kortikoterapia) a tým identifikovať klinické markery súvisiace s reálnym znížením úrovne kostného zdravia v súvislosti s JIA.
MATERIÁL A METÓDY
Do štúdie, realizovanej od novembra 2008 do januára 2014, bolo zaradených celkom 60 pediatrických subjektov vo veku od 6–19 rokov, napĺňajúcich kritériá ILAR (International League of Associations of Rheumatologists) [8] pre diagnózu JIA a 60 zdravých detí zodpovedajúceho veku a pohlavia. V tejto súvislosti bolo dieťa definované ako zdravé po podrobení sa klinickému vyšetreniu a na základe deklarácie rodiča alebo legitímneho zákonného zástupcu dieťaťa. Boli zaradené výlučne subjekty kaukazskej rasy. Pred zaradením do štúdie bola účasť všetkých subjektov právne ošetrená písomným informovaným súhlasom získaným od rodičov alebo od legitímnych zákonných zástupcov detí štúdie zúčastnených. Projekt bol pred zahájením schválený Etickou komisiou JLF UK v Martine.
Demografické údaje a antropometrické merania, Tanner staging
Všetky antropometrické merania boli vykonané v čase realizácie DXA scanov. Súborne boli u všetkých zaradených subjektov zaznamenávané vek, pohlavie, výška, váha a BMI (body mass index). Výstupy z antropometrických meraní sme zaznamenávali špecificky pre vek a pohlavie (percentilové grafy). U každého subjektu bolo ohodnotené štádium puberty, Tanner 1–5.
Realizácia DXA scanov lumbálnej chrbtice a odhady objemových parametrov
Realizácia DXA scanov lumbálnej chrbtice (L2–L4) bola vykonaná za použitia prístroja Hologic QDR Discovery A (S/N 83944). Merania sa uskutočnili za použitia štandardných techník polohovania. Po ukončení PA (posteroanteriórneho) skenovania sa C-rameno prístroja automaticky otáča o 90 stupňov bez toho, aby bol subjekt traumatizovaný ďalšou zmenou polohy na chrbte a vykoná sa laterálny scan. Keďže všetky DXA prístroje Hologic sú vo výstupoch pri laterálnom skenovaní obmedzené na oblasť L2–L4 (vzhľadom k anatomickej interferencii oblasti L1 a priľahlého rebra), aj výstupy z vertebrálnych DXA scanov v práci sú obmedzené na oblasť L2–L4. Z PA a laterálnych DXA vertebrálnych scanov sme automaticky získali dvojdimenzionálne hodnoty PA area, PA BMC, laterálnej arey a laterálneho BMC. Regiónom záujmu (ROI) pri laterálnom scanovaní bolo samotné telo stavca a následne automaticky definovaný subregión centrálnej oblasti tela, tzv. „midregión“, ktorý v podstate reprezentuje oblasť tela stavca s vyšším podielom trámcovej kosti. Následne bol realizovaný odhad volumometrických parametrov, tzv. BMAD (získaná z PA scanov) a WA BMD (získaná z párovania PA a laterálnych scanov) a to nasledujúcim spôsobom: a) stanovili sme PA objem (tzv. PA volume), ktorý možno matematicky vyjadriť ako (area)1,5, b) bola určená BMAD, ktorej výpočet vychádza z predchádzajúceho vzťahu a je kalkulovaná ako PA BMC//(PA area)1,5, c) bol stanovený odhad WA objemu z párovania PA a laterálnych DXA scanov (tzv. WA volume), kalkulovaný ako [(Π/4)x(PA vertebrálna šírka)x(laterálna hĺbka)x(vertebrálna výška)], d) bola určená hodnota WA BMD podľa vzťahu laterálny BMC/(WA volume).
Bližšia charakteristika súboru detí s JIA
Deti s JIA boli zaradené k príslušnému subtypu podľa kritérií ILAR [8]. Okrem vyššie už uvedených demografických, či antropometrických údajov a Tanner stagingu boli v súbore detí s JIA vyhodnocované nasledujúce parametre: trvanie choroby, rýchlosť sedimentácie erytrocytov (FW), celkové ohodnotenie aktivity choroby lekárom na 10 cm vizuálnej analógovej škále (VAS), počet opuchnutých kĺbov, počet bolestivých kĺbov, počet kĺbov s obmedzenou pohyblivosťou, počet kĺbov s aktívnou artritídou, CHAQ (Childhood Health Assessment Questionnaire) disability index (vyjadrujúci index funkčnej neschopnosti) [9], pozitivita ANA (antinukleárne protilátky), pozitivita RF (reumatoidný faktor) a liečba kortikoidmi. Ohodnotenia všetkých klinických parametrov, ohodnotenie indexu disability pomocou CHAQ a laboratórne odbery boli vykonané v deň realizácie DXA scanu. Taktiež bol u každého dieťaťa zaznamenávaný anamnestický údaj o vzniku fraktúry (kdekoľvek a kedykoľvek v priebehu života). Tieto parametre sme korelovali voči vyššie uvedeným DXA položkám.
Štatistická analýza
Výsledky sme analyzovali pomocou štatistických programov SPSS (verzia 14.0, SPSS Inc. Chicago, IL 60606-6412, USA). Všetky numerické hodnoty sme prezentovali ako priemer ± štandardná odchýlka (SD). Nominálne dáta prezentujeme priamo číselným a percentuálnym vyjadrením. Jednotlivé numerické hodnoty sme vzhľadom na neparametrické rozloženie súboru porovnali pomocou Spearmanovho korelačného koeficientu ρ (ró) a jeho p. Hodnoty p ≤0,05 vyjadrili štatisticky významný rozdiel medzi porovnávanými premennými. Nominálne dáta sme s ohľadom na rozloženie súboru porovnávali pomocou Fisherovho exaktného testu (ak bolo indikované) alebo pomocou chi kvadratického χ2 testu, p ≤0,05 reflektuje štatistickú významnosť.
VÝSLEDKY
V skupine detí s JIA sme vyšetrili 35 dievčat a 25 chlapcov, v kontrolnej skupine bolo zastúpenie dievčat a chlapcov rovnaké (p = 1,00). Priemerný vek kontrolnej skupiny bol porovnateľný so skupinou detí s JIA a síce 9,9 ± 1,8 roka u kontrolnej skupiny a 10,2 ± 1,8 roka u skupiny detí s JIA (p = 0,91). Percentil váhy sa pohyboval v priemere na úrovni 59,7 ± 25,3 v kontrolnej skupine a 42,5 ± 29,4 v skupine detí s JIA (p <0,05). Nameraná hodnota výšky pacientov sa pohybovala v priemere na úrovni 55,2 ± 23,1 percentilu u kontrolnej skupiny a 45,1 ± 27,4 percentilu v skupine detí s JIA (p <0,05). Body mass index sa v priemere pohyboval na úrovni 57,8 ± 21,3 percentilu u kontrolnej skupiny v porovnaní s hodnotou 45,5 ± 30,3 percentilu u skupiny detí s JIA (p <0,05).
Výstupy z plošných DXA scanov a základná charakteristika choroby
Priemerná hodnota BMD v oblasti L2–L4 zdravých detí sa pri vyhodnotení plošných PA lumbálnych scanov pohybovala na úrovni 0,602 ± 0,08 g/cm2, v porovnaní so skupinou detí s JIA, kde sme zaznamenali signifikantne nižšie hodnoty PA BMD (0,206 ± 0,06, p <0,005). Vo vyšetrovanom súbore pacientov s JIA (n = 60) sme zaznamenali až u 17 detí (28,3 %) zníženie PA BMD Z-skóre s ohľadom na vek (Z-skóre <-2,0). Priemerná hodnota Z-skóre v skupine detí s JIA so znížením PA BMD sa pohybovala na úrovni -2,09 ± 0,08. Obe skupiny detí s JIA (deti s hodnotou BMD Z-skóre do -2,0 SD vs. deti s hodnotou BMD Z-skóre <-2,0 SD sme vzájomne porovnali vo vzťahu k niektorým klinickým a laboratórnym charakteristikám ochorenia ako aj vo vzťahu k niektorým charakteristikám liečby (kortikoterapia). Do súboru sme zaradili 60 detí s JIA, z toho 7 (11,66 %) detí s JIA so systémovým začiatkom (SoJIA), 16 (26,66 %) detí s JIA polyartritídou (pre málopočetnosť RF-pozitívnych polyartritíd ohodnocujeme séropozitívne a séronegatívne polyartritídy spolu), 20 (33,33 %) perzistentných JIA oligoartritíd, 6 (10 %) extendovaných JIA oligoartritíd, 5 (8,33 %) detí s JIA asociovanou s entezitídou (JIA ERA), 4 (6,66 %) deti s JIA psoriatickou artritídou (JPSA) a dve deti s bližšie nediferencovanou JIA (3,33 %).
Pri vyhodnotení DXA PA lumbálnych scanov súborne možno konštatovať, že sme v skupine detí s JIA so znížením BMD Z-skóre oproti skupine detí s JIA s normálnymi hodnotami BMD Z-skóre zaznamenali vyššie zastúpenie ANA pozitívnych detí (p <0,005) so skorým začiatkom ochorenia (p <0,05). Deti so znížením BMD Z-skóre mali zároveň dlhšie trvanie choroby (p <0,05) a tiež aktivita základného ochorenia, hodnotená podľa Gianniniho kritérií [10], bola v tejto skupine súborne signifikantne vyššia. Rovnako vyššia bola v súbore JIA pacientov so znížením BMD Z-skóre aj úroveň disability (CHAQ disability index) (p <0,05) a vyšší bol súborne i podiel detí, ktoré anamnesticky alebo aktuálne užívali kortikoterapiu (p <0,005). Základnú charakteristiku choroby v skupine detí s JIA so znížením BMD Z-skóre oproti skupine detí s JIA s normálnymi hodnotami BMD Z-skóre uvádzame v tabuľke 1.
Table 1. Vybrané charakteristiky JIA vo vzťahu k zníženiu BMD Z-skóre. 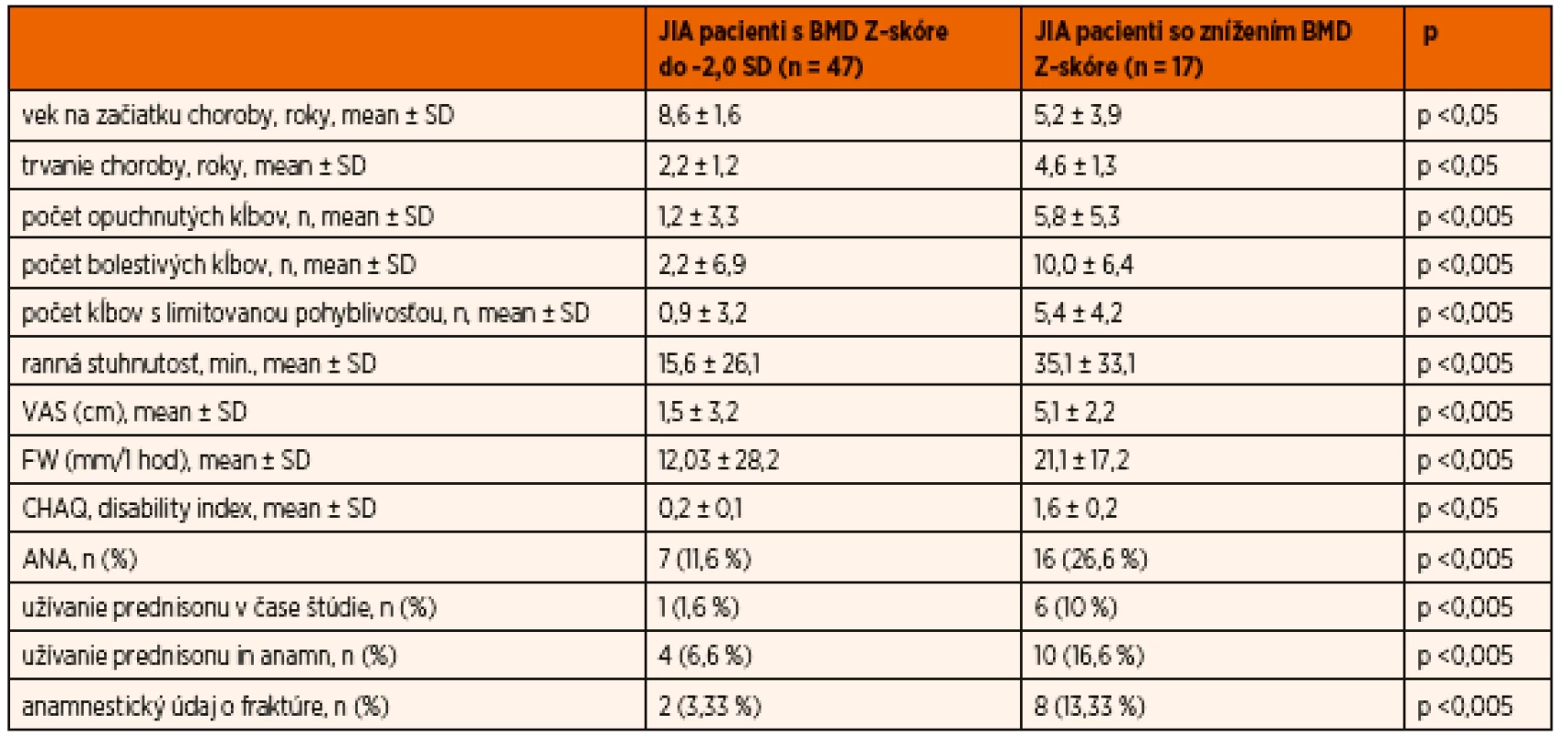
JIA – juvenilná idiopatická artritída; FW – rýchlosť sedimentácie erytrocytov; CHAQ – Childhood Health Assessment Questionnaire; ANA – antinukleárne protilátky; VAS – vizuálna analógová škála Porovnanie výstupov z plošných a párovaných DXA scanov navzájom a voči antropometrickým údajom
Vo výstupoch ohodnotenia plošných scanov u pacientov s JIA sme zaznamenali signifikantné korelácie plošných DXA parametrov (PA area, PA BMC a PA volume) voči výške (p <0,05). Po odstránení jedného zo základných parametrov skresľujúcich výstup DXA PA scanu (a síce po odstránení BMC kortikálneho tŕňového výbežku z ohodnotenia tým, že bol zrealizovaný laterálny scan) sme vo výstupoch zaznamenali až extrémne signifikantné korelácie DXA parametrov získaných z laterálneho scanu voči výške (p <0,005), avšak menej signifikantné korelácie laterálnych DXA parametrov voči PA BMC a ostatným PA DXA parametrom (pozn.: hodnoty laterálneho BMC voči PA BMC po odstránení kortikálneho tŕňovitého výbežku tela stavca boli oproti hodnotám PA BMC signifikantne nižšie).
Výsledky odrážajú skutočnosť, že trabekulárna zložka sa počas procesu rastu a dospievania výrazne zvyšuje, zatiaľ čo kortikálna zložka ostáva viac-menej konštantná. Laterálny BMC, ktorý má po odstránení kortikálneho výbežku stavca z ohodnotenia reprezentovať prevažne trabekulárnu zložku kosti, sa teda zdá byť omnoho citlivejším markerom na zmeny BMD počas rastu, ako PA BMC. Po stanovení volumometrických odhadov z plošného scanu (BMAD) a párovaných PA a laterálnych scanov (WA BMD a WA volume) deklarujeme, že tieto parametre boli v našich výstupoch vo vzťahu k výške po zohľadnení hĺbky stavca menej závislé od telesnej výšky v porovnaní s výstupmi z plošných DXA scanov (stredne signifikantné korelácie). Hodnoty volumometrických odhadov však extrémne signifikantne korelovali medzi sebou (p <0,001). Súborne tieto výstupy uvádzame graficky na obrázku 1.
Image 1. Korelácie (r) vybraných DXA parametrov voči výške. p <0,05 pre všetky uvedené. Veľmi významné až extrémne signifikantné vzťahy nevolumometrických DXA parametrov voči výške (p <0,005). Stredne signifikantné korelácie volumometrických parametrov voči výške, r = 0,3–0,5 (značne nižšia závislosť volumometrických parametrov od výšky) 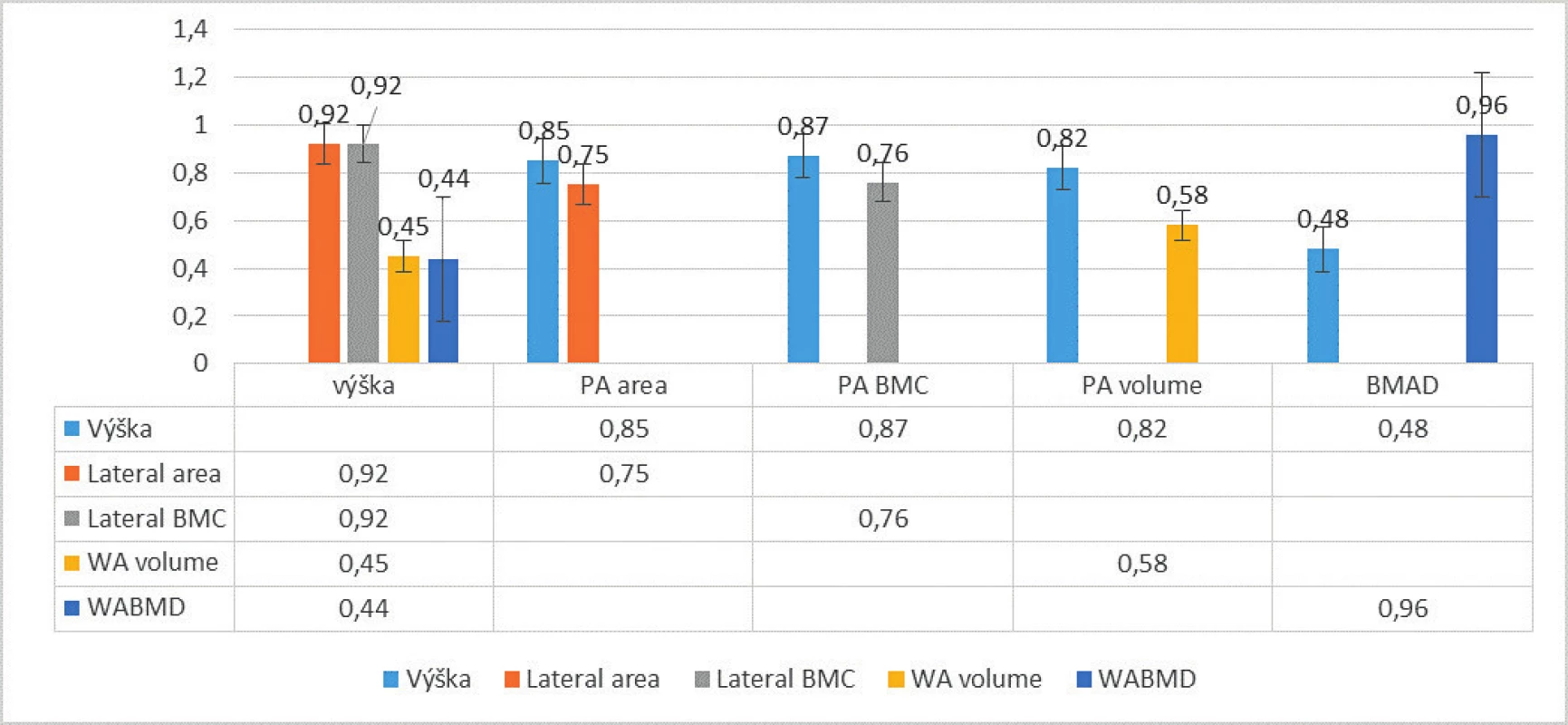
Vysvetlivky skratiek: BMAD – bone mineral apparent density; BMC – obsah kostného minerálu; PA – posteroanteriórny; WA – width- adjusted; WA BMD – width-adjusted bone mineral density Porovnanie volumometrických DXA parametrov v skupine detí s JIA voči kontrolnej skupine a Tanner staging
Priemerné hodnoty BMAD sa medzi skupinou pacientov s JIA (0,12 ± 0,06) v porovnaní s skupinou zdravých detí (0,13 ± 0,07) od seba štatisticky signifikantne nelíšili. V porovnaní štádií Tanner 1–5 sa od seba hodnoty BMAD pre jednotlivé Tanner štádiá medzi skupinou zdravých detí a skupinou detí s JIA taktiež štatisticky signifikantne neodlišovali. U detí s JIA sme zaznamenali porovnateľné hodnoty BMAD v skupine detí s Tanner 1 (0,09 ± 0,05) a Tanner 2 (0,09 ± 0,03), prudší nárast BMAD v štádiu Tanner 3 (0,12 ± 0,03) a Tanner 4 (0,15 ± 0,02), ktorý sa už v štádiu Tanner 5 zvyšoval len minimálne (0,16 ± 0,02). Hodnoty WA BMD v skupine detí s JIA v porovnaní s kontrolnou skupinou zdravých detí znova nevykazovali štatisticky signifikantné rozdiely (0,19 ± 0,05 vs. 0,20 ± 0,07) a v jednotlivých Tanner štádiách vykazovali prudší nárast v porovnaní s BMAD. V porovnaní štádií Tanner 1–5 sme tiež v skupinách detí s JIA oproti BMAD zaznamenali nárast WA BMD pre každé Tanner štádium, avšak znova boli podobné hodnoty medzi štádiami Tanner 1–2 a štádiami Tanner 4–5. Vzostup WA BMD v Tanner štádiu 5 bol minimálny (Tanner 1 – 0,16 ± 0,04, Tanner 2 – 0,17 ± 0,05, Tanner 3 – 0,20 ± 0,05, Tanner 4 – 0,23 ± 0,07 a Tanner 5 – 0,24 ± 0,2). Tieto hodnoty sa od zdravých detí klasifikovaných podľa príslušných štádií Tanner 1–5 medzi sebou štatisticky signifikantne neodlišovali a súborne možno konštatovať, že najprudší nárast volumometrických parametrov sme zaznamenali u všetkých detí zhruba v polovici puberty.
V súbore sme identifikovali 8 subjektov s JIA majúcich signifikantne nižšiu hodnotu BMAD (0,08 ± 0,02) a WA BMD (0,15 ± 0,04) voči kontrolnej skupine zdravých detí pre daný Tanner staging (p <0,001). Súborne šlo o deti s vyšším priemerným vekom oproti priemernému veku celej skupiny s JIA, so včasnejším začiatkom choroby, s vyššou aktivitou a disabilitou (CHAQ disability index) (p <0,001 pre všetky vyššie uvedené). Všetky identifikované subjekty anamnesticky alebo v predchádzajúcom období užívali kortikoterapiu a u väčšiny z nich sme anamnesticky zaznamenali údaj o fraktúre (6 z 8, t.j. 75 %). Vyššie uvedené výsledky bližšie charakterizujeme v tabuľkách 2 a 3. Grafické vyjadrenie prudkého nárastu objemových parametrov v polovici puberty ako aj porovnanie nárastu WA BMD voči BMAD prezentujeme na obrázku 2.
Table 2. Hodnoty BMAD a WA BMD u analyzovaného súboru detí s JIA v porovnaní s kontrolnou skupinou. 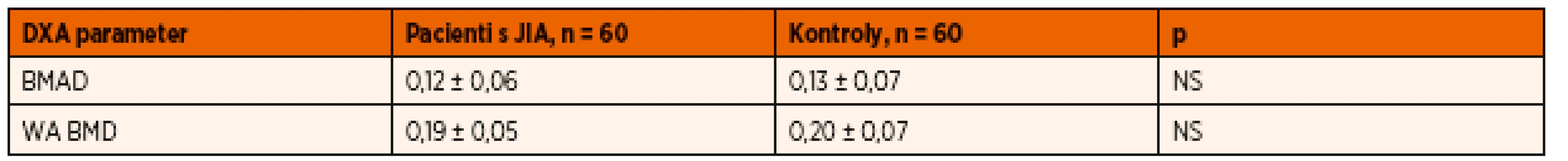
BMAD – bone mineral apparent density; WA BMD – width-adjusted bone mineral density; JIA – juvenilná idiopatická artritída; NS – nesignifikantný Table 3. Hodnoty BMAD a WA BMD u analyzovaného súboru detí s JIA pre jednotlivé štádiá puberty. 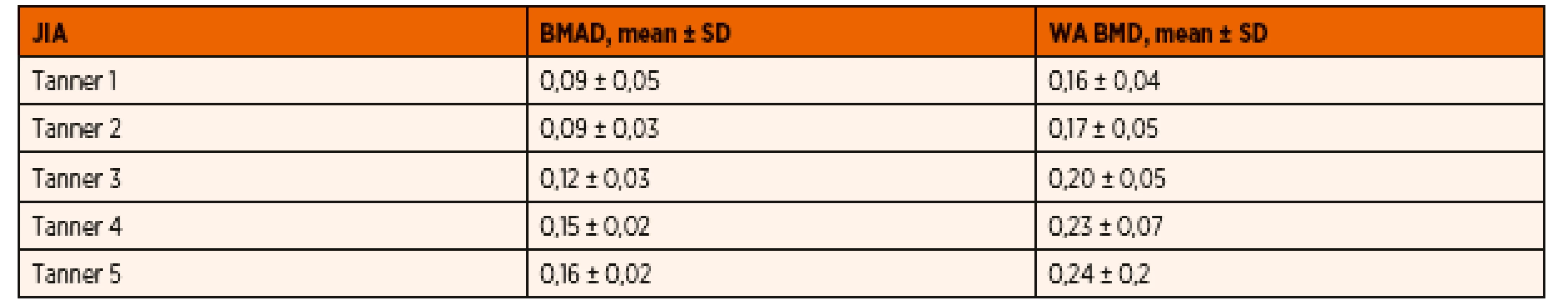
JIA – juvenilná idiopatická artritída; BMAD – bone mineral apparent density; WA BMD – width-adjusted bone mineral density Image 2. Nárast objemových DXA parametrov v polovici puberty (analyzovaný súbor s JIA), relatívne vyššie tempo nárastu WA BMD. 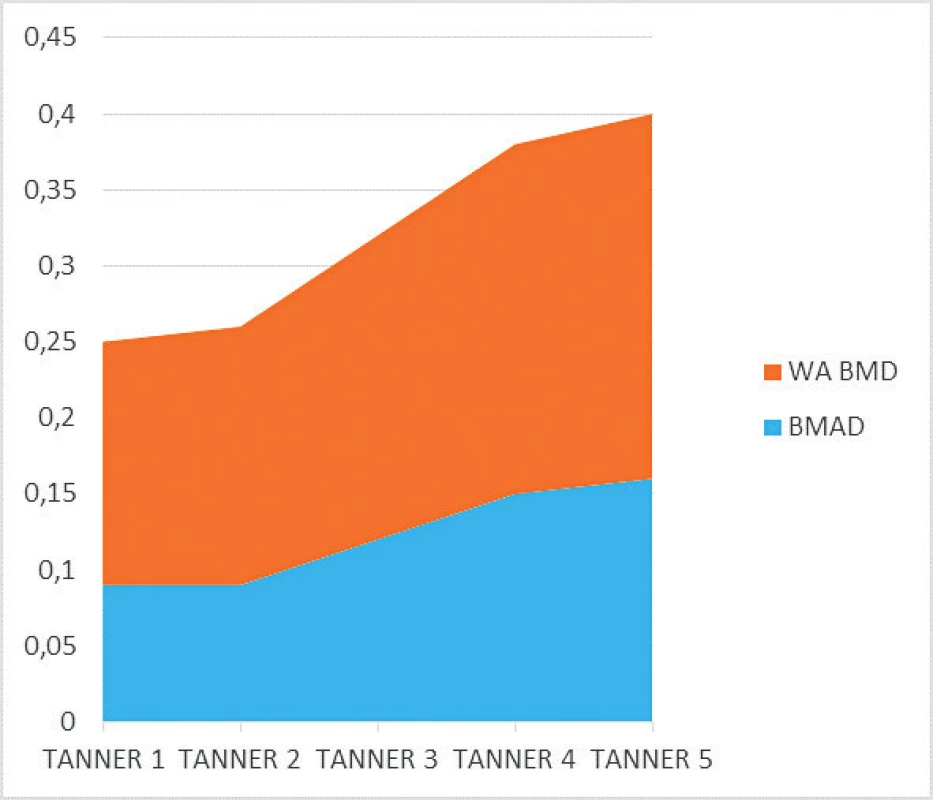
Vysvetlivky skratiek: BMAD – bone mineral apparent density; WA BMD – width-adjusted bone mineral density DISKUSIA
Podľa našich vedomostí v SR doposiaľ neexistuje iná pediatrická štúdia využívajúca pri ohodnotení výstupov z DXA u detí s JIA kombináciu PA a laterálnych vertebrálnych DXA scanov so stanovením odhadov objemových parametrov zohľadňujúcich samotný proces rastu a jednotlivé štádiá puberty. Práca okrem časti venovanej súboru pacientov s JIA prináša aj cenné pohľady na odhady vBMD zdravých detí a jej zmeny v súvislosti s rastom a pubertálnym vyzrievaním. V súbore prezentujeme ohodnotenie PA a párovaných PA a laterálnych vertebrálnych scanov (L2–L4) u 120 detí, pričom cielene porovnávame 60 detí s chronickým ochorením ovplyvňujúcim rast a maturáciu skeletu (JIA), u ktorých sme preukázali signifikantne nižšiu hodnotu telesnej výšky voči kontrolnej skupine 60 zdravých detí (p <0,05), v snahe dokázať predpokladaný falošný pokles PA BMD vo vzťahu k nižšej hodnote telesnej výšky chronicky chorého dieťaťa a aj možné nadhodnotenie diagnózy ,,zníženia BMD Z-skóre“ u detí s JIA.
Viaceré, už dlhodobejšie známe štúdie preukázali, že vertebrálna trabekulárna vBMD sa počas rastu a dospievania významne zvyšuje, zatiaľ čo kortikálna vBMD zostáva relatívne konštantná [11, 12]. Z tohto dôvodu izolácia prevažne trabekulárneho tela stavca pri laterálnom zobrazení chrbtice vyzdvihuje s rastom súvisiace zmeny trabekulárneho podielu BMC. Tieto tvrdenia podporujú aj v našich výsledkoch zaznamenané extrémne signifikantné korelácie laterálneho BMC vo vzťahu k telesnej výške, ktoré vykazovali omnoho signifikantnejšie vzťahy v porovnaní s koreláciami PA BMC voči výške dieťaťa, nakoľko rastúci podiel BMC L2–L4 je obsiahnutý takmer výlučne v tele stavca. Navyše, keďže objemové odhady WA BMD sú kalkulované pomocou laterálneho BMC, možno aj WA BMD vo všeobecnosti považovať za citlivejší marker na zmeny skutočnej vBMD v procese rastu v porovnaní s PA BMC. Tieto tvrdenia sú podporované aj pozorovaním relatívne vyššieho tempa nárastu WA BMD vzhľadom k progresii Tanner štádií voči BMAD v našej štúdii (BMAD vychádza výlučne z parametrov získaných pri PA scanovaní). Takéto zistenia sú analogické voči štúdiám u starších žien i mužov, v ktorých laterálne DXA parametre boli k úbytku kostnej hmoty súvisiacej so starnutím v porovnaní s výstupmi z PA DXA podstatne citlivejšie [13–15]. Navyše, podľa niektorých autorov u postmenopauzálnych žien DXA parametre získané z párovania PA a laterálnych scanov korelovali s výskytom fraktúr omnoho výraznejšie v porovnaní s volumometrickými odhadmi získanými z PA scanov [16].
Zaznamenané rozdiely vo veľkosti PA a objemu WA pripisujeme rôznym východiskám vo vzťahu ku geometrii vertebrálnej kosti [17]. Stanovenie WA objemu (WA volume) je totiž založené na predpoklade, že telo stavca možno prirovnať k elipse. Naproti tomu, ohodnotenie PA objemu (PA volume) vychádza z hypotézy, že priemerná hĺbka stavca je priamo úmerná druhej odmocnine projikovanej oblasti [5]. To znamená, že PA objem je síce priamo úmerný skutočnému objemu stavca, ale nemožno ho považovať za jeho ekvivalent. V súlade s týmito predpokladmi, aj v našej štúdii bol PA objem síce násobkom skutočného objemu, avšak jeho hodnoty boli približne trojnásobne vyššie v porovnaní s WA objemom. Tieto štatisticky významné rozdiely sa premietli aj do významnosti korelácií WA objemu voči výške (slabo signifikantné), nakoľko WA objem na rozdiel od objemu PA, narastá nielen vo vzťahu k výške stavca, ale sa mení aj v dôsledku zmien šírky a hĺbky tela stavca rastom (PA objem parametre šírka a hĺbka nezohľadňuje). V dôsledku toho je potom WA objem omnoho menej ovplyvnený výškou ako PA objem. Navyše, realizácia laterálnych a párovaných DXA scanov umožní do veľkej miery redukovať amplifikáciu chýb pri ohodnotení DXA scanu v procese rastu – čiže predpokladaný falošný nárast PA BMD na vrub samotného procesu rastu u vyššieho a zrelšieho zdravého dieťaťa v porovnaní s možným falošným poklesom PA BMD u nižšieho subjektu s chronickým ochorením, avšak s hypoteticky identickou vBMD [18–24].
Nakoľko oba volumometrické DXA odhady boli u JIA skupiny porovnateľné so skupinou zdravých detí, v štúdii sme preukázali, že ohodnotenie PA BMD založené výlučne na ohodnotení PA BMD Z-skóre u detí s chronickým ochorením, u ktorých sa predpokladá, že ich telesná výška je celkovo nižšia, môže skutočne priniesť významne skreslené výsledky v zmysle nadhodnotenia diagnózy tzv. „zníženia BMD Z-skóre vzhľadom k veku“. Vo výstupoch jasne deklarujeme, že hoci sme zaznamenali pokles PA BMD Z-skóre pod úroveň <-2SD až u 17 detí s JIA (28,3 %), v kontraste k ohodnoteniu PA scanov po realizácii laterálneho a párovaného scanu a po stanovení volumometrických DXA parametrov sme identifikovali iba 8 pacientov so skutočným znížením vBMD voči kontrolnej skupine, vyhodnotenej ako na základe PA scanov (BMAD), tak z párovania PA a laterálnych DXA parametrov (WA BMD). Stanovením extrémne signifikantných korelácií voči volumometrickým položkám sme potvrdili ako negatívne klinické prediktory celkovej úrovne kostného zdravia u pacientov s JIA tieto parametre: včasnejší začiatok choroby, ANA pozitivitu, vysokú aktivitu choroby a úroveň disability (CHAQ disability index), liečbu kortikoidmi a anamnestický údaj o vzniku fraktúry kdekoľvek a kedykoľvek v priebehu života.
V súlade s našimi závermi v ohodnotení odhadov volumometrických DXA parametrov, avšak i v asociácii s porovnaním týchto premenných voči výstupom ohodnotenia vBMD priamo za použitia trojrozmerných zobrazovacích metód, sa väčšina autorov zhoduje, že stanovenie objemových DXA parametrov prináša oproti izolovanému vyhodnoteniu plošných DXA scanov omnoho presnejší pohľad na problematiku posúdenia stavu skeletu chronicky chorého dieťaťa a môže významne zvýšiť výťažnosť samotnej DXA metodiky merania [16, 25–28].
Naše tvrdenia podporujú i závery autorov Wren a kol. [27], ktorí porovnávali hodnoty vBMD získanej z axiálnych QCT (kvantitatívna počítačová tomografia) meraní voči odhadom vertebrálnych objemových DXA parametrov u 124 detí a dospievajúcich. K eliminácii vplyvu veľkosti kosti na výstupy z DXA scanov autori použili niekoľko matematických extrapolácií: (1) stanovili BMAD, (2) korigovali hodnotu aBMD na hodnotu výšky kosti. Autori vo výsledkoch deklarujú prítomnosť signifikantnejších korelácií medzi hodnotami BMAD a QCT vBMD a medzi hodnotami aBMD korigovanej na výšku tela stavca voči QCT vBMD (pozn.: BMAD, R2 = 0,49; aBMD/výška tela stavca, R2 = 0,55) v porovnaní s použitím nekorigovaných hodnôt aBMD (R2 = 0,39). V súlade s našimi závermi autori zaznamenali i omnoho menej signifikantné vzťahy plošných DXA parametrov voči QCT vBMD u detí v ranných fázach pubertálneho vývoja. Napríklad, vzťah medzi BMAD a QCT vBMD bol len R2 = 0,13 u Tanner štádia 1–3, v porovnaní s hodnotou 0,60 u detí v štádiu Tanner 4. Až po použití viacregresnej analýzy pre korekciu aBMD so zohľadnením štádia puberty, veku dieťaťa, hmotnosti, výšky a kostného veku sa korelácia medzi DXA premennými a premennými získanými z QCT meraní zlepšila. V porovnaní odhadov objemových DXA parametrov voči výstupom ohodnotenia vBMD za použitia QCT , niektorí autori dokonca uvádzajú, že stanovenie volumometrických DXA premenných, vychádzajúcich z párovaných PA a laterálnych scanov (oproti izolovanému určeniu plošných DXA parametrov) vykazuje oveľa signifikantnejšie vzťahy v asociácii k prítomnosti vertebrálnych fraktúr a senzitivitou sa väčšmi približuje metodike QCT merania [28].
Možnosti trojdimenzionálnej analýzy volumometrickej BMD však ponúka i metóda merania pomocou periférnej QCT (pQCT), ktorá pri nižšej radiačnej záťaži a finančných nákladoch, v porovnaní s metodikou axiálneho QCT merania, rovnako dobre poskytuje údaje o kostnej geometrii a rozlišuje kortikálne a trabekulárne časti kostnej masy. Jej využitie je však, žiaľ, v pediatrii výrazne obmedzené najmä s ohľadom na nedostatok normatívnych dát. Metóda, je tiež aplikovateľná výlučne na periférne oblasti a teda prítomnosť epifyzeálnej platničky a variácia veľkosti metafýz v súvislosti s procesom rastu značne sťažujú možnosti merania rovnakého miesta pre výstupy longitudinálnych štúdií [29]. Súčasne je potrebné spomenúť, že výstupy merania kortikálnej geometrie pomocou pQCT sú priamo úmerné dĺžke kosti a mali by byť následne interpretované až po jej zohľadnení. Tento fakt samozrejme spôsobuje, že interpretácia dát získaných z pQCT merania u dieťaťa s oneskorením rastu sa stáva nesmierne komplikovanou [30].
Na druhej strane, použitie HR-pQCT (high resolution – pQCT) sa ukazuje byť sľubným experimentálnym nástrojom poznania zmien kostnej architektoniky v súvislosti so skeletálnou maturáciou [31]. Niekoľko nových, málopočetných pediatrických štúdií využívajúcich pQCT a HR-pQCT metodiku merania u zdravých detí a adolescentov tak prinieslo do detskej osteológie pomerne hodnotné pohľady zamerané na ohodnotenie zmien kostnej veľkosti, kostnej geometrie, či asociácie výstupov HR-pQCT meraní vo vzťahu ku kostnej fragilite počas skeletálneho vývoja [32].
Súhrnom rozhodne možno uviesť, že ohodnocovanie objemových DXA parametrov v rámci experimentálneho zamerania pediatrickej osteológie (pri nedostupnosti QCT/pQCT meraní na mnohých pracoviskách) predstavuje značné spresnenie výstupov DXA scanu, v snahe so zohľadnením vplyvu najmä veku a puberty, či rôznych chorobných procesov, priblížiť sa odhadu skutočnej objemovej vBMD. Rozhodne je však potrebné deklarovať, že matematické extrapolácie v asociácii k odhadom vBMD z DXA scanov sú zaťažené množstvom chýb a je potrebné zrealizovať ešte mnoho štúdií zameraných na overenie týchto zistení (najmä v porovnaní s trojrozmernými zobrazovacími metódami). Tiež je nevyhnutné presnejšie stanoviť senzitivitu a špecificitu týchto postupov vo vzťahu k predikcii vzniku zlomeniny – a to ako u zdravých detí a tak i u detí s rozmanitými chronickými ochoreniami. V praxi je však pre posúdenie stavu skeletu v detstve nevyhnutné hodnotu BMD predovšetkým ohodnocovať v kontexte klinického vyšetrenia [33, 34], v asociácii k prítomnosti fraktúr v anamnéze [35], či vo svetle zmien trendu hodnôt BMD v priebehu času.
ZÁVER
Záverom možno uviesť, že vysoká prevalencia zníženia BMD Z-skóre vzhľadom k veku u detí s JIA v našich geografických podmienkach sa zdá byť skutočne diagnózou významne nadhodnotenou. Bez zohľadnenia volumometrických DXA parametrov a procesu rastu (vrátane ohodnotenia puberty) tak môžu byť mnohé deti s chronickým ochorením negatívne ovplyvňujúcim rast diagnostikované a aj liečené ako ,,zníženie BMD Z-skóre s ohľadom na vek” – avšak často úplne nepodstatnene, totiž aj za okolností, ak hodnota volumometrickej BMD je ideálna.
Táto práca bola podporená Ministerstvom zdravotníctva Slovenskej republiky. Grant 2012/28-UKMA-5.
Došlo: 30. 3. 2017
Přijato: 3. 7. 2017
MUDr. Lenka Turoňová, PhD.
Klinika detí a dorastu JLF UK a UNM
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: lenosko@centrum.sk
Sources
1. Tatoń G, Rokita E, Wróbel A, et al. Combining areal DXA bone mineral density and vertebrae postero-anterior width improves the prediction of vertebral strength. Skeletal Radiol 2013; 42 (12): 1717–1725.
2. Cole JH, Scerpella TA, van der Meulen MC. Fan-beam densitometry of the growing skeleton: are we measuring what we think we are? J Clin Densitom 2005; 8 (1): 57–64.
3. Lebl J. Malý vzrůst. Čes-slov Pediat 2014; 69 (1): 47–50.
4. Leonard MB, Zemel BS. Current concepts in pediatric bone disease. Pediatr Clin North Am 2002; 49 (1): 143–173.
5. Carter DR, Bouxsein ML, Marcus R. New approaches for interpreting projected bone densitometry data. J Bone Miner Res 1992; 7 : 137–145.
6. Kroger H, Kontaniemi A, Vainio P, Alhava E. Bone densitometry of the spine and femur in children by dual-energy x-ray absorptiometry. Bone Miner 1992; 17 : 75–85.
7. Antoniazzi F, Zamboni G, Bertoldo F, et al. Bone mass at final height in precocious puberty aftergonadotropin-releasing hormone agonist with and without calcium supplementation. J Clin Endocrinol Metab 2003; 88 (3): 1096–1101.
8. Petty RE, Southwood TR, Manners P, et al. International league of associations for rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton, 2001. J Rheumatol 2004; 31 (2): 390–392.
9. Singh G, Athreya BH, Fries JF, et al. Measurement of health status in children with juvenile rheumatoid arthritis. Arthritis Rheum 1994; 37 (12): 1761–1769.
10. Giannini EG, Ruperto N, Ravelli A, Lovell DJ, et al. Preliminary definition of improvement in juvenile arthritis. Arthritis Rheum 1997; 40 (7): 1202–1209.
11. Gilsanz V, Kovanlikaya A, Costin G, et al. Differential effect of gender on thesizes of the bones in the axial and appendicular skeletons. J Clin Endocrinol Metab 1997; 82 (5): 1603–1607.
12. Gilsanz V, Skaggs DL, Kovanlikaya A, et al. Differential effect of race on the axial and appendicularskeletons of children. J Clin Endocrinol Metab 1998; 83 (5): 1420–1427.
13. Finkelstein JS, Cleary RL, Butler JP, et al. A comparison of lateral versus anterior-posterior spine dual energy x-ray absorptiometry for the diagnosis of osteopenia. J Clin Endocrinol Metab 1994; 78 (3): 724–730.
14. Grampp S, Genant HK, Mathur A, et al. Comparisons of noninvasive bone mineral measurements inassessing age-related loss, fracture discrimination, and diagnostic classification. J Bone Miner Res 1997; 12 (5): 697–711.
15. Zmuda JM, Cauley JA, Glynn NW, et al. Posterior-anterior and lateral dual-energy x-ray absorptiometry for the assessment of vertebral osteoporosis and bone loss among older men. J Bone Miner Res 2000; 15 (7): 1417–1424.
16. Jergas M, Breitenseher M, Gluer CC, et al. Estimates of volumetric bone density fromprojectional measurements improve the discriminatory capability of dual x-ray absorptiometry. J Bone Miner Res 1995; 10 (7): 1101–1110.
17. Edwards WB, Troy KL. Number crunching: how and when will numerical models be used in the clinical setting? Curr Osteoporos Rep 2011; 9 (1): 1–3.
18. Varechova S, Durdik P, Cervenkova V, et al. The influence of autonomic neuropathy on cough reflex sensitivity in children with diabetes mellitus type 1. J Physiol Pharmacol 2007; 58 (5): 705–715.
19. Matějek T, Navrátilová M, Kokštein Z, et al. Metabolické kostní onemocnění při nezralosti. Čes-slov Pediat 2015; 70 (5): 303–312.
20. Gordon CM, Leonard MB, Zemel BS. International Society for Clinical Densitometry. 2013 Pediatric Position Development Conference: Executive summary and reflections. J Clin Densitom 2014; 17 : 219–224.
21. Schoenau E. The „functional muscle-bone unit“: A two - step diagnostic algorithm in pediatric bone disease. Pediatr Nephrol 2005; 20 (3): 356–359.
22. Nahar VK, Nelson KM, Ford MA, et al. Predictors of bone mineral density among Asian Indians in Northern Mississippi: A pilot study. J Res Health Sci 2016; 16 (4): 228–232.
23. Dall’Ara E, Pahr D, Varga P, et al. QCT-based finite elementmodels predict human vertebral strength in vitro significantly better than simulated DEXA. Osteoporos Int 2012; 23 (2): 563–572.
24. Jakusova L, Jesenak M, Schudichova J, et al. Bone metabolism in cow milk allergic children. Indian Pediatr 2013; 50 (7): 706.
25. Leonard MB, Shults J, Zemel BS. DXA estimates of vertebral volumetric bone mineral density in children: potential advantages of paired posteroanterior and lateral scans. J Clin Densitom 2006; 9 : 265–273.
26. Dowthwaite JN, Rosenbaum PF, Scerpella TA. Mechanical loading during growth is associated with plane-specific differences in vertebral geometry: a cross-sectional analysis comparing artistic gymnasts vs. non-gymnasts. Bone 2011; 49 : 1046–1054.
27. Wren TA, Liu X, Pitukcheewanont P, et al. Bone densitometry in pediatric populations: discrepancies in the diagnosis of osteoporosis by DXA and CT. J Pediatr 2005; 46 (6): 776–779.
28. Jergas M, Breitenseher M, Glüer CC, et al. Estimates of volumetric bone density from projectional measurements improve the discriminatory capability of dual X-ray absorptiometry. J Bone Miner Res 1995; 10 (7): 1101–1110.
29. Zemel B, Bass S, Binkley T, et al. Peripheral quantitative computed tomography in children and adolescents: the 2007 ISCD Pediatric Official Positions. J Clin Densitom 2008; 11 : 59–74.
30. Fonseca A, Gordon CL, Barr RD. Peripheral quantitative computed tomography (pQCT) to assess bone health in children, adolescents, and young adults: a review of normative data. J Pediatr Hematol Oncol 2013; 35 : 581–589.
31. Cheung AM, Adachi JD, Hanley DA, et al. High-resolution peripheral quantitative computed tomography for the assessment of bone strength and structure: a review by the Canadian Bone Strength Working Group. Curr Osteoporos Rep 2013; 11 : 136–146.
32. ChevalleyT, Bonjour JP, Audet MC, et al. Fracture prospectively recorded from pre-puberty to young adulthood: Are they markers of peak bone mass and strength in males? J Bone Miner Res 2017 Sep; 32 (9): 1963–1969. doi: 10.1002/jbmr.3174. [Epub 2017 Jun 12].
33. Gordon CM, Bachrach LK, Carpenter TO, et al. Dual energy X-ray absorptiometry interpretation and reporting in children and adolescents: the 2007 ISCD Pediatric Official Positions. J Clin Densitom 2008 Jan-Mar; 11 (1): 43–58.
34. Veselá PK, Kaniok R, Bayer M. Markers of bone metabolism, serum leptin levels and bone mineral density in preterm babies. J Pediatr Endocrinol Metab 2016; 29 (1): 27–32.
35. Kutilek S, Bayer M. Quantitative ultrasonometry of the calcaneus in children with osteogenesis imperfecta. J Paediatr Child Health 2010; 46 (10): 592–594.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2017 Issue 6-
All articles in this issue
- Volumometrické korekcie vertebrálnych DXA scanov u detí s juvenilnou idiopatickou artritídou
- Vrodená cysta hrtana – zriedkavá príčina život ohrozujúcej obštrukcie horných dýchacích orgánov
- Holoprosencefalie
- Nehojící se atopický ekzém
- Specifika péče o děti narozené po asistované reprodukci
- Emoční a psychosociální situace dítěte s těžkým postižením a jeho rodiny
- Odporúčania pre pohybovú aktivitu detí a mládeže na Slovensku (6–18 rokov)
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Holoprosencefalie
- Odporúčania pre pohybovú aktivitu detí a mládeže na Slovensku (6–18 rokov)
- Nehojící se atopický ekzém
- Specifika péče o děti narozené po asistované reprodukci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

