-
Medical journals
- Career
Základy molekulární biologie nádorů pro praxi
Authors: O. Kodet 1,2,3; L. Lacina 1,2,3
Authors‘ workplace: Dermatovenerologická klinika 1. LF UK a VFN přednosta prof. MUDr. Jiří Štork, CSc. 1; Anatomický ústav 1. LF UK přednosta prof. MUDr. Karel Smetana, DrSc. 2; BIOCEV – Biotechnologické a biomedicínské centrum Akademie věd a Univerzity Karlovy ve Vestci u Prahy vedoucí laboratoře/senior researcher prof. MUDr. Karel Smetana, DrSc. 3
Published in: Čes-slov Derm, 92, 2017, No. 6, p. 245-261
Category: Reviews (Continuing Medical Education)
Overview
Molekulárně biologický přístup ke studiu nádorů zažívá v posledních dekádách významný rozvoj a přináší stále nové poznatky o patogenezi nádorových onemocnění. Některé jsou pak díky novým technologiím využity prakticky a zaváděny přímo do onkologické péče. Molekulární biologie umožnila i zavedení zcela nových onkologických léčebných schémat v rámci tzv. personalizované onkologické terapie včetně terapie biologické. Vedle pokroku v onkologické terapii se molekulární biologie podílí i na identifikaci a charakterizaci celé řady biologických molekul tzv. biomarkerů. Biomarker představuje charakteristickou vlastnost biologického systému, kterou lze objektivně změřit, a použít tak pro potřeby monitorování stavu organismu. Molekulární biologie nachází stále nové biomarkery, které lze užívat jak pro zlepšení diagnostiky nádorových onemocnění, tak i pro účely prognostické nebo prediktivní. K těmto postupům lze využívat nejen molekulárně genetická vyšetření, ale posloužit takto mohou v určitých modifikacích i již dlouho běžně dostupná biochemická vyšetření sér pacientů nebo imunohistochemická vyšetření tkání. Dermatoonkologie zaznamenává soudobé trendy celé onkologie a v řadě případů je pomáhá i utvářet, a významně tak přispívá i ke znalostem a zavádění personalizované onkologické terapie.
Klíčová slova:
molekulární biologie – mutace – onkogeny – tumor-supresorové geny – biomarkery – kožní nádory – melanomÚVOD
Molekulární biologie a molekulární genetika nádorů zažívá v posledních dekádách obrovský rozkvět. Do klinické praxe jsou tak zaváděny řady nových vyšetřovacích postupů, které kladou na lékaře v klinické praxi nároky na kontinuální rozšiřování alespoň základního porozumění novým diagnostickým metodám a principům, na kterých jsou tyto metody založeny. Molekulárně biologické metody se stávají součástí rutinní diagnostiky i v jiných odvětvích medicíny. V onkologii napomáhají pochopit složitost a komplexnost nádorové patogeneze.
V onkologické praxi však jejich význam roste i vzhledem k novým terapeutickým možnostem a zaváděním tzv. personalizované onkologické terapie, což platí i v případě dermatoonkologie. Pro správnou interpretaci jednotlivých nálezů je nutná znalost základní terminologie molekulární genetiky a biologie, se kterou se lze setkat při interpretaci jednotlivých vyšetření.
ZÁKLADNÍ TERMINOLOGIE MOLEKULÁRNÍ GENETIKY/BIOLOGIE
Mutace je změna genetického kódu, ke které může dojít spontánně či pod indukčním vlivem zevních faktorů (mutagenů). Takto změněná genetická informace může poškozovat buňku či organismus, a může být tedy patogenní, způsobující onemocnění. Mutace může mít ale také zcela neutrální dopad, někdy může dokonce přinášet nové pozitivní vlastnosti, a může se tak jednat i o fyziologický prvek evoluce [4]. Za hlavní mutageny se považují vlivy fyzikální (UV a ionizující záření), vlivy chemické (aromatické sloučeniny, silné oxidanty, radikálové iniciátory), nebo vlivy biologické představující např. virové infekce (HPV, HHV8 apod.) [4, 35, 66, 70]. Distribuce mutací bývá v rozsahu genomu zpravidla náhodná, nicméně některá místa (tzv. lokusy) jsou ke vzniku mutací, např. ze strukturálních důvodů, náchylnější, a proto je označujeme jako tzv. hot-spots. Jestliže je poškození DNA stochastické, trvalé akvizici mutací a jejich konzervaci v genomu zabraňují reparační procesy DNA [47]. Porušení této homeostázy, tedy defekty v genech odpovědných za reparační mechanismy, je podkladem některých geneticky podmíněných onemocnění s vysokým výskytem nádorových onemocnění, jako je xeroderma pigmentosum nebo např. Fanconiho anémie [11, 34].
Mutace lze rozdělit podle řady kritérií, ale pro pochopení problematiky je nezbytné znát alespoň základní typy mutací. Podle buněčné linie, která je mutací postižena, rozeznáváme mutace somatické, tedy mutace, které vznikají v určité buněčné populaci (např. BRAF mutace u melanomu) a mutace germinální (germ line), které mohou být podkladem dědičných vad a dědičných genetických syndromů (např. mutace u BRCA1, u karcinomu mléčné žlázy) [47]. Je tedy evidentní, že germinální mutace zděděné od rodiče budou přítomny ve všech buněčných populacích jedince. Případný efekt mutace závisí na tom, zda buněčná populace takto postižený gen vůbec exprimuje, a tedy zda mutovaný výsledný protein může funkčně vést k poškození struktury a funkce buňky. Naproti tomu somatické mutace jsou získány v pozdějším období vývoje jedince, a jejich efekt je tak omezen jen na některé struktury těla – toto lze ilustrativně vztáhnout například i na mutace získané v průběhu embryogeneze, které budou tedy postihovat i některý celý zárodečný list, ale ne všechny. Po ukončení zásadního období embryogeneze pak akvizice somatické mutace mívá vysloveně fokální charakter ve tkáni.
Podle oblasti v genomu a výslednému efektu rozlišujeme mutace v kódující oblasti (tzv. exonové), které většinou působí patologii ve smyslu změny struktury překládaného proteinu. Významné jsou v některých případech i mutace nepřepisovaných oblastí (tzv. introny), které regulují aktivitu přepisu genetické informace, aniž by měly efekt na strukturu samotného proteinu. Jako mechanistický příklad jednotlivých mutačních událostí na úrovni kodonu DNA (tj. jakési základní abecedy pro převod informace z DNA na protein) lze uvézt tzv. missense mutace. Tyto mutace mění smysl kodonu (vyjádřeného trojicí písmen z repertoáru A-adenin, U-uracyl, C-cytosin, G-guanin), jejímž výsledkem je změna aminokyseliny v proteinovém řetězci. Představu o vlivu nukleotidové záměny na funkci proteinu získáme porovnáním struktury a biologické aktivity mutovaného a normálního proteinu. I prostá změna jedné aminokyseliny v proteinovém řetězci může vést k významné odchylce při skládání proteinu do konformace vyšších řádů, a tak i ke změně jeho funkce. Změna biologické aktivity mutovaného proteinu (ať již zvýšení, či snížení), může znamenat přítomnost podkladu pro rozvoj onemocnění. V některých vzácných případech je nakonec například biologická aktivita mutovaného proteinu patologicky zvýšena a taková mutace v proteinech signálních drah může vést k jejich trvalé aktivaci [4]. V určitých případech jsou i odlišně složené aminokyselinové řetězce schopné udržení srovnatelné aktivity, v takových případech se jedná pravděpodobně o polymorfismus. Polymorfismus na úrovni některých genů je v populaci velmi častý, často jde o polymorfismus na úrovni jediného nukleotidu (tzv. SNP).
Dalším typem mutačních událostí v kódující oblasti je tzv. nonsense mutace (nesmyslná mutace, změna kodonu pro aminokyselinu za jeden ze stop kodonů – UGA, UAA, UAG) vede k předčasnému ukončení translace a zkrácení polypeptidového řetězce, což může být podkladem (alespoň částečně) pro ztrátu funkce proteinu. V některém případě lze detekovat zkrácený (tzv. trunkovaný) protein v množství srovnatelném s normálním proteinem. V jiných případech je množství zkráceného proteinu výrazně sníženo, případně protein nejsme schopni vůbec detekovat – za tento efekt je zodpovědné odklizení abnormální mRNA (tzv. mutation mediated RNA decay).
Vzhledem k určité rezervě genetického kódu může dojít k bodové mutaci, která sice vede ke změně konkrétního kodónu, ale zůstane zachován jeho původní smysl (tj. nedojde ke změně dané aminokyseliny) a vlastností proteinu. Takovouto mutaci označujeme jako samesense. Její význam je tedy nulový. V některých jiných případech zařazení sice jiné, ale strukturně podobné aminokyseliny do proteinového řetězce nevede k fenotypové změně a takovou mutaci označujeme jako tzv. tichou mutaci [4, 47]. Rozhodnout při sekvenování jednotlivého genomu, zda jde o mutaci, či polymorfismus může být někdy obtížné a klasifikace je často nejprve konsenzuální (viz níže).
Z dalších typů chromozomálních mutací je nutné zmínit termín inzerce a delece. Inzerce a delece jsou mutační události, při nichž dochází k vypuštění, respektive k včlenění jednoho, ale i řádově miliónů nukleotidů. Důsledky takových mutací závisí na počtu a umístění odstraněných nebo včleněných nukleotidů. Například při vypadnutí jednoho nukleotidu dojde ve zbytku sekvence k tzv. posunu čtecího rámce (frame shift mutation). Takovýto protein má pak s vysokou pravděpodobností při nejmenším velmi odlišnou strukturu a funkci.
Dojde-li k deleci nebo inzerci jednoho nebo několika kodonů (tedy 3 nukleotidů, popř. násobků 3), neporuší se mutací čtecí rámec a výsledkem je bílkovina zkrácená o jednu či několik aminokyselinových zbytků. Pokud delece není příliš velká a odstraněné aminokyselinové zbytky nezasahují do biologicky aktivních částí proteinu, nemusí se taková změna na aktivitě proteinu projevit [47, 85]. Daleko zásadnější změny tedy způsobují delece a inzerce narušující čtecí rámec. V tom případě jsou pak od místa mutace do bílkovinného řetězce začleňovány jiné aminokyseliny, dokud nevznikne spontánně tzv. stop kodon [85].
Za určitých vzácných situací může být přenesen rozsáhlý úsek genetické informace (tzv. translokace) a může být včleněn do zcela nového kontextu a regulačního rámce. Naštěstí jen vzácně vzniká takovým náhodným spojením skutečně funkční genový produkt (fúzní protein) s patologickým fenotypem [4, 80].
Mozaicismus je označení pro stav, kdy u jedince jsou přítomny dvě nebo více geneticky odlišných buněčných linií, tedy jde o buněčnou linii s mutací a bez mutace. Příčin tohoto stavu je několik. Výše byl uveden příklad časně získané mutace postihující zárodečný list. Obdobně však lze nahlížet i na situaci, kdy jsou linie odvozeny již přímo od zygoty, ale dochází k inaktivaci (zpravidla náhodné) například jednoho rodičovského chromozomu (tzv. lyonizace u X chromozomu). Jiný pohled nabízejí mutace vznikající jen v určité buněčné populaci somatických buněk (např. v nádorovém klonu) a výsledkem je tzv. somatický mozaicismus. Somatické mutace nejsou dědičné na další generace [36]. Jestliže se mutace vyskytne v buňkách, ze kterých vzniká germinální linie, mutace se stává dědičnou změnou pro další generaci.
Polymorfismus je označení pro stav, kdy v populaci existují pro určitý znak minimálně 2 genetické varianty, alely, jejichž frekvence v populaci přesahuje 1 %. Vzhledem k variabilitě genetického kódu se však nemusí jednotlivé polymorfismy vždy projevit, především pokud se vyskytují v nekódujících oblastech. Základním příkladem polymorfismu je variabilita v genu pro Rh faktor. Tento gen se vyskytuje v populaci v alelách Rh+ a Rh-. Jiným příkladem jsou krátké repetitivní sekvence označované jako mikrosatelity, které jsou vysoce specifické pro jednotlivce a mohou být tedy využívány např. při určování paternity [4, 47].
HEREDITÁRNÍ NÁDOROVÁ ONEMOCNĚNÍ
Nádorová onemocnění jsou důsledkem selhání kontrolních mechanismů odpovědných za reparativní buněčné pochody schopné opravovat poškození DNA [21, 24]. Jejich následkem je pak nekontrolované buněčné dělení, které neodpovídá homeostatickým potřebám organismu, což finálně může vést až k jeho smrti. V současné době jsou nádorová onemocnění chápána jako multifaktoriální onemocnění, kde vedle genetických abnormalit hrají významnou roli i zevní faktory (tzv. environmentální) a životní styl jedince (faktory behaviorální). Jedná se tedy o zcela individuální proces.
Somatické mutace v organismu vznikají přirozeně poměrně často a se stárnutím organismu se jejich frekvence neustále zvyšuje [21, 24, 65]. Soubor těchto faktorů označujeme jako replikativní riziko. Stejně významnou roli hraje vystavení organismu mutagenům, tzv. environmentální riziko [65]. Samotné dědičné (hereditární) nádorové syndromy jsou v populaci relativně vzácné, podílejí se na vzniku asi jen 5–10 % všech nádorů [24]. V současné době je známo asi 200 hereditárních nádorových syndromů s převážně autozomálně dominantní dědičností, kdy je dostačující zárodečná mutace jedné alely genu [21].
Patogenezi těchto nádorových syndromů vysvětlují dvě základní teorie. Knudsonova (dvouzásahová) teorie vysvětluje patogenezi na zárodečné mutaci tumor-supresorového genu, kdy je následně dostačující již jen jedna somatická mutace (může se jednat i jen o bodovou mutaci) [42, 43]. Druhá teorie tzv. vícestupňová Vogelsteinova teorie je založena na poškození strážných genů (gatekeepers), které kontrolují buněčný cyklus. K jejich poruše je nutná ztráta obou alel, jako příklad lze použít zárodečnou mutaci genu p53 odpovědnou za Li-Fraumeniho syndrom [19, 80]. Dalším mechanismem může být zárodečná mutace správcovských genů (housekeepers) odpovědných za integritu i stabilitu genomu. Poškození obou alel vede k pozvolné akumulaci dalších mutací, buněčné proliferaci a následně možné malignitě. Výsledkem může být nádorový proces spíše až v dospělém věku [80]. Zde jako příklad lze použít např. dědičné syndromy karcinomu ovarii (BRCA1 a BRCA2) či tzv. Lynchův syndrom (nepolypózní kolorektální karcinom) [27, 55]. Přehled základních hereditárních syndromů spojených s dermatoonkologií ukazuje tabulka 1. V případě podezření na hereditární nádorové onemocnění se lze obrátit s konzultací na klinického genetika, který případně pacienta může indikovat ke genetickému vyšetření. Jednoznačná indikační kritéria pro dermatoonkologii nejsou stanovena, ale obecně lze vyšetření zvážit u mladších jedinců s maligním onemocněním (do 40 let věku) s rodinnou anamnézou melanomu, či rodinou a osobní anamnézou jiného onkologického onemocnění (především s rodinnou akumulací karcinomu prsu, ovaria, kolorektálního karcinomu) nebo u pacienta mladšího věku s mnohočetnými bazaliomy. Pacient musí být plně informován o účelu testování s nutným použitím genetického materiálu, o možném výsledku vyšetření a v případě pozitivity nálezu i o vhodnosti rozšíření testování na další příbuzné [20, 61]. V současné době navíc nejsou vypracovány v dermatoonkologii jednoznačné postupy pro genetické poradentství, tedy jakým způsobem je nutné správně tyto pacienty preventivně sledovat v rámci pravidelné preventivní onkologické péče [44].
Table 1. Výběr z hereditárních nádorových syndromů se vztahem k dermatoonkologii 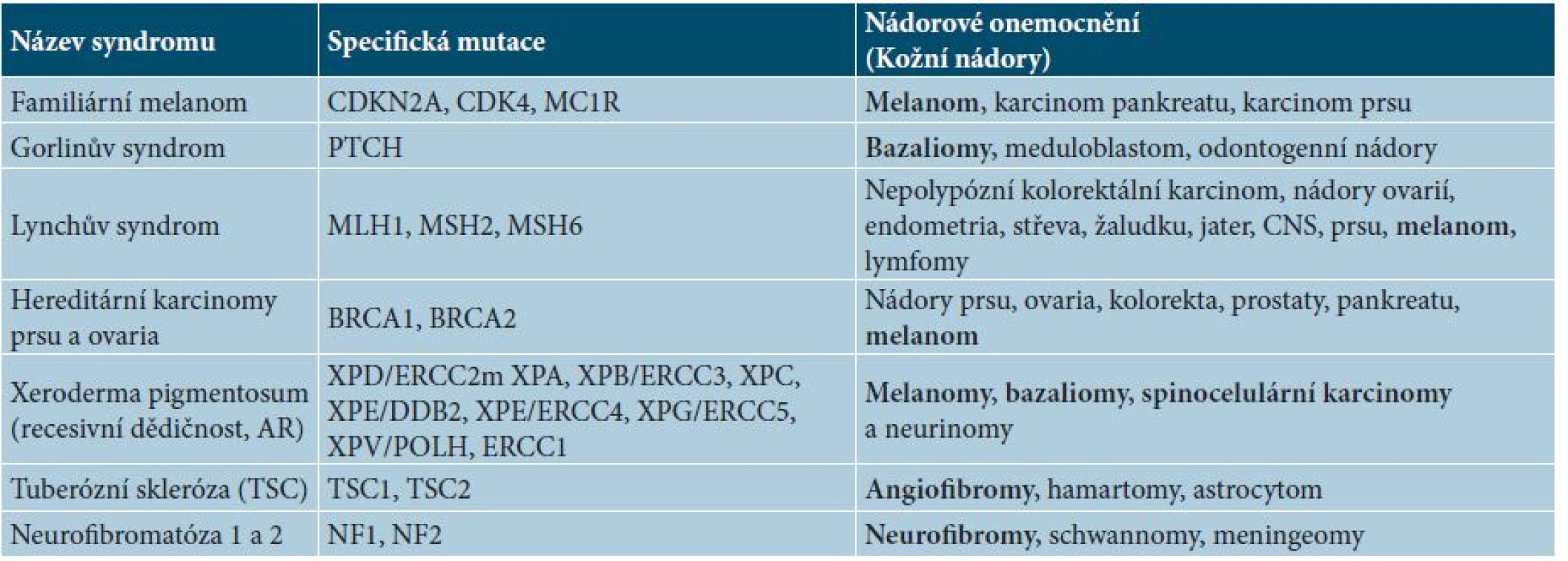
Table 2. Přehled základních molekulárně genetických biomarkerů v dermatoonkologii 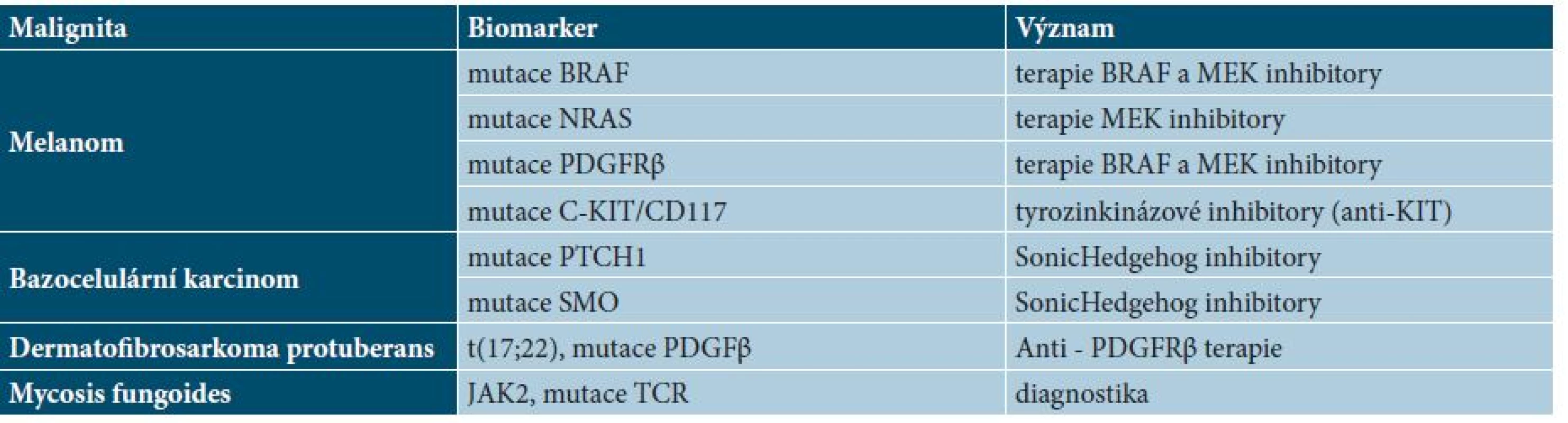
Table 3. Přehled základních diagnostických imunohistochemických markerů v dermatoonkologii 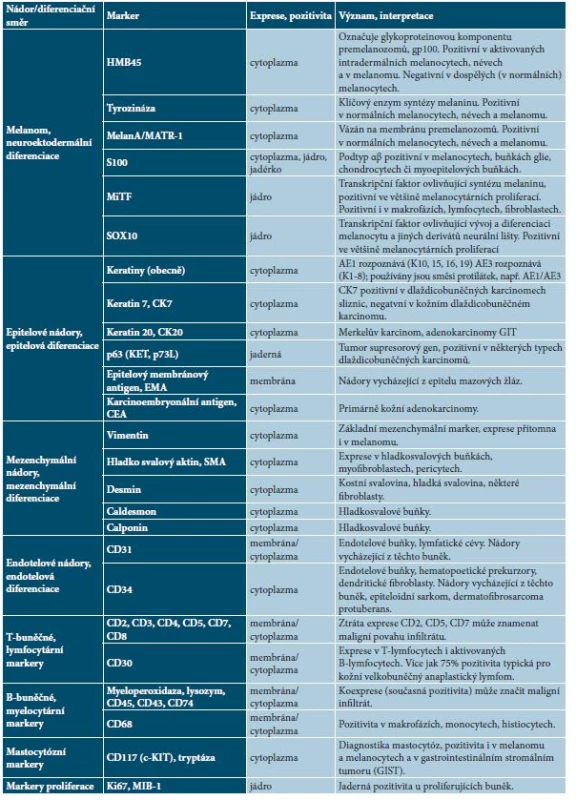
ONKOGENY A TUMOR-SUPRESOROVÉ GENY
Onkogeny a protoonkogeny hrají klíčovou roli v procesu karcinogeneze, jedná se o geny, které jsou přímo odpovědné za vznik nádorů. Jestliže dojde k abnormální aktivaci protoonkogenu, dochází k zvýšené expresi nebo hyperaktivitě cílového proteinu. Důsledkem je nadměrné buněčné dělení. Protoonkogeny se aktivují několika mechanismy jako např. bodovou mutací, amplifikací (zvýšeným počtem kopií), translokací nebo tvorbou chimérických (fúzních) genů (např. BCL/ABL u leukémií, filadelfský chromozom) [4, 80].
Geny rodiny RAF jsou bohatou skupinu genů ARAF, BRAF a CRAF, které jsou součástí tzv. MAPK (mitogen-activated protein kinases) signalizační kaskády [53]. Pro potřeby dermatoonkologie je nejvýznamnější gen BRAF, který kóduje serin-threonin-protein kinázu B-Raf významně se podílející na transdukci signálu v rámci MAP signalizace a ovlivňující buněčnou proliferaci a diferenciaci. V rámci studia nádorově specifických mutací bylo detekováno více než 30 mutací genu BRAF. U melanomu se nejčastěji nachází mutace V600E (jedná se o bodovou mutaci na pozici 1796 sekvence BRAF, kodon 600, kde dochází k záměně pyrimidinového nukleotidu tyminu za purinový nukleotid adenin – výsledkem je záměna aminokyseliny glutaminu za valin). Méně časté jsou mutace V600D a V600K [5, 10]. Mutace BRAF se u melanomu vyskytuje asi v 50 % případů, ale samotná role v patogenezi melanomu je doposud nejasná, jelikož u benigních melanocytárních névů se vyskytuje až v 83 %, aniž by u těchto névů docházelo k maligní transformaci [46]. Vedle melanomu lze mutace BRAF detekovat i u karcinomu plic (do 3 %), u kolorektálního karcinomu (cca 5 %), nebo u karcinomů štítné žlázy. Poměrně častá je přítomnost BRAF mutace u pacientů s histiocytózou z Langerhansových buněk (asi 55 % pacientů), a dokonce ji nacházíme u všech pacientů s leukémií z vlasatých buněk [3, 17, 77]. Jedná se obecně o jednu z nejčastějších mutací detekovaných v nádorové biologii hned po mutacích v genu p53 [10]. I když mutace V600E je pouze bodová (a tedy dojde jen k záměně jedné aminokyseliny za jinou) dochází k mnohonásobnému zvýšení aktivity B-Raf proteinu a posílení signalizace na další protein MAP kinázové dráhy zvaný MEK 1/2. Detekce BRAF mutace je v soudobé onkologické péči klíčová pro možnost nasazení cílené personalizované terapie pomocí tzv. BRAF inhibitorů, případně jejich následné kombinace s MEK inhibitory, která významně prodlužuje dobu přežití a dobu do progrese onemocnění u metastazujícího melanomu [48].
Geny rodiny RAS představují skupinu genů HRAS, KRAS a NRAS, které mají GTPázovou aktivitu a fungují jako molekulární převaděči signalizace mezi receptorovými a intracelulárními tyrozinkinázami. V dermatoonkologii nacházíme mutace NRAS (kodon 12, 13 a 61) u melanomu asi jen v 15–20 %, jsou ale relativně časté i u dlaždicobuněčného karcinomu. Pozitivita NRAS mutace u pacientů s metastazujícím melanomem je spojena s významně horší prognózou a nabízí možnost terapie MEK inhibitory [37].
Gen c-KIT kóduje tyrozinkinázový receptor typu III, označovaný také jako CD117, který se podílí na vazbě tzv. kmenového faktoru (stem cell factor, SCF), znám jako KIT-ligand. Vazba SCF na CD117 hraje roli v buněčném přežívání, proliferaci a buněčné diferenciaci. Vedle účasti na formování hematopoetických kmenových buněk hraje i významnou roli ve vývoji melanocytů. Mutace c-KIT se vyskytuje u slizničních a akrolentiginózního melanomu okolo 10 %, a představuje tak molekulu s možnou cílenou formou terapie [82].
Gen Bcl-2 je protoonkogen, který má funkci v regulaci apoptózy. Jeho zvýšená exprese blokuje apoptózu a stimuluje proliferaci nádorových buněk. Podporuje i jejich migratorní vlastnosti produkcí např. metaloproteináz (MMP-2), které degradují komponenty extracelulární matrix a napomáhají migraci nádorových buněk. Zvýšenou expresi Bcl-2 lze detekovat jak v melanomu, tak i nádorech epitelových, a především u hematologických malignit [57].
Gen CDK4 se nachází na dlouhém raménku chromozomu 12 a jedná se o gen, který kóduje protein skupiny serin-threonin kináz, účastnící se regulace buněčného cyklu G1 fáze. Aktivita této kinázy je omezena na fázi G1-S buněčného cyklu a je řízena regulačními podjednotkami cyklinů typu D a inhibitorem proteinem p16. Mutace genu CDK4 vede k znemožnění navázaní inhibičního proteinu p16 a trvalé vazbě CDK4 s aktivačním ligandem cyklinem typu D. Celá tzv. CDK4 signalizační dráha (p16-cyclin D-CDK4/6-retinoblastoma protein dráha) je disregulována až u 90 % melanomů [1, 69].
Gen MDM2 kódující protein MDM2, neboli E3 ubikvitin-proteinová ligáza MBM2, který je negativní regulátor tumor-supresorového genu p53. Zvýšenou expresi MDM2 lze nalézt i v počínajících melanomech, což podporuje domněnku, že může hrát roli v nádorové transformaci melanocytů. Navíc konečným efektorem proteinu MDM2 jsou proteiny BAX/Bcl-2, které dál stimulují proliferaci nádorových buněk [88].
Gen MET je znám také jako tyrozinová-proteinová kináza Met, nebo též receptor pro hepatocytární-růstový faktor (HGFR). MET je za normálních podmínek významně exprimován během embryogeneze a postnatálně během hojení, dále je silně exprimován v epitelových buňkách. Abnormální exprese během karcinogeneze je spojena s horší prognózou nádorů, invazivním růstem nádorů a nádorovou neoangiogenezí [25]. Amplifikace genu MET je spojena nejvíce s papilárním karcinomem ledvin, ale i s progresí a metastatickým melanomem, karcinomem plic a karcinomem žaludku [51]. Ovlivnění signalizace přes HGF (hepatocytární růstový faktor) hraje roli i v rezistenci na BRAF inhibitory při cílené terapii melanomu, ale ovlivňuje např. i rezistenci kolorektálního karcinomu na terapii anti-EGFR terapií [51, 54].
Tumor-supresorové geny brání vzniku nádorů, označují se jako antionkogeny. Tyto geny brzdí buněčné dělení, účastní se oprav DNA, podporují apoptózu a účastní se buněčné diferenciace. Mutace tumor-supresorových genů se vyznačují recesivním charakterem, tedy že se poškození tumor-supresorového genu projeví pouze tehdy, pokud je mutace přítomna v obou alelách (a tedy na rozdíl od protoonkogenu, kde dostačující může být mutace pouze v jedné alele). Role tumor supresorových genů byla pochopena až při studiu hereditárních nádorových syndromů a byla popsána v tzv. Knudsonově dvouzásahové teorii vzniku nádorů. Knudson popsal roli tumor-supresorového genu na retinoblastomovém genu Rb-1, který je odpovědný za hereditární formu retinoblastomu [43]. Ten se projevu v dětském věku a bývá často bilaterální, jeho sporadická forma se projevu naproti tomu v pozdějším věku a je pouze jednostranná.
Vůbec nejčastěji mutovaný tumor-supresorový gen v nádorové biologii je p53 (TP 53, tumor protein 53), který se nachází na krátkém raménku chromozomu 17. Pro jeho hlavní funkci, kterou je monitorování poškození DNA a jeho případná zástava ve fázi G1, je někdy s nadsázkou označován jako strážce genomu [88]. Pozastavení buněčného cyklu v G1 fázi je klíčové pro získání dostatečného času pro reparativní procesy genomu nebo při nemožnosti zajištění opravy navození buněčné smrti apoptózou. Inaktivace p53 bývá jedním z prvních kroků, který vede k maligní transformaci, hereditární formu germinální mutace představuje např. Li-Fraumeniho syndrom, pacienti s vysokým rizikem sarkomů, leukémií a především karcinomu mléčné žlázy [89]. V dermatoonkologii u kožních nádorů pozorujeme nejčastěji útlum funkční aktivity proteinu p53, který je navozen delecí genu p53 [72]. Vzhledem k obrovské mutační zátěži zejména UV zářením, které lidská kůže musí čelit, není překvapivé, že na každý 1 cm2 kožního povrchu připadá až 40 keratinocytárních klonů s mutací p53 [38].
PTEN gen se nachází na dlouhém raménku 10. chromozomu, jeho hlavní funkce je defosforylace PIP3 (fosfatidylinositol trifosfát) na PIP2. Tyto proteiny následně inhibují AKT kinázu (serin-threonin proteinová kináza B), což má za následek snížení proapoptotické signalizace [25, 88].
CDKN2A gen je jedním ze zásadních genů, jehož mutace ovlivňující karcinogenezi. Nachází se na dlouhém raménku chromozomu 9, jedná se o klíčový gen ovlivněný efektem UV záření, a to zejména prostřednictvím svých dvou produktů, proteinů p16 a p14. Protein p16 se váže na cyklin-dependentní kinázy CDK4 a CDK6 a tím aktivuje retinoblastomovou (Rb) rodinu proteinů, které blokují přechod buněčného cyklu z fáze G1 do S-fáze [1]. Protein p16 je významným inhibitorem buněčné proliferace, jeho porucha vede k nekontrolovatelnému buněčnému dělení a významně se podílí na procesu karcinogeneze. Somatické mutace CDKN2A jsou časté u mnoha nádorových onemocnění. Jedná se o druhý nejčastěji inaktivovaný tumor-supresorový gen v nádorové biologii hned po mutacích p53 [1, 30, 31, 69]. Germinální mutace CDKN2A jsou spojeny s familiárním výskytem melanomu, glioblastomu a karcinomu pankreatu. Ale somatické mutace CDKN2A jsou spojeny s lymfomy, dlaždicobuněčným karcinomem hlavy a krku, nemalobuněčným karcinomem plic, kolorektálním karcinomem či karcinomem žaludku [80].
MOLEKULÁRNÍ A GENETICKÉ BIOMARKERY JAKO ZÁKLAD PRO INDIVIDUALIZOVANÝ PŘÍSTUP V DERMATOONKOLOGII
Biomarker představuje určitou charakteristickou vlastnost biologického systému, kterou lze objektivně změřit, a použít tak pro potřeby monitorování stavu organismu. Vedle molekulárně genetických metod lze pro tato stanovení využít metody fyzikální, chemické, ale i metody zobrazovací, případně jejich kombinace. Je spíše zvykem biomarkery rozdělit na tzv. klasické a novodobé tzv. molekulární [7]. Jako příklad klasických biomarkerů lze uvést např. histologický staging a grading nádorů (v případě maligního melanomu, hodnocení podle Breslowa, Clarka, později přítomnost mitózy/1mm2, přítomnost ulcerace apod.). Za molekulární biomarkery jsou považovány biomolekuly podílející se při patogenezi onemocnění, nebo významně ovlivňují jejich biologické funkce, ať se již jedná o úroveň genomu, transkriptomu, proteomu apod. Tyto biomarkery jsou představovány tedy nukleovými kyselinami, respektive i jejich specifickými mutacemi, či výslednými proteiny a metabolity [7]. Pro klinickou praxi je však nejdůležitější rozdělení biomarkerů utilitární, tedy podle jejich funkce, kdy rozlišujeme biomarkery určující míru rizika, diagnostické, prognostické a prediktivní biomarkery [7, 49]. Tyto biomarkery, lze stanovit a kvantifikovat metodami klinické genetiky, molekulární genetiky či cytogenetiky, ale např. i pomocí imunohistochemických metod na úrovni proteinů.
Biomarkery rizika v onkologii udávají míru rizika vzniku nádorového onemocnění u zdravého jedince, tedy jeho genetická výbava je v korelaci s expozicí karcinogenům, mutagenům a obecně vlivům zevního prostředí. Nádorová transformace je zapříčiněna mutacemi v klíčových genech, protoonkogenech, tumor-supresorových genech a tzv. mutátorových genech, které jsou odpovědné za schopnost reparace nukleových kyselin, přičemž se jedná o proces vícestupňový a k nádorové transformaci je nutný vznik více mutací [80]. Jestliže je nádorové onemocnění podmíněné jednou mutovanou alelou neboli lokusem, označují se tato onemocnění v rámci mendelovské dědičnosti jako onemocnění monogenní. Příkladem mohou být mutace v tumor-supresorovém genu p53, nebo protoonkogenech MET či CDK4 a tyto mutace jsou odpovědné za hereditární nádorová onemocnění neboli nádorové syndromy [21, 24, 43, 65, 80]. Při polygenním typu dědičnosti je onemocnění podmíněno mutacemi v několika genetických lokusech. O multifaktoriální dědičnosti lze hovořit v situaci, kdy se na dědičnosti onemocnění významně uplatňují i faktory zevního prostředí [4, 21, 80]. Genetická predispozice je diskutována i u pacientů se sporadickým výskytem nádorů, které tvoří asi 90 % všech malignit. Toto lze vysvětlit i na příkladu maligního melanomu, kde se za jeden z významných rizikových faktorů považuje výskyt melanomu v rodinné anamnéze [44, 68]. V dermatoonkologii lze jako genetické biomarkery rizika určit hereditární mutace odpovědné za zvýšený výskyt kožních nádorů, a zejména u maligního melanomu, geny CDKN2A, p16 a p14. U bazocelulárního karcinomu je pak gen PTCH odpovědný za Gorlinův syndrom [1, 61, 69].
Diagnostické genetické biomarkery představují významně se rozvíjející kategorii, která napomáhá diagnostice nádorových onemocnění, zejména pak jejich odlišení např. od atypických lézí či prekanceróz. U hematologických malignit je možné uvést příklad vyšetření tzv. přestavby TCR genu. Přeskupení v T-buněčném receptoru (TCR) lze běžně detekovat ve stadiu infiltrovaných projevů mycosis fungoides (MF a v tumorózním stadiu, ale v časném premykotickém stadiu ho lze nalézt v méně než 50 % případů, kde genetické změny jsou spíše ojedinělé [60, 81]. Onkogen p16 a tumor-supresorový gen p53 jsou často mutovány až v pozdějším tumorózním stadiu. V časných stadiích (MF), kde stanovení jednoznačné histopatologické diagnózy je někdy velice obtížné, může být nápomocné i vyšetření klonality, za použití specifických DNA sond [60]. V tomto případě detekujeme T-buněčný infiltrát s klonální charakteristikou, která značí původ v jedné patologické buňce. U diagnostických molekulárně genetických biomarkerů je nutné zmínit metodu FISH (Florescenční In Situ Hybridizace), která umožňuje identifikaci specifické sekvence nukleotidů v DNA. Samotná hybridizace představuje technologii, kdy dochází ke spojení vlákna nukleové kyseliny s druhým vláknem, na kterém je přítomna sonda značená fluorescenčně. K hybridizaci dochází přímo ve vyšetřovaném biologickém materiálu, tedy na místě (in situ) [26, 73]. Tato metoda v diagnostice atypických melanocytárních lézí nejistého biologického potenciálu zažívá určitou renezanci. V diagnostice pigmentových afekcí a melanomu se využívá kombinace 4 základních DNA sond pro geny RREB1 (6p25; Ras-responsive element-binding protein 1), MYB (6q23; protooncogen MYB), CCND1 (11q13; Cyclin D1) a CDKN2A (9p21; cyclin-dependent kinase Inhibitor 2A) s literárně udávanou senzitivitou až 94 % a specificitou 98 % při odlišení benigních a maligních melanocytárních afekcí. Nevýhodou metody je možné použití pouze u mitotických buněk, kterých není ve tkáni mnoho, určitá menší senzitivita u nejistých pigmentových afekcí v dětském věku, především u preadolescentů, relativní technická náročnost a vysoká cena DNA sond [26, 73].
Významnou roli mohou molekulární diagnostické biomarkery sehrávat při stagingu onemocnění a při sledování reziduální nádorové nemoci. Pro tyto potřeby zažívají v poslední době rozvoj metody analyzující cirkulující nádorové DNA (ctDNA) a cirkulující nádorové buňky (CTC), metody označované někdy jako tzv. tekuté biopsie. Přestože jde o metody principiálně staré, velký rozvoj této metodiky umocnily hlavně nové metody molekulární genetiky včetně tzv. sekvenování nové generace (NGS). Jedná se o relativně neinvazivní metodu detekující uvolněné nádorové buňky, či molekuly DNA, ale i RNA v séru pacientů [59]. Tyto metody jsou vhodné nejen pro diagnostiku hematologických maligních onemocnění, ale i pro sledování účinnosti terapie a pro včasné zachycení rezistence na léčbu. S určitou předběžnou opatrností je ale třeba přistupovat k této problematice u solidních nádorů. V případě melanomu a sledování účinnosti terapie je literárně některými autory popsána senzitivita více než 70 % a specificita 100 % [40, 59].
V poslední době je trendem rozvoj detekce tak zvaná mikroRNA molekul. MikroRNA (miRNA) jsou početnou skupinou krátkých (cca 18–25 nukleotidů) nekódujících RNA, které tedy samy nejsou podkladem pro vznik proteinů, ale které naopak tlumí translaci jiných genů vazbou na jejich cílové mRNA molekuly, případně vedou až k jejich degradaci [14, 23]. Tyto endogenní molekuly RNA jsou vysoce sekvenčně konzervované a podílejí se na řadě biologických procesů včetně diferenciace, proliferace, regulace kmenových vlastností buněk, nebo karcinogeneze.
Rozvoj těchto moderních metod v současné době nenaráží ani tak na přístrojové a technické vybavení laboratoří, ale spíše na chybějící úhradové mechanismy z veřejného zdravotního pojištění a poměrně vyšší cenu těchto metodik. V současné době není pro použití těchto metod v dermatoonkologii ani vymezeno žádné pevné doporučení mezinárodní či národní odbornou společností.
Genetické prognostické biomarkery představují ukazatele, které stanovují šanci na uzdravení, případně další vývoj onemocnění. Jedná se o biomarkery, které napomáhají zvolení optimálního léčebného postupu pro daného pacienta [49]. Jako nepochybný základní prognostický biomarker lze uvézt staging onkologického onemocnění v podobě TNM klasifikace, která má pro svou univerzálnost a mezinárodní použití nepopiratelný praktický význam a jednoduché použití v každodenní praxi. Molekulárně genetické biomarkery by mohly tento standardní mechanismus dále upřesnit až za hranici rozlišovací schopnosti diagnostické patologie. V dermatoonkologii nejsou ale doposud plošně použity tak, jako je tomu např. u nádorů prsu a kolorektálního karcinomu, kde lze využít komplexních prognostických systémů: Oncotype DX Brest Cancer nebo např. Oncotype DX Colon Cancer [8, 85]. Tyto systémy jsou založeny na analýze exprese několika specifických genů, která umožňuje výpočet skóre pravděpodobnosti možného relapsu (RS, recurrence score). Nevýhodou těchto testů je relativní nepřesnost při zařazení pacientů ve všech stadií onemocnění, a tedy vhodnost doporučení jen u pacientů s doposud lokalizovaným onemocněním. Ale i vzhledem k tomuto relativnímu indikačnímu omezení můžeme podle výsledku RS skóre při vyšším riziku recidivy onemocnění zvolit např. radikálnější adjuvantní terapii [8, 86]. Pro potřeby adjuvantní terapie melanomu (od stadia IIB) máme k dispozici pouze interferon alfa, o jehož efektivitě jsou vedeny nadále spory [75]. Proto jsou tato poměrně nákladná vyšetření méně rozvíjena a současné práce poukazující na možnosti některých genetických prognostických markerů jsou zatím jen na úrovni experimentálních studií [22].
Prediktivní genetické biomarkery mají v současné době nezastupitelnou roli i v dermatoonkologii při využití cílené (personalizované) onkologické terapie. Obecně prediktivní biomarker používáme za účelem predikce terapeutické odpovědi na onkologickou terapii [49]. V případě dermatoonkologie nejsou v současné době známy čistě genetické prediktivní biomarkery. Běžně se ale využívají genetické biomarkery umožňující volit cílenou terapii nádorů, jako je vyšetření BRAF mutace, případně mutace NRAS [22]. Tyto biomarkery se řadí do skupiny prediktivních biomarkerů, i když jejich detekce nepoukazuje na celkovou terapeutickou odpověď, ale indikuje pouze možnost zahájení cílené terapie. Při diagnostikovaném metastatickém postižení melanomem je vzhledem k terapeutické dostupnosti BRAF inhibitorů indikovano vyšetření BRAF mutace [22, 48]. Její detekci lze provádět rutině pomocí metody PCR i z parafinového histologického bloku. V tomto případě je získání biologického materiálu snadné, lze ho provádět i z archivního histologického materiálu. Stejný význam má i případné vyšetření mutace NRAS, zejména pak u negativity BRAF mutace. Limitující je však doposud chybějící úhradový mechanismus případné možnosti terapie MEK inhibitory, obdobná situace je i v případě detekce mutace u c-KIT pozitivních slizničních či akrolentiginózních melanomů s možnou následnou terapií imatinibem (inhibitor receptorů s tyrozinkinázovou aktivitou, používá se zejména v terapii chronické myeloidní leukémie a gastrointestinálního stromálního tumoru) [82].
Se současným rozvojem genetických metod a již běžným zaváděním sekvenování včetně sekvenování celého genomu (sekvenování nové generace) budou i v dermatoonkologii bezpochyby zaváděny tzv. multi-markerové testy ke zpřesnění prognózy onkologického onemocnění a predikci terapeutické odpovědi [22].
SÉROLOGICKÉ BIOMARKERY
Sérologické biomarkery nabízejí výhodu snadného, dostupného a velice dobře interpretovatelného vyšetření. I vzhledem k dostupnosti a ceně metodiky představují téměř ideální biomarkery. Na druhé straně je obtížné nalezení vysoce specifického a senzitivního znaku, který by dostatečným způsobem mohl být biologickým prediktorem nádorového onemocnění [22, 79].
Jeden z nejběžněji používaných biomarkerů v dermatoonkologii je S100 protein. Pro sérologickou diagnostiku se využívá S100B podjednotka, kterou lze detekovat u pacientů s melanomem a zvýšené hladiny byly spojeny s nádorovou rezistencí a progresí onemocnění [79]. V řadě provedených studií byla zaznamenána elevace S100B proteinu v séru pacientů v prvních týdnech progrese onemocnění (ve 4. týdnu od progrese asi 78 % pacientů, v 8. týdnu až 84 % pacientů). Současně je patrna tendence ke stabilizaci či poklesu S100B při terapeutické odpovědi [32]. Výhodou vyšetření je v současné době běžná dostupnost prakticky ve všech biochemických laboratořích. Nevýhodou je nižší senzitivita při časné diagnostice progrese onemocnění a nutnost pravidelného opakování vyšetření k posouzení dynamiky vývoje.
Zvýšené hladiny laktát dehydrogenázy (LDH) doprovázejí jakékoli onemocnění charakterizované destrukcí buněk a anaerobním metabolismem. Jedná se o vysoce nespecifický biomarker. LDH se rutině používá jako pomocný diagnostický marker u pacientů s podezřením na recidivu melanomu, může být použit i jako monitorovací nástroj pro pacienty s pokročilým onemocněním. Navíc se v rámci diagnostiky používá i jako jeden ze stagingových biomarkerů v rámci TNM klasifikace podle kritérií AJCC [2]. Elevace LDH má i prognostický význam u pacientů ve stadiu IV. U pacientů s normálními hladinami LDH v séru byla celková míra přežití (OS, overall survival) v 1. a 2. roce onemocnění 65 %, respektive 40 %, ve srovnání s pouze 32 % a 18 %, u pacientů s elevací LDH [2]. Vedle diagnostiky a prognózy onemocnění lze použít sérové hladiny LDH i jako prediktivní marker terapeutické odpovědi imunoterapie. Pacienti s nízkou, respektive normální hladinou LDH (ale např. i v kombinaci s normální hladinou CRP) mají obecně lepší terapeutickou odpověď v rámci imunoterapie (anti-CTLA4, anti-PD1) [45]. Sérová elevace LDH je i jeden z biomarkerů, který lze použít u kožních lymfomů jak k diagnostice, tak k monitorování stability onemocnění [39].
Dalším ze sérologicky detekovatelných proteinů je MIA (Melanoma Inhibitory Activity), který interaguje s proteiny extracelulární matrix. Jeho expresi lze detekovat i v normální tkáni, např. chrupavce. V patologických procesech je zvýšená exprese vedle melanomu pozorována v nádorech prsu, kolorektálním karcinomu a buňkách glioblastomu. Sérová elevace MIA dobře koreluje s klinickým stadiem a progresí onemocnění. U pacientů v klinickém stadiu I a II je sérová elevace MIA detekována u 13–23 % pacientů, v klinickém stadiu III a IV dokonce až ve 100 %. Podle některých retrospektivních studií bylo prokázáno, že i když je elevace MIA detekována jen asi u čtvrtiny pacientů v nižším klinickém stadiu, může být tento marker určitým signálem budoucí progrese a rozvoje metastatického postižení [6, 64].
Z nových zatím běžně nepoužívaných sérologických markerů lze zmínit VEGF (vaskulární endoteliální růstový faktor, Vascular Endothelial Growth Factor), bFGF (fibroblastový růstový factor beta, Fibroblast Growth Factor beta) a IL-8. VEGF se účastní v průběhu normální i patologické angiogeneze, dále je popsán i efekt na vyzrávání dendritických buněk a možné ovlivnění potenciálních mechanismů úniku nádorových buněk imunitním mechanismům pacienta. Sérové elevace VEGF, bFGF a IL-8 jsou běžně zaznamenávány u pacientů s melanomem oproti zdravé populaci, navíc statisticky dobře korelují i s celkovým přežitím a přežitím do progrese onemocnění [16, 78].
S možnostmi molekulárně genetické diagnostiky se mezi sérologické markery řadí i detekce microRNA molekul (miRNAs). Jak již bylo zmíněno, jedná se o malé nekódující RNA molekuly regulující genovou expresi a post-transkripční modifikace, které vykazují dobrou stabilitu oproti RNázám [23]. V poslední době bylo detekováno v lidském genomu více než dva tisíce různých miRNAs a některé z nich mají poměrně slibný význam i v sérologické diagnostice. Tento aspekt lze využít při monitorování a detekci progrese onemocnění u maligního melanomu. Zatím nejvíce diskutovaná je molekula miRNA 355, dále pak miRNA-150, -15b, -199a, -5p, -33a, -424. Tyto miRNA navíc umožňují úspěšně stratifikovat jednotlivé pacienty a přiřadit jim míru rizika v návaznosti na možnosti progrese onemocnění. Jedná se tedy i vedle diagnostiky o velmi citlivý prediktivní biomarker [23, 87]. Role miRNA je hojně diskutována ve všech odvětvích onkologie a možnost použití je i u jiných nádorů než jen u melanomu. Poměrně slibné nálezy lze detekovat i u pacientů s primárními kožními lymfomy, kde obecně chybí citlivé biomarkery, které by jednoznačně odlišily časná stadia onemocnění od benigních kožních dermatóz [14].
CIRKULUJÍCÍ NÁDOROVÉ BUŇKY
Detekce cirkulujících nádorových buněk má teoreticky významný klinický potenciál pro diagnostiku progrese onemocnění a metastatického postižení. Význam může mít i při výběru správné a personalizované terapie. Maligní melanom byl jeden z prvních solidních tumorů, kde byla v klinické praxi použita detekce cirkulujících nádorových buněk, zejména s ohledem na jejich výrazné morfologické charakteristiky [71]. Nověji byla metoda detekce nádorových cirkulujících buněk vylepšena orientací na detekci exprese poměrně specifických nádorových markerů, které jsou dobře kvantifikovatelné při vyšetření cytometrickými metodami, např. průtokovou cytometrií. Výhodou je pak i možnost tímto přístupem florescenčně detekovat několik antigenů současně na jediné buňce. V současné době lze využít diagnostické kity, které umožňují vyšetření specifických nádorových markerů (např. u melanomu se jedná o Melcam, HMW-MAA, high molecular weight melanoma-associated antibody) [41]. V některých retrospektivních studiích však autoři poukazují na spolehlivost asi jen u čtvrtiny pacientů s melanomem, kteří s vyšším množstvím detekovaných cirkulujících nádorových buněk měli i významně kratší celkovou dobu přežití (2,6 měsíce oproti 7,2 měsíce) [41]. Relativně nižší schopnost detekovat cirkulující nádorové buňky lze vysvětlil schopností melanomových buněk plasticky měnit svůj fenotyp v závislosti na daném prostředí a při poměrně úzkém spektru nádorových antigenů hrozí riziko falešně negativních nálezů. Lepších výsledků bylo dosaženo ve studiích, kde byl použit vedle melanocytárního markeru MLANA i marker buněk s kmenovým fenotypem ABCB5 [40, 63]. Tato kombinace použitých markerů vedla k zachycení prakticky 50 % pacientů, u kterých následně došlo k relapsu onemocnění. Navíc detekce těchto cirkulujících buněk byla možná až u 92 % pacientů s melanomem oproti zdravé kontrole [63]. Detekci nádorových cirkulujících buněk lze použít i jako solidní biologický marker odpovědi na protinádorovou terapii. Metoda průtokové cytometrie je rutinně používaná pro detekci nádorových cirkulujících buněk při diagnostice kožních lymfomů, a to především při vyšetření periferní krve u leukemických variant (tedy např. Sézaryho syndromu), nebo po enzymatické disociaci při vyšetření bioptického materiálu. U vyšetření bioptického materiálu je nutné ale počítat s poměrně nižší citlivostí této metodiky u pacientů zejména v nižším stadiu, vzhledem k možnému jen nenápadnému kožnímu infiltrátu nádorových buněk [83, 84].
NÁDOROVÉ INICIUJÍCÍ BUŇKY
Se zdokonalením metod průtokové cytometrie a současně v korelaci s imunohistochemickými metodami byly ve tkáních identifikovány buněčné subpopulace, které jsou odpovědné za iniciaci nádorového růstu a mají schopnost udržovat trvalý růst nádoru. Detekce těchto subpopulací podpořila teorii o existenci tzv. nádorových kmenových buněk v různých typech nádorů. I když samotná patogeneze řady nádorů je nejasná, je prokázáno, že akumulace řady genetických mutací a epigenetických změn vede i u poměrně diferencovaných buněk k opětovnému získání kmenového fenotypu cestou tzv. somatického reprogramování [4, 47]. Kmenové vlastnosti propůjčují buňkám nejen schopnost sebeobnovy a následné diferenciace, ale z terapeutického pohledu je zásadní i rezistence vůči xenobiotikům s proapoptotickým působením, či dokonce rezistence vůči dlouhodobé izolaci, tzv. anoikis. Teorie nádorových kmenových buněk je plně respektována v patogenezi řady primárně hematologických malignit, později se stala významným konceptem i u mnohých solidních nádorů. Jako zásadní je tento koncept diskutován i u maligního melanomu [15, 29, 67]. Pro identifikaci nádorových kmenových buněk byla testována celá řada především povrchových molekul a antigenů. Jako případné markery kmenových nádorových buněk slouží např. CD 20, CD 166 (obr. 1), CD 133 (obr. 2) a ABCG2, ABCB5 [18, 29, 55 67]. Expresi kmenových znaků lze experimentálně využít pro studium případného metastatického a invazivního potenciálu nádorů. I když do rutinní diagnostiky nebyly tyto markery doposud zavedeny, na jejich případný potenciál ukazují práce porovnávající benigní pigmentové névy a primární melanom případně s jeho následnými metastázemi. Bohužel i v řadě benigních pigmentových projevů může být zastižena exprese těchto kmenových znaků, i když v případě melanomu a metastáz je výrazně vyšší [18, 56]. V současné době existují desítky až stovky různých experimentálních prací poukazující na celou řadu biomarkerů, které se nejen u maligního melanomu mohou podílet na progresi onemocnění. Je však otázkou, který z těchto markerů lze prohlásit za spolehlivý a běžně dostupný prediktor nádorové progrese. Tyto poznatky se proto dosud neodrážejí v žádném široce respektovaném doporučení mezinárodních či národních odborných společností.
Image 1. Pozitivita CD166, membránová pozitivita v buňkách melanomu 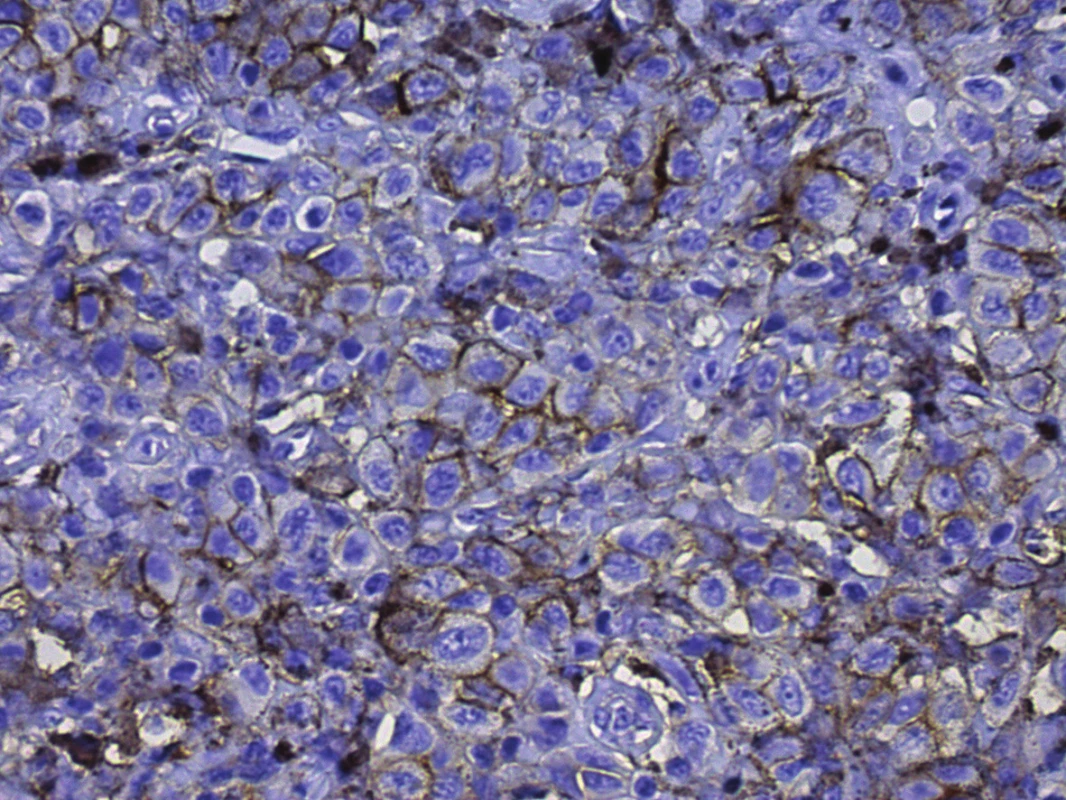
Breslow 3,0, zvětšeno 400x Image 2. Pozitivita CD133, jemně granulární cytoplazmatická a membránová pozitivita v buňkách melanomu 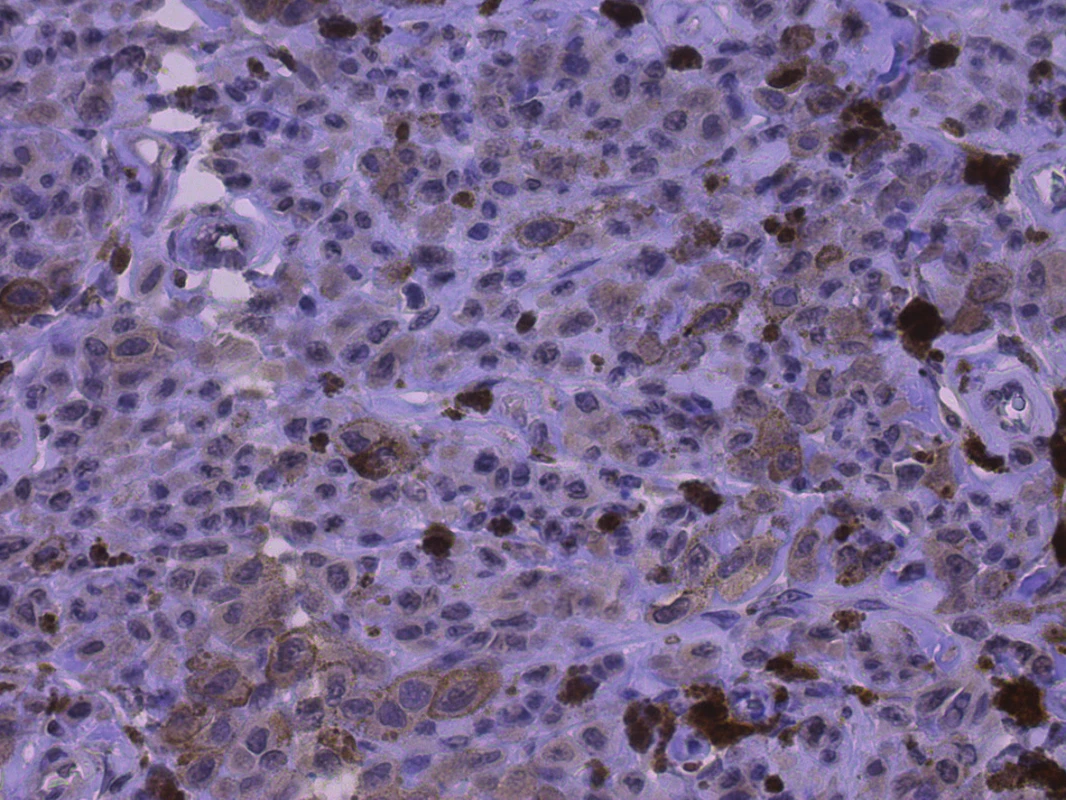
Breslow 2,8 , zvětšeno 400x IMUNOHISTOCHEMICKÁ DIAGNOSTIKA, ODBĚR TKÁNÍ A SPRÁVNÁ FIXACE
Histopatologické techniky umožňují vedle rutinních histologických metod i plošné zavádění molekulárně biologických vyšetření. Nejvíce rozšířené a snadno dostupné jsou metody imunohistochemického značení, které umožňují vyšetřování celé řady biomarkerů, jak na diagnostické úrovni včetně diferenciálně diagnostických biomarkerů, tak i pro účely tzv. prediktivní patologie. Imunohistochemie je metoda v rutinní praxi používaná již od 80. let minulého století, která umožňuje znázornit přítomnost jednoho (ale i více) konkrétního antigenu (zejména proteinu) pomocí specifických protilátek. Z technologických a ekonomických příčin se obvykle používá tzv. nepřímá imunochemická metoda, při které se v prvním kroku na tkáňový řez naváží protilátky proti konkrétním cílovým proteinům a ve druhém kroku se použijí značné protilátky (např. s enzymem peroxidázou), které se váží na protilátky prvního kroku. V závěrečném kroku se řez inkubuje se substrátem, který enzym přeměňuje na nerozpustný barevný produkt, jehož depozice v některých strukturách řezu ilustruje přítomnost cílového antigenu v mikroskopickém obraze [13, 50]. Metoda nepřímé peroxidázové imunohistochemie je rutinně používaná na většině patologických pracovišť provádějících onkologickou diagnostiku a používá se na tkáni fixované formaldehydem a zalité v parafinu (takzvané parafinové bloky).
Diagnostické markery pro imunohistochemické metody nejsou v současné době, bohužel, zpravidla zcela nádorově specifické, ale v kombinaci se základním morfologickým obrazem dané léze jejich hodnota dramaticky vzrůstá, a podílejí se tak na rutinní diagnostice nádorů (obr. 3, rutinní diagnostické markery melanomu). Diagnostické markery mohou upřesňovat i grading nádorů, a to za předpokladu, že nádory nízce diferencované mají horší prognózu. Může se tedy jednat i o biomarkery prediktivní, respektive prognostické [13, 50]. Příkladem může být exprese keratinů epitelovými nádory. Ty jsou pro epitelové nádory poměrně specifické, ale např. exprese již některých keratinů (např. keratinu 8 u dlaždicobuněčných karcinomů hlavy a krku) může poukazovat na nízkou diferenciaci nádorových buněk spojenou s horší prognózou onemocnění [52]. Diferenciálně diagnostické markery lze využít v případě, kdy morfologické znaky histologického vyšetření nejsou jednoznačně schopny určit původ nádorových buněk. Zcela obecně tak lze využít markery pro nádory epitelové (keratiny), mezenchymální (vimentin) či např. nádory vycházející s neuroektodermu (S100 protein).
Image 3. Pozitivita rutinně používaných imunohistochemických biomarkerů v buňkách melanomu A – HMB45 s cytoplazmatickou pozitivitou; B – MelanA/MART-1 s cytoplazmatickou pozitivitou; C – S100 – cytoplazmatická i jaderná pozitivita; D – MiTF – jaderná pozitivita. 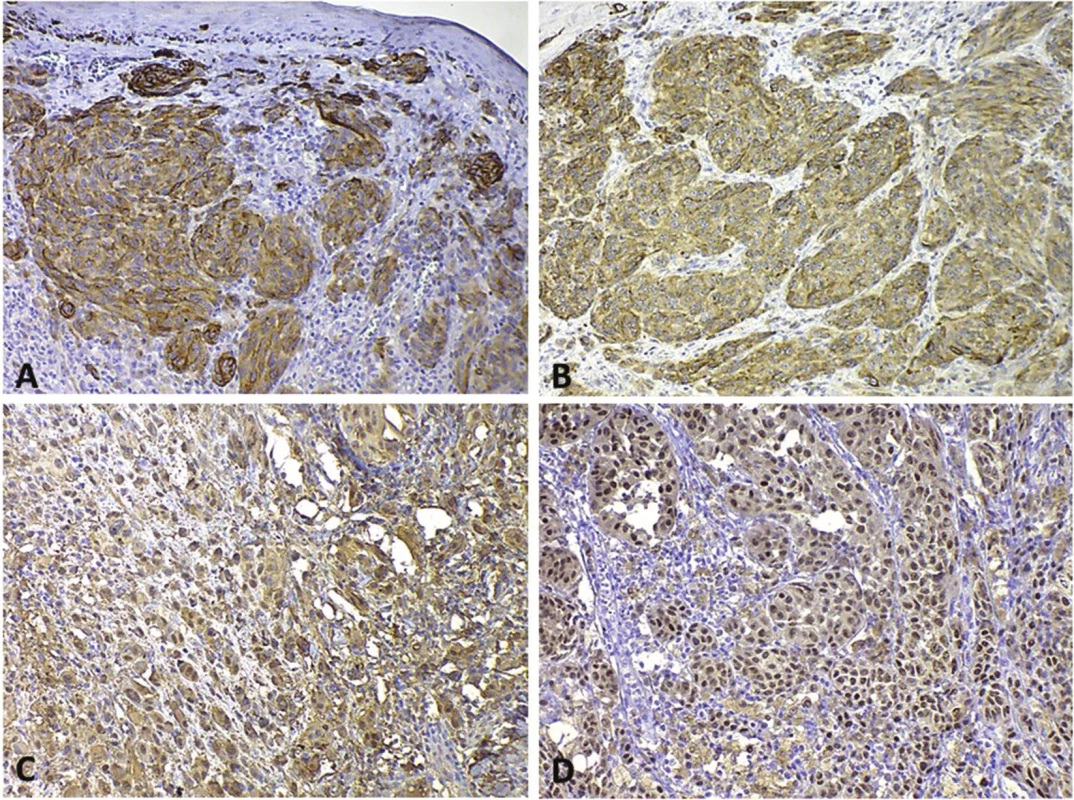
Jako příklad lze demonstrovat na rutinně používané vyšetření S100 proteinu, který je sice v případě melanomu považován za vysoce senzitivní, ale jeho specificita je poměrně nízká. Široce totiž vedle melanocytů značí i některé fibroblasty, chondrocyty, Langerhansovy buňky, tedy buňky se společnou histogenezí. Nověji se proto do klinické diagnostiky a diferenciální diagnostiky melanocytárních lézí zavádí vyšetření SOX10. Tento transkripční faktor je zapojený více specificky do vývoje melanocytů, není tedy přítomen u výše zmíněných histogeneticky příbuzných, leč odlišně se diferencujících buněčných typů. Typicky je SOX10 spojován s jadernou pozitivitou v melanomu a melanocytech (obr. 4), dokonce má výrazně vyšší senzitivitu i specificitu než S100 protein [76].
Image 4. Pozitivita SOX10, jaderná pozitivita s nespecifickým signálem v cytoplazmě, v buňkách melanomu Breslow 1,7, zvětšeno 200x 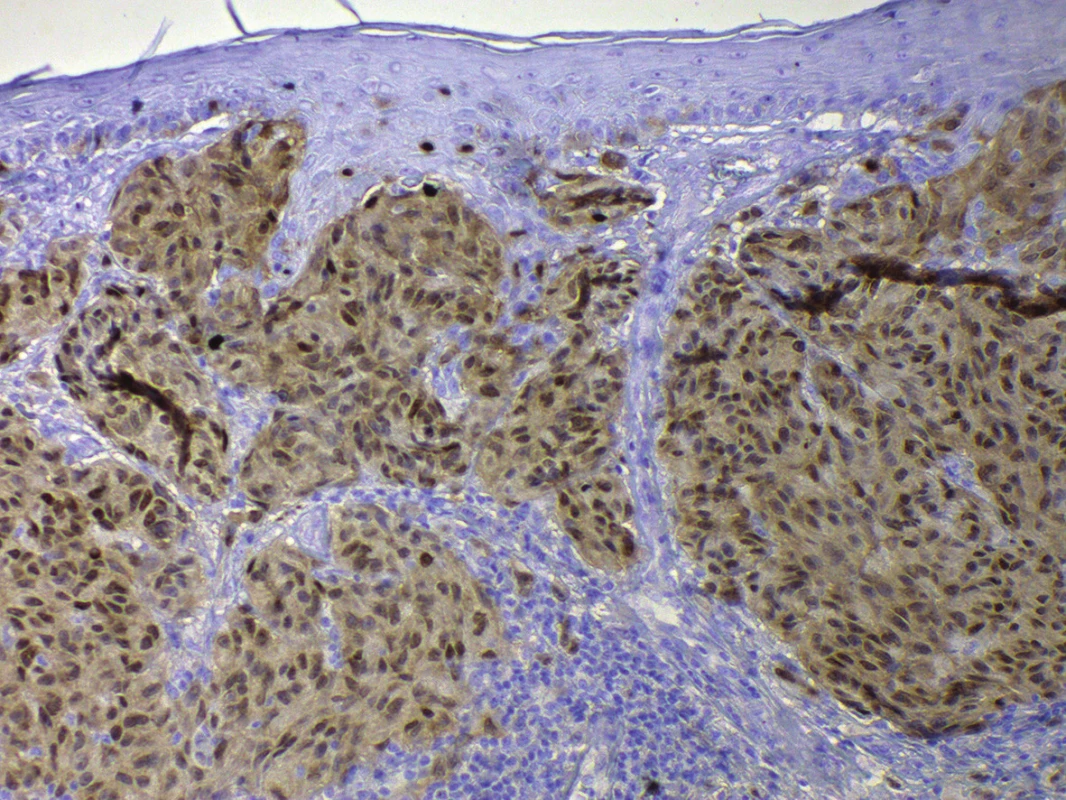
Pro potřeby onkologické personalizované terapie mají velký význam prediktivní biomarkery vyšetřované pomocí imunohistochemických metod. Z nejrutinněji vyšetřovaných biomarkerů je ilustrativním příkladem průkaz estrogenových receptorů u karcinomů prsu. Pro potřeby dermatoonkologie lze zmínit hojně diskutovaný antigen PD-L1 (Programmed death-ligand 1), jehož pozitivita se zdá být klíčová pro terapeutickou odpověď u anti-PD1 terapie (pembrolizumab, nivolumab). V poslední době je toto téma diskutováno i u epitelových karcinomů plic. U pacientů s pozitivitou nádorových buněk vyšší než 50 % lze očekávat výrazně vyšší terapeutickou odpověď než u pacientů s nižší pozitivitou [62]. Obdobné studie lze v nejbližší době očekávat i u kožních karcinomů a u karcinomů hlavy a krku. V případě melanomu může však být pozitivita PD-L1 i výrazně nižší (obr. 5), aniž by toto výrazně ovlivnilo terapeutickou odpověď na anti-PD1 léčbu. Je zřejmé, že řada nádorů včetně melanomu, vykazuje výraznou heterogenitu exprese PD-L1 v rámci jednoho nádoru. Toto pak platí i pro heterogenitu v porovnání primárního ložiska a metastázy. Prediktivní význam stanovování tohoto biomarkeru není doposud u melanomu jednoznačně definován, ale je doporučováno stanovení provádět z co možná nejaktuálnější nádorové recidivy či progrese, která může odrážet aktuální poměry v expresi PD-L1 a odrážet tak souvislosti se stavem pacienta a aktuálního ladění nádorového mikroprostředí [28, 74].
Image 5. Pozitivita PD-L1, místy jemně granulární cytoplazmatická a především membránová pozitivita v buňkách melanomu – pozitivita do 10 % nádorových buněk Breslow 2,8 , zvětšeno 400x 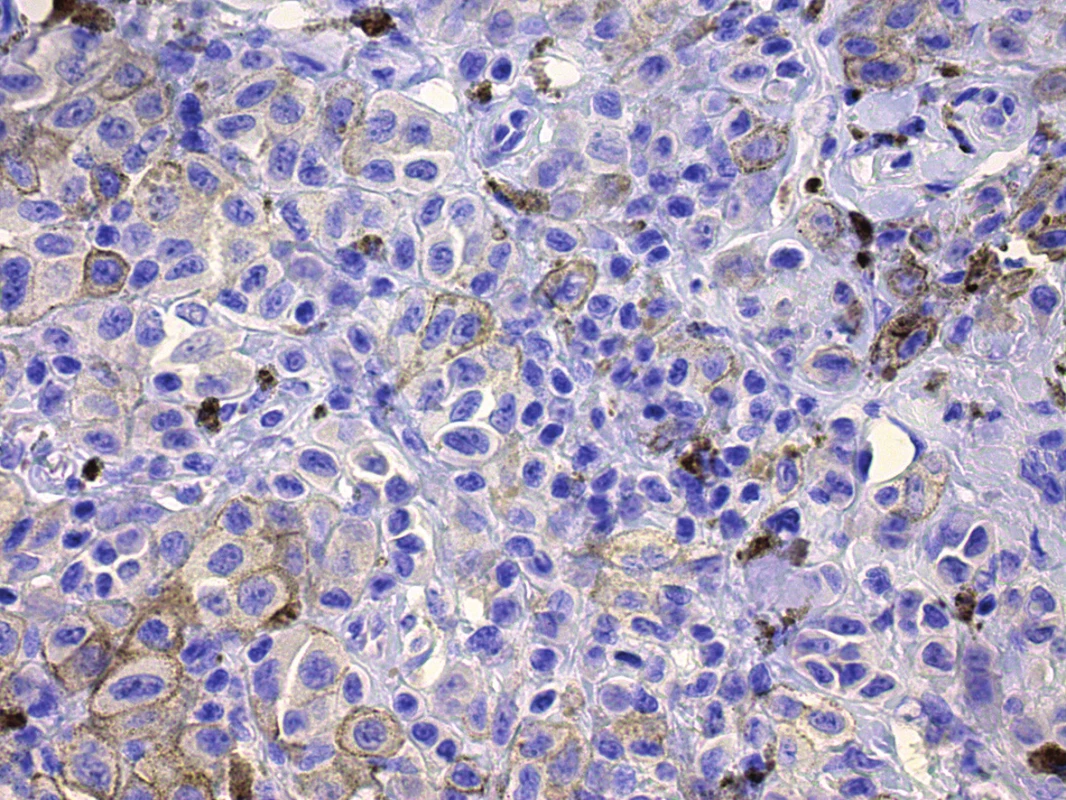
Zcela zásadní je pro provádění imunohistochemických a později i molekulárně genetických metod preanalytická fáze zpracování tkáně. Tuto fázi může ovlivnit při provádění biopsie každý dermatolog. Prakticky okamžikem omezení cévní perfuze začínají ve tkáni působit autolytické procesy, které znesnadňují následnou analýzu tkáně. Rychlost a šetrné nakládání s tkání v průběhu operace i po ní je tedy zásadní. Doba, kterou tkáň stráví mimo tělo pacienta před zahájením fixace (doba tzv. studené ischémie, tj. čas od přerušení cévního zásobení), by měla být cíleně minimalizována. Správná fixace bioptovaného materiálu je nezbytná pro zabránění degradace tkáně včetně nukleových kyselin. Rutině používaný 10% neutrální pufrovaný formol (tj. přibližně 4% formaldehyd v ústojném roztoku, zpravidla fosfátovém) poskytuje dostatečně bezpečné fixativum, zejména pro proteinové komponenty tkáně. Doba fixace nesmí být však příliš krátká (ne méně než 6 hodin), aby došlo k dostatečnému prosycení materiálu. Orientačně se předpokládá, že dokonalé penetrace tkáně je dosahováno rychlostí menší než 1 mm/hodinu při pokojové teplotě [33]. Potřebný čas je tedy závislý na velikosti resekátu. V průběhu fixace se formaldehyd váže na proteiny tkáně, a ve fixativu tak klesá jeho koncentrace. Platí tedy, že minimální objem fixativa na začátku by měl být asi 20krát větší, než je objem fixované tkáně. Současně platí, že snížená teplota nepřispívá k lepší penetraci do tkáně, fixace za snížené teploty v chladničce tedy rovněž není vhodná. Fixace by neměla být ani příliš dlouhá (jistě ne déle než 48 hod.), jelikož především nukleové kyseliny při dlouhé fixaci ve formaldehydu podléhají fragmentaci, a dochází tak k nevratnému poškození RNA, ale dokonce i stabilnější DNA [9, 58]. Pro fixaci tkání a při předpokladu nutného delšího uskladnění před transportem do laboratoře lze využít i následné fixace v 70% etanolu. Pro cílená molekulárně genetická vyšetření je určitou výhodou prudké zmražení nativního preparátu v tekutém dusíku, který zaručuje excelentní kvalitu nukleových kyselin (zejména pak RNA), vyšší než po fixaci formaldehydem či alkoholem. Zmražená tkáň v tekutém dusíku sice poskytuje relativně ideální materiál s nativní DNA i RNA, ale během prudkého zamražení dochází k porušení integrity buněčných membrán a při opětovném rozmražení vzorku k dalšímu zpracování jsou aktivovány RNázy (enzymy ze skupiny nukleáz štěpící RNA). Tomuto procesu lze zabránit při použití fixačního roztoku s inhibitory nukleáz, tzv. RNA later [9, 58]. Nevýhodou zmraženého vzorku je relativní nevhodnost pro klasické histologické vyšetření. Dermatolog odebírající nádorové tkáně by měl zajistit jak správné fixativum a skladování, tak i případný včasný transport tkáně do laboratoře k dalšímu zpracování. V současné době jsou volně dostupné laboratorní příručky pracovišť provádějící zpracování bioptických vzorků, kde je standardně popsán postup preanalytického zpracování tkání, případně při pochybnostech je vhodné se na laboratoř obrátit s cílenými dotazy.
ZÁVĚR
Pokroky v nádorové biologii pomáhají pochopit složitost a komplexnost nádorových onemocnění, navíc molekulárně biologické biomarkery přináší možnosti, jak zpřesnit a zlepšit diagnostiku onkologických onemocnění. V řadě případů biomarkery pomáhají odhadnout i další osud pacienta a zvolit adekvátní terapeutickou strategii. I když byl v tomto odvětví zaznamenán velký pokrok, doposud není zaveden biomarker, který by odlišil nádorovou buňku od té nenádorové. Na diagnostické a prognostické biomarkery je vždy nutné pohlížet v kontextu dané tkáně či onemocnění komplexně a zohlednit individuální charakteristiky pacienta. Nesporný význam mají biomarkery v zavádění personalizované onkologické terapie, kde jsou naprosto klíčové a nenahraditelné. Zavádění těchto nových onkologických postupů a vyšetření zdůrazňuje nutnost multioborového přístupu a získání alespoň základní erudice i jiných odvětví laboratorní diagnostiky a klinické medicíny.
Podpořeno grantovým projektem: Grantová agentura ČR, GAČR 16-05534S, Ministerstvo zdravotnictví ČR, Agentura zdravotnického výzkumu AZV 16–30954A, PROGRES UK, BIOCEV CZ.1.05/1.1.00/02.0109.
Autoři rovněž děkují 1. LF UK za setrvalou institucionální podporu a podporu přístrojového vybavení Dermatohistopatologické laboratoře kliniky, kde byla provedena veškerá imunohistochemická vyšetření ilustrující tento článek.
Do redakce došlo dne 28. 11. 2017.
Adresa pro korespondenci:
MUDr. Ondřej Kodet, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocenice 499/2, Praha 2, 128 00
e-mail: ondrej.kodet@vfn.cz
Sources
1. AOUDE, L. G., GARTSIDE, M., JOHANSSON, P. et al. Prevalence of Germline BAP1, CDKN2A, and CDK4 Mutations in an Australian Population-Based Sample of Cutaneous Melanoma Cases. Twin Res Hum Genet., 2015, 18, p. 126–133.
2. BALCH, C. M., GERSHENWALD, J. E., SOONG, S. J. et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol., 2009, 27, p. 6199–6206.
3. BENLLOCH, S., PAYÁ, A., ALENDA, C. et al. Detection of BRAF V600E mutation in colorectal cancer: comparison of automatic sequencing and real-time chemistry methodology. J Mol Diagn., 2006, 8, p. 540–543.
4. BERTRAM, J. S. The molecular biology of cancer. Mol Aspects Med., 2000, 21, p. 167–223.
5. BOLLAG, G., HIRTH, P., TSAI, J. et al. Clinical efficacy of a RAF inhibitor needs broad target blockade in BRAF-mutant melanoma. Nature, 2010, 467, p. 596–599.
6. BOSSERHOFF, A. K., MOSER, M., HEIN, R. et al. In situ expression patterns of melanoma-inhibiting activity (MIA) in melanomas and breast cancers. J Pathol., 1999, 187, p. 446–454.
7. BROOKS, J. D. Translational genomics: the challenge of developing cancer biomarkers. Genome Res., 2012, 22, p. 183–187.
8. CARLSON, J. J., ROTH, J. A. The impact of the Oncotype Dx breast cancer assay in clinical practice: a systematic review and meta-analysis. Breast Cancer Res Treat., 2013, 141, p. 13–22.
9. CREE, I. A., DEANS, Z., LIGTENBERG, M. J. et al. European Society of Pathology Task Force on Quality Assurance in Molecular Pathology; Royal College of Pathologists. Guidance for laboratories performing molecular pathology for cancer patients. J Clin Pathol., 2014, 67, p. 923–931.
10. DAVIES, H., BIGNELL, G. R., COX, C. et al. Mutations of the BRAF gene in human cancer. Nature, 2002, 417, p. 949–954.
11. DIGIOVANNA, J. J., KRAEMER, K. H. Shining a light on xeroderma pigmentosum. J Invest Dermatol., 2012, 132, p. 785–796.
12. DOWNWARD, J. Targeting RAS signalling pathways in cancer therapy. Nat Rev Cancer., 2013, 3, p. 11–22.
13. DURAIYAN, J., GOVINDARAJAN, R., KALIYAPPAN, K. et al. Applications of immunohistochemistry. J Pharm Bioallied Sci., 2012, 4, p. 307–309.
14. DUSÍLKOVÁ, N., BÁŠOVÁ, P., POLÍVKA, J. Plasma miR-155, miR-203, and miR-205 are Biomarkers for Monitoring of Primary Cutaneous T-Cell Lymphomas. Int J Mol Sci., 2017, 18, E2136.
15. DVOŘÁNKOVÁ, B., SZABO, P., KODET, O. et al. Intercellular crosstalk in human malignant melanoma. Protoplasma., 2017, 254, p. 1143–1150.
16. ENE NICOLAE, C. D., NICOLAE, I. Interleukin 8 serum concentration, but not lactate dehydrogenase activity, positively correlates to CD34 antigen in melanoma tumors. J Immunoassay Immunochem., 2016, 37, p. 463–471.
17. ESPINOSA, A. V., PORCHIA, L., RINGEL, M. D. Targeting BRAF in thyroid cancer. Br J Cancer., 2007, 96, p. 16–20.
18. FANG, D., NGUYEN, T. K., LEISHEAR, K. et al. A tumorigenic subpopulation with stem cell properties in melanomas. Cancer Res., 2005, 65, p. 9328–9337.
19. FEARON, E. R., VOGELSTEIN, B. A genetic model for colorectal tumorigenesis. Cell, 1990, 61, p. 759–767.
20. FORETOVÁ, L., NAVRÁTILOVÁ, M., MACHÁČKOVÁ, E. Limitace genetického testování v onkologii. Klin Onkol., 2009, 22, s. 65–68.
21. FORETOVÁ, L. Hereditary neoplastic diseases. Klin Onkol., 2012, 25, s. 6.
22. FOTH, M., WOUTERS, J., DE CHAUMONT, C. et al. Prognostic and predictive biomarkers in melanoma: an update. Expert Rev Mol Diagn., 2016, 16, p. 223–237.
23. FRIEDMAN, E.B., SHANG, S., DE, MIERA, E.V. et al. Serum microRNAs as biomarkers for recurrence in melanoma. J Transl Med., 2012, 10, p. 155.
24. GARDER, J. E., OFFIT, K. Hereditary cancer predisposition syndromes. J Clin Oncol., 2005, 10, p. 276–292.
25. GENTILE, A., TRUSOLINO, L., COMOGLIO, P. M. The Met tyrosine kinase receptor in development and cancer. Cancer Metastasis Rev., 2008, 27, p. 85–94.
26. GERAMI, P., LI, G., POURYAZDANPARAST, P. et al. A highly specific and discriminatory FISH assay for distinguishing between benign and malignant melanocytic neoplasms. Am J Surg Pathol. 2012, 36, p. 808–817.
27. GOYAL, G., FAN, T., SILBERSTEIN, P. T. Hereditary cancer syndromes: utilizing DNA repair deficiency as therapeutic target. Fam Cancer, 2016, 15, p. 359–366.
28. GIBNEY, G. T., WEINER, L. M., ATKINS, M. B. Predictive biomarkers for checkpoint inhibitor-based immunotherapy. Lancet Oncol., 2016, 17, p. 542–551.
29. GIROUARD, S. D., MURPHY, G. F. Melanoma stem cells: Not rare, but well done. Lab. Invest., 2011, 91, p. 647–664.
30. HA, L., MERLINO, G., SVIDERSKAYA, E.V. Melanomagenesis: Overcoming the Barrier of Melanocyte Senescence. Cell Cycle., 2008, 7, p. 1944–1948.
31. HALUSKA, F. G., TSAO, H., WU, H. et al. Genetic alterations in signaling pathways in melanoma. Clin Cancer Res., 2006, 12, p. 2301–2307.
32. HAUSCHILD, A., ENGEL, G., BRENNERM, W. et al. Predictive value of serum S100B for monitoring patients with metastatic melanoma during chemotherapy and/or immunotherapy. Br J Dermatol., 1999, 40, p. 1065–1071.
33. HOWAT, W. J., WILSON, B. A. Tissue fixation and the effect of molecular fixatives on downstream staining procedures. Methods., 2014, 70, p. 12–19.
34. CHEN, H., ZHANG, S., WU, Z. Fanconi anemia pathway defects in inherited and sporadic cancers. Transl Pediatr., 2014, 3, p. 300–304.
35. IKEHATA, H., ONO, T. The mechanisms of UV mutagenesis. J Radiat Res., 2011, 52, p. 115–125.
36. JACOBS, K. B., YEAGER, M., ZHOU, W. et al. Detectable Clonal Mosaicism and Its Relationship to Aging and Cancer. Nature Genetics., 2012, 44, p. 651–668
37. JOHNSON, D. B., PUZANOVA, I. Treatment of NRAS-mutant melanoma. Curr Treat Options Oncol., 2015, 16, p. 15.
38. JONASON, A. S., KUNALA, S., PRICE, G. J. et al. Frequent clones of p53-mutated keratinocytes in normal human skin. Proc Natl Acad Sci U S A., 1996, 93, p. 14025–14029.
39. JURISIC, V., RADENKOVIC, S., KONJEVIC, G. The Actual Role of LDH as Tumor Marker, Biochemical and Clinical Aspects. Adv Exp Med Biol., 2015, 867, p. 115–124.
40. KARAKOUSIS, G., YANG, R., XU, X. Circulating melanoma cells as a predictive biomarker. J Invest Dermatol., 2013, 133, p. 1460–1462.
41. KHOJA, L., LORIGAN, P., ZHOU, C. et al. Biomarker utility of circulating tumor cells in metastatic cutaneous melanoma. J Invest Dermatol., 2013, 133, p. 1582–1590.
42. KNUDSON, A. G. JR., The genetics of childhood cancer. Cancer., 1975, 35, p. 1022–1026.
43. KNUDSON, A. G. JR., MEADOWS, A. T., NICHOLS, W. W. et al. Chromosomal deletion and retinoblastoma. Engl J Med., 1976, 295, p. 1120–1123.
44. KODET, O., KRAJSOVÁ, I. Maligní melanom, incidence, rizikové faktory a jeho časná diagnostika, Onkologie., 2017, 11, s. 138–143.
45. KRAJSOVÁ, I., ARENBERGER, P., LAKOMÝ, R. Long-term Survival with Ipilimumab: Experience from a National Expanded Access Program for Patients with Melanoma. Anticancer Res., 2015, 35, p. 6303–6310.
46. KUMAR, R., ANGELINI, S., SNELLMAN, E. et al. BRAF mutations are common somatic events in melanocytic nevi. J Invest Dermatol., 2004, 122, p. 342–348.
47. LODISH, H. Molecular Cell Biology. 7 ed. 2013.
48. LONG, G. V. STROYAKOVSKIY, D., GOGAS, H. et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med., 2014, 371, p. 1877–1888.
49. MARUVADA, P., WAMG, W., WAGNER, P. D. et al. Biomarkers in molecular medicine: cancer detection and diagnosis. Biotechniques., 2005, Suppl., p. 9–15.
50. MATOS, L. L., TRUFELLI, D. C., DE MATOS, M. G. et al. Immunohistochemistry as an important tool in biomarkers detection and clinical practice. Biomark Insights., 2010, 9, p. 9–20.
51. MATSUMOTO, K., UMITSU, M., DE SILVA, D. M. et al. Hepatocyte growth factor/MET in cancer progression and biomarker discovery. Cancer Sci., 2017, 108, p. 296–307.
52. MATTHIAS, C., MACK, B., BERGHAUS, A. et al. Keratin 8 expression in head and neck 11 epithelia. BMC Cancer, 22, p. 267.
53. MCCUBREY, J. A., STEELMAN, L. S., CHAPELL, W. H. et al. Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance. Biochim Biophys Acta, 2007, 1773, p. 1263–1284.
54. MENON, D. R., SCHAIDER, H. Microenvironment-Driven Resistance to BRAF Inhibition Comes of Age. J Invest Dermatol., 2015, 135, p. 2923–2925.
55. MILNE, R. L., ANTONIOU, A. C. Modifiers of breast and ovarian cancer risks for BRCA1 and BRCA2 mutation carriers. Endocr Relat Cancer., 2016, 23, p. 69–84.
56. MONZANI, E., FACCHETTI, F., GALMOZZI, E. et al. Melanoma contains CD133 and ABCG2 positive cells with enhanced tumorigenic potential. Eur J Cancer., 2007, 43, p. 935–946.
57. MUKHERJEE, N., SCHWAN, J. V., FUJITA, M. et al. Alternative Treatments For Melanoma: Targeting BCL-2 Family Members to De-Bulk and Kill Cancer Stem Cells. J Invest Dermatol., 2015, 135, p. 2155–2161.
58. MÜLLAUER, L. Milestones in pathology-from histology to molecular biology. Memo., 2017, 10, p. 42–45.
59. NEZOS, A., LEMBESSIS, P., SOURLA, A. Molecular markers detecting circulating melanoma cells by reverse transcription polymerase chain reaction: Methodological pitfalls and clinical relevance. Clin Chem Lab Med., 2009, 47, p. 1–11.
60. OLEK-HRAB, K., SILNY, W. Diagnostics in mycosis fungoides and Sezary syndrome. Rep Pract Oncol Radiother., 2013, 19, p. 72–76.
61. PLEVOVÁ, P., KRUTÍLKOVÁ, V., PUCHMAJEROVÁ, A. et al. Gorlin syndrome. Klin Onkol., 2009, 22, s. 34–35.
62. RECK, M., RODRÍGUEZ-ABREU, D., ROBINSON, A. G. et al. KEYNOTE-024 Investigators. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med., 2016, 375, p. 1823–1833.
63. REID, A. L., MILLWARD, M., PEARCE, R. et al. Markers of circulating tumour cells in the peripheral blood of patients with melanoma correlate with disease recurrence and progression. Br J Dermatol., 2013, 168, p. 85–92.
64. RIECHERS, A., BOSSERHOFF, A. K. Melanoma inhibitory activity in melanoma diagnostics and therapy – a small protein is looming large. Exp Dermatol. 2014, 23, p. 12–14.
65. RÜBBEN, A., ARAUJO, A. Cancer heterogeneity: converting a limitation into a source of biologic information. J Transl Med., 2017, 15, p. 190.
66. SALNIKOW, K., ZHITKOVICH, A. Genetic and epigenetic mechanisms in metal carcinogenesis and cocarcinogenesis: nickel, arsenic, and chromium. Chem Res Toxicol., 2008, 21, p. 28–44.
67. SHAKHOVA, O., SOMMER, L. Testing the cancer stem cell hypothesis in melanoma: The clinics will tell. Cancer Lett., 2013, 338, p. 74–81.
68. SHENEBERGER, D. W. Cutaneous malignant melanoma: a primary care perspective. Am Fam Physician, 2012, 85, p. 161–168.
69. SHEPPARD, K. E., MCARTHUR, G. A. The cell-cycle regulator CDK4: an emerging therapeutic target in melanoma. Clin Cancer Res., 2013, 19, p. 5320–5328.
70. SCHIFFER, J. T., AUBERT, M., WEBER, N. D. et al. Targeted DNA mutagenesis for the cure of chronic viral infections. J Virol., 2012, 86, 17, p. 8920–8936.
71. SMITH, B., SELBY, P., SOUTHGATE, J. Detection of melanoma cells in peripheral blood by means of reverse transcriptase and polymerase chain reaction. Lancet, 1991, 338, p. 1227–1229.
72. SONG, I. Y., BALMAIN, A. Cellular reprogramming in skin cancer. Semin Cancer Biol., 2015, 32, p. 32–39.
73. SONG, J., MOOI, W. J., PETRONIC-ROSIC, V. et al. Nevus versus melanoma: to FISH, or not to FISH. Adv Anat Pathol., 2011, 18, p. 229–234.
74. SUNSHINE, J. C., NGUYEN, P. L., KAUNITZ, G. J. et al. PD-L1 Expression in Melanoma: A Quantitative Immunohistochemical Antibody Comparison. Clin Cancer Res. 2017, 23, p. 4938–4944.
75. TARHINI, A. A., GOGAS, H., KIRKWOOD, J. M. IFN-α in the treatment of melanoma. J Immunol., 2012, 189, p. 3789–3793.
76. TETZLAFF, M. T., TORRES-CABALA, C. A., PATTANAPRICHAKUL, P. et al. Emerging clinical applications of selected biomarkers in melanoma. Clin Cosmet Investig Dermatol., 2015, 30, p. 35–46.
77. TIACCI, E., TRIFONOV, V., SCHIAVONI, G. et al. BRAF mutations in hairy-cell leukemia. N Engl J Med., 2011, 364, p. 2305–2315.
78. UGUREL, S., RAPPL, G., TILGEN, W. et al. Increased serum concentration of angiogenic factors in malignant melanoma patients correlates with tumor progression and survival. J Clin Oncol., 2001, 19, p. 577–583.
79. VERYKIOU, S., ELLIS, R. A., LOVAT, P. E. Established and Emerging Biomarkers in Cutaneous Malignant Melanoma. Healthcare (Basel), 2014, 2, p. 60–73.
80. VOGELSTEIN, B., KINZLER, K.W. et al. The Genetic Basis of Human Cancer. 2nd edition, p. 583–612.
81. WILCOX, R. A. Cutaneous T-cell lymphoma: 2014 update on diagnosis, risk-tratification, and management. Am J Hematol., 2014, 89, p. 837–851.
82. WOODMAN, S. E., DAVIES, M. A. Targeting KIT in melanoma: a paradigm of molecular medicine and targeted therapeutics. Biochem Pharmacol., 2010, 80, p. 568–574.
83. WU, H., SMITH, M., MILLENSON, M. M., Contribution of flow cytometry in the diagnosis of cutaneous lymphoid lesions. J Invest Dermatol., 2003, 121, p. 1522–1530.
84. WU, J. M., VONDERHIED, E., GOCKE, C. D. et al. Flow cytometry of lesional skin enhances the evaluation of cutaneous B-cell lymphomas. J Cutan Pathol., 2012, 39, p. 918–928.
85. YANHUI, F., WENJUAN, W., GUOJI, M. et al. Patterns of Insertion and Deletion in Mammalian Genomes. Curr Genomics., 2007, 8, p. 370–378.
86. YOU, Y. N., RUSTIN, R. B., SULLIVAN, J. D. Oncotype DX® colon cancer assay for prediction of recurrence risk in patients with stage II and III colon cancer: A review of the evidence. Surg Oncol., 2015, 24, p. 61–66.
87. ZHANG, Q., WANG, Y., LIANG, J. et al. Bioinformatics analysis to identify the critical genes, microRNAs and long noncoding RNAs in melanoma. Medicine (Baltimore), 2017, 96, p. 7497.
88. ZHAO, L., SAMUELS, T., WINCKLER, S. et al. Cyclin G1 has growth inhibitory activity linked to the ARF-Mdm2-p53 and pRb tumor suppressor pathways. Mol Cancer Res., 2003, 1, p. 195–206.
89. ZHOU, R., XU, A., GINGOLD, J., STROMG, L. C. et al. Li-Fraumeni Syndrome Disease Model: A Platform to Develop Precision Cancer Therapy Targeting Oncogenic p53. Trends Pharmacol Sci., 2017, 38, p. 908–927.
Labels
Dermatology & STDs Paediatric dermatology & STDs Paediatric rheumatology Medical virology
Article was published inCzech-Slovak Dermatology

2017 Issue 6
Most read in this issue- Frontální fibrotizující alopecie – popis případu
- Základy molekulární biologie nádorů pro praxi
- Vliv kouření na sérové hladiny vybraných adipokinů u pacientů s lupénkou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

