-
Medical journals
- Career
Vliv kouření na sérové hladiny vybraných adipokinů u pacientů s lupénkou
Authors: S. Vachatová 1; K. Ettler 1; L. Borská 2; J. Krejsek 3; C. Andrýs 3; Eva Čermáková 4; V. Řeháček 5; Z. Fiala 6
Authors‘ workplace: Klinika nemocí kožních a pohlavních, Fakultní nemocnice Hradec Králové, Univerzita Karlova, Lékařská fakulta v Hradci Králové přednosta doc. MUDr. Miloslav Salavec, CSc. 1; Ústav patologické fyziologie, Univerzita Karlova, Lékařská fakulta v Hradci Králové přednosta prof. MUDr. Miroslav Kuba, CSc. 2; Ústav klinické imunologie a alergologie, Fakultní nemocnice Hradec Králové, Univerzita Karlova, Lékařská fakulta v Hradci Králové přednosta prof. RNDr. Jan Krejsek, CSc. 3; Ústav lékařské biofyziky, Univerzita Karlova, Lékařská fakulta v Hradci Králové přednosta doc. Ing. Josef Hanuš, CSc. 4; Transfuzní oddělení Fakultní nemocnice Hradec Králové primář MUDr. Vít Řeháček 5; Ústav hygieny a preventivního lékařství, Univerzita Karlova, Lékařská fakulta v Hradci Králové přednosta prof. Ing. Zdeněk Fiala, CSc. 6
Published in: Čes-slov Derm, 92, 2017, No. 6, p. 264-274
Category: Pharmacologyand Therapy, Clinical Trials
Overview
Psoriáza je chronické recidivující zánětlivé onemocnění postihující 2–3 % evropské populace. Metabolický syndrom (MetS) je souborem centrální obezity, dyslipidémie, arteriální hypertenze a inzulinové rezistence a je rizikovým faktorem kardiovaskulárních chorob a diabetes mellitus II. typu (DM2T), jehož prevalence se pohybuje mezi 25–30 % v ekonomicky vyspělých zemích. Kouření je úzce spojeno s MetS: kuřáci mají zvýšené riziko MetS. Pacienti s lupénkou mají na straně jedné vyšší sklon ke kouření a na straně druhé také vyšší riziko rozvoje MetS. Jedním z mechanismů pojících psoriázu s MetS, může být subklinický zánět a zvýšená tvorba adipokinů, které jsou přítomny u obou nemocí. Kouření je spojeno s rozvojem oxidačního stresu a aktivací zánětlivých pochodů podporujících chronický průběh u psoriázy. Cílem studie bylo porovnat zánětlivé parametry: C-reaktivní protein (CRP), leptin, adiponektin, resistin a fosfolipázu A2 asociovanou s lipoproteiny (LpPLA-2) společně se složkami MetS u psoriatických pacientů (PP) a kontrolní skupiny (KS), s ohledem na přítomnost MetS a na kuřáckou anamnézu. Statisticky nevýznamně vyšší sklon ke kouření měla skupina PP, kde kouřilo 40,5 % v porovnání s KS, kde kouřilo jen 30,8 % jedinců. Dále jsme, u pacientů kuřáků bez MetS, v porovnání s pacienty nekuřáky bez MetS, shledali statisticky významně vyšší hodnoty PASI (Psoriasis Area and Severity Index, p < 0,5). Toto zjištění podporuje souvislost mezi závažností lupénky a kouřením bez ohledu na přítomnost MetS. Prozánětlivý ukazatel CRP (p < 0,01) a leptin (p < 0,05) a proaterogenní Lp-PLA2 (p < 0,01) byly statisticky významně vyšší ve skupině nekuřáků PP s MetS, v porovnání s nekuřáky KS s MetS. Hladiny CRP (p = 0,001), LpPLA2 (p < 0,001), leptinu (p = 0,006) a resistinu (p = 0,005) byly statisticky významně ovlivněny lupénkou. Lupénka a obezita podle naší studie spolu souvisí pro statisticky významně vyšší BMI (p < 0,05) u nekuřáků PP s MetS v porovnání s nekuřáky KS s MetS. Závěrem můžeme potvrdit, že lupénka je zánětlivý stav, který jistě souvisí s obezitou bez ohledu na kuřáckou anamnézu. Kouření však zhoršuje závažnost lupénky.
Klíčová slova:
lupénka – obezita – metabolický syndrom – kouření – C-reaktivní protein – fosfolipáza A2 asociovaná s lipoproteiny – adiponektin – leptin – resistinÚVOD
Psoriáza je chronické recidivující zánětlivé onemocnění. Postihuje 2–3 % evropské populace [60]. Přesná etiologie lupénky není známa, ale na jejím vzniku se podílejí genetické a imunologické faktory. Ústřední roli v patogenezi psoriázy hraje porucha regulace T-lymfocytů, zejména T-pomocných lymfocytů 1 (Th-1, T-helper lymphocytes 1), T-pomocných lymfocytů 17 (Th-17) a T-pomocných lymfocytů 22 (Th-22), které následně produkují prozánětlivé mediátory – interferon gamma (IFNγ), tumor nekrotizující faktor alfa (TNF-α), interleukin 6 (IL-6) a interleukin 22 (IL-22) [34]. Metabolický syndrom (MetS) je nenáhodný cluster obezity s ambdominální akumulací tukové tkáně, dyslipidémie, arteriální hypertenze a inzulinové rezistence a je rizikovým faktorem kardiovaskulárních chorob a diabetes mellitus II. typu (DM2T). MetS se vyvíjí časem u jedinců s genetickou predispozicí při nevhodném životním stylu, tj. při nadměrném energetickém příjmu a nedostatečné pohybové aktivitě. Prevalence MetS a jeho jednotlivých komponent u dospělé i pediatrické populace je vyšší u pacientů s lupénkou v porovnání s kontrolami a dosahuje 25–30 % [45, 48, 72]. Jednou ze složek MetS je obezita, která může být definována jako expanze bílou tukovou tkání. Obézní stav je charakterizován zvýšeným uvolňováním volných mastných kyselin z tukové tkáně, což vede k jejich zvýšení v séru [34]. Proaterogenní makrofágy klasického fenotypu M1 a T-lymfocyty infiltrují poškozenou a hypertrofickou tukovou tkáň, kde produkují zánětlivé cytokiny, včetně adipokinů. Výsledkem je systémový subklinický zánětlivý stav, který koreluje se systémovými markery zánětu, mezi které patří C-reaktivní protein (CRP). Vede ke vzniku dalších složek MetS [76]. Pacienti s lupénkou trpí častěji nadváhou nebo obezitou v porovnání s běžnou populací [5]. Jedním z mechanismů pojících psoriázu s obezitou/MetS může být zvýšená tvorba adipokinů, přítomná u obou nemocí [66]. Mezi nejdůležitější adipokiny patří adiponektin, leptin a resistin. Adiponektin je exprimován adipocyty a má vysoký protizánětlivý potenciál. Nízké hladiny adiponektinu se pojí s cukrovkou, MetS, kardiovaskulárními nemocemi a s lupénkou [76]. Leptin je protein tvořený tukovou tkání a je důležitou součástí látkově energetického metabolismu. Má prozánětlivý efekt. Aktivuje monocyty a makrofágy, které jsou zdrojem IL-6 a TNF-α [30]. Polypeptid resistin je také produktem tukové tkáně, konkrétně makrofágů a monocytů v ní obsažených. Byl pojmenován pro svou schopnost indukovat inzulinovou rezistenci [76]. Produktem makrofágů je i fosfolipáza A2 asociovaná s lipoproteiny (LpPLA2), která může sloužit jako marker kardiovaskulárního rizika [50]. Obezita rovněž indukuje sekreci cytokinů IL-6, TNF-α a lymfocytů Th-17, které dále produkují interleukin 17 (IL-17). Ten je součástí patogeneze autoimunitních chorob, včetně lupénky [34]. Obezita obecně předchází vzniku psoriázy a zvýšený index tělesné hmotnosti (body mass index - BMI) koreluje se zvýšeným rizikem výskytu lupénky [21]. U pacientů se závažným průběhem lupénky, jsou kardiovaskulární komplikace příčinou zkrácení života v průměru o pět let [1]. Kromě nadměrného energetického příjmu a nedostatečné pohybové aktivity patří k nevhodnému životnímu stylu i vyšší konzumace alkoholu a kouření tabákových cigaret. Kouření je úzce spojeno s MetS: kuřáci mají zvýšené riziko MetS [32, 43, 61]. Pacienti s lupénkou mají vyšší sklon ke kouření [23]. Byla prokázána i přímá souvislost mezi lupénkou a kouřením [20, 24, 51, 78]. Souvislost mezi aktivním kouřením a vznikem MetS nebo jedné z jeho komponent není plně pochopena. Nikotin je nejznámější škodlivou složkou uvolňovanou z cigaretového kouře. Nikotinové acetylcholinové receptory jsou exprimovány v centrálním a periferním nervovém systému. Nikotin, vazbou na acetylcholinový receptor, zprostředkovává rychlý synaptický přenos neurotransmiterů na neuromuskulárním spojení. Tím se zvýší uvolňování několika důležitých neurotransmiterů a hormonů, zejména argininu, vazopresinu, kortikoliberinu, adrenokortikotropního hormonu, růstového hormonu, dopaminu, serotoninu, glutamátu, kyseliny gama-aminomáselné, acetylcholinu, epinefrinu, norepinefrinu a kortizolu. Do těchto procesů je zapojena osa hypothalamus-hypofýza-nadledviny a renin-angiotenzin-aldosteronový systém. Z výše uvedeného vyplývá, že mezi kouřením a některými poruchami metabolismu existuje přímá spojitost [35]. V plicích zvyšuje kouření počet makrofágů, neutrofilů, eozinofilů a mastocytů a snižuje počet dendritických buněk dýchacích cest. Systémově vede ke zvýšení počtu bílých krvinek, zejména neutrofilů a aktivuje reaktanty zánětu, včetně CRP [44, 67]. CRP je jedním z nejdůležitějších ukazatelů zánětu a kromě své aktivace kouřením pozitivně koreluje se stupněm obezity [42, 50]. Kouření je příčinou oxidačního stresu. Reaktivní kyslíkové a dusíkové sloučeniny stimulují buněčné signální dráhy, které jsou aktivní u psoriázy. Kromě toho, nikotin aktivuje dendritické buňky, makrofágy a keratinocyty, které dále uvolňují cytokiny TNF-α a IL-6. To vede k aktivaci T-buněk a ke chronickému průběhu psoriázy [4]. Cílem studie bylo porovnat zánětlivé parametry – CRP, leptin, adiponektin, resistin a LpPLA-2 společně se složkami MetS u pacientů a kontrol s ohledem na přítomnost MetS a na kuřáckou anamnézu.
SOUBOR A METODIKA
Charakteristika souboru
Do výzkumu bylo zařazeno 74 pacientů s psoriázou (PP) a 65 zdravých dárců krve (kontrolní skupina, KS). Skupinu PP tvořilo 33 žen a 41 mužů (s průměrným věkem 50,6 roku; věkovým rozmezím 18–80 roků; 30 kuřáků a 44 nekuřáků). PP byli hospitalizováni na Klinice nemocí kožních a pohlavních ve Fakultní nemocnice Hradec Králové v letech 2012–2014. Odběry všech vzorků byly provedeny před zahájením léčby (v rámci vstupního vyšetření), ráno (na lačno). PP s léčbou antidiabetiky, antihypertenzivy a hypolipidemiky nebyli do studie zařazeni. Pacienti s psoriatickou artritidou byli ze studie vyřazeni.
KS se skládala z 32 žen a 33 mužů (s průměrným věkem 51,6 roku; věkovým rozmezím 20–65 roků; 20 kuřáků a 45 nekuřáků). KS tvořili zdraví dárci krve (Transfuzní oddělení, Fakultní nemocnici Hradec Králové). Do KS byli zařazeni dárci krve v letech 2012–2014, bez medikamentózní léčby inzulinové rezistence, cukrovky a kardiovaskulárních nemocí. Do KS nebyli zařazeni dárci krve s infekčním nebo jiným zánětlivým onemocněním.
Laboratorní vyšetření
Pacientům a kontrolní skupině byla odebrána periferní žilní krev z kubitální žíly. Krevní sérum bylo izolováno centrifugací a až do analýzy skladováno při teplotě -70 °C. Z krevních vzorků jsme stanovili lačnou glykémii, triacylglyceroly (TAG) a lipoproteiny s vysokou hustotou (HDL). Metabolický syndrom byl stanoven na základě diagnostických kritérií definovaných v rámci National Cholesterol Education Program Adult Treatment Panel (NCEP/ATPIII) [52]. To znamená, že musela být splněna tři nebo více z následujících pěti diagnostických kritérií:
- obvod pasu > 102 cm u mužů, > 88 cm u žen,
- TAG > 1,7 mmol/l,
- HDL-C < 1 mmol/l u mužů, < 1,3 mmol/l u žen,
- krevní tlak (TK) > 130/85 mm Hg (nebo specifická léčba hypertenze),
- lačná glykemie > 5,6 mmol/l (nebo léčba DM).
Překročení v kterékoli z hodnot: jako jedno kritérium bylo počítáno překročení obou hodnot.
Body mass index (BMI) byl určen jako podíl tělesné hmotnosti a druhé mocniny výšky. Psoriasis area and severity index (PASI) je nejpoužívanějším nástrojem pro měření rozsahu a intenzity psoriázy. PASI v sobě spojuje posouzení závažnosti lézí a ploch, které se pak vyjadřuje ve stupnici od 0 (žádná choroba) do 72 (maximální choroba) [68].
Z krevních vzorků jsme také detekovali hodnoty CRP, adiponektinu, leptinu, resistinu a fosfolipázy A2 asociované s lipoproteiny (LpPLA2). Hladiny CRP byly určeny za pomoci imunonefelometrické analýzy na přístroji Immage 800 firmy Beckman (USA) s reagencemi téže firmy. Ke stanovení sérové koncentrace leptinu, adiponektinu a resistinu, byly použity komerční ELISA (Enzyme-Linked ImmunoSorbent Assay) soupravy (R&D Systems, USA), a to Quantikine ELISA Human Leptin Immunoassay, Quantikine Human Total Adiponectin/Acrp30 Immunoassay, Quantikine Human Resistin Immunoassay. Koncentrace s lipoproteiny asociované fosfolipázy A2 (Lp-PLA2) byla změřena pomocí soupravy ELISA Lp-PLA2 (Cloud-Clone Corp, USA). Ve všech případech se jednalo o ELISA metodiku. Při analýze jsme postupovali podle doporučení výrobce. Pro měření barevné změny (absorbance) byl použit u všech měřených parametrů ELISA reader Multiskan a software Genesis (Thermo Fisher Scientific, USA). Koncentrace všech měřených parametrů byly vypočteny z kalibračních křivek.
Etické aspekty
Studie byla schválená Etickou komisí Fakultní nemocnice Hradec Králové, všichni pacienti i z kontrolní skupiny byli seznámeni se studií a podepsali informovaný souhlas.
Statistika
Získaná data byla analyzována pomocí statistického softwaru NCSS 10 (NCSS 10 Statistical Software (2015). NCSS, LLC. Kaysville, Utah, USA, ncss.com/software/ncss.). Bylo vytvořeno osm skupin, které byly rozdělené podle nemoci, kuřáctví a MetS. Na porovnání vztahu mezi těmito skupinami byla použita neparametrická Kruskalova-Wallisova jednofaktorová analýza rozptylu s následným mnohonásobným porovnáním Dunnovým testem s Bonferroniho modifikací. Výsledky byly považovány za významné, pokud hladina významnosti (p) byla nižší než 0,05. K posouzení vlivu MetS, lupénky a kouření na sledované parametry byla dále použita trojfaktorová analýza rozptylu s interakcemi s následným mnohonásobným porovnání Fisherovým testem.
VÝSLEDKY
Ve skupině PP trpělo 12 pacientů (16,2 %) mírnou formou lupénky (PASI < 10), 44 pacientů (59,5 %) mělo středně závažnou formu lupénky (PASI 10–20) a u 18 pacientů (24,3 %) byla zjištěna závažná forma lupénky (PASI > 20). Medián (dolní a horní kvartil) PASI indexu byl 15,3 (12–19,9). Ve skupině PP bylo 30 kuřáků (40,5 %) – z toho 13 žen a 17 mužů a 44 nekuřáků (59,5 %) – z toho 20 žen a 24 mužů. V KS bylo 20 kuřáků (30,8 %) – z toho 7 žen a 13 mužů a 45 nekuřáků (69,2 %) – z toho 25 žen a 20 mužů. Tabulka 1 porovnává parametry MetS u pacientů a kontrol s ohledem na přítomnost MetS a na kuřáckou anamnézu. Tabulka 2 porovnává parametry zánětu u pacientů a kontrol s ohledem na přítomnost MetS a na kuřáckou anamnézu. Tabulka 3 popisuje vztah zánětlivých markerů s nemocí, kouřením a MetS.
Table 1. Hodnoty parametrů MetS a hladiny významnosti u pacientů s lupénkou s MetS a bez MetS v porovnání s kontrolami s MetS a bez MetS 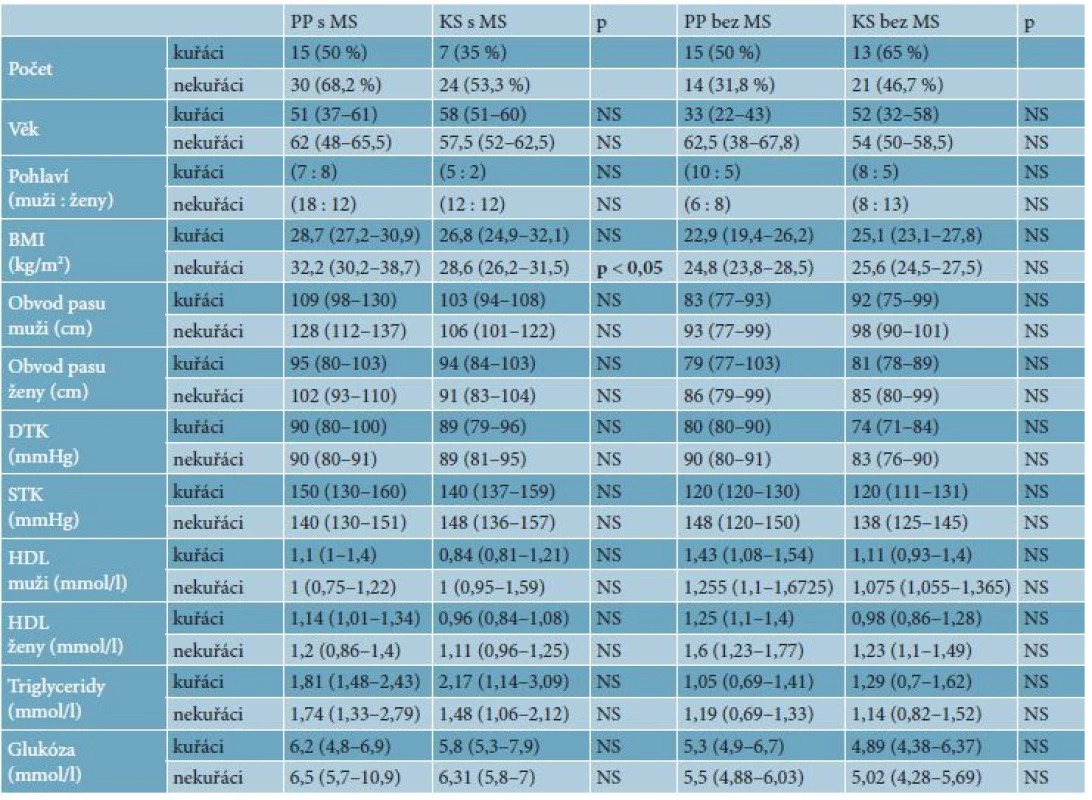
Hodnoty jsou porovnávané u kuřáků a nekuřáků. BMI – body mass index, STK – systolický tlak, DTK – diastolický tlak, HDL – lipoproteiny o vysoké hustotě, CRP – C-reaktivní protein, Lp-PLA2 – fosfolipáza A2 asociovaná s lipoproteiny, p – hladina významnosti. Hodnoty jsou v mediánu, v závorce je dolní a horní kvartil. Table 2. Hodnoty parametrů zánětu a hladiny významnosti u pacientů s lupénkou s MetS a bez MetS v porovnání s kontrolami s MetS a bez MetS 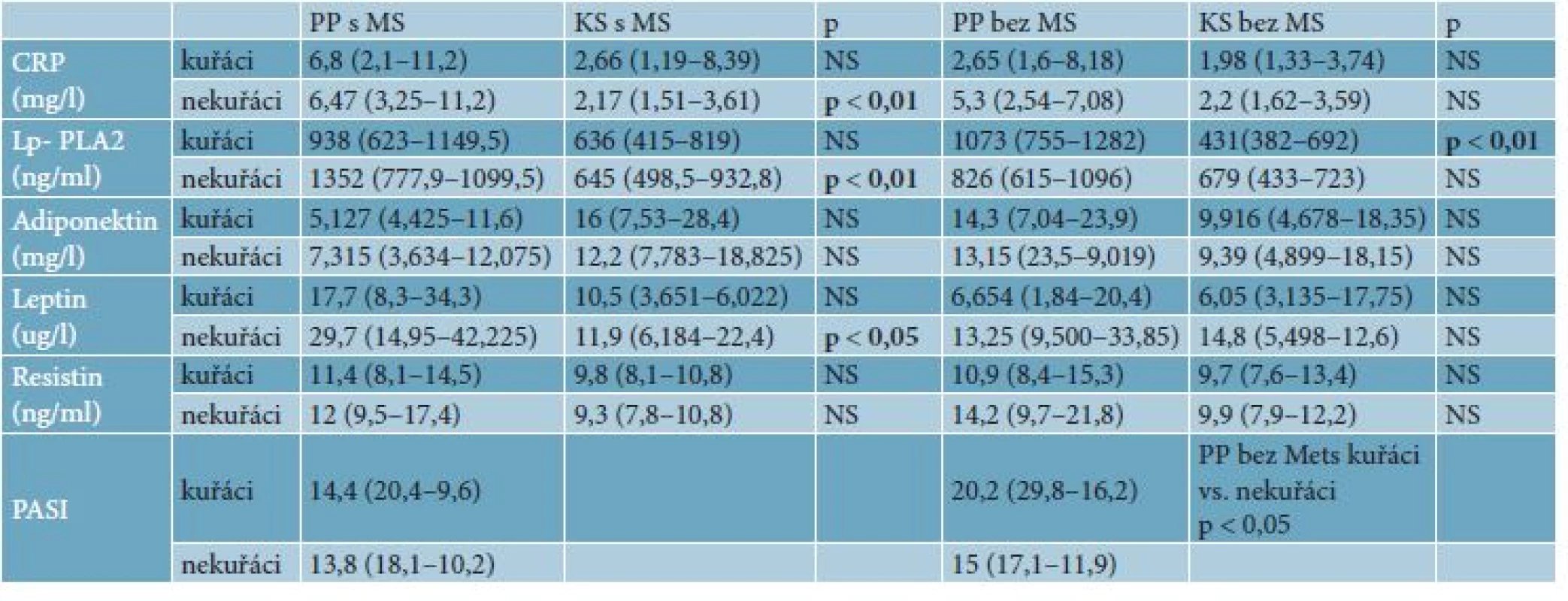
Hodnoty jsou porovnávané u kuřáků a nekuřáků. BMI – body mass index, STK – systolický tlak, DTK – diastolický tlak, HDL – lipoproteiny o vysoké hustotě, CRP – C-reaktivní protein, Lp-PLA2 – fosfolipáza A2 asociovaná s lipoproteiny, p – hladina významnosti, PASI – psoriasis area and severity index. Hodnoty jsou v mediánu, v závorce je dolní a horní kvartil. Table 3. Statisticky signifikantní hladiny významnosti (p) MetS a zánětlivych parametrů v závislosti na nemoci, kouření a MetS 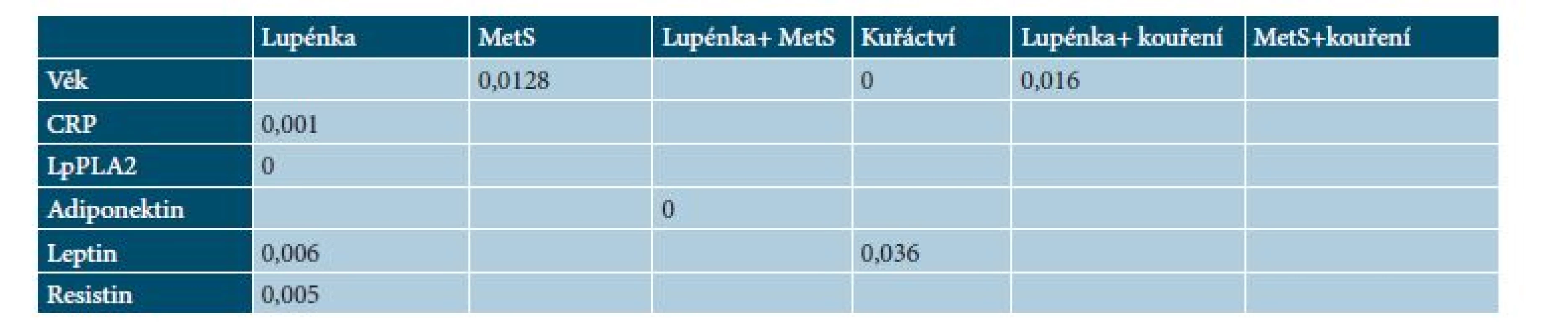
CRP – C-reaktivní protein, Lp-PLA2 – fosfolipáza A2 asociovaná s lipoproteiny. DISKUSE
Metabolický syndrom, kouření a lupénka
Prevalence MetS se u evropské populace pohybuje kolem 25–30 % [75], u české populace v rámci posledního šetření studie post-MONICA (2006–2009, n = 3 609, věk 25–64 roků) byla stanovena na 37,6 % u mužů a 25,9 % u žen [28]. Prozkoumalo se, že prevalence MetS vzrůstá s věkem. U účastníků od 20–29 let byl MetS zastoupen ve 6,7 %, od 60–70 let již ve 43,5 % [18]. Zastoupení MetS je vyšší u žen, které dosáhnou 50 roků, což je způsobeno poklesem hladin estrogenu. Pod jeho vlivem jsou hladiny HDL-cholesterolu vyšší než u mužů. Tuk se hromadí převážně na úrovni gluteální a kyčelní kosti než abdominálně [63]. MetS je prekurzorem cukrovky II. typu a kardiovaskulárních onemocnění. Riziko cukrovky II. typu je zvýšené u MetS 3–4krát a riziko kardiovaskulárních nemocí 1,4krát. Výskyt MetS je častější u obézních jedinců [35]. Dosavadní klinické studie zjistily, že pacienti s lupénkou mají, v porovnání s běžnou populací, větší predispozici trpět MetS a jeho komponentami. Jsou to arteriální hypertenze, abdominální obezita a inzulinová rezistence [3, 45, 48, 69, 79]. Z těchto uvedených studií Love et al. (2011) a Sommer et al. (2006) nebrali v potaz věk pacientů [45, 69]. Zindanci et al. (2012) studovali skupinu pacientů a kontrol starších než 40 roků [79] a Miller et al. (2015) starších než 40 roků [48]. Milčić et al. (2017) zjistili prevalenci MetS u 45,1 % psoriatiků v porovnání s 19,6 % u kontrolní skupiny. Průměrný věk pacientů však byl v této skupině signifikantně vyšší než průměrný věk kontrol (53,54 vs. 43,69 roků) a počet mužů byl vyšší než žen [47]. Owczarczyk-Saczonek et al. (2015) objevili, že prevalence MetS u pacientů s psoriázou ve věku od 30 do 49 let je podobná jako u celé dospělé populace v Polsku [56]. V naší studii trpělo MetS 60,8 % pacientů s lupénkou a 47,7 % jedinců z kontrolní skupiny. Průměrný věk u obou skupin byl vyšší než 50 let. To znamená, že zastoupení MetS u kontrolní skupiny přibližně odpovídá běžné starší populaci. Zastoupení MetS u pacientů s lupénkou je však vyšší, což potvrzuje dosavadní poznatky. Navíc, bylo zjištěno, že pacienti se závažným průběhem lupénky mají vyšší riziko výskytu MetS než ti s mírnější formou lupénky [76]. Pacienti naší skupiny měli v 59,5 % (PASI 10–20) středně závažný průběh lupénky a závažným průběhem lupénky (PASI 10–20) trpělo 24,3 % pacientů.
Kouření je modifikovatelným rizikovým faktorem MetS. Mezi kouřením a rizikem MetS existuje pozitivní souvislost. Celosvětově je 1,1 miliardy kuřáků, což je přibližně třetina dospělé populace [35]. V České republice bylo v roce 2015 celkem 24,1% kuřáků tabáku [70]. Procentuální zastoupení kuřáků v naší studijní skupině bylo 40,5 %, což je vyšší než v běžné populaci a než u kontrolní skupiny (30,8 % kuřáků). Kouření ovlivňuje více složek MetS. Vede k okamžitému zvýšení krevního tlaku, srdeční frekvence a kontraktility myokardu. Tyto změny jsou z velké části důsledkem silných sympatomimetických účinků nikotinu. Je známo, že kouření mění hladiny hormonů u obou pohlaví. Bylo popsáno zvýšení hladin adrenokortikotropního hormonu, kortizolu, aldosteronu, angiotenzin-konvertujícího enzymu a katecholaminů. Kouření také mění vazomotorické funkce v důsledku poškození proteázy aktivovaného receptoru typu 1, zvyšuje arteriální tuhost a tloušťku stěny karotidové arterie [59]. Spuštěné chemické procesy v mozku potlačují chuť k jídlu a zvyšují/snižují rychlost metabolické výměny. Uvolněný norepinefrin a epinefrin zvyšuje termogenezi v tukové tkáni částečně zvýšením lipolýzy a následnou recyklací mastných kyselin do triglyceridů. Akutní změny spojené s kouřením vedou ke snížení apetitu a zvyšují látkový metabolismus, zatímco chronické kouření zvyšuje chuť k jídlu a snižuje metabolickou rychlost. Navíc nikotin zvyšuje pravděpodobnost inzulinové rezistence a vede k přebytku kortizolu, který se může podílet na vzniku abdominální obezity [35]. U mužů, aktivních kuřáků, bylo zjištěno vyšší riziko MetS v porovnání s muži, kteří nikdy nekouřili. Toto riziko je závislé na množství vykouřených cigaret. U žen nebylo prokázáno spojení MetS s kouřením [35]. Nikotinová závislost může vyvolat lupénku u geneticky predisponovaných jedinců a má vliv na závažnost onemocnění. Popisuje se dokonce, že jeden z pěti případů lupénky je vyprovokován kouřením [51]. Po zanechání kouření bylo pozorováno postupné snížení rizika onemocnění [41]. Několik mechanismů by mohlo potenciálně zvýšit závažnost průběhu lupénky nebo vyvolat její nástup u kuřáků. Kouření vytváří volné radikály, které mohou aktivovat mitogenem aktivované proteinkinázy, nukleární faktor kappa B a dráhy Janus kinázy. Nikotin může zvýšit produkci interleukinu 12 (IL-12) dendritickými buňkami a zvyšuje expresi stimulačních faktorů T-lymfocytů CD40 a CD86. Kromě toho se dioxiny vzniklé při spalování tabáku vážou na arylové uhlovodíkové receptory, které jsou exprimovány buňkami Th-22 a Th-17. Tyto receptory můžou sloužit jako transkripční faktory pro IL-17 a IL-22 [65]. V naší studii jsme zjistili statisticky významně vyšší hodnoty PASI (p < 0,05) u pacientů kuřáků bez MetS v porovnání s pacienty nekuřáky bez MetS, což podporuje předchozí tvrzení a fakt, že kouření má samo, jako nezávislý faktor, vliv na závažnost onemocnění. Větší množství studií hodnotilo souvislosti mezi psoriázou, MetS a kouřením. Gisondi et al. (2007) zjistili, že ačkoli lidé s psoriázou kouří častěji, asociace mezi MetS a psoriázou nebyla ve spojení s kouřením [22]. V dalším výzkumu, který provedli Owczarcyk-Saconek et al. (2015), také nebyly zjištěny žádné rozdíly v prevalenci MetS, obezity, inzulinové rezistence a hypertenze mezi pacienty s lupénkou, kteří kouřili a mezi kontrolní skupinou. Prevalence MetS u pacientů kuřáků s lupénkou byla 27,58 % a v kontrolní skupině 25,2 % [55]. V naší studii jsme detekovali MetS u 50 % kuřáků s lupénkou a 35 % kuřáků kontrolní skupiny. Dále jsme MetS zjistili u 68,2 % nekuřáků PP a u 53,3 % nekuřáků KS. To znamená, že výsledky naší studie se shodují s již dříve popsanými nálezy. Kouření v naší studii nemělo statisticky významný vliv na prevalenci MetS u pacientů ani u kontrol. Jedním z vysvětlení může být i vyšší věk u obou skupin.
Obezita, kouření a lupénka
U kuřáků jsou měřeny v porovnání s kontrolami s ohledem na věk a pohlaví nižší hodnoty BMI [2], které jsou pravděpodobně důsledkem zvýšeného energetického výdeje a nižšího příjmu kalorií. Kouření zvyšuje výdej energie přibližně o 10 % [25]. I když kuřáci mají tendenci k nižšímu BMI oproti nekuřákům, trpí častěji závažnější formou obezity – abdominální. Poměr mezi obvodem pasu a obvodem boků byl u kuřáků mužů i žen vyšší ve srovnání s nekuřáky [12]. Obezita, stravovací návyky západních společností a vysoké hodnoty BMI všeobecně představují rizikové faktory pro vznik autoimunitních onemocnění [40]. U psoriatiků byly popsány zvýšené hodnoty viscerálního tuku [7]. Uvádí se, že nadváha je nezávislým rizikovým faktorem pro rozvoj lupénky a že obezita může zvýšit riziko vzniku lupénky více než dvakrát [8]. Statisticky významně vyšší BMI u psoriatiků v porovnání s kontrolami potvrdil i náš výzkum z roku 2016 [74]. V nynější studii jsme měřili statisticky významně vyšší BMI (p < 0,05) ve skupině nekuřáků s lupénkou a s MS v porovnání s nekuřáky kontrolní skupiny s MS. Tento výsledek může znamenat, že obezita a kouření jsou nezávislými faktory pro lupénku.
Hladiny glykémie, kouření a lupénka
Kouření snižuje inzulinovou senzitivitu a je rizikem pro cukrovku 2. typu [49]. Je dobře známo, že silní kuřáci (kouření 20 a více cigaret/den) mají dvojnásobné riziko vzniku cukrovky 2. typu a že kouření vede ke snížení glukózové tolerance [13]. Metaanalýza hodnotící data z 88 prospektivních studií, zahrnujících téměř 6 milionů účastníků, prokázala, že jak aktivní, tak pasivní kouření zvyšuje riziko incidence cukrovky 2. typu [58]. Mezi lupénkou, diabetem a inzulinovou rezistencí byla zjištěna významná souvislost. Obě nemoci, lupénka i cukrovka, jsou asociované s chronickým zánětem díky TNF a ostatním prozánětlivým cytokinům jako jsou interleukin 1 (IL-1) a IL-6 [62]. V naší studii jsme mezi sledovanými skupinami nezjistili žádné statisticky významné rozdíly v hladinách glykémie.
Lipidový metabolismus, kouření a lupénka
U kuřáků byly zjištěny signifikantně vyšší sérové hladiny cholesterolu, TAG a lipoproteinů o nízké hustotě (low density lipoproteins, LDL). Nižší hladiny HDL jsou následkem elevace TAG [16]. Příčina rozdílných hodnot lipidů u kuřáků není známá, ale spojitost můžeme hledat v rozdílných stravovacích návycích u kuřáků a nekuřáků [64]. Spojení mezi lupénkou a dyslipidémii je kontroverzní. Některé studie zjistily nižší hladiny HDL u pacientů s lupénkou, vyšší cholesterol, TAG a LDL. Jiné nezjistily žádné statisticky významné změny v hladinách lipidů u pacientů s lupénkou v porovnání s kontrolami [62]. V naší studii jsme mezi sledovanými skupinami nedetekovali žádné statisticky významné rozdíly v hladinách HDL a TAG.
Arteriální hypertenze, kouření a lupénka
Zvýšení arteriální tuhosti u kuřáků může být způsobeno zvýšeným uvolňováním tromboxanu A2 [31], který má významný vazokonstrikční efekt. Inhibuje vznik oxidu dusnatého, což též způsobuje poškození endotelu s neschopností vazodilatace. Riziko arteriálních a žilních cévních chorob (infarkt myokardu, tromboflebitida, plicní embolie a cévní mozková příhoda) bylo 2,2krát vyšší u pacientů s lupénkou v porovnání s kontrolami s jiným kožním onemocněním [46]. V naší studii jsme mezi sledovanými skupinami neměřili žádné statisticky významné rozdíly v hodnotách tlaku krve.
Zánětlivé markery, adipokiny, kouření a lupénka
C-reaktivní protein
S kouřením je spojeno vyšší CRP [53]. Pacienti se středně závažnou až závažnou lupénkou mají signifikantně vyšší hodnoty CRP než zdravé kontroly [10, 14, 15]. V naší studii jsme měřili statisticky významně vyšší CRP (p < 0,01) ve skupině nekuřáků s lupénkou a s MetS v porovnání s nekuřáky kontrolní skupiny s MetS. U ostatních skupin nebyly rozdíly statisticky významné. Lupénka měla statisticky významný vliv na hodnoty CRP (p = 0,001). To může signalizovat spojení lupénky s elevací CRP s ohledem na MetS, ale bez ohledu na kuřáckou anamnézu.
Adiponektin
Studie popisují hypoadiponektinémii u kuřáků [9, 33, 77]. Snížené hladiny adiponektinu mohou být klíčovým faktorem v propojení mezi kouřením a aterosklerózou [17]. U lupénky nejsou výsledky studií konstantní. Některé popisují signifikantně nižší hladiny adiponektinu u psoriatiků [11, 15, 39, 54], další nezjistily žádné rozdíly v hladinách adiponektinu u kontrol a pacientů s lupénkou [36, 37] a jsou i studie, které zjistily vyšší hladiny adiponektinu u psoriatiků [8, 19, 38, 57]. Pro adiponektin v naší studii vycházela významně interakce nemoci a MetS (p < 0,001).
Leptin a resistin
Sérové koncentrace leptinu a resistinu jsou signifikantně vyšší u mužů kuřáků než u nekuřáků. Hladiny leptinu jsou zvýšené jak u pacientů s lupénkou, tak u obézních jedinců a pozitivně korelují se závažností lupénky i s BMI. Jestli je elevace leptinu přímým důsledkem lupénky není pořád jisté [71]. V naší studii jsme zjistili, že hladiny leptinu byly statisticky významně ovlivněny kouřením (p = 0,036). Také jsme měřili statisticky významně vyšší hladiny leptinu (p < 0,05) ve skupině nekuřáků s lupénkou a s MetS v porovnání s nekuřáky kontrolní skupiny s MetS. Nikotin může zvyšovat sekreci resistinu prostřednictvím sodno-draselné pumpy v adipocytech [6]. Dosavadní poznatky popisují vyšší hladiny sérového resistinu u psoriatiků v porovnání s kontrolami. [11, 15, 29]. Analyzovali jsme, že jak hodnoty leptinu (p = 0,006), tak resistinu (p = 0,005) byly statisticky významně ovlivněny lupénkou.
Fosfolipáza A2 asociovaná s lipoproteiny (Lp-PLA2)
Aktivní i pasivní kouření je spojeno se zvýšením celkové plazmatické Lp-PLA2 [73]. Některé studie popisují zvýšené hladiny Lp-PLA2 aktivity u pacientů s lupénkou [26, 27]. V naší studii jsme měřili statisticky významně vyšší hladiny Lp-PLA2 (p < 0,01) ve skupině nekuřáků s lupénkou a s MetS v porovnání s nekuřáky kontrolní skupiny s MetS. Také statisticky významné byly rozdíly Lp-PLA2 (p < 0,01) mezi skupinami psoriatků-kuřáků bez MetS a kontrolami kuřáků bez MetS. Lp-PLA2 může sloužit jako ukazatel kardiovaskulárního rizika u psoriatiků, protože i u kuřáků i u nekuřáků byly elevovány její hladiny bez ohledu na MetS a jeho hladiny statisticky významně souvisely s lupénkou (p < 0,01).
ZÁVĚR
Ve studii jsme potvrdili dřívější zjištění, že pacienti s lupénkou mají vyšší sklon ke kouření. Ve skupině PP kouřilo 40,5 % pacientů a v kontrolní skupině 30,8 % jedinců. Dále jsme zjistili statisticky signifikantní elevaci hodnoty PASI (p < 0,05) u pacientů kuřáků bez MetS v porovnání s pacienty nekuřáky bez MetS, což podporuje přímou souvislost mezi závažností lupénky a kouřením bez ohledu na přítomnost MetS. Na základě naší studie nelze spolehlivě určit, jestli jsou komorbidity důsledkem samotného zánětu asociovaného s lupénkou nebo obezity přítomné při psoriáze. Prozánětlivé CRP (p < 0,01) a proaterogenní Lp-PLA2 (p < 0,01) byly statisticky významně vyšší ve skupině nekuřáků PP s MetS v porovnání s nekuřáky KS s MetS a jejich hodnoty významně statisticky souvisely s lupénkou. Statisticky významné byly i rozdíly Lp-PLA (p < 0,01) mezi skupinami psoriatků-kuřáků bez MetS a kontrolami kuřáků bez MetS. Celkově, hladiny CRP (p = 0,001) a LpPLA2 (p < 0,001) byly ovlivněny lupénkou. Lupénka a obezita jsou podle naší studie spojeny, protože BMI byl statisticky významně vyšší (p < 0,05) u nekuřáků PP s MetS v porovnání s nekuřáky KS s MetS. Přímá souvislost mezi lupénkou a obezitou může být vysvětlena zvýšenou expresí prozánětlivého adipokinu a leptinu, jejichž hladiny jsme detekovali statisticky významně vyšší (p < 0,05) u nekuřáků PP s MetS v porovnání s nekuřáky KS s MetS. Hodnoty leptinu (p = 0,006) a resistinu (p = 0,005) byly statisticky významně ovlivněny lupénkou. Závěrem lze říct, že lupénka je zánětlivý stav, který jistě souvisí s obezitou bez ohledu na kuřáckou anamnézu. Nicméně kouření zhoršuje závažnost lupénky. Je důležité lupénku včas léčit, ale jednotlivé složky MetS se během systémové terapie můžou dokonce zhoršit. Například je známo, že blokátory TNF-α zvyšují BMI (jistě kvůli kachektické vlastnosti TNF-α), zatímco acitretin může zvýšit hladinu triglyceridů a cholesterolu v krvi a cyklosporin A může indukovat hypertenzi. Měli bychom se proto zaměřit, kromě léčby pacientů, i na ovlivnitelné faktory zhoršující lupénku a důrazně pacienty poučit o nutnosti zanechání kouření a o vhodných stravovacích návycích.
Použité zkratky
BMI – index tělesné hmotnosti, body mass index
CRP – C-reaktivní protein
DTK – diastolický tlak
ELISA – enzyme-linked immunosorbent assay
HDL – high-density lipoprotein
IL-1 – interleukin 1
IL-6 – interleukin 6
IL-17 – interleukin 17
IL-22 – interleukin 22
IFNγ – interferon gamma
KS – kontrolní skupina
LDL – low-density lipoprotein
Lp-PLA2 – fosfolipáza A2 asociovaná s lipoproteiny
MetS – metabolický syndrom
PASI – psoriasis area and severity index
PP – pacienti s psoriázou
STK – systolický tlak
TAG – triacylglyceroly
Th1 – T - helper lymfocyt 1
Th17 – T - helper lymfocyt 17
Th22 – T - helper lymfocyt 22
TNF-α – tumor nekrotizující faktor α
Autoři v souvislosti s tématem práce v posledních 12 měsících nespolupracovali s žádnou farmaceutickou firmou.
Práce byla podpořena projektem PROGRES Q40-09 and Q40-10.
Do redakce došlo dne 13. 10. 2017
Adresa pro korespondenci:
MUDr. Simona Vachatová
Klinika nemocí kožních a pohlavních
Fakultní nemocnice Hradec Králové
Sokolská tř. 581, 500 05 Hradec Králové
e-mail: vachatova.simona@gmail.com
Sources
1. ABUABARA, K., AZFAR, R. S., SHIN, D. B. et al. Cause-specific mortality in patients with severe psoriasis: a population-based cohort study in the U.K. Br. J. Dermatol., 2010, 163, 3, p. 586–592.
2. ALBANES, D., JONES, D. Y., MICOZZI, M. S., MATTSON, M. E. Associations between smoking and body weight in the US population: analysis of NHANES II. Am. J. Public. Health, 1987, 77, 4, p. 439–444.
3. ALSUFYANI, M. A., GOLANT, A. K., LEBWOHL, M. Psoriasis and the metabolic syndrome. Dermatol. Ther., 2010, 23, 2, p. 137–143.
4. ARMSTRONG, A. W., ARMSTRONG, E. J., FULLER, E. N. et al. Smoking and pathogenesis of psoriasis. Br. J. Dermatol., 2011, 165, 6, p. 1162–1168.
5. ARMSTRONG, A. W., HARSKAMP, C. T., ARMSTRONG, E. J. The association between psoriasis and obesity: a systematic review and meta-analysis of observational studies. Nutr Diabetes, 2012, 2. doi:10.1038/nutd.2012.26.
6. BAI, X. J., FAN, L. H., HE, Y. et al. Nicotine may affect the secretion of adipokines leptin, resistin, and visfatin through activation of KATP channel. Nutrition, 2016, 32, 6, p. 645–648.
7. BALCI, A., BALCI, D. D., YONDEN, Z. et al. Increased amount of visceral fat in patients with psoriasis contributes to metabolic syndrome. Dermatology, 2010, 220, 1, p. 32–37.
8. BARAN, A., FLISIAK, I., JAROSZEWICZ, J., SWIDERSKA, M. Serum adiponectin and leptin levels in psoriatic patients according to topical treatment. J. Dermatolog. Treat., 2015, 26, 2, p. 134–138.
9. BERGMANN, S., SIEKMEIER, R. Influence of smoking and body weight on adipokines in middle aged women. Eur. J. Med. Res., 2009, 14, 4, p. 21–26.
10. BEYGI, S., LAJEVARDI, V., ABEDINI R. C-reactive protein in psoriasis: a review of the literature. J. Eur. Acad. Dermatol. Venereol., 2014, 28, 6, p. 700–711.
11. CAMPANATI, A., GANZETTI, G., GIULIODORI, K. et al. Serum levels of adipocytokines in psoriasis patients receiving tumor necrosis factor-α inhibitors: results of a retrospective analysis. Int. J. Dermatol., 2015, 54, 7, p. 839–845.
12. CANOY, D., WAREHAM, N., LUBEN, R. et al. Cigarette smoking and fat distribution in 21, 828 British men and women: a population-based study. Obes. Res, 2005, 13, 8, p. 1466–1475.
13. CARLSSON, S., MIDTHJELL, K., GRILL, V. et al. Smoking is associated with an increased risk of type 2 diabetes but a decreased risk of autoimmune diabetes in adults: an 11-year follow-up of incidence of diabetes in the Nord-Trøndelag study. Diabetologia, 2004, 47, 11, p. 1953–1956.
14. COBAN, M., TASLI, L., TURGUT, S. et al. Association of adipokines, insulin resistance, hypertension and dyslipidemia in patients with psoriasis vulgaris. Ann. Dermatol., 2016, 28, 1, p. 74–79.
15. COIMBRA, S., OLIVEIRA, H., REIS, F. et al. C-reactive protein and leucocyte activation in psoriasis vulgaris according to severity and therapy. J. Eur. Acad. Dermatol. Venereol., 2010, 24, 7, p. 789–796.
16. CRAIG, W. Y., PALOMAKI, G. E., HADDOW, J. E. Cigarette smoking and serum lipid and lipoprotein concentrations: an analysis of published data. BMJ, 1989, 298, 6676, p. 784–788.
17. FAN, L. H., HE, Y., XU, W. et al. Adiponectin may be a biomarker of early atherosclerosis of smokers and decreased by nicotine through KATP channel in adipocytes. Nutrition, 2015, 31, 7–8, p. 955–958.
18. FORD, E. S., GILES, W. H., DIETZ, W. H. Prevalence of the metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey. JAMA, 2002, 287, 3, p. 356–359.
19. GERDES, S., OSADTSCHY, S., ROSTAMI-YAZDI, M. et al. Leptin, adiponectin, visfatin and retinol-binding protein-4 mediators of comorbidities in patients with psoriasis? Exp. Dermatol., 2012, 21, 1, p. 43–47.
20. GERDES, S., ZAHL, V. A., WEICHENTHAL, M. et al. Smoking and alcohol intake in severely affected patients with psoriasis in Germany. Dermatology, 2010, 220, 1, p. 38–43.
21. GISONDI, P., GALVAN, A., IDOLAZZI, L., GIROLOMONI, G. Management of moderate to severe psoriasis in patients with metabolic comorbidities. Front. Med., 2015, 2, 1. doi: 10.3389/fmed.2015.00001.
22. GISONDI, P., TESSARI, G., CONTI, A. et al. Prevalence of metabolic syndrome in patients with psoriasis: a hospital-based case-control study. Br. J. Dermatol., 2007, 157, 1, p. 68–73.
23. HAYES, J., KOO, J. Psoriasis: depression, anxiety, smoking, and drinking habits. Dermatol. Ther., 2010, 23, 2, p. 174–180.
24. HERRON, M., HINCKLEY, M., HOFFMAN, M. S. et al. Impact of obesity and smoking on psoriasis presentation and management. Arch. Dermatol., 2005, 141, 12, p. 1527–1534.
25. HOFSTETTER, A., SCHUTZ, Y., JEQUIER, E., WAHREN, J. Increased 24-hour energy expenditure in cigarette smokers. N. Engl. J. Med., 1986, 314, 2, p. 79–82.
26. HOLZER, M., WOLF, P., CURCIC, S. et al. Psoriasis alters HDL composition and cholesterol efflux capacity. J. Lipid Res., 2012, 53, 8, p.1618–1624.
27. HOLZER, M., WOLF, P., INZINGER, M. et al. Anti-psoriatic therapy recovers high-density lipoprotein composition and function. J. Invest. Dermatol., 2014, 134, 3, p. 635–642.
28. HORÁKOVÁ, D., AZEEM, K., DUMBROVSKÁ, L. et al. Epidemiological significance of the metabolic syndrome. Epidemiol. Mikrobiol. Imunol., 2016, 65, 4, p. 215–218.
29. HUANG, H., SHEN, E., TANG, S. et al. Increased serum resistin levels correlate with psoriasis: a meta-analysis. Lipids Health Dis., 2015, 14, p. 44. doi: 10.1186/s12944-015-0039-9.
30. CHIRICOZZI, A., RAIMONDO, A., LEMBO, S. et al. Crosstalk between skin inflammation and adipose tissue-derived products: pathogenic evidence linking psoriasis to increased adipozity. Expert Rev. Clin. Immunol., 2016, 12, 12, p. 1299–1308.
31. IIDA, M., IIDA, H., DOHI, S. et al. Mechanisms underlying cerebrovascular effects of cigarette smoking in rats in vivo. Stroke, 1998, 29, 8, p. 1656–1665.
32. ISHIZAKA, N., ISHIZAKA, Y., TODA, E. et al. Association between cigarette smoking, metabolic syndrome, and carotid arteriosclerosis in Japanese individuals. Atherosclerosis 2005, 181, p. 381–388.
33. IWASHIMA, Y., KATSUYA, T., ISHIKAWA, I. et al. Association of hypoadiponectinemia with smoking habit in men. Hypertension, 2005, 45, 6, p. 1094–1100.
34. JENSEN, P., SKOV, L. Psoriasis and Obesity. Dermatology, 2016, 232, 6, p. 633–639.
35. JIA, W. P. The Impact of Cigarette Smoking on Metabolic Syndrome. Biomed. Environ. Sci., 2013, 26, 12, p. 947–952.
36. JOHNSTON, A., ARNADOTTIR, S., GUDJONSSON, J. E. et al. Obesity in psoriasis: leptin and resistin as mediators of cutaneous inflammation. Br. J. Dermatol., 2008, 159, 2, p. 342–350.
37. KAUR, S., ZILMER, K., KAIRANE, C. et al. Clear differences in adiponectin level and glutathione redox status revealed in obese and normal-weight patients with psoriasis. Br. J. Dermatol., 2008, 159, 6, p. 1364–1367.
38. KAUR, S., ZILMER, K., LEPING, V. et al. The levels of adiponectin and leptin and their relation to other markers of cardiovascular risk in patients with psoriasis. J. Eur. Acad. Dermatol. Venereol., 2011, 25, 11, p. 1328–1333.
39. KONDELKOVA, K., BORSKA, L., ANDRYS, C. et al. Selected inflammatory and metabolic markers in psoriatic patients treated with goeckerman therapy. Mediators Inflamm., 2015, 8. doi: 10.1155/2015/979526.979526.
40. LANDSBERG, L., ARONNE, L. J., BEILIN, L. J. et al. Obesity-related hypertension: pathogenesis, cardiovascular risk, and treatment – a position paper of The Obesity Society and The American Society of Hypertension. Obesity (Silver Spring), 2013, 21, 1, p. 8–24.
41. LI, W., HAN, J., CHOI, H. K., QURESHI, A. A. Smoking and risk of incident psoriasis among women and men in the United States: a combined analysis. Am. J. Epidemiol., 2012, 175, 5, p. 402–413.
42. LITVINOVA, L., ATOCHIN, D., VASILENKO, M. et al. Role of adiponectin and proinflammatory gene expression in adipose tissue chronic inflammation in women with metabolic syndrome. Diabetol. Metab. Syndr., 2014, 6, 1. doi: 10.1186/1758-5996-6-137.
43. LIU, S., MANSON, J. E. Dietary carbohydrates, physical inactivity, obesity, and the ‚metabolic syndrome‘ as predictors of coronary heart disease. Curr. Opin. Lipidol., 2001, 12, 4, p. 395–404.
44. LOPRINZI, P., WALKER, J. F. Combined association of physical activity and diet with C-reactive protein among smokers. J. Diabetes Metab. Disord., 2015, 14. doi: 10.1186/s40200-015-0181-y.
45. LOVE, T. J., QURESHI, A. A., KARLSON, E. W. et al. Prevalence of the Metabolic Syndrome in psoriasis: Results from the National Health and Nutrition Examination Survey, 2003-2006. Arch. Dermatol., 2011, 147, 4, p. 419–424.
46. MCDONALD, C. J., CALABRESI, P. Psoriasis and occlusive vascular disease. Br. J. Dermatol., 1978, 99, 5, p. 469–475.
47. MILČIĆ, D., JANKOVIĆ, S., VESIĆ, S. et al. Prevalence of metabolic syndrome in patients with psoriasis: a hospital-based cross-sectional study. An. Bras. Dermatol., 2017, 92, 1, p. 46–51.
48. MILLER, I. M., ELLERVIK, C., ZARCHI, K. et al. The association of metabolic syndrome and psoriasis: a population - and hospitalbased cross-sectional study. J. Eur. Acad. Dermatol. Venereol., 2015, 29, 3, p. 490–497.
49. MIZUNO, O., OKAMOTO, K., SAWADA, M. et al. Obesity and smoking: relationship with waist circumference and obesity-related disorders in men undergoing a health screening. J. Atheroscler. Thromb., 2005, 12, 4, p. 199–204.
50. MOUTZOURI, E., V. TSIMIHODIMOS, V., TSELEPIS, A. D. Inflammatory biomarkers and cardiovascular risk assessment. Current knowledge and future perspectives. Curr. Pharm. Des., 2013, 19, 21, p. 3827–3840.
51. NALDI, L., CHATENOUD, L., LINDER, D. et al. Cigarette smoking, body mass index, and stressful life events as risk factors for psoriasis: results from an Italian case-control study. J. Invest. Dermatol., 2005, 125, 1, p. 61–67.
52. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third report of the National Cholesterol Education Program (NCEP). Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation, 2002, 106, 25, p. 3143–3421.
53. NAVARRO, S. L., KANTOR, E. D., SONG, X. et al. Factors Associated with Multiple Biomarkers of Systemic Inflammation. Cancer. Epidemiol. Biomarkers Prev., 2016, 25, 3, p. 521–531.
54. OH, Y. J., LIM, H. K., CHOI, J. H. et al. Serum leptin and adiponectin levels in Korean patients with psoriasis. J. Korean Med. Sci., 2014, 29, 5, p. 729–734.
55. OWCZARCZYK SACZONEK, A., NOWICKI, R. The association between smoking and the prevalence of metabolic syndrome and its components in patients with psoriasis aged 30 to 49 years. Postępy Dermatol. Alergol., 2015, 32, 5, p. 331–336.
56. OWCZARCZYK-SACZONEK, A. B., NOWICKI, R. J., Prevalence of cardiovascular disease risk factors, and metabolic syndrome and its components in patients with psoriasis aged 30 to 49 years. Postep. Derm. Alergol., 2015, 32, 4, p. 290–295.
57. ÖZDEMIR, M., YÜKSEL, M., GÖKBEL, H. et al. Serum leptin, adiponectin, resistin and ghrelin levels in psoriatic patients treated with cyclosporin. J. Dermatol., 2012, 39, 5, p. 443–448.
58. PAN, A., WANG, Y., TALAEI, M. et al. Relation of active, passive, and quitting smoking with incident type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol., 2015, 3, 12, p. 958–967.
59. PANKOVA, A., KRALIKOVA, E., FRASER, K. et al. No difference in hypertension prevalence in smokers, former smokers and non-smokers after adjusting for body mass index and age: a cross-sectional study from the Czech Republic, 2010. Tob. Induc. Dis., 2015, 13, 1, p. 24.
60. PARISI, R., SYMMONS, D. P., GRIFFITHS, C. E. et al. Global epidemiology of psoriasis: a systematic review of incidence and prevalence. J. Invest. Dermatol., 2013, 133, 2, p. 377–385.
61. PARK, H. S., OH, S. W., CHO, S. I. et al. The metabolic syndrome and associated lifestyle factors among South Korean adults. Int. J. Epidemiol., 2004, 33, 2, p. 328–336.
62. PEREIRA, R. R., AMLADI, S. T., VARTHAKAVI, P. K. A study of the prevalence of diabetes, insulin resistance, lipid abnormalities, and cardiovascular risk factors in patients with chronic plaque psoriasis. Indian. J. Dermatol., 2011, 56, 5, p. 520–526.
63. PUCCI, G., ALCIDI, R., TAP, L. Sex - and gender-related prevalence, cardiovascular risk and therapeutic approach in metabolic syndrome: A review of the literature. Pharmacol. Res., 2017, 120, p. 34–42.
64. REAVEN, G., TSAO, P. S. Insulin resistance and compensatory hyperinsulinemia: The key player between cigarette smoking and cardio-vascular disease. J. Am. Coll. Cardiol., 2003, 41, 6, p. 1044–1047.
65. RICHER, V., ROUBILLE, C., FLEMING, P. et al. Psoriasis and Smoking: A Systematic Literature Review and Meta-Analysis With Qualitative Analysis of Effect of Smoking on Psoriasis Severity. J. Cutan. Med. Surg., 2016, 20, 3, p. 221–227.
66. ROMANÍ, J., CAIXÀS, A., CEPERUELO-MALLAFRÉ, V. et al. Circulating levels of lipocalin-2 and retinol-binding protein-4 are increased in psoriatic patients and correlated with baseline PASI. Arch. Dermatol. Res., 2013, 305, 2, p. 105–112.
67. SHIELS, M. S., KATKI, H. A., FREEDMAN, N. D. et al. Cigarette smoking and variations in systemic immune and inflammation markers. J. Natl. Cancer. Inst., 2014, 106, 11. doi: 10.1093/jnci/dju294.
68. SCHMITT, J., GOTTFRIED, W. The Psoriasis Area and Severity Index Is the Adequate Criterion to Define Severity in Chronic Plaque-Type Psoriasis. Dermatology, 2005, 210, p. 194–199.
69. SOMMER, D. M., JENISCH, S., SUCHAN. M. et al. Increased prevalence of the metabolic syndrome in patients with moderate to severe psoriasis. Arch. Dermatol. Res., 2006, 298, 7, p. 321–328.
70. SOVINOVÁ, H., CSÉMY, L. Užívání tabáku v České republice 2015. Státní zdravotní ústav, 2016.
71. STJERNHOLM, T., OMMEN, P., LANGKILDE, A. et al. Leptin-deficiency in mice counteracts imiquimod (IMQ)-induced psoriasis-like skin inflammation while leptin stimulation induces inflammation in human keratinocytes. Exp. Dermatol., 2016. doi: 10.1111/exd.13149.
72. TAKESHITA, J., GREWAL, S., LANGAN, S. M. et al. Psoriasis and comorbid diseases: Epidemiology. J. Am. Acad. Dermatol., 2017, 76, 3, p. 377–390.
73. TSELEPIS, A. D., PANAGIOTAKOS, D. B., PITSAVOS, C. et al. Smoking induces lipoprotein-associated phospholipase A2 in cardiovascular disease free adults: the ATTICA Study. Atherosclerosis. 2009, 206, 1, p. 303–308.
74. VACHATOVA, S., BORSKA, L., ANDRYS, C., KREJSEK, J. et al. Metabolic Syndrome and Selective Inflammatory Markers in Psoriatic Patients. J. Immunol. Res., 2016. doi: 10.1155/2016/5380792.
75. VOSÁTKOVÁ, M., ČEŘOVSKÁ, J., ZAMRAZILOVÁ, H. et al. Prevalence of obesity and metabolic syndrome in adult population of selected regions of the Czech Republic. Relation to rating habits and smoking. Prague Medical Report, 2012, 113, 3, p. 206–216.
76. WOLK, K., SABAT, R. Adipokines in psoriasis: an important link between skin inflammation and metabolic alterations. Rev. Endocr. Metab. Disord., 2016, 17, 3, p. 1–13.
77. WON, W. Y., LEE, C. U., CHAE, J. H. et al. Changes of plasma adiponectin levels after smoking cessation. Psychiatry Investig., 2014, 11, 2, p. 173–178.
78. ZHANG, X., WANG, H., TE-SHAO, H. et al. Frequent use of tobacco and alcohol in Chinese psoriasis patients. Int. J. Dermatol., 2002, 41, 10, p. 659–662.
79. ZINDANCI, I., ALBAYRAK, O., KAVALA, M. et al. Prevalence of metabolic syndrome in patients with psoriasis. ScientificWorldJournal, 2012, p. 312463–312463. DOI: 10.1100/2012/312463.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2017 Issue 6
Most read in this issue- Frontální fibrotizující alopecie – popis případu
- Základy molekulární biologie nádorů pro praxi
- Vliv kouření na sérové hladiny vybraných adipokinů u pacientů s lupénkou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

