-
Medical journals
- Career
Deformační analýza pravé komory pomocí speckle tracking echokardiografie v diagnostice plicní arteriální hypertenze u pacientů se systémovou sklerodermií a smíšeným onemocněním pojiva
Authors: J. Vymětal 1; M. Hutyra 2; A. Smržová 1; M. Skácelová 1; Z. Heřmanová 3; K. Langová 4; P. Horák 1
Authors‘ workplace: 3. interní klinika – nefrologická, revmatologická a endokrinologická, LF UP a FN Olomouc 1; 1. interní klinika – kardiologická, LF UP a FN Olomouc 2; Oddělení imunologie, LF UP a FN Olomouc 3; Oddělení biostatistiky, LF UP Olomouc 4
Published in: Čes. Revmatol., 23, 2015, No. 4, p. 123-132.
Category: Original Papers
Overview
Rozvoj plicní arteriální hypertenze (PAH) u systémové sklerodermie představuje jednu z nejvážnějších orgánových komplikací. Její časná neinvazivní detekce je založena na pravidelném echokardiografickém screeningu. Cílem této práce je posoudit přínos longitudinálního strainu pravé komory (RVLS), hodnoceného s využitím speckle tracking echokardiografie v diagnostice plicní hypertenze.
Soubor a metodika:
Celkem 74 pacientů (60 pac. se sklerodermií, 14 pac. se smíšeným onemocněním pojiva) bylo vyšetřeno echokardiograficky; kromě standardního vyšetření funkce levé a pravé komory a odhadu plicní hypertenze, byla měřena frakční změna plochy pravé komory (FAC, fractional area change) a 2D strain volné stěny pravé komory. Současně byly stanovovány hladiny NT-proBNP (N-terminal pro-brain natriuretic peptide), charakteristické autoprotilátky a difúzní kapacita plic (DLCO). U pacientů s pravděpodobnou plicní hypertenzí byla provedena pravostranná katetrizace.Výsledky:
Plicní hypertenze byla nepravděpodobná u 59 (79,7 %) nemocných, u 10 (13,5 %) nemocných možná a u 5 (6,7 %) nemocných pravděpodobná. Statisticky signifikantní korelace byly zjištěny pro systolický tlak v plicnici (PASP, pulmonary artery systolic pressure) a globální longitudinální strain pravé komory (RVGLS, right ventricle global longitudinal strain), resp. střední segment volné stěny pravé komory (r = 0,292, p = 0,012), pro systolický tlak v plicnici a NT-proBNP (r = 0,436 p = 0,001) a dále pro PASP a frakční změnu plochy pravé komory RV-FAC (r = 0,320, p = 0,005). Systolický tlak v plicnici ve vyšetřovaném souboru nekoreloval s parametry systolické či diastolické funkce levé komory.Závěr:
Měření strainu pravé komory pomocí speckle trackingu může být užitečným doplňkem při echokardiografickém vyšetření pacientů se systémovou sklerodermií a plicní hypertenzí.Klíčová slova:
systémová sklerodermie, smíšené onemocnění pojiva, plicní arteriální hypertenze, echokardiografie, speckle trackingÚvod
Plicní arteriální hypertenze (PAH) u systémové sklerodermie (SSc) je prognosticky vážnou a život ohrožující orgánovou komplikací. Její neinvazivní diagnostika je založena na echokardiografickém odhadu systolického tlaku v plicnici (PASP, pulmonary artery systolic pressure) (1). Mezi prediktory plicní hypertenze u systémové sklerodermie patří snížená difúzní kapacita plic (DLCO) a zvýšené hladiny N-terminálního konce natriuretického peptidu (N-terminal pro-brain natriuretic peptide, NT-proBNP)(2). Nové echokardiografické metody, jako např. deformační analýza s využitím speckle trackingu, byly nedávno použity u systémové sklerodermie k hodnocení levé (3) i pravé (4) komory, avšak nikoliv blíže ve vztahu k hodnocení plicní hypertenze.
Speckle tracking echokardiografie (STE) je založena na sledování (tracking) prostorové změny polohy „speckles“, definovaných jako artefakty/skvrny šedi generované interakcí ultrazvukových vln v tkáni myokardu. STE umožňuje poloautomatické kvantitativní hodnocení jak podélné (longitudinální), tak paprskovité (radiální) a obvodové (circumferenciální) deformace myokardu, kterými se vyznačuje prostorově komplexní srdeční stah. Strain (ε) pak představuje kvantitativní míru deformace zkoumaného segmentu myokardu v poměru k jeho původnímu rozměru (ε = (L – L0)/ L0, kde L je délka segmentu myokardu po deformaci a L0 je původní délka segmentu) a je vyjadřován v procentech. Dle konvence má zkrácení, popř. ztenčení myokardu hodnotu strainu zápornou, kdežto prodloužení, popř. ztluštění segmentu má hodnotu strainu kladnou (5).
Cílem této práce je zhodnotit význam longitudinálního strainu pravé komory (RV-GLS, right ventricle global longitudinal strain) a dalších parametrů systolické a diastolické funkce pravé komory v diagnostice plicní hypertenze u systémové sklerodermie a smíšeného onemocnění pojiva (MCTD).
Soubor a metodika
Soubor zahrnoval celkem 74 pacientů, z toho 60 pacientů se systémovou sklerodermií (51 žen, průměrný věk 58,86 ± 11,88 let a 9 mužů, průměrný věk 57,55 ± 1,57) a 14 pacientů se smíšeným onemocněním pojiva (10 žen, průměrný věk 46,62 ± 10,98 let a 1 muž, 36 let), splňujících diagnostická kritéria SSc, resp. MCTD (6, 7). Do studie byli zařazeni sledovaní nemocní našeho centra, včetně pacientů s již známou plicní arteriální hypertenzí, i v průběhu studie nově diagnostikovaní nemocní a všichni měli provedená recentní vyšetření. Echokardiografie byla prováděna na přístroji Philips iU 22 (matrixová sonda S5-1, frekvenční rozsah 5 až 1 MHz). Systolický tlak v plicnici byl určen z měření maximální rychlosti jetu trikuspidální regurgitace (TR Vmax ) jako součet vrcholového tlakového gradientu trikuspidální regurgitace a tlaku v pravé síni, odhadnutého z rozměru a respirační variability dolní duté žíly na základě platných doporučení (1). Do vyšetření bylo zahrnuto měření změny plochy pravé komory (Right Ventricle Fractional Area Change, RV-FAC), plochy pravé síně (Right Atrium Area, RAA), systolické exkurze roviny trikuspidálního anulu (Tricuspid Annular Plane Systolic Excursion, TAPSE) a systolická rychlost trikuspidálního anulu měřená tkáňovým Dopplerem (Stri TDI).
Pro speckle tracking a měření strainu volné stěny pravé komory byl použit PHILIPS Qlab 9.1 software. Spirometrie a difúzní kapacita plic (DLCO) byly provedena na bodypletysmografu Jaeger® MasterScreen™. Hladiny troponinu T (TnT) a natriuretického peptidu (NT-proBNP) byly stanovovány elektrochemiluminiscenční analýzou (ECLIA, přístroj Hitachi Cobas 8000) s použitím standardizovaných kitů Troponin T hs (cut-off hodnota 0,014 ng/ml, Roche Diagnostics) a proBNP II (cut-off hodnota 125 ng/l). Relevantní autoprotilátky byly stanoveny imunoabsorpční analýzou (ELISA, přístroj TECAN SunriseTM), a sice: kvalitativně ENA (MASTAZYME ENA Screen 7, kat.č. 733023), anti-Scl 70 a anticentromerické autoprotilátky (MASTAZYME ANA Profil HJS), kvantitativně antinukleozomální protilátky (5B28L Anti–nucleosome, negativní cut-off hodnota ≤ 20 U/ml, resp. pozitivní cut-off hodnota > 20 U/ml).
V souladu s arbitrárními kritérii pravděpodobnosti plicní hypertenze stanovené na základě echokardiografického vyšetření (8) byli pacienti rozděleni do tří kategorií: Kategorie 1 - PH nepravděpodobná (TR Vmax < 2,8 m/s, PASP < 36mmHg, normální funkce pravé komory, bez hypertrofie), kategorie 2 - PH možná (TR Vmax 2,8 - 3,4 m/s, PASP 36-50mmHg, nebo PASP < 36mmHg a přítomnost hypertrofie a/nebo dilatace či dysfunkce pravé komory) a kategorie 3 - PH pravděpodobná (TR Vmax > 3,4 m/s, PASP > 50 mmHg, přítomnost nebo absence hypertrofie/dilatace a dysfunkce pravé komory). U všech nemocných s pravděpodobnou PH (kategorie 3) a symptomatických pacientů s echokardiografickou suspekcí (kategorie 2) byla provedena pravostranná katetrizace, od asymptomatických nemocných kategorie 2 nebyl získán informovaný souhlas k invazivnímu vyšetření. Katetrizace byla prováděna za aseptických podmínek cestou v. jugularis interna a pozice katétru byla ověřována za skiaskopické kontroly. K měření byl použit balónkový termodiluční katétr firmy B/Braun Corodyn TD-I s příslušenstvím a monitor s modulárním systémem pro měření invazivního tlaku a srdečního výdeje Philips IntelliVue MX600. Flebostatická rovina byla stanovena ve výšce 1/2 hrudníku vyšetřovaného.
K statistickému zpracování dat byl použit statistický software SPSS Statistics, verze 15 (SPSS Inc. Chicago USA), všechny testy byly provedeny na úrovni signifikance 0,05. Shapiro-Wilkovými testy normality bylo prokázáno, že většina veličin nemá normální distribuci, proto byly pro zpracování použity neparametrické metody. Korelace kvantitativních veličin byla ověřena výpočtem Spearmanových korelačních koeficientů. Vztahy pozitivity autoprotilátek k echokardiografickým a spirometrickým parametrům byly ověřeny Mann-Whitneyovými U-testy. Závislost na diagnóze byla testována Kruskal-Wallisovými testy; v případě, že výsledek byl statisticky významný, bylo provedeno mnohonásobné porovnání po dvojicích pomocí Mann-Whitneyho U-testů. Hladina signifikance byla korigována Bonferroniho korekcí.
Výsledky
Při echokardiografickém vyšetření byla plicní hypertenze (PH) nepravděpodobná u 59 (79,7 %) nemocných, možná u 10 (13,5 %) a pravděpodobná u 5 (6,7 %) nemocných (tab. 1). Signifikantní korelace byly zjištěny pro PASP a globální longitudinální strain volné stěny pravé komory (p = 0,023), z jejich segmentů pak nejlépe pro PASP a střední segment volné stěny pravé komory (RV-S med, obr. 1). Frakční změna plochy pravé komory (RV-FAC) korelovala negativně jak s PASP (r = 0,320, p= 0,05, obr. 2) tak s plochou pravé síně (RAA) (r = 0,509, p = 0,002). Validita hodnot PASP byla potvrzena silnou korelací mezi PASP odhadovaným při echokardiografii a PASPcath měřeným u katetrizovaných pacientů (r = 0,873). PASPcath také silně koreloval s globálním longitudinálním strainem pravé komory (r = 0,793, p = 0,033), s RV-FAC (r = 0,857, p = 0,014) i s TAPSE (r = 0,929, p = 0,003), viz tab. 2 a tab 3.
Table 1. Echokardiografické parametry (průměr ± SD) souboru podle systolického tlaku v plícnici (n = 74). 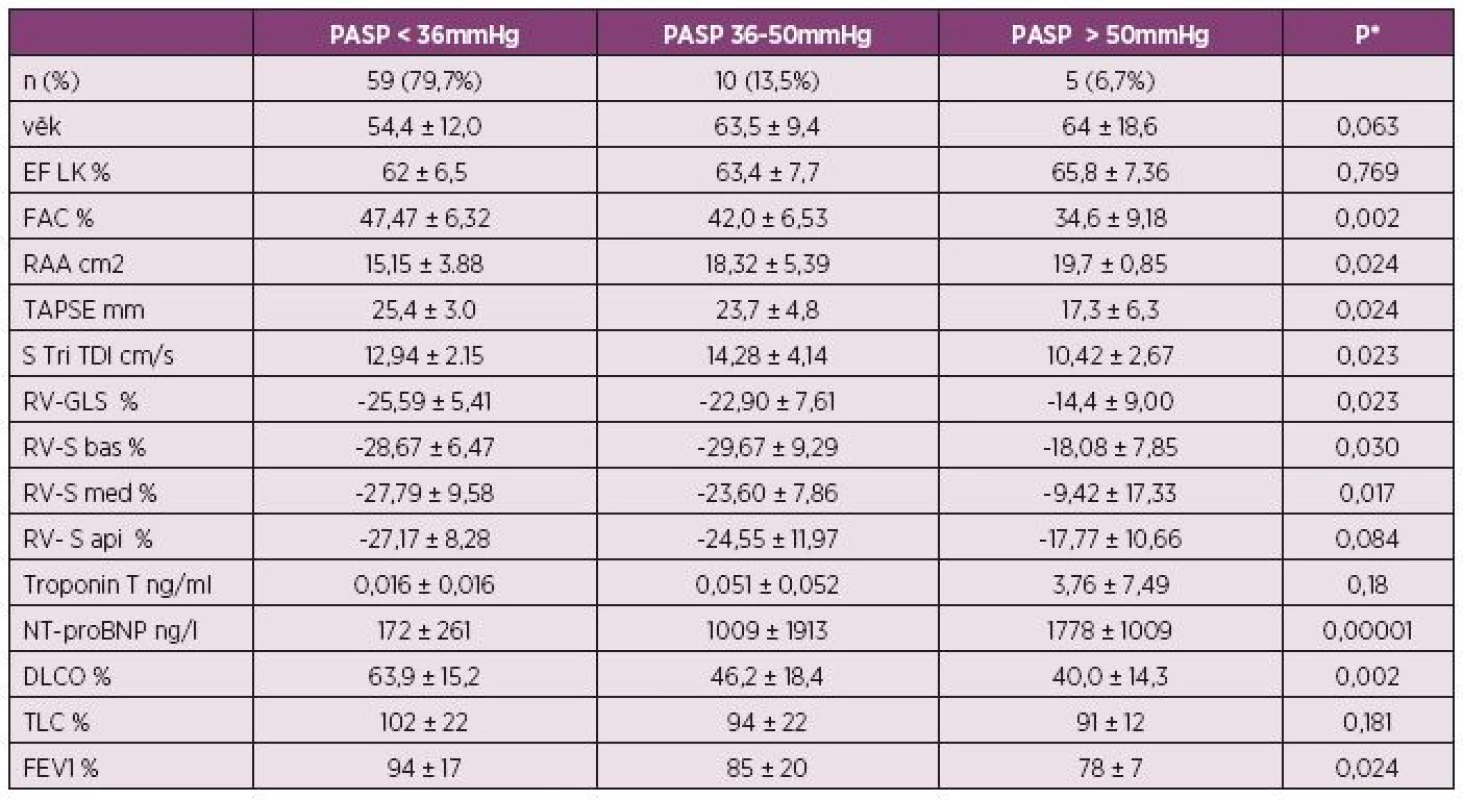
PASP – systolický tlak a. pulmonalis , EF LK – ejekční frakce levé komory, FAC – frakční změna plochy pravé komory, RAA – plocha pravé síně, TAPSE – systolická exkurze roviny trikuspidálního anulu, S Tri TDI - systolická rychlost trikuspidálního anulu v tkáňovém Doppleru (TDI), RV-GLS – globální longitudinální strain volné stěny pravé komory, RV-S bas – strain bazálního segmentu pravé komory, RV-S med – strain mediálního segmentu pravé komory, RV-S api – strain apikálního segmentu pravé komory, NT-proBNP – N-terminální natriuretický peptid, DLCO – difúzní kapacita plic, TLC – celková kapacita plic, FEV1 – usilovný objem za 1 s, SD – směrodatná odchylka, * – Kruskal Wallisův test Image 1. Spearmanova korelace strainu středního segmentu pravé komory a echokardiografického odhadu systolického tlaku v plicnici. 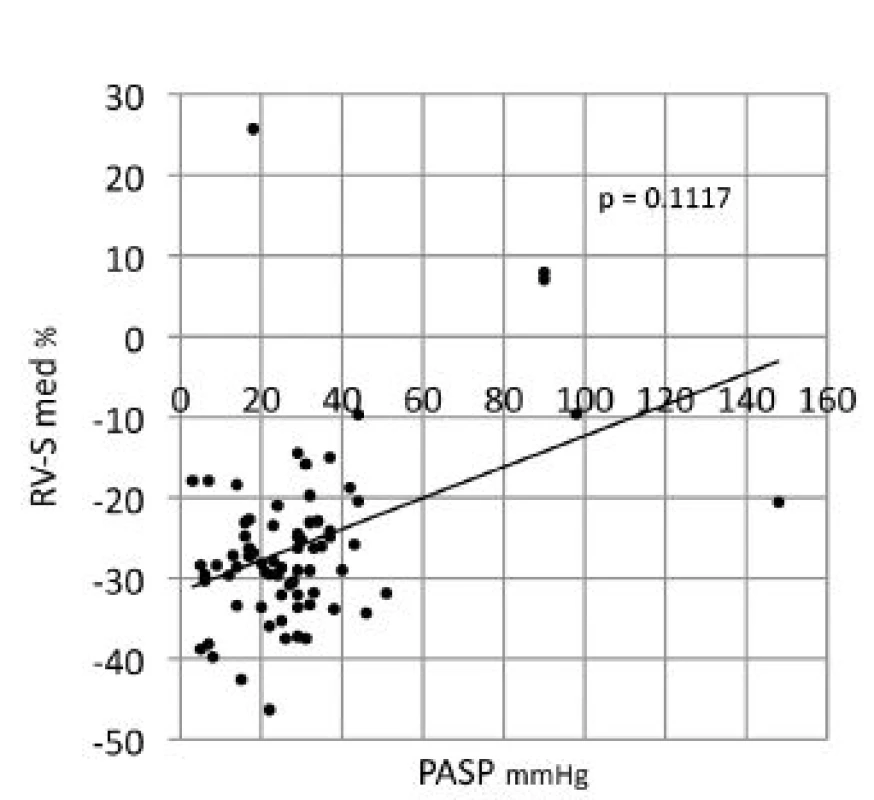
PASP - systolický tlak v plicnici na základě echokardiografického odhadu, RV-S med - strain středního segmentu volné stěny pravé komory Image 2. Spearmanova korelace systolického tlaku v plicnici (echokardiografický odhad) a frakční změny plochy pravé komory 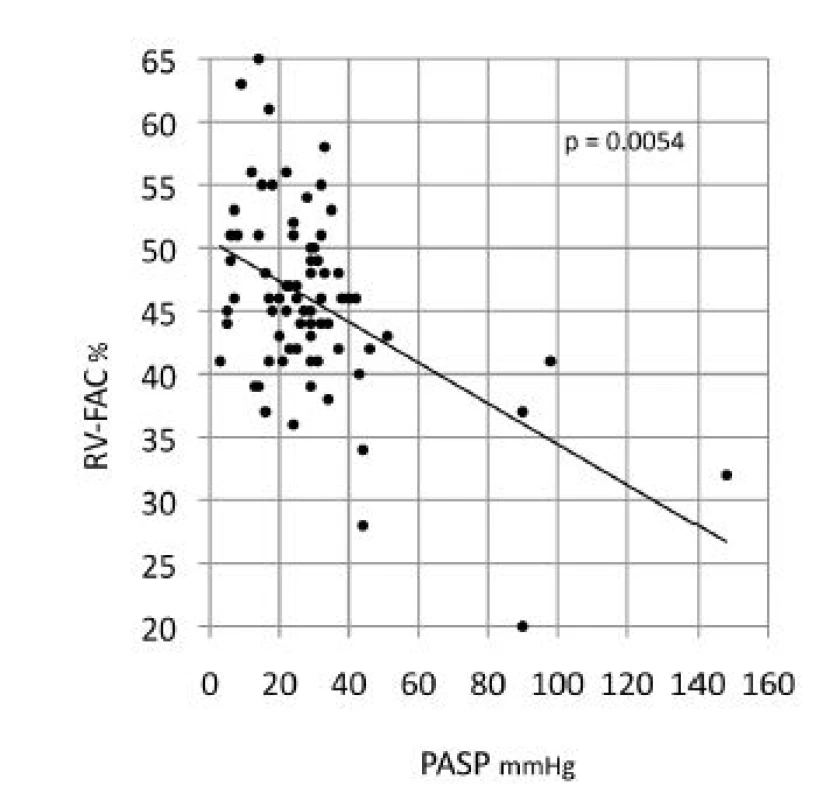
PASP - systolický tlak v plicnici, RV-FAC - frakční změna plochy pravé komory Table 2. Invazivně měřené parametry (průměr ± SD) u katetrizovaných nemocných (n = 8). 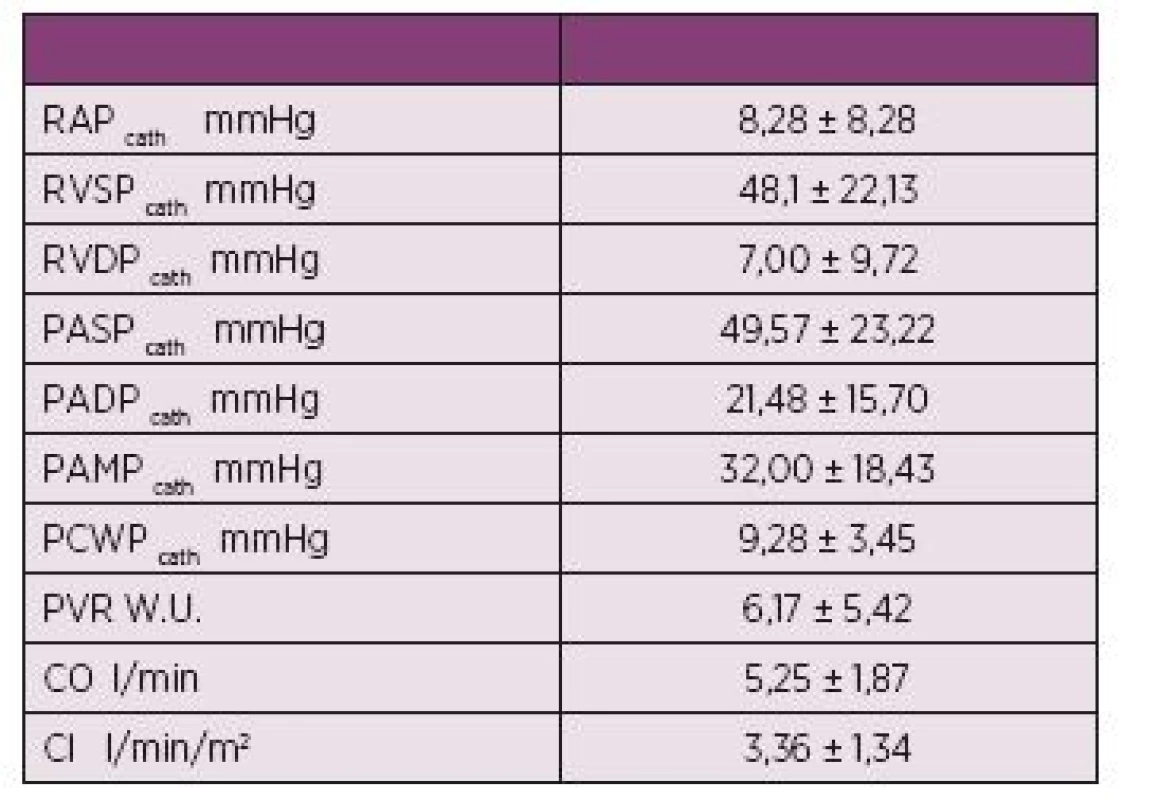
RAP – tlak v pravé síni, RVSP – systolický tlak v pravé komoře, RVDP – diastolický tlak v pravé komoře, PASP – systolický tlak v plicnici, PADP – diastolický tlak v plicnici, PAMP – střední tlak v plicnici, PCWP – tlak v zaklínění, PVR – plicní vaskulární rezistence, W.U. – Woods units, CO – srdeční výdej, CI – srdeční index Table 3. Spearmanovy korelace vybraných echokardiografických parametrů s invazivním PASP cath. 
PASP cath – systolický tlak v plícnici při katetrizaci, PASPecho – systolický tlak v plicnici při echokardiografii, RV-GLS – globální longitudinální strain volné stěny pravé komory, RV-S med – strain mediálního segmentu pravé komory, FAC – frakční změny plochy pravé komory, TAPSE – systolická exkurze roviny trikuspidálního anulu, STri TDI – systolická rychlost trikuspidálního anulu v tkáňovém Doppleru Sérové hladiny NT-proBNP signifikantně korelovaly jak s PASP (r = 0,436, p = 0,001; Obr. 3, vzhledem k širokému rozpětí hodnot v grafu použit logaritmus NT-proBNP) tak s kategorií plicní hypertenze (p = 0,0002), stejně jako s frakční změnou plochy pravé komory (r = 0,348, p = 0,008). U troponinu T nebyly zjištěny žádné signifikantní korelace.
Image 3. Korelace NT-pro BNP (zobrazen jako log log NT-proBNP) a PASP stanoveném echokardiograficky 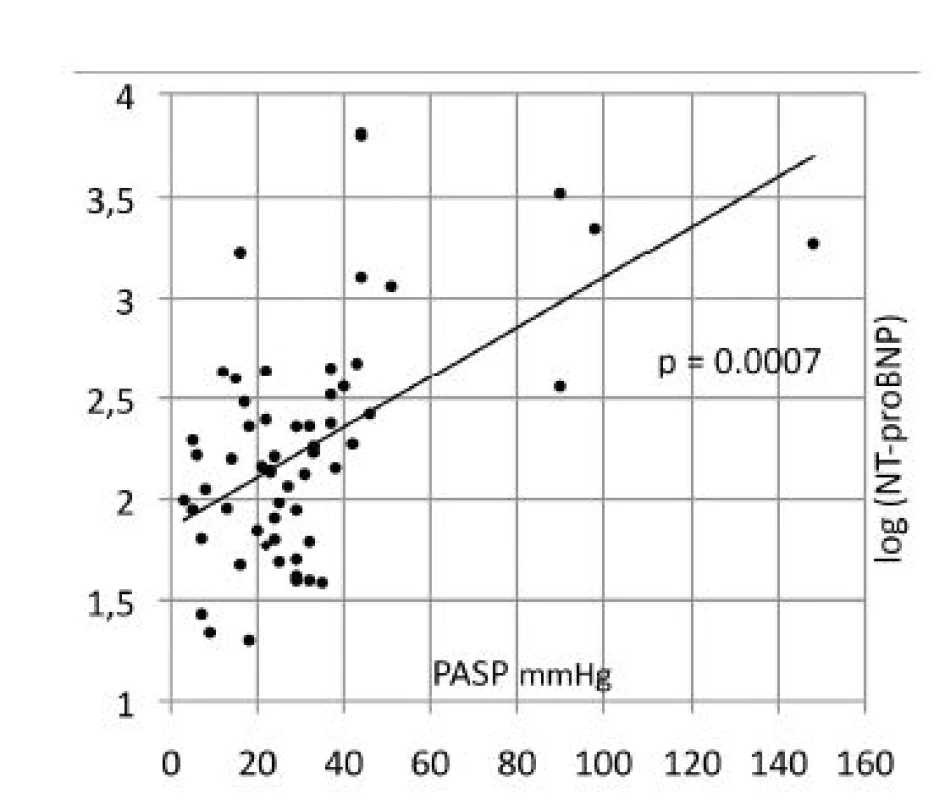
PASP - systolický tlak v plícnici, NT-proBNP - N-terminální natriuretický peptid Difúzní kapacita plic (DLCO) statisticky významně korelovala s kategorií plicní hypertenze (p = 0,0028) i s FAC (r = 0,319, p = 0,0006; obr. 4). Signifikantně nižší DLCO měli pacienti s difúzní systémovou sklerodermií (tab. 4).
Image 4. Korelace difúzní kapacity plic a frakční změny plochy pravé komory 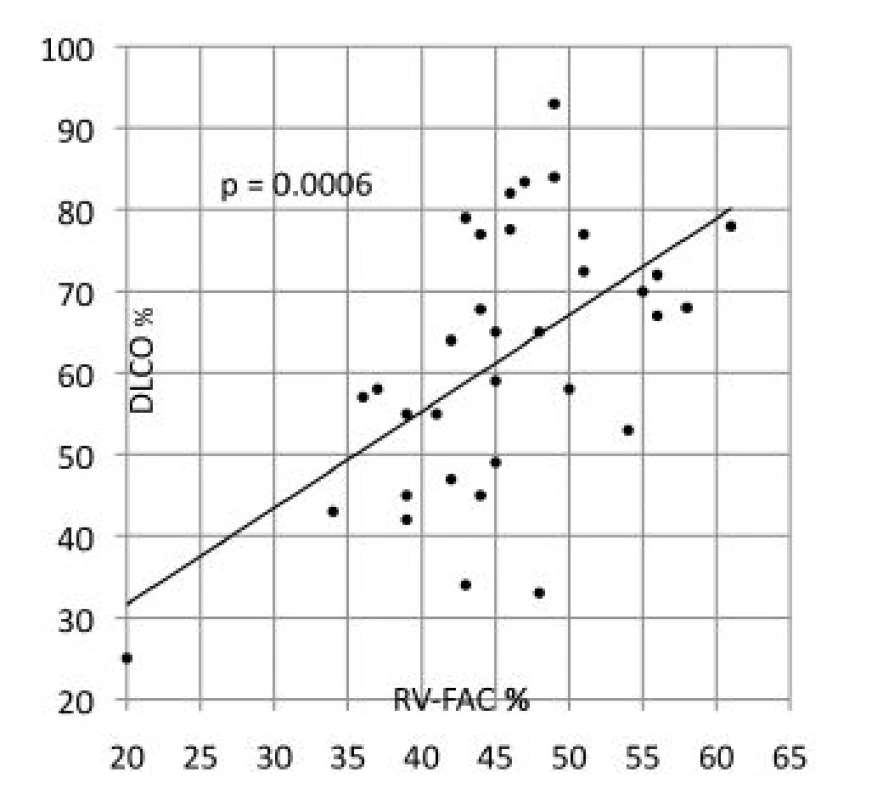
RV-FAC - frakční změny plochy pravé komory, DLCO - difúzní kapacita plic Table 4. Vybrané parametry souboru (průměr ± SD) podle typu diagnózy (n = 74). 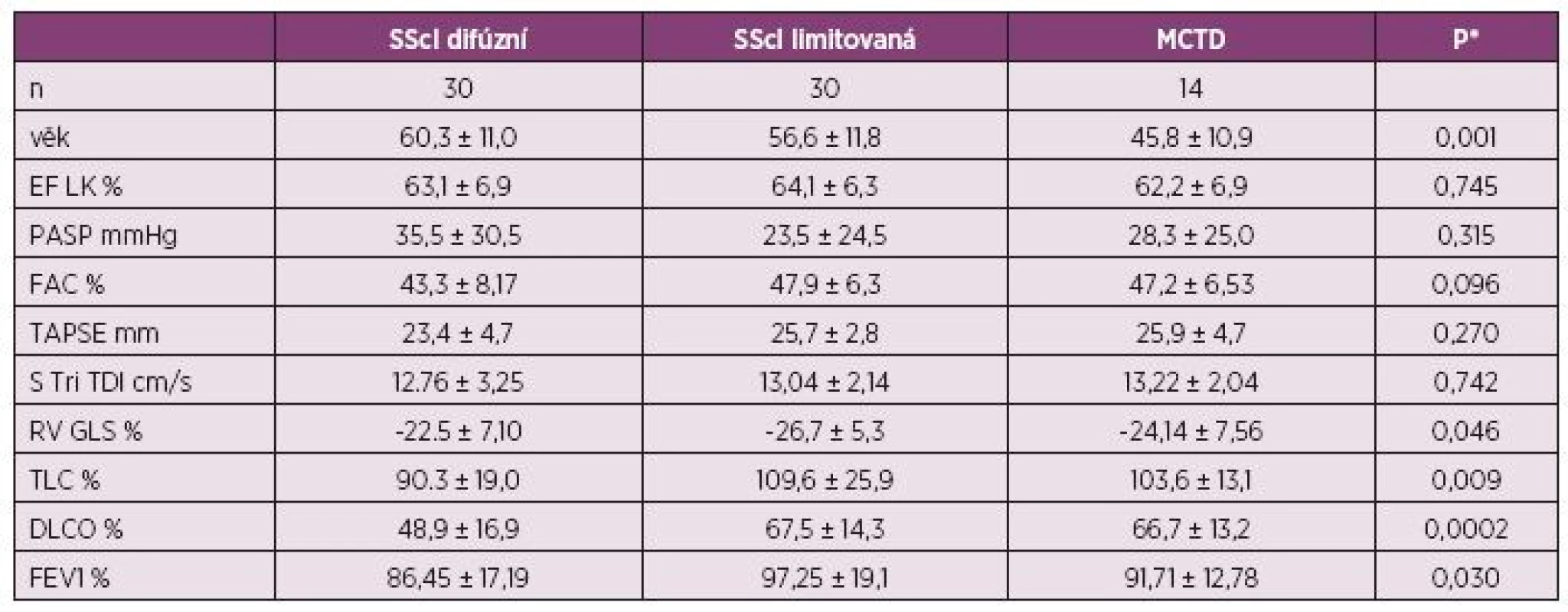
SScl – systémová sklerodermie, MCTD - smíšené onemocnění pojiva, EF LK – ejekční frakce levé komory, PASP – systolický tlak v plícnici, FAC – Fraction Area Change – frakční změna plochy pravé komory, TAPSE – systolická exkurze roviny trikuspidálního anulu, S Tri TDI – systolická rychlost trikuspidálního anulu v tkáňovém Doppleru (TDI), RV-GLS – globální longitudinální strain volné stěny pravé komory, TLC – celková kapacita plic, DLCO – difúzní kapacita plic, FEV1 % – usilovný objem za 1 s, SD – směrodatná odchylka * – Kruskal Wallis Test Analyzované autoprotilátky neměly žádný signifikantní vztah k PASP či ostatním echokardiografickým parametrům, avšak Mann-Whitneyho U-test zjistil rozdíly ve spirometrii a stanovení DLCO, kdy pacienti s pozitivitou anticentromerových autoprotilátek měli signifikantně nižší celkovou vitální kapacitu plic (TL%VC, p = 0,013) a anti-Scl 70 pozitivní pacienti měli nižší difúzní kapacitu plic.
V předpovědi možné a pravděpodobné plicní hypertenze (kategorie 2 a 3) v naší práci byly ROC (Receiver Operating Characteristic) analýzami stanoveny následující cut-off hodnoty: NT-proBNP 229,2 ng/l (senzitivita 86,7 % a specificita 85,7 %), FAC: 44 % (senzitivita 66,7 % a specificita 74,6 %), RVSmed: 26,08% (senzitivita 73,3 %, specificita 69,5 %) a DLCO 59 % (senzitivita 75,0 %, specificita 65,4 %).
Plicní hypertenze v našem souboru nekorelovala s parametry systolické či diastolické funkce levé komory.
Diskuse
Systémová sklerodermie bývá provázena řadou vážných orgánových komplikací, z nichž plicní arteriální hypertenze patří mezi vedoucí příčiny úmrtnosti (9). Osoby se SSc-PAH mají dokonce třikrát horší prognózu než osoby s idiopatickou plicní hypertenzí (10). Věk nad 60 let, mužské pohlaví a snížená difúzní kapacita plic DLCO < 39 % jsou významnými prediktory úmrtnosti u nemocných se systémovou sklerodermií a plicní arteriální hypertenzí (11). Údaje o prevalenci PAH u systémové sklerodermie se v literatuře liší, většinou se pohybuje do 12 % (12). V evropském vzorku z 11 center ve Francii a Itálii byla prevalence PAH 5 % a v následné metaanalýze zahrnující celkem 3818 nemocných ze 4 dalších studií dosahovala prevalence PAH 9 % (13). Naproti tomu v jiné velké italské kohortě (867 pacientů se SSc) byla popsána zřetelně nižší prevalence PAH 3,7 % (14).
Ve studii z České republiky, která zahrnovala 203 pacientů se SSc, byla prevalence PAH 7,08 % (15). Rovněž v naší předkládané práci většina pacientů se systémovou sklerodermií a smíšeným onemocněním pojiva nevykazovala při echokardiografii nálezy svědčící pro přítomnost PAH. Pravděpodobná PAH (PASP > 50 mmHg) byla echokardiograficky zjištěna pouze u 5 (6,7 %) pacientů a u všech těchto pacientů byla PAH i potvrzena pravostrannou srdeční katetrizací, zatímco u pacientů ze skupiny možné PAH (PASP 36–50 mmHg), kteří podstoupili pravostrannou katetrizaci, byla PAH vyloučena. Řada autorů proto hledá další neinvazivní i invazivní prediktory plicní hypertenze, jako např. zátěžovou dopplerovskou echokardiografii (16) nebo i zátěží indukovanou plicní hypertenzi, hodnocenou invazivně (17), která může rozlišit mezi jednotlivými typy PH, včetně plicní venózní hypertenze (18) a rozlišit tak mezi zátěží indukovanou PAH a diastolickou dysfunkcí levé komory (19). S ohledem na svůj invazivní charakter a nedořešené metodologické problémy však není zatím rozšířena a doporučena. Otázku výběru nemocných indikovaných k echokardiografickému a následně katetrizačnímu vyšetření, řeší velmi komplexně, s vysokou senzitivitou a klinickými důkazy podpořený algoritmus vycházející z DETECT study (20), a který kvantitativně hodnotí několik laboratorních, funkčních a echokardiografických parametrů. Existují však i omezení použití DETECT algoritmu, který byl primárně vyvinut na pacientech se SSc ve vysokém riziku rozvoje PAH (DLCO% < 60 %, více než 3 roky trvání choroby) zahrnutých do studie, a rovněž v klinické praxi nemusí být vždy dostupné všechny vstupní parametry nezbytné ke kalkulaci DETECT skóre.
PAH není však jediným typem plicní hypertenze, který se u nemocných se SSc může vyskytnout, i když vzhledem k povaze onemocnění stojí v popředí zájmu. V úvahu přichází zejména postkapilární, případně smíšená, plicní hypertenze v důsledku těžšího postižení systolické nebo diastolické funkce levé komory, popř. v souvislosti s retencí tekutin u nemocných užívajících např. kortikoidy. Hodnoty echokardiografického odhadu PASP v našem souboru nekorelovaly s parametry systolické či diastolické funkce levé komory, což svědčí pro podíl prekapilární komponenty u nemocných se systémovou sklerodermií. Současně mezi katetrizovanými pacienty nebyl prokázán případ postkapilární plicní hypertenze.
Širokou komplexní problematiku jednotlivých typů plicní hypertenze nově detailně shrnují aktualizovaná doporučení Evropské kardiologické společnosti (21).
Speckle tracking echokardiografie byla vyvinuta k hodnocení regionální funkce myokardu, našla uplatnění v aplikacích při hodnocení zejména levé komory. Funkce pravé komory je nepochybně dotčena s rozvojem a progresí plicní hypertenze. STE pravé komory v zavedené echokardiografické laboratoři tak může sloužit k získání užitečné doplňující informace v rámci komplexního neinvazivního vyšetření pacientů v riziku plicní hypertenze. Tato metoda však dosud zdaleka není součástí běžného echokardiografického vyšetření. Přínos globálního longitudinálního strainu pomocí speckle trackingu v diagnostice plicní hypertenze byl v současné době doložen v několika pracích. Freed a spol. popsali u 30 pacientů s plicní hypertenzí korelaci longitudinálního strainu pravé komory s její ejekční frakcí, vypočtenou z vyšetření magnetickou rezonancí (22). Ikeda a spol. označili vrcholový systolický strain pravé komory jako nezávislý faktor spojený se středním tlakem v plicnici (MPAP, mean pulmonary artery pressure) >/= 35 mmHg, měřeným při pravostranné katetrizaci (23). Jeho cut-off hodnota vrcholového systolického strainu 20,75 % byla blízká i cut-off hodnotě zjištěné v naší práci. Zavedené, tkáňovým dopplerem (TDI) snadno měřitelné parametry funkce pravé komory, jako systolická exkurze trikuspidálního anulu (TAPSE) a systolická rychlost trikuspidálního anulu (S Tri TDI) v naší práci potvrdily dobrou korelaci s PASP stanoveném echokardiograficky, stejně jako s PASPcath katetrizované podskupině. Zjištění předkládané práce jsou také v souladu s výsledky nově publikované práce Focardiho a spol., ve které jak konvenční (TAPSE, S-Tri TDI, RV-FAC), tak novější (strain pravé komory) parametry byly porovnávány s vyšetřením magnetickou rezonancí srdce. V této práci se však nejednalo o nemocné se systémovým onemocněním (24).
Z laboratorních ukazatelů byl NT-pro BNP nejsilnějším parametrem v předpovědi i plicní hypertenze; v ROC (Receiver operating characteristic) analýze vykazovala cut-off hodnota pro NT-proBNP 229,2 ng/l nejlepší poměr mezi specificitou a senzitivitou. Ve studiích hodnotících NT-proBNP v diagnostice plicní arteriální hypertenze u systémových chorob pojiva, byla stanovena hodnota cut-off > 236 pg/ml se specificitou 83–100 % pro PAH (25). Troponin T ani testované autoprotilátky neměly přímý vztah k přítomnosti PAH Anti-Scl-70 autoprotilátky korelovaly s nižší difúzní kapacitou plic a anticentromerové autoprotilátky korelovaly s nižší celkovou kapacitou plic. Grader-Beck a spol. popsali spojitost anti-4S-LacNAc protilátky s vyšší prevalencí plicní hypertenze (26) u systémové sklerodermie, což si zaslouží další výzkum. NT-proBNP a DLCO jsou tedy zatím nejspolehlivější prediktory plicní hypertenze u pacientů se systémovou sklerodermií (27, 28).
V našem souboru byli nemocní s MCTD významně mladší než nemocní se sklerodermií. Difúzní forma systémové sklerodermie byla spojena se významně horšími hodnotami celkové i difúzní kapacity plic v porovnání s limitovanou formou systémové sklerodermie či MCTD. To odpovídá dokumentované vyšší incidenci plicního postižení u difúzní formy systémové sklerodermie (29). Kromě globálního longitudinálního strainu pravé komory, který byl nižší u difúzní formy (p = 0,046), nebyly v echokardiografických parametrech pozorovány jiné signifikantní rozdíly mezi difúzní a limitovanou formou systémové sklerodermie a smíšeným onemocněním pojiva.
Limitací práce může být, že ne všichni nemocní byli katetrizováni. Plicní hypertenze v naší práci nebyla při katetrizaci potvrzena u 3 symptomatických nemocných, kteří mezi nemocnými v pásmu možné plicní hypertenze měli při echokardiografii nejvyšší odhad PASP v dané kategorii (kategorie 2). Vzhledem k tomuto zjištění nebylo na zbylé asymptomatické pacienty, kteří váhali se souhlasem k invazivnímu vyšetření a kteří vykazovali pouze nadhraniční hodnoty PASP, pro účely studie naléháno.
Závěr
Pravidelný skrínink plicní arteriální hypertenze je důležitou součástí dispenzární péče o pacienty se systémovou sklerodermií. Pravostranná katetrizace ve specializovaném centru nadále zůstává zlatým standardem v diagnostice PAH, nezbytným k potvrzení diagnózy před rozhodnutím o zahájení specifické léčby PAH, ovlivňující přežití nemocných. Echokardiografie je klíčovou metodou při skríninku. Výpočet strainu volné stěny pravé komory metodou speckle trackingu pak užitečným doplňkem. Limitací metody je požadavek získání kvalitního echokardiografického obrazu pravé komory s nutností dodatečného softwarového zpracování obrazových dat a zatím zejména absence validovaných referenčních hodnot, které se mohou lišit i mezi jednotlivými softwarovými platformami. Další výzkum na tomto poli, jakož i pokračující vývoj echokardiografického softwaru přinesou zřejmě odpovědi na otázky ohledně širšího uplatnění této metody.
Podpořeno: Grant 15-28659A
Adresa pro korespondenci:
Prof. MUDr. Pavel Horák, CSc.
3. interní klinika – NRE, LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
horakp@fnol.cz
603 449 567
Sources
1. Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher MD, Chandrasekaran K, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr 2010; 23(7): 685–713.
2. Khanna D, Gladue H, Channick R, Chung L, Distler O, Furst DE, et al. Recommendations for screening and detection of connective tissue disease-associated pulmonary arterial hypertension. Arthritis Rheum 2013; 65(12): 3194–201.
3. Spethmann S, Rieper K, Riemekasten G, Borges AC, Schattke S, Burmester GR, et al. Echocardiographic follow-up of patients with systemic sclerosis by 2D speckle tracking echocardiography of the left ventricle. Cardiovasc Ultrasound 2014; 12 : 13.
4. Durmus E, Sunbul M, Tigen K, Kivrak T, Ozen G, Sari I, et al. Right ventricular and atrial functions in systemic sclerosis patients without pulmonary hypertension: Speckle-tracking echocardiographic study. Herz 2014; 40(4): 709–15.
5. Mondillo S, Galderisi M, Mele D, Cameli M, Lomoriello VS, Zaca V, et al. Speckle-tracking echocardiography: a new technique for assessing myocardial function. J Ultrasound Med 2011; 30(1): 71–83.
6. Bečvář R, Soukup T, Štork J, Suchý D, Němec P, Jansa P, et al. Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie. Čes Revmatol 2014; 22(2): 51–68.
7. van den Hoogen F, Khanna D, Fransen J, Johnson SR, Baron M, Tyndall A, et al. 2013 classification criteria for systemic sclerosis: an American college of rheumatology/European league against rheumatism collaborative initiative. Ann Rheum Dis 2013; 72(11): 1747–55.
8. Galie N, Hoeper MM, Humbert M, Torbicki A, Vachiery JL, Barbera JA, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension: the Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009; 30(20): 2493–537.
9. Hachulla E, Clerson P, Airò P, Cuomo G, Allanore Y, Caramaschi P, et al. Value of systolic pulmonary arterial pressure as a prognostic factor of death in the systemic sclerosis EUSTAR population. Rheumatology (Oxford) 2015; 54(7): 1262–9.
10. Chung L, Farber HW, Benza R, Miller DP, Parsons L, Hassoun PM, et al. Unique Predictors of Mortality in Patients With Pulmonary Arterial Hypertension Associated With Systemic Sclerosis in the Reveal Registry. Chest 2014; 146(6): 1494-504.
11. Chung L, Domsic RT, Lingala B, Alkassab F, Bolster M, Csuka ME, et al. Survival and predictors of mortality in systemic sclerosis-associated pulmonary arterial hypertension: outcomes from the pulmonary hypertension assessment and recognition of outcomes in scleroderma registry. Arthritis Care Res 2014; 66(3): 489–95.
12. Mukerjee D, St George D, Coleiro B, Knight C, Denton CP, Davar J, et al. Prevalence and outcome in systemic sclerosis associated pulmonary arterial hypertension: application of a registry approach. Ann Rheum Dis 2003; 62(11): 1088–93.
13. Avouac J, Airo P, Meune C, Beretta L, Dieude P, Caramaschi P, et al. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies. J Rheumatol 2010; 37(11): 2290–8.
14. Iudici M, Codullo V, Giuggioli D, Riccieri V, Cuomo G, Breda S, et al. Pulmonary hypertension in systemic sclerosis: prevalence, incidence and predictive factors in a large multicentric Italian cohort. Clin Exp Rheumatol 2013; 31(Suppl 76): 31-6.
15. Jansa P, Becvar R, Ambroz D, Palecek T, Tomcik M, Skacelova S, et al. Pulmonary arterial hypertension associated with systemic sclerosis in the Czech Republic. Clin Rheumatol 2012; 31(3): 557–61.
16. Codullo V, Caporali R, Cuomo G, Ghio S, D'Alto M, Fusetti C, et al. Stress Doppler echocardiography in systemic sclerosis: evidence for a role in the prediction of pulmonary hypertension. Arthritis Rheum 2013; 65(9): 2403–11.
17. Tolle JJ, Waxman AB, Van Horn TL, Pappagianopoulos PP, Systrom DM. Exercise-induced pulmonary arterial hypertension. Circulation 2008; 118(21): 2183–9.
18. Saggar R, Khanna D, Furst DE, Shapiro S, Maranian P, Belperio JA, et al. Exercise-induced pulmonary hypertension associated with systemic sclerosis: four distinct entities. Arthritis Rheum 2010; 62(12): 3741–50.
19. Hager WD, Collins I, Tate JP, Azrin M, Foley R, Lakshminarayanan S, et al. Exercise during cardiac catheterization distinguishes between pulmonary and left ventricular causes of dyspnea in systemic sclerosis patients. Clin Respir J 2013; 7(3): 227–36.
20. Coghlan JG, Denton CP, Grünig E, Bonderman D, Distler O, Khanna D, et al. Evidence-based detection of pulmonary arterial hypertension in systemic sclerosis: the DETECT study. Ann Rheum Dis 2014; 73(7): 1340–9.
21. Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher MD, Chandrasekaran K, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr 2010; 23(7): 685–713.
22. Khanna D, Gladue H, Channick R, Chung L, Distler O, Furst DE, et al. Recommendations for screening and detection of connective tissue disease-associated pulmonary arterial hypertension. Arthritis Rheum 2013; 65(12): 3194–201.
23. Spethmann S, Rieper K, Riemekasten G, Borges AC, Schattke S, Burmester GR, et al. Echocardiographic follow-up of patients with systemic sclerosis by 2D speckle tracking echocardiography of the left ventricle. Cardiovasc Ultrasound 2014; 12 : 13.
24. Durmus E, Sunbul M, Tigen K, Kivrak T, Ozen G, Sari I, et al. Right ventricular and atrial functions in systemic sclerosis patients without pulmonary hypertension: Speckle-tracking echocardiographic study. Herz 2014; 40(4): 709–15.
25. Mondillo S, Galderisi M, Mele D, Cameli M, Lomoriello VS, Zaca V, et al. Speckle-tracking echocardiography: a new technique for assessing myocardial function. J Ultrasound Med 2011; 30(1): 71-83.
26. Bečvář R, Soukup T, Štork J, Suchý D, Němec P, Jansa P, et al. Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie. Čes Revmatol 2014; 22(2): 51–68.
27. van den Hoogen F, Khanna D, Fransen J, Johnson SR, Baron M, Tyndall A, et al. 2013 classification criteria for systemic sclerosis: an American college of rheumatology/European league against rheumatism collaborative initiative. Ann Rheum Dis 2013; 72(11): 1747–55.
28. Galie N, Hoeper MM, Humbert M, Torbicki A, Vachiery JL, Barbera JA, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension: the Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009; 30(20): 2493–537.
29. Hachulla E, Clerson P, Airò P, Cuomo G, Allanore Y, Caramaschi P, et al. Value of systolic pulmonary arterial pressure as a prognostic factor of death in the systemic sclerosis EUSTAR population. Rheumatology (Oxford) 2015; 54(7): 1262–9.
30. Chung L, Farber HW, Benza R, Miller DP, Parsons L, Hassoun PM, et al. Unique Predictors of Mortality in Patients With Pulmonary Arterial Hypertension Associated With Systemic Sclerosis in the Reveal Registry. Chest 2014; 146(6): 1494–504.
31. Chung L, Domsic RT, Lingala B, Alkassab F, Bolster M, Csuka ME, et al. Survival and predictors of mortality in systemic sclerosis-associated pulmonary arterial hypertension: outcomes from the pulmonary hypertension assessment and recognition of outcomes in scleroderma registry. Arthritis Care Res 2014; 66(3): 489–95.
32. Mukerjee D, St George D, Coleiro B, Knight C, Denton CP, Davar J, et al. Prevalence and outcome in systemic sclerosis associated pulmonary arterial hypertension: application of a registry approach. Ann Rheum Dis 2003; 62(11): 1088–93.
33. Avouac J, Airo P, Meune C, Beretta L, Dieude P, Caramaschi P, et al. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies. J Rheumatol 2010; 37(11): 2290–8.
34. Iudici M, Codullo V, Giuggioli D, Riccieri V, Cuomo G, Breda S, et al. Pulmonary hypertension in systemic sclerosis: prevalence, incidence and predictive factors in a large multicentric Italian cohort. Clin Exp Rheumatol 2013; 31(Suppl 76): 31–6.
35. Jansa P, Becvar R, Ambroz D, Palecek T, Tomcik M, Skacelova S, et al. Pulmonary arterial hypertension associated with systemic sclerosis in the Czech Republic. Clin Rheumatol 2012; 31(3): 557–61.
36. Codullo V, Caporali R, Cuomo G, Ghio S, D'Alto M, Fusetti C, et al. Stress Doppler echocardiography in systemic sclerosis: evidence for a role in the prediction of pulmonary hypertension. Arthritis Rheum 2013; 65(9): 2403–11.
37. Tolle JJ, Waxman AB, Van Horn TL, Pappagianopoulos PP, Systrom DM. Exercise-induced pulmonary arterial hypertension. Circulation 2008; 118(21): 2183–9.
38. Saggar R, Khanna D, Furst DE, Shapiro S, Maranian P, Belperio JA, et al. Exercise-induced pulmonary hypertension associated with systemic sclerosis: four distinct entities. Arthritis Rheum 2010; 62(12): 3741–50.
39. Hager WD, Collins I, Tate JP, Azrin M, Foley R, Lakshminarayanan S, et al. Exercise during cardiac catheterization distinguishes between pulmonary and left ventricular causes of dyspnea in systemic sclerosis patients. Clin Respir J 2013; 7(3): 227–36.
40. Coghlan JG, Denton CP, Grünig E, Bonderman D, Distler O, Khanna D, et al. Evidence-based detection of pulmonary arterial hypertension in systemic sclerosis: the DETECT study. Ann Rheum Dis 2014; 73(7): 1340–9.
41. Galiè N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS)Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J [First published online] 2015 Aug 29. Available from http://dx.doi.org/10.1093/eurheartj/ehv317.
42. Freed BH, Tsang W, Bhave NM, Patel AR, Weinert L, Yamat M, et al. Right Ventricular Strain in Pulmonary Arterial Hypertension: A 2D Echocardiography and Cardiac Magnetic Resonance Study. Echocardiography 2015; 32(2): 257–63.
43. Ikeda S, Tsuneto A, Kojima S, Koga S, Nakata T, Yoshida T, et al. Longitudinal strain of right ventricular free wall by 2-dimensional speckle-tracking echocardiography is useful for detecting pulmonary hypertension. Life Sci 2014; 111(1-2): 12–7.
44. Focardi M, Cameli M, Carbone SF, Massoni A, De Vito R, Lisi M, et al. Traditional and innovative echocardiographic parameters for the analysis of right ventricular performance in comparison with cardiac magnetic resonance. Eur Heart J Cardiovasc Imaging 2015; 16(1): 47–52.
45. Gladue H, Altorok N, Townsend W, McLaughlin V, Khanna D. Screening and diagnostic modalities for connective tissue disease-associated pulmonary arterial hypertension: a systematic review. Semin Arthritis Rheum 2014; 43(4): 536–41.
46. Grader-Beck T, Boin F, von Gunten S, Smith D, Rosen A, Bochner BS. Antibodies recognising sulfated carbohydrates are prevalent in systemic sclerosis and associated with pulmonary vascular disease. Ann Rheum Dis 2011; 70(12): 2218–24.
47. Allanore Y, Borderie D, Avouac J, Zerkak D, Meune C, Hachulla E, et al. High N-terminal pro-brain natriuretic peptide levels and low diffusing capacity for carbon monoxide as independent predictors of the occurrence of precapillary pulmonary arterial hypertension in patients with systemic sclerosis. Arthritis Rheum 2008; 58(1): 284–91.
48. Thakkar V, Stevens W, Prior D, Youssef P, Liew D, Gabbay E, et al. The inclusion of N-terminal pro-brain natriuretic peptide in a sensitive screening strategy for systemic sclerosis-related pulmonary arterial hypertension: a cohort study. Arthritis Res Ther 2013; 15(6): R193.
49. Nihtyanova SI, Tang EC, Coghlan JG, Wells AU, Black CM, Denton CP. Improved survival in systemic sclerosis is associated with better ascertainment of internal organ disease: a retrospective cohort study. QJM 2010; 103(2): 109–15.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2015 Issue 4-
All articles in this issue
- Vztah revmatických chorob a jejich léčby k manifestnímu postižení ledvin
- Sérové biomarkery u axiálních spondyloartritid
- Deformační analýza pravé komory pomocí speckle tracking echokardiografie v diagnostice plicní arteriální hypertenze u pacientů se systémovou sklerodermií a smíšeným onemocněním pojiva
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vztah revmatických chorob a jejich léčby k manifestnímu postižení ledvin
- Sérové biomarkery u axiálních spondyloartritid
- Deformační analýza pravé komory pomocí speckle tracking echokardiografie v diagnostice plicní arteriální hypertenze u pacientů se systémovou sklerodermií a smíšeným onemocněním pojiva
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

