-
Medical journals
- Career
Sérové biomarkery u axiálních spondyloartritid
: K. Grobelná; K. Pavelka; L. Šenolt
: Revmatologická klinika 1. LF UK Praha ; Revmatologický ústav Praha
: Čes. Revmatol., 23, 2015, No. 4, p. 146-162.
: Review Article
U pacientů s axiální spondyloartritidou (axSpA) je nedostatek spolehlivých ukazatelů, které by měly vypovídající hodnotu při hodnocení rizika vzniku, aktivity nebo progrese onemocnění, případně odpovědi na léčbu, a zároveň by se daly jednoduše a levně měřit. Existuje mnoho studií zabývajících se detekcí právě takovýchto markerů. Do souvislosti se zvýšeným nebezpečím propuknutí nemoci je nejčastěji dáván antigen HLA-B27, slibně se ukazují i některé varianty genu pro aminopeptidázu endoplazmatického retikula – 1 (ERAP1). V rámci hodnocení aktivity, možné radiografické progrese či odpovědi na anti-TNFα terapii bývají biomarkery obvykle tříděny do dvou hlavních skupin. Jedná se o biomarkery, které mají vztah k zánětlivému procesu anebo k metabolismu kloubních tkání. C-reaktivní protein (CRP) spolu se sedimentací erytrocytů (FW) jsou základní oporou skupiny markerů reflektující zánětlivou aktivitu, mají však nízkou senzitivitu a specificitu. Za ukazatele zánětlivé aktivity lze považovat také sérový amyloid (SAA) nebo interleukin-6 (IL-6), metaloproteináza-3 (MMP-3) a další markery jako calprotectin (S100A8/A9), dickkopf-1 (DKK-1) nebo cytotoxický s T-lymfocyty asociovaný protein 4 (sCTLA-4), případně degradační peptid kolagenu typu III (C3M). Potenciálními prediktory radiografické progrese je kromě MMP-3 například sclerostin, DKK-1 nebo některé kostní morfogenní proteiny (BMP-2 a 4). Dobrou odpověď na léčbu můžeme předpokládat zejména u pacientů s vyššími hodnotami reaktantů akutní fáze a již přítomným strukturálním poškozením páteře. Biomarkerů asociovaných s axSpA vychází ze studií velké množství, díky nim jsme schopni nahlédnout alespoň částečně do patogeneze tohoto onemocnění a určit další možné přístupy k léčbě. Většina studií má však své limitace jako například nedostatečné množství pacientů ve zkoumaných kohortách, rozdílné standardy a techniky pro stanovení biomarkerů v séru a v neposlední řadě chybějící multivariační analýzy. Cílem této práce bylo vypracování přehledu dostupných sérových laboratorních markerů asociovaných s axSpA.
Klíčová slova:
biomarker, spondyloartritidy, ankylozující spondylitida
Spondyloartritidy (SpA) patří mezi zánětlivá revmatická onemocnění postihující páteř, ale často také velké, někdy i malé klouby. Onemocnění bývá asociováno s rozvojem entezitidy, daktylitidy a jiných mimokloubních manifestací, jako jsou například uveitida, psoriáza nebo nespecifické střevní záněty. Samotnou skupinu spondyloartritid můžeme rozdělit dle lokalizace zánětlivého postižení na formu axiální, s preferenčním postižením osového skeletu, a formu periferní, napadající klouby končetin. Axiální spondyloartritidy (axSpA) lze dále dělit na ankylozující spondylitidu (AS) a na tzv. neradiografickou axiální spondyloartritidu (nr-axSpA) dle nálezů zobrazovacích metod (obr. 1) (1). Pro diagnózu AS musí pacient splňovat New Yorská kritéria, obsahující radiografické znaky sakroiliitidy. Pacienti s nr-axSpA nemají radiograficky průkaznou sakroiliitidu, ale lze je diagnostikovat pomocí kritérií pracovní skupiny ASAS (Assessment of SpondyloArthritis international Society)(2). Dle těchto kritérií musí mít pacient nález na magnetické rezonanci odpovídající aktivní sakroiliitidě a k tomu jeden typický klinický příznak (tzv. zobrazovací větev), nebo pozitivní antigen HLA-B27 a dva typické příznaky.
1. Klasifikace spondyloartritid (1) 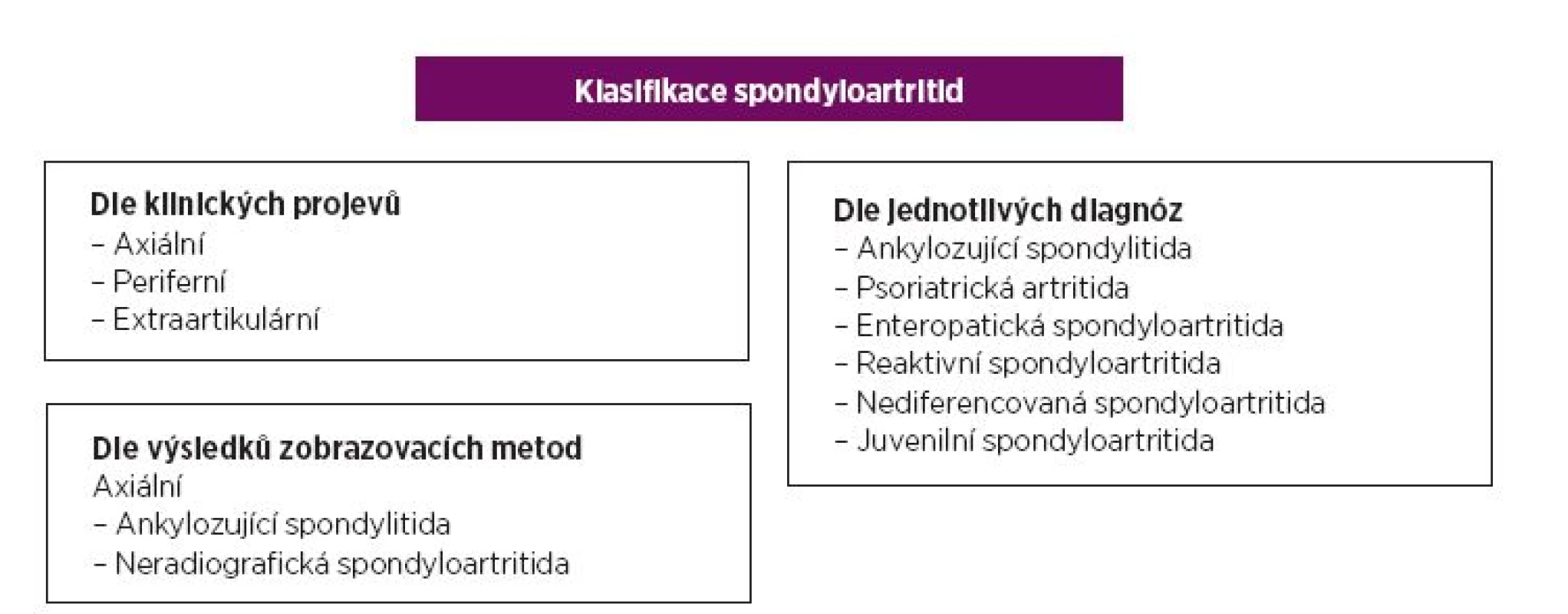
Ankylozující spondylitida (známá též jako Bechtěrevova choroba) se vyskytuje v Evropě s prevalencí 0,1–1,5 % a postihuje 2–3krát častěji muže než ženy. Obvykle začíná mezi 25. až 30. rokem jako nespecifická, pomalu progredující bolest v zádech, probouzející pacienta v noci a zlepšující se po rozcvičení. Vzhledem k široké diferenciální diagnóze bolestí zad a dlouhému časovému úseku k detekci prvních radiografických změn bývá diagnóza tohoto onemocnění opožděna zhruba o 6–9 let (3). Z prognostického hlediska se jedná o chorobu potenciálně invalidizující. Proto je kladen důraz na včasnou diagnostiku, rychlé zahájení léčby a snížení aktivity nemoci na minimum (4).
Jednou z možností dosažení zmíněných cílů je využití biomarkerů asociovaných s tímto onemocněním. Biomarkerem se rozumí objektivně měřitelný a hodnotitelný indikátor normálních biologických procesů, patologických stavů nebo farmakologické odpovědi na terapeutickou intervenci (5). Biomarkery lze rozdělit na diagnostické, biomarkery aktivity onemocnění, prognózy a odpovědi na léčbu.
Biomarkery zvýšeného rizika vzniku onemocnění
Zvýšené riziko vzniku onemocnění existuje v rodinách pacientů s AS. Dřívější teorie o silném genetickém podkladu podpořily studie v rámci takto postižených rodin, při kterých se riziko zvyšuje pro sourozence zhruba padesátkrát oproti všeobecnému populačnímu riziku (6). Samotná dědičnost AS je nyní odhadována na 95 % (7).
Hlavním genem podezřelým s asociací s onemocněním je HLA-B27 (human leukocyte antigen B27). Tento gen kóduje glykoprotein schopný vázat peptidové fragmenty jiných proteinů pohlcených či produkovaných buňkou a vystavovat je na buněčném povrchu. Existuje mnoho jeho subtypů, z nichž některé jeví silnou (B*2704, 2705), slabou (B*2703) nebo naopak protektivní asociaci s AS (B*2709) (8–11). Přestože je prokázáno silné spojení mezi HLA-B27 a onemocněním AS, pouze asi 2 % nosičů nemoc plně vyvine (12, 13). Tento poznatek rozproudil diskusi o existenci dalších genů, které se na vzniku AS mohou podílet. Z dalších podezřelých lokusů v HLA-B skupině je třeba zmínit B60, jehož nosiči mají prokazatelně vyšší riziko vzniku nemoci (14). Kromě těchto skupin v rámci HLA existuje evidence o dalších genech komplexu suspektních z asociace s AS, jako jsou například geny haplotypu DPA1 (DPA1*01 a DPA1*02) (15) nebo DRB1, které se zdají být nezávislé na B27, avšak jejich konkrétní typy nebyly dosud plně determinovány pro obtížnou replikaci asociací individuálních alel v různých populacích. Nicméně některé práce již poukazují na haplotypy (DRB1*03, DRB1*04 a DRB1*07) s možnou asociací s onemocněním (16, 17).
V mnoha studiích byl prokázán pozitivní záchyt genových variant pro aminopeptidázu endoplazmatického retikula 1 a 2 (ERAP1, ERAP2), případně dalších peptidáz (LNPEP (Leucyl/cystinyl Aminopeptidase) a NPEPPS (Aminopeptidase Puromycin-sensitive) (18,19). ERAP1 je cytoplazmatický protein účastnící se zapracování ligandů do struktury MHC-I (Major Histocompatibility Complex – I) (20) Relativní atributivní riziko vzniku AS pro ERAP1 je asi 25%, což ho spolu s HLA-B27 (50%) činí nejvyššími rizikovými faktory vzniku nemoci (21). Zajímavé je, že asociace ERAP1 je omezena pouze na HLA-B27 pozitivní pacienty oproti genu pro ERAP2, u kterého existuje tendence k propuknutí choroby bez přítomnosti HLA-B27 (19).
Z dalších non-MHC genů se slibně ukazují některé genové varianty související s interleukin (IL)-23 signální kaskádou, kdy se určité asociace s onemocněním prokázaly jednak pro samotný receptor, ale i pro molekuly přenášející aktivační signál do jádra buňky (Janus Kinase 2, Signal Transducer and Activator of Transcription3, Tyrosine Kinase 2 (JAK2, STAT3, TYK2)) (19, 22, 23). Receptor IL-23 je exprimovaný na velkém množství buněk včetně Th-17 lymfocytů, kde podporuje jejich diferenciaci a zvýšenou produkci IL-17, cytokinu usnadňujícího sekreci dalších prozánětlivých faktorů, např. IL-6, IL-8 nebo tumor nekrotizujícího faktoru-α (TNFα) (24). U AS bylo nadměrné množství Th-17 lymfocytů spolu se zvýšenými sérovými hladinami IL-17 popsáno již dříve (25, 26).
Mezi ostatními kandidátními geny se často zmiňují geny v rámci IL-1 komplexu na chromozomu 2p, avšak studie s nimi vychází prozatím nejednoznačně (27, 28); geny pro proteiny účastnící se ubikvitinizace: UBE2E3 a UBE2L3 (Ubiquitin-conjugating enzyme E2E3 a E2L3) (18); geny ovlivňující T buněčnou linii: EOMES (Eomesodermin), IL-7R, RUNX3 (Runt-related Transcription Factor 3), a ZM1Z1 (Zinc finger, MIZ-type Containing 1) pro CD8+ a BACH2 (Basic Leucine Zipper Transcription Factor 2), SH2B3 (SH2B Adaptor Protein 3) pro CD4+; varianty pro receptory asociované s G proteiny: GPR35, GPR37, GPR65, GPR25 (G Protein-coupled Receptor). Jejich účast v patogenezi AS však není stále zcela objasněna (18, 19). Nově se objevují i studie s ANTXR2 (Anthrax Toxin Receptor 2) genem, kde byly různé jednonukleotidové polymforfismy (SNP) asociovány s HLA-B27 pozitivními i negativními jedinci (22, 29). V dalších studiích na Americkém populačním vzorku s AS bylo potvrzeno zvýšené sdílení genového úseku pro ANKH (ANKH Inorganic Pyrophosphate Transport Regulator), který je součástí membránového transportního systému pro pyrofosfát, hrajícího velkou roli při mineralizaci a kostní formaci. U mužů se prokázal i typ AS s asociací k variantě genu pro TNAP (TRAFs And NIK-Associated Protein) (30, 31) Přestože velké studie (kupříkladu genom-wide association study (GWAS) (tab. 1)) zabývající se identifikací dalších polymorfismů detekovaly kromě již zmiňovaných i další (např. KIF21B, 2p15, IL12B, LTBR-TNFRSF1A a 21q22, PTGER4, CARD9 a TBKBP1), je zatím objasněno asi jen 24 % dědičnosti AS.
1. Souhrn genů suspektních z asociace s ankylozující spondylitidou identifikovaných pomocí metody celogenomové asociační studie (genome-wide association studies; GWAS) (19-22). 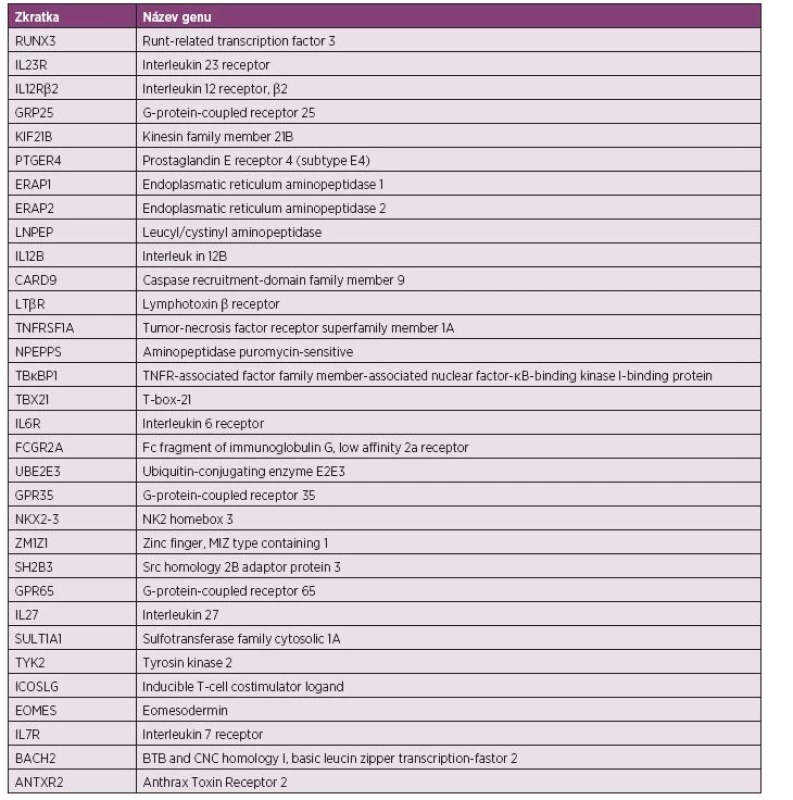
Biomarkery aktivity onemocnění
V běžné klinické praxi se aktivita onemocnění nejčastěji hodnotí pomocí hladin laboratorních ukazatelů zánětu. Pro indikaci biologické léčby a monitorování účinnosti terapie je hojně využíván index BASDAI (Bath Ankylosing Apondylitis Disease Activity Index). Lepším ukazatel aktivity onemocnění se zdá být ASDAS (Ankylosing Spondylitis Disease Aktivity Score). Jedná se o kombinaci některých komponent BASDAI (bolest páteře, periferních kloubů nebo ranní ztuhlost) a navíc celkového hodnocení pacientem spolu s reaktanty akutní fáze (32).
V posledních letech se rozšiřuje používání magnetické rezonance (MR). Aktivní sakroiliitida koreluje se stupněm zánětlivého postižení hodnoceného histopatologickým vyšetřením sakroiliakálních skloubení (33). Nové potenciální sérové biomarkery bývají vztahovány právě k výše zmíněným parametrům. Můžeme je rozdělit na biomarkery přímo a nepřímo reflektující zánětlivou aktivitu (tab. 2–4).
2. Dělení biomarkerů reflektujících zánětlivou aktivitu (36). 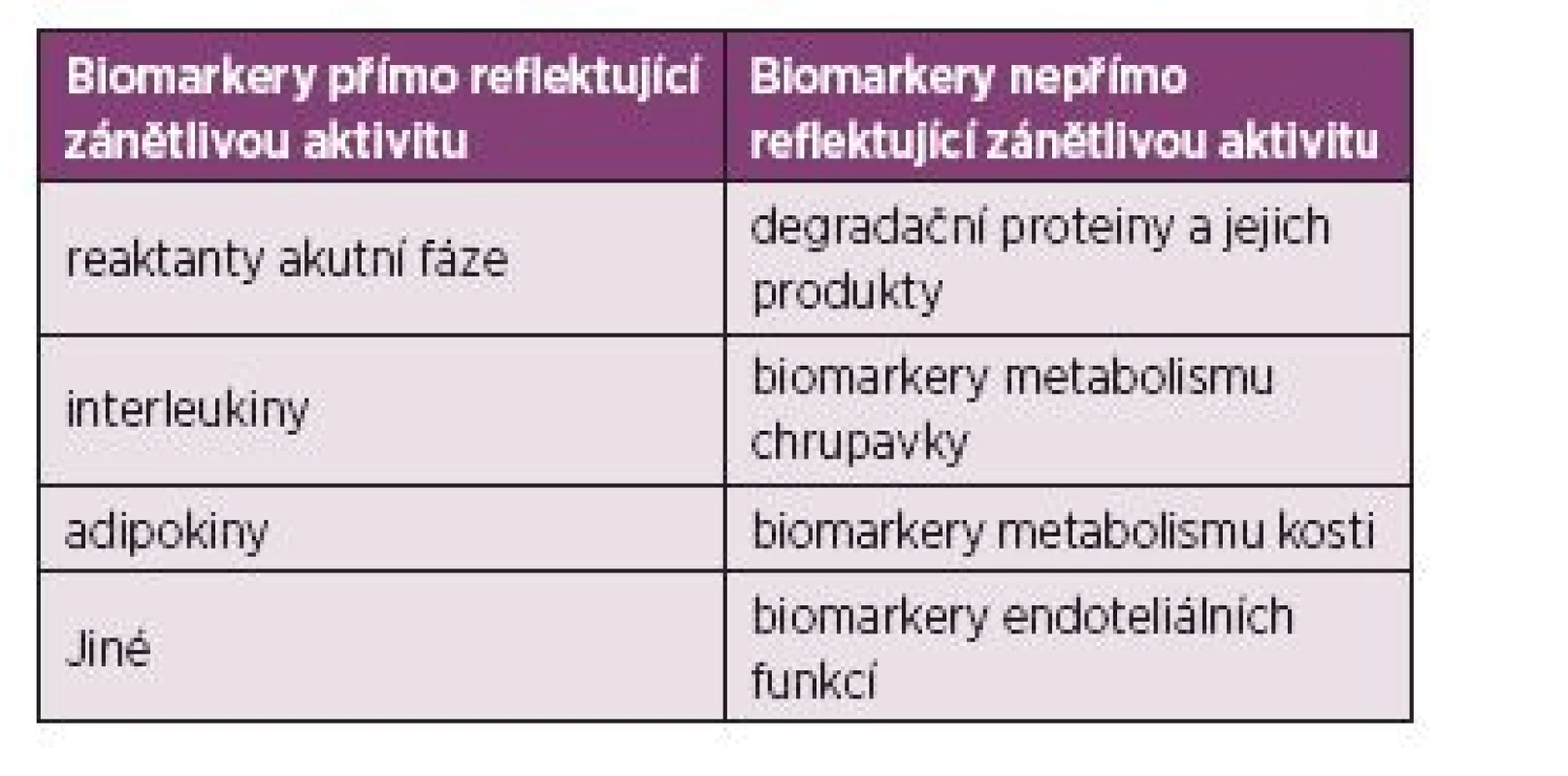
3. Přehled přímých zánětlivých biomarkerů, jejich sérové hladiny a korelace s aktivitou onemocnění u pacientů s ankylozující spondylitidou (34-62 64-70). 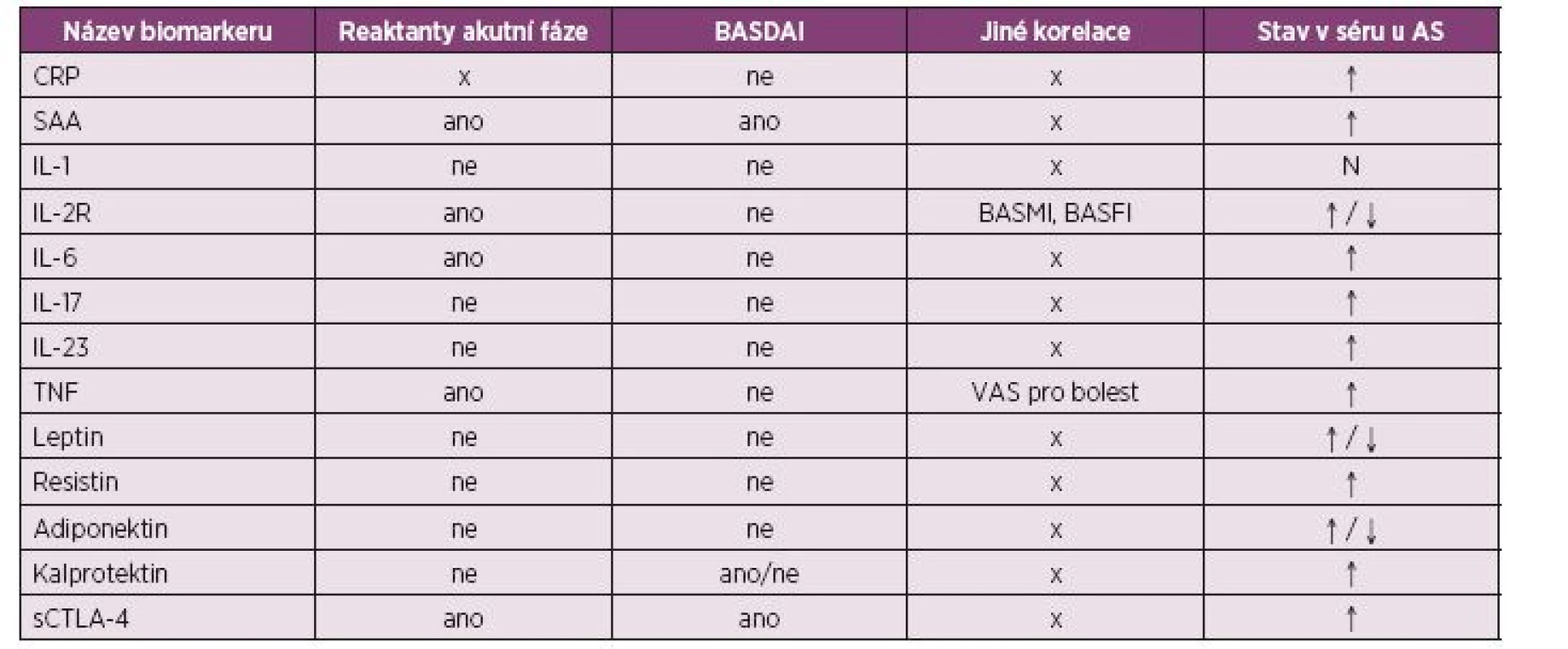
Zkratky: AS – ankylozující spondylitida; BASDAI – Bath Ankylosing Spondylitis Disease Activity Index; BASMI - Bath Ankylosing Spondylitis Metrology Index; BASFI - Bath Ankylosing Spondylitis Functional Index; CRP – C reaktivní protein; FW – sedimentace erytrocytů; IL – interleukin; IL-2R – receptor pro interleukin 2; RAF – reaktanty akutní fáze; SAA – sérový amyloid; sCTLA-4 – solubilní cytotoxický s T-lymfocyty asociovaný protein 4; TNF – tumor nekrotizující faktor; VAS – vizuální analogová škála; ↑ - zvýšení; ↓ - snížení 4. Přehled biomarkerů nepřímo reflektujících zánětlivou aktivitu, jejich sérové hladiny a korelace s aktivitou onemocnění u pacientů s ankylozující spondylitidou (71-78,80-103). 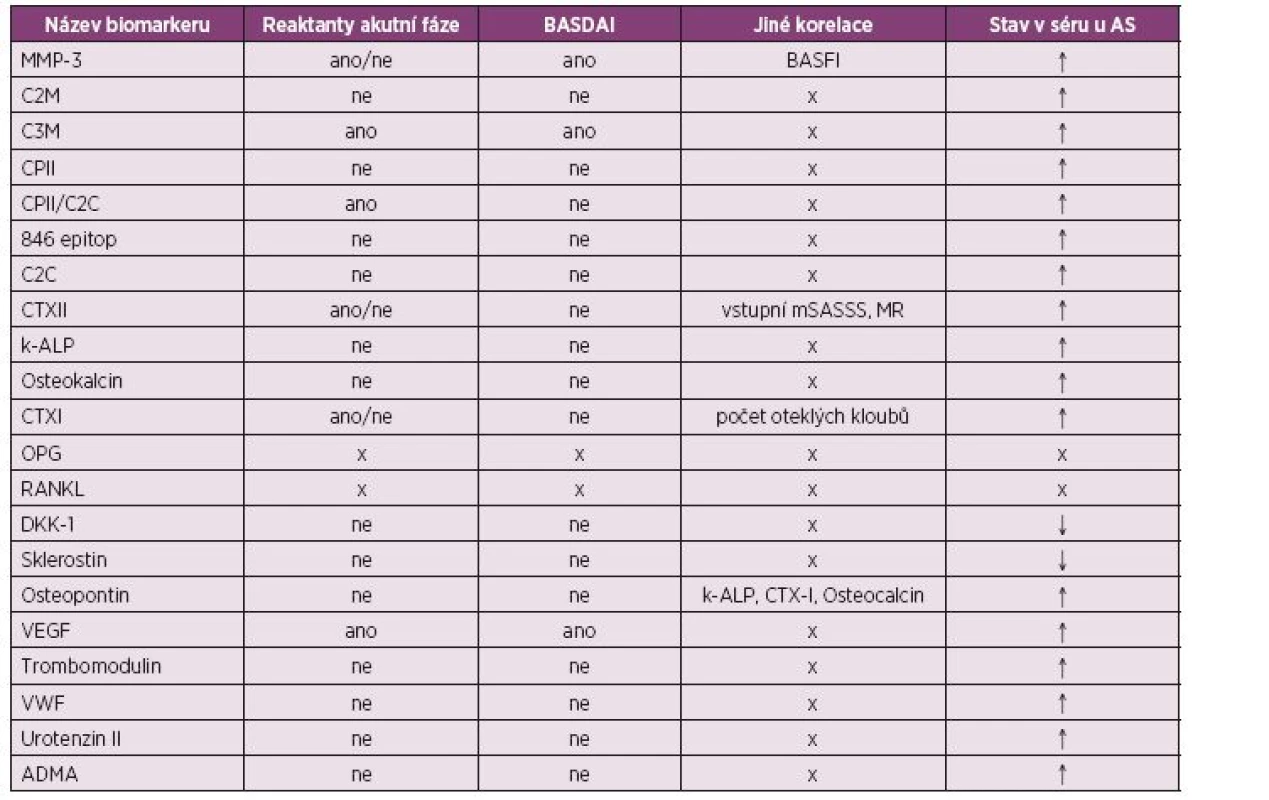
Zkratky: 846 epitop - 846 epitop postranního řetězce chondroitin sulfátu; ADMA – asymetrický dimetylarginin; AS – ankylozující spondylitida; BASDAI – Bath Ankylosing Spondylitis Disease Activity Index; BASFI - Bath Ankylosing Spondylitis Functional Index; C2C, C2M – degradační produkty kolagenu II; C3M – degradační produkt kolagenu III; CPII – C-propeptid kolagenu II; CPII/C2C – poměr mezi CPII a C2C; CRP – C reaktivní protein; CTX I – C-terminální telopeptid kolagenu I; CTX II – C-terminální telopeptid kolagenu II; FW – sedimentace erytrocytů; DKK-1 – Dikkopf-1; k-ALP – kostní izoforma alkalické fosfatázy; MMP-3 – metaloproteináza 3; mSASSS – Modified Stoke Ankylosing Spondylitis Spine Score; MR – nukleární magnetická rezonance; OPG – osteoprotegerin; RAF – reaktanty akutní fáze; RANKL – receptor activator of nuclear factor; VEGF- vaskulární endoteliální růstový faktor; VWF – von Willebrandův faktor; ↑ - zvýšení; ↓ - snížení Biomarkery přímo reflektující zánět
Reaktanty akutní fáze. C-reaktivní protein (CRP) patří spolu se sedimentací erytrocytů k základním a nejdostupnějším reaktantům akutní fáze. CRP je syntetizován v játrech jako odpověď na velké množství inzultů způsobujících zánět a/nebo tkáňové poškození. Jeho hodnota spolu s hodnotou sedimentace přímo korelují se zánětlivým procesem a jsou tohoto času rutinně využívány i přesto, že postrádají dostatek senzitivity a nekorespondují s BASDAI (34–37). CRP odpovídá stupni zánětlivého postižení hodnoceného dle MR (38) Vzhledem k nedostatečné senzitivitě standardních esejí byly vyvinuty i vysoce senzitivní eseje pro stanovení CRP (hs-CRP), které zvyšují pravděpodobnost zachycení i jeho lehkého nárůstu. Hladina hsCRP má prokazatelně tendenci k vzestupu u osob s výraznějšími klinickými projevy a normálními hodnotami standardního CRP (39, 40).
K dalším reaktantům akutní fáze asociovaných s AS patří sérový amyloid A (SAA). Syntetizuje se také převážně v játrech jako odpověď na zvýšenou koncentraci prozánětlivých cytokinů a byla prokázaná jeho významně vyšší koncentrace u nemocných s AS. Hladina SAA významně korelovala s indexem BASDAI, koncentrací CRP a hodnotou sedimentace erytrocytů. Ve skupině jedinců s nízkými hodnotami reaktantů akutní fáze, ale vyšším indexem BASDAI byla prokázaná vyšší koncentrace SAA. Při porovnávání senzitivity pro AS vycházel proto SAA lépe než tradičně užívané reaktanty akutní fáze (41).
Cytokiny. Velkou skupinou proteinů reflektující zvýšenou zánětlivou aktivitu tvoří cytokiny. Jedná se o regulátory sekretované leukocyty a dalšími buňkami zprostředkovávající interakce mezi buňkami imunitního systému i mimo něj. Mezi prozánětlivé cytokiny spojované s průběhem AS patří IL-1β, IL-2 a jeho solubilní receptor, IL-6, IL-7, IL-17, IL-23 a TNFα (42–44). Z většiny studií vycházely zvýšené sérové koncentrace sIL-2R, IL-6 a TNFα u AS pacientů oproti kontrolní skupině, které zároveň korelovaly s hodnotou sedimentace erytrocytů. Výpovědní hodnota zvýšeného sIL-2R je sporná. Pouze hladiny IL-1β zůstaly téměř vždy na hranici normy. Ze zmíněné skupiny cytokinů pouze IL-6 koreloval s hladinou CRP a sedimentací erytrocytů, BASDAI a zánětlivým skóre dle MR (42, 43, 45, 46). V poslední době se u AS stala předmětem zájmu analýza cytokinů IL-23 a IL-17. Jak již bylo zmíněno, IL-23 podporuje diferenciaci buněk směrem k Th-17 imunitní odpovědi. Přestože nacházíme zvýšené sérové koncentrace obou cytokinů u pacientů s AS (47), studie zatím neprokazují jednoznačně jejich korelaci s aktivitou nemoci či odpovědí na léčbu (44, 48, 49).
Ze sérových proteinů je třeba zmínit ještě sCTLA (soluble Cytotoxic T lymphocyte antigen-4), protein produkovaný T-lymfocyty, a to převážně při jejich aktivaci. CTLA-4 je molekula s úzkým vztahem k CD28. Jeho cílem je vazba na CD80 a CD86 molekuly vedoucí ke snížené regulaci T lymfocytární odpovědi a případné apoptóze. CTLA-4 ovlivňuje odpověď T-lymfocytů a indukuje periferní toleranci, zatímco absence této funkce má prokazatelný vliv na autoimunitní procesy (50-52). Bylo například prokázáno, že zvýšené hladiny sCTLA-4 u SpA pacientů korelují s klinickou aktivitou onemocnění (53). Zajímavé je, že zdravé kontroly s pozitivním antigenem HLAB27 zvýšené sérové hladiny sCTLA-4 nemají (53)
Adipokiny. Jedná se o molekuly tvořené adipocyty a imunitními buňkami, které kromě vlivu na metabolismus a imunitní funkce slouží i jako regulátory kostní hmoty (54). V souvislosti s AS se udává zvýšení jejich sérových hladin, což může ve výsledku zvýšit i nárůst kostní hmoty cestou inhibice osteoklastů nebo stimulace osteoblastů. Leptin jako jeden ze zástupců této skupiny má prozatím u AS nejednoznačné výsledky (55, 56). Resistin je prozánětlivý cytokin tvořený převážně monocyty a makrofágy, který je v séru pacientů s AS přítomen ve zvýšeném množství, ale na rozdíl od RA nekoreluje s CRP, sedimentací erytrocytů nebo BASDAI (57, 58) Adiponektin je produkovaný převážně v adipocytech, ale malé množství této látky tvoří endotelové nebo svalové buňky. Výsledky studií s adiponektinem jsou u AS prozatím nejednoznačné, nicméně pacienti s postižením kyčlí, synovitidou nebo entezitidou, měli zjištěny prokazatelně vyšší hladiny adiponektinu v séru oproti zdravým kontrolám (54, 59, 60). Ghrelin je peptidem tvořícím se hlavně v žaludeční sliznici. Jedná se o endogenní ligand receptoru stimulujícího sekreci růstového hormonu, má protizánětlivý účinek (61) a jeho hladiny byly u AS pacientů proti zdravým kontrolám zvýšené (62), nicméně v další práci se tento nález již nepotvrdil (63).
S100 proteiny. Recentně se objevují i studie zabývající se hodnocením kalprotektinu u AS, jehož elevace nejen v séru, ale i v synoviální tekutině byla již několikrát popsána u pacientů s revmatoidní artritidou (64, 65). Jedná se o nejznámější protein z rodiny S100, je tvořen převážně neutrofily a monocyty v průběhu jejich aktivace a migrace přes endotel do zánětem postižené tkáně (66). Kalprotektin patří mezi tzv. alarminy, látky signalizující poškození tkání a buněk (66, 67). Ty dokáží aktivovat vrozenou imunitu přes Toll-like receptory a vedou ke zvýšené sekreci prozánětlivých cytokinů (68). Podle nejnovější práce koreluje hladina kalprotektinu v séru s aktivitou onemocnění u AS pacientů lépe než samotný CRP (69). Na druhou stranu další práce tyto výsledky nepotvrdila (70).
Biomarkery nepřímo reflektující zánět
Katalytické enzymy. Matrixové metaloproteinázy (MMP) patří mezi jedny z nejvýznamnějších ukazatelů metabolismu pojiva. Jedná se o degradační enzymy extracelulární hmoty sekretované velkým množstvím buněk v kloubu v závislosti na stimulaci cytokiny a jinými regulačními molekulami. Zvýšená sérová hladina zejména MMP-3 u pacientů s AS je známá již dlouho. Samotná korelace MMP-3 a MMP-8 s aktivitou nemoci vychází převážně kladně, i když konkrétní vztahy s aktivitou nemoci se v jednotlivých studiích liší. V jedné z prací byla popsaná senzitivita a specificita záchytu vysoké aktivity nemoci pomocí zvýšené hladiny MMP-3 okolo 70 % (71–74).
Jak již bylo řečeno, MMP se podílejí na degradaci extracelulární hmoty, proto se vyskytly studie měřící degradační produkty vznikající při tomto procesu (75). Typickou součástí extracelulární matrix chrupavky je kolagen typu II, podobně i kolagen typu III tvoří hlavní proteinovou komponentu měkkých tkání. Jejich degradační fragmenty C2M a C3M (matrix metalloproteinase-derived fragments of type II and III collagen) byly nalezeny u AS ve zvýšených koncentracích, přičemž C3M koreloval s hladinou CRP (76).
Biomarkery metabolismu chrupavky. V rámci biomarkerů metabolismu chrupavky rozlišujeme podskupinu markerů syntézy, kam řadíme C-propeptid kolagenu II (CPII) a 846 epitop postranního řetězce chondroitin sulfátu, a markery degradace, kam patří již zmíněný C3M, dále pak marker degradace kolagenu typu II (C2C) a C-telopeptid kolagenu II (CTXII). V jedné práci byla zjištěna zvýšená hladina CPII, 846 epitopu a CPII/C2C poměru u pacientů s AS oproti skupině zdravých kontrol (77). V jiné byla zjištěna pozitivní asociace mezi CTXII a reaktanty akutní fáze (nikoliv BASDAI). Vyšší hladiny CTXII měly navíc vztah k horšímu stupni iniciálních zánětlivých změn na MR (78).
Biomarkery metabolismu kostí. Studium biomarkerů kostního obratu se v poslední době stalo středem velkého zájmu mnoha vědeckých pracovišť. Pro pochopení problematiky je však nutné nejprve zjednodušeně vysvětlit procesy odehrávající se ve zdravé kostní tkáni.
Osteocyty hrají v kostním metabolismu zásadní regulační roli, v závislosti na způsobu jejich stimulace uvolňují lokální mediátory ovlivňující aktivitu okolních osteoblastů a osteoklastů. Dvěma hlavními produkty osteocytů podílejících se na této regulaci jsou ligand spouštějící transkripci faktoru NF-kB (RANKL) a sklerostin. Produkce RANKL urychluje osteoklastickou resorpci v odpovědi na působení mechanický stimulů a některých hormonů (parathormon). Sklerostin je inhibitorem Wnt (wingless type)/β-katenin signální kaskády, která přispívá k regulaci kostní formace osteoblastů. Tato signální kaskáda má na kostní metabolismus zásadní vliv. Wnt slouží jako stabilizátor β-kateninu a přispívá k jeho translokaci do buněčného jádra. Při absenci Wnt je koncentrace β-kateninu v cytoplazmě buněk nízká, protože dochází k jeho postupné degradaci multiproteinovým komplexem, který za pomocí kasein kinázy fosforyluje β-katenin, tím jej označí k ubiquitinaci a proteazomální degradaci. Pokud však dojde k navázání Wnt ligandu na receptor skládající se z Wnt koreceptorů LRP5/6 (low-density lipoprotein receptor-related protein 5 a 6) a transmembránového proteinu, je zahájen přenos signálu do nitra buňky. Postupně dochází k deaktivaci multiproteinového degradačního komplexu a hromadění β-kateninu v cytoplazmě, jeho následné translokaci do buněčného jádra a asociaci s transkripčními faktory zahajujícími přepis genetické informace. Wnt/β-katenin signální kaskáda ovlivňuje celou osteoblastickou linii, kde vede k aktivaci kostní formace a na druhé straně snižuje aktivitu osteoklastů produkcí významného proteinu osteoprotegerinu (OPG), inhibujícího již výše zmíněný RANKL (tab. 5). Wnt β-katenin signální kaskáda je dále esenciální v procesech diferenciace osteoblastů z mezenchymálních kmenových buněk, kde zabraňuje vývoji kmenových buněk směrem k chondrogenní a adipogenní linii. Tato signalizace je důležitá i pro správné vyzrávání osteoblastů nebo utlumení apoptózy. Další reprezentace propojení mechanismů resorpce a novotvorby kosti je patrná při uvolňování transformačního růstového faktoru – β (TGF-β) a kostních morfogenních proteinů (BMPs) fungujících jako růstové faktory v kostní matrix, ke které dochází již v průběhu fáze osteoklastické resorpce (79, 80).
5. Mechanismy AS pod vlivem Wnt/β katenin signální kaskády (79,131). 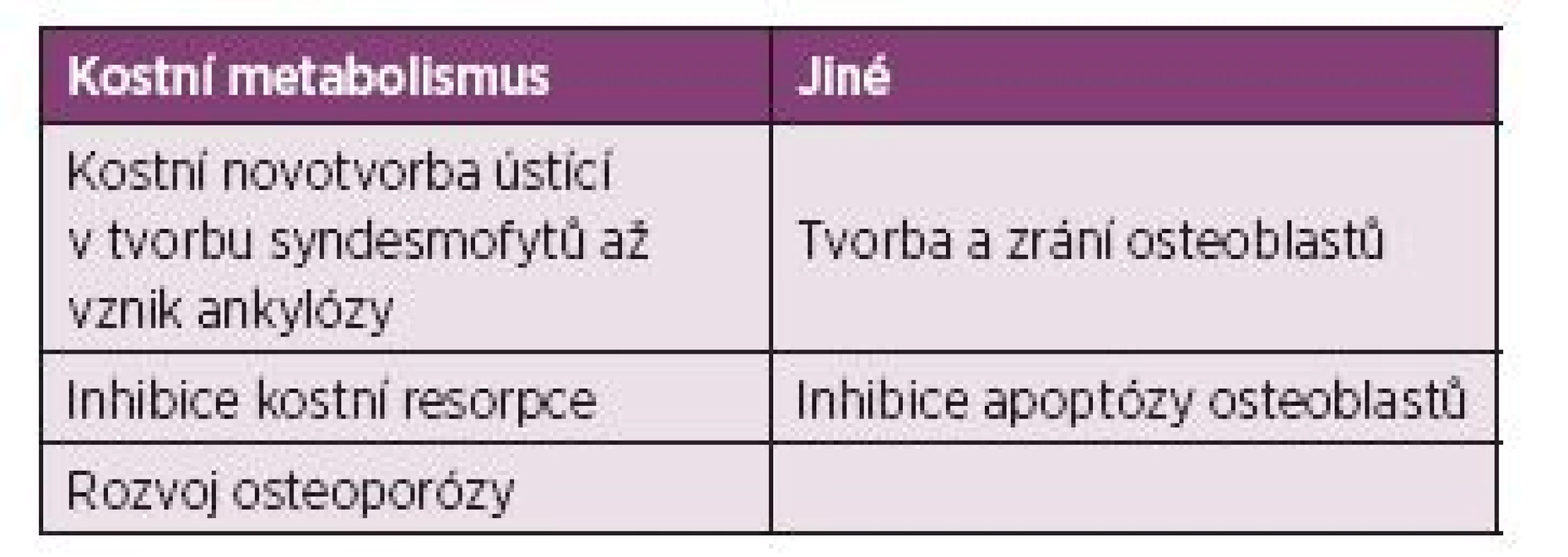
V případě AS dochází k dysregulaci těchto dvou procesů s následkem úbytku kostní hmoty v okolí úponů šlach ke kosti a excesivní kostní formaci v periostu v místech přítomnosti kostních erozí (80).
Kostní biomarkery můžeme rozdělit na markery kostní formace a resorpce. K prvním řadíme pro kosti specifickou alkalickou fosfatázu (ALP), což je enzym produkovaný osteoblasty a má hlavní roli při mineralizaci kosti. Dále sem patří osteokalcin, malý protein tvořený také osteoblasty, jehož gama-karboxylovaná forma je schopna vázat hydroxyapatit. U lidí postižených AS se nachází vyšší hladiny osteokalcinu a kostní izoformy ALP oproti zdravým kontrolám (81, 82). Druhou skupinu tvoří C-telopeptid kolagenu I (CTX-I), který je degradačním produktem kolagenu typu I, jednoho z hlavních proteinů kostní matrix. V nedávné studii korelovala hladina CTX-I s počtem oteklých kloubů a se sérovým CRP (83). Zkoumaným markerem resorpce je i izoforma 5b tartarát rezistentní kyselé fosfatázy, která je specifická pro osteoklastickou aktivitu. Dříve se sice prokázala její korelace s reaktanty zánětu (84), ale tento výsledek se dále nepotvrdil (85).
Z dalších markerů kostního metabolismu zkoumaných v souvislosti s AS je třeba zmínit OPG, protein schopný inhibovat aktivaci osteoklastů. Recentně proběhly četné studie zabývající se sérovými hladinami RANKL, OPG, jejich vzájemným poměrem a změnami po léčbě anti-TNFα preparáty. Vzhledem k rozdílnosti výsledků se není možné o jejich chování při AS jednoznačně vyjádřit (81, 85–88).
V poslední době se objevují práce, jejichž předmětem se stal dickkopf – 1 (DKK-1). Jedná se o regulátor kostního metabolismu, který je produkovaný velkým množstvím buněk včetně osteoklastů. Interferuje s Wnt/β-katenin signální kaskádou podobným mechanismem jako výše zmíněný inhibitor sklerostin. Oba dva vedou k potlačení osteoblastogeneze a reparace kostní hmoty (obr. 2) (80, 89, 90). DKK-1 vychází ze studií převážně jako marker se signifikantně sníženou expresí u AS postižených jedinců (86, 91, 92), i když existují studie, kde je DKK-1 naopak vyšší u AS oproti zdravým kontrolám (81, 85), nebo kde není rozdíl mezi těmito dvěma skupinami, ale je rozdíl ve vazbě ke svému receptoru (93). Tyto studie ukazují na možnou dysfunkci DKK-1 v případě onemocnění AS. Sérové hladiny sklerostinu jsou u pacientů s AS snížené (92, 94). Jedna práce ukázala korelaci zvýšené koncentrace tohoto proteinu v séru s aktivitou nemoci u pacientů s AS (95).
2. Procesy v kostní tkáni u ankylozující spondylitidy. U ankylozující spondylitidy byla prokázaná nízká sérová hladina sclerostinu a dikkopf-1 (DKK-1), proteinů inhibujících Wnt/β katenin signalizační cestu. Nedostatečná inhibice této dráhy vede ke zvýšené produkci osteoprotegerinu (OPG), molekuly inhibující receptorový aktivátor jádrového faktoru (RANKL), který je zodpovědný za zvýšenou resorpci kosti (80,92) 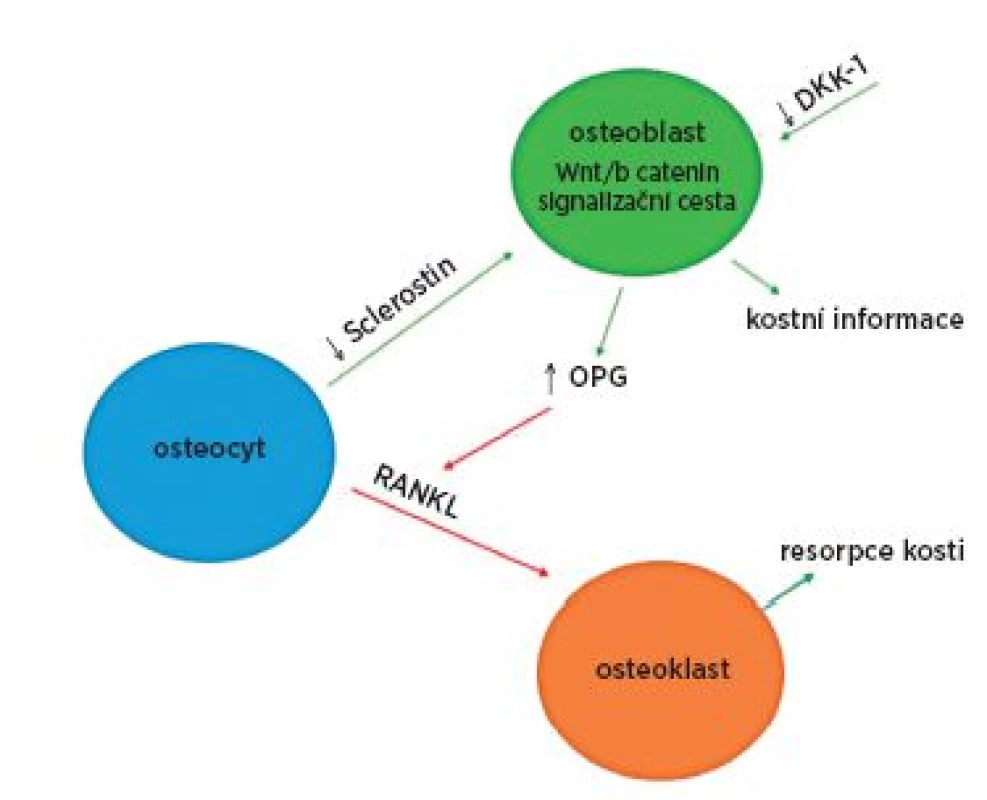
Vysvětlivky: zelené šipky – stimulace; červené šipky – inhibice Dalším proteinem hrajícím roli v metabolismu kostí je osteopontin (OPN). Jde o vysoce fosforylovaný sialoprotein. Jeho exprese v různých tkáních ukazuje na široké spektrum funkcí včetně kostní resorpce a kalcifikace. V kostech usnadňuje přichycení osteoklastů ke kostní matrix skrze integriny a CD44 molekulu (96). U AS jsou prokazovány zvýšené hladiny osteopontinu v séru, ale korelace s aktivitou nemoci chybí. Zdá se, že ale odpovídá hladinám kostní izoformy ALP, osteokalcinu a CTX-I (97).
Biomarkery endoteliálních funkcí. U pacientů s AS bylo popsáno i narušení funkce endotelu, a proto se objevuje snaha o nalezení vhodných biomarkerů i v rámci této kategorie (98). Hlavním zástupcem je vaskulární endotelový růstový faktor (VEGF). Jedná se o silný růstový faktor pro angiogenezi, který zvyšuje permeabilitu kapilár a proliferaci endoteliálních buněk. U nemocných s AS byla již dříve prokázaná jeho zvýšená hladina v séru, která koreluje s reaktanty zánětu a aktivitou nemoci podle indexu BASDAI. Jeho specifita pro AS je bohužel nízká (99–101). U dalších endoteliální markerů jako jsou Von Willebrandův faktor, trombomodulin (glykoproteiny syntetizované endoteliálními buňkami a megakaryocyty), urotensin-II či asymetrický dimetylarginin byly popsány elevace v séru u pacientů s AS oproti zdravým kontrolám, avšak jejich korelace s CRP,IL-6, BASDAI ani změny při různé aktivitě nemoci se neprokázaly (102, 103).
Biomarkery progrese
Studií zabývajících se radiografickou progresí v kombinaci se změnami solubilních biomarkerů u nemocných AS je stále relativně málo, kvůli nutné délce trvání minimálně dvou let k průkazu případného strukturálního postižení páteře (tab. 6).
6. Biomarkery korelující s progresí radiografického nálezu (71, 76,104-118). 
Z genetických poznatků u AS byla vzhledem k silné asociaci ERAP1 genu s onemocněním vyslovena otázka, zda by gen nemohl být také markerem závažnosti onemocnění. Pro tyto účely vznikla studie analyzující SNP u genů ERAP1, LMP2 a 7 (Low Molecular Mass Protein 2 a 7), TAP1 a 2 (Antigen Peptide Transporter 1, 2) a jejich asociaci k závažnosti vstupního radiografického obrazu postižení páteře, který by mohl ovlivňovat další progresi onemocnění. Jediným genem se silnou asociací ke vstupnímu poškození měřenému dle mSASSS (modified Stoke ankylosing spondylitis spine score) byl dle multivariační analýzy LMP2, další hodnocení ukázalo, že pouze vstupní pokročilý radiografický nález má vliv na další progresi nemoci (104). Právě LMP2 byl již dříve asociován i s uveitidou u AS (105), což by mohlo ukazovat na více agresivní formu nemoci. Z dalších genetických markerů byly publikovány studie s ANTXR2, HAPLN1 (Hyaluronan and Proteoglycan Link Protein 1), EDIL3 (EGF-like Repeat and Discoidin I-like Domain-Containing Protein 3), ANO6 (Anoctamin-6), u kterých se předpokládá možný vliv na kostní novotvorbu, a proto by i tyto geny mohly souviset s radiografickou progresí (106).
Dlouhodobě zvýšená aktivita onemocnění jasně vede ke zhoršení radiografického nálezu na páteři. Tento jev je více viditelný u mužů v časné fázi onemocnění, a to zejména při měření aktivity dle kompozitního skóre ASDAS, kdy zvýšení o jednu jednotku vedlo k zvýšení mSASSS o 0,72 za 2 roky. U velmi aktivních jedinců se skóre ASDAS vyšším než 3,5 byla radiografická progrese postižení páteře ještě výraznější (107). Prediktivní kapacita samotného sérového CRP, které je součástí skóre ASDAS, byla také několikrát potvrzena (108). Nedávno byla navíc zvýšená hodnota CRP označena jako jeden z hlavních rizikových faktorů pro vznik nových vertebrálních fraktur (109). K dalším zajímavým výsledkům u přímých ukazatelů zánětu patří rychlejší progrese nemoci při zvýšené sérové koncentraci IL-17 (110). Recentní studie ukázaly i na calprotectin jako na potenciální prognostický marker vývoje axSpA. Jeho sérové hodnoty byly významně vyšší u pacientů, kteří měli po dvouletém sledování zhoršení mSASSS o více než dvě jednotky, a zároveň u pacientů s tvorbou nových syndesmofytů (111).
Z ukazatelů metabolismu pojiva měla nezávislou prediktivní hodnotu vstupní zvýšená koncentrace MMP-3 v séru u pacientů, která dobře korelovala i s dvouletou radiografickou progresí nemoci, a to zvláště u skupiny s preexistujícím strukturálním poškozením (71). Degradační produkt C3M také koreloval s radiografickou progresí měřenou dle mSASSS. Kombinace s C2M byla schopná detekovat až 80 % pacientů s progresí této nemoci (76). CTX-II také koreloval se zhoršením radiografického nálezu (112). Zvýšené hladiny OPG u pacientů na anti-TNFα léčbě se řadí rovněž k možným prediktivním faktorům závažnější progrese onemocnění ve dvouletém horizontu (113). Nedávno byla u pacientů s AS zjištěna významná negativní korelace mezi funkčním DKK-1 a závažným radiografickým nálezem. Proto by mohla být nízká cirkulující hladina DKK-1 považována za potenciální biomarker reflektující progresi AS (114). Podobně bylo prokázáno, že nízké hladiny sklerostinu, inhibitoru nové kostní formace, významně korelují s progresí nemoci a tvorbou syndesmofytů (115).
Existuje i studie zabývající se kostními morfogenními proteiny (BMPs), vedoucími k nové kostní formaci. Ukázalo se, že BMP-2 a BMP-4 mají vztah k míře radiografického postižení páteře. Pacienti s fúzí obratlových těl měli vyšší sérové hodnoty BMP-2 a 4 než zdravé kontroly nebo AS pacienti bez těchto změn. Hladiny BMP-7 pak byly jasně zvýšené u pacientů s fúzí obratlů oproti těm bez fúze (116). BMPs by proto mohly být považovány za potenciální markery radiografické progrese u nemocných s axSpA.
Z markerů endoteliálních funkcí stojí za zmínku především VEGF. Nedávno bylo zjištěno, že vysoké hladiny VEGF mají významný vztah k rychlé radiografické progresi u pacientů s axSpA. VEGF je prediktorem progrese hlavně u osob, které jsou již ve vysokém riziku progrese při existenci syndesmofytů (117).
Nově byl také u pacientů s AS studován vimentin. Koncentrace citrulinovaných degradačních produktů vimentinu (VICM) byly u AS pacientů významně zvýšené oproti zdravým kontrolám, ale nižší než u RA pacientů. Pacienti s vyššími hodnotami VICM měli aktivnější průběh onemocnění a ti s nejvyššími hodnotami VICM měli těžší radiografickou progresi, a to zejména při již patrném vstupním nálezu na rentgenu.(118)
Biomarkery léčebné odpovědi
V rámci odpovědi na anti-TNFα preparáty u AS se nejčastěji objevuje CRP jako parametr, který při úspěšné terapii signifikantně klesá (119). Při kombinaci zvýšených hodnot sérového CRP a dalšího reaktantu akutního zánětu, sérového amyloidu A (SAA), byla prediktivní hodnota odpovědi na léčbu dokonce okolo 81 %. Naopak normální hladiny těchto dvou markerů jsou spojeny s nedostatečnou léčebnou odpovědí (120). Dobrou klinickou odpověď můžeme předpokládat i v případě zvýšených vstupních hodnot CRP a TNFα (121). Naopak prediktivní význam zvýšené sedimentace je stále sporný (121, 122).
Z interleukinů se jevil jako nezávislý marker predikce pouze IL-6, což je vzhledem k jeho vztahu k CRP pochopitelné (46). V rámci adipokinů bylo určité snížení koncentrace v séru po aplikaci infliximabu viditelné i u retinol vázajícího proteinu-4, který je prozánětlivou molekulou spojenou s metabolickým syndromem (123). Po anti-TNF léčbě u AS pacientů bylo prokázáno významné snížení hladin calprotectinu, který může představovat lepší ukazatel léčebné odpovědi, než změna sérového CRP (69).
Snížení sérových hladin MMP při léčbě anti-TNFα preparáty bylo prokázáno již několikrát, zajímavá je i negativní korelace s kostní izoformou ALP ve studii s adalimumabem (100, 124). Z dalších markerů metabolismu pojiva odpovídal CPII/C2C poměr změnám CRP při léčbě infliximabem (77). Jiná vědecká práce ukázala pozitivní korelaci C2C se snížením sérové koncentrace reaktantů zánětu po léčbě etanerceptem (124). Při hodnocení kostních markerů syntézy byl zaznamenán růst kostní izoformy ALP v séru u pacientů s AS po anti-TNF léčbě (86, 100, 125) U degradačních produktů měla hladina CTX-I tendenci k poklesu po anti-TNF terapii (126). Zdá se, že úspěšná terapie vede i ke zvýšení hladin DKK-1 v séru (81, 91).
Významný pokles byl popsán i u sérového VEGF po léčbě infliximabem u AS pacientů (46). Angiopoetin-2 je také prozánětlivým markerem endotelové aktivace, který se zapojuje do angiogeneze a odpovědi endotelu na zánětlivé stimuly (127). U pacientů léčených infliximabem koreloval s délkou trvání nemoci a bylo pozorováno i snížení jeho hladiny v séru po aplikaci infliximabu (128). Gelsolin patří naopak k protizánětlivým proteinům produkovaným převážně svalovými buňkami, který je spojován s cytoskeletální reorganizací (129). Jeho snížené hladiny byly detekovány u pacientů s AS podstupujících dlouhodobou anti-TNF léčbu (130). Přehled biomarkerů a jejich chování v séru pacientů s AS po terapii anti-TNF preparáty je uveden v tabulce 6.
7. Potenciální biomarkery léčebné odpovědi a jejich chování v séru po anti-TNFα terapii u pacientů s ankylozující spondylitidou (46,69,77,81,86,91,100,119-130). 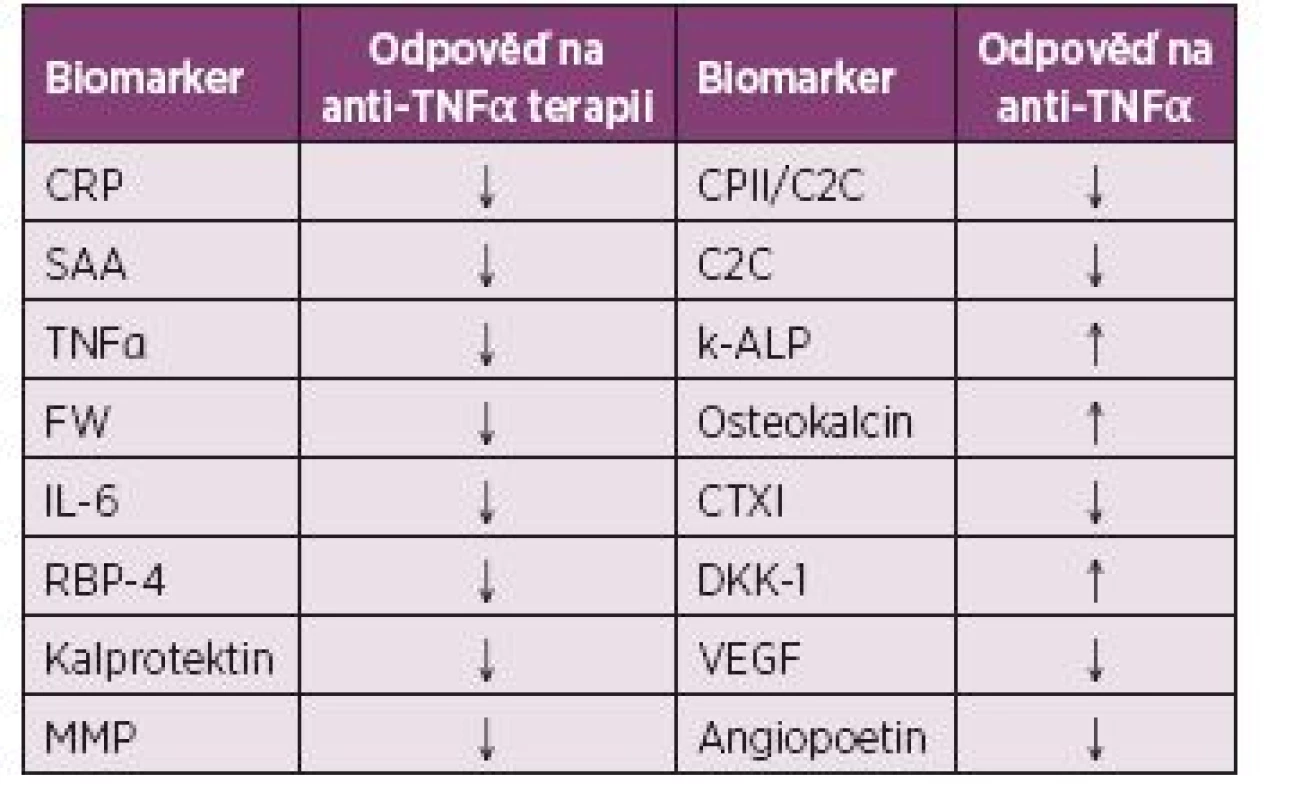
Zkratky: C2C – degradační produkty kolagenu II; CPII – C-propeptid kolagenu II; CPII/C2C – poměr mezi CPII a C2C; CRP – C reaktivní protein; CTX I – C-terminální telopeptid kolagenu I; DKK-1 – Dikkopf-1; k-ALP – kostní izoforma alkalické fosfatázy; MMP – metaloproteináza; RBP-4 - retinol vázajícího proteinu-4; TNF – tumor necrosis faktor; VEGF- vaskulární endoteliální růstový faktor; ↑ - zvýšení; ↓ - snížení Diskuse
Z předchozího textu vyplývá, že bylo již identifikováno několik slibných kandidátů z řad sérových biomarkerů, které mohou mít vztah k riziku vývoje nemoci, aktivitě, progresi anebo schopnosti předurčit léčebnou odpověď u osob s axSpA.
Základním markerem, který pomáhá při diagnostice axSpA zůstává antigen HLA-B27, ke kterému se poslední dobou přidávají i další varianty genů pro hlavní histokompatibilní komplex, a to jednak v rámci HLA-B, tak i mimo něj. Poslední dobou se diskutuje i otázka rizika vzniku AS u určitých variant ERAP1 genu, pro které již byla publikována i přesvědčivá data v rámci genetických analýz. V sekci o riziku vzniku onemocnění byly zmíněny i jiné možné kandidátní geny, jež budou muset být podrobeny dalšímu výzkumu k odhalení jejich přesného vlivu na vývoj nemoci.
Při hodnocení aktivity onemocnění jsou v klinické praxi k dispozici běžně užívané reaktanty akutní fáze. Experimentálně se využívá studium dalších markerů s prokázanou asociací k AS, jako je SAA, kterému bohužel stejně jako předchozím jmenovaným chybí dostatek specifity. Mezi slibné ukazatele zánětlivého postižení páteře na podkladě MR do nedávna patřil IL-6 a MMP-3, která více reflektuje histopatologický stupeň zánětlivého kloubního poškození. Dnes k nim můžeme přiřadit i některé další kandidátní molekuly, jakými jsou kalprotektin, který je kromě aktivity onemocnění potenciálním markerem radiografické progrese a léčebné odpovědi. Aktivitu nemoci odráží také sérové hladiny CTLA-4, radiografickou progresi reflektuje C3M, degradační produkt kolagenu III nebo DKK-1, který svědčící pro narušenou regulaci metabolického obratu kosti. Mezi další nadějné biomarkery aktivity a zejména progrese nemoci lze řadit některé ukazatele kostního metabolismu, některé BMPs, sklerostin a MMP-3.
K radiografické progresi u AS můžeme konstatovat, že podle výsledků mnoha dílčích studií mají sklon k těžšímu postižení pacienti, kteří již mají vstupně přítomné strukturální postižení páteře anebo mají dlouhodobě zvýšenou aktivitu nemoci, zejména sérové hladiny CRP.
Při terapii anti-TNFα preparáty lze předpokládat dobrou odpověď právě u těch pacientů, kteří mají výrazně zvýšené zánětlivé parametry v séru, jakými jsou CRP, SAA či cytokiny IL-6 a TNFα. Anti-TNF terapie dokáže u pacientů s AS potlačit či alespoň významně zmírnit probíhající zánět a tím vrátit zvýšené reaktanty akutní fáze spolu s některými cytokiny do rozmezí normálních hodnot. Dobrou odpověď na léčbu provází změny kalprotektinu nebo snížení markerů degradace a naopak zvýšení markerů syntézy kostní matrix.
Závěrem lze konstatovat, že neexistuje ideální biomarker, který by byl dostatečně senzitivní a specifický pro hodnocení všech aspektů nemoci, nicméně je k dispozici řada kandidátních molekul, které by mohly přispět k danému hodnocení závažnosti nemoci, případně k objasnění její patogeneze. Pro objasnění bližších vztahů mezi cirkulujícími biomarkery a axSpA budou nezbytné další studie a komplexnější analýzy.
Poděkování: Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Dále děkuji za konzultaci při sestavování textu MUDr. Michalovi Tomčíkovi, Ph.D.
Adresa pro korespondenci:
MUDr. Kristýna Grobelná
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: grobelna@revma.cz
Sources
1. Rudwaleit M, Khan MA, Sieper J. The challenge of diagnosis and classification in early ankylosing spondylitis: do we need new criteria? Arthritis Rheum 2005; 52(4): 1000 – 8.
2. Rudwaleit M, van der Heijde D, Landewe R, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Annals Rheum Dis 2009; 68(6): 777 – 83.
3. Braun J, Sieper J. Ankylosing spondylitis. Lancet 2007; 369(9570): 1379 – 90.
4. Boonen A, Brinkhuizen T, Landewe R, et al. Impact of ankylosing spondylitis on sick leave, presenteeism and unpaid productivity, and estimation of the societal cost. Ann Rheum Dis 2010; 69(6): 1123 – 8.
5. Biomarkers definition Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther 2001; 69(3): 89 – 95.
6. Carter N, Williamson L, Kennedy LG, et al. Susceptibility to ankylosing spondylitis. Rheumatology (Oxford) 2000; 39(4): 445.
7. Brown MA, Kennedy LG, MacGregor AJ, et al. Susceptibility to ankylosing spondylitis in twins: the role of genes, HLA, and the environment. Arthritis Rheum 1997; 40(10): 1823 – 8.
8. MacLean IL, Iqball S, Woo P, et al. HLA-B27 subtypes in the spondarthropathies. Clinical Exp Immunol 1993; 91(2): 214 – 9.
9. Lopez-Larrea C, Sujirachato K, Mehra NK, et al. HLA-B27 subtypes in Asian patients with ankylosing spondylitis. Evidence for new associations. Tissue Antigens 1995; 45(3): 169 – 76.
10. Ben Radhia K, Ayed-Jendoubi S, Sfar I, et al. Distribution of HLA-B*27 subtypes in Tunisians and their association with ankylosing spondylitis. Joint Bone Spine 2008; 75(2): 172 – 5.
11. Reveille JD, Inman R, Khan M, et al. Family studies in ankylosing spondylitis: microsatellite analysis of 55 concordant sib pairs. J Rheumatol 2000; 27(Suppl 59) (5).
12. Braun J, Bollow M, Remlinger G, et al. Prevalence of spondylarthropathies in HLA-B27 positive and negative blood donors. Arthritis Rheum 1998; 41(1): 58 – 67.
13. van der Linden SM, Valkenburg HA, de Jongh BM, et al. The risk of developing ankylosing spondylitis in HLA-B27 positive individuals. A comparison of relatives of spondylitis patients with the general population. Arthritis Rheum 1984; 27(3): 241 – 9.
14. Wei JC, Tsai WC, Lin HS, et al. HLA-B60 and B61 are strongly associated with ankylosing spondylitis in HLA-B27-negative Taiwan Chinese patients. Rheumatology (Oxford) 2004; 43(7): 839 – 42.
15. Diaz-Pena R, Aransay AM, Bruges-Armas J, et al. Fine mapping of a major histocompatibility complex in ankylosing spondylitis: association of the HLA-DPA1 and HLA-DPB1 regions. Arthritis Rheum 2011; 63(11): 3305 – 12.
16. Sims AM, Barnardo M, Herzberg I, et al. Non-B27 MHC associations of ankylosing spondylitis. Genes and immunity 2007; 8(2): 115 – 23.
17. Breban M. Genetic studies of spondylarthropathies. French Spondylarthropathy Genetic Study Group. Ann Med Interne (Paris) 1998; 149(3): 142 – 4.
18. Robinson PC, Brown MA. Genetics of ankylosing spondylitis. Mol Immunol 2014; 57(1): 2 – 11.
19. Cortes A, Hadler J, Pointon JP, et al. Identification of multiple risk variants for ankylosing spondylitis through high-density genotyping of immune-related loci. Nat Genet 2013; 45(7): 730 – 8.
20. Alvarez-Navarro C, Lopez de Castro JA. ERAP1 structure, function and pathogenetic role in ankylosing spondylitis and other MHC-associated diseases. Mol Immunol 2014; 57(1): 12 – 21.
21. Burton PR, Clayton DG, Cardon LR, et al. Association scan of 14,500 nonsynonymous SNPs in four diseases identifies autoimmunity variants. Nat Genet 2007; 39(11): 1329 – 37.
22. Reveille JD, Sims AM, Danoy P, et al. Genome-wide association study of ankylosing spondylitis identifies non-MHC susceptibility loci. Nature genetics 2010;42(2):123-7.
23. Rahman P, Inman RD, Gladman DD, et al. Association of interleukin-23 receptor variants with ankylosing spondylitis. Arthritis Rheum 2008; 58(4): 1020 – 5.
24. Smith JA, Colbert RA. Review: The interleukin-23/interleukin-17 axis in spondyloarthritis pathogenesis: Th17 and beyond. Arthritis Rheum 2014; 66(2): 231 – 41.
25. Jandus C, Bioley G, Rivals JP, et al. Increased numbers of circulating polyfunctional Th17 memory cells in patients with seronegative spondylarthritides. Arthritis Rheum 2008; 58(8): 2307 – 17.
26. Wendling D, Cedoz J-P, Racadot E, et al. Serum IL-17, BMP-7, and bone turnover markers in patients with ankylosing spondylitis. Joint Bone Spine 2007; 74(3): 304 – 05.
27. Sims AM, Timms AE, Bruges-Armas J, et al. Prospective meta-analysis of interleukin 1 gene complex polymorphisms confirms associations with ankylosing spondylitis. Ann Rheum Dis 2008; 67(9): 1305 – 9.
28. Monnet D, Kadi A, Izac B, et al. Association between the IL-1 family gene cluster and spondyloarthritis. Ann Rheum Dis 2012; 71(6): 885 – 90.
29. Karaderi T, Keidel SM, Pointon JJ, et al. Ankylosing spondylitis is associated with the anthrax toxin receptor 2 gene (ANTXR2). Ann Rheum Dis 2014; 73(11): 2054 – 8.
30. Tsui HW, Inman RD, Paterson AD, et al. ANKH variants associated with ankylosing spondylitis: gender differences. Arthritis Research & Therapy 2005; 7(3): R513 – 25.
31. Tsui HW, Inman RD, Reveille JD, et al. Association of a TNAP haplotype with ankylosing spondylitis. Arthritis Rheum 2007; 56(1): 234 – 43.
32. van der Heijde D, Lie E, Kvien TK, et al. ASDAS, a highly discriminatory ASAS-endorsed disease activity score in patients with ankylosing spondylitis. Ann Rheum Dis 2009; 68(12): 1811 – 8.
33. Appel H, Loddenkemper C, Grozdanovic Z, et al. Correlation of histopathological findings and magnetic resonance imaging in the spine of patients with ankylosing spondylitis. Arthritis Res Ther 2006; 8(5): R143.
34. Deodhar SD. C-reactive protein: the best laboratory indicator available for monitoring disease activity. Cleveland Clinic J Med 1989; 56(2): 126 – 30.
35. Morley JJ, Kushner I. Serum C-reactive protein levels in disease. Ann N Y Acad Science 1982; 389 : 406 – 18.
36. Maksymowych WP. Biomarkers in spondyloarthritis. Current rheumatology reports 2010; 12(5): 318 – 24.
37. Spoorenberg A, van der Heijde D, de Klerk E, et al. Relative value of erythrocyte sedimentation rate and C-reactive protein in assessment of disease activity in ankylosing spondylitis. The Journal of rheumatology 1999; 26(4): 980 – 4.
38. Lambert RG, Salonen D, Rahman P, et al. Adalimumab significantly reduces both spinal and sacroiliac joint inflammation in patients with ankylosing spondylitis: a multicenter, randomized, double-blind, placebo-controlled study. Arthritis Rheum 2007; 56(12): 4005 – 14.
39. Poddubnyy DA, Rudwaleit M, Listing J, et al. Comparison of a high sensitivity and standard C reactive protein measurement in patients with ankylosing spondylitis and non-radiographic axial spondyloarthritis. Ann Rheum Dis 2010; 69(7): 1338 – 41.
40. Ridker PM. High-sensitivity C-reactive protein: potential adjunct for global risk assessment in the primary prevention of cardiovascular disease. Circulation 2001; 103(13): 1813 – 8.
41. Jung SY, Park M-C, Park Y-B, et al. Serum Amyloid A as a Useful Indicator of Disease Activity in Patients with Ankylosing Spondylitis. Yonsei Med J 2007; 48(2): 218 – 24.
42. Bal A, Unlu E, Bahar G, et al. Comparison of serum IL-1 beta, sIL-2R, IL-6, and TNF-alpha levels with disease activity parameters in ankylosing spondylitis. Clin Rheumatol 2007; 26(2): 211 – 5.
43. Gratacos J, Collado A, Filella X, et al. Serum cytokines (IL-6, TNF-alpha, IL-1 beta and IFN-gamma) in ankylosing spondylitis: a close correlation between serum IL-6 and disease activity and severity. Br J Rheumatol 1994; 33(10): 927 – 31.
44. Mei Y, Pan F, Gao J, et al. Increased serum IL-17 and IL-23 in the patient with ankylosing spondylitis. Clin Rheumatol 2011; 30(2): 269 – 73.
45. Toussirot E, Lafforgue P, Boucraut J, et al. Serum levels of interleukin 1-beta, tumor necrosis factor-alpha, soluble interleukin 2 receptor and soluble CD8 in seronegative spondylarthropathies. Rheumatol Internat 1994; 13(5): 175 – 80.
46. Visvanathan S, Wagner C, Marini JC, et al. Inflammatory biomarkers, disease activity and spinal disease measures in patients with ankylosing spondylitis after treatment with infliximab. Ann Rheum Dis 2008; 67(4): 511 – 7.
47. Jansen DT, Hameetman M, van Bergen J, et al. IL-17-producing CD4+ T cells are increased in early, active axial spondyloarthritis including patients without imaging abnormalities. Rheumatology (Oxford) 2015; 54(4): 728 – 35.
48. Xueyi L, Lina C, Zhenbiao W, et al. Levels of circulating Th17 cells and regulatory T cells in ankylosing spondylitis patients with an inadequate response to anti-TNF-alpha therapy. J Clin Immunol 2013; 33(1): 151 – 61.
49. Wendling D, Cedoz JP, Racadot E. Serum and synovial fluid levels of p40 IL12/23 in spondyloarthropathy patients. Clin Rheumatol 2009; 28(2): 187 – 90.
50. Teft WA, Kirchhof MG, Madrenas J. A molecular perspective of CTLA-4 function. Ann Rev Immunol 2006; 24 : 65 – 97.
51. Lenschow DJ, Walunas TL, Bluestone JA. CD28/B7 system of T cell costimulation. Ann Rev Immunol 1996; 14 : 233 – 58.
52. Carreno BM, Bennett F, Chau TA, et al. CTLA-4 (CD152) can inhibit T cell activation by two different mechanisms depending on its level of cell surface expression. J Immunol 2000; 165(3): 1352 – 6.
53. Toussirot E, Saas P, Deschamps M, et al. Increased production of soluble CTLA-4 in patients with spondylarthropathies correlates with disease activity. Arthritis Res Ther 2009; 11(4): R101.
54. Procaccini C, De Rosa V, Galgani M, et al. Role of adipokines signaling in the modulation of T cells function. Front Immunol 2013; 4 : 332.
55. Park MC, Chung SJ, Park YB, et al. Pro-inflammatory effect of leptin on peripheral blood mononuclear cells of patients with ankylosing spondylitis. Joint Bone Spine 2009; 76(2): 170 – 5.
56. Sari I, Demir T, Kozaci L, et al. Body composition, insulin, and leptin levels in patients with ankylosing spondylitis. Clin Rheumatol 2007; 26(9): 1427 – 32.
57. Neumann E, Frommer KW, Vasile M, et al. Adipocytokines as driving forces in rheumatoid arthritis and related inflammatory diseases? Arthritis Rheum 2011; 63(5): 1159 – 69.
58. Kocabas H, Kocabas V, Buyukbas S, et al. The serum levels of resistin in ankylosing spondylitis patients: a pilot study. Rheumatol Internat 2012; 32(3): 699 – 702.
59. Derdemezis CS, Filippatos TD, Voulgari PV, et al. Leptin and adiponektin levels in patients with ankylosing spondylitis. The effect of infliximab treatment. Clin Exp Rheumatol 2010; 28(6): 880 – 3.
60. Miranda-Filloy JA, Lopez-Mejias R, Genre F, et al. Adiponektin and resistin serum levels in non-diabetic ankylosing spondylitis patients undergoing TNF-alpha antagonist therapy. Clin Exp Rheumatol 2013; 31(3): 365 – 71.
61. Baatar D, Patel K, Taub DD. The effects of ghrelin on inflammation and the immune system. Mol Cell Endocrinol 2011; 340(1): 44 – 58.
62. Toussirot E, Streit G, Nguyen NU, et al. Adipose tissue, serum adipokines, and ghrelin in patients with ankylosing spondylitis. Metabolism 2007; 56(10): 1383 – 9.
63. Toussirot É, Grandclément É, Gaugler B, et al. Serum Adipokines and Adipose Tissue Distribution in Rheumatoid Arthritis and Ankylosing Spondylitis. A Comparative Study. Front Immunol 2013; 4 : 453.
64. Sunahori K, Yamamura M, Yamana J, et al. The S100A8/A9 heterodimer amplifies proinflammatory cytokine production by macrophages via activation of nuclear factor kappa B and p38 mitogen-activated protein kinase in rheumatoid arthritis. Arthritis Res Ther 2006; 8(3): R69.
65. Andrés Cerezo L, Mann H, Pecha O, et al. Decreases in serum levels of S100A8/9 (calprotectin) correlate with improvements in total swollen joint count in patients with recent-onset rheumatoid arthritis. Arthritis Res Ther 2011; 13(4): R122.
66. Foell D, Wittkowski H, Vogl T, et al. S100 proteins expressed in phagocytes: a novel group of damage-associated molecular pattern molecules. J Leukoc Biol 2007; 81(1): 28 – 37.
67. Bianchi ME. DAMPs, PAMPs and alarmins: all we need to know about danger. J Leukoc Biol 2007; 81(1): 1 – 5.
68. Goh FG, Midwood KS. Intrinsic danger: activation of Toll-like receptors in rheumatoid arthritis. Rheumatology (Oxford) 2012; 51(1): 7 – 23.
69. Turina MC, Yeremenko N, Paramarta JE, et al. Calprotectin (S100A8/9) as serum biomarker for clinical response in proof-of-concept trials in axial and peripheral spondyloarthritis. Arthritis Res Ther 2014; 16(5): 413.
70. Oktayoglu P, Bozkurt M, Mete N, et al. Elevated serum levels of calprotectin (myeloid-related protein 8/14) in patients with ankylosing spondylitis and its association with disease activity and quality of life. J Investig Med 2014; 62(6): 880 – 4.
71. Maksymowych WP, Landewe R, Conner-Spady B, et al. Serum matrix metalloproteinase 3 is an independent predictor of structural damage progression in patients with ankylosing spondylitis. Arthritis Rheum 2007; 56(6): 1846 – 53.
72. Chen CH, Lin KC, Yu DT, et al. Serum matrix metalloproteinases and tissue inhibitors of metalloproteinases in ankylosing spondylitis: MMP-3 is a reproducibly sensitive and specific biomarker of disease activity. Rheumatology (Oxford) 2006; 45(4): 414 – 20.
73. Yang C, Gu J, Rihl M, et al. Serum levels of matrix metalloproteinase 3 and macrophage colony-stimulating factor 1 correlate with disease activity in ankylosing spondylitis. Arthritis Rheum 2004; 51(5): 691 – 9.
74. Mattey DL, Packham JC, Nixon NB, et al. Association of cytokine and matrix metalloproteinase profiles with disease activity and function in ankylosing spondylitis. Arthritis Res Ther 2012; 14(3): R127.
75. Bay-Jensen AC, Leeming DJ, Kleyer A, et al. Ankylosing spondylitis is characterized by an increased turnover of several different metalloproteinase-derived collagen species: a cross-sectional study. Rheumatol Internat 2012; 32(11): 3565 – 72.
76. Bay-Jensen AC, Wichuk S, Byrjalsen I, et al. Circulating protein fragments of cartilage and connective tissue degradation are diagnostic and prognostic markers of rheumatoid arthritis and ankylosing spondylitis. PLoS ONE 2013; 8(1): e54504.
77. Kim TH, Stone M, Payne U, et al. Cartilage biomarkers in ankylosing spondylitis: relationship to clinical variables and treatment response. Arthritis Rheum 2005; 52(3): 885 – 91.
78. Pedersen SJ, Sørensen IJ, Lambert RGW, et al. Radiographic progression is associated with resolution of systemic inflammation in patients with axial spondylarthritis treated with tumor necrosis factor α inhibitors: A study of radiographic progression, inflammation on magnetic resonance imaging, and circulating biomarkers of inflammation, angiogenesis, and cartilage and bone turnover. Arthritis Rheum 2011; 63(12): 3789 – 800.
79. Baron R, Kneissel M. WNT signaling in bone homeostasis and disease: from human mutations to treatments. Nat Med 2013; 19(2): 179 – 92.
80. Goldring SR. Osteoimmunology and bone homeostasis: relevance to spondyloarthritis. Curr Rheumatol Rep 2013; 15(7): 342.
81. de Andrade KR, de Castro GR, Vicente G, et al. Evaluation of circulating levels of inflammatory and bone formation markers in axial spondyloarthritis. Internat Immunopharmacol 2014; 21(2):481 – 6.
82. Kapustin AN, Shanahan CM. Osteocalcin: a novel vascular metabolic and osteoinductive factor? Arterioscler Thromb Vasc Biol 2011; 31(10): 2169 – 71.
83. Almodovar R, Rios V, Ocana S, et al. Association of biomarkers of inflammation, cartilage and bone turnover with gender, disease activity, radiological damage and sacroiliitis by magnetic resonance imaging in patients with early spondyloarthritis. Clin Rheumatol 2014; 33(2): 237 – 41.
84. Toussirot E, Dumoulin G, Saas P, et al. Increased tartrate-resistant acid phosphatase serum levels in ankylosing spondylitis and relationship with the inflammatory process. Ann Rheum Dis 2008; 67(3): 430 – 1.
85. Taylan A, Sari I, Akinci B, et al. Biomarkers and cytokines of bone turnover: extensive evaluation in a cohort of patients with ankylosing spondylitis. BMC Musculoskelet Dis Disord 2012; 13 : 191.
86. Woo JH, Lee HJ, Sung IH, et al. Changes of clinical response and bone biochemical markers in patients with ankylosing spondylitis taking etanercept. J Rheumatol 2007; 34(8): 1753 – 9.
87. Chen CH, Chen HA, Liao HT, et al. Soluble receptor activator of nuclear factor-kappaB ligand (RANKL) and osteoprotegerin in ankylosing spondylitis: OPG is associated with poor physical mobility and reflects systemic inflammation. Clin Rheumatol 2010; 29(10): 1155 – 61.
88. Kim H-R, Kim H-Y, Lee S-H. Elevated serum levels of soluble receptor activator of nuclear factors-κB ligand (sRANKL) and reduced bone mineral density in patients with ankylosing spondylitis (AS). Rheumatology (Oxford) 2006; 45(10): 1197 – 200.
89. Gooi JH, Pompolo S, Karsdal MA, et al. Calcitonin impairs the anabolic effect of PTH in young rats and stimulates expression of sclerostin by osteocytes. Bone 2010; 46(6): 1486 – 97.
90. Kim B-J, Bae SJ, Lee S-Y, et al. TNFα mediates the stimulation of sclerostin expression in an estrogen-deficient condition. Biochem Biophys Res Commun 2012; 424(1): 170 – 75.
91. Diarra D, Stolina M, Polzer K, et al. Dickkopf-1 is a master regulator of joint remodeling. Nat Med 2007; 13(2): 156 – 63.
92. Ustun N, Tok F, Kalyoncu U, et al. Sclerostin and Dkk-1 in patients with ankylosing spondylitis. Acta Reumatol Port 2014; 39(2): 146 – 51.
93. Daoussis D, Liossis SN, Solomou EE, et al. Evidence that Dkk-1 is dysfunctional in ankylosing spondylitis. Arthritis Rheum 2010; 62(1): 150 – 8.
94. Klingberg E, Nurkkala M, Carlsten H, et al. Biomarkers of bone metabolism in ankylosing spondylitis in relation to osteoproliferation and osteoporosis. J Rheumatol 2014; 41(7): 1349 – 56.
95. Korkosz M, Gasowski J, Leszczynski P, et al. High disease activity in ankylosing spondylitis is associated with increased serum sclerostin level and decreased wingless protein-3a signaling but is not linked with greater structural damage. BMC Musculoskelet Disord 2013; 14 : 99.
96. Weber GF, Ashkar S, Glimcher MJ, et al. Receptor-ligand interaction between CD44 and osteopontin (Eta-1). Science 1996; 271(5248): 509 – 12.
97. Choi ST, Kim JH, Kang E-J, et al. Osteopontin might be involved in bone remodelling rather than in inflammation in ankylosing spondylitis. Rheumatology (Oxford) 2008; 47(12): 1775 – 79.
98. Sari I, Okan T, Akar S, et al. Impaired endothelial function in patients with ankylosing spondylitis. Rheumatology (Oxford) 2006; 45(3): 283 – 6.
99. Lin TT, Lu J, Qi CY, et al. Elevated serum level of IL-27 and VEGF in patients with ankylosing spondylitis and associate with disease activity. Clin Exp Med 2015; 15(2): 227 – 31.
100. Appel H, Janssen L, Listing J, et al. Serum levels of biomarkers of bone and cartilage destruction and new bone formation in different cohorts of patients with axial spondyloarthritis with and without tumor necrosis factor-alpha blocker treatment. Arthritis Res Ther 2008; 10(5): R125.
101. Tosovsky M, Bradna P, Andrys C, et al. The VEGF and BMP-2 levels in patients with ankylosing spondylitis and the relationship to treatment with tumour necrosis factor alpha inhibitors. Acta medica (Hradec Kralove) / Universitas Carolina, Facultas Medica Hradec Kralove 2014; 57(2): 56 – 61.
102. Divecha H, Sattar N, Rumley A, et al. Cardiovascular risk parameters in men with ankylosing spondylitis in comparison with non-inflammatory control subjects: relevance of systemic inflammation. Clin Sci (London) 2005; 109(2): 171 – 6.
103. Taylan A, Sari I, Kozaci DL, et al. Evaluation of various endothelial biomarkers in ankylosing spondylitis. Clin Rheumatol 2012; 31(1): 23 – 8.
104. Haroon N, Maksymowych WP, Rahman P, et al. Radiographic severity of ankylosing spondylitis is associated with polymorphism of the large multifunctional peptidase 2 gene in the Spondyloarthritis Research Consortium of Canada cohort. Arthritis Rheum 2012; 64(4): 1119 – 26.
105. Maksymowych WP, Russell AS. Polymorphism in the LMP2 gene influences the relative risk for acute anterior uveitis in unselected patients with ankylosing spondylitis. Clin Investigat Med 1995; 18(1): 42 – 6.
106. Tsui FW, Tsui HW, Akram A, et al. The genetic basis of ankylosing spondylitis: new insights into disease pathogenesis. Appl Clin Genet 2014; 7 : 105 – 15.
107. Ramiro S, van der Heijde D, van Tubergen A, et al. Higher disease activity leads to more structural damage in the spine in ankylosing spondylitis: 12-year longitudinal data from the OASIS cohort. Ann Rheum Dis 2014; 73(8): 1455 – 61.
108. Poddubnyy D, Haibel H, Listing J, et al. Baseline radiographic damage, elevated acute-phase reactant levels, and cigarette smoking status predict spinal radiographic progression in early axial spondylarthritis. Arthritis Rheum 2012; 64(5) : 1388 – 98.
109. Kang KY, Kim IJ, Jung SM, et al. Incidence and predictors of morphometric vertebral fractures in patients with ankylosing spondylitis. Arthritis Res Ther 2014; 16(3): R124.
110. Maksymowych WP, Morency N, Wichuk S, et al. Multiplex assay of a panel of 58 biomarkers in ankylosing spondylitis: Identification of high priority candidates for prediction of structural damage. Arthritis Rheum 2010; 62 (10): 1451.
111. Turina MC, Sieper J, Yeremenko N, et al. Calprotectin serum level is an independent marker for radiographic spinal progression in axial spondyloarthritis. Ann Rheumat Dis 2014; 73(9): 1746 – 48.
112. Vosse D, Landewe R, Garnero P, et al. Association of markers of bone - and cartilage-degradation with radiological changes at baseline and after 2 years follow-up in patients with ankylosing spondylitis. Rheumatology (Oxford) 2008; 47(8): 1219 – 22.
113. Baraliakos X, Landewe R, Heijde DVD, et al. The relationship of biomarkers and radiographic progression in patients with ankylosing spondylitis. Arthritis Rheum 2010; 62(10): 105.
114. Yucong Z, Lu L, Shengfa L, et al. Serum functional dickkopf-1 levels are inversely correlated with radiographic severity of ankylosing spondylitis. Clin Lab 2014; 60(9): 1527 – 31.
115. Appel H, Ruiz-Heiland G, Listing J, et al. Altered skeletal expression of sclerostin and its link to radiographic progression in ankylosing spondylitis. Arthritis and rheumatism 2009; 60(11): 3257 – 62.
116. Chen HA, Chen CH, Lin YJ, et al. Association of bone morphogenetic proteins with spinal fusion in ankylosing spondylitis. The Journal of rheumatology 2010; 37(10): 2126 – 32.
117. Poddubnyy D, Conrad K, Haibel H, et al. Elevated serum level of the vascular endothelial growth factor predicts radiographic spinal progression in patients with axial spondyloarthritis. Ann Rheum Dis 2014; 73(12): 2137 – 43.
118. Bay-Jensen AC, Karsdal MA, Vassiliadis E, et al. Circulating citrullinated vimentin fragments reflect disease burden in ankylosing spondylitis and have prognostic capacity for radiographic progression. Arthritis Rheum 2013; 65(4): 972 – 80.
119. Rudwaleit M, Claudepierre P, Wordsworth P, et al. Effectiveness, safety, and predictors of good clinical response in 1250 patients treated with adalimumab for active ankylosing spondylitis. The J Rheumatol 2009; 36(4): 801 – 8.
120. de Vries MK, van Eijk IC, van der Horst-Bruinsma IE, et al. Erythrocyte sedimentation rate, C-reactive protein level, and serum amyloid a protein for patient selection and monitoring of anti-tumor necrosis factor treatment in ankylosing spondylitis. Arthritis Rheum 2009; 61(11): 1484 – 90.
121. Stone MA, Payne U, Pacheco-Tena C, et al. Cytokine correlates of clinical response patterns to infliximab treatment of ankylosing spondylitis. Annals of the rheumatic diseases 2004; 63(1): 84 – 7.
122. Romero-Sanchez C, Robinson WH, Tomooka BH, et al. Identification of acute phase reactants and cytokines useful for monitoring infliximab therapy in ankylosing spondylitis. Clin Rheumatol 2008; 27(11):1429 – 35.
123. Genre F, López-Mejías R, Miranda-Filloy JA, et al. Antitumour necrosis factor α treatment reduces retinol-binding protein 4 serum levels in non-diabetic ankylosing spondylitis patients. Ann Rheum Dis 2014; 73(5): 941 – 43.
124. Maksymowych WP, Poole AR, Hiebert L, et al. Etanercept exerts beneficial effects on articular cartilage biomarkers of degradation and turnover in patients with ankylosing spondylitis. J Rheumatol 2005; 32(10): 1911-7.
125. Visvanathan S, van der Heijde D, Deodhar A, et al. Effects of infliximab on markers of inflammation and bone turnover and associations with bone mineral density in patients with ankylosing spondylitis. Ann Rheum Dis 2009; 68(2): 175 – 82.
126. Arends S, Spoorenberg A, Houtman PM, et al. The effect of three years of TNFalpha blocking therapy on markers of bone turnover and their predictive value for treatment discontinuation in patients with ankylosing spondylitis: a prospective longitudinal observational cohort study. Arthritis Res Ther 2012; 14(2): R98.
127. Westra J, de Groot L, Plaxton SL, et al. Angiopoietin-2 is highly correlated with inflammation and disease activity in recent-onset rheumatoid arthritis and could be predictive for cardiovascular disease. Rheumatology (Oxford) 2011; 50(4): 665 – 73.
128. Genre F, Miranda-Filloy JA, López-Mejias R, et al. Antitumour necrosis factor-α therapy modulates angiopoietin-2 serum levels in non-diabetic ankylosing spondylitis patients. Ann Rheum Dis 2013; 72(7): 1265 – 67.
129. Kwiatkowski DJ, Mehl R, Izumo S, et al. Muscle is the major source of plasma gelsolin. J Biol Chemistry 1988; 263(17): 8239 – 43.
130. Genre F, Lopez-Mejias R, Miranda-Filloy JA, et al. Gelsolin levels are decreased in ankylosing spondylitis patients undergoing anti-TNF-alpha therapy. Clinical and experimental rheumatology 2014; 32(2): 218 – 24.
131. Carter S, Lories RJ. Osteoporosis: a paradox in ankylosing spondylitis. Curr Osteoporos Rep 2011; 9(3): 112 – 5.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2015 Issue 4-
All articles in this issue
- The relation of rheumatic diseases and their treatment to clinical renal involvement
- Serum biomarkers in axial spondyloarthritis
- Deformation analysis of the right ventricle using speckle tracking in the diagnosis of pulmonary arterial hypertension in patients with systemic sclerosis and mixed connective tissue disease
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The relation of rheumatic diseases and their treatment to clinical renal involvement
- Serum biomarkers in axial spondyloarthritis
- Deformation analysis of the right ventricle using speckle tracking in the diagnosis of pulmonary arterial hypertension in patients with systemic sclerosis and mixed connective tissue disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

