-
Medical journals
- Career
Možnosti přípravy endometria ke kryoembryotransferu
Authors: J. Vodička 1; M. Dvořan 1; K. Smékalová 1; Ľ. Michnová 2; P. Hejtmánek 1; K. Lehnertová 1; J. Dostál 1; M. Pešková 1; M. Annenková 1; R. Pilka 1
Authors‘ workplace: Porodnicko-gynekologická klinika LF UP a FN, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 1; IVF Clinic, Olomouc, vedoucí lékař MUDr. Š. Machač, Ph. D. 2
Published in: Ceska Gynekol 2018; 83(1): 24-28
Overview
Cíl studie:
Vyhodnotit možnosti a efektivitu léčby neplodnosti v závislosti na přípravě endometria ke kryoembryotransferu.Typ studie:
Retrospektivní analýza.Název a sídlo pracoviště:
Porodnicko-gynekologická klinika LF UP a FN Olomouc.Metodika:
V centru asistované reprodukce Fakultní nemocnice Olomouc jsme vyhodnotili úspěšnost kryoembryotransferů prováděných v období ledna až srpna 2017. Srovnávali jsme výsledky po přenosu rozmražených embryí v přirozeném ovulačním cyklu žen (skupina A), v substituovaném cyklu – perorální estrogen, vaginální gestagen (skupina B), v substituovaném cyklu – transdermální estrogen, vaginální gestagen (skupina C). Ve všech cyklech jsme transferovali jednu blastocystu (v pěti cyklech dvě blastocysty) šestý den po ovulaci (skupina A) nebo šestý den užívání gestagenů (skupiny B, C).Výsledky:
Úspěšnost byla nejvyšší ve skupině C (pregnancy rate 56 %), téměř ve shodě se skupinou B (pregnancy rate 52 %), nejnižší ve skupině A (pregnancy rate 22 %). Pokračujících gravidit je nejvíce ve skupině A, 100 %, ve skupinách B a C 57 % respektive 56 %.Závěr:
Kryoembryotransfer v přirozených cyklech je provázen vyššími nároky na načasování výkonu. V našem souboru byla nejnižší úspěšnost léčby v přirozených cyklech. Substituované cykly v perorální i transdermální formě podání estrogenů přinášejí lepší výsledky.Klíčová slova:
kryoembryotransfer, přirozený cyklus, substituovaný cyklus, pregnancy rateÚVOD
Kryoembryotransfer (KET) jako metoda asistované reprodukce nabývá v posledních letech na významu. Od prvního úspěšného KET v počátku 80. let minulého století se podíl KET v IVF léčbě zvýšil na přibližně 25 % všech embryotransferů [14]. Některá pracoviště upřednostňují program transferu kryokonzervovaných embryí [9]. Řízená ovariální stimulace má negativní vliv na endometriální receptivitu, vzhledem k suprafyziologickým hladinám estrogenů a progesteronu [1, 5, 15, 16]. Z metod asistované reprodukce má nejvyšší pregnancy rate program dárcovských oocytů, kde není endometrium vystaveno nadměrným hladinám hormonů [1, 2, 5, 9, 15, 16]. Významnému rozšíření KET pomohly nové kryokonzervační metody zefektivňujícící úspěšnost programu.
Kryokonzervace a odložený embryotransfer jsou indikovány v případě rizika ovariálního hyperstimulačního syndromu, dále při použití nových stimulačních strategií s cílem snížit riziko ovariální hyperstimulace [10]. Z kryokonzervace všech embryí získaných v cyklu (freeze all strategy) budou profitovat páry s počty oocytů ≥ 15 [5]. KET je prováděn v případě genetického vyšetřování embryí v rámci preimplantačního genetického screening nebo diagnostiky. Odložený transfer je vhodný při předčasném nárůstu hladin progesteronu (P4), při suspektních nálezech nebo nedostatečné proliferaci endometria či jiných méně raritních komplikacích [9]. Kryokonzervace gamet je metodou volby u onkologických pacientů [8].
U žen s ovulačním cyklem lze plánovat KET v přirozeném cyklu s detekcí luteinního (LH) peaku v krevním séru nebo v moči. Rozmražení a KET plánujeme podle fáze zamražení embrya, v našich podmínkách při transferu blastocyst do fáze + sedm dnů [14, 17]. Ovulaci lze prokázat sonograficky monitorovanou folikulometrií s průkazem ruptury dominantního foliklu. Další možnost plánování KET je v modifikovaném přirozeném cyklu se subkutánní nebo intramuskulární aplikací choriového gonadotropinu (hCG) při nálezu dominantního foliklu 17 a více mm [14]. Rozmražení a transfer blastocysty časujeme hCG + sedm dnů.
Další možností, zvláště u anovulačních cyklů jsou KET v substituovaných cyklech s estradiolem (E2) a progesteronem (P4), se supresí a nebo bez suprese hypofýzy analogy gonadotropin uvolňujícího hormonu (a GnRh). Endometrium připravujeme od časné proliferační fáze cyklu kontinuální nebo postupně se zvyšující dávkou perorálně nebo transdermálně podávaného estrogenu (někteří autoři uvádějí i vaginální formu) [11, 12, 14]. Minimální doba pro proliferaci endometria se udává osm dnů. Při výšce endometria od osmi mm přidáme k transformaci endometria gestageny. Gestageny je možno podat vaginálně, perorálně, subkutánně nebo intramuskulárně [13]. Šestý den od zahájení transformace endometria gestageny provádíme v případě blastocyst kryoembryotransfer. V estrogen gestagenní substituci pokračujeme do 12. týdne gravidity. Pro asi 5% riziko ovulace a předčasné transformace endometria je možná suprese hypofýzy analogy GnRh v substituovaném cyklu [6].
SOUBOR A METODIKA
V centru asistované reprodukce Fakultní nemocnice Olomouc jsme porovnali výsledky KET prováděných v lednu až srpnu 2017. V daném období jsme provedli 80 KET u 74 žen. Ve všech cyklech jsme transferovali jednu blastocystu (v pěti případech dvě). Byly zrušeny čtyři transfery pro nízkou kvalitu rozmražených embryí (5 %; 4/84), tyto cykly nejsou zahrnuty ve studii. Ze studie byly vyřazeny páry s provedeným preimplantačním genetickým screeningem u embryí.
Embrya ve stadiu blastocyst byla kryokonzervována metodou vitrifikace za použití systému Rapidi a média RapidVitTM Blast (Vitrolife). Rozmražení bylo provedeno v médiu RapidWarmTM Blast (Vitrolife). Vitrifikace i rozmražení probíhalo podle standardního protokolu firmy Vitrolife.
Embrya byla transferována v den rozmražení pod sonografickou kontrolou měkkým transferovým katétrem (Semtrac Vision set) do děložní dutiny.
Skupina A zahrnovala 23 žen s ovulačními cykly, které preferovaly KET v modifikovaném přirozeném cyklu. Od střední folikulární fáze jsme prováděli sonograficky folikulometrii s kontrolou proliferace endometria. Při nálezu dominantního folikulu velikosti 17 a více milimetrů a výšce endometria minimálně osm milimetrů jsme aplikovali 5000 IU hCG s.c. a KET časovali sedmý den po aplikaci hCG. Luteální fázi cyklu jsme podporovali vaginálním podáním mikronizovaného progesteronu (Utrogestan, Besins Manufacturing Belgium) v dávce 200 mg/denně od ovulace v případě koncepce do šestého týdne gravidity.
Do skupiny B jsme zařadili 41 žen, u kterých proběhla příprava endometria estrogen-gestagenní substitucí. V časné proliferační fázi jsme zahájili podávání perorální formy estradiolu (Estrimax, Gedeon Richter) 2 mg/den po dobu pěti dnů, následně 4 mg/den od šestého do desátého dne substituce a od desátého dne 6 mg/den kontinuálně do 12. týdne gravidity. Ultrazvukové vyšetření bylo plánováno od desátého dne užívání estradiolu. Při nálezu endometria minimálně osm milimetrů, nepřítomnosti dominatního folikulu a vyloučení případné ovulace byl naplánován KET. K estrogenní substituci jsme přidali vaginálně mikronizovaný progesteron v dávce 400 mg dvakrát denně kontinuálně do 12. týdne gravidity. KET byl prováděn šestý den užívání gestagenů.
Skupinu C tvořilo 16 žen, u kterých proběhla příprava endometria estrogen-gestagenní substitucí. Perorální formu estrogenu byla nahrazena transdermální substitucí estradiol 1,5 mg/sprejem (Lenzeto, Gedeon Richter). V časné proliferační fázi jsme zahájili podávání transdermální formy estradiolu 1,5 mg/den po dobu pěti dnů, následně 3 mg/den od šestého do desátého dne substituce a od desátého dne 4,5 mg/den kontinuálně do 12. týdne gravidity. Další postup byl shodný se skupinou B.
Kontrolní hladiny hCG jsme měřili 14. až 18. den po transferu, sonografickou verifikaci gravidity jsme časovali do období za čtyři týdny po transferu a prosperitu gravidity ověřovali ve 12. týdnu gravidity.
V cyklech jsme vyhodnocovali pregnancy rate, implantation rate, počet těhotenských ztrát a počet pokračujících gravidit. Sledovali jsme závislost na demografických parametrech.
Statistické zpracování dat
Data pro pregnancy, implantation and ongoing pregnancy rate byla analyzována pomocí t-testu. Data pro abortion rate a ectopic pregnancy byla analyzována pomocí Mannova-Whitneyho Rank Sum testu. Statistické analýzy byly provedeny softwarem Sigma Plot verze 11.0 (Systat Software, USA). Statisticky signifikantní výsledek byl definován jako p < 0,05.
VÝSLEDKY
Ve skupině A jsme zaznamenali pět gravidit. Přenášeli jsme vždy jednu blastocystu, pregnancy i implantation rate byl 22 % (5/23). Všechny dosažené gravidity pokračovaly do 12. týdne gravidity.Věkový průměr ve skupině A byl 35,1 let (27–40), BMI byl 24,6 (20,0–28,0). V 65 % se jednalo o sekundární sterilitu, 60% byl podíl androgenní sterility, 18 % tvořil tuboperitoneální faktor, 13 % ovariální faktor, 9 % imunologická příčina.
Celkem 13 % transferů ve skupině bylo komplikovaných, bylo nutné použít stylet nebo provést rektifikaci dělohy.
Ve skupině B otěhotnělo 21 žen. Jedna gravidita (po přenosu dvou blastocyst) byla dvoučetná. Ve třech cyklech jsme transferovali na žádost páru dvě embrya ve stadiu blastocysty. Pregnancy rate byl 52 % (21/41), implantation rate byl 50 % (22/44). Dvanáct gravidit (57 %) pokračuje do 12. týdne. V osmi případech (38 %) došlo k abortu, jedna gravidita (5 %) byla ektopická.
Věkový průměr byl 31,8 roků (26–41), BMI byl 25,5 (18,0–46). V 58 % se jednalo o sekundární sterilitu, ze 60 % dominovala ovariální příčina neplodnosti, ze 30 % androgenní faktor, 20 % tuboperitoneální faktor. S komplikacemi bylo provedeno 10 % transferů.
Ve skupině C otěhotnělo devět žen. Ve dvou cyklech jsme přenášeli na žádost páru dvě embrya ve stadiu blastocysty. Pregnancy rate byl 56 % (9/16). Implantation rate byl 50 % (9/18). Pět gravidit (56 %) pokračuje do 12. týdne. Ve třech případech (33 %) došlo k abortu, jedna gravidita (11 %) byla ektopická.Věkový průměr byl 35,1 roků (26–46), BMI bylo 24,6 (17–37).
V 50 % se jednalo o sekundární sterilitu, ve 40 % byl příčinou ovariální faktor, v 35 % tuboperitoneální faktor, 20% podíl androgenní a 6% imunologické složky.Všechny transfery proběhly bez komplikací.
Výsledky jsou shrnuty v tabulce 1.
Table 1. Výsledky transferů v jednotlivých skupinách 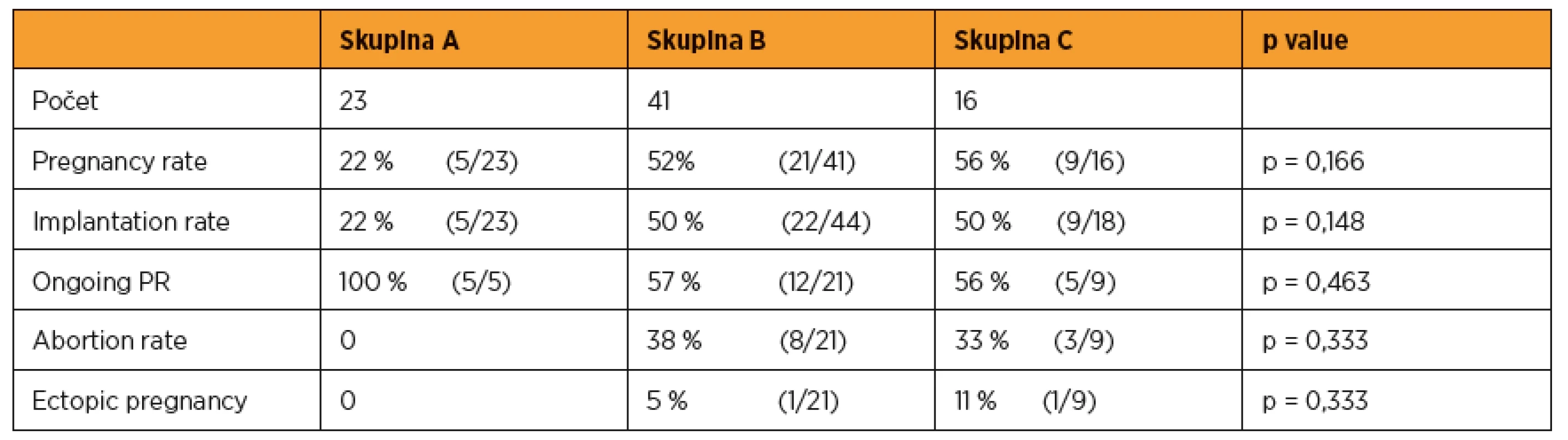
DISKUSE
V naší studii jsou výsledky v arteficiálních cyklech přípravy endometria ke kryoembryotransferu, a to po transdermální nebo peroralní formě podání estrogenů (56 % resp. 52 % PR) příznivější než v modifikovaných nativních cyklech (22 % PR). V literatuře se udává přibližně stejná úspěšnost [3, 14, 15]. Nativní nebo modifikované nativní cykly jsou klientkami preferovány vzhledem k minimalizaci podávání exogenních hormonů [17]. Nutným předpokladem jsou však ovulační cykly a zkušenosti pracoviště s časováním optimálního termínu pro kryoembryotransfer. V těchto cyklech je nutný vyšší počet vyšetření, ve srovnání se substituovanými cykly, kde již většinou při druhé návštěvě probíhá kryoembryotransfer. Kromě ultrazvukového monitoringu ovulačního cyklu je často nutné laboratorně monitorovat elevaci endogenního LH k přesnějšímu stanovení termínu ovulace. Nevýhodou pro provádění nativních nebo modifikovaných nativních cyklů může být dále nutnost časovat kryoembryotransfer do období víkendových nebo svátečních dnů. Substituované cykly umožňují lépe plánovat a organizovat provoz pracoviště.
V přirozených cyklech jsme zaznamenali nižší procento těhotenských ztrát v I. trimestru, v substituovaných cyklech jsme zaznamenali 21 % potratů při perorální formě podání estrogenů a 33 % potratů při transdermální formě. Tato data se shodují s výsledky v dostupné literatuře [15, 16]. Ektopická gravidita byla po jednom případu v obou ze substituovaných skupin (5 % resp. 11 %) bez signifikantního významu. Další demografická data se neliší v jednotlivých skupinách a nemají vliv na úspěšnost v cyklech. Ve skupinách B a C bylo zastoupeno více žen s ovariálním faktorem neplodnosti, které častěji vyžadují substituovaný cyklus.
ZÁVĚR
Kryoembryotransfer v nativních cyklech je provázen vyššími nároky na načasování výkonu, vyžaduje vyšší počet vyšetření a je s ohledem na organizaci provozu pracoviště komplikovanější. Substituované cykly v perorální i transdermální formě podání estrogenů přinášejí lepší výsledky. Výběr přípravy endometria ke kryoembryotransferu je metodou volby a záleží na preferencích a zvyklostech pracoviště.
Práce byla podpořena grantem MZ ČR – RVO (FNOl,00098892).
Použité zkratky
aGnRh – analoga gonadotropin uvolňujícího hormonu
BMI – body mass index
E2 – estradiol
hCG – lidský choriový gonadotropin
KET – kryoembryotransfer
LH – luteinní hormon
P4 – progesteron
MUDr. Jan Vodička
Porodnicko-gynekologická klinika
LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: Jan.Vodička@fnol.cz
Sources
1. Braga, DP., Setti, AS., Figueira, RC., et al. Freeze-all, oocyte vitrification, or fresh embryo transfer? Lesson from an egg-sharing donation program. Fertil Steril, 2016, 106, p. 615–622.
2. Cedars, M. Fresh versus frozen: initial transfer or cumulative cycle results: how do we interpret results and design studies? Feril Steril, 2016, 106, 2, p. 251–256.
3. Cerrillo, M., Herrero, L., Guillen, A., et al. Impact of endometrial preparation protocols for frozen embryo transfer on live birth rates. Rambam Maimonidess Med J, 2017, 8(2), p. e0020.
4. Davar, R., Janati, S., Mosheni, F., et al. A comparison of the effects of transderma estradiol and estradiol valerate on endometrial receptivity in frozen-thawed embryo transfer cycles: a randomized clinical trial. J Reprod Infertility, 2016, 17(2), p. 97–103.
5. Diemant, FC., Petersen, CG., Mauri, AL., et al. Fresh embryos versus freeze-all embryos – transfer strategies: Nuances of a meta-analysis. JBRA Assisted Reprod, 2017, 21(3), p. 260–272.
6. Gelbaya, TA., Nardo, LG., Hunter, HR., et al. Cryopreserved – thawed embryotransfer in natural or down-regulated hormonally controlled cycles: a retrospective study. Fertil Steril, 2006, p. 603–609.
7. Healy, MW., Yamasaki, M., Patounakis, G., et al. The slow growing embryo and premature progesterone elevation: compounding factors for embryo-endometrial asynchrony. Hum Reprod, 2017, 32(2), p. 362–367.
8. Huser, M., Crha, I., Žáková, J., et al. Onkofertilita – nový směr reprodukční medicíny. Čes Gynek, 2011, 76(2), s. 91–99.
9. Chambers, GM., Wand, H., Macaldowie, A., et al. Population trends and live birth rates associated with common ART treatment strategies. Hum Reprod, 2016, 31(11), p. 2632–2641.
10. Chen, YH., Wang, Q., Zhang, YN., et al. Cumulative live birth and surplus embryo incidence after frozen-thaw cycles in PCOS: how many oocytes do we need? J Assist reprod Genet, 2017, 3.
11. Kalem, Z., Kalem, MN., Gurgan, T. Methods for endometrial preparation in frozen-thawed embryo transfer cycles. J Turkish-German Gyneacol Ass, 2016, 17(3). p. 168–172.
12. Liao, X., Dong, X., Zhang, H. Comparison between oral and vaginal estrogen usage in inadequate endometrial patients for frozen-thawed blastocyst transfer. Int J Clin Exp Pathol, 2014, 7(10), p. 6992–6997.
13. Michnová, L., Rumpíková, T., Dostál, J. Luteální podpora v programu IVF/ET. Čes Gynek, 2011, 76, 2, s. 104–107.
14. Peeraer, K., Couck, I., Debrock, S., et al. Frozen-thawed embryo transfer in a natural or mildly hormonally stimulated cycle in woman with regular ovulatory cycles: a RCT. Hum Reprod, 2015, 30, 11, p. 2552–2562.
15. Roque, M., Lattes, K., Serra, S., et al. Fresh embryo transfer versus frozen embryo transfer in in vitro fertilization cycles:a systematic review and meta-analysis. Fertil Steril, 2013, p. 152–162.
16. Shapiro, BS., Daneshmand, ST., Garner, FC., et al. Evidence of impaired endometrial receptivity after ovarian stimulation for in vitro fertilization: a prospective randomized trial comparing fresh and frozen thawed embryo transfer in normal responders. Fertil Steril, 2011, 96, 2., p. 344–348.
17. Xiao, Z., Zhou, X., Xu, W., et al. Natural cycle is superior to hormone replacement therapy cycle for vitrificated-preserved frozen-thawed embryo transfer. Systems biology in Repr. Medicine, 2012, 58, p. 107–112.
Labels
Paediatric gynaecology Gynaecology and obstetrics Neonatology Paediatrics Reproduction medicine
Article was published inCzech Gynaecology

2018 Issue 1-
All articles in this issue
- Využití medroxyprogesteron acetátu k blokádě LH při stimulaci dárkyní vajíček
- Vývoj prenatální diagnostiky vrozených srdečních vad, zisk z jednotlivých ultrazvukových projekcí
- Intravenózní leiomyomatóza jako vzácný nádor myometria
- Možnosti přípravy endometria ke kryoembryotransferu
- Validácia nového nástroja pre indentifikáciu bariér v prevencii rakoviny krčka maternice na Slovensku
- Malformace Galenovy žíly u plodu
- Subarachnoidální krvácení u matky v graviditě
- Non-Hodgkinův B-lymfom ovarií s nepříznivou prognózou – náhodný nález při císařském řezu
- Hysteroskopicky asistovaná laparoskopická salpingostomie při řešení tubární gravidity
- Metoda One-Step Nucleic Acid Amplification – jaká je budoucnost zpracování sentinelových uzlin?
- Těhotenství u žen po transplantacích solidních orgánů
- Antibiotická terapie v graviditě
- Dopad císařského řezu na soukromou zdravotní službu v Brazílii: indikace a míra morbidity a úmrtnosti novorozenců
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Možnosti přípravy endometria ke kryoembryotransferu
- Antibiotická terapie v graviditě
- Malformace Galenovy žíly u plodu
- Využití medroxyprogesteron acetátu k blokádě LH při stimulaci dárkyní vajíček
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

