-
Medical journals
- Career
Karcinosarkom endometria s melanomovou diferenciací, kazuistika
Authors: D. Berezovskiy; P. Vlasák; J. Kosťun; J. Bouda; Jiří Presl
Authors‘ workplace: Gynekologicko-porodnická klinika LF UK a FN, Plzeň, přednosta doc. MUDr. Z. Novotný, CSc.
Published in: Ceska Gynekol 2017; 82(5): 390-395
Overview
Cíl studie:
Představujeme případ 60leté pacientky odeslané z okresní nemocnice, kde byla provedena ablace cervikálního polypu a separovaná kyretáž s histologickým nálezem vysoce maligního karcinosarkomu s melanomovou diferenciací.Typ studie:
Kazuistika.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF UK a FN, Plzeň.Závěr:
Karcinosarkom, dříve maligní smíšený mülleriánský tumor, je velice agresivní raritní endometriální karcinom s nízkou incidencí, který se vyskytuje především u starších žen a nejčastěji postihuje děložní tělo a hrdlo. Klinicky karcinosarkom nelze odlišit od karcinomu endometria nebo sarkomu dělohy. Definitivní diagnóza může být stanovena pouze na základě histologického vyšetření.Klíčová slova:
karcinosarkom, maligní smíšený mülleriánský tumor, diagnostika, radikální operace, histologie, recidivaÚVOD
Karcinosarkom (KS), dříve maligní smíšený mülleriánský tumor (mixed malignant Müllerian tumor – MMMT), je velice agresivní raritní endometriální karcinom (méně než 5 %), který obsahuje maligní epitelovou složku (karcinom) a maligní stromální složku (sarkom). Jedná se o tumor, který postihuje především starší ženy v průměrném věku 62–67 let, s nízkou incidencí, asi 1–4/100 000 žen.
Karcinosarkom nejčastěji postihuje děložní tělo a hrdlo, kdy typickým nálezem je velký korporální polyp vyplňující celou dutinu děložní, ale může být nalezen i ve vejcovodech, vaječnících, pochvě, na peritoneu či extragenitálně. Klinicky karcinosarkom nelze odlišit od karcinomu endometria nebo sarkomu dělohy. Definitivní diagnóza může být stanovena pouze na základě histologického vyšetření. Mikroskopická různorodost a nízká četnost případů má svůj odraz v častých nejasnostech o klinickém postupu a nízké úspěšnosti léčby této patologie.
V kazuistice představujeme případ 60leté pacientky odeslané z okresní nemocnice, kde byla provedena ablace cervikálního polypu a separovaná kyretáž s histologickým nálezem vysoce maligního KS s melanomovou diferenciací. Vzhledem k nálezu byl v našem onkogynekologickém centru proveden radikální výkon v rozsahu střední laparotomie, extrafasciální hysterektomie s oboustrannou adnexektomií, infrakolická a suprakolická omentektomie, apendektomie a pánevní a paraaortální lymfadenektomie.
Definitivní histologické zpracování potvrdilo diagnózu karcinosarkomu s diferenciací do maligního melanomu stadia pT1apN0M0. U nemocné byla následně indikována dispenzarizace gynekologem. Po osmi měsících od radikální chirurgické léčby byla pacientka přijata k symptomatické terapii pro generalizaci karcinosarkomu a rozsáhlou plicní embolii.
VLASTNÍ POZOROVÁNÍ
Šedesátiletá žena byla odeslána do Komplexního onkologického centra (KOC) FN Plzeň z gynekologického oddělení okresní nemocnice, kde byla provedena ablace cervikálního polypu velikosti 5×3 cm a separovaná kyretáž pro šest měsíců trvající špinění. Histologicky byl verifikován karcinosarkom s melanomovou diferenciací vycházející z cervikálního polypu. Bylo doplněno oční a kožní vyšetření, které neprokázaly známky primárního melanomu. Pacientka měla negativní gynekologickou anamnézu, pravidelně gynekologem sledována nebyla, naposledy byla vyšetřena před třemi lety. V osobní anamnéze měla pouze varixy obou dolních končetin při pravidelném užívání vazoprotektiv.
Podle vstupního gynekologického vyšetření v KOC FN Plzeň byla v zrcadlech v zevní brance patrná kontaktně krvácející žláznatá struktura velikosti 8×5 mm, makroskopicky podezřelá z rezidua tumoru, v oblasti levé poševní stěny dále patrné suspektní ložisko o rozměrech 1,2×1,5 mm (obr. 1, 2). Podle expertního sonografického vyšetření na Gynekologicko-porodnické klinice FN Plzeň byla popsána děloha a děložní hrdlo normální velikosti, v oblasti zevní branky centrálně patrné hyperechogenní reziduum po odstraněném maligním polypu velikosti 10×8×7 mm, s diskrétní vaskularizací, parametria bez infiltrace, Douglasův prostor bez volné tekutiny, myometrium homogenní, dutina děložní symetrická, dobře ohraničená, endometrium nízké, ovaria atrofická, normálního vzhledu, oblast pánevních cév a třísel bez patologické lymfadenopatie (obr. 3, 4).
Image 1. Reziduum tumoru v oblasti zevní branky po polypektomii 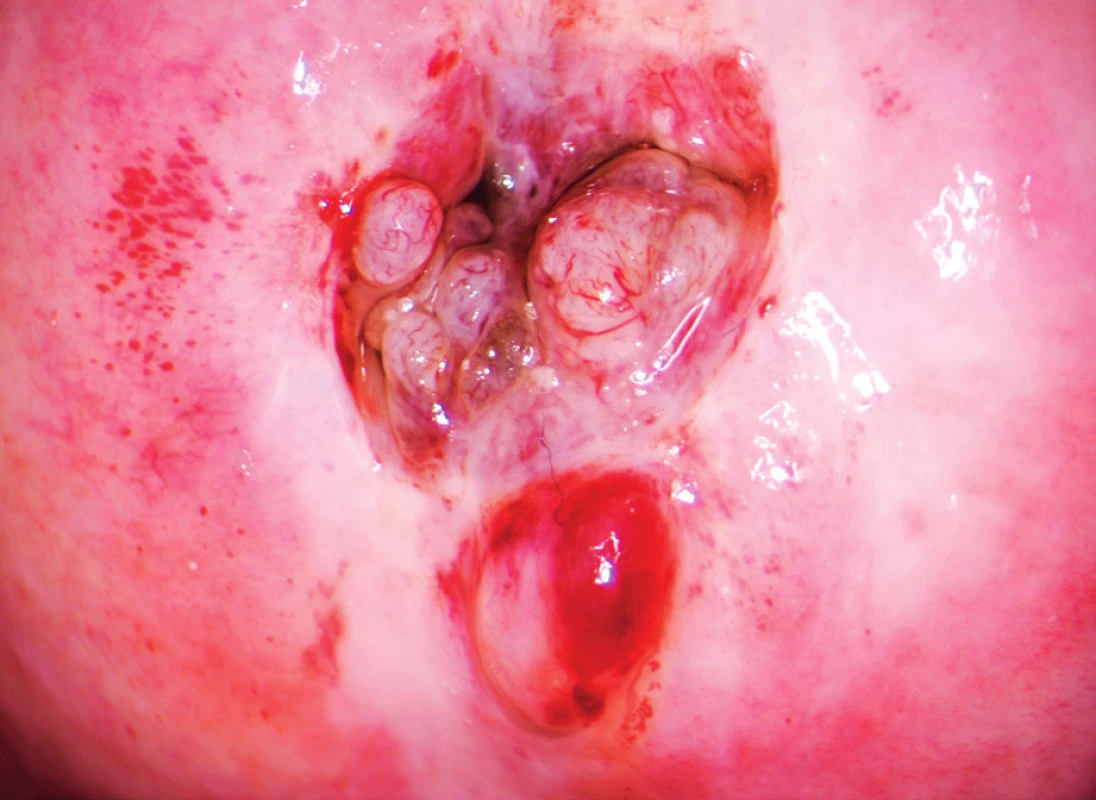
Image 2. Suspektní ložisko na poševní stěně 
Image 3. Hyperechogenní reziduum po odstraněném maligním polypu 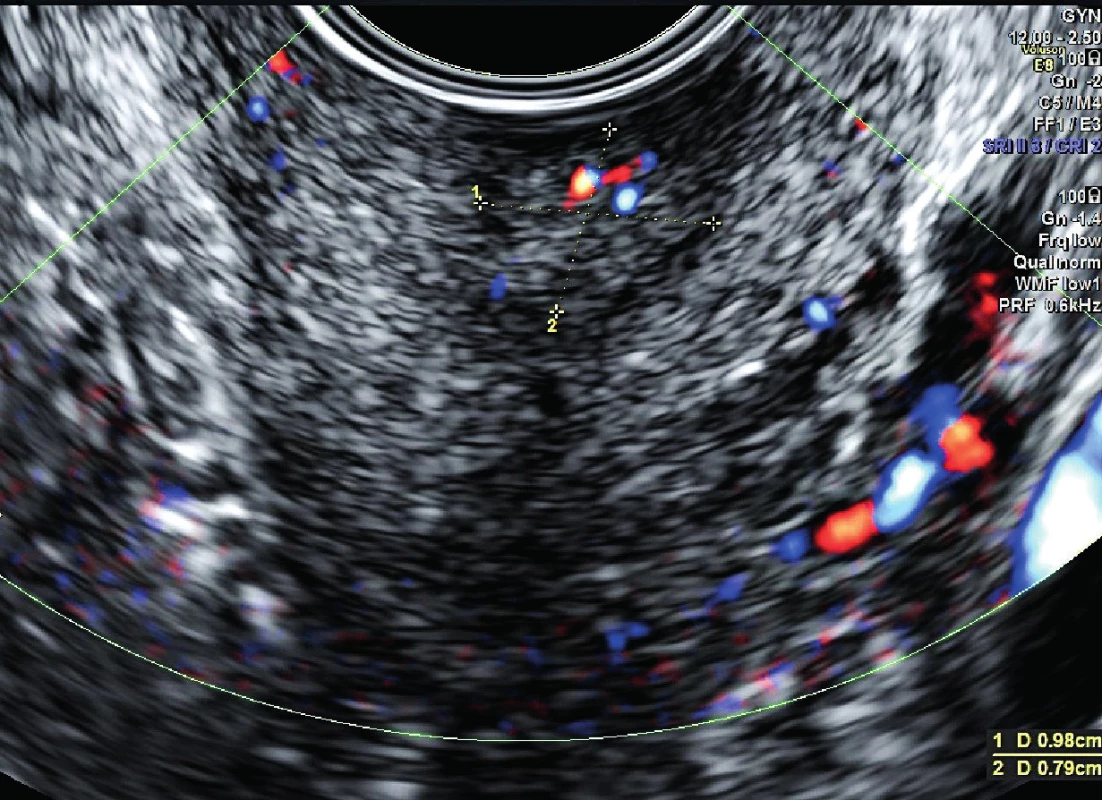
Image 4. Přívodná céva s diskrétním cévním zásobením 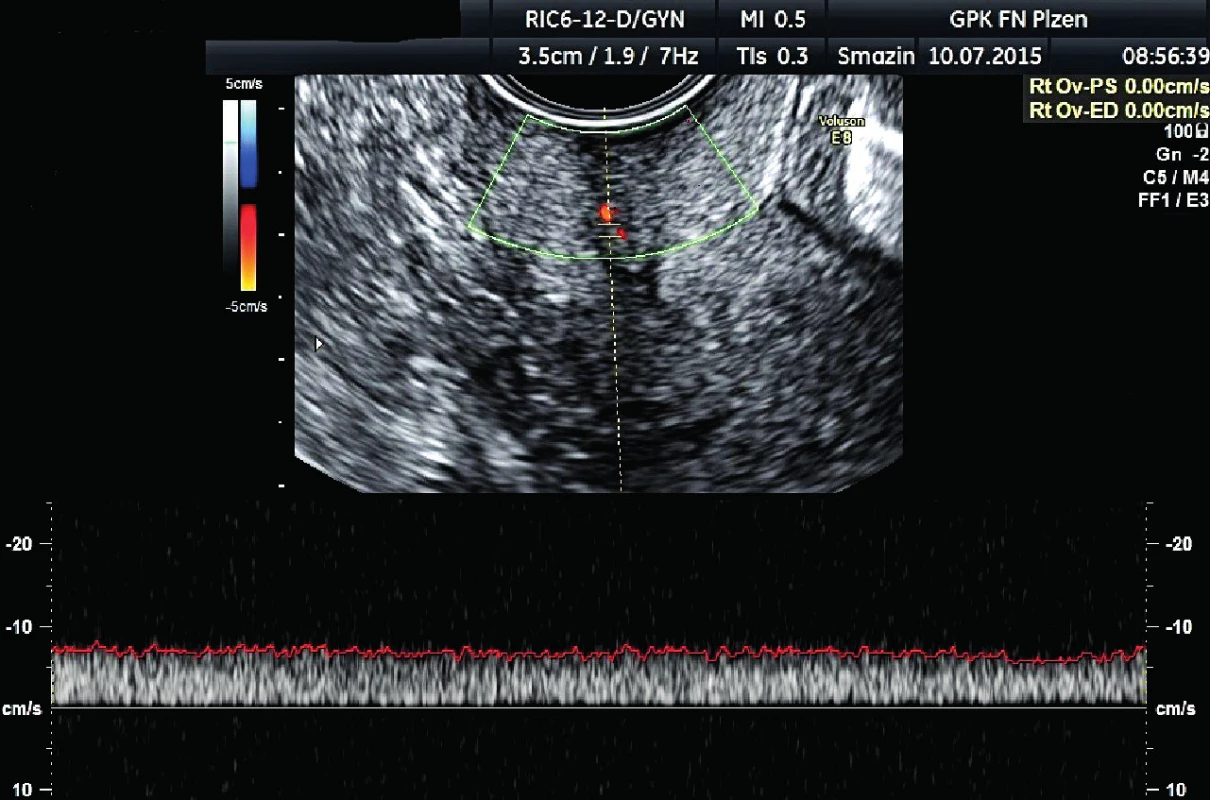
Vzhledem k histologickému nálezu byla indikována radikální chirurgická léčba v rozsahu střední laparotomie: lavage dutiny břišní, extrafasciální hysterektomie s oboustrannou adnexektomií, infrakolická a suprakolická omentektomie, apendektomie, pánevní a paraaortální lymfadenektomie, a exstirpace suspektního ložiska z levé poševní stěny. Perioperačně byla zjištěna volná děloha v anteverzi, anteflexi, normální velikosti a vzhledu, adnexa oboustranně bez patologických změn, v Douglasově prostoru fyziologické množství výpotku, peritoneum, střevo i omentum bez maligních změn, bránice, játra a podjaterní krajina bez známek tumoru. Operace byla provedena s nulovým makroskopickým reziduem. Pooperační období proběhlo bez komplikací, pacientka byla propuštěna z hospitalizace devátý pooperační den.
Patologem byla popsána děloha s reziduem vřetenobuněčného epiteloidního novotvaru, který imunohistochemicky reagoval pozitivně s tyrozinázou, SOX10, HMB45 a s cytokeratiny. Omentum, apendix a lymfatické uzliny (histologicky vyšetřeno celkem 30 uzlin) bez nádorového postižení. Klinicky suspektní metastáza na poševní stěně byla histologicky vyšetřena a diagnostikována jako vaginální polyp. Cytologické vyšetření „lavage“ z břišní dutiny bylo negativní na přítomnost maligních buněk.
Vzhledem k přítomnosti jasných epitelových formací, vzhledem k nepřítomnosti primárního melanomu a absenci specifické translokace, byla vylučovacím způsobem stanovena diagnóza vysoce maligního KS s melanomovou diferenciací. Pacientka byla s definitivním výsledkem histologie přeložena na Onkologickou a radioterapeutickou kliniku FN Plzeň, kde byla indikována pouze pečlivá dispenzarizace gynekologem. Dále se již pacientka na kontrolní vyšetření na onkogynekologickou ambulanci KOC GPK FN Plzeň nedostavila.
Pacientka byla sledována u obvodního gynekologa, kterého navštívila dvakrát během čtyř měsíců, bez sonografického vyšetření a bez nálezu recidivy. Disease free interval (DFI) u pacientky trval asi pět měsíců. Po této době pacientka začala pozorovat pocit stupňujícího se nitrobřišního napětí a po třech měsících sama přichází na centrální příjem FN Plzeň pro zhoršení celkového stavu, týden trvající ortostázu a nechutenství, pozoruje námahovou dušnost, otok a zarudnutí levé dolní končetiny, bez bolesti na hrudi či bolesti břicha, průjmu a dysurie, stolice je pravidelná, normokolorická, bez nadýmání, plyny odcházejí, pacientka je subfebrilní, normotenzní s poslechově čistým dýcháním. Pro otok levé dolní končetiny bylo provedeno sonografické vyšetření žil dolních končetin, na kterém byla popsána subakutní rozsáhlá femoro-popliteo-crurální trombóza levé dolní končetiny, a proto byla doplněna CT angiografie s nálezem rozsáhlé plicní embolizace od větvení pravé a levé plicní tepny, jako vedlejší nález byla popisována volná tekutina a vícečetné peritoneální metastázy v pravém epigastriu. Byla provedena punkce ascitu pod USG kontrolou a vzorek punktátu odeslán na cytologické vyšetření.
Pacientka byla hospitalizována na I. interní klinice FN Plzeň, kde byla zahájená terapie nízkomolekulárním heparinem, infuzní terapie a indikována odlehčovací punkce ascitu. Cytologické vyšetření punktátu bylo pozitivní na přítomnost maligních buněk s jadernou pozitivitou SOX 10 a cytoplazmatickou pozitivitou HMB45, které odpovídají maligní komponentě dříve diagnostikovaného karcinosarkomu s melanomovou diferenciací. Sedmý den hospitalizace byla pacientka odeslána ke gynekologickému konziliárnímu vyšetření na ambulanci Gynekologicko-porodnické kliniky FN Plzeň. V pravém mezogastriu a hypogastriu byly hmatné fixované solidní rezistence. Bimanuální gynekologické vyšetření bylo ztížené ascitem, pochva klidná, bez zánětlivých změn a známek prorůstání, slepě končící. Dorzálně od poševního pahýlu je hmatný dolní pól fixované nepohyblivé solidní rezistence hladkých kontur, v průměru minimálně 7 cm. Při vyšetření per rectum je stěna rekta v dosahu prstu hladká. Nález byl uzavřen jako inoperabilní recidiva základního onemocnění, doporučena byla pozitronová emisní tomografie (PET-CT) k upřesnění rozsahu onemocnění, poté objednání k onkologickému konziliu k stanovení možnosti podání paliativní chemoterapie.
Podle PET-CT provedeného devátý den hospitalizace byla popsána rozsáhlá vysoce metabolicky aktivní generalizace maligního onemocnění na viscerálním i parietálním peritoneu. Počínající městnání v dutém systému pravé ledviny útlakem ureteru metastatickými pakety uzlin v úrovni dolního retroperitonea a pánve, ascites. Subjektivně se pacientka cítí velmi slabá, při námaze se zadýchává, je bledá, kachektizuje a po onkologickém konziliu byla přeložena na oddělení ORAK FN Plzeň. Vzhledem k celkovému stavu (WHO 3) byla pacientka shledána nevhodná k onkologické léčbě a dále byla doporučena pouze symptomatická léčba. Následně po domluvě s rodinou a pacientkou byl zajištěn překlad na Léčebnu dlouhodobě nemocných nemocnice Privamed Plzeň, kde pacientka zemřela.
DISKUSE
Karcinosarkom s melanomovou diferenciací patří mezi extrémně vzácná nádorová onemocnění s nepříznivou prognózou, krátkým DFI i overall survival (OS). Doposud byly popsány pouze dva případy karcinosarkomu endometria s melanomovou diferenciací (Pubmed a ScienceDirect). První je kazuistika 54leté ženy s anamnézou karcinomu prsu a zjištěným karinosarkomem endometria v průběhu léčby tamoxifenem. Po zahájení adjuvantní terapie pacientka zemřela za osm měsíců na generalizaci [7, 10, 15, 17]. Druhá kazuistika popisuje případ 65leté ženy s postmenopauzálním krvacením, u které byl diagnostikován špatně diferencovaný karcinom a byla provedena radikální hysterektomie s oboustrannou adnexektomií. Makroskopicky byl zjištěn endometriální tumor o velikosti tři centimetry, který histologicky odpovídal karcinosarkomu s větší epitelovou a menší mezenchymální komponentou a v obou dvou složkách byl nalezen melaninový pigment [1]. V citovaném článku nejsou uvedena klinická data o DFI či OS.
Karcinosarkom děložního těla nebo maligní smíšený mülleriánský tumor je nediferencovaný (metaplastický) karcinom, který zahrnuje karcinomatózní a sarkomatoidní, popřípadě sarkomové elementy rostoucí z jednoho maligního kmene. Karcinosarkom je považován za high-risk variantu endometriálního adenokarcinomu. Epidemiologie, rizikové faktory a klinické příznaky těchto tumorů jsou shodné. Karcinosarkom je vzácný nádor s nízkou incidencí, který tvoří méně než pět procent maligních nádorů děložního těla a typicky postihuje ženy ve věku 62–67 let [2]. Rizikové faktory vzniku tohoto onemocnění jsou podobné jako u endometriálního karcinomu a jsou spojeny s obezitou, nuliparitou, vlivem exogenních estrogenů a užíváním tamoxifenu [7, 15, 17]. Karcinosarkom je dáván také do souvislosti s předchozí iradiací pánve (0–30 %) [12]. Progestinová kontraceptiva jsou protektivním faktorem proti vzniku obou typů malignit. Podle klinických příznaků, laboratorních vyšetření a zobrazovacích metod není možné rozlišit karcinosarkom, endometriální karcinom a děložní sarkom. Diagnóza může být stanovena pouze na základě histologického vyšetření. Pacientky s heterologními tumory bývají starší, mívají pokročilejší onemocnění a mohou mít klasickou klinickou triádu: bolesti, krvácení a rychle se zvětšující dělohu. Z výše uvedených symptomů je děložní krvácení nejčastějším klinickým příznakem [5, 6]. Prozatím největší práce, která analyzuje symptomy karcinosarkomu, zahrnuje 300 pacientek s perimenopauzálním krvácením (82 %), pánevní bolestí (13 %) a výtokem (10 %) [5].
Více než 10 % pacientek s karcinosarkomem má metastatické postižení extragenitálních orgánů, 60 % extrauterinní šíření tumoru a při fyzikálním vyšetření je přítomna hmatná rezsitence v malé pánvi [13]. U 15 % pacientek lze diagnostikovat šíření tumoru do děložního hrdla při cervikální biopsii nebo kyretáži cervikálního kanálu [5]. Při diagnostice pacientek s podezřením na malignitu dělohy začíná vždy vyšetření sběrem anamnestických údajů, klinickým vyšetřením, a zejména expertním sonografickým vyšetřením. Pro KS může být charakteristický hyperechogenní vzhled v porovnání s okolním myometriem. Sonograficky by měla být popsána výška endometria, prorůstání nádoru do myometria a rozměry nádoru [8]. Avšak ani při expertním sonografickém vyšetření není možné odlišit karcinosarkom od endometriálního adenokarcinomu. U žen s klinickým podezřením na malignitu endometria je nutné provést cílenou biopsii cestou hysteroskopie či kyretáže dutiny děložní a na základě histologického výsledku a dalších obligatorních stagingových vyšetření je plánována následná léčba. Nicméně pokud je negativní biopsie endometria a klinické podezření na endometriální malignitu zůstává vysoké, je nutné bioptické vyšetření opakovat. Vzhledem k tomu, že karcinosarkom vychází ze sliznice děložní dutiny, je přístupnější k biopsii než čisté děložní sarkomy [3].
Diagnóza KS je založena na histologickém nálezu dvou komponent: epitelové (nejčastěji endometroidního karcinomu, adenokarcinomu se skvamózní diferenciací, serózního, clear cell nebo nediferencovaného karcinomu) a složky mezenchymální, podle které lze KS rozdělit na homologní, obsahující buňky, které jsou nativní součástí dělohy – hladká svalovina, endometriální stroma (endometriální stromální sarkom, leiomyosarkom, nediferencovaný endometriální sarkom) a heterologní, neobvyklou tkáň, jako je chrupavka, kost, kosterní svalovina – chondrosarkom, rabdomyosarkom, osteosarkom, liposarkom. U karcinosarkomů je typický jejich polypoidní růst. Na řezu jsou nehomogenní, s nekrózami, cystickými změnami a krvácením. Ačkoli bývá invaze do myometria pravidlem, tumor může být omezen pouze na polyp. Nejdůležitějším prognostickým faktorem u karcinosarkomu je stadium onemocnění, hloubka invaze do myometria a extrauterinní šíření nádoru. Lymfovaskulární invaze je spojena se signifikantně vyšší pravděpodobností metastázování.
Pacientky s histologicky verifikovanou diagnózou by se měly podrobit dalším doplňujícím vyšetřením k vyloučení metastatického postižení vzhledem k 20% riziku extragenitálního šíření již v době projevů prvních příznaků onemocnění. Neexistují žádné studie, které by preferovaly jednu zobrazovací metodu. Vhodná je výpočetní tomografie (CT) hrudníku, břicha a pánve pro hodnocení rozsahu onemocnění. Tyto informace jsou nezbytné ke stanovení příslušného léčebného plánu. Pozitronová emisní tomografie (PET), případně PET/CT může být použita místo CT vyšetření, existují pouze omezené údaje, které naznačují, že PET/CT poskytuje více informací, ale využití PET/CT nebylo spojeno se zlepšením celkového přežití [14]. Diferenciální diagnostika je stejná jako u endometriálního adenokarcinomu.
Ženy, u kterých biopsie prokázala karcinosarkom, lze rozdělit do dvou kategorií: pacientkám bez známek extrauterinního šíření je doporučena primární chirurgická léčba, ženám s extrauterinním šířením tumoru, které je omezeno jen na dutinu břišní, je doporučena chirurgická cytoredukce a u pacientek s extraabdominálním šířením tumoru je indikována paliativní léčba. Přínos chirurgické léčby nebo chemoterapie je individuální a záleží na symptomech a klinickém stavu pacientky. Dosud není jednoznačný konsenzus léčby tohoto onemocnění. Přístupem se neliší od adenokarcinomu endometria. V počátečních stadiích je indikována radikální chirurgická léčba s následnou dispenzarizací nebo adjuvantní chemoterapií (karboplatina + paklitaxel), která je preferovaná před radioterapií [16]. V pokročilých stadiích (III a více) je preferována primární chemoterapie. I přes záchyt onemocnění ve stadiu IA se pětileté přežití pohybuje kolem 50 %, pacientky ve vyšších stadiích umírají většinou do dvou let od zjištění diagnózy. Gonzales Bosquet et al. ve své práci provedli analýzu 121 pacientek po chirurgickém řešení děložního karcinosarkomu s následnou dispenzarizací (29 %), radioterapií (38 %) a chemoterapií (33 %). Bez ohledu na léčbu pětileté přežití u pacientek ve stadiu I/II bylo 59 %, st. III 22 %, st. IV 9 % [9].
ZÁVĚR
Karcinosarkom s melanomovou diferenciací je raritní, vysoce maligní tumor se špatnou prognózou, časným relapsem a krátkým celkovým přežitím. Nejdůležitějším prognostickým faktorem je stadium onemocnění [11]. Dalšími důležitými prognostickými faktory jsou lymfovaskulární invaze, věk pacientky a pozdní nástup menopauzy [4]. Pokud máme podezření na karcinosarkom, mezi základní zobrazovací metody k určení stadia by mělo patřit celotělové CT, event. PET-CT. Karcinosarkom má podobné šíření jako adenokarcinom, a proto se doporučuje stagingová operace v podobném rozsahu, jako odpovídá jednotlivým stadiím u adenokarcinomu. Cílem follow-up po radikální léčbě je časná detekce recidivy onemocnění. Dispenzarizace zahrnuje monitorování klinických symptomů a fyzikální vyšetření po třech měsících první dva roky a dále jednou za šest měsíců nebo ročně.
MUDr. Denis Berezovskiy
Gynekologicko-porodnická klinika
LF UK a FN
Alej Svobody 80
304 60 Plzeň
e-mail: den.berezovsky@gmail.com
Sources
1. Amant, F., Moerman, P., Davel, GH., et al. Uterine carcinosarcoma with melanocytic differentiation. Int J Gynecol Pathol, 2001, 20(2), p. 90–186.
2. Arend, R., Doneza, JA., Wright, JD. Uterine carcinosarcoma. Curr Opin Oncol, 2011, 23, p. 531.
3. Bansal, N., Herzog, TJ., Burke, W., et al. The utility of preoperative endometrial sampling for the detection of uterine sarcomas. Gynecol Oncol, 2008, 110, p. 43.
4. Bodner-Adler, B., Bodner, K., Obermair, A., et al. Prognostic parameters in carcinosarcomas of the uterus: a clinico-pathologic study. Anticancer Res, 2001, 21, p. 3069.
5. Callister, M., Ramondetta, LM., Jhingran, A., et al. Malignant mixed Müllerian tumors of the uterus: analysis of patterns of failure, prognostic factors, and treatment outcome. Int J Radiat Oncol Biol Phys, 2004, 58, p. 786.
6. Dave, KS., Chauhan, A., Bhansali, R., et al. Uterine carcinosarcomas: 8-year single center experience of 25 cases. Indian J Med Paediatr Oncol, 2011, 32, p. 149.
7. Fotiou, S., Hatjieleftheriou, G., Kyrousis, G., et al. Long-term tamoxifen treatment: a possible aetiological factor in the development of uterine carcinosarcoma: two case-reports and review of the literature. Anticancer Res, 2000, 20, p. 2015.
8. Frühauf, F., Dvořák, M., Haaková, L., et al. Ultrazvukový staging karcinomu endometria - doporučená metodika vyšetření. Čes Gynek, 2014, 79, 6, s. 76-466.
9. Gonzalez Bosquet, J., Terstriep, SA., Cliby, WA., et al. The impact of multi-modal therapy on survival for uterine carcinosarcomas. Gynecol Oncol, 2010, 116, p. 419.
10. Kajo, K., Zubor, P., Spacek, J., Ryska, A., et al. Carcinosarcoma of the uterus with melanocytic differentiation. Pathol Res Pract, 2007, 203, 10, p. 753.
11. Nemani, D., Mitra, N., Guo, M., Lin, L. Assessing the effects of lymphadenectomy and radiation therapy in patients with uterine carcinosarcoma: a SEER analysis. Gynecol Oncol, 2008, 111, p. 82.
12. Pothuri, B., Ramondetta, L., Martino, M., et al. Development of endometrial cancer after radiation treatment for cervical carcinoma. Obstet Gynecol, 2003, 101, p. 941.
13. Salazar, OM., Bonfiglio, TA., Patten, SF., et al. Uterine sarcomas: natural history, treatment and prognosis. Cancer, 1978, 42, p. 1152.
14. Tirumani, SH., Ojili, V., Shanbhogue, AK., et al. Current concepts in the imaging of uterine sarcoma. Abdom Imaging, 2013, 38, p. 397.
15. Treilleux, T., Mignotte, H., Clement-Chassagne, C., et al. Tamoxifen and malignant epithelial-nonepithelial tumours of the endometrium: report of six cases and review of the literature. Eur J Surg Oncol, 1999, 25, p. 477.
16. Wolfson, AH., Brady, MF., Rocereto, T., et al. A gynecologic oncology group randomized phase III trial of whole abdominal irradiation vs. cisplatin-ifosfamide and mesna as post-surgical therapy in stage I-IV carcinosarcoma of the uterus. Gynecol Oncol, 2007, 107, p. 177.
17. Zelmanowicz, A., Hildesheim, A., Sherman, ME., et al. Evidence for a common etiology for endometrial carcinomas and malignant mixed mullerian tumors. Gynecol Oncol, 1998, 69, p. 253.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2017 Issue 5-
All articles in this issue
- Selektivní fetoredukce u monochoriálních gravidit komplikovaných vrozenou vývojovou vadou jednoho z plodů: management a výsledky péče
- The finding of isolated oligohydramnios after 37th week of gestation and its association with perinatal outcome
-
Zevní obrat plodu z polohy podélné koncem pánevním po 36. týdnu gravidity
Analýza subjektivního hodnocení rodiček - Corifollitropin alfa u žen poprvé stimulovaných v programu mimotělního oplodnění
-
Screeningové vyšetření endometriálních NK buněk u vybraných infertilních pacientek
1. část – metodika a průběžné výsledky -
Jaká je česká dárkyně oocytů?
Analýza profilu - Jaké je riziko recidivy sestupu pánevních orgánů po vaginální hysterektomii s poševními plastikami?
- Karcinosarkom endometria s melanomovou diferenciací, kazuistika
-
Mola hydatidosa completa s přechodem do nemetastázující perzistující trofoblastické nemoci
Kazuistika, poučení a úvaha nad pravidly dispenzarizace a rozhodovacích mechanismů Forenzní zodpovědnost a postavení spádového gynekologa - Úloha mateřské imunity a mikrobiomu ženy v patogenezi předčasného porodu
- Endometrióza a kvalita života
- Management of Medical Termination of Pregnancy (MToP) up until the 7th week of gestation in the Czech Republic
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaké je riziko recidivy sestupu pánevních orgánů po vaginální hysterektomii s poševními plastikami?
-
Screeningové vyšetření endometriálních NK buněk u vybraných infertilních pacientek
1. část – metodika a průběžné výsledky - Selektivní fetoredukce u monochoriálních gravidit komplikovaných vrozenou vývojovou vadou jednoho z plodů: management a výsledky péče
- Endometrióza a kvalita života
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

