-
Medical journals
- Career
Význam trifolátů u gynekologických onemocnění
Authors: D. Neubert 1; R. Pilka 1; D. Stejskal 2,3; G. Krejčí 3
Authors‘ workplace: Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 1; VIA Agel, ředitelka Mgr. Ing. K. Murtingerová 2; Oddělení laboratorní medicíny Středomoravské nemocniční, a. s., přednosta prof. MUDr. D. Stejskal, Ph. D. 3
Published in: Ceska Gynekol 2016; 81(6): 444-450
Overview
Cíl:
Trefoil peptidy patří do skupiny malých peptidů, jejichž exprese je místně i tkáňově specifická. Tyto peptidy mají význam pro hojení sliznic, u nádorových onemocnění a v lidské reprodukci.Typ studie:
Literární přehled.Název a sídlo pracoviště:
Porodnicko-gynekologická klinika FN a LF UP Olomouc; Oddělení klinické biochemie, Středomoravská nemocniční a.s., Nemocnice Prostějov.Výsledky:
Trifoláty jsou v různé míře exprimovány v celé řadě karcinomů a u zánětlivých gastrointestinálních onemocnění. Mimo gastrointestinální trakt byly fyziologicky identifikovány v hypotalamu, hypofýze, endometriu a v normální prsní tkáni, kde reagují na stimulaci estrogeny. Exprese trifolátů byla zjištěna v nádorech urologických, gynekologických, gastrointestinálních, plicních a v karcinomu prsu. Navíc byly prokázány možné souvislosti mezi genetickými polymorfismy TFF3 a habituálním potrácením.Závěr:
V budoucnu by mohly být sérové hladiny trifolátů využívány jako markery pro nádorová a zánětlivá onemocnění, stejně jako pro poruchy reprodukce.Klíčová slova:
TFF, karcinom, endometriální, habituální potrácení, trefoil faktor, sérovýÚVOD
Trefoil peptidy (trifoláty) patří do skupiny malých peptidů bohatých na cystein. Trifolátové proteiny jsou definovány přítomností 42–43 aminokyselin, které tvoří unikátní strukturální motiv. Jejich tři páry disulfidových vazeb jsou zodpovědné za charakteristický vzhled molekuly ve tvaru trojlístku.
Byly pojmenovány jako „trefoil“ peptidy Thimem v roce 1989 [44]. Dosud byly identifikovány tři savčí trefoil peptidy. TFF1 byl objeven v roce 1982 při pátrání po estrogeny indukované mRNA v buněčných liniích karcinomu prsu a ve stejném roce byl objeven spazmolytický peptid (TFF2) při izolaci prasečího inzulinu [21, 28]. Střevní trifolát TFF3 byl původně objeven v roce 1991 u krys [41]. Ve snaze o standardizaci nomenklatury jsou tyto trefoil faktory dnes souhrnně nazývány rodina trifolátových peptidů (TFF). Všechny tři jsou zastoupeny v lidském těle a jejich geny jsou umístěny společně na chromozomu 21q22.3 [40]. Z animálních pozorování (myš, krysa, ropucha) je zřejmé, že trifolátová doména je evolučně velmi stabilní [19]. Jednotlivé trifolátové peptidy se tkáňově specificky vyskytují v epiteliálních buňkách lidského gastrointestinálního ústrojí: TFF1 v epiteliálních povrchových foveolárních buňkách celého žaludku, TFF2 v distální části žaludku a v dolních částech Brunnerových žlázek duodena a TFF3 v průběhu celé délky tenkého i tlustého střeva [13, 14, 36, 39, 45].
Image 1. Znázornění jedné molekuly trifolátového peptidu (TFF). 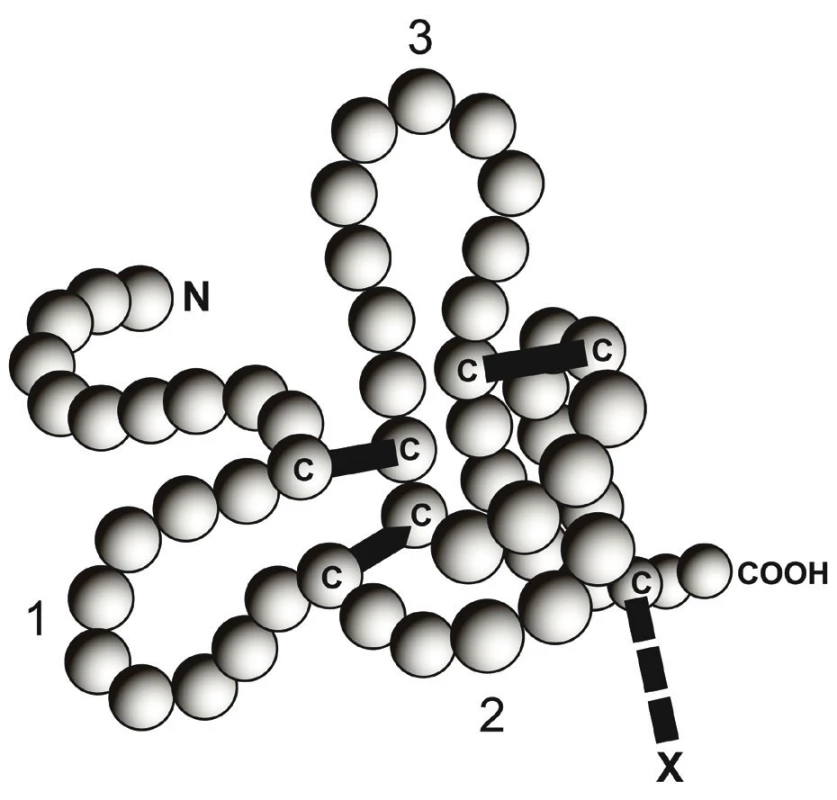
Kličky odpovědné za název „trifoláty“ jsou očíslovány. Esenciální pro tvar struktury jsou rezidua cysteinu (C). Pro některé funkce trifolátů je nezbytná dimerizace na místě „X“. Tak vzniká struktura podobná TFF2, obsahující dvě domény trifolátů. Jedná se o velmi stabilní molekuly, rezistentní k účinkům kyselin, proteáz i tepelné degradaci [21, 35].
Jejich fyziologický výskyt byl již dokumentován i v dalších tkáních – hypofýze, hypotalamu, slinných žlázách, v děloze a prsní tkáni [16, 33, 37, 38]. U mladých žen se vzorec exprese mění v závislosti na menstruačním cyklu. Naopak, v mukózních epiteliálních buňkách respiračního a močového ústrojí nebyly dosud identifikovány a je možné, že probíhající výzkumy odhalí další členy této rodiny. Trifoláty by v budoucnu mohly sloužit jako sérové markery nádorových a inflamatorních onemocnění, případně poruch reprodukce.
SOUVISLOST S RŮSTOVÝMI FAKTORY
Ačkoliv byl TFF3 objeven díky své podobnosti s lidským TGIF (transforming growth-interacting factor), nebyl dále prokázán žádný vztah mezi TFF3 a TGIF. Rovněž působení obou peptidů na buněčnou migraci je rozdílné. Jedna ze studií s TFF2 prokazuje „growth factor-like effects“ tohoto peptidu ve vztahu ke kolorektálnímu karcinomu (HCT116) a karcinomu prsu (MCF7). Je prokázán shodný protektivní účinek TFF peptidů, růstových faktorů, epidermálního růstového faktoru (EGF) a fibroblastového růstového faktoru na střevní mukózu [8, 16, 34]. Na zvířecím modelu byl dokumentován shodný vliv TFF3 a EGF na zvýšení sekrece prostaglandinů a elektrolytů v epiteliálních buňkách, která vedla k jejich ochraně proti ulceracím způsobeným účinkem indometacinu. EGF se podílí na regulaci exprese genu pro TFF1 a ovlivňuje celou řadu dalších procesů v těle, jako např. sekreci estrogenu, insulin-like growth faktoru 1, fibroblastového růstového faktoru. K účinkům EGF jsou senzitivní pouze geny pro TFF1, geny pro ostatní TFF peptidy jsou k těmto účinkům rezistentní [20].
MECHANISMUS PŮSOBENÍ
Dosud byly identifikovány dvě základní funkce trefoil peptidů v gastrointestinálním traktu – ochrana sliznic a tkáňové hojení. Tyto peptidy jsou považovány za proteiny „okamžité reakce“ na tkáňové poranění, kde ovlivňují časné fáze tkáňového hojení [35]. Kromě toho je možno tyto proteiny detekovat v případě mnoha humánních karcinomů. Trefoil peptidy zlepšují ochranné schopnosti supramukózní bariéry na povrchu sliznic gastrointestinálního traktu interakcí s mucinózními glykoproteiny a vytvořením viskoelastické mukózní gelové vrstvy chrání tyto buňky před působením žaludečních kyselin [23]. Role těchto peptidů je spatřována v indukci změn fyzikálních vlastností mucinu, vedoucí ke zvýšení optické hustoty a viskozity ochranné slizniční vrstvy. Dále se předpokládá jejich vliv na pohárkové buňky, kde ovlivňují sekreci a kvalitu produkovaného mucinu. TFF peptidy jsou též zřejmě vylučovány jako součást mucinu. Provedené studie předpokládají, že TFF peptidy přispívají k ochraně žaludeční sliznice před acidifikací tvorbou silnější ochranné vrstvy mukózního gelu v žaludku [9].
Table 1. Výskyt TFF peptidů v jednotlivých orgánech 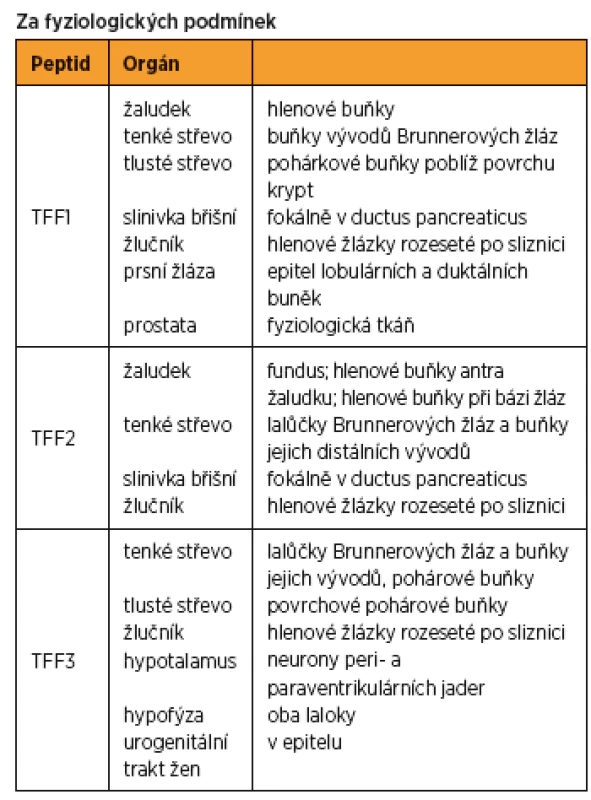

PID – pánevní zánětlivé onemocnění, UACL – ulcer-associated cell lineage Další práce přisuzují protektivní roli TFF spíše na úrovni působení na receptory. Transport chloridových iontů v gastrointestinálních epiteliálních buňkách je při pokusech in vitro indukován pouze v případě, když bazolaterální povrch buněk je vystaven působení TFF. Navázání TFF3 na membránový protein kolorektálních epiteliálních buněk je spojeno s následnou fosforylací tyrozinu a beta-kateinu. Tyto cytoplazmatické peptidy poté ovlivňují receptorovou odpověď [20]. Kromě ochrany sliznic trávicího ústrojí hrají TFF významnou roli též v procesu hojení již vzniklého poranění. Na mnoha zvířecích modelech, ale i lidských buněčných koloniích bylo prokázáno, že trefoil peptidy indukují buněčnou migraci, a tím umožňují rychlou obnovu mukózy po jejím poranění, což je proces zvaný restituce [23, 35]. Zvýšená koncentrace TFF peptidů byla pozorována v případech zánětlivých onemocnění střev a dále pak v blízkosti peptických ulcerací, zejména v epiteliálních buňkách migrujících přes bázi vředu [8].
Recentní studie podporují hypotézu významu TFF peptidů ve stimulaci obnovy gastrointestinálních poranění. Při pokusech na myších s nadprodukcí TFF2 byla demonstrována zvýšená rezistence na indometacinem indukované poškození sliznic [34]. Myši s nedostatkem genu pro TFF3 vykazovaly poruchu slizničního hojení a podléhaly důsledkům zánětlivých střevních onemocnění [27]. Stimulací migrace epiteliálních buněk z okrajů rány spolu se zplošťováním přiléhajících nepoškozených buněk přispívají tyto peptidy k obnovení integrity sliznic [24].
VZTAH K NEOPLAZIÍM
TFF1 byl původně izolován z buněk karcinomu prsu. Od té doby několik studií dokumentovalo vztah mezi TFF peptidy a vznikem neoplazií. Exprese TFF1 byla prokázána u mnoha známých epiteliálních karcinomů, včetně karcinomu prsu, žaludku, slinivky, plic, endometria, vaječníku (zejména mucinózní typ), prostaty a dále některých nádorů močového měchýře a hrdla děložního [5, 17]. Rozdílná exprese TFF proteinů u jednotlivých nádorů je nicméně poměrně dobře zdokumentována. U karcinomu prsu, kde je exprese TFF1 přítomna až u 50 % nádorů, je pozitivita na TFF1 spojena se stavem estrogenových receptorů, odpovědí na hormonální léčbu a příznivou prognózou [7, 11]. U všech ostatních tumorů se zdá být přítomnost TFF1 nezávislá na stavu estrogenových receptorů.
Dosud není známo, zda TFF peptidy ovlivňují vznik tumoru či jeho metastázování. Možnost detekovat TFF v nádorových tkáních či stanovovat jejich sérovou koncentraci by mohlo být klinicky užitečné.
Karcinom prsu
TFF1 byl objeven v souvislosti s karcinomem prsu [28, 35]. Bylo prokázáno, že většina karcinomů prsu vykazuje přítomnost TFF1 a TFF3 [37]. Ve více než 68 % případů tohoto karcinomu byla zjištěna zvýšená exprese TFF1, TFF3 bylo exprimováno v 90 % případů [30, 37]. Zvýšená exprese TFF1 i TFF3 byla prokázána jak v případě duktálního a lobulárního karcinomu in situ, tak i v případě karcinomu invazivního [37].
Karcinom prostaty
Většina karcinomů prostaty exprimuje TFF1. Přítomnost TFF1 vykazuje kromě vlastního maligního tumoru též přilehlá tkáň hyperplastická, na druhou stranu fyziologická prostatická tkáň je TFF1 negativní [5]. Toto zjištění se jeví jako klinicky významné při hodnocení histologicky negativních biopsií prostaty, která jsou však TFF1 pozitivní. Tento nález může predikovat vysokou pravděpodobnost přítomnosti malignity kdekoli v prostatické tkáni. TFF1 je detekováno ve velmi úzké návaznosti na neuroendokrinní buňky karcinomu prostaty; význam tohoto vztahu však zůstává nejasný [5]. Neuroendokrinní buňky ve střevní tkáni postižené chronickou ulcerací však rovněž exprimují TFF1, což by mohlo znamenat, že trifoláty mohou hrát roli v modulaci buněčného uvolňování neuroendokrinních peptidů.
Karcinom žaludku
TFF1 je běžně přítomen v žaludeční tkáni. Exprese TFF1 je nižší v případě adenomu a karcinomu žaludku v porovnání s hyperplastickými polypy či normální tkání mukózy [25]. Až v polovině případů všech karcinomů žaludku pak exprese genu pro TFF1 zcela chybí [17, 26]. Některé práce prokazují vztah mezi expresí TFF1 a stagingem tumoru. Exprese TFF3 pak byla prokázána v enterocytech adenomů a karcinomů tlustého střeva, kdy tyto enterocyty současně ztrácejí svou typickou morfologii pohárkových (goblet) buněk. Zatímco kompletní ztráta exprese proteinů je u karcinomů tlustého střeva vzácná, snížené hladiny jsou často asociovány s nekrózou tumoru a pokročilým stagingem [42].
Table 2. Výskyt TFF u nádorových onemocnění 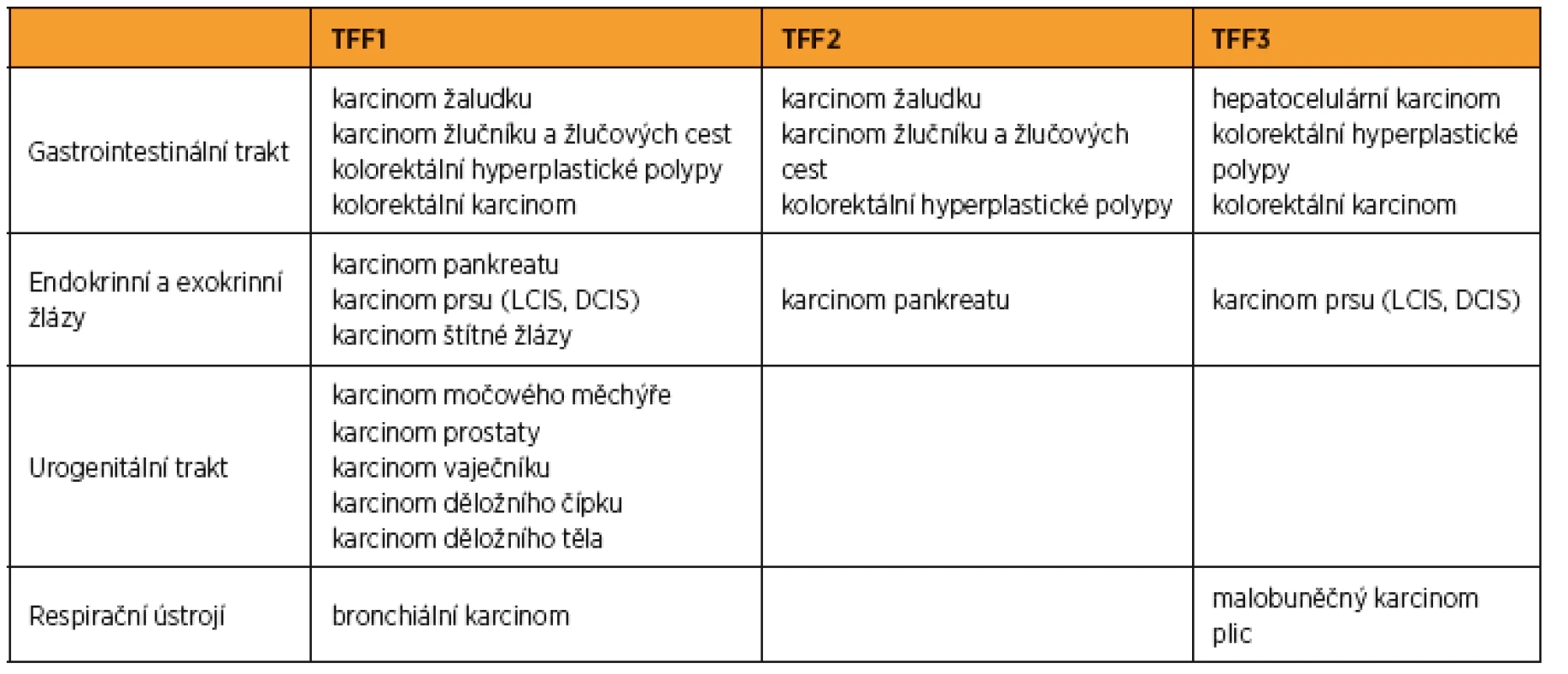
LCIS – lobulární karcinom in situ, DCIS – duktální karcinom in situ Kolorektální karcinom
TFF3 je běžně ve velkém množství obsažen ve slizničních buňkách tlustého střeva za fyziologického stavu, zatímco v případě kolorektální neoplazie je jeho množství značně sníženo [42]. U kolorektálních adenomů byla popsána silná pozitivní korelace mezi expresí TFF3 a stupněm dysplastických změn [42]. Ztráta exprese TFF3 naopak koreluje se ztrátou buněčné diferenciace a s pokročilejším stadiem onemocnění [42, 46]. To může ukazovat na význam TFF pro průběh tumorogeneze a pro přechod z adenomu do metastatického karcinomu, zejména s ohledem na jejich migrační a cytokinetický efekt.
Nádory plic
Benigní tumory plic, skvamózní či malobuněčný bronchogenní karcinom nejsou spojeny se zvýšenou sérovou hladinou TFF1 [18]. Naopak, zvýšené průměrné sérové hladiny a imunohistochemická pozitivita byly prokázány u pokročilých stadií bronchogenního karcinomu, zejména u „goblet cell“ podtypů a karcinomu bronchoalveolárního. TFF1 pozitivní adenokarcinomy plic jsou rovněž spojeny s horší prognózou než karcinomy TFF1 negativní [18].
GYNEKOLOGICKÁ ONEMOCNĚNÍ
Karcinom endometria
V nedávných studiích byly prokázány vyšší sérové hladiny TFF3 u pacientek s endometriálním karcinomem G3 ve srovnání se zdravými kontrolami a pacientkami s hyperplazií endometria [4]. Podobně imunohistochemické analýzy ukázaly zvýšenou expresi TFF3 u špatně diferencovaných endometriálních karcinomů [32]. Použití imunohistochemického panelu obsahujícího estrogenový receptor (ER), progesteronový receptor (PR), insulin-like growth factor II mRNA – binding protein 3 (IMP3) a TFF3 umožňuje bezpečně odlišit vzácné podtypy karcinomů endometria G3 od serózního karcinomu a karcinomu z jasných buněk. Na rozdíl od špatně diferencovaného karcinomu endometria mají přes podobnou histopatologii serózní karcinom a karcinom z jasných buněk významně horší prognózu z hlediska přežití pacientek. Možnost odlišení těchto nádorů pomocí imunomarkerů nabývá na významu zejména v případě, že je tento krok možné učinit již na materiálu získaném z biopsie/kyretáže a následně včas uzpůsobit adekvátní management léčby těchto onemocnění [31].
Receptivita endometria a habituální potrácení
Je známo, že povrchové muciny jsou důležité pro receptivitu endometria a jeho schopnost selekce a implantace vysoce kvalitních embryí. Současně u žen s habituálním potrácením byla prokázána nižší endometriální exprese určitých mucinů ve srovnání s ženami zdravými. Tato snížená exprese může být příčinou narušené receptivity endometria umožňující implantaci defektních embryí [3, 12, 43]. U žen s habituálním potrácením byly rovněž zjištěny nižší hladiny endometriálních mucinů v sekreční fázi cyklu [3]. Produkce TFF3 byla kromě jiných epiteliálních povrchů prokázána i v děložním endometriu [6, 22]. Pomocí genové analýzy byl TFF3 rovněž identifikován jako jeden z možných faktorů receptivity endometria v období implantace [2]. V nedávné studii byla prokázána souvislost mezi genovými polymorfismy TFF3, počtem úspěšně ukončených těhotenství a habituálním potrácením [15].
TFF JAKO BIOMARKERY ONEMOCNĚNÍ
Jaká je možná role TFF jako markerů v nové éře stratifikované medicíny? Nabízí se celkem šest možností využití těchto markerů. Především je nutno upřesnit, které buňky podléhají regulaci těmito proteiny a zda jsou tyto proteiny produkovány nádorovými buňkami. Za normálních okolností jsou TFF secernovány intraluminárně a uplatňují svůj protektivní vliv na epiteliální hlenovou vrstvu. U invazivních nádorů však jsou TFF secernovány do stromatu, a indikují tak metastatický fenotyp.
Druhou otázkou je, zda je nutno odlišovat různé molekulární formy. Z dosavadních studií se zdá, že ano, protože TFF1 diomer má větší potenci než monomer. Nádory žaludku tak mají větší sklon k metastázování, pokud chybí sekrece heterodimeru TFF1 [29].
Třetí zkoumanou oblastí je, zda TFF1 a TFF3 jsou prediktivními markery odpovědi na endokrinní terapii. Existují v tomto směru velmi silné podpůrné argumenty zejména pro využití TFF1 u karcinomu prsu [10].
Čtvrtým aspektem je vztah trifolátů k metastázám. TFF3 umožňuje odlišit buňky s větším či menším sklonem k metastázování; jeho vyšší exprese je asociována s tendencí k lymfovaskulární invazi. Ke zvážení je zde tak možnost, že stanovování hladin trifolátů jako prognostických biomarkerů by mohlo identifikovat špatně diferencované nádory s horší prognózou, a tak nahradit vyšetřování lymfatických uzlin [1].
Pátou oblastí jejich využití jako biomarkerů je možnost rozlišení pomocí hladin trifolátů případnou vnitřní heterogenitu nádorů. Pro prognostické biomarkery invaze a metastázování (v tomto případě trifolátů) by bylo velmi důležité, pokud by jejich sérové hladiny byly schopny odlišit existenci více, či méně agresivních populací buněk v nádoru. Právě případná možnost stanovení podílu buněk v nádoru se sklonem k metastázování by byla nesmírně důležitá a přínosná.
Poslední, šestou možností je využití trifolátů v diagnostice a léčbě patologických stavů reprodukce ve smyslu habituálního potrácení a poruch receptivity endometria a implantace.
ZÁVĚR
Význam TFF peptidů je postupně studován od okamžiku jejich objevu v roce 1982. Ukazuje se, že spolu s luminálními muciny hrají ústřední roli v ochraně sliznic žaludku a střev a podílejí se na hojivém procesu po ulceraci. Jejich exprese a biologická aktivita jsou úzce spojeny s hormonálním řízením, růstovými faktory a onkogenními stimuly. Změny v jejich expresi s následnými poruchami sekrece mucinů mohou být příčinou narušené receptivity endometria. Na základě experimentálních a observačních studií je zřejmý jejich potenciální význam v morfogenezi, maligní transformaci a poruchách reprodukce.
MUDr. David Neubert
Porodnicko-gynekologická klinika
FN a LF UP
I. P. Pavlova 6
775 00 Olomouc
e-mail: david.neubert@seznam.cz
Sources
1. Ahmed, AR., Griffiths, AB., Tilby, MT., et al. TFF3 is a normal breast epithelial protein and is associated with differentiated phenotype in early breast cancer but predisposes to invasion and metastasis in advanced disease. Am J Pathol, 2012, 180(3), p. 904–916.
2. Altmae, S., Martinez-Conejero, JA., Salumets, A., et al. Endometrial gene expression analysis at the time of embryo implantation in women with unexplained infertility. Mol Hum Reprod, 2010, 16(3), p. 178–187.
3. Aplin, JD., Hey, NA., Li, TC. MUC1 as a cell surface and secretory component of endometrial epithelium: reduced levels in recurrent miscarriage. Am J Reprod Immunol, 1996, 35(3), p. 261–266.
4. Bignotti, E., Ravaggi, A., Tassi, RA., et al. Trefoil factor 3: a novel serum marker identified by gene expression profiling in high-grade endometrial carcinomas. Br J Cancer, 2008, 99(5), p. 768–773.
5. Bonkhoff, H., Stein, U., Welter, C., et al. Differential expression of the pS2 protein in the human prostate and prostate cancer: association with premalignant changes and neuroendocrine differentiation. Hum Pathol, 1995, 26(8), p. 824–828.
6. Borthwick, JM., Charnock-Jones, DS., Tom, BD., et al. Determination of the transcript profile of human endometrium. Mol Hum Reprod, 2003, 9(1), p. 19–33.
7. Cappelletti, V., Coradini, D., Scanziani, E., et al. Prognostic relevance of pS2 status in association with steroid receptor status and proliferative activity in node-negative breast cancer. Eur J Cancer, 1992, 28A(8–9), p. 1315–1318.
8. Dignass, A., Lynch-Devaney, K., Kindon, H., et al. Trefoil peptides promote epithelial migration through a transforming growth factor beta-independent pathway. J Clin Invest, 1994, 94(1), p. 376–383.
9. Engel, E., Guth, PH., Nishizaki, Y., et al. Barrier function of the gastric mucus gel. Am J Physiol, 1995, 269(6 Pt 1), p. G994–999.
10. Foekens, JA., Portengen, H., Look, MP., et al. Relationship of PS2 with response to tamoxifen therapy in patients with recurrent breast cancer. Br J Cancer, 1994, 70(6), p. 1217–1223.
11. Foekens, JA., Rio, MC., Seguin, P., et al. Prediction of relapse and survival in breast cancer patients by pS2 protein status. Cancer Res, 1990, 50(13), p. 3832–3837.
12. Gipson, IK., Blalock, T., Tisdale, A., et al. MUC16 is lost from the uterodome (pinopode) surface of the receptive human endometrium: in vitro evidence that MUC16 is a barrier to trophoblast adherence. Biol Reprod, 2008, 78(1), p. 134–142.
13. Hanby, AM., Poulsom, R., Elia, G., et al. The expression of the trefoil peptides pS2 and human spasmolytic polypeptide (hSP) in ‚gastric metaplasia‘ of the proximal duodenum: implications for the nature of ‚gastric metaplasia‘. J Pathol, 1993, 169(3), p. 355–360.
14. Hanby, AM., Poulsom, R., Singh, S., et al. Spasmolytic polypeptide is a major antral peptide: distribution of the trefoil peptides human spasmolytic polypeptide and pS2 in the stomach. Gastroenterology, 1993, 105(4), p. 1110–1116.
15. Haroun, S., Altmae, S., Karypidis, H., et al. Association between trefoil factor 3 gene variants and idiopathic recurrent spontaneous abortion. Reprod Biomed Online, 2014, 29(6), p. 737–744.
16. Hauser, F., Poulsom, R., Chinery, R., et al. hP1.B, a human P-domain peptide homologous with rat intestinal trefoil factor, is expressed also in the ulcer-associated cell lineage and the uterus. Proc Natl Acad Sci U S A, 1993, 90(15), p. 6961–6965.
17. Henry, JA., Bennett, MK., Piggott, NH., et al. Expression of the pNR-2/pS2 protein in diverse human epithelial tumours. Br J Cancer, 1991, 64(4), p. 677–682.
18. Higashiyama, M., Doi, O., Kodama, K., et al. Estimation of serum level of pS2 protein in patients with lung adenocarcinoma. Anticancer Res, 1996, 16(4B), p. 2351–2355.
19. Hoffmann, W. A new repetitive protein from Xenopus laevis skin highly homologous to pancreatic spasmolytic polypeptide. J Biol Chem, 1988, 263(16), p. 7686–7690.
20. Chinery, R., Cox, HM. Modulation of epidermal growth factor effects on epithelial ion transport by intestinal trefoil factor. Br J Pharmacol, 1995, 115(1), p. 77–80.
21. Jorgensen, KH., Thim, L., Jacobsen, HE. Pancreatic spasmolytic polypeptide (PSP): I. Preparation and initial chemical characterization of a new polypeptide from porcine pancreas. Regul Pept, 1982, 3(3–4), p. 207–219.
22. Kao, LC., Tulac, S., Lobo, S., et al. Global gene profiling in human endometrium during the window of implantation. Endocrinology, 2002, 143(6), p. 2119–2138.
23. Kindon, H., Pothoulakis, C., Thim, L., et al. Trefoil peptide protection of intestinal epithelial barrier function: cooperative interaction with mucin glycoprotein. Gastroenterology, 1995, 109(2), p. 516–523.
24. Lacy, ER., Morris, GP.,Cohen, MM. Rapid repair of the surface epithelium in human gastric mucosa after acute superficial injury. J Clin Gastroenterol, 1993, 17, Suppl. 1, p. S125–S135.
25. Machado, JC., Carneiro, F., Blin, N., et al. Pattern of pS2 protein expression in premalignant and malignant lesions of gastric mucosa. Eur J Cancer Prev, 1996, 5(3), p. 169–179.
26. Machado, JC., Carneiro, F., Ribeiro, P., et al. pS2 protein expression in gastric carcinoma. An immunohistochemical and immunoradiometric study. Eur J Cancer, 1996, 32A(9), p. 1585–1590.
27. Mashimo, H., Wu, DC., Podolsky, DK., et al. Impaired defense of intestinal mucosa in mice lacking intestinal trefoil factor. Science, 1996, 274(5285), p. 262–265.
28. Masiakowski, P., Breathnach, R., Bloch, J., et al. Cloning of cDNA sequences of hormone-regulated genes from the MCF-7 human breast cancer cell line. Nucleic Acids Res, 1982, 10(24), p. 7895–7903.
29. May, FE., Griffin, SM., Westley, BR. The trefoil factor interacting protein TFIZ1 binds the trefoil protein TFF1 preferentially in normal gastric mucosal cells but the co-expression of these proteins is deregulated in gastric cancer. Int J Biochem Cell Biol, 2009, 41(3), p. 632–640.
30. May, FE., Westley, BR. Cloning of estrogen-regulated messenger RNA sequences from human breast cancer cells. Cancer Res, 1986, 46(12 Pt 1), p. 6034–6040.
31. Mhawech-Fauceglia, P., Yan, L., Liu, S., et al. ER+ /PR+ /TFF3+ /IMP3 - immunoprofile distinguishes endometrioid from serous and clear cell carcinomas of the endometrium, p. a study of 401 cases. Histopathology, 2013, 62(7), p. 976–985.
32. Mhawech, P., Benz, A., Cerato, C., et al. Downregulation of 14-3-3sigma in ovary, prostate and endometrial carcinomas is associated with CpG island methylation. Mod Pathol, 2005, 18(3), p. 340–348.
33. Piggott, NH., Henry, JA., May, FE., et al. Antipeptide antibodies against the pNR-2 oestrogen-regulated protein of human breast cancer cells and detection of pNR-2 expression in normal tissues by immunohistochemistry. J Pathol, 1991, 163(2), p. 95–104.
34. Playford, RJ., Marchbank, T., Goodlad, RA., et al. Transgenic mice that overexpress the human trefoil peptide pS2 have an increased resistance to intestinal damage. Proc Natl Acad Sci U S A, 1996, 93(5), p. 2137–2142.
35. Playford, RJ., Marchbank, T., Chinery, R., et al. Human spasmolytic polypeptide is a cytoprotective agent that stimulates cell migration. Gastroenterology, 1995, 108(1), p. 108–116.
36. Podolsky, DK., Lynch-Devaney, K., Stow, JL., et al. Identification of human intestinal trefoil factor. Goblet cell-specific expression of a peptide targeted for apical secretion. J Biol Chem, 1993, 268(9), p. 6694–6702.
37. Poulsom, R., Hanby, AM., Lalani, EN., et al. Intestinal trefoil factor (TFF 3) and pS2 (TFF 1), but not spasmolytic polypeptide (TFF 2) mRNAs are co-expressed in normal, hyperplastic, and neoplastic human breast epithelium. J Pathol, 1997, 183(1), p. 30–38.
38. Probst, JC., Zetzsche, T., Weber, M., et al. Human intestinal trefoil factor is expressed in human hypothalamus and pituitary: evidence for a novel neuropeptide. FASEB J, 1996, 10(13), p. 1518–1523.
39. Rio, MC., Bellocq, JP., Daniel, JY., et al. Breast cancer-associated pS2 protein: synthesis and secretion by normal stomach mucosa. Science, 1988, 241(4866), p. 705–708.
40. Seib, T., Blin, N., Hilgert, K., et al. The three human trefoil genes TFF1, TFF2, and TFF3 are located within a region of 55 kb on chromosome 21q22.3. Genomics, 1997, 40(1), p. 200–202.
41. Suemori, S., Lynch-Devaney, K., Podolsky, DK. Identification and characterization of rat intestinal trefoil factor: tissue - and cell-specific member of the trefoil protein family. Proc Natl Acad Sci U S A, 1991, 88(24), p. 11017–1121.
42. Taupin, D., Ooi, K., Yeomans, N., et al. Conserved expression of intestinal trefoil factor in the human colonic adenoma-carcinoma sequence. Lab Invest, 1996, 75(1), p. 25–32.
43. Teklenburg, G., Salker, M., Heijnen, C., et al. The molecular basis of recurrent pregnancy loss: impaired natural embryo selection. Mol Hum Reprod, 2010, 16(12), p. 886–895.
44. Thim, L. A new family of growth factor-like peptides. ‚Trefoil‘ disulphide loop structures as a common feature in breast cancer associated peptide (pS2), pancreatic spasmolytic polypeptide (PSP), and frog skin peptides (spasmolysins). FEBS Lett, 1989, 250(1), p. 85–90.
45. Tomasetto, C., Rio, MC., Gautier, C., et al. hSP, the domain-duplicated homolog of pS2 protein, is co-expressed with pS2 in stomach but not in breast carcinoma. EMBO J, 1990, 9(2), p. 407–414.
46. Uchino, H., Kataoka, H., Itoh, H., et al. Expression of intestinal trefoil factor mRNA is downregulated during progression of colorectal carcinomas. J Clin Pathol, 1997, 50(11), p. 932–934.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2016 Issue 6-
All articles in this issue
- Současné možnosti preimplantačního genetického screeningu a preimplantační genetické diagnostiky
- Mutace v genech ovlivňujících plodnost mužů – současná rutinní laboratorní genetická diagnostika a hledání dalších úseků DNA a genů, ovlivňujících spermatogenezi
- Význam trifolátů u gynekologických onemocnění
- Možnosti užití selektivních modulátorů progesteronových receptorů v léčbě děložních myomů
- Sarkoidóza ženského pohlavního ústrojí
- Samovyšetření prsu. Ano, či ne?
- Celiakia ako možná príčina niektorých gynekologicko-pôrodníckych ochorení
- Incidence císařského řezu a úspěšnost vaginálně vedeného porodu u těhotných po myomektomii
- Ektopická gravidita v jizvě po císařském řezu
- Gravidita u pacientek s vrozenou krvácivou chorobou
- Cervix skóre dle Bishopa a jeho modifikace
- Nekrotizující fasciitida laterální svalové skupiny stehna jako pozdní komplikace inzerce tahuprosté transobturátorové pásky
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cervix skóre dle Bishopa a jeho modifikace
- Ektopická gravidita v jizvě po císařském řezu
- Samovyšetření prsu. Ano, či ne?
- Celiakia ako možná príčina niektorých gynekologicko-pôrodníckych ochorení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

