-
Medical journals
- Career
Laparoskopická lymfadenektomie v gynekologické operativě
Authors: M. Mára; M. Fanta; J. Sláma; Michal Zikán; K. Kubínová; D. Kužel; D. Cibula
Authors‘ workplace: Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Published in: Ceska Gynekol 2012; 77(4): 320-326
Overview
Cíl studie:
Analyzovat naše zkušenosti s prováděním transperitoneální laparoskopické disekce lymfatických uzlin u žen s gynekologickými malignitami.Typ studie:
Retrospektivní klinická studie.Název a sídlo pracoviště:
Centrum gynekologické endoskopie a minimálně invazivní chirurgie; Gynekologicko-porodnická klinika VFN a 1. LF UK v Praze.Metodika:
Analýza vlastních dat z laparoskopických operací v letech 2006–2011, jejichž součástí nebo jediným cílem byla systematická pánevní (PLN) a/nebo paraaortální lymfadenektomie (PALN) a/nebo exstirpace sentinelových uzlin z pánve a/nebo cílená exstirpace „bulky“ lymfatické uzliny z pánve či paraaortální oblasti.Výsledky:
Provedli jsme celkem 177 primárně laparoskopických výkonů, zaměřených na disekci pánevních a/nebo paraaortálních lymfatických uzlin. Průměrný operační čas a počet získaných uzlin byl 82 minut a 26,5 uzlin u PLN, resp. 75 minut a 12,5 uzlin u PALN. Frekvence laparo-konverzí v celém souboru byla 4,5 %, vážné komplikace se vyskytly v 6,8 % případů, závažné krvácení u 5,6 % a ustoupení od zamýšlené lymfadenektomie u 2,3 % pacientek. Častěji se komplikace vyskytovaly v ouvislosti s ALN.Závěr:
Laparoskopická PLN i PALN jsou technicky proveditelnými výkony u velké většiny indikovaných pacientek s požadovaným ziskem lymfatických uzlin, přípustným operačním časem a relativně nízkým výskytem komplikací. K provedení zejména vysoké, infrarenální PALN je však zapotřebí erudovaný operační tým.Klíčová slova:
laparoskopie, pánevní lymfadenektomie, paraaortální lymfadenektomie.ÚVOD
Postavení laparoskopie a minimálně invazivní chirurgie v blasti operativy gynekologických malignit bylo dlouhou dobu přinejmenším kontroverzním tématem různých odborných fór. V posledních asi 15–20 letech si však laparoskopie vydobyla pevné místo v chirurgickém řešení karcinomu endometria, karcinomu děložního hrdla i časných stadií ovariálních nádorů a lze dnes dokonce tvrdit, že všechny typy výkonů prováděných laparotomicky, včetně např. totální pánevní exenterace, již byly provedeny i laparoskopicky [13, 23]. Došlo k tomu díky dobrému zvládnutí technik laparoskopické hysterektomie (včetně hysterektomie radikální), některých dalších přidružených výkonů (omentektomie, apendektomie, pánevní peritonektomie, parametrektomie, resekční výkony na gastrointestinálním i uropoetickém traktu, transpozice adnex), a zejména díky osvojení a standardizaci laparoskopické disekce lymfatických uzlin v ánvi (PLN) i v oblasti aorty a dolní duté žíly (PALN) [12, 14, 16, 19, 31]. Laparoskopie, díky svým tradičním výhodám augmentace obrazu, možnosti jemné, velmi exaktní, bezkrevné preparace a samozřejmě díky nízké invazivitě a morbiditě, je také často využívána k detekci a exstirpaci sentinelových uzlin (SLN) v managementu časného cervikálního karcinomu [22].
Záměrem tohoto sdělení je podělit se o víceleté zkušenosti s těmito operacemi na pracovišti, které patří k největším onkogynekologickým i endoskopickým centrům v ČR. Práce je zaměřena především na technické aspekty a komplikace těchto laparoskopických výkonů.
METODIKA
V počítačové databázi kliniky jsme z let 2006–2011 vyhledali všechny operace různých typů gynekologických malignit, u nichž bylo cílem laparoskopické odstranění lymfatických uzlin. Do souboru jsme nabírali pacientky indikované k PLN a/nebo PALN a/nebo identifikaci a exstirpaci SLN a/nebo exstirpaci objemné „bulky“ lymfatické uzliny v pánvi či paraaortálně, dříve detekované na základě expertního ultrazvukového vyšetření. Ze souboru nebyly vyloučeny pacientky, které kromě výše uvedených výkonů na lymfatikách podstoupily, většinou jako součást jejich „stagingové“ operace, i další laparoskopický nebo laparo-vaginální výkon (nejčastěji LAVH nebo TLH s/bez adnexetomie; případně infrakolickou omentektomii, apendektomii nebo transpozici adnex). V tomto období od roku 2006 již byla na našem pracovišti standardizována operační technika laparoskopických lymfadenektomií (viz níže), počet těchto operací za rok byl alespoň 15 a sestavené operační týmy již měly za sebou nezbytné období learning curve.
Provedli jsme retrospektivní rozbor zjistitelných klinických dat se zaměřením na: indikaci k laparoskopii, přesný rozsah výkonu, operační čas, výskyt signifikantních komplikací (nemožnost provést výkon, konverze na laparotomii, krevní ztráta > 500 ml, poranění střeva, močovodu nebo močového měchýře, poranění velkých cév, nutnost operační revize v časném pooperačním období, tj. do 7 dnů od operace), počet získaných uzlin a histologický výsledek lymfatických uzlin.
PROVEDENÍ LYMFADENEKTOMIE
Odpoledne před operací každá pacientka podstoupila standardní předoperační střevní přípravu (roztoky fosforečnanů a magnezia s vynecháním klyzmatu) a s úvodem do anestezie jí byla aplikována jedna dávka širokospektrého antibiotika. Každou laparoskopii, jejíž součástí byla disekce lymfatických uzlin, jsme prováděli v celkové anestezii a v Trendelenburgově poloze. Obvykle umísťujeme 10mm port pro kameru asi 2–3 cm nad pupek a dále dva 10mm a dva 5mm porty laterálně na stěně břišní v obou hypo-, resp. mezogastriích. Pro účely PALN přidáváme 10mm port centrálně suprapubicky a tento výkon pak provádíme za asistence optiky směrem z podbřišku kraniálně směrem k bránici. Oba hlavní typy lymfadenektomie (PLN, PALN) jsme tedy prováděli transperitoneálně. Maximální povolený intraperitoneální tlak CO2 byl stanoven na obvyklých 12 mm sloupce rtuti.
Pánevní lymfadenektomii zahajujeme vpravo obvyklou vertikální disekcí peritonea nad kaudální částí musculus psoas maior, několik centimetrů laterálně od tzv. malé bifurkace (větvení a. ilica communis) směrem kaudálním k ig. teres uteri. Vlevo je přístup do retroperitonea mírně odlišný pro přítomnost esovité kličky tlustého střeva, kterou obvykle hned v úvodu operace uvolňujeme od laterální stěny pánve mediálně. Postupně kombinací tupé a ostré preparace pronikáme mediálně od v. ilica externa do fossa obturatoria a ozřejmujeme průběh obturatorního nervu (přibližně v kaudální třetině fossy), ligamentum umbilicale mediale (mediálně od n. obturatorius), laterální parametria s odstupem a. uterina od a. ilica interna, paravezikální a pararektální fossu a průběh ureteru od přechodu do malé pánve (přechází velké cévy pánve přibližně v oblasti malé bifurkace) přes jeho průběh po zadním listu plica lata uteri. Přesnou orientaci o těchto strukturách považujeme za důležitou součást bezpečného provedení laparoskopické PLN. Tukově--lymfatickou tkáň odstraňujeme na každé straně ze standardních lokalit, jež ostatně kontinuálně přechází jedna v druhou:
- a) z oblasti externích ilických cév (od malé bifurkace až po přemostění a. ilica externa vénou circumflexa ilium profunda) jejich „očištěním“ a eliberací od spodiny i od sebe navzájem,
- b) z ossa obturatoria (mezi kostěnou pánví a v. ilica externa laterálně a lig. umbilicale mediale mediálně) nad i pod n. obturatorius,
- c) z oblasti malé bifurkace a průběhu společných ilických cév (laterálně, na ventrální ploše m. psoas maior je vhodné šetřit senzitivní genito-femorální nerv),
- d) z oblasti presakrální (kaudálně od bifurkace aorty a od v. ilica communis sinistra).
Paraaortální lymfadenektomii jsme zahajovali vertikální incizí peritonea ve střední čáře. Z blasti přibližně 4–5 cm pod bifurkací aorty postupujeme směrem kraniálním, minimálně 5 cm nad odstup a. mesenterica inferior (IMA) z aorty tak, abychom při tzv. vysoké PALN dosáhli k odstupu levé renální žíly (obvykle přebíhá aortu), resp. k odstupu pravostranné v. ovarica z v. cava inferior (VCI). Dosažení této úrovně mohou u špatně připravených, zejména obézních operantek bránit střevní kličky (úpon duodena), jež musíme spolu s peritoneem dislokovat graspery kranio-ventrálně po jejich předchozím tupém uvolnění z oblasti velkých cév („vytvoření stanu“ nad průběhem aorty a VCI nad úrovní odstupu IMA). Při resekci tukově-lymfatických tkání postupujeme od oblasti sub-bifurkační (tkáň obvykle intimně adherující na zprvu nenápadném ventrálním povrchu v. ilica communis sin.) kraniálně pre-aortálně a para-aortálně (vlevo od aorty, pod i nad odstupem IMA po odstup v. renalis sin.), interaorto-kaválně, pre-kaválně a para-kaválně (vlevo od VCI po odstup v. ovarica dx.). Bilaterálně je třeba laterálně od obou dominantních velkých cév vizualizovat a respektovat průběh obou ureterů.
K preparaci a disekci tkání retroperitonea jsme ve většině případů používali kombinaci laparoskopické monopolární (jemné nůžky) a bipolární (jemný disektor) elektrochirurgie. V menšině případů (ekonomické důvody) jsme používali ultrazvukovou energii harmonického skalpelu (SonoSurg Scissors, SonoSurg-G2, Olympus Medical Systems Corp. Tokyo, Japan nebo LCS-C, UltraCision; Ethicon EndoSurgery, Johnson & Johnson Ltd, Cincinnati, USA). Z ostatních nástrojů běžné graspery a irigační / sukční kanylu. Lymfatika jsme obvykle odstraňovali v delších blocích a z dutiny peritoneální evakuovali přes 10mm porty bez použití endobagu (nesuspektní tkáň) či s pomocí endobagu (suspektní, křehký materiál). Zatímco při PLN lze i při disekci lymfatik postupovat povětšinou prostřednictvím trakce a tupé preparace, při PALN jsme preferovali ostrou preparaci monopolární energií (drobnější cévy) nebo „studené“ nůžky, avšak po předchozí cílené koagulaci bipolárním disektorem, nebo ještě výhodněji harmonickým skalpelem.
Technika cílené exstirpace „bulky“ lymfatické uzliny se významně neliší od výše popsaných postupů, samozřejmě s přihlédnutím ke konkrétní anatomické oblasti. Při vyhledávání SLN jsme po úvodu do laparoskopie aplikovali do hrdla děložního 4 ml patentové modři (Patent blau V, Byk Gulden, Konstanz, Germany nebo Bleu patenté V 2,5 %, Guerbet, Roissy, France) přísně do reziduálního stromatu hrdla děložního. Technika aplikace byla modifikována podle uložení a velikosti tumoru na základě předoperačního transrektálního ultrazvukového vyšetření. Vysledování průběhu lymfatických kolektorů umožnilo identifikaci zbarvených uzlin považovaných za SLN a jejich následnou exstirpaci k obvykle peroperačnímu histologickému vyšetření [30].
Sled operačních výkonů
Pokud bylo indikováno více typů výkonů u jedné pacientky najednou, postupovalo se logicky tak, že jako první se prováděl buď výkon, z něhož vyplývalo peroperační histologické vyšetření (např. exstirpace SLN), nebo výkon, u něhož je nejvyšší riziko konverze na laparotomii (PALN). Nejčastějším a nejtypičtějším příkladem je indikace systematické PLN a PALN spolu s LAVH nebo TLH (typ miniinvazivní hysterektomie byl volen především s ohledem na prostornost pochvy). V těchto případech jsme prováděli nejprve PALN, poté PLN a konečně LAVH, nebo v případě úzké pochvy nejprve PALN, poté TLH a konečně PLN. Pokud byla indikována kombinace hysterektomie a omentektomie, byla preferována TLH a před suturou pochvy bylo resekované omentum z utiny břišní evakuováno vaginálně.
VÝSLEDKY
V letech 2006–2011 jsme na našem pracovišti, v souladu s výše uvedenou operační technikou, provedli celkem 177 laparoskopických operací, při nichž byla exstirpována lymfatika. Operace z pozice prvního operatéra prováděli celkem 4 erudovaní endoskopičtí chirurgové a operační tým byl vždy sestaven z 2 zkušených endoskopistů a 1 mladšího lékaře v tréninku. Základní charakteristiky souboru jsou shrnuty v tabulce 1. V délce operačních časů jednotlivých typů operačních výkonů nebyly shledány signifikantní rozdíly mezi jednotlivými roky ani mezi jednotlivými operatéry. Lymfatika byla histologicky hodnocena různými patology.
Table 1. Charakteristiky souboru pacientek s laparoskopickou operací lymfatických uzlin 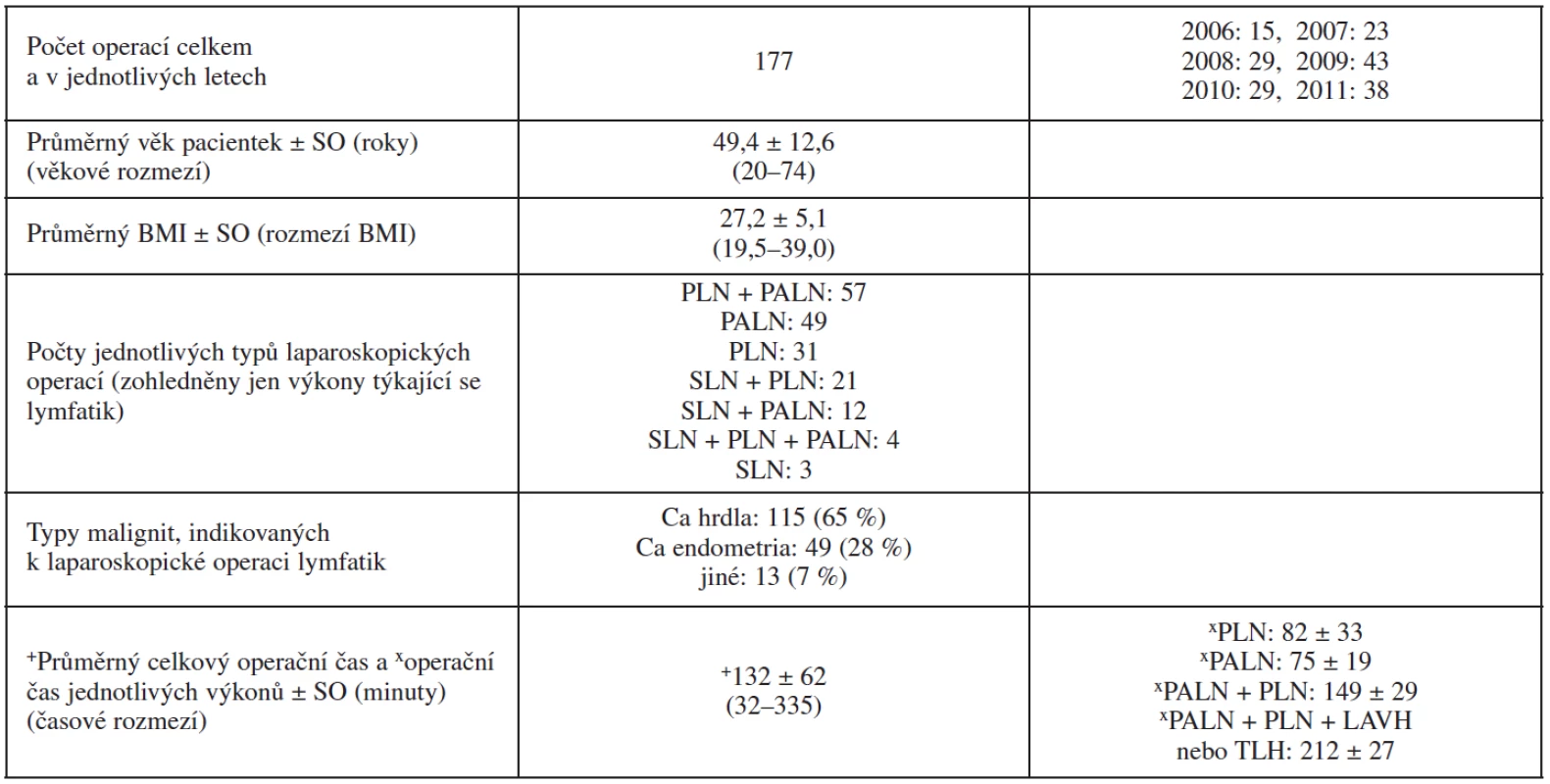
BMI – body mass index, Ca – karcinom, PALN – paraaortální lymfadenektomie, PLN – pánevní lymfadenektomie, SO – směrodatná odchylka, + délka celé operace, včetně přidružených výkonů (jako např. LAVH, TLH či LRH, adnexektomie, adheziolýza pooperačních srůstů obvykle po hysterektomii apod.), x kalkulováno pouze u těch výkonů, kde bylo možné čas jednoznačně určit a kde byla lymfadenektomie prováděna systematicky (nezapočítávány výkony s konverzí na lapartotomii nebo s peroperační histologií): u 42 pacientek s PLN, 67 s PALN, 37 s PLN + PALN a u 21 žen s PALN + PLN + TLH / LAVH Kromě výše zmíněných parametrů jsme se zaměřili na počty získaných lymfatických uzlin. Průměrný počet uzlin získaných z celkem 91 hodnocených, systematických PLN byl 26,2 (medián: 25 uzlin, SO: 10,0, rozmezí: 6–60 uzlin) a průměrný počet uzlin z PLN v jednotlivých hodnocených letech v čase neklesal ani nestoupal (nejméně v 3. roce studie v roce 2008 : 18 uzlin a nejvíce v roce 2010 : 36 uzlin; v roce 2011 už opět méně: 25 uzlin). Ze systematické PALN (105 pacientek) byl průměrný počet histologem nalezených uzlin 12,5 (medián: 11 uzlin, SO: 7,3, rozmezí: 3–38 uzlin) a ani zde jsme nezaznamenali signifikantní nárůst nebo pokles průměrného počtu lymfatických uzlin ve sledovaném časovém období 6 let. Je však pravdou, že případ s nižším počtem uzlin z PALN než 5 se naposledy vyskytl v roce 2009. Počty získaných lymfatických uzlin z obou typů lymfadenektomie podrobněji ukazují grafy 1 a 2.
Graph 1. Distribuce pacientek podle počtu získaných lymfatických uzlin (hodnoceno u 91 žen se systematickou PLN) 
Graph 2. Distribuce pacientek podle počtu získaných lymfatických uzlin (hodnoceno u 105 žen s provedenou systematickou PALN) 
Dalším důležitým výstupem studie byl charakter a četnost peroperačních a časných pooperačních komplikací (tab. 2). Kromě jedné pacientky s nepoznaným poraněním střevní kličky, které přímo nesouviselo s lymfadenektomií, nýbrž s rozsáhlou adheziolýzou po předchozí laparotomické supracervikální hysterektomii, byly nejvážnějšími komplikacemi případy poranění velkých cév nejčastěji při PALN. V 6 případech šlo o poranění VCI (či o její vytrženou žilní spojku), dvakrát o v. ilica communis sin. v místě těsně pod bifurkací aorty, dvakrát o a. mesenterica inferior v blízkosti jejího odstupu z aorty a jedenkrát o krvácení z oblasti větvení v. ilica interna. Ve více než polovině těchto případů bylo krvácení zvládnuto laparoskopicky, včetně jednoho případu laparoskopické sutury poraněné VCI.
Table 2. Typy peroperačních a časných pooperačních komplikací při laparoskopických lymfadenektomiích 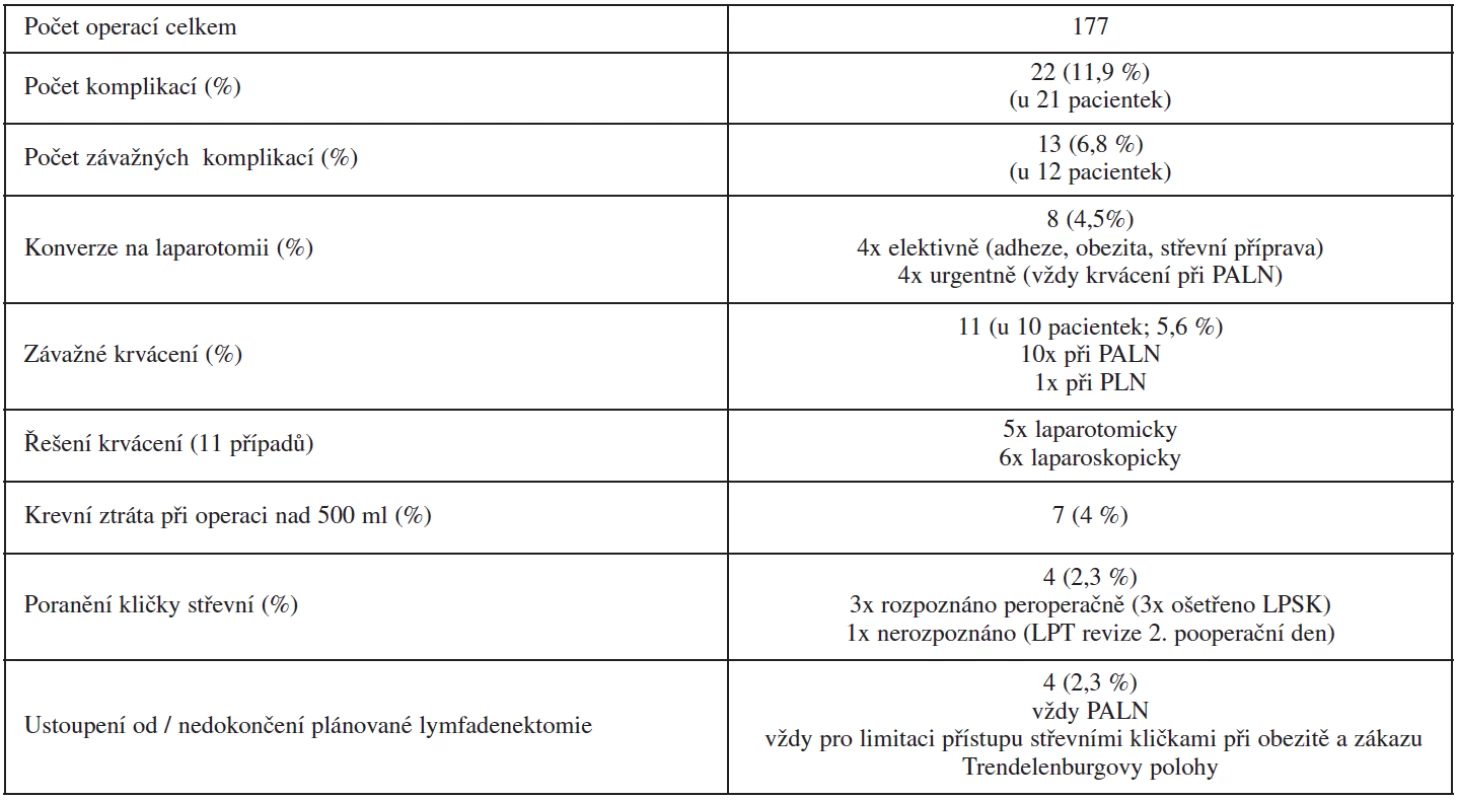
LPSK – laparoskopicky, LPT – laparotomická, PALN – paraaortální lymfadenektomie, PLN – pánevní lymfadenektomie, DISKUSE
Laparoskopická lymfadenektomie pánevní i paraaortální bezpochyby patří k technicky náročným laparoskopickým výkonům, vyžadujícím dobré znalosti anatomie i vysokou erudici v pokročilé endoskopické operativě. U PLN je však learning curve přece jen o poznání kratší a rizika nižší. Hlavní pozornost operatéra by zde měla být soustředěna na včasnou identifikaci a šetření (tj. respektování dostatečné vzdálenosti, zejména pokud používáme monopolární elektrokoagulaci) ureteru a obturatorního nervu. Pokud nejsou nevhodně traumatizována ani potenciální místa krvácení (obturatorní cévní pleteně na dně obturatorní fossy; povodí vnitřní ilické žíly v laterálním parametriu, tedy mediálně od obliterované a. umbilicalis; případně většinou dobře patrný i přístupný průběh v. ilica externa) je u laparoskopické PLN riziko závažného krvácení, a tím i riziko laparo-konverze velmi nízké [8, 9, 10]. Svědčí o tom minimální výskyt komplikací při PLN (jen 1x krvácení převyšující peroperační ztrátu 500 ml, žádný případ poranění ureteru či obturatorního nervu) v našem souboru. Při respektování základních anatomických souvislostí a po úvodní preparaci jednotlivých retroperitoneálních prostor, lze v oblasti malé pánve provádět lymfadenektomii povětšinou tupě, což umožňuje zisk souvislejších tkáňových celků a zkracuje operační čas [18].
Přístup, technika i rizika laparoskopické PALN jsou od PLN dosti odlišné. Už samotný přístup k této nad pánví lokalizované oblasti, s pohledem optiky zdola směrem k hlavě pacientky, je pro gynekologické laparoskopisty nezvyklý a žádá si delší trénink. Dále je zde, i při velmi pečlivé operační technice, vyšší riziko krvácení, což dokládají data nejen z naší studie [11, 17]. Tupá preparace a trakce v blízkosti VCI, v. ilica communis sinistra (nenápadně skrytá tukovou tkání těsně pod bifurkací aorty), lumbálních cévních větví (subaortálně vlevo) a ve vyšších partiích v blízkosti odstupu renálních a ovarických žil, je zde pro nebezpečí náhlého profuzního krvácení velmi riskantní a nedoporučovaná. Zatímco u laparoskopické PLN jsou obezita a s ní spojená intraabdominální adipozita nebo horší vyprázdněnost střev sice nepříjemné, ale velkou většinou překonatelné problémy, u PALN jsou tyto okolnosti přece jen častějším důvodem k ředčasnému ukončení výkonu nebo ke konverzi na laparotomii. A to zejména, pokud je kraniální rozsah resekce lymfatik vymezen nikoli odstupem IMA, ale odstupy renálních žil. Tedy tak, jak je v posledních letech požadováno v mnoha onkogynekologických centrech pro adekvátním chirurgický management karcinomu adnex, hrdla i endometria, vyžadujících lymfadenektomii [6, 7].
Důležitá je samozřejmě i míra obezity. Zatímco u pacientek s BMI nižším než 35 je laparoskopická PLN a PALN většinou zvládnutelná, u pacientek s vyšším BMI se udává proveditelnost adekvátní laparoskopické PLN a PALN pod 50 % [29]. V našem souboru celkem 177 operací se od úmyslu provést lymfadenektomii nebo ji adekvátně dokončit ustoupilo ve 4 případech ze 109 plánovaných k systematické PALN (3,7 %) a u žádné z 91 žen indikovaných k systematické PLN. Též frekvenci konverzí na laparotomii jsme měli relativně nízkou (4,5 %) a přibližně odpovídající frekvenci laparo-konverzí (2–18 %) u jiných velkých souborů s PLN a/nebo PALN [4, 8, 10, 26]. Rozdělíme-li data na jednotlivé typy operací, byla frekvence laparo-konverzí u pacientek s karcinomem endometria ve stadiu IB (průměrný BMI 31,2) plánovaných k TLH/LAVH, PLN a PALN 16 % a u případů s PALN (s či bez PLN a dalších procedur) 5,7 %.
Celková četnost našich peroperačních a časných pooperačních komplikací byla necelých 12 %, četnost vážných (major) komplikací necelých 7 % a signifikantních vaskulárních komplikací 5,6 %. Ve 4 srovnatelných studiích na celkem 449 pacientkách s laparoskopickou PLN a PALN byla frekvence vážných peroperačních komplikací (poranění velkých cév, měchýře, střeva nebo ureteru) 3,8 % a frekvence laparo-konverzí, jež nebyly počítány mezi velké peroperační komplikace, 9,3 % [5, 24, 27, 28]. Malurova randomizovaná prospektivní studie udává celkovou frekvenci komplikací staging operace pro karcinom endometria 30 % pro laparoskopii a 39 % pro laparotomii [15], Qeurleu et al. při auditu 1000 pacientek s laparoskopickou lymfadenektomií pro různé typy a stadia gynekologických malignit 12,4 % [26].
Zatímco technika transperitoneální laparoskopické PLN je dosti standardizovaná, tudíž na různých pracovištích obdobná ve svém provedení a pro většinu pacientek vyhovující, výše zmíněné technické problémy PALN inspirovaly některé operatéry k hledání alternativy ve formě extraperitoneální (či retroperitoneální) laparoskopické PALN [25]. Výhodami tohoto přístupu jsou nepotřeba Trendelenburgovy polohy, nepřítomnost de-novo vzniklých pooperačních intraperitoneálních adhezí (mj. důležité pro kandidátky následné radioterapie) a snazší přístup k zejména levé infrarenální oblasti (odpadá nutnost odtlačovat střevní kličky). Learning curve u zkušených onkolaparoskopistů údajně není dlouhá a operace je uspokojivě proveditelná u více než 90 % pacientek [20, 26]. Jiným, stále zřetelnějším impulzem směrem k více exaktní a bezpečnější lymfadenektomii je také robotická laparoskopie [3, 21].
Obvyklým předmětem diskusí o adekvátnosti lymfadenektomie bývá počet získaných lymfatických uzlin. Mnohé studie v tomto bodě prokázaly srovnatelnost laparoskopického a otevřeného přístupu pro PLN a PALN [2, 15], s čímž se ztotožňují i autoři této práce, s výjimkou pacientek obecně nevhodných k laparoskopii a indikovaných k vysoké, infrarenální PALN. Jde o ženy s bezitou, s BMI vyšším než 35, s interními a anesteziologickými kontraindikacemi a ženy s masivními nitrobřišními adhezemi. V těchto skupinách však lze případně uvažovat o extraperitoneálním přístupu. Mnozí operatéři poukazují na ovlivnitelnost udaného počtu uzlin kvalitou či pečlivostí histopatologa, na fyziologicky dosti odlišné počty uzlin u různých typů pacientek apod. Nicméně jiný, objektivní marker kvality provedení těchto operací (kromě posouzení videozáznamu) zatím neexistuje. Průměrné počty získaných uzlin z pánve (26,2) a z PALN (12,5) v našem souboru minimálně odpovídají datům z obdobných prací v jiných onkogynekologických centrech [1, 12, 15, 21].
ZÁVĚR
Laparoskopická PLN a PALN nadále patří k nejnáročnějším laparoskopickým zákrokům v gynekologické operativě. V rukou trénovaných endoskopických operatérů a erudovaného operačního týmu je výkonem proveditelným u většiny onkologických pacientek k těmto výkonům indikovaných. Zachovává si tradiční výhody miniinvazivních operací a přitom poskytuje standardní požadovaný výsledek (anatomický rozsah výkonu, počty uzlin). Nejzávažnější komplikace jsou častěji spojeny s PALN a týkají se krvácení z vytržených cévních spojek či přímo z oranění velkých žil. Ani tyto závažné situace není vždy nutné řešit urgentní konverzí na laparotomii, je-li celý operační tým na tuto eventualitu připraven. V posledních letech požadovaný rozsah operačních výkonů pro nejčastější gynekologické malignity (nejen PLN, ale i vysoká, infrarenální PALN) nutí operační týmy, pokud chtějí tyto operace provádět miniinvazivně, ke zvládnutí celé této, technicky často hůře přístupné oblasti.
Seznam použitých zkratek
BMI – body mass index
Ca – karcinom
IMA – arteria mesenterica inferior
LAVH – laparoskopicky asistovaná vaginální hysterektomie
LRH – laparoskopická radikální hysterektomie
PLN – pánevní lymfadenektomie
PALN – paraaortální lymfadenektomie
SLN – sentinelová lymfatická uzlina
SO – směrodatná odchylka
TLH – totální laparoskopická hysterektomie
VCI – vena cava inferior (dolní dutá žíla)
Doc. MUDr. Michal Mára, CSc.
Gynekologicko-porodnická klinika 1. LF UK a VFN
Apolinářská 18
128 00 Praha 2
e-mail: michal.mara@quick.cz
Sources
1. Abu-Rustum, NR., Chi, DS., Sonoda, Y., et al. Transperitoneal laparoscopic pelvic and para-aortic lymph node dissection using the argon-beam coagulator and monopolar instruments: an 8-year study and description of technique. Gynecol Oncol, 2003, 89, p. 504–513.
2. Benedetti Panici, P., Plotti, F., Zullo, MA., et al. Pelvic lymphadenectomy for cervical carcinoma: laparotomy extraperitoneal, transperitoneal or laparoscopic approach? A randomized study. Gynecol Oncol, 2006, 103, p. 859–864.
3. Boggess, JF., Gehrig, A., Cantrell, L., et al. A comparative study of 3 surgical methods for hysterectomy with staging for endometrial cancer: robotic assistance, laparoscopy, laparotomy. Am J Obstet Gynecol, 2008, 199, p. 360.e1–9.
4. Burney, TL., Campbell, EC. Jr., Naslund, MJ., Jacobs, SC. Complications of staging laparoscopic pelvic lymphadenectomy. Surg Laparosc Endosc, 1993, 3, p. 184–190.
5. Dottino, PR., Tobias, DH., Beddoe, A., et al. Laparoscopic lymphadenectomy for gynecologic malignancies. Gynecol Oncol, 1999, 73, p. 383–388.
6. Eitan, R., Abu-Rustum, NR., Walker, JL., Barakat, RR. Endometrial cancer metastatic to infrarenal aortic lymph nodes unrecognized during laparoscopic inframesenteric aortic lymph node dissection. Gynecol Oncol, 2004, 93, p. 260–262.
7. Chéreau, E., Feron, JG., Ballester, M., et al. Contribution of pelvic and para-aortic lymphadenectomy with sentinel node biopsy in patients with IB2-IIB cervical cancer. Br J Cancer, 2012, 106, p. 39–44.
8. Childers, JM., Hatch, KD., Tran, AN., Surwit, EA. Laparoscopic para-aortic lymphadenectomy in gynecologic malignancies. Obstet Gynecol, 1993, 82, p. 741–747.
9. Childers, JM., Lang, J., Surwit, EA., Hatch, KD. Laparoscopic surgical staging of ovarian cancer. Gynecol Oncol, 1995, 59, p. 25–33.
10. Kavoussi, LR., Sosa, E., Chandhoke, P., et al. Complications of laparoscopic pelvic lymph node dissection. J Urol, 1993, 149, p. 322–325.
11. Kehoe, SM., Abu-Rustum, NR. Transperitoneal laparoscopic pelvic and paraaortic lymphadenectomy in gynecologic cancers. Curr Treat Options Oncol, 2006, 7, p. 93–101.
12. Köhler, C., Klemm, P., Schau, A., et al. Introduction of transperitoneal lymphadenectomy in a gynecologic oncology center: analysis of 650 laparoscopic pelvic and/or paraaortic transperitoneal lymphadenectomies. Gynecol Oncol, 2004, 95(1), p. 52–61.
13. Leblanc, E., Querleu, D., Narducci, F., et al. Laparoscopic surgeries in gynaecological oncology. In Ayhan, A., Reed, N., Gultekin, M., Dursun, P., eds. Textbook of Gynaecological Oncology. Günes Publishing, 2012, p. 580–587.
14. Liang, Z., Xu, H., Chen, Y., et al. Laparoscopic radical trachelectomy or parametrectomy and pelvic and para-aortic lymphadenectomy for cervical or vaginal stump carcinoma: report of six cases. Int J Gynecol Cancer, 2006, 16, p. 1713–1716.
15. Malur, S., Possover, M., Michels, W., Schneider, A. Laparoscopic-assisted vaginal versus abdominal surgery in patients with endometrial cancer - a prospective randomized trial. Gynecol Oncol, 2001, 80, p. 239–244.
16. Nezhat, CR., Burrell, MO., Nezhat, FR., et al. Laparoscopic radical hysterectomy with paraaortic and pelvic node dissection. Am J Obstet Gynecol, 1992, 166, p. 864–865.
17. Nezhat, C., Childers, J., Nezhat, F., et al. Major retroperitoneal vascular injury during laparoscopic surgery. Hum Reprod, 1997, 12, p. 480–483.
18. Nezhat, FR., Datta, MS. Laparoscopic lymphadenectomy. In Nezhat, C., Nezhat, F., Nezhat C., eds. Nezhat’s Operative Gynecologic Laparoscopy and Hysteroscopy. Cambridge University Press, 2008, p. 436–446.
19. Obermair, A., Ginbey, P., McCartney, AJ. Feasibility and safety of total laparoscopic radical hysterectomy. J Am Assoc Gynecol Laparosc, 2003, 10, p. 345–9.
20. Occelli, B., Narducci, F., Lanvin, D., et al. Learning curves for transperitoneal laparoscopic and extraperitoneal endoscopic paraaortic lymphadenectomy. J Am Assoc Gynecol Laparosc, 2000, 7, p. 51–3.
21. Pilka, R., Marek, R., Táborská, S., Dzvinčuk, P. Robotem asistovaný laparoskopický staging karcinomu endometria – srovnání se standardní laparotomií. Čes Gynek, 2011, 76, s. 462–468.
22. Plante, M., Renaud, M.C., Tźtu, B., et al. Laparoscopic sentinel node mapping in early-stage cervical cancer. Gynecol Oncol, 2003, 91, p. 494–503.
23. Pomel, C., Rouzier, R., Pocard, M., et al. Laparoscopic total a pelvic exenteration for cervical cancer relapse. Gynecol Oncol, 2003, 91, p. 616–618.
24. Possover, M., Krause, N., Plaul, K., et al. Laparoscopic para-aortic and pelvic lymphadenectomy: experience with 150 patients and review of the literature. Gynecol Oncol, 1998, 71, p. 19–28.
25. Querleu, D., Dargent, D., Ansquer, Y., et al. Extraperitoneal endosurgical aortic and common iliac dissection in the staging of bulky or advanced cervical carcinomas. Cancer, 2000, 88, p. 1883–1891.
26. Querleu, D., Leblanc, E., Cartron, G., et al. Audit of preoperative and early complications of laparoscopic lymph node dissection in 1000 gynecologic cancer patients. Am J Obstet Gynecol, 2006, 195, p. 1287–1292.
27. Renaud, MC., Plante, M., Roy, M. Combined laparoscopic and vaginal radical surgery in cervical cancer. Gynecol Oncol, 2000, 79, p. 59–63.
28. Scribner, DR. Jr., Walker, JL., Johnson, GA., et al. Laparoscopic pelvic and paraaortic lymph node dissection: analysis of the first 100 cases. Gynecol Oncol, 2001, 82, p. 498–503.
29. Scribner, DR. Jr., Walker, JL., Johnson, GA., et al. Laparoscopic pelvic and paraaortic lymph node dissection in the obese. Gynecol Oncol, 2002, 84, p. 426–430.
30. Sláma, J., Dundr, P., Dušek, L., et al. Sentinel lymph node status in patients with locally advanced cervical cancers and impact of neoadjuvant chemotherapy. Gynecol Oncol, 2012 Feb 14. [Epub ahead of print].
31. Spirtos, NM., Eisenkop, SM., Schlaerth, JB., Ballon, SC. Laparoscopic radical hysterectomy (type III) with aortic and pelvic lymphadenectomy in patients with stage I cervical cancer: surgical morbidity and intermediate follow-up. Am J Obstet Gynecol, 2002, 187, p. 340–348.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2012 Issue 4-
All articles in this issue
- Racionální předoperační diagnostika benigních a maligních ovariálních nádorů – zobrazovací metody, nádorové markery
- Přehled současné klasifikace a terminologie onemocnění vulvy
- Ultrazvuk v urogynekologii
- Vaginální tahuprosté páskové operace řešící stresový typ inkontinence moči u žen
- Prolaps a avulzní poranění levatoru
- Management a výsledky ambulantní hysteroskopie
- Endometrióza
- Laparoskopická lymfadenektomie v gynekologické operativě
- Laparoskopická konzervativní léčba děložních myomů
- In vitro fertilizace – rozbor údajů Národního registru asistované reprodukce za roky 2007-2011
- Akutní, nebo expektační přístup u předčasného porodu s předčasně odteklou plodovou vodou?
- Childbirth analgesia and anesthesia in the Czech Republic in 2012 The 20th anniversary of post-gradual education
- Porovnání krátkodobých výsledků TVT-O a TVT‑S v operační léčbě stresové inkontinence moči
- Netypická bolest při ruptuře děložní
- Epidemiologie genitálních bradavic mezi ženami v České republice
- Validita onkologické cytodiagnostiky a kolposkopie versus biopsie v prevenci rakoviny cervixu
- Detekce hlavních fetálních strukturálních anomálií během ultrazvukového vyšetření v 1.-14. týdnu těhotenství v neselektované populaci
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometrióza
- Prolaps a avulzní poranění levatoru
- Racionální předoperační diagnostika benigních a maligních ovariálních nádorů – zobrazovací metody, nádorové markery
- Ultrazvuk v urogynekologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

