-
Medical journals
- Career
Akutní, nebo expektační přístup u předčasného porodu s předčasně odteklou plodovou vodou?
Authors: Z. Hájek 1; V. Horáková 1; M. Koucký 1; M. Dokoupilová 2; R. Plavka 1; A. Pařízek 1
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. A. Martan, DrSc. 1; Neonatologické oddělení nemocnice Hořovice, vedoucí MUDr. M. Dokoupilová 2
Published in: Ceska Gynekol 2012; 77(4): 341-346
Overview
Cíl:
Podat přehled současných poznatků týkajících se postupu u pacientky, kdy je předčasný porod komplikován předtermínovým předčasným odtokem plodové vody (PPROM).Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Perinatologické centrum, Gynekologicko-porodnická klinika Všeobecné fakultní nemocnice a 1. lékařské fakulty Univerzity Karlovy v Praze.Metodika a výsledky:
Vyčkávací přístup při PPROM zvyšuje u těhotných výskyt infekce / zánětu, ale statisticky nezvyšuje mortalitu a významnou morbiditu novorozence, pokud je zánět pod kontrolou. Výskyt komplikací souvisí s gestačním věkem. Čím je těhotenství mladší, tím je více neonatologických komplikací. Je nutno vždy zvolit u každého případu individuální přístup. Akutní přístup zvyšuje frekvenci císařských řezů a rozvoj RDS. Kombinace RDS, těžká prematurita a hypoxie během porodu nejvíce snižují záchranu nezralého novorozence.Závěr:
Pokud je možné prodloužit latenci mezi PPROM a porodem nad 28. týden těhotenství podstatně se snižuje mortalita i těžká morbidita novorozenců.Klíčová slova:
předčasný porod, předčasný odtok plodové vody.ÚVOD
Předčasný odtok plodové vody (PPROM) před dokončeným 37. týdnem gravidity je klinický problém a dilema řešení pro porodnický tým ošetřující těhotnou ženu. Vyskytuje se u 3 % těhotných a podílí se na třetině všech předčasných porodů. Na jedné straně vyčkávací postup zvyšuje riziko intraovulární infekce a morbiditu matky i dítěte, amnionitis 13–60 %, abrupce placenty 4–12 %, komprese pupečníku při extrémním oligohydramniu 32–70 %. Na druhé straně indukce porodu a aktivní přístup k problému zvyšuje neonatální morbiditu, respiratory distress syndrom (RDS) 35 % a frekvenci císařských řezů [8]. Riziko komplikací se zvyšuje s nižším gestačním týdnem obr. 1 a obr. 2.
PATOFYZIOLOGIE PPROM
Infekce v choriodeciduálním prostoru a zánět hrají klíčovou roli v etiologii PPROM. Vzestup matrixmetalloproteináz MMP (1, 8 a 9) v plodové vodě a pokles jejich inhibitorů (1a 2) je hlavní biochemický proces u žen s PPROM. Tvorbu MMP stimulují během předčasného porodu především prozánětlivé cytokiny a prostaglandiny [12]. Konečným výsledkem je degradace celistvosti plodových membrán, lokální zánět a ascendentní bakteriální kolonizace s rozvojem intraamniální zánětlivé invaze (MIAC).
PREDIKCE PŘEDČASNĚHO PORODU A PPROM
Velké prospektivní studie [3] prokazují, že ženy, které v anamnéze předčasně porodily mezi 23.–27. týdnem měly 27,1% riziko opakování předčasného porodu. Ty z nich, s anamnézou PPROM, měly 13,5% riziko předčasného porodu pro PPROM v následující graviditě a 13krát větší riziko PPROM před 28. týdnem gestace. Jakékoliv zdravotní problémy, bakteriální vaginóza a nízký body mass index zvyšují riziko PPROM u nulipar. Zkrácení děložního hrdla pod 25 mm při ultrazvukové cervikometrii zvyšuje riziko PPROM u nulipar i multipar [22]. Nulipary s pozitivním cervikovaginálním fetálním fibronektinem a zkráceným děložním hrdlem mají 16,7% riziko předčasného porodu pro PPROM. Multipary s anamnézou předčasného porodu, zkráceným děložním hrdlem a pozitivním fetálním fibronektinem mají 25% riziko PPROM. Multipary se všemi třemi rizikovými faktory mají 31krát vyšší riziko, že porodí před 35. týdnem gravidity než ženy bez těchto rizikových faktorů [3, 10, 12].
VALIDITA BIOCHEMICKÝCH VYŠETŘENÍ V PREDIKCI PŘEDČASNÉHO PORODU
V praxi se uplatňuje fetální fibronektin (fFN). Je to glykoprotein produkovaný trofoblastem a detekovatelný v cervikovaginální tekutině. Má především negativní prediktivní hodnotu. Je-li negativní, je pravděpodobnost, že až v 99,7 % nedojde k předčasnému porodu v nejbližších 14 dnech, a 93% pravděpodobnost, že žena neporodí před 37. týdnem gestace [4]. Dalším často používaným testem v renomovaných perinatologických centrech je inzulin-like growth factor binding protein-1(IGF-1). Stanovení je podobně jako u fFN stěrem z poševní klenby. Jde o látku uvolňovanou do choriodeciduálního prostoru. Je produkován deciduou – endometriálními stromálními buňkami. Jeho sekrece je regulována progesteronem, relaxinem a inzulinem. Má rovněž vysokou negativní prediktivní hodnotu a relativně nízkou pozitivní prediktivní hodnotu [19]. V běžné praxi se nejčastěji uplatňuje hodnocení C-reaktivního proteinu (CRP) a leukocytů. Jejich zvýšení odráží přítomnost zánětu obecně, ale nemusí být spojeny s rozvojem intraamniálního zánětu. Senzitivita CRP kolísá podle různých autorů od 33 % do 100 % [9]. Stejné je hodnocení počtu leukocytů. Důležitý je diferenciální rozpočet leukocytů a stanovená tzv. immature/total indexu. Jde o poměr mezi počtem nezralých granulocytů a celkovým počtem granulocytů. Můžeme tak odlišit zánět od ovlivnění krevního obrazu léčbou např kortikoidy [22]. Vzestup hladin interleukinu 6 (ITL-6) je spojen s předčasným porodem před 32. týdnem a s rizikem neonatologických komplikací, jako je intraventrikulární hemoragie (IVH) [21]. Matrixmetaloproteinázy mají velký vztah k PPROM, především MMP-8 v plodové vodě. Bedside test pro stanovení MMP-8 je již používán k rychlému stanovení intraamniálního zánětu [15]. Další parametry sRAGE – receptor pro produkty pokročilé glykace je studován v souvislosti s inhibicí zánětu. Vysoké hodnoty sRAGE mohou mít protektivní úlohu před rozvojem zánětu [7]. V blízké budoucnosti bude mít velkou úlohu proteomická a metabolomická analýza plodové vody [18], studium genetické predispozice k předčasnému porodu a studium genů, polymorfismu cytokinů, sRAGE a TLR [7, 18]. Všechny biochemické markery je nutno posuzovat v kontextu klinických příznaků a posuzování ultrazvukové cervikometrie. Zkrácení děložního hrdla pod 25 mm zjištěné UZ cervikometrií před 28. týdnem předikuje zvýšené riziko předčasného porodu. Při rychlém zkrácení děložního hrdla jde většinou o kombinaci s rozvojem intraamniálního zánětu [22].
METODIKA PÉČE O PŘEDČASNÉ PORODY
Předkládáme zkušenosti Perinatologického centra na Gynekologicko-porodnické klinice 1. LF UK a VFN v Praze. PPROM je diagnostikován obvykle Actim PROM testem (Medix Biochemica ab. Finland). Při expektačním postupu a ukončení gravidity se postupuje podle standardního protokolu (obr. 3). Antibiotika (penicilin, azitromycin nebo kombinace ampicilin + gentamicin) jsou podávána v terapeutických dávkách. Jako tokolytikum se používá hexoprenalin (Gynipral), atosiban (Tractosil) a magnesium sulfuricum i.v. K indukci plicní zralosti plodu je většinou použit betametazon ve dvou dávkách nebo dexamethazon ve čtyřech dávkách. Dynamicky jsou sledovány markery infekce (zánětu) C-reaktivní proteinu (CRP) a leukocyty s rozpočtem granulocytů. U každého příjmu rodičky s odteklou plodovou vodou je provedena kultivace z hrdla a pochvy. Ultrazvukové vyšetření kromě biometrie plodu je zaměřeno především na posouzení dýchacích pohybů plodu a pohybů jeho končetin. Kardiotokografický záznam je pořizován jednou nebo dvakrát denně. Pokud sledování těhotné nevykazuje rozvoj intraamniálního zánětu, je podávání antibiotik ukončeno většinou po 5–6 dnech. Sledování těhotné však pokračuje ve stejných termínech podle protokolu. Tokolytika jsou podávána, i když jsou zánětlivé markery negativní. Rozhodnutí o ukončení gravidity závisí na posouzení klinického stavu těhotné (vzestup teploty na 38 °C a více, vzestup leukocytů, granulocytů nad 75 %, zvýšený tonus dělohy), zhoršení parametrů v UZ obraze – těžký olihohydramnion bez pohybů plodu, susp. kardiotokografický záznam s možnou kompresí pupečníku. Placenty od všech porodů jsou odeslány k histologickému vyšetření. Kritériem proběhlého zánětu je histopatologický nález chorioamnionitis nebo funisitis [23]. Dále hodnotíme skóre Apgarové v 1. a 5. minutě, pH z pupečníkové arterie, mortalitu a morbiditu na jednotce intenzivní neonatologické péče. Hodnotíme střední a těžkou formu bronchopulmonální dysplazie (BPD), retinopatii, stadium III nebo vyšší podle Internacionální klasifikace retinopatie u předčasně narozených dětí z roku 1987. Intraventrikulární haemoragie (IVH) podle Papile stadium III a vyšším, jakož i cystickou formu periventrikulární leukomalacie (PVL). Jako vrozená sepse u novorozence je klasifikován takový případ, kdy je pozitivní kultivace z krve novorozence do 72 hodin života.
HLAVNÍ ROZDÍLY MEZI AKUTNÍM A EXPEKTAČNÍM PŘÍSTUPEM
Hlavním rizikem expektačního postupu je ascendentní infekce, chorioamnionitis a funisitis [24]. Pokud se narodí novorozenec před 30. týdnem gestace, je nejčastěji ohrožen intraventrikulární hemoragií (IVH), nekrotizující enterokolitidou (NEC), nebo respiratory distress syndromem (RDS). Toto riziko je největší u extrémně nezralých novorozenců a snižuje se, pokud se podaří prodloužit těhotenství nad 28. resp. 30. týden gravidity [6, 8, 9, 10]. Pokud je gravidita starší než 32 týdnů, další prodlužování těhotenství již nepřináší větší benefit pro plod a zvyšuje se riziko adnátní infekce [13]. Randomizované studie popisují rozdíl mezi aktivním a expektačním přístupem. Spinnato [20] zaznamenal ve své studii těhotných s PPROM před 37. týdnem zvýšený výskyt infekčních komplikací u matek, ale nezjistil signifikantně zvýšený výskyt neonatální morbidity. Mercer [13] nezjistil signifikantní zvýšení mateřské morbidity a stejný výskyt císařských řezů v obou sledovaných skupinách. Naef [14] ve své randomizované studii nezjistil signifikantní benefit pro plod s expektačním postupem. Všechny práce týkající se tohoto problému popisují snížení výskytu chorioamnionitis při akutním přístupu a porodu do 24 hodin. U expektačního přístupu je vyšší výskyt chorioamnionitis, ale nejsou rozdíly v mateřské a novorozenecké morbiditě [23]. Při PPROM ve 26. týdnu je výskyt chorioamnionitidy až 100 %, ve 30. týdnu 70 % a nad 32. týden 50–60 %. Aplikace antibiotik zlepšuje stav plodu in utero. Prodloužení latence od PPROM a vyšší gestační týden v době narození snižuje incidenci NEC, IVH a hlavně RDS [2, 16]. Časté nasazení ATB umožňuje prodloužit graviditu. Benefit tokolytické léčby není jasný, ale aplikace kortikosteroidů zlepšují stav nezralého novorozence [11, 25]. Také aplikace surfaktantu po narození zlepšuje stav novorozence [12]. Nejzávažnější rozhodnutí je ukončení gravidity po PPROM na hranici viability plodu. Porody plodů s hmotností pod 500 g jsou zatíženy perinatální úmrtností (PÚ) 860/1000 živě narozených, u plodů o hmotnosti 500–750g je PÚ 470/1000 [5]. Při srovnání akutního a expektačního managementu nebyl zjištěn rozdíl v mortalitě plodů. V tab.1. jsou uvedeny výsledky z Perinatologického centra, Gynekologicko-porodnické kliniky 1. LF UK a VFN v Praze. Jsou uvedeny výsledky akutního přístupu, kdy porod nastal do 48 hodin a expektačního přístupu, kdy porod nastal s latencí větší než 48 hodin od PPROM. Stejně jako ve výše uvedených publikacích nebyl rozdíl v mortalitě a těžké morbiditě novorozenců. Nejvíc kontroverzní je indikace k císařskému řezu u gravidity pod 24. týdnem vzhledem k možnému poranění dělohy a prognóze pro další graviditu [1, 6]. Jeden týden prodloužení gravidity mezi 23. až 32. týdnem gravidity jasně zlepšuje přežití i snižuje morbiditu novorozence. Po 27. týdnu se výrazně snižuje výskyt IVH, NEC a výskyt sepse u novorozence. Multicentrické studie porodů plodů pod 1000 g hmotnosti uvádí přežití novorozenců ve 23. týdnu gravidity 37 % [1, 5]. V tomto gestačním týdnu je však výrazná morbidita IVH, retinopatie a NEC. Výskyt sepse je až 2krát vyšší než po porodu ze zachovalou plodovou vodou [6, 17].
Table 1. Akutní a expektační přístup při PPROM morbidita a mortalita novorozenců 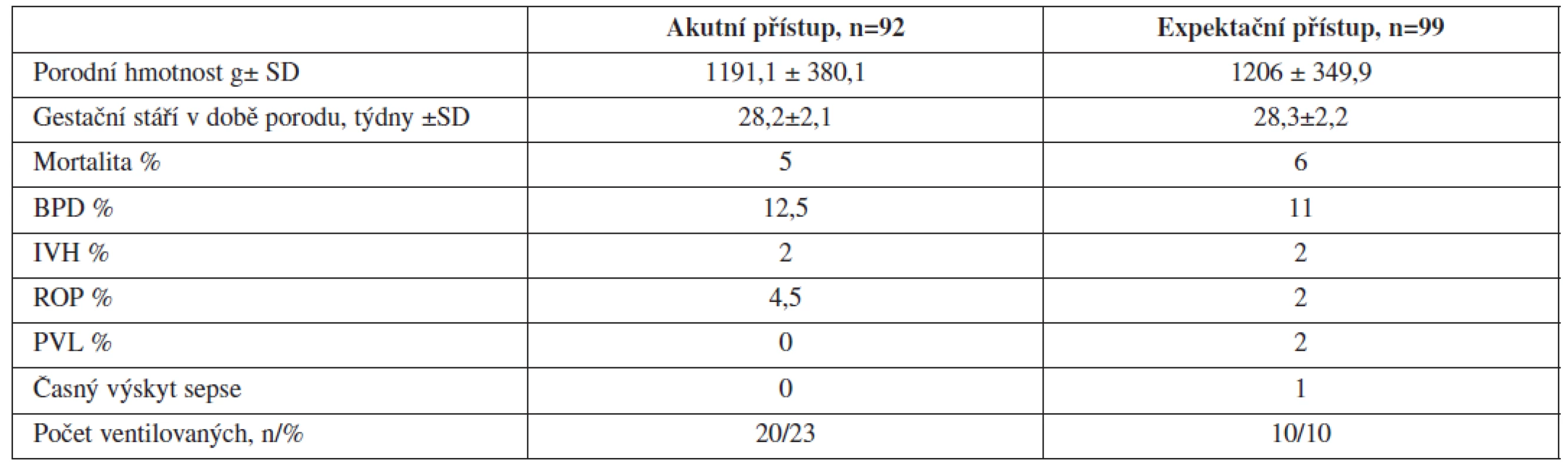
BPD – bronchopulmonální dysplazie (střední a těžká forma), IVH – intraventrikulární hemoragie ≥stupeň III., RO – retinopatie ≥ stupeň III., PVL – periventrikulární leukomalacie (cystická forma). Z materiálu Gynekologicko- porodnické kliniky 1. LF UK a VFN Praha ZÁVĚR
Infekce je hlavní příčinou předčasného předtermínového odtoku plodové vody. Incidence chorioamniitidy u matky a závažné morbidity novorozence je v přímé úměrnosti s gestačním stářím. Čím je těhotenství mladší, tím je výskyt komplikací vyšší, jak je uvedeno v obr. 1 a obr. 2. V současné perinatologii je tendence pokud možno oddálit porod, aby event. komplikace u nedonošeného novorozence byly řešeny ve vyšším gestačním věku. Z tohoto postupu vyplývá benefit pro novorozence. Pokud však se biochemické markery zhoršují a svědčí pro rozvoj intrauterinní infekce a MIAC a pokud není intrauterinní stav plodu uspokojivý, je lépe plod porodit co nejdříve. Prodloužení latence mezi PPROM a porodem podle současných literárních údajů nezvyšuje signifikantně neonatální mortalitu a morbiditu, pokud je rozvoj zánětu pod kontrolou a stav matky je intenzivně monitorován [1, 8, 24].
Image 1. Vztah chorioamniitidy a mortality novorozenců v závislosti na gestačním stáří (z materiálu Gynekologicko-porodnické kliniky 1. LF UK a VFN Praha) 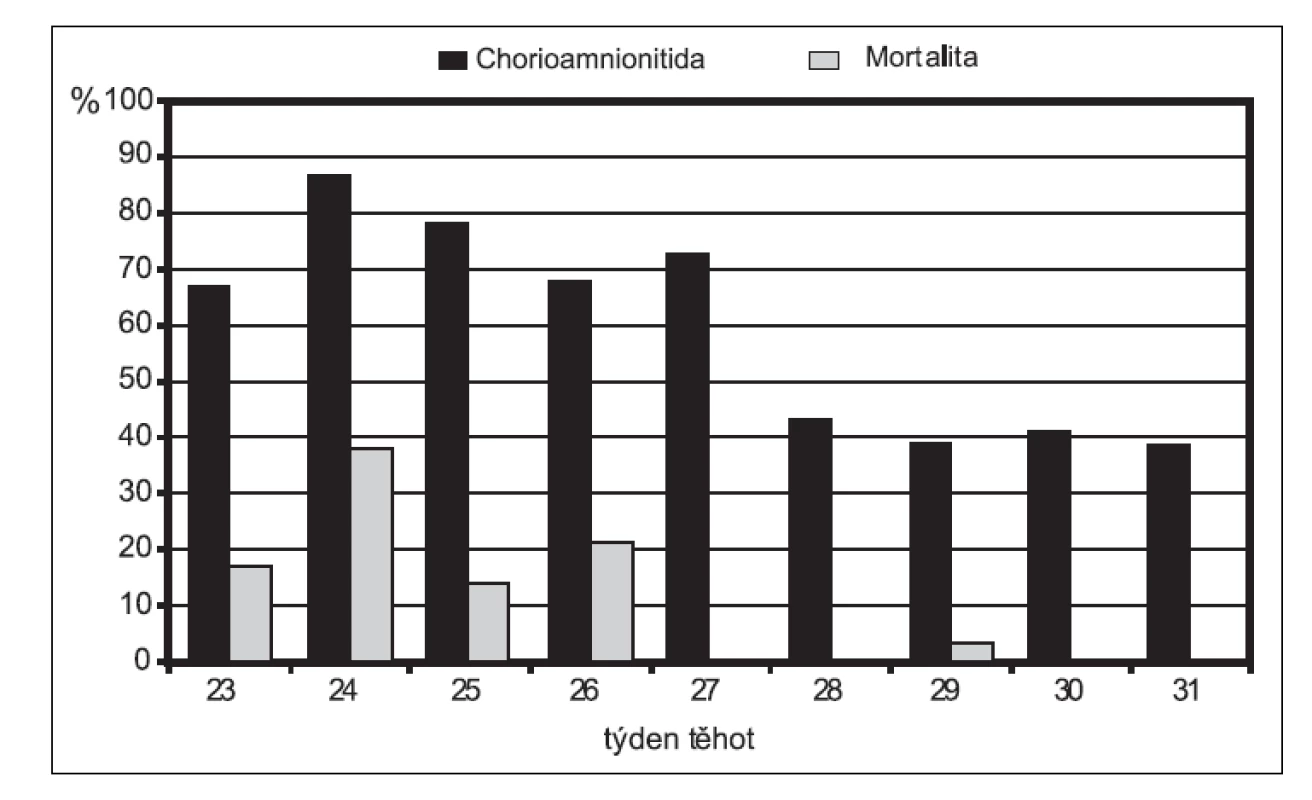
Image 2. Výskyt závažné morbidity novorozenců (IVH – intraventrikulární hemoragie a BPD – bronchopulmonální dysplazie) v závislosti na gestačním stáří (z materiálu Gynekologicko-porodnické kliniky 1. LF UK a VFN Praha) 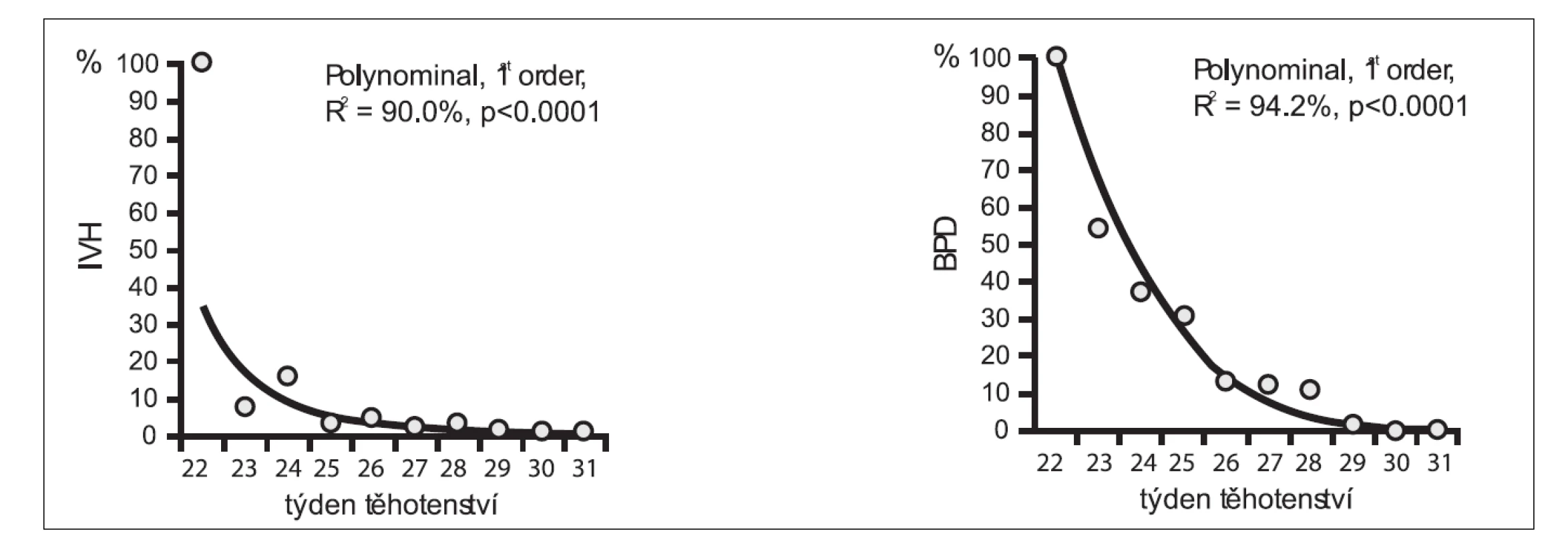
Image 3. Schéma péče o předčasné porody s PPROM 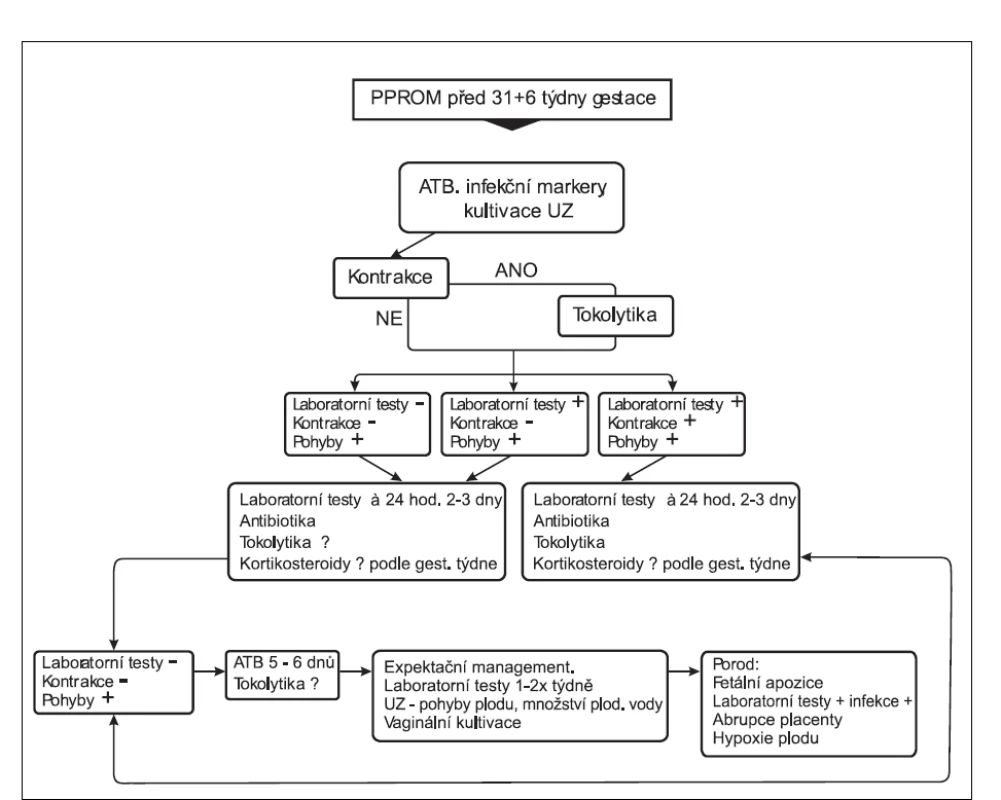
Prof. MUDr. Zdeněk Hájek, DrSc.
Perinatologické centrum
Gynekologicko-porodnická klinika
1. LF UK a VFN
Apolinářská 18
128 08 Praha 2
e-mail: prof.zdenek.hajek@seznam.cz
Sources
1. Berger, TM., Bernet, V., El Alama, S., et al. Perinatal care at the limit of viability between 22 and 26 completed weeks of gestation in Switzerland. Swiss Medical Weekly, 2011, 141, p. 2–13.
2. Cudin, MH., Van Schalkwyk, J., VanEyk, N., et al. Antibiotic therapy in preterm premature rupture of the membranes. J Obstet Gynecol Can, 2009, 31, p. 863–867.
3. Caughey, AB., Robinson, JN., Norwitz, ER, Contemporary diagnosis and management of preterm premature rupture of membranes. Rev Obstet Gynecol, 2008, 1, p. 11–22.
4. Daskalakis, DJ., Papantoniu, NE., Koutsodimes, NB. Fetal fibronectin as a predictor of preterm birth. J Obstet Gynaecol, 2000, 20, p. 347–353.
5. Donohue Pamela, K., Boss, RD., Shepard, J. Intervention at the border of viability. Arch Pediatr adolesc Med, 2009, 163, p. 902–906.
6. Falk, SJ., Ambell, LJ., Lee-Parritz, A., et al. Expectant management in spontaneous preterm premature rupture of membranes between 14–24 weeks gestation. J Perinat Med, 2004, 24, p. 611–616.
7. Hajek, Z., Germanova, A., Koucky, M., et al. Detection of feto-maternal infection/inflammation by the soluble receptor for advanced glycation end products (sRAGE): results of a pilot study. J Perinat Med, 2008, 36, p. 399–404.
8. Kayem, G., Bernier-Duprelle, A., Coffinet, F., et al. Active versus expectant management for preterm prelabour rupture of membranes at 34–36 weeks of completed gestation: comparison of maternal and neonatal outcomes. Acta Obstet Gynecol Scand, 2010, 89, p. 776–781.
9. Kayem, H., Maillard, F., Schmitz, L., et al. Prediction of clinical infection in women with preterm labour with intact membranes: a score based on ultrasonographic, clinical and biological markers. Eur J Obstet Gynecol Reprod Biol, 2009, 145, p. 36–40.
10. Medina, TM., Ashley Hill, D. Preterm premature rupture of membranes: Diagnosis,management. Amer Family Physic, 2006, 15, p. 659–664.
11. Mercer, MB. Is there a role for tocolytic therapy during conservative management of preterm premature rupture of the membranes? Clin Obstet Gynecol, 2007, 50, p. 487–496.
12. Mercer, MB. Preterm premature rupture of the membranes. Obstet Gynec, 2003, 101, p. 179–193.
13. Mercer, MB., Goldenberg, RL., Moawad, AH., et al. The preterm prediction study: Effect of gestational age and cause of preterm birth on subsequent obstetric outcome. Am J Obstet Gynecol, 1999, 181, p. 1216–1221.
14. Naef, RW., Albert, JR., Ross, EL., et al. Premature rupture of membranes at 34–37 weekęs gestation: aggresive versus conservative management. Am J Obstet Gynecol, 1998, 178, p. 126–130.
15. Park, CW., Lee, SM, Park, JK., et al. The antenatal identification of funisitis with rapid MMP-8 bedside test. J Perinat Med, 2008, 36, p. 496–502.
16. Poma, PA. Premature rupture of membranes. J Natl Med Assoc, 1996, 88, p. 27–32.
17. Ramsey, PS., Nuthalapaly, FS., Ramin, S., et al. Contemporary management of preterm premature rupture of membranes (PPROM): a servey of maternal-fetal medicine providers. Am J Obstet Gynecol, 2004, 191, p. 1497–1502.
18. Romero, R., Espinato, J., Hassan, S., et al. The use of high-dimensional biology (genomics, trascriptomics, proteomics and metabolomics) to understand the preterm parturition syndrome. BJOG, 2006, 113, p. 118–135.
19. Rahkonen, L., Rutanen, EM., Nuutila, M. Elevated levels of decidual insulin-like growth factor binding protein-1 in cervical fluid in early and mid-pregnancy are associated with an increased risk of spontaneous preterm delivery BJOG 2010, 117, p. 701–771.
20. Spinnato, JA., Shaver, DC., Bray, EM., et al. Preterm premature rupture of the membranes with fetal pulmonary maturity present: a prospective study. Obstet Gynecol, 1987, 69, p. 96–201.
21. Sorokin, Y., Romero, R., Mele, L., et al. Maternal serum interleukin-6, CRP and MMP-9 concentrations as a risk factor for preterm birth <32 weeks and adverse neonatal outcomes. Am J Perinatol, 2010, 27, p. 631–640.
22. Sunagawa, S., Takagui, K., Ono, K. Comparison of biochemical markers and cervical lenght for predicting preterm delivery. J Obstet Gynecol Res, 2008, 34, p. 812–819.
23. Tita, ATN., Andrews, WW. Diagnosis and management of clinical chorioamnionitis. Clin Perinatol, 2010, 37, p. 339–354.
24. Vande Ham, DP., Nimbus, JG., Mol, BW., et al. Induction of labor versus expectant management in women with preterm prelabor rupture of membranes between 34 and 37 weeks (The PPROMEXIL-trial). BMC, Pregnancy and Childbirth, 2007, 7, p. 11–16.
25. Vidaeff, AC., Ramin, SM. Antenatal corticosteroids after preterm premature rupture of membranes. Clin Obstet Gynecol, 2011, 54, p. 337–343.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2012 Issue 4-
All articles in this issue
- Racionální předoperační diagnostika benigních a maligních ovariálních nádorů – zobrazovací metody, nádorové markery
- Přehled současné klasifikace a terminologie onemocnění vulvy
- Ultrazvuk v urogynekologii
- Vaginální tahuprosté páskové operace řešící stresový typ inkontinence moči u žen
- Prolaps a avulzní poranění levatoru
- Management a výsledky ambulantní hysteroskopie
- Endometrióza
- Laparoskopická lymfadenektomie v gynekologické operativě
- Laparoskopická konzervativní léčba děložních myomů
- In vitro fertilizace – rozbor údajů Národního registru asistované reprodukce za roky 2007-2011
- Akutní, nebo expektační přístup u předčasného porodu s předčasně odteklou plodovou vodou?
- Childbirth analgesia and anesthesia in the Czech Republic in 2012 The 20th anniversary of post-gradual education
- Porovnání krátkodobých výsledků TVT-O a TVT‑S v operační léčbě stresové inkontinence moči
- Netypická bolest při ruptuře děložní
- Epidemiologie genitálních bradavic mezi ženami v České republice
- Validita onkologické cytodiagnostiky a kolposkopie versus biopsie v prevenci rakoviny cervixu
- Detekce hlavních fetálních strukturálních anomálií během ultrazvukového vyšetření v 1.-14. týdnu těhotenství v neselektované populaci
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometrióza
- Prolaps a avulzní poranění levatoru
- Racionální předoperační diagnostika benigních a maligních ovariálních nádorů – zobrazovací metody, nádorové markery
- Ultrazvuk v urogynekologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

