-
Medical journals
- Career
Minimálně invazivní výkony pod ultrazvukovou kontrolou v onkogynekologii
Authors: Michal Zikán; D. Fischerová; J. Sláma; I. Pinkavová; D. Cibula
Authors‘ workplace: Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Published in: Ceska Gynekol 2011; 76(4): 257-261
Overview
Cíl studie:
Prezentovat zkušenosti s prováděním ultrazvukově naváděných miniinvazivních výkonů v onkogynekologii.Typ studie:
Původní práce.Název a sídlo pracoviště:
Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha.Předmět a metoda studie:
Pod kontrolou abdominální nebo vaginální ultrazvukovou sondou bylo užito miniinvazivního punkčního přístupu ve třech indikačních skupinách – při diagnostických výkonech (tru-cut biopsie), terapeutických výkonech (punkční drenáž lymfocyst) a paliativních výkonech (zavedení permanentního peritoneálního katétru).Závěr:
Miniinvazivní výkony pod ultrazvukovou kontrolou představují soubor dostupných a poměrně jednoduchých metod využitelných v mnoha indikacích nejen v gynekologické onkologii. Lze je použít v celé šíři spektra od diagnostiky po paliaci. Zvládnutí ultrazvukové asistence punkčních výkonů je dovedností, která umožňuje rozšířit spektrum nabízených výkonů v onkogynekologii a zároveň snížit zátěž pro pacientku.Klíčová slova:
tru-cut, lymfocysta, ultrazvuk.ÚVOD
Výkony prováděné pod ultrazvukovou kontrolou jsou (nebo by alespoň měly být) běžnou součástí klinické praxe. V onkogynekologii může být ultrazvuk cenným nástrojem dovolujícím omezit invazivitu výkonu u některých pacientek.
Ultrazvukem navigované výkony používáme na našem pracovišti ve třech indikačních skupinách: 1. diagnostické výkony (např. FNAB, tru-cut biopsie), 2. terapeutické výkony (např. punkce a drenáž lymfocysty, abscesu) a 3. paliativní výkony (např. zavedení permanentního peritoneálního nebo hrudního katétru).
DIAGNOSTICKÉ VÝKONY
Biopsie tenkou jehlou
Biopsie tenkou jehlou (FNAB, fine needle aspiration biopsy) patří k nejméně invazivním výkonům k získání bioptického vzorku. Byla poprvé popsána v roce 1921 Guthriem [2] a již po mnoho let slouží zvláště k bioptické verifikaci primárních a rekurentních gynekologických malignit. V punktátu je provedeno vyšetření cytologické – tedy hodnocení jednotlivých buněk nebo jejich shluků, nikoli vyšetření histologické.
Pro biopsii tenkou jehlou se využívají jehly o průměru ≤0,9 mm, tj. o průměru ≥19 G. Jde o jednoduchou techniku s nízkou morbiditou, je možné bioptovat většinu i hůře dostupných lézí a není nutné výkon provádět v celkové anestezii [1, 5].
Kontraindikací jsou obecně závažné koagulopatie. Hlavním limitem metody je získání adekvátního vzorku (až ve 30 % je vzorek inadekvátní), nutná erudice cytodiagnostika a omezená možnost imunohistochemického vyšetření [5].
Biopsie tenkou jehlou nám může potvrdit přítomnost maligních buněk, již méně se může vyjádřit k typu nádoru. Pro bioptickou verifikaci pokročilého pánevního nádoru je méně spolehlivou metodou ve srovnání s biopsií silnou jehlou [5].
Biopsie silnou jehlou (tru-cut biopsie)
Tru-cut biopsie je optimální minimálně invazivní metodou k získání vzorku pro stanovení histologické diagnózy. Biopsií silnou jehlou (tru-cut nebo core-cut biopsie) získáme váleček kompaktní tkáně o délce 10–20 mm a šíři 1,4–2 mm. Vzorek je dostatečný pro histopatologické vyšetření – určení struktury tumoru, morfologie nádorových buněk a imunohistochemické vyšetření.
Cílem odběru jsou nejčastěji primárně inoperabilní abdomino-pelvické nádory nebo jejich metastatická ložiska (karcinomatóza, omentum, uzliny, játra).
Nejčastější indikací je primárně suboptimálně operabilní tumor pánve a břicha, dále snaha o vyloučení či potvrzení přítomnosti recidivy známého nádoru, nebo sekundárního nádoru.
Pacientka přichází k biopsii silnou jehlou s výsledky koagulačního vyšetření a krevního obrazu, nemusí lačnit. Výkon provádíme ambulantně. Před výkonem je možné podat nesteroidní analgetika, nejčastěji využíváme rektální aplikaci asi 30 minut před výkonem. Biopsie se provádí pod ultrazvukovou kontrolou v gynekologické poloze (lze i na běžném vyšetřovacím stole nebo na ultrazvukové vyšetřovně) – při vaginální biopsii, nebo na běžném vyšetřovacím lehátku – při abdominální biopsii. Volba transvaginálního nebo transabdominálního přístupu záleží na uložení maxima vitální nádorové tkáně – při stagingovém vyšetření před biopsií využíváme dopplerovské zobrazení k odlišení oblastí nekróz. Pro transvaginální odběr není nutná lokální anestezie. Pro transabdominální odběr je možné využít lokální anestezii infiltrací 10–20 ml 1% trimecainu (Mesocain).
Používáme bioptické dělo s nastavitelnou délkou výstřelu a jehly o průsvitu 14–18 G (obvykle pro transvaginální odběr 18 G, pro transabdominální 14 G) a délce 15–30 cm (obr. 1). Provádíme odběr ze 2–3 vpichů, vizuálně kontrolujeme přítomnost tkáně v jehle a přenášíme tkáň do nádobky s formolem. Po výkonu zůstává pacientka minimálně 30 minut na oddělení, kontrolujeme celkový stav a krvácení.
Image 1. Jehla používaná k tru-cut biopsii má dvě části: vnitřní mandrén se žlábkem a vnější pouzdro. Při bioptickém výstřelu nejprve vyjíždí vnitřní část a pouzdro přejíždí přes ni, tak zůstane část tkáně v podobě válečku uzavřena ve žlábku mandrénu. 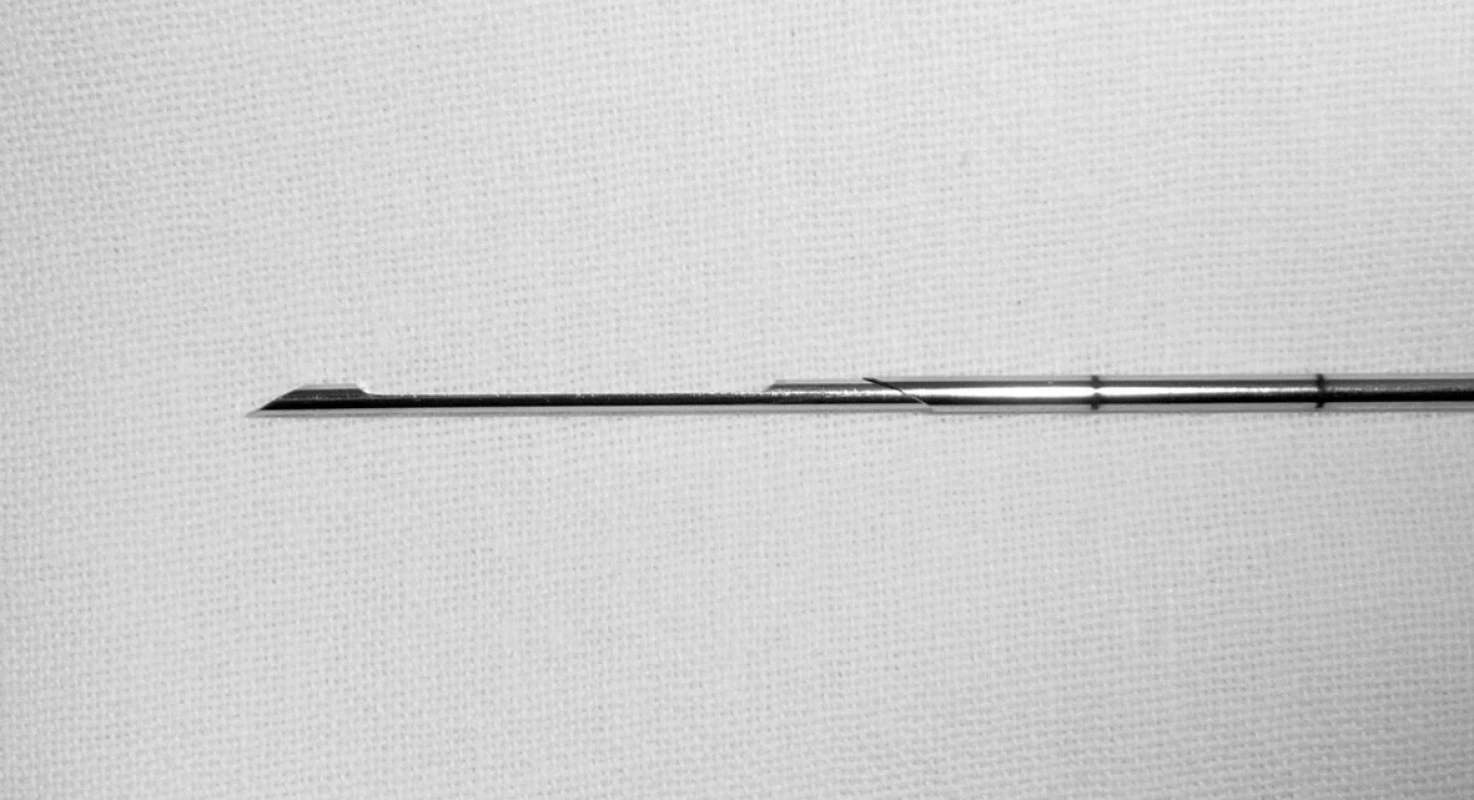
Kontraindikací výkonu je vrozená koagulopatie (např. hemofilie) nebo získané poruchy srážlivosti (trombocytopenie, chronická diseminovaná intravaskulární koagulopatie, chronická antikoagulační nebo antiagregační léčba – warfarin, lawarin, kyselina acetylsalicylová). Další limitací výkonu je rizikové uložení nádoru. Bezpečně lze provést biopsii přes močový měchýř, pacientku neohrozí ani případný vpich do stěny rekta. Rizikovými orgány jsou tenké kličky (používáme však tenkou bioptickou jehlu, proto v případě jasného poranění tenkého střeva v průběhu výkonu zvolíme primárně expektační přístup) a parenchymatózní orgány (játra, slezina, ledvina). Subjektivní obtíže po biopsii nejsou časté, ojediněle se může vyskytnout přechodná bolest v místě vpichu, vaginální špinění nebo krvácení a kolapsový stav (v důsledku iritace peritonea).
Komplikace při biopsii jsou vzácné. V našem publikovaném souboru 195 biopsií [5] byly zaznamenány pouze dvě komplikace (1,05 %). V obou případech šlo o krvácení do břišní dutiny. U první pacientky si vyžádalo laparotomii, při níž bylo zjištěno pomalé krvácení z povrchu ovariálního nádoru z otvoru po biopsii, u druhé pacientky byla pro ultrazvukem pozorované krvácení z místa biopsie po výkonu provedena laparoskopie – v jejím průběhu však již nebyly známky krvácení přítomny.
Adekvátní vzorek (tj. takový, u nějž bylo možné kompletní histologické vyšetření včetně imunohistochemie k určení původu nádoru) byl v naší skupině získán u 93,7 % pacientek. Shoda bioptické histologie s finální operační histologií byla v 98,31 % případů (tzn. 2 neshody u mucinózního karcinomu a leiomyosarkomu, jejichž diagnostika stran primárního původu nebo míry malignity je obtížná i z většího množství materiálu).
Ultrazvuková kontrola výkonu umožňuje precizní a bezpečnou biopsii i ve velmi rizikových lokalitách, např. při velkých cévách (obr. 2).
Image 2. Tru-cut biopsie infiltrované uzliny v obturatorní fosse při externích ilických cévách, vaginální přístup. Ultrazvuková kontrola umožňuje přesnou vizualizaci hrotu jehly (vpravo) a bezpečné provedení výkonu. 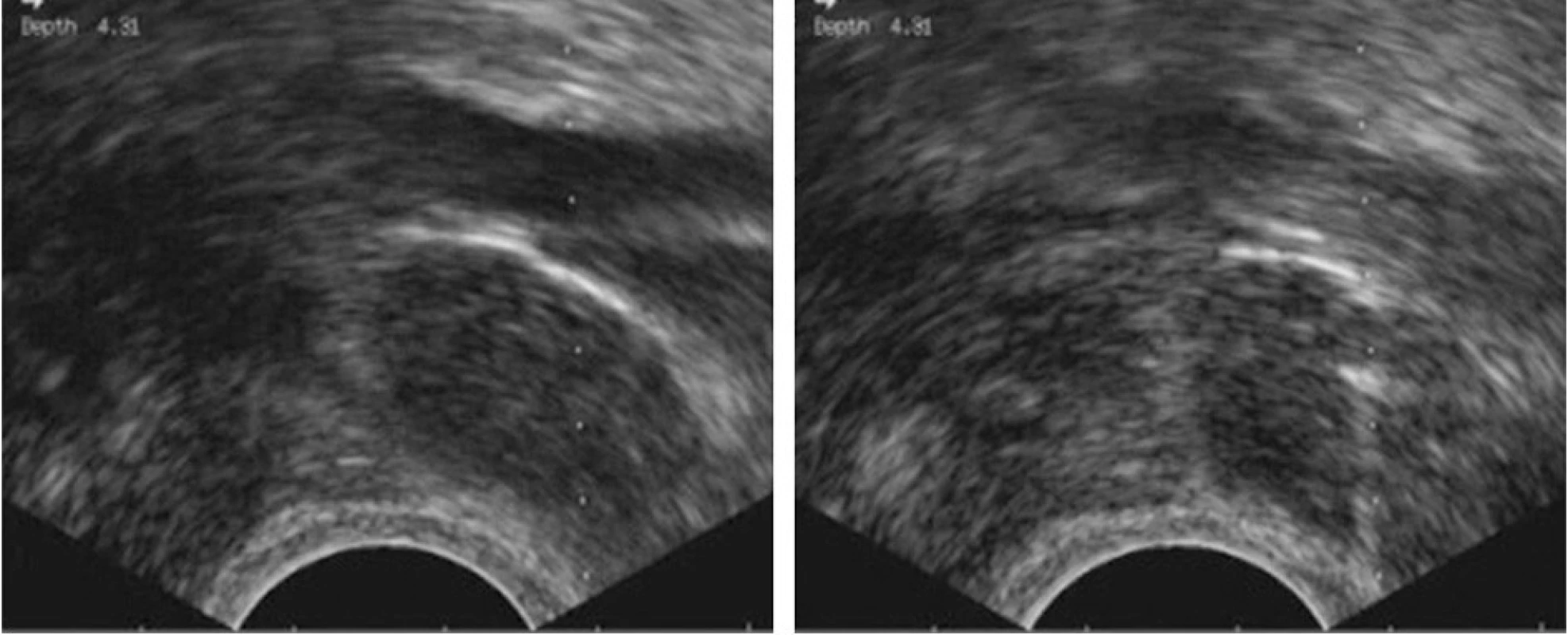
TERAPEUTICKÉ VÝKONY
Nejčastějším miniinvazivním terapeutickým výkonem je v naší zkušenosti punkce lymfocysty. Vznik lymfocysty (tedy pseudocysty v podobě kolekce lymfy, jejíž stěna je tvořena krustou fibrinových vláken) je častou komplikací systematických výkonů na lymfatikách, především v pánvi. Literární údaje o incidenci lymfocyst se velmi liší v širokém rozmezí 2–30 % [3, 4]. Ve vlastní skupině pacientek jsme detekovali lymfocysty z 472 provedených pánevních a 225 paraaortálních lymfadenektomií u 138 pacientek (29,44 %) pacientek, ale pouze u 3,87 % (27) pacientek šlo o lymfocysty symptomatické, tzn. projevující se bolestí, otokem dolních končetin, dysurií, útlakem močovodu nebo zánětlivými příznaky v případě, že je lymfocysta sekundárně infikována.
Vlastní výkon provádíme nejčastěji transabdominálně, lze jej ale provést (zvláště u lymfocyst uložených hluboko v obturatorní fosse kaudodorzálně od velkých cév nebo u pánevních abscesů) i transvaginálně. Po aplikaci místní anestezie je z volné ruky pod ultrazvukovou kontrolou zavedena dutá jehla do komory lymfocysty, jejím lumen pak inzerujeme drénující katétr (obr. 3). Nejlepší zkušenost máme se systémem Cystofix, primárně používaným k punkční epicystostomii. Katétr je fixován ke kůži stehem. Obsah lymfocysty standardně odesíláme na kultivační a cytologické vyšetření a na vyšetření biochemické (k potvrzení diagnózy lymfocysty a vyloučení případného urinomu – postačí vyšetření urey a kreatininu, jejichž hodnoty jsou v moči tisíckrát vyšší než v plazmě). Katétr ponecháváme 3–5 dnů za aplikace antibiotického krytí, podle stavu pacientky a zánětlivých parametrů v perorální nebo intravenózní formě. Denně kontrolujeme odpad z drénu, laboratorně zánětlivé parametry a ultrazvukový obraz lymfocysty.
Image 3. Punkce lymfocysty. Jehla je vedena z levé části obrázku (zprava z pacientčina pohledu), po celou dobu punkce je ultrazvukem vizualizována pozice jehly a jejího hrotu. 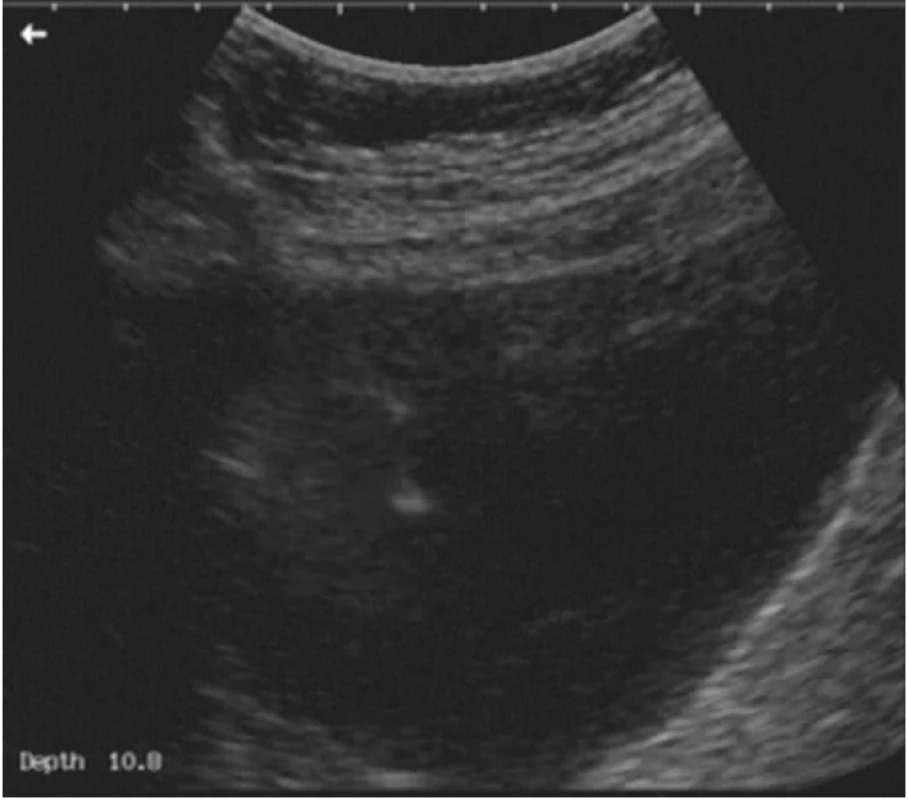
Ve vlastním souboru jsme tuto drenáž dosud provedli u 27 pacientek. U více než poloviny z nich (15 pacientek) byly přítomny známky zánětu (febrilie, vzestup CRP, leukocytóza) doprovázené subjektivními obtížemi v podobě bolesti, akutního lymfedému dolní končetiny, oblenění peristaltiky, event. paresteziemi v oblasti inervace n. obturatorius. U 12 pacientek byly vyjádřeny pouze subjektivní obtíže bez známek zánětu.
Ve skupině pacientek bez známek zánětu se podařilo drenáží pod ultrazvukovou kontrolou zbavit obtíží všech 12 žen, 9 v jednom sezení, 3 ve dvou sezeních, tj. punkci a drenáž bylo nutné opakovat po doplnění lymfocysty. Ve skupině pacientek se zánětlivě změněnými lymfocystami byla úspěšnost nižší, plně se podařilo vyléčit 7 žen, 8 muselo podstoupit laparotomii pro neustupující klinické i laboratorní známky intraabdominální infekce. Celkově tedy byla drenáž úspěšná u 19 pacientek z 27 (70,4 %), a u těchto žen umožnila vyhnout se operační (otevřené nebo laparoskopické) intervenci.
PALIATIVNÍ VÝKONY
Inzerce permanentního peritoneálního katétru
Refrakterní recidivující ascites je častým jevem snižujícím kvalitu života pacientek s recidivujícím ovariálním karcinomem. Jsou-li vyčerpány terapeutické možnosti, pak možným opatřením zůstávají opakované punkce ascitu na špičce vyjádření symptomatiky. Alternativu tomuto postupu pak představuje zavedení permanentního peritoneálního katétru, jehož pomocí může pacientka sama (popřípadě za asistence členů rodiny nebo sestry domácí péče) evakuovat malá množství ascitické tekutiny častěji, a zamezit tak rozvoji symptomů.
Naše zkušenost zahrnuje inzerci peritoneálního katétru certifikovaného pro peritoneální dialýzu a intraperitoneální chemoterapii, který má dvě dakronové manžety. Jedna zůstává ve vrstvě svalu mezi peritoneem a fascií, druhá je ponechána v podkoží. V místech dakronových manžet je fibrózním procesem katétr pevně fixován ve vlastní tkáni.
Katétr je zaváděn v kombinaci intravenózní analgosedace a místní anestezie infiltrací 1% trimecainem (Mesocain) v místě inzerce katétru. Ultrazvuková kontrola slouží k ozřejmení místa nejvhodnějšího k zavedení katétru (nejčastěji na hranici levého nebo pravého mezo/hypogastria) a posléze k ověření a event. upravení polohy katétru.
Po ověření místa inzerce zahajujeme výkon krátkou (asi 2–3 cm) vertikální incizí. Tupě rozhrnujeme podkoží na fascii. Fascii protínáme příčně v délce 1,5–2 cm a zachycujeme póly incize fascie dlouhovstřebatelným stehem (Vicryl, Safil) – tím se vyhneme obtížnému zachycování okrajů v pozdější fázi výkonu. Tupě rozhrnujeme sval na peritoneum, které je ve většině případů zesíleno karcinomatózou. V této fázi ověřujeme bezpečný prostor pod fascií ultrazvukem a ostře protínáme fascii podélně v délce asi 5 mm. Odsáváme odtékající ascites a zároveň zavádíme do otvoru peán s nasazeným pigtailem katétru. První dakronovou manžetu ponecháváme nad peritoneem ve vrstvě svalu, podle potřeby nakládáme na otvor peritonea steh. Fascii uzavíráme nad první manžetou již založenými pólovými stehy. Ultrazvukem kontrolujeme polohu katétru a případně pootáčením ji upravujeme. Poté pokračujeme krátkou 5mm kožní incizí laterálně od incize první, z tohoto malého otvoru tunelujeme peánem podkoží a vzniklým tunelem provlékáme volný konec katétru s ponecháním druhé dakronové manžety v podkoží. Obě kožní incize uzavíráme vstřebatelným stehem. Odsáváním z katétru kontrolujeme jeho průchodnost a finálně nasazujeme katétrovou zátku (obr. 4).
Image 4. Stav bezprostředně po zavedení permantního peritoneálního katétru. Dvě kožní incize uzavřené stehy, katétr se zátkou a tlačkou. 
Permanentní peritoneální katétr jsme dosud zavedli u 10 pacientek s recidivujícím karcinomem ovaria a děložního hrdla a vyčerpanou onkologickou léčbou, u nichž symptomatologie ascitu vyžadovala peritoneální punkci v intervalech 7–10 dnů.
Doba trvání výkonu se pohybovala mezi 17 a 39 minutami. Zákrok byl pacientkami velmi dobře tolerován. Po dimisi pacientky evakuovaly v průměru 250 ml jednou za 2 dny, ve všech případech byl katétr průchodný až do doby úmrtí – přežití pacientek se pohybovalo mezi 3 a 11 měsíci. Nebyla zaznamenána žádná abdominální infekce, ani infekce v místě inzerce katétru. Potenciální hypoproteinémie byla substituována podáváním mléčné bílkoviny.
ZÁVĚR
Miniinvazivní výkony pod ultrazvukovou kontrolou představují soubor dostupných a poměrně jednoduchých metod využitelných v mnoha indikacích nejen v gynekologické onkologii. Na vlastním pracovišti využíváme miniinvazivní přístup v celé šíři spektra od diagnostiky po paliaci.
Zvládnutí ultrazvukové asistence punkčních výkonů je dovedností, která umožňuje rozšířit spektrum nabízených výkonů v onkogynekologii a zároveň snížit zátěž pro pacientku.
Práce byla podpořena grantem IGA MZ ČR NS10566-3/2009.
MUDr. Michal Zikán, Ph.D.
Gynekologicko-porodnická klinika 1. LF UK a VFN
Apolinářská 18
128 00 Praha 2
e-mail: michal.zikan@lf1.cuni.cz
Sources
1. Fischerova, D., Cibula, D., Dundr, P., et al. Ultrasound-guided tru-cut biopsy in the management of advanced abdomino-pelvic tumors. Int J Gynecol Cancer, 2008, 18, p. 833-837.
2. Guthrie, D. Dentigerous cyst (follicular odontome) of the upper jaw. Proc R Soc Med, 1921, 14, p. 13-14.
3. Pastore, M., Manci, N., Marchetti, C., et al. Late aortic lymphocele and residual ovary syndrome after gynecological surgery. World J Surg Oncol, 2007, 5, p. 146.
4. vanSonnenberg, E., Wittich, GR., Casola, G., et al. Lymphoceles: imaging characteristics and percutaneous management. Radiology, 1986, 161, p. 593-596.
5. Zikan, M., Fischerova, D., Pinkavova, I., et al. Ultrasound-guided tru-cut biopsy of abdominal and pelvic tumors in gynecology. Ultrasound Obstet Gynecol, 2010, 36, p. 767-772.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2011 Issue 4-
All articles in this issue
- Transabdominální ultrazvukové vyšetření v gynekologii
- Minimálně invazivní výkony pod ultrazvukovou kontrolou v onkogynekologii
- Aplikace metody SNP array v prenatální diagnostice
- Vplyv exogénneho luteinizačného hormónu na parametre IVF/ICSI cyklov
- Metylácia vybraných tumor-supresorických génov v benígnych a malígnych ovariálnych nádoroch
- Současná klasifikace zhoubných nádorů v onkogynekologii – část I
- Biochemické aspekty fetálnej hypoxie
- Trikuspidální regurgitace u plodu
- Je třeba revidovat doporučení prevence trombembolické nemoci u těhotných?
- Riziko vzniku prolapsu „de novo“ v primárne nepostihnutom kompartmente pri použití syntetického implantátu v rámci operačnej liečby prolapsu panvových orgánov
- Nová metoda screeningu Downova syndromu v I. trimestru: One-Stop-Clinic for Assessment of Risk (OSCAR)
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trikuspidální regurgitace u plodu
- Aplikace metody SNP array v prenatální diagnostice
- Transabdominální ultrazvukové vyšetření v gynekologii
- Současná klasifikace zhoubných nádorů v onkogynekologii – část I
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

