-
Medical journals
- Career
Chemoterapie během těhotenství
Authors: Michael Jiří Halaška 1; K. Šuchová 1; I. Špálová 1; Helena Robová 1; H. Stankušová 2; M. Pluta 1; Lukáš Rob 1
Authors‘ workplace: Gynekologicko-porodnická klinika 2. LF UK a FN, Praha, přednosta prof. MUDr. L. Rob, CSc. 1; Radioterapeuticko-onkologické oddělení FN Motol, Praha, primářka MUDr. J. Prausová, CSc. 2
Published in: Ceska Gynekol 2009; 74(4): 252-256
Category: Original Article
Overview
Cíl studie:
Cílem práce je shrnout současná data týkající se podání chemoterapie během těhotenství.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, 2. LF UK a FN v Motole, Praha.Předmět a metoda studie:
Databáze Pubmed byla prohledána v období od roku 1980 do roku 2009. Zadány byly kombinace klíčových slov týkajících se cytostatik, léčby a těhotenství. Podání cisplatiny bylo popsáno ve 38 případech. Karboplatina byla aplikována v 8 případech. Podání taxanů se uvádělo ve 21 případech (paklitaxel 14, docetaxel 7).Závěr:
Na základě dostupných dat lze zvážit specifickou cytostatickou léčbu pro terapii onkogynekologických onemocnění během těhotenství při pečlivém a dlouhodobém sledování ve specializovaných centrech.Klíčová slova:
chemoterapie, těhotenství, léčba, paklitaxel, cisplatina, antracyklin.ÚVOD
Maligní onemocnění v těhotenství jsou vzácná, nicméně jejich výskyt stoupá vzhledem k tomu, že ženy stále více odkládají těhotenství do pozdějšího věku. Průměrný věk prvorodiček i vícerodiček se výrazně posunul do vyšších věkových kategorií (graf 1). Zatímco v roce 1985 byl průměrný věk primipary 22,3 a multipary 24,6 let, v roce 2003 byl 25,9 a 28,1 let. Odhad incidence nejčastějších malignit v těhotenství je shrnut v tabulce 1.
Graph 1. Průměrný věk prvorodiček a vícerodiček 
Table 1. Výskyt malignit během těhotenství 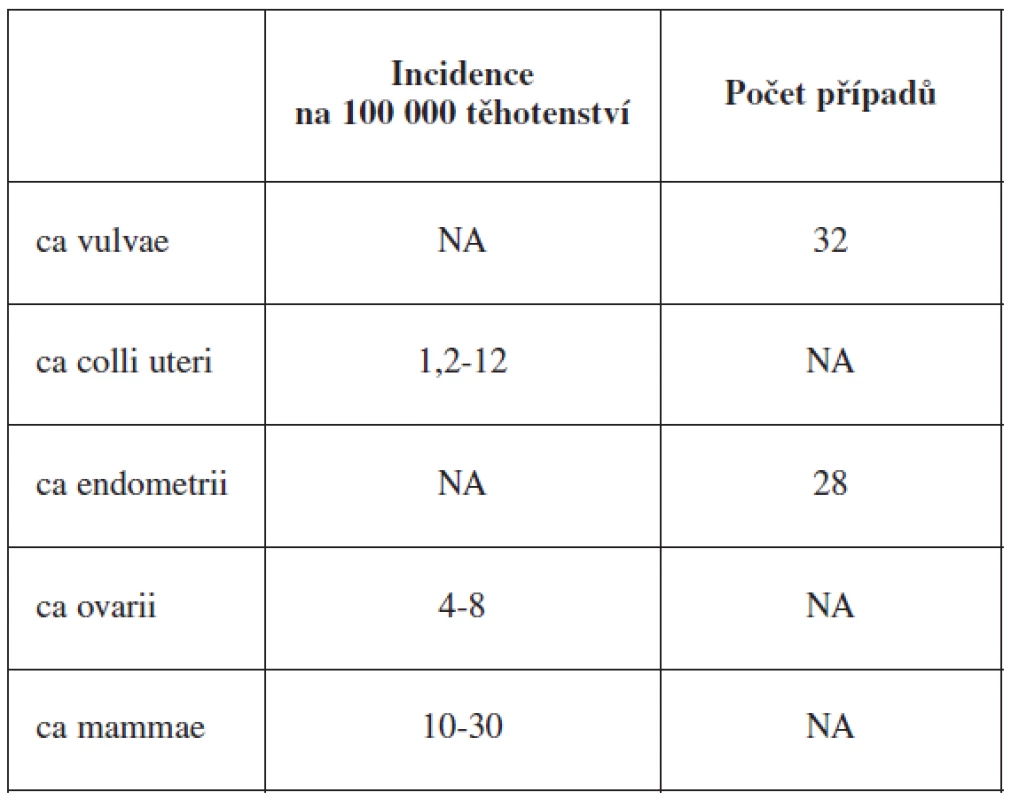
NA – nelze aplikovat V článku uvádíme přehled dostupných publikací zabývající se podáváním chemoterapie v průběhu gravidity. S přibývajícím množstvím informací se chemoterapie stále častěji stává eventualitou při léčbě nádorových nemocí u těhotných pacientek.
MATERIÁL A METODY
Databáze Pubmed byla prohledána v období od roku 1980 do roku 2009. Zadány byly kombinace klíčových slov: treatment, chemotherapy, pregnancy, ovarian cancer, cervical cancer, endometrial cancer, breast cancer, cisplatine, carboplatine, taxanes, doxorubicin, epirubicin, trastuzumab.
VÝSLEDKY
Rozhodnutí o způsobu léčby nádorového onemocnění během těhotenství záleží na stadiu nemoci, gestačním stáří a v neposlední řadě na rozhodnutí nemocné. Nejméně vhodné období k podání chemoterapie je od 10. dne do 8. týdne těhotenství, kdy u plodu probíhá organogeneze. Je potřeba mít na paměti, že některé systémy ve vývoji pokračují i po 8. týdnu, a proto je podání chemoterapie do 14. týdne kontraindikováno. Ve druhém a začátkem třetího trimestru je cytostatická léčba považována za relativně bezpečnou. Naopak se nedoporučuje podání chemoterapie po 35. týdnu těhotenství vzhledem k zvýšenému riziku předčasného porodu. Porod by se měl plánovat 3 až 4 týdny po podání chemoterapie, aby se minimalizovala rizika pro plod, který má nižší clearence cytostatik z těla, a tak je v případě porodu do 3 týdnů po podání chemoterapie ohrožen výraznou hematotoxicitou a dalšími nežádoucími účinky cytostatik.
Fyziologické změny v průběhu gravidity mohou ovlivnit farmakodynamiku a farmakokinetiku cytostatik. Zvýšení glomerulární filtrace může zvýšit clearance cytostatika a jeho vylučování ledvinami. Hladiny léků jsou ovlivněny i zvýšenou metabolickou aktivitou jaterní tkáně. V těhotenství se zvyšuje entero-hepatální cirkulace, kdy aktivní metabolity vyloučené do střev jsou opětovně vstřebávány. Tento mechanismus může mít za následek prodlouženou expozici organismu a zvýšení plazmatické koncentrace léků. Zvýšení objemu plazmy má naopak za následek snížení koncentrace cytotoxických látek, k čemuž přispívá i zvýšená koncentrace plazmatických vazebných proteinů. Amniální tekutina pak funguje pro většinu léků jako třetí prostor. Přes všechna výše uvedená fakta ani jedna prospektivní farmakokinetická studie v těhotenství nebyla úspěšná. Vzhledem k nedostatku validních informací používáme v současné době protokoly, kdy dávku chemoterapeutika počítáme podle výšky a váhy a eventuálně clearence kreatininu, stejně jako u netěhotných žen.
V literatuře jsme nalezli 38 případů léčby cisplatinou [5, 8, 15, 17, 21, 23, 30, 32, 35–37, 40, 41, 52, 53, 59, 61, 64]. V jedné kazuistice je popsán septický stav a předčasný porod u pacientky po podání kombinace bleomycinu, cisplatiny a etoposidu. V další kazuistice se u předčasně narozeného novorozence (porodní váha 1190 g) po porodu rozvinul syndrom respirační tísně (RDS), se známkami myelosuprese, nedoslýchavostí a s alopecií. Sporné ovšem zůstává, zda poruchu sluchu u tohoto novorozence způsobila prematurita, chemoterapie či prenatální podání gentamycinu.
Podání karboplatiny v graviditě bylo popsáno v 8 případech (4 v kombinaci s paklitaxelem), kdy neonatální výsledky byly v normě [31, 33, 46, 48, 57, 65]. V jednom případě byla popsána růstová retardace u plodu. Jednou z možných příčin této retardace by mohlo být podání dexametazonu jako premedikace před aplikací vlastní chemoterapie. Tento běžně užívaný lék by v těhotenství měl být nahrazen metylprednisolem nebo hydrokortisonem.
O použití taxanů v průběhu gravidity bylo publikováno 21 kazuistik. Ve 14 léčebných protokolech byl použit paklitaxel [4, 18, 21, 22, 27, 33, 39, 43, 45, 48, 49, 64] a v 7 docetaxel [13, 20, 37, 51, 58, 62]. Vyskytl se jeden případ hydrocefalie u plodu matky, které byl v průběhu gravidity podán docetaxel v kombinaci s doxorubicinem a cyklofosfamidem. Po 28 měsících dítě prosperovalo dobře.
Cyklofosfamid byl popsán nejméně ve 122 kazuistikách s minimálními riziky pro plod [6, 24, 28, 60].
Z 9 případů použití kombinace bleomycinu, cisplatiny a etoposidu (BEP) [5, 15, 30, 32, 35, 36, 41, 59] se v jednom případě vyskytla ventrikulomegalie a ztráta sluchu (viz výše) [15, 59]. Ve 3 kazuistikách s použitím bleomycinu, cisplatiny a vinblastinu (PVB) [10, 11, 42, 49] nebylo referováno o maternálních nebo fetálních komplikacích. Obdobně při užití vinorelbinu nebyly zaznamenány žádné vrozené defekty [12, 24].
K léčbě nádorového onemocnění prsu jsou často podávána antitumorózní antibiotika doxorubicin a epirubicin [9, 55]. Kromě četných kazuistik byly publikovány dvě prospektivní studie s použitím doxorubicinu. Berry a kol. léčil 24 pacientek bez závažnějších problémů [6]. Hahn a kol. rozšířil Berryho práci a do FAC protokolu zařadil 57 pacientek. V souboru bylo zachyceno jedno těhotenství s Downovým syndromem a 2 plody s kongenitálními malformacemi (pes equiovarus a bilaterální ureterální reflux) [28].
O použití epirubicinu bylo nalezeno 35 kazuistik [2, 7, 14, 18, 19, 15, 16, 29, 44, 50, 55, 60]. Ve 2 případech došlo k intrauterinnímu úmrtí, v jednom k úmrtí novorozence, jednou byla gravidita komplikována eklampsií. Všechny tyto pacientky byly léčeny kombinovanou chemoterapií. Epirubicin vykazuje kratší poločas a je o něco méně lipofilní než doxorubicin [55]. Vzhledem ke kardiotoxicitě je nutné pacientky sledovat stejným způsobem jako při podávání tohoto léku v dětském věku [38].
Nejvyšší fetotoxicitu vykazují léky, jejichž mechanismus účinku je založený na antagonismu kyseliny listové. Metotrexát je nejužívanějším lékem této skupiny [9]. Přísná kontraindikace se vztahuje k použití v I. trimestru, kdy je tento preparát dokonce používán k ukončení mimoděložního těhotenství, v dalším průběhu gravidity nebyly ovšem prokázány závažné nepříznivé účinky [24, 60].
Jiným lékem ze skupiny antimetabolitů je 5-fluorouracil. V kombinaci s jiným cytotoxickým přípravkem jím bylo bezpečně léčeno minimálně 109 těhotných žen [6, 24, 28, 60].
Trastuzumab byl použit v 8 případech [47, 54]. Při podání v kombinaci s docetaxelem [62], s paclitaxelem [4] a v monoterapii v průběhu II. trimestru, nebo při podání v I. trimestru [54] se těhotenství komplikovalo přechodným oligo - až anhydramniem, který do 7 týdnů po ukončení léčby odezněl. U jedné pacientky se objevilo tranzitorní srdeční selhání (u matky) [63]. Při kombinaci transtuzumabu s vinorelbinem [16] nebyla žádná komplikace zaznamenána. Při použití vysokých dávek trastuzumabu (celková dávka 56 mg/kg) se vyskytl těžký oligohydramnion, respirační insuficience se závažným capillary leak syndromem u novorozence [67].
Nemáme přesvědčivé informace o dlouhodobém efektu na děti vystavené chemoterapii. V dostupné literatuře se potýkáme s nedostatky, které plynou z velké heterogenity souborů, většina studií je retrospektivních a sledování dětí je příliš krátké. I hodnocení získaných informací je obtížné, protože jsou ovlivněna matoucími údaji, např. stresem matky, nádorovým onemocněním matky, podpůrnou léčbou, a nejčastěji prematuritou. Aviles a kol. popsali 84 případů dětí intrauterinně vystavených chemoterapii, kdy matky byly léčeny pro hematologickou malignitu [3]. Věkový medián sledovaných pacientů byl 18 let (stáří mezi 6 až 29 lety). U 84 přímých potomků a 12 potomků z druhé generace nebyly zjištěny odchylky v mentálním vývoji. Není zde ovšem dostatečně popsaná metodika sledování a výsledky vycházejí lépe než v normální populaci. Dosud byla publikována jedna kazuistika, v níž Zemlickis a kol. popsali vznik sekundárního nádorového onemocnění [68]. Jednalo se o dvojčetnou graviditu vystavenou léčbě cyklofosfamidem. Jedno dítě se narodilo s kongenitálními malformacemi, ve věku 11 let onemocnělo karcinomem štítné žlázy a ve věku 14 let neuroblastomem. Sourozenec byl zdráv. V jiném souboru 10 dětí, kde medián sledování byl 35 měsíců, bylo pomocí fyzikálního a neurologického vyšetřování odhaleno jedno dítě s vážným vývojovým [66]. Dítě pocházelo z dvojčetného těhotenství, narozené ve 32. týdnu těhotenství, kdy při vyšetření magnetickou rezonancí byla diagnostikována polymikrogyrie. Jestli daný defekt souvisí s in utero vystavením chemoterapii, není zcela jasné. Jiné vývojové odchylky pozorovány nebyly, většina zdravotních komplikací souvisela s prematuritou. Když odhlédneme od přímých důsledků léčby, vyplývá z této práce, že pro dlouhodobou morbiditu a změny kognitivního a behaviorálního vývoje je zásadní předčasný porod [34].
Spekulativní a nezodpovězenou zůstává otázka vyšší predispozice jedinců vystavených intrauterinně vlivu cytostatik zejména pak inhibitorů topoizomeráz (etoposid) vůči vzniku sekundárních malignit. Tato problematika musí být ještě intenzivně studována a tito jedinci musí být dlouhodobě sledováni.
ZÁVĚR
Při rozhodování o terapii zhoubných tumorů v průběhu gravidity se cytostatika s platinovým derivátem u vybraných pacientek jeví jako metoda volby. Podávání chemoterapie v I. trimestru bychom se ovšem měli vyvarovat. Poznatky a zkušenosti s chemoterapií v těhotenství se stále rozšiřují, je ale nutné sledovat dlouhodobý efekt na děti, které byly této léčbě in utero vystaveny. Podání vybraného cytostatika v těhotenství lze zvážit, vzhledem k malému počtu případů by ovšem tyto pacientky měly být léčeny ve specializovaných centrech s pečlivým a dlouhodobým sledováním.
Tato práce byla podpořena grantem ministerstva zdravotnictví IGA MZ NR 9455-3.
MUDr. Michael Halaška, Ph.D.
Gynekologicko-porodnická klinika
2. LF UK a FN Motol
V Úvalu 84
150 00 Praha 5
e-mail: mhalaska@centrum.cz
Sources
1. Zdravotnická ročenka ÚZIS - 2003. Praha: ÚZIS, 2003.
2. Andreadis, C., Charalampidou, M., Diamantopoulos, N., et al. Combined chemotherapy and radiotherapy during conception and first two trimesters of gestation in a woman with metastatic breast cancer. Gynecol Oncol, 2004, 95, p. 252-255.
3. Aviles, A., az-Maqueo, JC., Garcia, EL., et al. Late lethal events in patients with diffuse large B cell lymphoma: a review of 714 patients treated in a single centre. Leuk Lymphoma, 2001, 42, p. 631-637.
4. Bader, AA., Schlembach, D., Tamussino, KF., et al. Anhydramnios associated with administration of trastuzumab and paclitaxel for metastatic breast cancer during pregnancy. Lancet Oncol, 2007, 8, p. 79-81.
5. Bakri, YN., Given, FT. Jr. Normal pregnancy and delivery following conservative surgery and chemotherapy for ovarian endodermal sinus tumor. Gynecol Oncol 1984, 19, p. 222-225.
6. Berry, DL., Theriault, RL., Holmes, FA., et al. Management of breast cancer during pregnancy using a standardized protocol. J Clin Oncol, 1999, 17, p. 855-861.
7. Bodner-Adler, B., Bodner, K., Zeisler, H. Breast cancer diagnosed during pregnancy. Anticancer Res, 2007, 27, p. 1705-1707.
8. Caluwaerts, S., Van, CK., Mertens, L., et al. Neoadjuvant chemotherapy followed by radical hysterectomy for invasive cervical cancer diagnosed during pregnancy: report of a case and review of the literature. Int J Gynecol Cancer, 2006, 16, p. 905-908.
9. Cardonick, E., Iacobucci, A. Use of chemotherapy during human pregnancy. Lancet Oncol, 2004, 5, p. 283-291.
10. Caubel, P., Giovangrandi, Y., Lasry, S., et al. Ovarian seminoma and pregnancy. Apropos of a new case. J Gynecol Obstet Biol Reprod (Paris), 1989, 18, p. 487-491.
11. Christman, JE., Teng, NN., Lebovic, GS., Sikic, BI. Delivery of a normal infant following cisplatin, vinblastine, and bleomycin (PVB) chemotherapy for malignant teratoma of the ovary during pregnancy. Gynecol Oncol, 1990, 37, p. 292-295.
12. Cuvier, C., Espie, M., Extra, JM., Marty, M. Vinorelbine in pregnancy. Eur J Cancer, 1997, 33, p. 168-169.
13. De, SM., Lucchese, A., De, CS., et al. Metastatic breast cancer in pregnancy: first case of chemotherapy with docetaxel. Eur J Cancer Care, 2000, 9, p. 235-237.
14. Eedarapalli, P., Biswas, N., Coleman, M. Epirubicin for breast cancer during pregnancy: a case report. J Reprod Med, 2007, 52, p. 730-732.
15. Elit, L., Bocking, A., Kenyon, C., Natale, R. An endodermal sinus tumor diagnosed in pregnancy: case report and review of the literature. Gynecol Oncol, 1999, 72, p. 123-127.
16. Fanale, MA., Uyei, AR., Theriault, RL., et al. Treatment of metastatic breast cancer with trastuzumab and vinorelbine during pregnancy. Clin Breast Cancer, 2005, 6, p. 354-356.
17. Ferrandina, G., Distefano, M., Testa, A., et al. Management of an advanced ovarian cancer at 15 weeks of gestation: case report and literature review. Gynecol Oncol, 2005, 97, p. 693-696.
18. Gadducci, A., Cosio, S., Fanucchi, A., et al. Chemotherapy with epirubicin and paclitaxel for breast cancer during pregnancy: case report and review of the literature. Anticancer Res, 2003, 23, p. 5225-5229.
19. Gaillard, B., Leng, JJ., Grellet, J., et al. Transplacental passage of epirubicin. J Gynecol Obstet Biol Reprod, 1995, 24, p. 63-68.
20. Gainford, MC., Clemons, M. Breast cancer in pregnancy: are taxanes safe? Clin Oncol (R Coll Radiol), 2006, 18, p. 159.
21. Garcia-Gonzalez, J., Cueva, J., Lamas, MJ., et al. Paclitaxel and cisplatin in the treatment of metastatic non-small-cell lung cancer during pregnancy. Clin Transl Oncol, 2008, 10, p. 375-376.
22. Garcia-Manero, M., Royo, MP., Espinos, J., et al. Pregnancy associated breast cancer. Eur J Surg Oncol, 2008, 10, 6.
23. Garrido, M., Clavero, J., Huete, A., et al. Prolonged survival of a woman with lung cancer diagnosed and treated with chemotherapy during pregnancy. Lung Cancer, 2008, 60, p. 285-290.
24. Giacalone, PL., Laffargue, F., Benos, P. Chemotherapy for breast carcinoma during pregnancy: A French national survey. Cancer, 1999, 86, p. 2266-2271.
25. Ginopoulos, PV., Michail, GD., Kourounis, GS. Pregnancy associated breast cancer: a case report. Eur J Gynaecol Oncol, 2004, 25, p. 261-263.
26. Goldwasser, F., Pico, JL., Cerrina, J., et al. Successful chemotherapy including epirubicin in a pregnant non-Hodgkin’s lymphoma patient. Leuk Lymphoma, 1995, 20, p. 173-176.
27. Gonzalez-Angulo, A., Walters, R., Carpenter, RJ., et al. Paclitaxel chemotherapy in a pregnancy patient with bilateral breast cancer. Clin Breast Cancer, 2004, 5, p. 317-319.
28. Hahn, KM., Johnson, PH., Gordon, N., et al. Treatment of pregnant breast cancer patients and outcomes of children exposed to chemotherapy in utero. Cancer, 2006, 107, p. 1219-1226.
29. Halaska, MJ., Pentheroudakis, G., Strnad, P., et al. Presentation, management and outcome of 32 patients with pregnancy-associated breast cancer: A matched controlled study. Breast, 2009, in press.
30. Han, JY., Nava-Ocampo, AA., Kim, TJ., et al. Pregnancy outcome after prenatal exposure to bleomycin, etoposide and cisplatin for malignant ovarian germ cell tumors: report of 2 cases. Reprod Toxicol, 2005, 19, p. 557-561.
31. Henderson, CE., Elia, G., Garfinkel, D., et al. Platinum chemotherapy during pregnancy for serous cystadenocarcinoma of the ovary. Gynecol Oncol, 1993, 49, p. 92-94.
32. Horbelt, D., Delmore, J., Meisel, R., et al. Mixed germ cell malignancy of the ovary concurrent with pregnancy. Obstet Gynecol, 1994, 84, p. 662-664.
33. Hubalek, M., Smekal-Schindelwig, C., Zeimet, AG., et al. Chemotherapeutic treatment of a pregnant patient with ovarian dysgerminoma. Arch Gynecol Obstet, 2007, 276, p. 179-183.
34. Johnson, S. Cognitive and behavioural outcomes following very preterm birth. Semin Fetal Neonatal Med, 2007, 12, p. 363-373.
35. Karimi, ZM., Behtash, N., Modares, GM. Good pregnancy outcome after prenatal exposure to bleomycin, etoposide and cisplatin for ovarian immature teratoma: a case report and literature review. Arch Gynecol Obstet, 2008, 277, p. 75-78.
36. Kim, DS., Park, MI. Maternal and fetal survival following surgery and chemotherapy of endodermal sinus tumor of the ovary during pregnancy: a case report. Obstet Gynecol, 1989, 73, p. 503-507.
37. Kim, JH., Kim, HS., Sung, CW., et al. Docetaxel, gemcitabine, and cisplatin administered for non-small cell lung cancer during the first and second trimester of an unrecognized pregnancy. Lung Cancer, 2008, 59, p. 270-273.
38. Lipshultz, SE., Colan, SD., Gelber, RD., et al. Late cardiac effects of doxorubicin therapy for acute lymphoblastic leukemia in childhood. N Engl J Med, 1991, 324, p. 808-815.
39. Lycette, JL., Dul, CL., Munar, M., et al. Effect of pregnancy on the pharmacokinetics of paclitaxel: a case report. Clin Breast Cancer, 2006, 7, p. 342-344.
40. Machado, F., Vegas, C., Leon, J., et al. Ovarian cancer during pregnancy: analysis of 15 cases. Gynecol Oncol, 2007, 105, p. 446-450.
41. Malhotra, N., Sood, M. Endodermal sinus tumor in pregnancy. Gynecol Oncol, 2000, 78, p. 265-266.
42. Malone, JM., Gershenson, DM., Creasy, RK., et al. Endodermal sinus tumor of the ovary associated with pregnancy. Obstet Gynecol, 1986, 68, p. 86S-89S.
43. Mantovani, G., Gramignano, G., Mais, V., et al. Use of chemotherapy for ovarian cancer during human pregnancy: case report and literature review. Eur J Obstet Gynecol Reprod Biol. 2007, 131, p. 238-239.
44. Mathelin, C., Annane, K., Dufour, P., et al. Chemotherapy for breast cancer during pregnancy. Eur J Obstet Gynecol Reprod Biol, 2005, 123, p. 260-262.
45. Mendez, LE., Mueller, A., Salom, E., Gonzalez-Quintero, VH. Paclitaxel and carboplatin chemotherapy administered during pregnancy for advanced epithelial ovarian cancer. Obstet Gynecol, 2003, 102, p. 1200-1202.
46. Mendez, LE., Mueller, A., Salom, E., Gonzalez-Quintero, VH. Paclitaxel and carboplatin chemotherapy administered during pregnancy for advanced epithelial ovarian cancer. Obstet Gynecol, 2003, 102, p. 1200-1202.
47. Mir, O., Berveiller, P., Ropert, S., et al. Emerging therapeutic options for breast cancer chemotherapy during pregnancy. Ann Oncol, 2008, 19, p. 607-613.
48. Modares, GM., Karimi, ZM., Behtash, N., et al. Preservation of pregnancy in a patient with advanced ovarian cancer at 20 weeks of gestation: case report and literature review. Int J Gynecol Cancer, 2007, 17, p. 1140-1143.
49. Motegi, M., Takakura, S., Takano, H., et al. Adjuvant chemotherapy in a pregnant woman with endodermal sinus tumor of the ovary. Obstet Gynecol, 2007, 109, p. 537-540.
50. Muller, T., Hofmann, J., Steck, T. Eclampsia after polychemotherapy for nodal-positive breast cancer during pregnancy. Eur J Obstet Gynecol Reprod Biol, 1996, 67, p. 197-198.
51. Nieto, Y., Santisteban, M., Aramendia, JM., et al. Docetaxel administered during pregnancy for inflammatory breast carcinoma. Clin Breast Cancer, 2006, 6, p. 533-534.
52. Otton, G., Higgins, S., Phillips, KA., Quinn, M. A case of early-stage epithelial ovarian cancer in pregnancy. Int J Gynecol Cancer, 2001, 11, p. 413-417.
53. Palaia, I., Pernice, M., Graziano, M., et al. Neoadjuvant chemotherapy plus radical surgery in locally advanced cervical cancer during pregnancy: a case report. Am J Obstet Gynecol, 2007, 197, p. e5-e6.
54. Pant, S., Landon, MB., Blumenfeld, M., et al. Treatment of breast cancer with trastuzumab during pregnancy. J Clin Oncol, 2008, 26, p. 1567-1569.
55. Peccatori, F., Martinelli, G., Gentilini, O., Goldhirsch, A. Chemotherapy during pregnancy: what is really safe? Lancet Oncol, 2004, 5, p. 398.
56. Pentheroudakis, G., Pavlidis, N. Cancer and pregnancy: Poena magna, not anymore. Eur J Cancer, 2006, 42, p. 126-140.
57. Picone, O., Lhomme, C., Tournaire, M., et al. Preservation of pregnancy in a patient with a stage IIIB ovarian epithelial carcinoma diagnosed at 22 weeks of gestation and treated with initial chemotherapy: case report and literature review. Gynecol Oncol, 2004, 94, p. 600-604.
58. Potluri, V., Lewis, D., Burton, GV. Chemotherapy with taxanes in breast cancer during pregnancy: case report and review of the literature. Clin Breast Cancer, 2006, 7, p. 167-170.
59. Raffles, A., Williams, J., Costeloe, K., Clark, P. Transplacental effects of maternal cancer chemotherapy. Case report. Br J Obstet Gynaecol, 1989, 96, p. 1099-1100.
60. Ring, AE., Smith, IE., Jones, A., et al. Chemotherapy for breast cancer during pregnancy: An 18-year experience from Five London Teaching Hospital. J Clin Oncol, 2005, 23, p. 4192-4196.
61. Robova, H., Rob, L., Hrehorcak, M., et al. Endodermal sinus tumor diagnosed in pregnancy: a case report. Int J Gynecol Cancer, 2007, 17, p. 914-916.
62. Sekar, R., Stone, PR. Trastuzumab use for metastatic breast cancer in pregnancy. Obstet Gynecol, 2007, 110, p. 507-510.
63. Shrim, A., Garcia-Bournis, sen. F., Maxwell, C., et al. Favorable pregnancy outcome following Trastuzumab (HerceptinR) use during pregnancy - Case report and updated literature review. Reprod Toxicol, 2007, 24.
64. Sood, AK., Shahin, MS., Sorosky, JI. Paclitaxel and platinum chemotherapy for ovarian carcinoma during pregnancy. Gynecol Oncol, 2001, 83, p. 599-600.
65. Tabata, T., Nishiura, K., Tanida, K., et al. Carboplatin chemotherapy in a pregnant patient with undifferentiated ovarian carcinoma: case report and review of the literature. Int J Gynecol Cancer, 2008, 18, p. 181-184.
66. van Calsteren, K., Berteloot, P., Hanssens, M., et al. In utero exposure to chemotherapy: effect on cardiac and neurologic outcome. J Clin Oncol, 2006, 24, p. e16-e17.
67. Witzel, ID., Muller, V., Harps, E., et al. Trastuzumab in pregnancy associated with poor fetal outcome. Ann Oncol, 2008, 19, p. 191-19a.
68. Zemlickis, D., Lishner, M., Erlich, R., Koren, G. Teratogenicity and carcinogenicity in a twin exposed in utero to cyclophosphamide. Teratog Carcinog Mutagen, 1993, 13, p. 139-143.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2009 Issue 4-
All articles in this issue
- Mediolaterální epiziotomie a poranění análního sfinkteru
- Chemoterapie během těhotenství
- Preeklampsie – některé možnosti predikce
- Ischemizující metody léčby děložních myomů
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu
- Proteomika a biomarkery karcinomu endometria
- Markery aktivace endoteliálních buněk – možnosti jejich vyšetření a klinický význam v gynekologii a porodnictví
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Prognostické faktory u mezenchymálních a smíšených nádorů děložního těla
-
Operování přirozenými tělními otvory
Hybridní transvaginální cholecystektomie - Placenta adherens partim accreta – ojedinělé možnosti terapie
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Placenta adherens partim accreta – ojedinělé možnosti terapie
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

