-
Medical journals
- Career
Stanovenie tiamínu a pyridoxínu vo výživových doplnkoch a nápojoch jednoduchou metódou kapilárnej zónovej elektroforézy v spojení s UV detekciou
Authors: Michaela Matušková; Ivana Čižmárová; Peter Mikuš; Juraj Piešťanský
Authors‘ workplace: Univerzita Komenského, Farmaceutická fakulta, Katedra farmaceutickej analýzy a nukleárnej farmácie ; Toxikologické a antidopingové centrum *
Published in: Čes. slov. Farm., 2020; 69, 237-243
Category: Original Articles
Overview
Práca sa zameriava na vývoj jednoduchej analytickej metódy na báze kapilárnej zónovej elektroforézy v spojení s UV-detekciou pre simultánne stanovenie tiamínu a pyridoxínu vo vzorkách farmaceutického a potravinárskeho charakteru. Separácia tiamínu a pyridoxínu prebiehala v elektrolytovom systéme 25 mmol ∙ l–1 GABA + 50 mmol ∙ l–1 HAc+ 0,05% m-HEC. Detekcia bola uskutočnená pri vlnovej dĺžke 260 nm. Medza detekcie pre tiamín bola 0,059 µg ∙ ml–1 a pre pyridoxín 0,23 µg ∙ ml–1. Tieto hodnoty naznačujú, že metóda je vhodná na stanovenie relatívne nízkych koncentrácií tiamínu a pyridoxínu. Uvedená CZE-UV metóda umožnila efektívne stanovenie obsahu dvojice vitamínov v piatich výživových doplnkoch a jedenástich energetických nápojoch a vitamínových vodách.
Klíčová slova:
tiamín – pyridoxín – kapilárna zónová elektroforéza – UV detekcia – kontrola kvality
Úvod
Vitamíny predstavujú živiny, ktoré sú potrebné pre zabezpečovanie mnohých fyziologických funkcií nevyhnutných pre život. Na rozdiel od iných tried živín vitamíny nedisponujú štrukturálnymi funkciami, a rovnako tak ich katabolizmus nepredstavuje významný zdroj energie. Ich úlohy v organizme sú však veľmi špecifické, preto sú potrebné iba v malých množstvách1). Zvyčajne sú súčasťou procesov spojených so zabezpečením a reguláciou normálneho metabolizmu. Vitamíny skupiny B reprezentujúce skupinu vo vode rozpustných látok, pôsobia prevažne ako koenzýmy energetického metabolizmu alebo sú významné z hľadiska tvorby nových buniek2). Mimoriadna pozornosť zo širokého spektra B vitamínov, je v súčasnosti venovaná predovšetkým vitamínu B1 a B6, a to na základe ich pozitívneho vplyvu na liečbu viacerých ochorení3).
Vitamín B1 (tiamín), chemicky 2-(3-((4-amino-2-metylpyrimidin-5-yl)metyl)-4-metyl-1,3-tiazol-3-ium-5-yl)etanol, vo svojej aktívnej forme priamo zasahuje do katabolizmu sacharidov a tvorby energie4–6). Absorbcia tiamínu prebieha v tenkom čreve saturabilným mechanizmom, kedy maximálne vstrebané množstvo z jednotlivej dávky predstavuje 2,5 mg. Jeho denná spotreba sa pohybuje na úrovni 0,8 – 1,5 mg7). Nedostatok vitamínu B1 sa prejavuje nešpecifickými symptómami ako anorexia, slabosť, periférna parestézia a vyúsťuje do choroby beri-beri. Rizikovými faktormi, ktoré môžu viesť k B1 hypovitaminóze, sú napr. nadmerná konzumácia alkoholu a kofeínu, dlhodobý stres, namáhavé cvičenie, diabetes alebo gravidita8).
Vitamín B6 (pyridoxín), chemicky 4,5-bis(hydroxymetyl)-2-metylpyridín-3-ol, je najdôležitejším koenzýmom v metabolizme aminokyselín, homocysteínu, glukózy a lipidov, zároveň je nevyhnutý v procese tvorby neurotransmiterov a syntéze DNA a RNA9). Špecifickú úlohu zohráva i v metabolizme proteínov a červených krviniek, súčasne je dôležitý pre správne fungovanie imunitného systému10). Denná dávka pyridoxínu u dospelého jedinca je v rozpätí 1,2 – 2 mg. Jeho nedostatok sa prejavuje veľmi zriedkavo, pričom vedie ku kožným lézám, poruchám v metabolizme aminokyselín, zvýšenej neuromuskulárnej dráždivosti a môže dôjsť i k epileptickým záchvatom4). Pyridoxín veľmi často vstupuje do interakcií s rozličnými liečivami. Ako príklad možno uviesť zníženú biologickú dostupnosť pyridoxínu pri podávaní penicilamínu, cykloserínu, hydralazínu alebo hormonálnej antikoncepcie7), prípadne zníženie účinnosti levodopy pri súčasnom podávaní pyridoxínu už v dávke 5 mg11).
V súčasnej hektickej dobe čoraz viac ľudí siaha po multivitamínových prípravkoch, pretože ich užívanie považujú za súčasť zdravého životného štýlu. Vitamínové prípravky sú k dispozícii vo forme liekov, výživových doplnkov alebo dietetických potravín. Vitamíny skupiny B sú zároveň i súčasťou nápojov modernej doby – energetické nápoje a vitamínové vody, ktoré sú mimoriadne obľúbené najmä u mladších užívateľov. Zámerom energetických nápojov je poskytovať energiu na zlepšenie výkonu. Ich spotreba v súčasnosti neustále rastie aj vďaka vysokým nárokom na výkon jednotlivca v spoločnosti. Usudzuje sa, že prítomnosť B vitamínov v energetických nápojoch je prínosná, keďže sú schopné efektívnym spôsobom konvertovať cukor, ktorý je obsiahnutý v takýchto nápojoch vo veľkom množstve, na energiu10). Na druhej strane dlhodobý príjem vysokých dávok pyridoxínu prítomného v daných nápojoch môže viesť k vzniku neuropatie12).
Stabilita niektorých vitamínov je ovplyvnená viacerými externými faktormi, ako je napríklad pH, teplota alebo svetlo, ktoré výrazným spôsobom môžu redukovať ich obsah vo výživových doplnkoch alebo spomínaných energetických a funkčných nápojoch. I z tohto dôvodu je potrebné realizovať kontrolu ich obsahu v predmetných vzorkách, a to analytickými metódami charakterizovanými vysokou presnosťou, správnosťou, robustnosťou, adekvátnou citlivosťou, selektivitou, rýchlosťou analýzy, jednoduchosťou prevedenia, ale i nízkymi nákladmi. Popri chromatografických metódach reprezentujúcich zlatý štandard v oblasti analýzy vzoriek farmaceutického, potravinárskeho alebo biomedicínskeho charakteru sa ako perspektívne javia metódy kapilárnej elektroforézy (CE). Je to na základe viacerých výhod, ktorými CE disponuje, a to: 1. vysoká separačná účinnosť, 2. relatívne krátky čas analýzy, 3. minimálne nároky na spotrebu rozpúšťadiel a vzoriek, 4. práca vo vodnom prostredí (ekologický aspekt)13). Preferovanými CE módmi v prípade analýzy vitamínov sú kapilárna zónová elektroforéza (CZE) a predovšetkým micelárna elektrokinetická chromatografia (MEKC)2, 14). Vyvinuté metódy MEKC v spojení s UV alebo DAD detekciou aplikované na hodnotenie predmetných vitamínov v multivitamínových doplnkoch stravy15–20) alebo energetických nápojoch17, 21) poskytovali hodnoty medze dôkazu (LOD) na úrovni 0,05 – 5 µg ∙ ml–1 pre tiamín a na úrovni 0,08 – 0,2 µg ∙ ml–1 pre pyridoxín. Popísané bolo i spojenie MEKC s ampérometrickou elektrochemickou detekciou22). Metódou CZE v spojení s UV detekciou boli analyzované vitamíny v rozličných liekových formách23–26), pričom dosiahnuté boli hodnoty LOD na úrovni 1,5 – 5,2 µg ∙ ml–1 pre tiamín a na úrovni 0,9 – 2,6 µg ∙ ml–1 pre pyridoxín. CZE v spojení s pokročilým typom detekcie reprezentovaným tandemovou hmotnostnou spektrometriou bol taktiež použitý pri hodnotení obsahu vitamínov v liekových formách a výživových doplnkoch, pričom boli dosiahnuté hodnoty LOD 0,1047 µg ∙ ml–1 pre tiamín a 0,1398 µg ∙ ml–1 pre pyridoxín27). Všetky z uvedených CE metód boli realizované v zariadeniach pracujúcich v hydrodynamicky otvorenom móde. Nevýhodou takýchto systémov je vysoká medza dôkazu (LOD) determinovaná limitovaným množstvom vzorky (niekoľko desiatok nl), ktoré je možné do systému injektovať. Z tohto dôvodu je potrebné pristúpiť pred samotným analytickým krokom často k predúprave vzoriek spojených s ich zakoncentrovaním, alebo k použitiu citlivejších detekčných techník, ako je napríklad flourescencia alebo hmotnostná spektrometria. Na druhej strane systémy pracujúce v hydrodynamicky uzatvorenom móde sú charakteristické použitím separačných kapilár s väčším vnútorným priemerom, čo zároveň umožňuje dávkovať vzorku na úrovni stoviek nl až desiatok µl. Takýmto spôsobom je výrazne zvýšená schopnosť analýzy látok prítomných vo vzorke na nízkych koncentračných úrovniach28).
Cieľom našej práce bolo vyvinutie jednoduchej CZE metódy v spojení s UV detekciou realizovanej v hydrodynamicky uzatvorenom elektroforetickom móde, ktorá by umožňovala simultánnu analýzu tiamínu a pyridoxínu vo vzorkách farmaceutického i potravinárskeho charakteru.
Pokusná časť
Inštrumentácia
Na prevedenie CZE experimentov bol použitý elektroforetický analyzátor EA 102 (Villa Labeco, Spišská Nová Ves, Slovenská republika) v jednokolónovom usporiadaní umožňujúcom CZE analýzu. Vzorka bola do analyzátora injektovaná prostredníctvom dávkovacieho bloku s integrovanou 200 nl vnútornou slučkou. Separačná kolóna bola tvorená polytetrafluóretylénovou kapilárou s vnútorným priemerom 300 μm a celkovou dĺžkou 160 mm, pričom bola súčasťou bloku so zabudovaným vodivostným detektorom a UV koncovkou. K elektroforetickému analyzátoru bol pomocou UV koncovky a optických vláken (J & M, Aalen, Nemecko) pripojený UV detektor (ECOM, Praha, Česká republika), ktorý bol nastavený na konštantnú vlnovú dĺžku 260 nm. Merania boli realizované pri laboratórnej teplote. Údaje získavané z CZE analyzátora boli zaznamenávané a vyhodnocované s použitím softvérového programu ITP Pro32 (Villa Labeco).
Chemikálie a vzorky
Všetky chemikálie použité na prípravu elektrolytových roztokov boli p. a. analytickej čistoty a boli zakúpené v spoločnostiach Merck (Darmstadt, Nemecko), Sigma Aldrich (Steinheim, Nemecko) a Fluka (Buchs, Švajčiarsko). Štandardy vitamínov skupiny B analytickej čistoty – hydrochlorid tiamínu a hydrochlorid pyridoxínu – boli získané zo Sigma Aldrich. Na prípravu elektrolytových roztokov, roztokov štandardov a vzoriek bola použitá demineralizovaná voda získaná s použitím purifikačného systému Millipore Simplicity 185 (UV) (Millipore, Molsheim, Francúzsko). Všetky pripravené roztoky elektrolytov boli pred použitím filtrované membránovými filtrami s veľkosťou pórov 0,22 μm (Millipore) a skladované pri teplote 2 – 8 °C. Súčasťou elektrolytových roztokov bola i metylhydroxyetylcelulóza (m-HEC), s koncentráciou 0,05 % (w/v), ktorá bola získaná zo spoločnosti Fluka.
Vzorky mutivitamínových efervescentných tabliet (ADDITIVA Multivitamin Tropic tbl eff, B-komplex GENERICA forte plus tbl eff, CEMIO Switzerland Multivitamin tbl eff, ZDROVIT MM tbl eff, GS Multivitamin tbl eff) boli zakúpené v miestnej lekárni. Vzorky energetických nápojov (Hell Active, Tiger, Semtex Energy High, Powerking, Red Bull, Monster Energy, Steiger Radler Energy, Alcohol βG Killer, Oshee Vitamin Energy Magnesium + B6 + vitamin B5) a vitamínových vôd (Body & Future Vitamin Water Active, Dr. Witt Relax) boli zakúpené v miestnom obchode.
Príprava roztokov štandardov a vzoriek
Zásobný roztok štandardov dvojice vitamínov skupiny B bol pripravený rozpustením 10 mg ich štandardov v 10 ml demineralizovanej vody. Pracovné roztoky zmesi štandardov o požadovaných koncentráciách (koncentračný rozsah tiamínu 0,19 – 78,68 μg ∙ ml–1, koncentračný rozsah pyridoxínu 0,41 – 82,27 μg ∙ ml–1) sme pripravili riedením základných roztokov štandardov demineralizovanou vodou.
Vzorky šumivých tabliet boli pripravené rozpustením jednej šumivej tablety v 100 ml demineralizovanej vody. Takto pripravený zásobný roztok vzorky bol následne vystavený pôsobeniu ultrazvukového kúpeľa počas 15 minút a potom filtrovaný membránovými filtrami s veľkosťou pórov 0,22 μm (Millipore). Vzorky šumivých tabliet boli následne injektované do CZE analyzátora priamo alebo po vhodnom nariedení demineralizovanou vodou. Vzorky energetických nápojov a vitamínových vôd boli vystavené pôsobeniu ultrazvukového kúpeľa počas 15 minút. Takto upravené vzorky boli filtrované cez membránové filtre s veľkosťou pórov 0,22 μm (Millipore) a priamo injektované do CZE analyzátora. Každá zo vzoriek bola premeriavaná trikrát.
Príprava vzoriek pre hodnotenie výťažnosti
Pre hodnotenie výťažnosti boli do roztoku reálnych matríc (šumivá tableta, energetický nápoj) pridávané štandardné prídavky tiamínu a pyridoxínu. Pripravené boli tri vzorky s koncentráciami pridaného roztoku štandardu tiamínu na úrovni 0,59; 3,93 a 59,01 µg ∙ ml–1 a štandardu pyridoxínu na úrovni 0,62; 4,11 a 61,70 µg ∙ ml–1. Súčasne bola pripravená i jedna vzorka bez prídavku štandardu. Všetky vzorky boli následne mechanicky pretrepávané počas 5 minút a pred vlastnou analýzou filtrované cez membránové filtre s veľkosťou pórov 0,22 µm. Každá zo vzoriek bola premeriavaná trikrát.
Výsledky a diskusia
Optimalizácia CZE-UV metódy
Proces optimalizácie CZE-UV metódy pre analýzu dvojice vitamínov skupiny B (tiamín, pyridoxín) spočíval vo výbere vhodného zloženia, iónovej sily a pH nosného elektrolytu (BGE), nastavenia hodnoty separačného prúdu a výbere vhodných detekčných podmienok. Výber zloženia BGE a veľkosti separačného prúdu boli realizované s cieľom dosiahnutia rýchlych analýz charakterizovaných vysokou separačnou účinnosťou a zároveň s cieľom minimalizácie tepelných a elektromigračných disperzných procesov. V našej práci bola detailne testované tri typy elektrolytov, a to kyselina mravčia – HFo, kyselina octová – HAc, a zmes kyseliny γ-aminomaslovej (GABA) s kyselinou octovou. Z uvedených testovaných elektrolytových systémov bol na základe stanovených kritérií napokon pre ďalšie experimenty zvolený elektrolyt pozostávajúci zo zmesi 25 mmol ∙ l–1 GABA a 50 mmol ∙ l–1 HAc (pH = 4,05), ktorého súčasťou bola i 0,05% m-HEC. Prídavok m-HEC do BGE zabezpečil dynamické pokrytie vnútorného povrchu separačnej kapiláry, čo na jednej strane zabránilo adhézii analytov na jej povrch a na strane druhej viedlo k supresii elektroosmotického toku, ktorý je v prípade elektroforetických systémov pracujúcich v hydrodynamicky uzatvorenom móde nežiadúci. Separácia tiamínu a pyridoxínu bola optimálna pri hodnote prúdu 50 µA. Detekcia prostredníctvom UV bola realizovaná pri konštantnej vlnovej dĺžke 260 nm reprezentujúcej kompromis medzi absorpčnými maximami jednotlivých analyzovaných látok. Uvedené separačné a detekčné podmienky reprezentujúce vhodný kompromis medzi rozlíšením analytov, časom analýzy, reprodukovateľnosťou meraní a medzou dôkazu viedli k úspešnej separácii požadovaných analytov z matríc testovaných vzoriek.
Validácia
Zoptimalizovaná CZE-UV metóda pre analýzu tiamínu a pyridoxínu bola následne validovaná na základe odporúčaní smernice ICH29). Parametrami hodnotenými v procese validácie boli: linearita, presnosť (vyjadrená ako opakovateľnosť), medza dôkazu (limit of detection – LOD), medza stanovenia (limit of quantification – LOQ), robustnosť a správnosť. Niektoré z validačných a operačných parametrov sú zosumarizované v tabuľke 1.
Table 1. Kalibračné a vybrané separačné parametre tiamínu a pyridoxínu 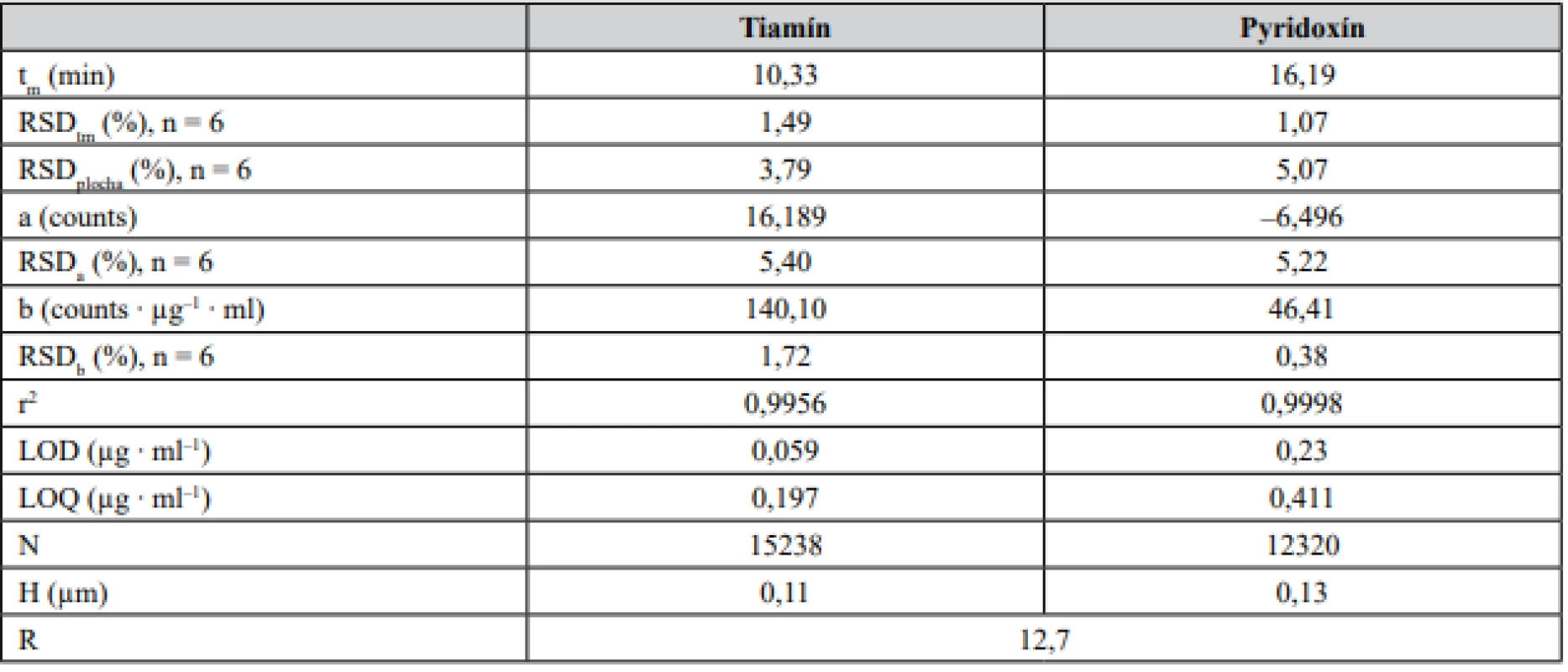
t m – migračný čas, N – účinnosť, H – výškový ekvivalent teroretickej priehradky, R – rozlíšenie. Separačná účinnosť (N) bola počítaná na základe vzťahu N = 5,545(tm/w1/2)2 , kde w1/2 je šírka píku v polovici jeho výšky. Kalibračná krivka bola vyjadrená vzťahom y = b ∙ x + a. RSDtm a RSDplocha boli počítané zo vzoriek na koncentračnej úrovni zodpovedajúcej LOQ Linearita bola hodnotená na základe opakovaných meraní zmesi štandardov tiamínu a pyridoxínu na šiestich koncentračných úrovniach, a to v rozsahu kalibračných meraní (0,19 – 78,68 μg ∙ ml–1 pre tiamín a 0,41 – 82,27 μg ∙ ml–1 pre pyridoxín). Z nameraných hodnôt bola zostrojená kalibračná krivka vyjadrujúca závislosť plochy píku od koncentrácie štandardu daného analytu. Parametre kalibračnej krivky boli vyhodnotené s použitím softvérového programu Microsoft Excel 2010 (Microsoft Corporation, Redmond, WA, USA) a sú predmetom tabuľky 1. Na základe príslušných parametrov a hodnôt koeficientov stanovenia (r2) pre dané analyty možno konštatovať dobrú linearitu kalibračných kriviek v zvolenom koncentračnom rozmedzí. Súčasne pri hodnotení parametrov kalibračných kriviek bol vykonaný test štatistickej významnosti úseku kalibračnej krivky. Hodnoty p úseku jednotlivých kalibračných kriviek boli v rozmedzí 0,35 – 0,86 na hladine významnosti α = 0,05. Uvedené dáta indikujú, že parameter a (úsek kalibračných kriviek) sa štatisticky významne nelíši od nulovej hodnoty.
Hodnoty medze dôkazu (LOD) a medze stanovenia (LOQ) boli vyjadrené na základe pomeru signál/šum (S/N), pričom platilo, že LOD = 3S/N a LOQ = 10S/N. Predikované hodnoty LOD a LOQ tiamínu a pyridoxínu boli na sub µg ∙ ml–1 úrovniach, ktoré sú dokonca porovnateľné s hodnotami dosiahnutými metódou kapilárnej elektroforézy v hydrodynamicky otvorenom móde v spojení s tandemovou hmotnostnou spektrometriou27).
Presnosť metódy bola určená na základe hodnôt relatívnej štandardnej odchýlky plochy analytického signálu (RSDplocha) a migračného času (RSDtm) vzoriek s koncentráciou v rozsahu kalibračnej krivky. Každá vzorka o požadovanej koncentrácii bola opakovane premeraná šesťkrát. Dosiahnuté výsledky RSD hodnôt reflektujú veľmi dobrú optimalizáciu metódy a jej opakovateľnosť (RSD migračného času bola na úrovni menej ako 1,5 % a RSD plochy píku bola úrovni okolo 5 %). Rovnakým spôsobom bola hodnotená i medziľahlá presnosť, kedy analýzy boli vykonané iným pracovníkom. Dosiahnuté hodnoty RSDtm a RSDplocha boli na úrovni 1,4 %, resp. 4,4 %.
Správnosť metódy bola overená na základe testu výťažnosti. Ten bol prevedený ako štandardný prídavok roztoku štandardu tiamínu a pyridoxínu o troch rozličných koncentráciách do roztokov matríc – lieková forma (šumivá tableta), energetický nápoj (obr. 1). Výťažnosť bola počítaná na základe vzťahu: výťažnosť (%) = 100 × [c(matrica + prídavok) – c(matrica)]/c(prídavok). Výsledky získané z daného experimentu sú zosumarizované v tabuľke 2 a svedčia o zanedbateľnom vplyve matrice na analytický signál testovaných vitamínov. Zároveň preukazujú akceptovateľnú mieru správnosti vyvinutej CZE-UV metódy.
Image 1. Reprezentatívne elektroforeogramy získané z validačného procesu testovania výťažnosti: a) matrica (šumivá tableta), b) matrica s prídavkom 0,590 µg ∙ ml–1 tiamínu a 0,617 µg ∙ ml–1 pyridoxínu, c) matrica s prídavkom 3,934 µg ∙ ml–1 tiamínu a 4,114 µg ∙ ml–1 pyridoxínu, d) matrica s prídavkom 59,008 µg ∙ ml–1 tiamínu a 61,703 µg ∙ ml–1 pyridoxínu. Detekcia bola uskutočnená pri vlnovej dĺžke 260 nm. Veľkosť separačného prúdu bola 50 µA. Ostatné separačné podmienky sú uvedené v časti Optimalizácia CZEUV metódy. 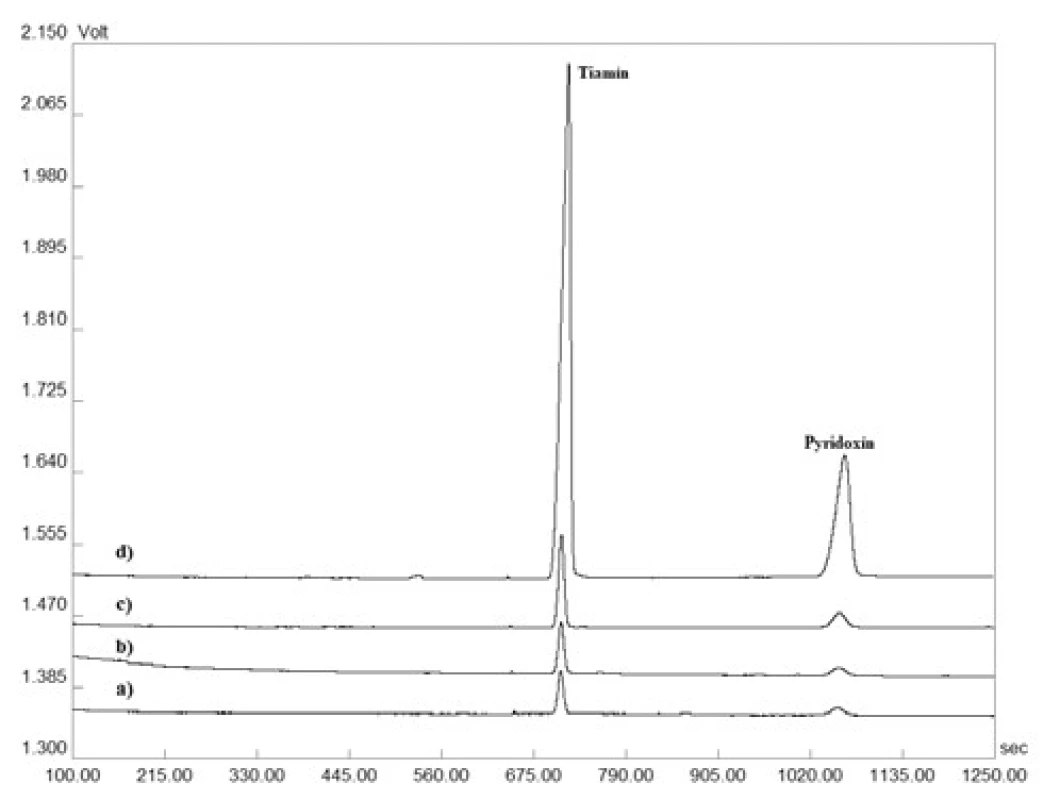
Table 2. Správnosť CZE-UV metódy overená ako výťažnosť 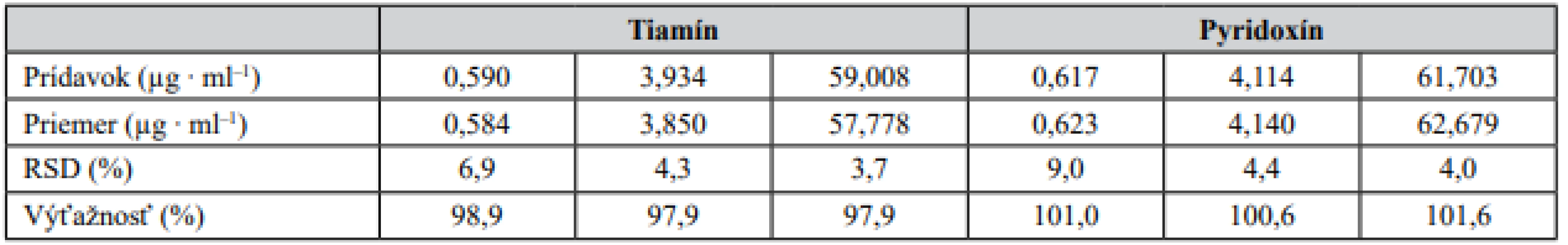
Robustnosť, ktorá reprezentuje spoľahlivosť metódy pri vykonaní malých zmien operačných parametrov, bola testovaná prostredníctvom: 1. zmeny koncentrácie nosného elektrolytu o ± 2 mmol ∙ l–1 a 2. prostredníctvom zmeny hodnoty pH nosného elektrolytu o ± 0,1 jednotky. Zmeny uvedených parametrov nemali významný vplyv na priebeh analýzy a zároveň ani na intenzitu analytického signálu testovaných látok. Z uvedeného vyplýva, že metódu je možné pokladať za dostatočne robustnú.
Aplikácia
Na základe mimoriadne priaznivých validačných parametrov bola zoptimalizovaná CZE-UV metóda aplikovaná pri simultánnom stanovení dvojice vitamínov skupiny B – tiamínu a pyridoxínu – v piatich vzorkách farmaceutického charakteru (komerčne dostupné vitamínové výživové doplnky reprezentované šumivými tabletami) a jedenástich vzorkách potravinárskeho charakteru (energetické nápoje a vitamínové vody). Výsledky z jednotlivých stanovení sú predmetom tabuľky 3 a na obrázku 2 sú znázornené ilustratívne reálne elektroforeogramy získané z analýzy tiamínu a pyridoxínu v šumivej multivitamínovej tablete (Additiva), energetických nápojoch (Hell active, Alcohol Killer) a vitamínovej vode (Dr. Witt). Z príslušných elektroforeogramov je možné potvrdiť i požadovanú mieru špecificity vyvinutej metódy, keďže neboli pozorované žiadne interferujúce píky v migračných pozíciách zodpovedajúcich sledovaným analytom – pyridoxínu a tiamínu. Zistený obsah dvojice vitamínov sa v jednotlivých testovaných prípravkoch pohyboval na 81 – 116 % (tiamín) a 74 – 109 % (pyridoxín) úrovni deklarovanej výrobcom. Vysoká miera zhody s hodnotami deklarovanými výrobcom bola dosiahnutá u vzoriek farmaceutického charakteru. Markantnejšie rozdiely boli pozorované v prípade niektorých vzoriek energetických nápojov a vitamínových vôd. Uvedené fluktuácie mohli byť spôsobené napr. podmienkami skladovania (teplo, svetlo), ale i absenciou efektívnej analytickej metódy použitej pri hodnotení finálneho produktu. Z dosiahnutých výsledkov vyplýva, že nami vyvinutá metóda je uplatniteľná v oblasti rutinného stanovenia tiamínu a pyridoxínu vo vzorkách farmaceutického i potravinárskeho charakteru.
Image 2. Reprezentatívne elektroforeogramy získané z analýzy tiamínu a pyridoxínu v reálnych vzorkách šumivých tabliet, energetických nápojov a vitamínových vôd. Detekcia bola uskutočnená pri vlnovej dĺžke 260 nm. Veľkosť separačného prúdu bola 50 µA. Ostatné separačné podmienky sú uvedené v časti Optimalizácia CZE-UV metódy 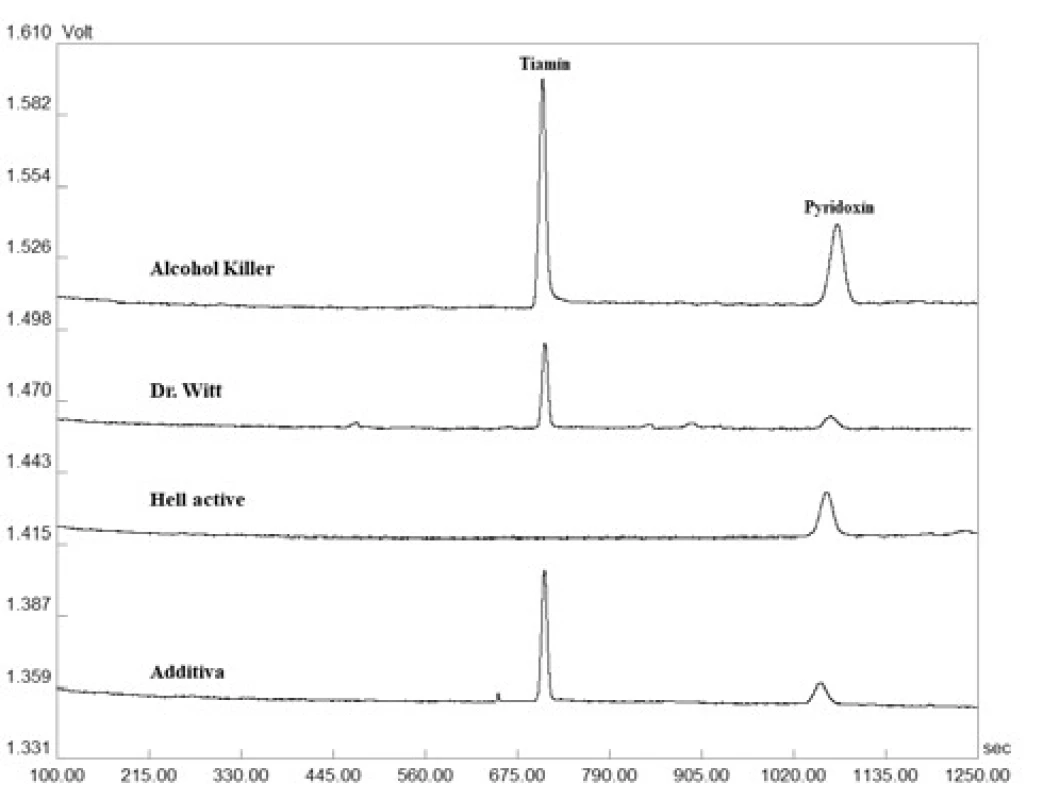
Table 3. Stanovenie obsahu tiamínu a pyridoxínu vo výživových doplnkoch, energetických nápojoch a vitamínových vodách 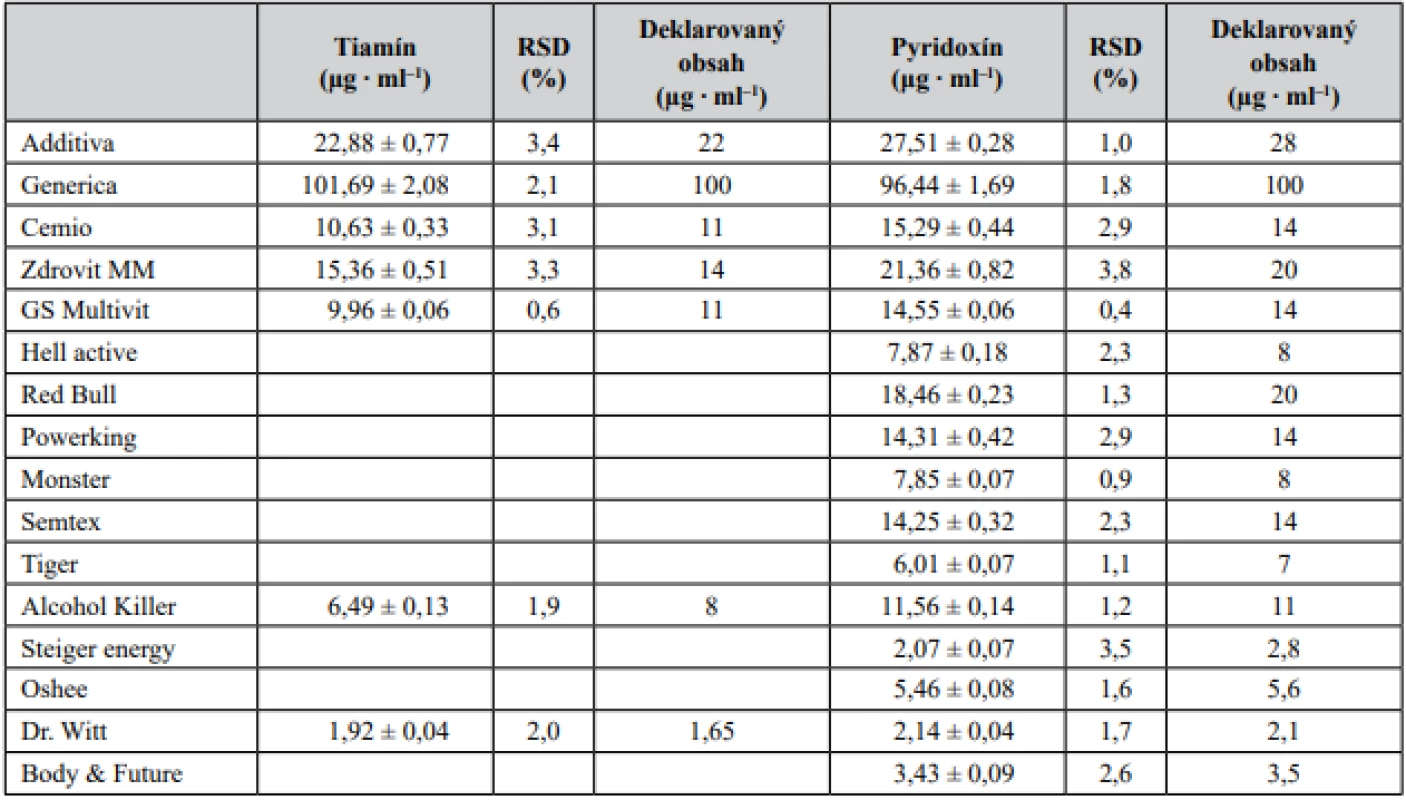
Záver
Zámerom práce bolo navrhnutie, vypracovanie a validácia jednoduchej CZE-UV metódy realizovanej v hydrodynamicky uzatvorenom systéme, ktorá by umožňovala simultánnu analýzu dvojice vitamínov skupiny B – tiamínu a pyridoxínu – v multikomponentných vzorkách farmaceutického a potravinárskeho charakteru reprezentovaných šumivými tabletami, energetickými a vitamínovými nápojmi. Optimalizovaná CZE-UV metóda vo validačnom procese preukázala dobrú linearitu v testovaných koncentračných rozsahoch, vyznačovala sa relatívnou rýchlosťou (celkový čas analýzy na úrovni 20 min.) a hodnotami LOD na sub µg ∙ ml–1 úrovni. Dosiahnuté výsledky preukázali jednoduchosť, vysokú separačnú účinnosť, nízke finančné nároky a ekologickosť vypracovanej metódy. Uvedenými atribútmi tak spĺňa kritériá kladené modernými laboratóriami zaoberajúcimi sa hodnotením kontroly kvality farmaceutických alebo potravinárskych produktov.
Práca vznikla s podporou grantu APVV–15–0585, VEGA 1/0463/18, KEGA 027UK–4/2020.
Stret záujmov: žiadny.
PharmDr. Juraj Piešťanský, PhD.* (∗) • Matušková M. • Čižmárová I. • Mikuš P.*
Univerzita Komenského, Farmaceutická fakulta
Katedra farmaceutickej analýzy a nukleárnej farmácie
*Toxikologické a antidopingové centrum
Odbojárov 10, 832 32 Bratislava, Slovenská republika
e-mail: piestansky@fpharm.uniba.sk
Sources
1. Combs F. G. The Vitamins. Fundamental Aspects in nutrition and health, 3rd ed. New York: Elsevier Health Science 2008.
2. Zhang Y., Zhou W., Yan J.-Q., Liu M., Zhou Y., Shen X., Ma Y.-L., Feng X.-S., Yang J., Li G.-H. A review of extraction and determination methods of thirteen essential vitamins to the human body: An update from 2010. Molecules 2018; 23, 1484.
3. Jenčo J., Kujovská Krčmová L., Sobotka L., Bláha V., Solich P., Švec F. Development of novel liquid chromatography method for clinical monitoring of vitamin B1 metabolites and B6 status in whole blood. Talanta 2020; 211, 120702.
4. Ba A. Metabolic and structural role of thiamine in nervous tissues. Cell. Mol. Neurobiol. 2008; 28, 923–931.
5. Rodwell V., Bender D., Botham K., Kennelly P., Weil P., Harper H. Harper’s Illustrated Biochemistry. 28th ed. New York: McGraw-Hill Publishing 2009.
6. Whitfield K. C., Bourassa M. W., Adamolekun B., Bergeron G., Bettendorff L., Brown K. H., Cox L., Fattal-Valevski A., Fischer P. R., Frank E. L., Hiffler L., Hlaing L. M., Jefferds M. E., Kapner H., Kounnavong S., Mousavi M. P. S., Roth D. E., Tsaloglu M.-N., Wieringa F., Combs Jr. G. F. Thiamine deficiency disorders: diagnosis, prevalence, and roadmap for global control programs. Ann. N. Y. Acad. Sci. 2018; 1430, 3–43.
7. Lüllmann H., Mohr K., Hein L. Pharmakologie und Toxikologie. 17. auflage. Stuttagart: Geort Thieme Verlag 2010.
8. Griffiths J. K. Vitamin deficiencies. In: Ryan E., Hill D., Solomon T., Endy T., Aronson N. (eds.) Hunter’s tropical medicine and emerging infectious diseases, 10th ed. New York: Elsevier 2020.
9. Spinneker A., Sola R., Lemmen V., Castillo M. J., Pietrzik K., Gonzalez-Gross M. Vitamin B6 status, deficiency and its consequences – an overview. Nutr. Hosp. 2007; 45, 527–534.
10. Higgins J. P., Tuttle T. D., Higgins C. L. Energy beverages: Content and safety. Mayo Clin. Proc. 2010; 85, 1033–1041.
11. Lincová D. Základní a aplikovaná farmakologie, 2.vydání. Praha: Galén 2007.
12. Wolk B. J., Ganetsky M., Babu K. M. Toxicity of energy drinks. Curr. Opin. Pediatr. 2012; 24, 243–251.
13. Landers J. P. Handbook of capillary and microchip electrophoresis and associated microtechniques, 3rd ed. London: CRC Press 2008.
14. Trenerry V. C. The application of capillary electrophoresis to the analysis of vitamins in food and beverages. Electrophoresis 2001; 22, 1468–1478.
15. Serni E., Audino V., del Carlo S., Manera C., Saccomanni G., Macchia M. Determination of water-soluble vitamins in multivitamin dietary cuplements and in artichokes by micellar electrokinetic chromatography. Nat. Prod. Res. 2013; 27, 2212–2215.
16. da Silva D. C., Visentainer J. V., de Souza N. E., Oliveira C. C. Micellar electrokinetic chromatography method for determination of the ten water-soluble vitamins in food supplements. Food Anal. Methods 2013; 6, 1592–1606.
17. Schreiner M., Razzazi E., Luf W. Determination of water–soluble vitamins in soft drinks and vitamin supplements using capillary electrophoresis. Nahrung 2003; 47, 243–247.
18. Blanco-Gomis D., González L. L., Álvarez D. G. Micellar electrokinetic capillary chromatography analysis of water–soluble vitamins. Anal. Chim. Acta 1999; 396, 55–60.
19. Delgado-Zamarreño M. M., González-Maza I., Sánchez-Pérez A., Carabias-Martinez R. Separation and simultaneous determination of water soluble and fat–soluble vitamins by micellar electrokinetic chromatography. J. Chromatogr. A 2002; 953, 257–262.
20. Su S.-C., Chou S.-S., Hwang D.-F., Chang P.-C., Liu C.-H. Capillary zone electrophoresis and micellar electrokinetic capillary chromatography for determining water-sol–uble vitamins in commercial capsules and tablets. J. Food Sci. 2001; 66, 10–14.
21. Navarro-Pascual-Ahuir M., Lerma-García M. J., Simó-Alfonso E. F., Herreo-Martínez J. M. Determination of water–soluble vitamins in energy and sport drinks by micellar electrokinetic capillary chromatography. Food Control 2016; 63, 110–116.
22. Hu Q., Zhou T., Zhang L., Li H., Fang Y. Separation and determination of three water–soluble vitamins in pharmaceutical preparations and food by micellar electrokinetic chromatography with amperometric electrochemical detection. Anal. Chim. Acta 2001; 437, 123–129.
23. Franco M., Jasionowska R., Salvatore E. Application of CZE method in routine analysis for determination of B-complex vitamins in pharmaceutical and veterinary preparations. Int. J. Anal. Chem. 2012; 2012, 592650.
24. Hu W., Tao J., Wang Q. Simultaneous determination of vitamins B1, B2, B6, niacinamide and calcium pantothenate in compound vitamin B tablets by high performance quantitative capillary electrophoresis. Se Pu. 2019; 37, 661–665.
25. Fotsing L., Fillet M., Chiap P., Hubert P., Crommen J. Elimination of adsorption efects in the analysis of water-soluble vitmains in pharmaceutical formulations by capillary electrophoresis. J. Chromatogr. A 1999; 853, 391–401.
26. Schiewe J., Mrestani Y., Neubert R. Application and optimization of capillary zone electrophoresis in vitamin analysis. J. Chromatogr. A 1995; 717, 255–259.
27. Maráková K., Piešťanský J., Havránek E., Mikuš P. Simultaneous analysis of vitamins B in pharmaceuticals and dietarysupplements by capillary electrophoresis hyphenated with triplequadrupole mass spectrometry. Pharmazie 2014; 69, 663–668.
28. Kaniansky D., Marák J., Masár M., Iványi F., Madajová V., Šimuničová E., Zelenská V. Capillary zone electrophoresis in a hydrodynamically closed separation system with enhanced sample loadability. J. Chromatogr. A 1997; 772, 103–114.
29. ICH Harmonised Tripartite Guideline: Validation of Analytical Procedures Q2 (R1) Step 4 Version. 2005.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2020 Issue 5-6-
All articles in this issue
- Automatizovaná příprava radiofarmak jako nástroj optimalizace radiační ochrany personálu
- Stanovenie tiamínu a pyridoxínu vo výživových doplnkoch a nápojoch jednoduchou metódou kapilárnej zónovej elektroforézy v spojení s UV detekciou
- K životnímu jubileu prof. RNDr. Jozefa Csölleiho, CSc.
- Pohľad na perchlozón, antituberkulotikum z Ruskej federácie
- Vývoj a validace metody HPLC pro kvantifikaci nečistot degradace salbutamol-sulfátu s následujícími dlouhodobými stabilitními testy ve vícesložkovém sirupu proti kašli
- Hepatoprotektivní účinek kombinace glucosaminových derivativů s quercetinem proti methotrexátem indukovanému toxickému poškození jater
- Sérové koncentrace meropenemu u pacientů vyžadujících intenzivní péči: retrospektivní analýza
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sérové koncentrace meropenemu u pacientů vyžadujících intenzivní péči: retrospektivní analýza
- K životnímu jubileu prof. RNDr. Jozefa Csölleiho, CSc.
- Automatizovaná příprava radiofarmak jako nástroj optimalizace radiační ochrany personálu
- Stanovenie tiamínu a pyridoxínu vo výživových doplnkoch a nápojoch jednoduchou metódou kapilárnej zónovej elektroforézy v spojení s UV detekciou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

