-
Medical journals
- Career
Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
Authors: K. Dvořáčková; M. Rabišková; R. Masteiková; L. Okáčová
Authors‘ workplace: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků
Published in: Čes. slov. Farm., 2008; 57, 269-274
Category: Original Articles
Overview
Cílem práce bylo sledování vlivu koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových tablet pro prodloužené uvolňování diklofenaku sodné soli se zaměřením na optimalizaci disolučního profilu v podmínkách in vitro. Lipofilním nosičem byl cetylalkohol, který měl současně funkci tajícího pojiva v procesu termoplastické granulace, povidon se použil jako gelotvorný polymer, plnivem byla sacharosa nebo laktosa. Výsledky ukázaly, že koncentrace cetylalkoholu měla vliv na jakostní parametry granulátů i připravených matricových tablet. Koncentrace cetylalkoholu ovlivňovala disoluční profil sacharosových vzorků statisticky významně, v případě vzorků s obsahem laktosy se výrazně projevila pouze při jeho vyšší koncentraci. S rostoucí koncentrací cetylalkoholu se uvolňování léčiva zpomalovalo; vzorky s obsahem sacharosy uvolňovaly léčivo rychleji ve srovnání s identickými vzorky s obsahem laktosy. Vliv byl výraznější při nižší koncentraci lipofilního nosiče.
Klíčová slova:
matricové tablety – řízené uvolňování – cetylalkohol – termoplastická granulaceÚvod
Matricové tablety s řízeným uvolňováním léčiva jsou tvořeny léčivou látkou rovnoměrně rozptýlenou v látkách pomocných. Pomocná látka, resp. látky, které mají pro řízené uvolňování léčiva rozhodující vliv, lze označit jako nosné. Podle povahy nosiče můžeme rozlišit polymerní nerozpustné, lipofilní, hydrofilní gelové, popř. směsné, tzv. hydrofilně-lipofilní matricové tablety 1).
Pro přípravu matricových tablet lze využít jako lipofilní nosič pomocnou látku cetylalkohol. Jedná se o směs tuhých alkoholů obsahující hlavně hexadekan--1-ol (CH3-[CH2]14-CH2OH) s molekulovou hmotností 242,44 Da. Představuje směs cetylalkoholu (60–70 %), stearylalkoholu (20–30 %), zbytek jsou příbuzné alkoholy 2). Cetylalkohol je bílý na omak mastný prášek, vločky nebo granule, prakticky nerozpustný ve vodě, snadno až mírně rozpustný v lihu 96%, snadno rozpustný v etheru. Má široké uplatnění v kosmetice i ve farmaceutickém průmyslu. Lze jej použít pro topickou, perorální i rektální aplikaci. Vzhledem k hydrofilně-lipofilnímu charakteru jeho molekuly patří mezi neiontové povrchově aktivní látky a jako emulgátor typu v/o se využívá například při výrobě emulzí, omývadel, krémů, dále jako změkčovadlo, popř. jako sekundární emulgátor v systémech o/v. Přispívá ke zvýšení stability a zlepšení vzhledu přípravků 3). V pevných lékových formách se tato pomocná látka uplatňuje při výrobě čípků a tablet. Cetylalkohol zvyšuje teplotu tání čípkového základu. Při výrobě tablet se používá například jako nízkotající tuhé pojivo při granulaci tavením 4), kde se využívá jeho nízké teploty tání. Dle ČL 2005 taje mezi 45–52 °C, čistá látka při teplotě 49 °C. Práškovou směs je možné granulovat také pomocí jeho lihového roztoku. U lékových forem vyšších generací se využívá jako nosná pomocná látka lipofilních matric 1), jako součást směsných matric hydrofilně-lipofilní povahy 5, 6) a jako obalový materiál. Cetylalkohol se spolu s tuhým parafínem úspěšně použil jako modifikátor uvolňování hydrofilního léčiva paracetamolu ze skeletové celulosové matrice 7). Použil se také jako pomocná látka při formování mikrosfér s řízeným uvolňováním ibuprofenu 8) a flurbiprofenu 9). Kulaté částice vznikly odkapáváním taveniny do studené vodní lázně 8). Při formování niozomů se cetylalkohol využil jako stabilizátor dvojvrstvy 10).
Cílem této experimentální práce byla příprava a hodnocení směsných, tj. hydrofilně-lipofilních matricových tablet s obsahem diklofenaku sodné soli jako modelového léčiva a cetylalkoholu jako lipofilního nosiče. Hydrofilními složkami byly gelotvorný polymer povidon a plniva (sacharosa, resp. laktosa monohydrát). Hlavní pozornost se věnovala vlivu koncentrace lipofilního nosiče na vlastnosti matricových tablet se zaměřením na optimalizaci disolučního profilu vzorků.
POKUSNÁ ČÁST
Použité suroviny
Jako modelové léčivo se při formulaci matricových tablet použil diklofenak sodná sůl – DNa (Amoli Organics, Indie), aritmetický střední průměr 59,7 μm. Jako lipofilní nosič se použil cetylalkohol (Cognis, D); k experimentu se použila frakce < 500 μm. Další součástí matricových tablet byl gelotvorný polymer povidon-30 – PVP-30 (BASF, D), aritmetický střední průměr 47,33 μm. Plnivem byla sacharosa (Cukrovary, CZ) ve velikostní frakci 80–125 μm získané sítováním a laktosa monohydrát Mesh 200 (Cerapharm, A). Stearan hořečnatý (Peter Greven, D) a koloidní oxid křemičitý – Aerosil 200, dále Aerosil, (Degussa, I) se použily jako kluzné a antiadhezivní pomocné látky 11). Všechny použité substance vyhovovaly lékopisným požadavkům.
Velikost částic použitých plniv (sacharosy, laktosy) se stanovila (měřeno minimálně 200 částic) pomocí optického mikroskopu (DN 45, Lambda, Praha, CZ) spojeného s CCD kamerou (Alphaphot, Nikon, JAP) s použitím softwaru Ia32.
Výroba granulátů a jejich hodnocení
Vzorky (300 g) připravené smísením jednotlivých složek (DNa, cetylalkohol , PVP-30, plnivo – sacharosa, resp. laktosa monohydrát) se homogenizovaly v zařízení Turbula (T2C, CH) po dobu 10 minut. Složení vzorků je shodné se složením matricových tablet uvedeným v tabulce 1, vyjádřeno v gramech, bez Aerosilu a stearanu hořečnatého. Práškové směsi vzorků I–VI se tavily ve skříňové sušárně Horo (typ 048B, D) při teplotě 55 °C po dobu 5 minut. Teplota se zvolila o 3°C vyšší než je horní hodnota rozmezí teplot tání pro cetylalkohol uvedená v ČL 2005. Vzniklý granulát se přesál přes síto o velikosti ok 1,25 mm. U připravených granulátů se hodnotila sypnost (Medipo, CZ, dle Ph.Eur., velikost otvoru 15 mm), Hausnerův poměr (HR) a index stlačitelnosti neboli Carr’s index (CI) (SVM 102, Erweka, D, dle Ph.Eur.). Následně se zhodnocené granuláty homogenizovaly s 0,5 % Aerosilu a 5 % stearanu hořečnatého.
Výroba a hodnocení matricových tablet
Složení matricových tablet uvádí tabulka 1. Ploché tablety o průměru 10 mm se vyrobily na výstředníkovém tabletovacím lisu (Korsch, EK 0, D) lisováním granulátů připravených termoplastickou granulací. Matricové tablety se lisovaly při stejném lisovacím tlaku.
Table 1. Složení matricových tablet 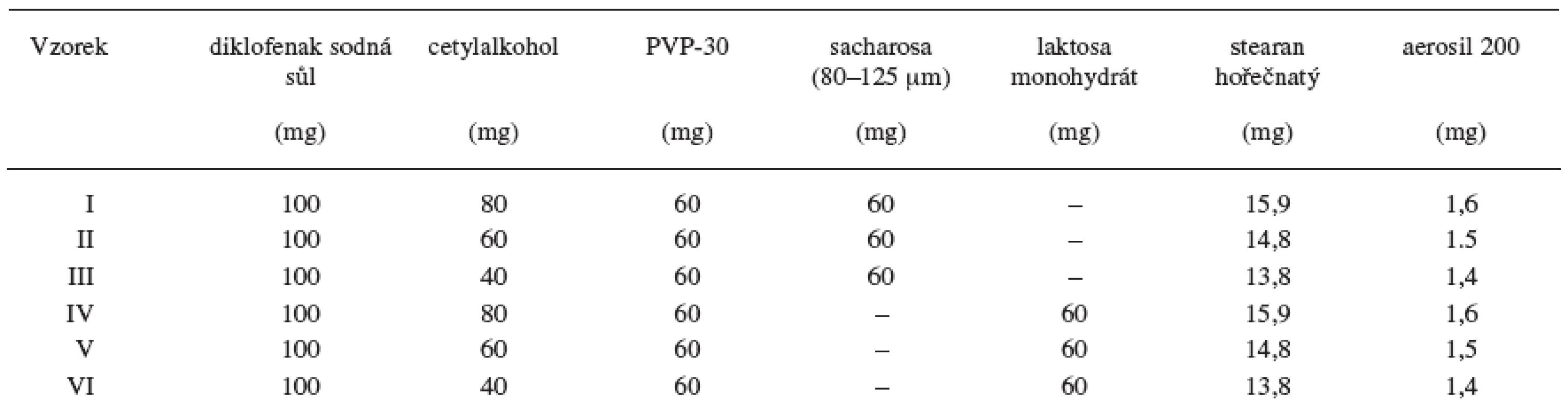
U jednotlivých vzorků tablet se provedly lékopisné zkoušky (ČL 2005), tj. hmotnostní stejnoměrnost (analytické váhy Kern 870-13, D), obsahová stejnoměrnost (UV spektrofotometr Lambda 25, Perkin Elmer, USA) při vlnové délce 276 nm pro DNa, pevnost (C50 Tablet Hardness & Compression tester, GB), oděr tablet (friabilátor Erweka, typ TAR 10, D) a zkouška disoluce. Výška tablet se vyjádřila jako průměr z 10 měření (posuvné digitální měřidlo Mahr 16EX, D).
Stanovení disolučního profilu modelové léčivé látky
Disoluční profil DNa se stanovil s použitím automatické disoluční aparatury Sotax AT 7 Smart (DonauLab, CH) míchadlovou metodou (ČL 2005). Disolučním médiem byl fosforečnanový tlumivý roztok o pH 6,8 (ČL 2005). Objem disoluční tekutiny byl 1000 ml, teplota 37 Ī 0,5 °C a rychlost otáčení míchadel byla 100/min. V daných časových intervalech (30 min, 60 min, 120 min a dále po 2 hod. v rámci 24hodinové disoluční zkoušky) se z disolučních nádob automaticky odebíraly vzorky, které se analyzovaly při vlnové délce 276 nm (UV spektrofotometr Lambda 25, Perkin Elmer, USA) v průtočných kyvetách a stanovilo se uvolněné množství léčiva v daném čase.
Hodnocení podobnosti disolučních profilů
K posouzení statistické významnosti vlivu koncentrace cetylalkoholu se vypočítal faktor podobnosti f2 mezi disolučními profily jednotlivých vzorků. Je-li hodnota tohoto faktoru menší než 50, disoluční profily jsou si nepodobné a závislost na sledovaném parametru je statisticky významná. Hodnoty faktoru podobnosti f2 se vypočítaly podle vztahu 12):
f2 = 50 log{ [1 + (1/N)Σ(Ri – Ti)2]-0,5 * 100}, [1]
kde N je počet časových bodů, Ri a Ti jsou hodnoty množství uvolněné léčivé látky srovnávacího (R) a testovaného (T) vzorku v daném čase.
Pro posouzení vlivu cetanolu na disoluční profil vzorku se vypočítal faktor podobnosti mezi vzorky I : II, I : III, II : III obsahujícími sacharosu ve funkci plniva a vzorky IV : V, IV : VI, V : VI obsahujícími ve funkci plniva laktosu. Významnost vlivu použitého plniva se hodnotila podle f2 počítaného mezi vzorky I : IV, II : V, III : VI.
Hodnocení průběhu disoluce léčiva
Pro hodnocení průběhu disoluce diklofenaku sodné soli z matricových tablet se z křivek získaných zkouškou disoluce počítalo množství léčiva uvolněné ze vzorků za 1 hodinu 13) a stanovil se střední disoluční čas t50% 14), který vyjadřuje dobu, za kterou se uvolní 50 % léčivé látky.
VÝSLEDKY A DISKUZE
Vzorky I, II a III obsahovaly jako indiferentní plnivo sacharosu, vzorky VI, V a VI potom laktosu monohydrát. Z výsledků obrazové analýzy plyne, že částice sacharosy velikostní frakce 80–125 μm mají střední velikost větší (99,17 μm) než částice laktosy monohydrátu 200 Mesh (34,60 μm). Distribuce velikosti částic je uvedena v tabulce 2.
Table 2. Distribuce velikosti částic použitých plniv 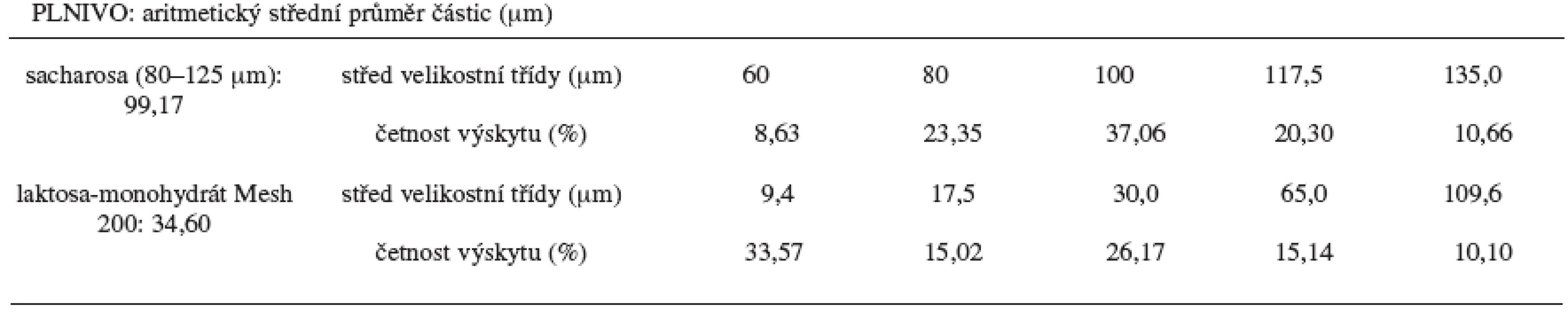
Výsledky hodnocení tokových vlastností granulátů uvádí tabulka 3. Tok připravených granulátů odpovídal slovnímu hodnocení dobrý, u vzorků III a VI (s nejnižším množstvím cetanolu) hodnocení dobrý/přiměřený. Z výsledku je patrná tendence zhoršení tokových vlastností s klesající koncentrací cetanolu v důsledku tvorby menších granulátových zrn. Toto zjištění koresponduje s výsledky Pereira de Souza et al. 15). Horší tokové vlastnosti se projevují růstem HR, CI a sypnosti. Větší částice sacharosy ve srovnání s částicemi laktosy byly pravděpodobně příčinou lepších tokových vlastností vzorků I, II a III ve srovnání se vzorky s obsahem laktosy jinak stejného složení.
Table 3. Hodnocení tokových vlastností granulátů 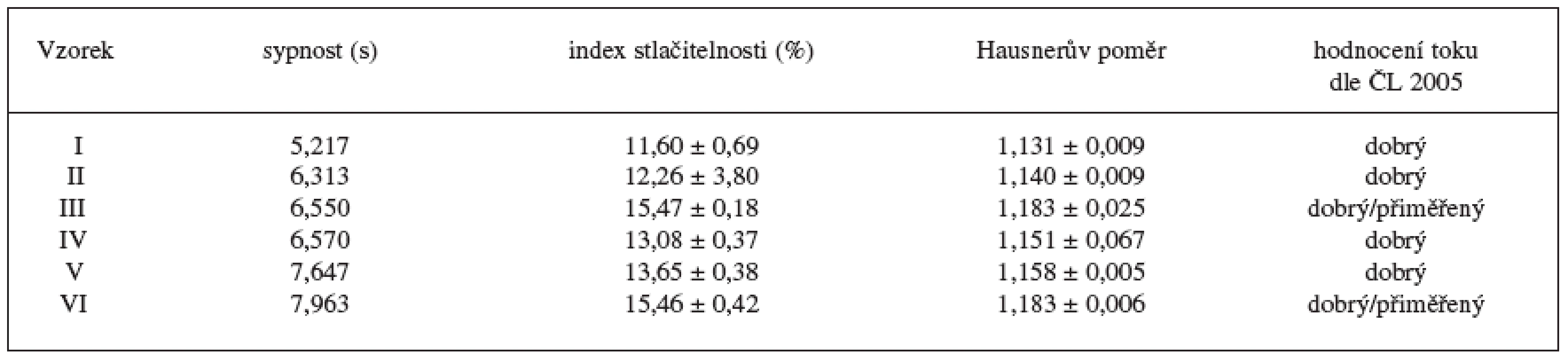
Vlastnosti připravených matricových tablet uvádí tabulka 4. Ze získaných výsledků je zřejmé, že rostoucí koncentrace cetanolu vedla ke zlepšení jejich mechanických vlastností. Při použití stejné lisovací síly se pevnost tablet pohybovala v intervalu 56,09–84,48 N. Nejnižších hodnot dosahovaly vzorky III (56,09 N) a VI (68,98 N) s nejnižším množstvím cetylalkoholu (14,5 % m/m). Nejvyšších hodnot dosahovaly vzorky I (79,80 N) a IV (84,48 N) s nejvyšším množstvím cetylalkoholu (25,2 % m/m). S těmito výsledky korelují výsledky oděru tablet vzorků, které se pohybovaly v intervalu 0,29–0,56 %. Vzorek III z důvodu příčného lomu tablet zkoušce na oděr nevyhověl. Zhoršení mechanických vlastností v řadě I–III a IV–VI bylo výrazně podpořeno také klesající hmotností a výškou tablet 16). Z výsledků byly dále patrné lepší mechanické vlastnosti vzorků s obsahem laktosy monohydrátu, pravděpodobně díky jejím menším částicím ve srovnání se sacharosou, které jsou předpokladem pro tvorbu pevnějších výlisků 17).
Table 4. Vlastnosti připravených matricových tablet 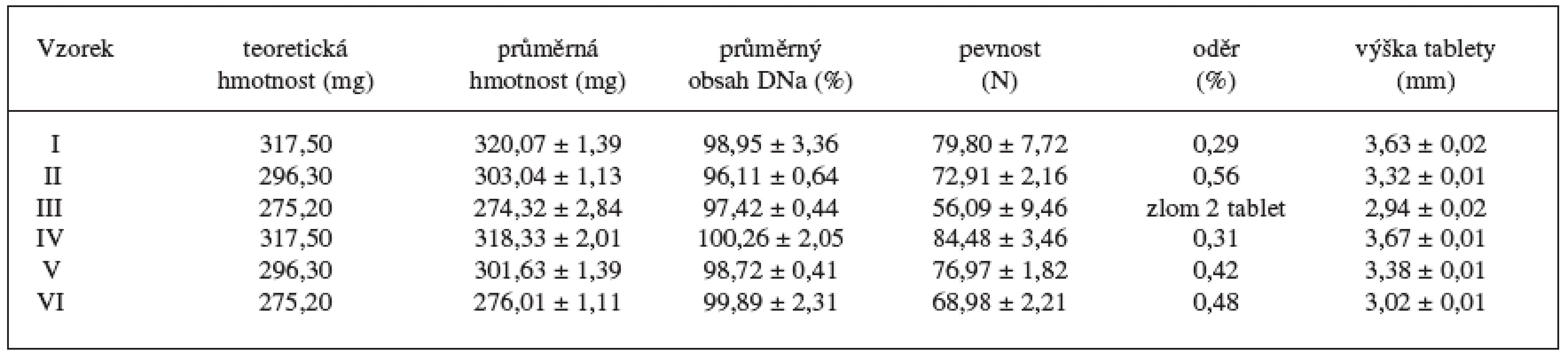
Disoluční profily vzorků v prostředí fosforečnanového tlumivého roztoku o pH 6,8 ukazuje obrázek 1, 2 a tabulka 5, ve které jsou uvedeny směrodatné odchylky průměrných hodnot. Koncentrace lipofilního nosiče cetylalkoholu ovlivňovala uvolňování modelového léčiva bez ohledu na použité plnivo. S klesající koncentrací cetylalkoholu se DNa při použití obou plniv uvolňoval z matricových tablet rychleji. V průběhu 24hodinové disoluční zkoušky vzorky uvolnily 56,45–85,57 % léčivé látky. Pro posouzení statistické významnosti tohoto vlivu se počítaly faktory podobnosti f2 mezi jednotlivými vzorky (tab. 6). Stanovení faktoru podobnosti f2 mezi disolučními profily vzorků s plnivem sacharosou prokázalo statistickou významnost vlivu koncentrace cetylalkoholu na uvolňování modelové léčivé látky při použití tohoto plniva. Faktor podobnosti f2u vzorků I–III s obsahem sacharosy dosahoval hodnot v intervalu 42,55–55,44. I přes hraniční hodnotu 55,44 mezi vzorkem II a III lze považovat disoluční profily vzorků za vzájemně nepodobné a vliv koncentrace lipofilního nosiče za statisticky významný. K jinému závěru se dospělo v případě vzorků IV–VI s obsahem laktosy. Hodnota faktoru podobnosti f2 = 46,26 mezi vzorkem IV a V ukazuje na nepodobné disoluční profily, avšak hodnoty faktoru podobnosti f2 = 82,11 mezi vzorky V a VI jednoznačně hovoří o podobnosti sledovaných disolučních profilů. Z těchto výsledků je patrné, že při změně koncentrace cetylalkoholu ze 25,2 % (vzorek IV) na 20,2 % (vzorek V) měl cetylalkohol vliv statisticky významný, další pokles koncentrace lipofilního nosiče z 20,2 % (vzorek IV) na 14,5 % (vzorek VI) již statisticky významný vliv neměl. Jak u vzorku s obsahem sacharosy, tak laktosy je patné, že vliv změny koncentrace cetylalkoholu na disoluční profil DNa se výrazněji projevuje při vyšším zastoupení lipofilního nosiče v matrici (obr. 1, 2).
Image 1. Disoluční profily sacharosových vzorků v prostředí fosforečnanového tlumivého roztoku o pH 6,8 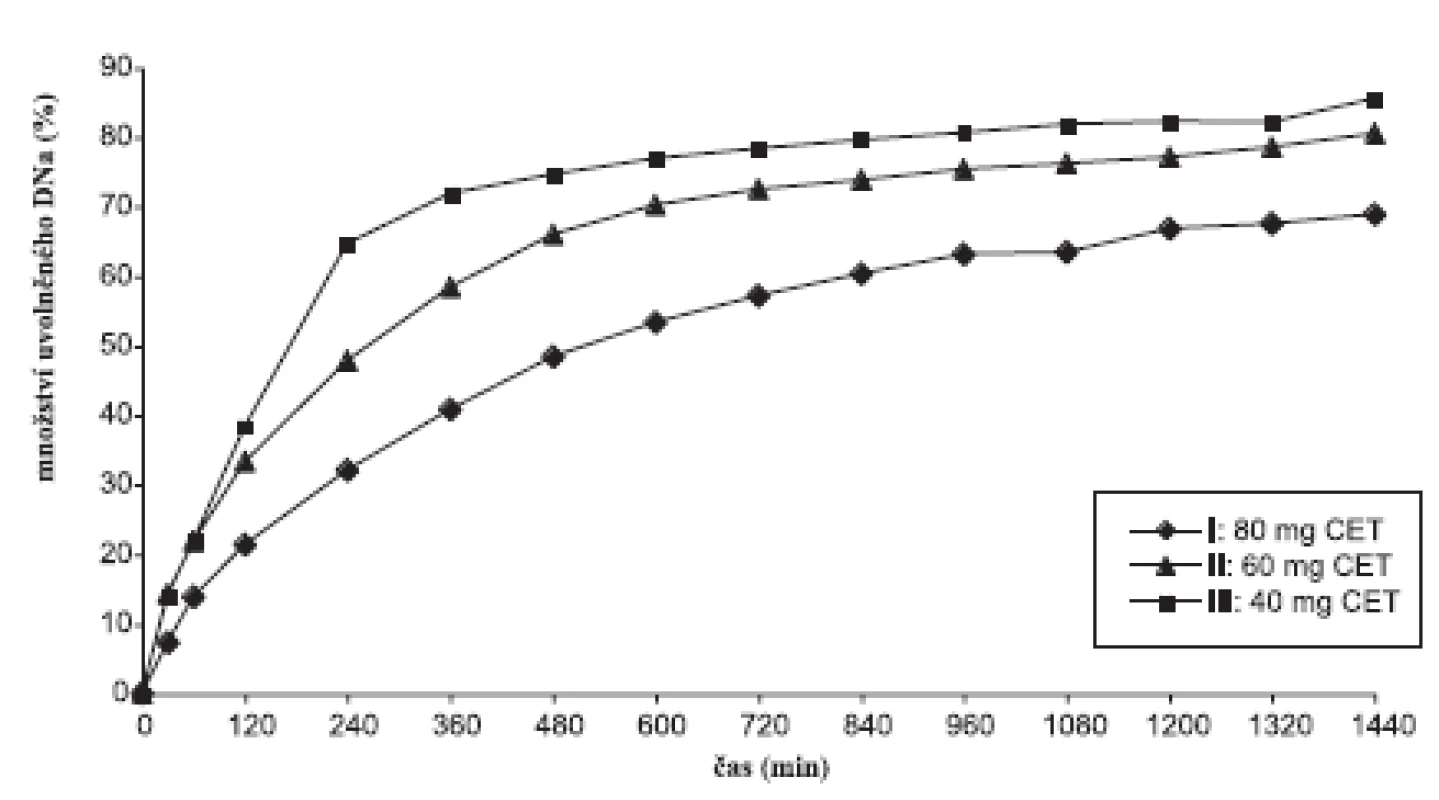
Image 2. Disoluční profily laktosových vzorků v prostředí fosforečnanového tlumivého roztoku o pH 6,8 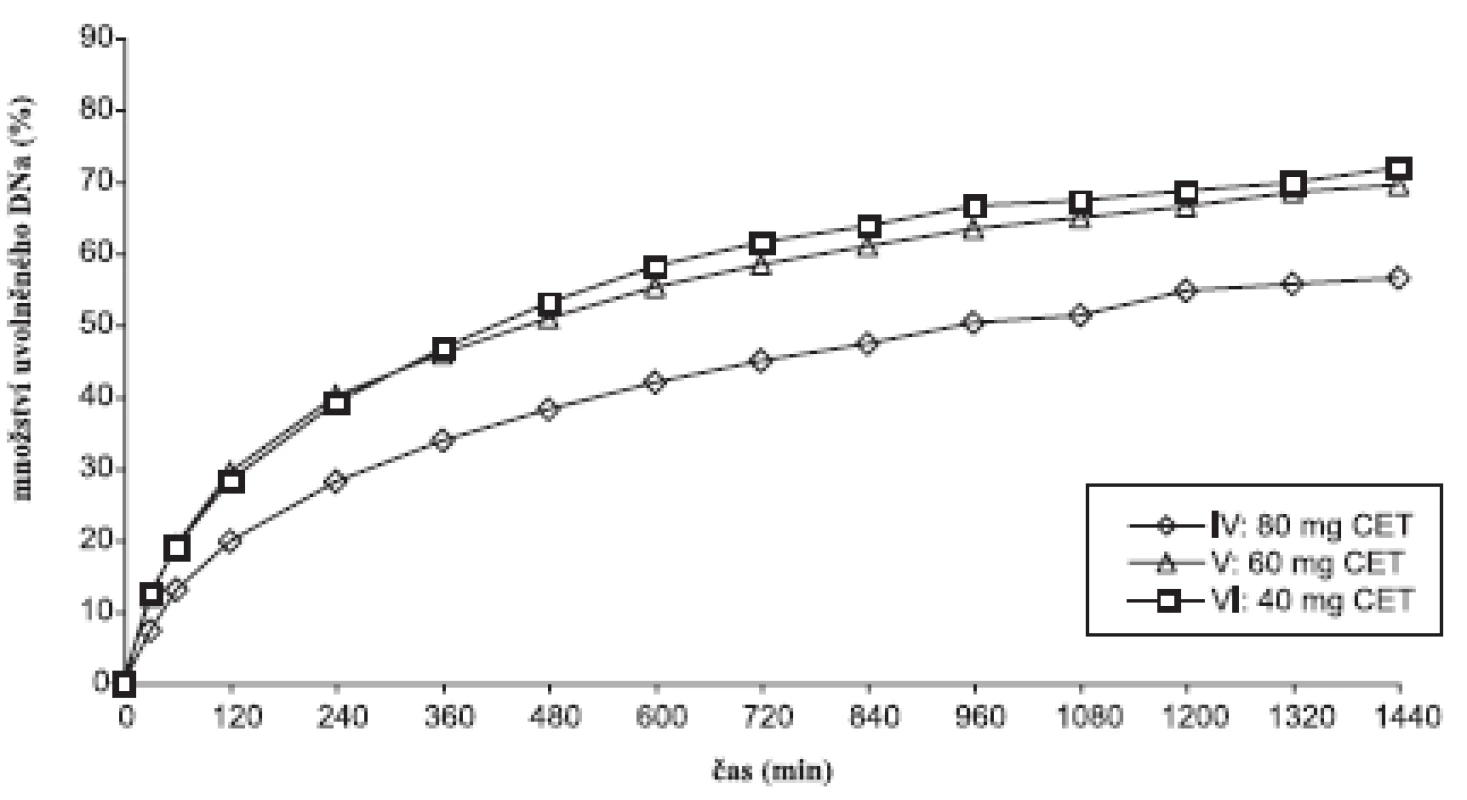
Table 5. Disoluční profily vzorků v prostředí fosforečnanového tlumivého roztoku o pH 6,8 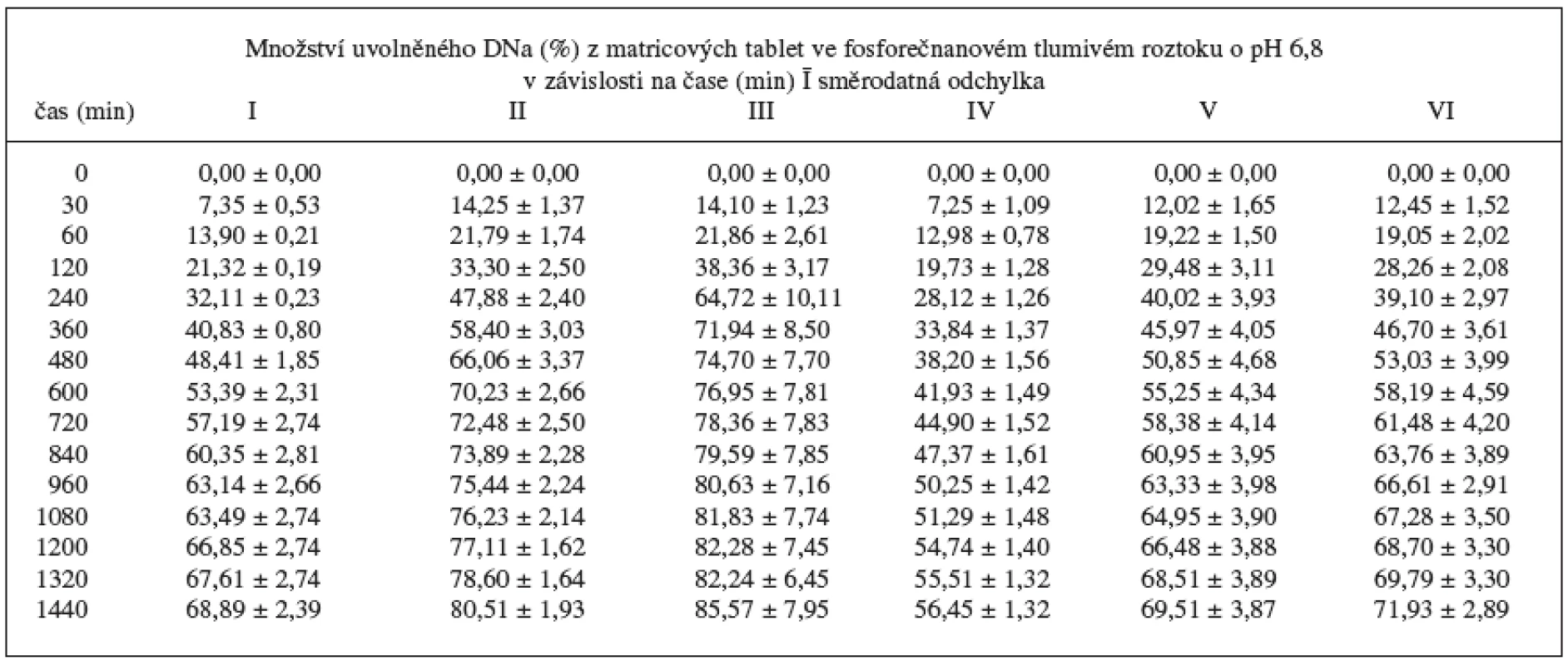
Table 6. Faktory podobnosti f2 mezi disolučními profily vzorků 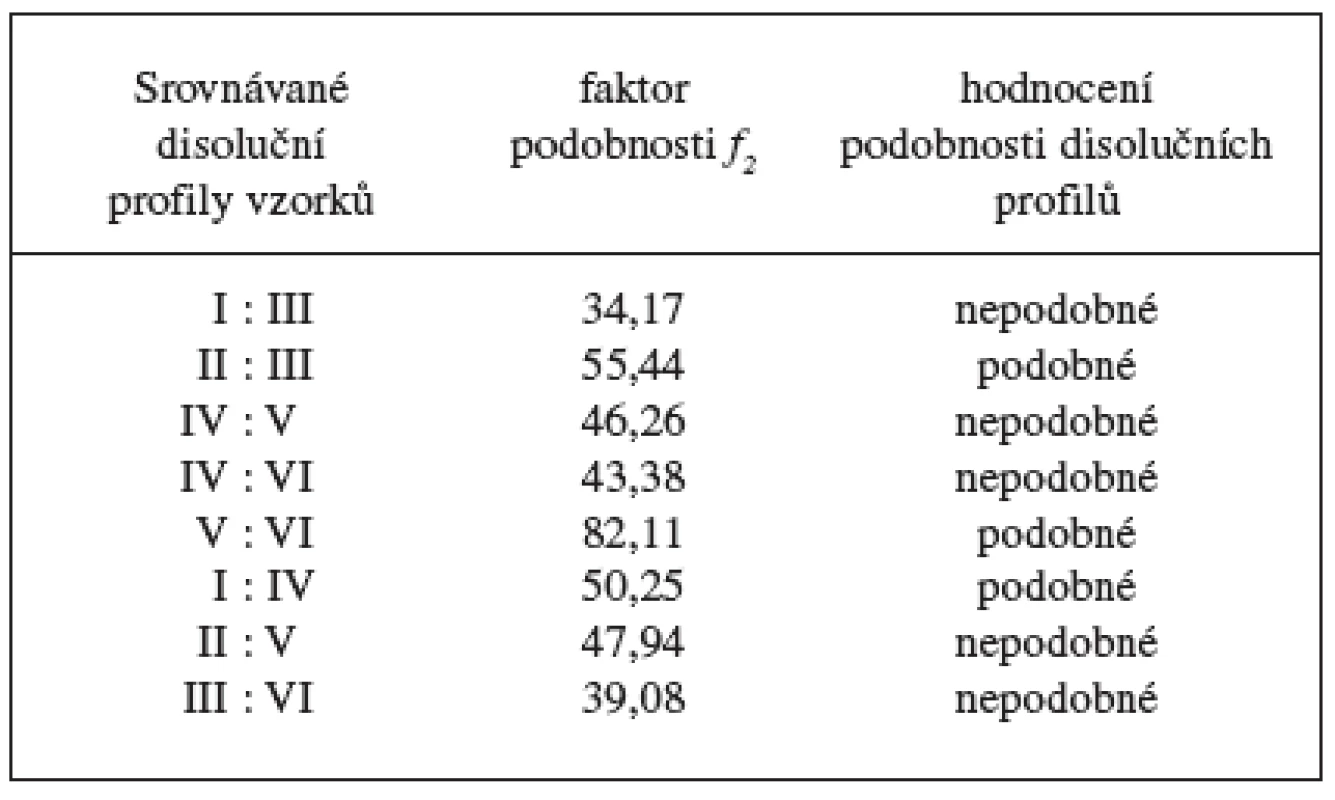
Z dosažených výsledků disoluční zkoušky a vypočítaných faktorů podobnosti je dále zjevné, že použitá plniva ovlivňují průběh disoluce DNa z matricových tablet statisticky významně. Faktory podobnosti f2 mezi jednotlivými disolučmími profily nabývaly hodnot f2= 50,25 u vzorků I a IV s největším obsahem lipofilního nosiče a f2 = 39,08 u vzorků III a VI s nejmenším obsahem lipofilního nosiče. Typ použitého plniva výrazně ovlivňuje disoluční profil DNa při nižší koncentraci cetylalkoholu. Rychlejší uvolňování DNa ze vzorků s obsahem sacharosy jako plniva lze připsat její lepší rozpustnosti a rychlejší disoluci ve srovnání s laktosou 2).
Průběh disoluce se hodnotil na základě dvou parametrů. Rychlejší uvolňování DNa z matricových tablet v počátku disoluce – burst efekt se kvantifikovalo jako množství léčiva uvolněné za 1 hodinu. Dalším sledovaným parametrem, který popisuje průběh řízeného uvolňování, je t50%, který vyjadřuje dobu, za kterou se uvolnilo 50 % inkorporovaného léčiva z lékové formy. Výsledky uvádí tabulka 7. Velikost burst efektu byla ovlivněna množstvím lipofilního nosiče přítomného v matrici. Nejmenších hodnot dosahovala u vzorků s největším množstvím cetylalkoholu (vzorek I – 13,90 %; vzorek IV – 12,98 %). Rozdíl burst efektu mezi vzorky se středním a nejnižších množstvím ctylalkoholu byl nepatrný (vzorek II – 21,79, vzorek III – 21,86; vzorek V – 19,22, vzorek VI – 19,05). Jako nevýrazný se jevil i rozdíl mezi vzorky lišícími se typem použitého plniva. Koncentrací lipofilního cetylalkoholu však byla ovlivněna velikost parametru t50% , výraznější byla závislost u sacharosových vzorků I–III (tab. 7). Hodnoty t50% potvrzují taktéž výrazný rozdíl disolučních profilů při použití odlišných plniv – sacharosy nebo laktosy.
Table 7. Sledování vybraných parametrů disolučních profilů vzorků 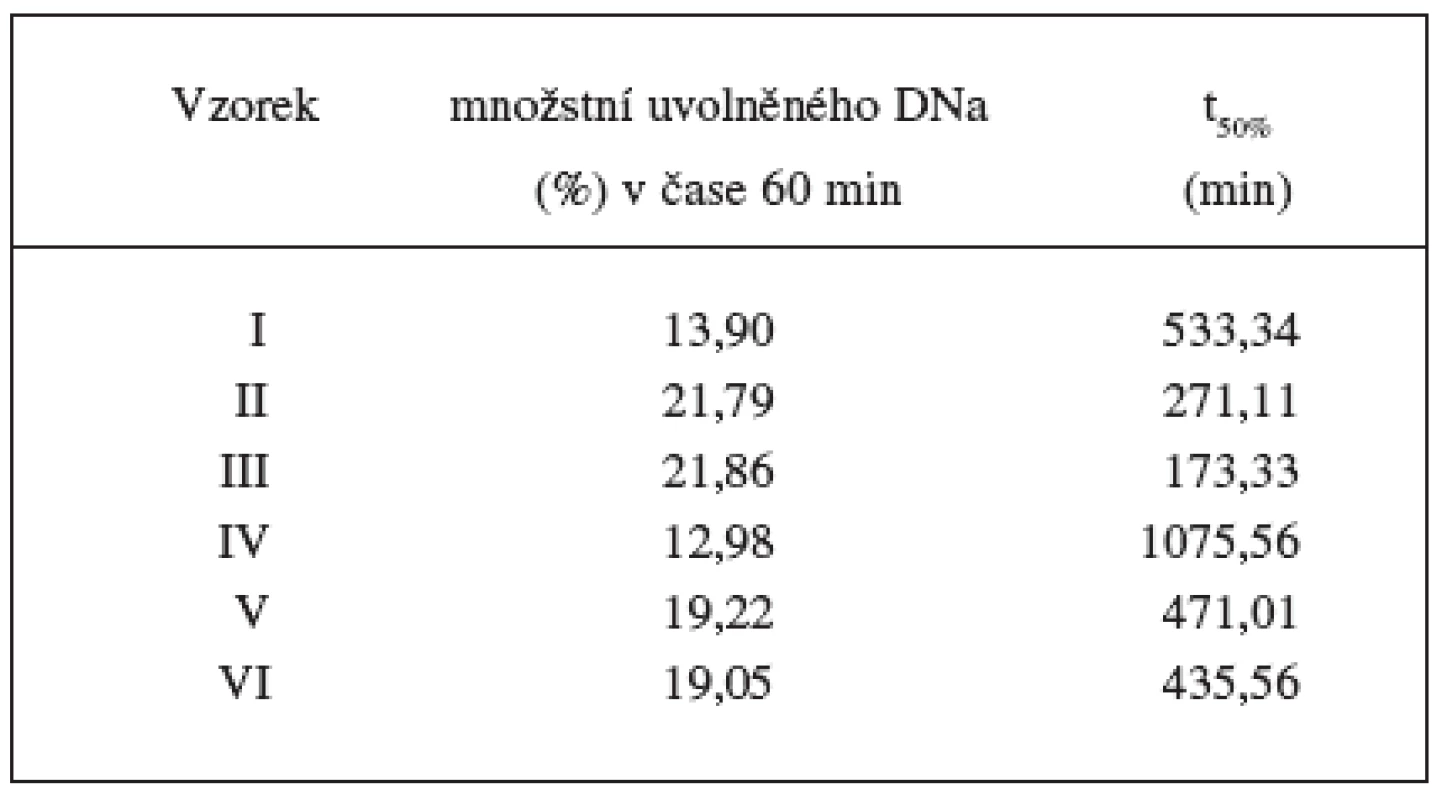
Ze sledování hodnot směrodatných odchylek (SD) disolucí jednotlivých vzorků vyplynulo, že i tento parametr je ovlivněn koncentrací lipofilního nosiče. Z hodnot SD uvedených v tabulce 5 vyplývá, že nejnižší hodnoty SD, a tedy nejjednotnější disoluční profil vykazovaly vzorky I a IV s nejvyšší koncentrací cetylalkoholu. Nejméně jednotný profil vykazoval vzorek III, tj. vzorek sacharosový s nejnižší koncentrací cetylalkoholu. Nejvyšší hodnoty SD lze přisoudit nejnižší koncentraci tajícího pojiva a širší distribuci velikosti částic sacharosy s odlišnou rychlostí rozpouštění.
ZÁVĚR
Připravily se hydrofilně-lipofilní matricové tablety pro 24hodinový přívod diklofenaku sodné soli. Koncentrace cetylalkoholu měla signifikantní vliv na disoluční profil vzorků, a lze ji tedy využít jako modifikátor řízeného uvolňování pro daný typ matrice. Jako nejvhodnější se ukázaly vzorky s nejvyšším množstvím lipofilního nosiče, nejmenším burst efektem a nejjednotnějším disolučním profilem. Vzhledem ke střednímu disolučnímu času a celkovému uvolněnému množství se z těchto dvou vzorků zdá vhodnější sacharosový vzorek.
Došlo 6. října 2008
Přijato 29. října 2008
Adresa pro korespondenci:
PharmDr. Kateřina Dvořáčková
Ústav technologie léků FaF VFU
Palackého 1/3, 612 42 Brno
e-mail: dvorackovak@vfu.cz
Sources
1. Rabišková, M.: Remedia, 2007; 17, 188-192.
2. Raymond, C., et al.: Handbook of Pharmaceutical Excipients. 5. ed. London: The Pharmaceutical Press, 2006, s. 651.
3. Rabišková, M., Komárek, P. et al.: Technologie léků. 3. přeprac. a dopl. vyd. Praha: Galén, 2006, s. 399.
4. Dvořáčková, K. et al.: Čes. slov. Farm., 2007; 56, 129–134.
5. Bozi, D. Z., Vreer, F., Kozjek, F.: Eur. J. Pharm. Sci., 1997; 5, 163–169.
6. Gil, E. C. et al.: Int. J. Pharm., 2006; 317, 32–39.
7. Gren, T., Nyströc, C.: Int. J. Pharm., 1999; 184, 7–19.
8. Maheshwari, M. et al.: Int. J. Pharm., 2003; 261, 57–67.
9. Paradkar, A. et al.: AAPS Pharm. Sci. Tech., 2003; 4(4) Art 65.
10. Devaraj, G. N. et al.: J Colloid Interface Sci., 2002; 251, 360–365.
11. Savickas A., Bernatonienė J.: Medicina (Kaunas), 2005; 41(3), 226.
12. Avachnnt, A., Kotwal, V.: AAPS PharmSciTech, 2007, 8, Art. 88 (http://www.aapspharmscitech.org).
13. Chopra, S., Patil, G. V., Motwani, S. K.: Eur. J. Pharm. Biopharm., 2007, 66, 73–82.
14. Singh, B., Chakkal, S. K., Ahuja, N.: AAPS Pharm. Sci. Tech., 2006; 7 (1) Art. 3 (http://www.aapspharmscitech. org).
15. Pereira de Souza, T. et al.: AAPS Pharm. Sci. Tech, 2007, 8(2), Art. 34 (www.aapspharmscitech.org).
16. Saravanan, M. et al.: Biol. Pharm. Bull., 2002; 25, 541–545.
17. Rabišková, M. et al.: Čes. slov. Farm., 2003; 52, 211–217.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2008 Issue 6-
All articles in this issue
- Spotřeba hypolipidemik v České republice v letech 2000–2007
- Testování efektu 2’, 3, 4’-trihydroxychalkonu u experimentálního diabetes mellitus – pilotní studie
- Stanovení metoprololu a jeho metabolitu α-hydroxymetoprololu v séru metodou HPLC s fluorescenční detekcí
- Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
- Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
- Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
- Možnosti ovplyvnenia liberácie alaptidu z dermálnych polotuhých liekov
- Vliv hlohového extraktu na funkci mitochondrií srdce
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Možnosti ovplyvnenia liberácie alaptidu z dermálnych polotuhých liekov
- Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
- Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
- Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

