-
Medical journals
- Career
Výsledky včasnej karotickej endarterektómie po tranzitornej ischemickej atake
Authors: M. Orlický 1,2; P. Vachata 1,2; M. Sameš 1
Authors‘ workplace: Neurochirurgická klinika Masarykovy nemocnice a Univerzity J. E. Purkyně, Ústí nad Labem 1; ICRC – Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2
Published in: Cesk Slov Neurol N 2015; 78/111(5): 550-554
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2015550Overview
Cieľ:
Veľká významnosť včasne prevedenej karotickej endarterektómie u indikovaných pacientov po tranzitornej ischemickej atake (TIA) z pohľadu sekundárnej prevencie iktu viedla k potrebe podrobnej analýzy našich dát, ich korelácie s všeobecne akceptovanými odporúčaniami AHA, prípadne hľadaní nápravy.Metodika:
Do prospektívnej štúdie bolo zaradených 975 karotických endarterektomií operovaných na Neurochirurgickej klinike Masarykovej nemocnice v Ústí nad Labem v období od roku 2006 do roku 2013. Všetky operácie boli v lokálnej anestézii so selektívnym požitím skratu v závislosti na vývoji neurologického stavu po nasadení klipov na karotídu. Vyšetrenie mozgu pomocou MR DW bolo uskutočnené v deň príjmu pacienta k operácii a 24 hod po výkone. Z dostupných dát bola spätne vyselektovaná skupina symptomatických stenóz (n = 422) a podrobne analyzovaná skupina s priebehom ako TIA (n = 187). Sledované parametre boli: 1. čas prevedenia operácie od vzniku klinických príznakov a 2. počet a typ komplikácií vzhľadom k časovaniu operácie.Výsledky:
1. V skupine všetkých TIA je od roku 2007 medián doby od vzniku príznakov k prevedeniu operácie v akceptovateľnom rozmedzí 3,5 – 14 dní, pre skupinu hemisferálnych TIA je medián ešte nižší 3–13 dní, pre skupinu TIA len s prejavom amaurosis fugax (AF) medián presahuje hodnotu odporúčanií (14 – 25,5 dní). 2. Počet veľkých komplikácií je 2,5 % a nie je častejší pri časných indikáciách.Záver:
Komplexné cerebrovaskulárne centrum spolu s iktovými jednotkami v ústeckom kraji managuje pacientov po hemisferálnej príhode TIA indikovaných CEA v súlade s odporúčaniami jak z pohľadu časovania, tak z pohľadu počtu komplikácií. Je potrebné zlepšiť informovanosť verejnosti o AF, a skrátiť tak dobu časovania CEA v týchto prípadoch.Kľúčové slová:
časovanie karotickej endarterektómie – symptomatická stenóza – tranzitorná ischemická atakaÚvod
Indikačné kritériá pre karotickú endarterektomiu sa vyvíjajú už od dôb prvej tejto operácie. Z pohľadu symptomatických stenóz, ktoré sú hlavnou témou nášho článku, sa indikácia operácie pri 50% stenóze a väčšej, ako výsledok štúdie NASCET, nemení už od jej publikácie v roku 1998 [1 – 3]. Dôsledkom štatisticky významného zníženia rizika recidívy ischemickej mozgovej príhody (iCMP) prevedením karotickej endarterektómie (CEA) v porovnaní s najlepšou konzervatívnou liečbou sa opodstatnilo prevádzanie endarterektomií v tejto indikácii v centrách s peroperačnou morbiditou do 6 % [4].
Odpoveď na otázku časovania endarterektomií u symptomatických stenóz už nie je tak jednoznačná. Éra šesť týždňov odkladaných operácií z dôvodu obavy z hemoragickej transformácie ischemického ložiska, ktorá sa opierala ešte o dáta z obdobia pred rozšírením CT [5 – 7], bola ukončená na prelome storočí. Nové randomizované štúdie NASCET, ECST [8] a ich metaanalýzy nepotvrdili zvýšené riziko časných CEA a ukázali na neopodstatnenosť odkladu výkonu [9 – 11]. Naviac odhalili, že riziko recidívy iCMP je najväčšie časne po prekonanej príhode a rýchlo sa znižuje s časom. Súčet rizika recidívy iCMP a odloženého plánovaného výkonu tak môže prevýšiť riziko časne prevedeného výkonu [12]. Túto problematiku ďalej rozvinula publikácia od Rothwella z roku 2005 [13], ktorá stanovila riziko recidívy iktu po prekonanej tranzitornej ischemickej atake (TIA) na 17 % v ten deň, resp. 46 % do 14 dní a potvrdila a spresnila tak jeden zo záverov publikácie Rothwell et al z roku 2004 [11], o prínose CEA do 14 dní po ikte [14].
Výsledky a odporúčania týchto štúdií, hoci sú podľa American Heart Association [4] vedené v triede IIa skupiny B, sú všeobecne prijímané a sú aj oporou v indikáciách karotických endarterektomií našej neurochirurgickej kliniky – súčasti Komplexného cerebrovaskulárneho centra (KCC) v Ústeckom kraji.
Vzhľadom k veľmi veľkej významnosti tejto problematiky z pohľadu sekundárnej prevencie mozgových príhod sme považovali za dôležité analyzovať naše postupy.
Cieľom našej štúdie bolo preto spätne:
- vyhodnotiť či indikácie k CEA pre symptomatické stenózy (TIA) v rámci KCC v Ústeckom kraji sledujú doporučovaný trend časovania – či operujeme indikovaných pacientov včas;
- zhodnotiť perioperačné komplikácie a ich vzťah k časovaniu operácie.
Na základe zistených výsledkov pracovať na úprave nedostatkov alebo pochváliť.
Súbor a metodika
Na Neurochirurgickej klinike Masarykovej nemocnice v Ústí nad Labem bolo v období rokov 2006 až 2013 prevedených 975 karotických endarterektomií. Indikácie boli v súlade s aktuálnymi odporúčaniami štúdií NACSET, ACST, ECST [15].
Z toho 422 endarterektomií bolo prevedených pre symptomatickú stenózu a zaradených do štúdie. Z tejto skupiny sme vybrali skupinu TIA vo všetkých klinických variantách. TIA sme definovali podľa AHA/ ASA [16]. Všetky výkony prebiehali v regionálnej anestézii (blok cervikálneho plexu) so selektívnym použitím karotického skratu na základe vývoja neurologického stavu hodnoteného v priebehu uzavretia karotídy svorkami (podľa postupnosti: arteria thyroidea superior, arterial carotis externa (ACE), communis (ACC) a interna (ACI)). Magnetickú rezonanciu mozgu (v sekvenciách T2, DW b0, b500, b1000, ADC) podstúpil každý pacient pri príjme do nemocnice, do 24 hod po výkone a prítomnosť akútnych ischemických ložisiek bola hodnotená na základe klasifikácie podľa Szaba et al [17].
Vývoj neurologického stavu hodnotil anestéziológ podľa predefinovanej schémy, v priebehu a po uzavretí karotídy svorkami. Hodnotil sa vývoj kvali ‑ i kvantitatívneho stavu vedomia, reč, motoriku kontralaterálnych končatín. Akékoľvek zhoršenie uvedených viedlo k okamžitému zavedeniu skratu [18].
V rámci aktuálnej štúdie sme sledovali parametre:
- čas prevedenia operácie od vzniku klinických príznakov (Symptoms‑to‑Surgery; StS).
- počet a typ komplikácií vzhľadom k časovaniu operácie: a) „major“ komplikácie (akýkoľvek iktus, akútny infarkt myokardu, hyperperfúzny syndrom), b) „minor“ komplikácie (parézy hlasivky, r. marginalis n. facialis na ipsilaterálnej strane a hematómy v rane (riešené konzervatívne i chirurgicky).
Výsledky sme hodnotili štatisticky využitím chí ‑ square analýzy. Dáta sme spätne analyzovali z prospektívne vedenej, nerandomizovanej štúdie.
Výsledky
Z 975 prevedených endarterektomií v rokoch 2006–2013 bolo do štúdie zaradených 422 (43 %) prípadov operovaných pre symptomatické stenózy.
Definícii TIA zodpovedalo 187 prípadov, čo predstavuje 44,3 % zo všetkých symptomatických prípadov (graf 1).
Graph 1. Zastúpenie TIA zo všetkých iCMP (n = 422). 
iCMP – ischemická mozgová príhoda, TIA – tranziotrná ischemická ataka. TIA, ktoré prebehli len ako monookulárne príhody charakteru amaurosis fugax (AF) predstavovali 24 % (n = 45). Ostatné, 76 % (n = 142), prebiehali s hemisferálnym klinickým prejavom prípadne i v kombinácii s AF (graf 2).
Graph 2. Podiel AF a ostatných prejavoch TIA zo všetkých TIA (n = 187). 
AF – amaurosis fugax, TIA – tranziotrná ischemická ataka. Čas prevedenia operácie od vzniku klinických príznakov
Priemerná doba StS bola v celom hodnotenom období 27,4 dní, s mediánom 12 dní. Podstatnejší je ale vývoj časovania v jednotlivých rokoch, ktorý začína na mediáne 35 dní (priemer 48) v roku 2006 a poklesáva od roku 2007 na medián 8,5 dní (priemer 16,8) v roku 2013, nie presne lineárne (graf 3).
Graph 3. Medián doby StS pre všetky typy iCMP (prerušovaná čiara) a všetky TIA (plná čiara) v jednotlivých rokoch. 
iCMP – ischemická mozgová príhoda, StS – symptoms-to-surgery, TIA – tranziotrná ischemická ataka. Oveľa zaujímavejší je výsledok, ktorý sme získali oddelením skupiny TIA len s príznakmi AF od skupiny všetkých ostatných klinických prejavov TIA.
Kým v prvej skupine (TIA s AF) pozorujeme len veľmi pomalý pokles doby StS, v druhej skupine ostatných TIA je tento pokles markantný, dosahujúci hodnoty mediánu okolo štyroch dní v posledných rokoch, so zlomovým rokom 2007 (graf 4).
Graph 4. Medián doby StS pre AF (prerušovaná čiara) a ostatné TIA (plná čiara) v jednotlivých rokoch. 
AF – amaurosis fugax, StS – symptoms-to-surgery, TIA – tranziotrná ischemická ataka. Ďalším zaujímavým zistením bolo, že od roku 2007, v skupine všetkých TIA, významne stúpol podiel (%) endarterektomií v prvom týždni od vzniku príznakov a adekvátne sa znižoval počet endarterektomií prevedených po 14. dni (graf 5).
Graph 5. Podiel operácií (v %) pred 7. dňom (plná čiara) a po 14. dni (prerušovaná čiara) od vzniku symptómov. 
Nakoniec je pre úplnosť potrebné uviesť, že časovanie endarterektomií u všetkých symptomatických stenóz karotíd sleduje podobný trend – medián sa v posledných rokoch pohybuje okolo 20 dní (graf 3).
Počet a typ komplikácií vzhľadom k časovaniu operácie
Celkový počet „major“ komplikácií bol v skupine všetkých prípadov TIA 2,5 % (n = 5; tab. 1.):
- S pooperačným (krátko po operácii) výskytom jednej príhody TIA v StS skupine do troch dní.
- Jednej príhody TIA a akútneho infarktu myokardu (obe krátko po operácii) v StS skupine do 4. – 7. deň.
- V StS skupine nad 14. deň prebehol jeden AIM a jeden pacient rozvinul hyperperfúzny syndróm krátkeho trvania.
Celkový počet „minor” komplikácií bol v skupine všetkých prípadov TIA 16 % (n = 32) bez významného rozdielu vo vzťahu k časovaniu (tab. 1).
Table 1. Podiel komplikácií vo (major/minor) vzťahu k časovaniu operácie – StS. 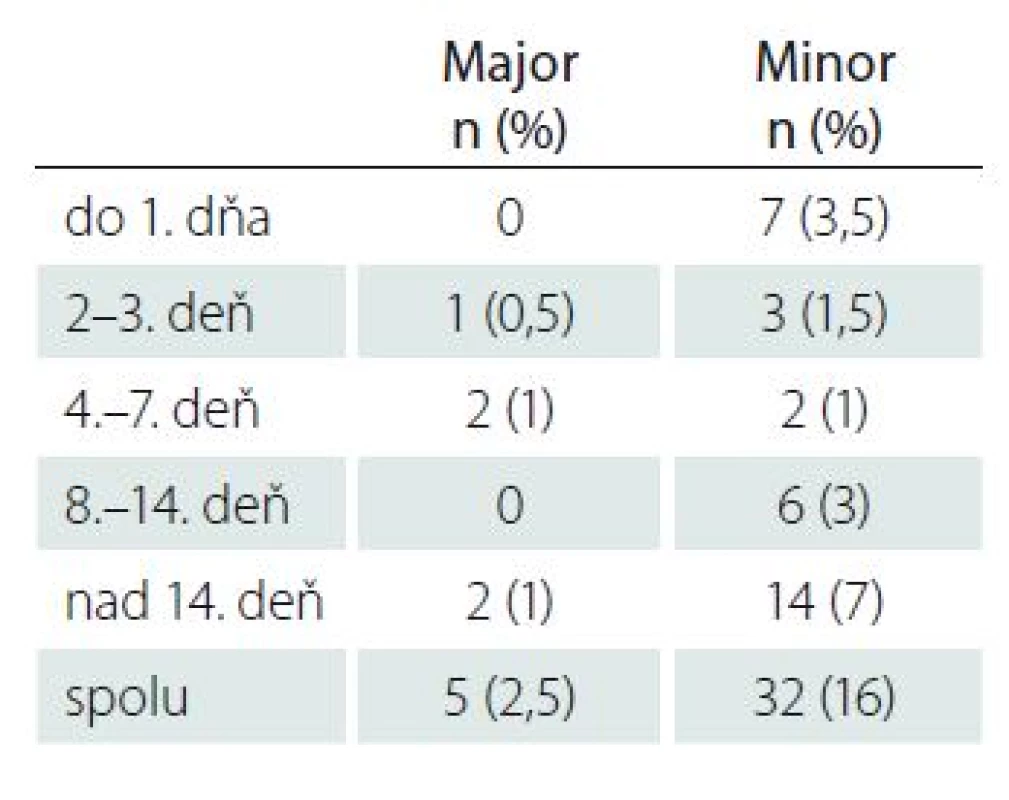
Diskusia
Časovanie karotických endarterektomií pre symptomatické stenózy je témou mnohých publikácií a metaanalýz. Je to nepochybne zložitá téma, kde proti sebe stoja argumenty pre čo najčasnejšiu operáciu so znížením rizika recidívy mozgovej príhody proti veľkej skupine rozličných faktorov, ktoré môžu príliš časnou operáciou zvýšiť morbiditu neúmerne riziku recidívy príhody. Za najvýznamnejšiu komplikáciu časného prevedenia operácie sa považuje hemoragická transformácia ischemického ložiska [19,20]. I z toho dôvodu sa tradične uvažovalo o šiestitýždennom odklade endarterektomií po prekonanej mozgovej príhode. Tieto štúdie sa opierali o dáta z éry pred CT, kedy nebolo možné predoperačne posúdiť prítomnosť mozgovej ischémie, resp. hemoragie [5 – 7]. Až randomizované štúdie NASCET, ECST ich metaanalýzy a ďalšie prospektívne štúdie zmenili pohľad na časovanie CEA. Bond et al v roku 2003 prezentoval analýzu CEA v rokoch 1980–2000, kde ukázal okrem iného, že riziko CEA prevedené do troch týždňov od iktu, u stabilného pacienta, nie je vyššie proti odloženej operácii [21]. Veľmi zásadná je publikácia od Rothwella et al z roku 2005, kde v skupine 2 416 pacientov s iCMP zistili, že až v 26 % prípadoch iktu predchádzala príhodu TIA [13]. Tiež že riziko iktu po prekonanej TIA bolo v ten deň až v 17 %, ďalší deň v 9 %, do týždňa v 43 % prípadoch. Na toto zistenie naviazala práca z roku 2006 [14], kde spresnili výsledky vlastnej metaanalýzy dát NASCET a ECST z roku 2004 [11] s odporúčaním prevedenia CEA čo najskôr po TIA, resp. do 14 dní.
Ak s vrátime k náplni našej štúdie, tak cieľom článku samozrejme nebolo overiť platnosť týchto uznávaných metaanalýz a ich odoporúčanií. Naša neurochirurgická klinika je súčasťou KCC Masarykovej nemocnice v Ústí nad Labem, pod ktoré spadajú iktové centra v Ústeckom kraji. Pri veľkom spáde, cez 1 mil. obyvateľov, a dobrej spolupráci s iktovými centrami v kraji zaujíma naša klinika v počte operovaných CEA popredné miesto v rámci Českej republiky. Zároveň pristupujeme k TIA ako k urgentnému stavu, ktorý včasnou diagnostikou a adekvátnou liečbou môže zamedziť vzniku dokončeného iktu [22,23] so všetkými medicínskymi a socioekonomickými dôsledkami. Považovali sme preto za dôležité vyhodnotiť naše dáta z pohľadu časovania, zhodnotiť ich vývoj, porovnať s vyššie citovanými štúdiami a napraviť prípadné nedostatky.
Čas prevedenia operácie od vzniku klinických príznakov
Pripomenieme, že v analýze sme sa venovali hlavne skupine CEA pre TIA, ako najrizikovejšej skupine iCMP z pohľadu jej recidívy [13].
Na grafe 3 pekne vidíme trend poklesu mediánu doby StS z hodnoty 35 v roku 2006 na hodnoty pod 14 od roku 2007, s hodnotami 3,5 resp. 8,5 v rokoch 2012 a 2013. Tento trend odpovedá uznávaným odporúčaniam, v roku 2012 dokonca pochvalne. Za povšimnutie v grafe stojí, že zlomový rok je 2007. Ak vychádzame z vyššie uvedeného, že zásadné publikácie ovplyvňujúce časovanie CEA u symptomatických stenóz vyšli v rokoch 2004 – 2006, tak môžeme s len ľahkou nadsázkou pozitívne ohodnotiť rýchlosť adaptácie nových odporúčanií v iktových centrách Ústeckého kraja.
Podrobnejšou analýzou všetkých TIA a jej rozdelením do skupín: 1. TIA s AF a 2. TIA s hemisferálnou symptomatikou nás prekvapili ešte nižšie hodnoty mediánu doby StS v skupine hemisferálnych príhod (2), ktoré z vysokej hodnoty (50) v roku 2006 poklesávajú k nízkym hodnotám od roku 2007 až k minimu 3, resp. 4,5 dňa v rokoch 2012 a 2013 (graf 4).
V skupine TIA ako AF tento trend nie je tak markantný a medián doby StS je výrazne vyšší (graf 4). Je možné sa len domnievať, že príčinou tohto rozdielu je nižšia informovanosť pacientov o význame prejavu AF a akútnosti vyhľadania lekárskej kontroly.
Celkový pozitívny trend vývoja doby StS, v koreláte s odporúčaniami len potvrdzuje graf 5, podľa ktorého postupne narastá počet CEA (v skupine všetkých TIA) v prvom týždni od vzniku príznakov a poklesáva počet CEA prevedených po 14. dni od ich vzniku.
Pre úplnosť je potrebné uviesť, že podobný pozitívny trend skracovania doby StS je možné sledovať i v skupine, do ktorej boli zahrnuté všetky iCMP (vrátane TIA) (graf 3).
Počet a typ komplikácií vzhľadom k časovaniu operácie
Celkový počet „major“ komplikácií do troch dní po výkone (akýkoľvek iktus, akútny infarkt myokardu, hyperperfúzny syndrom) bol v našej skupine malý (n = 5; 2,5 %), odpovedajúci požiadavkám odporúčania AHA pre symptomatické CEA [4] a nebol vyšší v časných indikáciách (tab. 1).
Tento výsledok ale pri nízkom počte komplikácií nemôžeme štatisticky overiť.
Do skupiny „minor“ komplikácií sme zaradili prechodné parézy hlasivky, r. marginalis n. facialis na ipsilaterálnej strane a hematómy v rane (riešené konzervatívne i chirurgicky). Ani v tejto skupine nebola jasná prevalencia v prvých dňoch, opäť bez možnosti štatistického vyhodnotenia.
Celkovo vyšší počet komplikácií (n = 32; 16 %) je daný hlavne podielom vyššieho zastúpenia hematómov v rane pri našej recentnej (od roku 2012) tolerancii k prevádzaniu operácií pri užívaní clopidogrelu v rámci sekundárnej prevencie. Tejto problematike sme sa venovali v samostatnej štúdii [24].
Záver
Naša analýza ukázala, že časovanie CEA po prekonanej hemisferálnej TIA dobre odpovedá svetovo uznávaným trendom a odporúčaniam. Je ale potrebné zlepšiť informovanosť verejnosti o AF a skrátiť tak dobu časovania CEA v týchto prípadoch.
Počet komplikácií sa nelíši v skorších a odložených operáciách.
Práca nebola podporená grantom.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Prijaté k recenzii: 6. 8. 2015
Prijaté do tlače: 17. 9. 2015
MUDr. Michal Orlický
Neurochirurgická klinika
Masarykova nemocnice
Sociální péče 12A
401 13 Ústí nad Labem
e-mail: orlicky@gmail.com
Sources
1. North American Symptomatic Carotid Endarterectomy Trial. Methods, patient characteristics, and progress.Stroke 1991; 22(6): 711 – 720.
2. North American Symptomatic Carotid Endarterectomy Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high‑grade carotid stenosis. N Engl J Med 1991; 325(7): 445 – 453.
3. Barnett HJ, Taylor DW, Eliasziw M, Fox AJ, Ferguson GG, Haynes RB et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med 1998; 339(20): 1415 – 1425.
4. Adams RJ, Albers G, Alberts MJ, Benavente O, Furie K,Goldstein LB et al. Update to the AHA/ ASA recommendations for the prevention of stroke in patients with stroke and transient ischemic attack. Stroke 2008; 39(5): 1647 – 1652. doi: 10.1161/ STROKEAHA.107.189063.
5. DeWeese JA, Rob CG, Satran R, Marsh DO, Joynt RJ, Summers D et al. Results of carotid endarterectomies for transient ischemic attacks – five years later. Ann Surg 1973; 178(3): 258 – 264.
6. Giordano JM, Trout HH, Kozloff L, DePalma RG. Timing of carotid artery endarterectomy after stroke. J Vasc Surg 1985; 2(2): 250 – 255.
7. Wylie EJ, Hein MF, Adams JE. Intracranial hemorrhage following surgical revascularization for treatment of acute strokes. J Neurosurg 1964; 21 : 212 – 215.
8. Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST). Lancet 1998; 351(9113): 1379 – 1387.
9. Gasecki AP, Ferguson GG, Eliasziw M, Clagett GP, Fox AJ,Hachinski V et al. Early endarterectomy for severe carotid artery stenosis after a nondisabling stroke: results from the North American Symptomatic Carotid Endarterectomy Trial. J Vasc Surg 1994; 20(2): 288 – 295.
10. Ballotta E, Da Giau G, Baracchini C, Abbruzzese E, Saladini M, Meneghetti G. Early versus delayed carotid endarterectomy after a nondisabling ischemic stroke: a prospective randomized study. Surgery 2002; 131(3): 287 – 293.
11. Rothwell PM, Eliasziw M, Gutnikov SA, Warlow CP, Barnett HJ. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004; 363(9413): 915 – 924.
12. Gasecki AP, Eliasziw M. Timing of carotid endarterectomy after stroke. Stroke 1998; 29(12): 2667 – 2668.
13. Rothwell PM, Warlow CP. Timing of TIAs preceding stroke: time window for prevention is very short. Neurology 2005; 64(5): 817 – 820.
14. Rothwell PM, Buchan A, Johnston SC. Recent advances in management of transient ischaemic attacks and minor ischaemic strokes. Lancet Neurol 2006; 5(4): 323 – 331.
15. Rothwell PM, Goldstein LB. Carotid endarterectomy for asymptomatic carotid stenosis asymptomatic carotid surgery trial. Stroke 2004; 35(10): 2425 – 2427.
16. Easton JD, Saver JL, Albers GW, Alberts MJ, Chaturvedi S, Feldmann E et al. Definition and evaluation of transient ischemic attack: a scientific statement for healthcare professionals from the American Heart Association/ American Stroke Association Stroke Council; Council on Cardiovascular Surgery and Anesthesia; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing; and the Interdisciplinary Council on Peripheral Vascular Disease. The American Academy of Neurology affirms the value of this statement as an educational tool for neurologists. Stroke 2009; 40(6): 2276 – 2293. doi: 10.1161/ STROKEAHA.108.192218.
17. Szabo K, Kern R, Gass A, Hirsch J, Hennerici M. Acute stroke patterns in patients with internal carotid artery disease: a diffusion ‑ weighted magnetic resonance imaging study. Stroke 2001; 32(6): 1323 – 1329.
18. Orlický M, Vachata P, Bartoš R, Sameš M. Skrat u karotických endarterektomií zvyšuje riziko ischemického iktu. Cesk Slov Neurol N 2015; 78/ 111(2): 163 – 166. doi: 10.14735/ amcsnn2015163.
19. Little JR, Moufarrij NA, Furlan AJ. Early carotid endarterectomy after cerebral infarction. Neurosurgery 1989; 24(3): 334 – 338.
20. Bruetman ME, Fields WS, Crawford ES, Debakey ME. Cerebral hemorrhage in carotid artery surgery. Arch Neurol 1963; 9 : 458 – 467.
21. Bond R, Rerkasem K, Rothwell PM. Systematic review of the risks of carotid endarterectomy in relation to the clinical indication for and timing of surgery. Stroke 2003; 34(9): 2290 – 2301.
22. Mraček J, Holečková I, Mork J. Timing karotické endarterektomie. Cesk Slov Neurol N 2008; 71/ 104(4): 414 – 421.
23. Benavente O, Eliasziw M, Streifler JY, Fox AJ, Barnett HJ,Meldrum H et al. Prognosis after transient monocular blindness associated with carotid ‑ artery stenosis. N Engl J Med 2001; 345(15): 1084 – 1090.
24. Vachata P, Orlický M, Sameš M. Clopidogrel a karotická endarterektomie. Praha: Kuncův memoriál 2013.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 5-
All articles in this issue
- Výsledky včasnej karotickej endarterektómie po tranzitornej ischemickej atake
- Metodologie tvorby systematických review I: Efekt hyperbarické oxygenoterapie na úmrtnost pacientů po kraniotraumatu
- Psychogenní poruchy vidění u dětí
- Osteomyelitida baze lební mylně léčená jako neuroborrelióza – kazuistika
- Recidivující tranzitorní globální amnézie – čtyři kazuistiky
- Hemihypoglossofaciální anastomóza – tři kazuistiky
- Akutní hyperkinetické syndromy léčené stereotaktickým neurochirurgickým zákrokem – tři kazuistiky
- Diagnostika pacienta s akutní závratí
- Implementační věda
- Přínos vyšetření čichu pro diagnostiku neurodegenerativních onemocnění
- Diferenciální diagnostika tauopatií – klinický pohled
- Kognitívno‑ komunikačné poruchy u pacientov s demenciou pri Alzheimerovej chorobe
- Normativní studie testu Reyovy‑ Osterriethovy komplexní figury v populaci českých seniorů
- Mozkový kámen – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika pacienta s akutní závratí
- Recidivující tranzitorní globální amnézie – čtyři kazuistiky
- Normativní studie testu Reyovy‑ Osterriethovy komplexní figury v populaci českých seniorů
- Přínos vyšetření čichu pro diagnostiku neurodegenerativních onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

