-
Medical journals
- Career
Přínos vyšetření čichu pro diagnostiku neurodegenerativních onemocnění
: Lenka Martinec Nováková 1–3; H. Štěpánková 3; J. Vodička 4; J. Havlíček 2,3
: Katedra obecné antropologie, FHS UK v Praze 1; Katedra zoologie, PřF UK v Praze 2; Národní ústav duševního zdraví, Klecany 3; Klinika otorinolaryngologie a chirurgie hlavy a krku FZS Univerzity Pardubice a Pardubická krajská nemocnice, a. s. 4
: Cesk Slov Neurol N 2015; 78/111(5): 517-525
: Review Article
U řady neurodegenerativních chorob dochází ke změnám v čichovém vnímání, které lze vyšetřit psychofyzickými testy. Největší význam má vyšetření čichu u Alzheimerovy a Parkinsonovy choroby, u nichž se poruchy čichu objevují před ostatními klinickými příznaky. Pouhý anamnestický údaj o poruše čichu je u pacientů zcela nedostatečný. Pacienti si poruchu čichu často neuvědomují. Vyšetření čichu tak může včasně upozornit na přítomnost neurologické choroby či usnadnit diferenciální diagnostiku. Přehledový článek představuje povahu poruch čichu u vybraných neurodegenerativních onemocnění s důrazem na Alzheimerovu a Parkinsonovu chorobu, způsoby hodnocení kvanti ‑ a kvalitativních poruch čichu se zaměřením na nejdostupnější psychofyzické testy, jimiž lze provádět rutinní vyšetření čichu v každodenní klinické praxi, a uplatnění vyšetření čichu v jejich diagnostice. U Alzheimerovy choroby je výrazněji postižena identifikace oproti detekčním prahům, zatímco u Parkinsonovy choroby je pokles napříč čichovými schopnostmi homogennější a prahy jsou zvýšeny více než u Alzheimerovy choroby.
Klíčová slova:
čich – neurodegenerativní choroby – hyposmie – anosmie – Alzheimerova choroba – Parkinsonova choroba – mírná kognitivní porucha
Od prvních studií provedených před více než 40 lety [1,2] bylo nashromážděno množství dokladů o změnách v čichovém vnímání u řady neurodegenerativních chorob, mezi nimiž lze uvést v první řadě Alzheimerovu (ACH) a Parkinsonovu chorobu (PCH) [3,4], dále amyotrofickou laterální sklerózu, Guamský parkinsonský komplex (GPK), Huntingtonovu chorobu, roztroušenou sklerózu mozkomíšní, mnohotnou systémovou atrofii (MSA), parkinsonizmus vyvolaný u uživatelů heroinu intoxikací 1 - metyl ‑ 4 - fenyl ‑ 1,2,3,6 - tetrahydropyridinem (MPTP ‑ P) či progresivní supranukleární paralýzu (PSP), pro přehled viz [5]. Vzhledem k tomu, že poruchy čichu se objevují u široké škály onemocnění, kromě neurodegenerativních chorob také např. u epilepsie, multiinfarktové demence či schizofrenie, a v neposlední řadě též v průběhu normálního (nepatologického) stárnutí, pro přehled viz [6,7], vyvstává otázka, zda změny v čichovém vnímání neodráží nespecifické všeobecné poškození drah centrálního nervového systému. To se však nejeví jako pravděpodobné z několika důvodů. Zaprvé se u některých chorob, např. u ACH a PCH, poruchy čichu objevují již dlouho před tím, než je zjištěno signifikantní poškození mozku a než se projeví klinické příznaky. Zadruhé se míra a specificita čichových dysfunkcí v průměru u většiny těchto chorob liší. Zatřetí se u některých neurodegenerativních onemocnění míra poruchy čichu vztahuje ke stadiu či progresi onemocnění, zatímco u jiných nikoli. Z tohoto pohledu tedy testování čichu může včasně upozornit na přítomnost neurologické choroby, usnadnit diferenciální diagnostiku (např. různých forem demence) či pomoci odhadnout přechod od mírné kognitivní poruchy (MKP) k ACH [8], pro přehled viz [9]. Největší využití má vyšetření čichu u ACH a PCH [10], u nichž je porucha čichu jedním z jejich prvních projevů, a to v době, kdy ještě nedochází k závažnému poklesu kognitivních funkcí. V běžné neurologické praxi se však čich systematicky nevyšetřuje, obyčejně se hodnotí jen anamnesticky nebo orientačně pomocí známých stimulů. Tento přístup vykazuje jen velmi nízkou citlivost, neboť subjektivní hodnocení vlastního čichu se rozchází s výsledky psychofyzických testů [11]. Cílem tohoto přehledového článku je představit povahu poruch čichu u vybraných neurodegenerativních onemocnění, způsoby hodnocení kvanti - a kvalitativních poruch čichu a uplatnění vyšetření čichu v diagnostice těchto onemocnění.
Klasifikace poruch čichu a jejich obecná prevalence
Dle symptomatologie je možné poruchy čichu klasifikovat na kvanti ‑ a kvalitativní [12]. Při kvantitativním hodnocení intaktní čichové funkce nazýváme normosmií, mezi poruchy pak řadíme sníženou míru čichového vnímání (hyposmii) či jeho ztrátu (anosmii), ale vzácně také hyperosmii, zvýšenou citlivost k určitým pachům za přítomnosti snížených prahů, která však některými autory není za patologii považována. Hyperosmie bývá někdy směšována s hyperreaktivitou, zvýšenou emoční odpovědí při normálním detekčním prahu [13], pro přehled viz [14]. U funkční anosmie sice nedochází k úplné ztrátě čichových funkcí, nýbrž k jejich signifikantnímu poklesu, který je spojen s jejich velmi nízkou využitelností v každodenním životě. Subjektivní hodnocení čichových a chuťových funkcí jsou obecně vysoce nespolehlivá [15,16], přičemž zdraví jedinci ani pacienti si nebývají vědomi zhoršení či ztráty čichu [11,17 – 19]. Prevalence výpovědí o zhoršení či ztrátě čichu se tak pohybuje mezi 1,4 a 15 % [19 – 21]. Z tohoto hlediska je u těchto poruch klíčové kvantitativní hodnocení pomocí psychofyzických testů, které budou představeny dále.
Mezi kvalitativní poruchy čichu, tzv. dysosmie, řadíme parosmii (zkreslené vnímání typické kvality pachu pocházejícího z daného zdroje), fantosmii (čichové halucinace; vjem za nepřítomnosti zdroje pachu), heterosmii (neschopnost rozlišovat mezi určitými pachy) a čichovou agnózii (neschopnost klasifikovat nebo identifikovat určitý pach) [22,23]. U parosmie jde obvykle o zkreslení směrem k vnímání pachu jako nepříjemného, tedy kakosmii [24]; euosmie je vzácná forma parosmie se zkreslením směrem k vnímání určitých pachů jako příjemných [25]. Prevalenci uvedených kvanti ‑ a kvalitativních poruch čichu v běžné populaci uvádí tab. 1. Souhrnně lze říci, že prevalence je vyšší u poruch kvantitativních [19,26 – 28] než kvalitativních [28,29], s výjimkou hyperosmie [30 – 33].
1. Prevalence kvanti- a kvalitativních poruch čichu v obecné populaci. 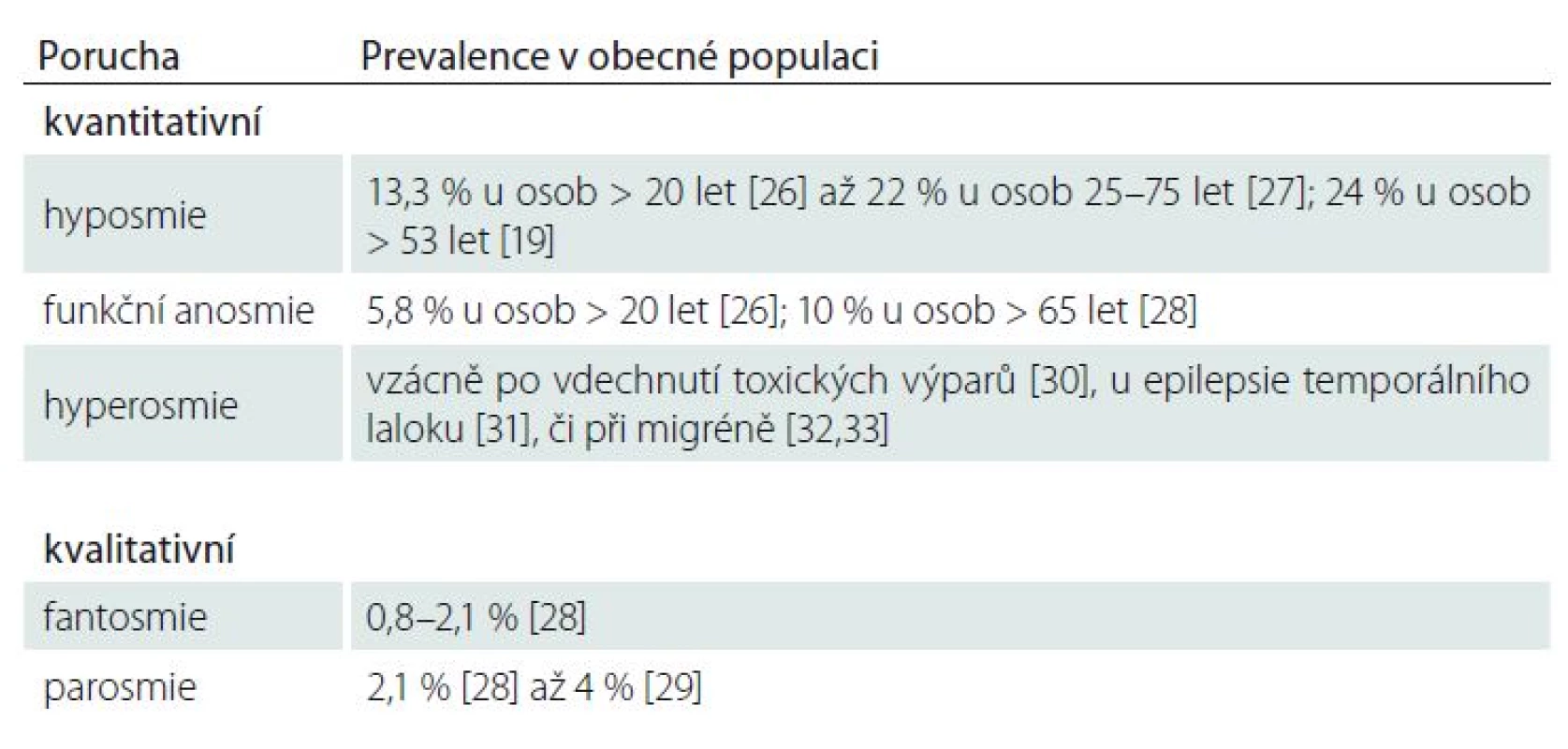
Na základě klinického obrazu a etiologie onemocnění můžeme poruchy čichu rozdělit na sinonazální (charakterizované patologií v dutině nosní, vedlejších nosních dutinách a případně nosohltanu), poúrazové (vznikající v souvislosti s úrazem hlavy), dále pak poruchy po virovém onemocnění horních cest dýchacích, poruchy vznikající v důsledku chronického působení toxických látek (např. formaldehydu či chloru), vrozené neboli kongenitální poruchy (vznikající buď dědičně nebo během těhotenství), poruchy u onemocnění neurologických (jimž bude v dalším textu věnována pozornost) a psychiatrických, poruchy u metabolických a endokrinních onemocnění, poruchy vznikající v důsledku nežádoucích účinků léků (např. zinek glukonátu, užívaného k léčbě chřipky) či chirurgického výkonu a konečně idiopatické postižení čichu (bez známé příčiny) [34].
Metody vyšetření poruch čichu
Metody vyšetření čichu lze rozdělit na subjektivní a objektivní; pro přehled viz [35,36]. Subjektivní metody kvanti ‑ i kvalitativní zahrnují nejrůznější komerčně dostupné psychofyzické testy čichových schopností, které obecně definujeme jako schopnosti umožňující zachycení pachů a jejich zpracování (str. 132) [37] a jsou založeny na vědomé (verbální či neverbální) odpovědi vyšetřované osoby v reakci na stimul. Mezi objektivní metody vyšetření čichu řadíme metody elektrofyziologické, k nimž patří např. elektroolfaktogram a čichové evokované potenciály vázané na událost (Olfactory Event ‑ Related Potentials; OERP), respirační olfaktometrie či Sniff Magnitude Test (SMT) a funkční zobrazovací metody, které zahrnují pozitronovou emisní tomografii, funkční magnetickou rezonanci a jednofotonovou emisní výpočetní tomografii. Zásadní nevýhoda většiny objektivních metod, jejichž bližší popis je nad rámec tohoto textu [38], je jejich vysoká náročnost na přístrojové vybavení a jeho obsluhu, a tedy náročnost finanční. Pozornost bude dále věnována psychofyzickým testům čichových schopností. Některé z nich jsou relativně méně časově náročné, finančně dostupné a lze je po kratším zácviku rutinně provádět v každodenní praxi.
Mezi čichové schopnosti řadíme zejména schopnost identifikace pachů (schopnost vybrat pojmenování či vlastními slovy pojmenovat zdroj pachu), diskriminace pachů (schopnost odlišit od sebe pachy látek v nadprahových koncentracích) a detekčních prahů (čichové citlivosti; nejnižší koncentrace látky, jejíž pach je jedinec schopen spolehlivě odlišit od stimulu bez pachu). V České republice patří mezi nejužívanější psychofyzické testy čichu tzv. čichová pera Sniffin‘ Sticks [39], University of Pennsylvania Smell Identification Test (UPSIT) [40], Odorized Marker Test (OMT) [41,42] a The Motol Hospital Smell Test (MHST) [43]. Schopnost identifikace pachů v nadprahových koncentracích lze testovat pomocí všech těchto čtyř testů metodou nucené volby ze čtyř možných pojmenování. Nejobsáhlejší, 40položkový UPSIT je založen na tzv. scratch‑ and‑ sniff technologii. Pach se uvolňuje po poškrábání odorizovaného políčka tužkou a vyšetřovaná osoba volí ze čtyř možných pojmenování to, které stimul vystihuje nejlépe. Výstup testu, jímž je počet správných pojmenování, se porovnává s percentilovými normami [44]. Test si administruje osoba sama a test ‑ retest reliabilita přesahuje 90 % [45]. UPSIT je k dispozici v několika jazykových mutacích a podněty jsou částečně uzpůsobeny danému kulturnímu prostředí. U nás lze jako nejbližší použít verzi německou. Mezi jeho nevýhody patří skutečnost, že ačkoli jsou podněty v nadprahových koncentracích, jsou poměrně málo intenzivní, a tudíž výsledky vysoce korelují s detekčním prahem [45]. Jeho využití pro hodnocení čichu v klinické praxi u nás je nadto omezeno tím, že zatím nejsou k dispozici normy pro populaci českou, nýbrž jen německou, dále finanční nákladností, jelikož jde o test jednorázový, a také časovou náročností, kdy se délka vyšetření u zdravé populace pohybuje kolem 15 – 20 min. Později byla vyvinuta a validizována jeho krátká, 12položková verze nyní známá jako Brief Smell Identification Test (B ‑ SIT) [46], kde kromě menší časové náročnosti (cca 5 min) ostatní nevýhody zůstávají. Test identifikace Sniffin‘ Sticks, stejně jako další dva testy v rámci rozšířené sady (diskriminace a detekčních prahů), má podobu fixů napuštěných odoranty a lze předkládat 16 nebo 32 stimulů (tzv. modrá a fialová verze obsahuje každá po 16 stimulech). K dostání je také skríningová 12položková „modrá“ verze identifikačního testu. Administrace každé z plných i této skríningové verze u zdravé populace trvá max. 5 – 10 min. Nevýhodou je finanční nákladnost, přičemž životnost sady je omezena na 12 měsíců. Podobnou formu má šestipoložkový test OMT, který představuje cenově nejvýhodnější a časově nejméně náročnou alternativu pro skríningová vyšetření. Výstupem u Sniffin‘ Sticks i OMT je součet správných odpovědí, který se porovná s normativními daty pro danou věkovou kohortu. Normy pro českou populaci pro 16 položkový test identifikace Sniffin‘ Sticks a OMT uvádí Vodička et al [47]. U 18 položkového testu MHST mají podněty podobu olejových esencí ve speciálních lahvičkách, které je třeba po třech měsících doplnit. Populační hodnoty tohoto testu v české populaci však nebyly doposud publikovány. Obecně lze tedy shrnout, že pro skríningové vyšetření čichu jsou v současné době z hlediska finančního a časového nejvhodnější testy identifikace OMT a 16položková verze Sniffin‘ Sticks, pro něž byly publikovány normy pro českou populaci.
Pro podrobné vyšetření čichu je žádoucí testy identifikace doplnit o test diskriminace a detekčního prahu. Ty lze v českých podmínkách nejlépe testovat také pomocí Sniffin‘ Sticks, a to odlišováním jednoho stimulu v rámci trojice od dvou stimulů nesoucích jinou kvalitu pachu (diskriminace) nebo od dvou neodorizovaných stimulů (detekční práh). Výstupem je pak celkové skóre složené ze skórů dílčích subtestů detekčního prahu, diskriminace a 16položkové identifikace (TDI), které se porovnává s normativními daty [47], na základě čehož se usuzuje na normosmii, hyposmii či anosmii. Nevýhodou kromě finanční stránky je i relativní časová náročnost testu, neboť celkový čas potřebný k vyšetření se blíží 60 min.
Skríning anhedonie je v českém prostředí možno provést pomocí českého Nového testu libosti pachů (New Test of Odor Pleasantness; NTOP) [48]. Test obsahuje 29 výrazně hédonicky zabarvených pachových látek a tři látky s výraznou schopností dráždit trojklaný nerv. Osoba po přičichnutí vždy uvede, zda látka voní, je neutrální, zapáchá či výrazně zapáchá (nebo dráždí). Na základě nejčetnějších odpovědí osob kontrolní skupiny ve věkovém rozmezí 16 – 35 let je nastaveno bodové hodnocení. Přehled všech testů včetně jejich přibližné časové náročnosti a finančních nákladů uvádí tab. 2.
2. Nejčastěji vyšetřované čichové schopnosti, jejich popis a v České republice dostupné testy, pro které jsou v současnosti k dispozici normativní data. 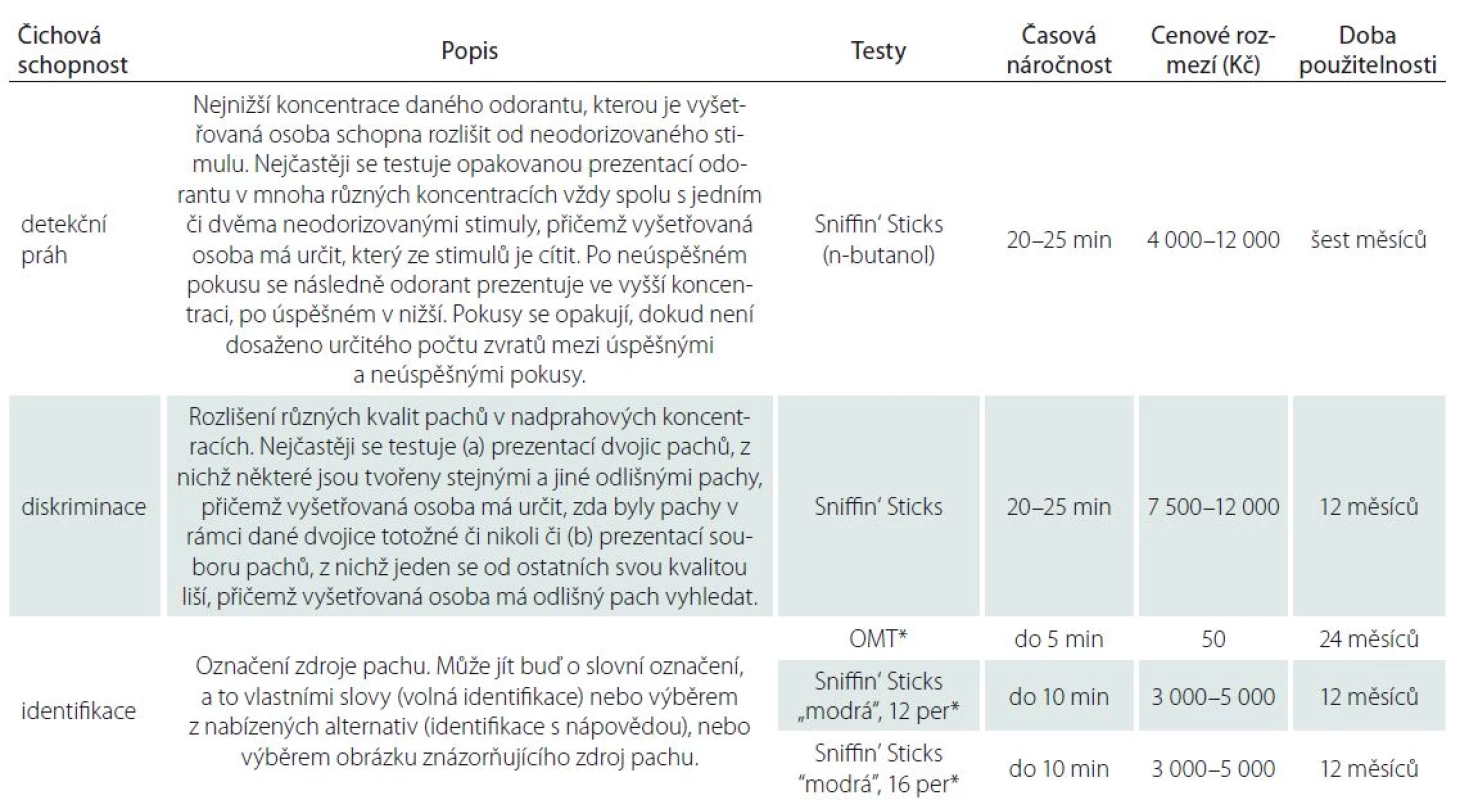
*Označuje testy, které jsou vhodné pro účely skríningu Poruchy čichu u vybraných neurodegenerativních onemocnění
Alzheimerova choroba a mírná kognitivní porucha
ACH představuje nejčastější příčinu demence a včasná diagnóza je klíčová pro zajištění adekvátní lékařské i sociální intervence jak u samotných pacientů, tak jejich rodiny [49]. Byla identifikována řada biomarkerů ACH v mozkomíšním moku (tzv. likvorový triplet fosfo ‑ tau protein (P ‑ tau), β ‑ amyloid (Aβ42) a celkový tau protein (H ‑ tau)) a v krvi [50,51] a navržen model typické progrese ACH, v němž tvorba β ‑ amyloidu předchází neurodegenerativním a následně kognitivním biomarkerům [52]. Mnoho oblastí mozku, které postihuje patologie spojená s ACH, se zároveň podílí na zpracování čichových informací. Spadá mezi ně přední čichové jádro, entorhinální kůra, piriformní kůra a hipokampus. Tyto oblasti mozku také patří mezi ty patologií ACH nejraněji a nejvíce zasažené [53]. To odráží pokles čichových funkcí, především zhoršená identifikace a zvýšené detekční prahy, pro přehled viz [54], které se objevují v předstihu před typickými příznaky ACH a jsou její časnou známkou [55 – 58]. Někteří se nadto domnívají, že psychofyzické testy čichu představují lepší prediktory kognitivního poklesu než běžně předkládané kognitivní testy [59]. Kupříkladu Scandinavian Odour Identification Test [60] společně s přítomností Apolipoprotein E epsilon 4 (APOE4) alely a vyšším věkem predikovaly celkový kognitivní pokles měřený testem Mini‑Mental State Examination (MMSE) [61], zatímco 30položkový Multiple ‑ choice test slovní zásoby nikoli [62]. Přítomnost APOE4 alely se pojí nejen se zhoršenou čichovou identifikací [57], ale i vyššími detekčními prahy (sníženou citlivostí) [63]. Není však doposud zřejmé, nakolik vyšší detekční prahy odrážejí progresi ACH [64]. Pro predikci kognitivního poklesu pomocí psychofyzických testů čichu se uvádí senzitivita 55,1 % a specificita 84,4 % [65].
Zhoršená identifikace také predikuje přechod od MKP k ACH. U pacientů s MKP, kteří byli vyšetřováni po dobu dvou let v šestiměsíčních intervalech, bylo zjištěno, že u těch, kteří vykazovali nízká UPSIT skóre (≤ 34 ze 40), a zároveň těch, kteří si svůj čichový deficit neuvědomovali, se ACH vyskytla častěji než u ostatních. Konkrétně se ACH vyskytla u 40 % ze 47 pacientů s nízkými UPSIT skóry, ale u žádného z 30 pacientů s vysokými skóry, a u 25 % z 64 pacientů, kteří si nebyli vědomi žádného zhoršení čichu oproti 23 % ze 13 pacientů, kteří uvedli nějaký problém s čichem [56]. Vzhledem k nízkému počtu pacientů je však namístě opatrnost při interpretaci těchto výsledků, zejména pokud jde o uvědomění si poruchy čichu. Horší výkon v testu identifikace přitom nejspíše není dán úpadkem verbálních schopností, neboť jedinci s rizikem výskytu ACH nebo s podezřením na ACH vykazovali zhoršenou identifikaci pachů měřenou jak na verbálních schopnostech závislým UPSIT testem, tak testem San Diego Odor Identification Test (SDOIT), založeném na přiřazování obrázků znázorňujících zdroj pachu k odorantům [19,66], který je na nich závislý méně [57]. Také zvýšené detekční prahy (snížená citlivost) mohou predikovat výskyt ACH. Jedinci, kteří netrpěli demencí, avšak vyskytovalo se u nich riziko výskytu ACH vzhledem k přítomnosti MKP, měli vyšší detekční prahy pro n ‑ butanol rok před tím, než u nich byla diagnostikována ACH [58]. Podobně u jedinců s familiárním rizikem (APOE4) pro ACH byly zjištěny vyšší detekční prahy pro fenyl etylalkohol (PEA) [67]. Studie, jíž se účastnili zdraví stárnoucí jedinci, jedinci s MKP a jedinci s podezřením na ACH, ukázala u MKP oproti kontrolním jedincům zvýšené detekční prahy pro PEA a zhoršenou identifikaci, ale i diskriminaci, která se však dala vysvětlit právě sníženou citlivostí. Jedinci s ACH vykazovali horší výkon ve všech třech testech než jedinci s MKP. Výkon v identifikaci a diskriminaci pachů přitom koreloval s výkonem v neuropsychologických testech více než detekční prahy [68]. Rozsáhlejší studie se seniory bez demence či kognitivní poruchy pak naznačila, že horší skóre v testu B ‑ SIT byla spojena s rychlejším poklesem epizodické paměti a zvýšeným rizikem výskytu MKP, a to i poté, co byla kontrolována počáteční úroveň epizodické paměti a přítomnost APOE4 alely. U jedinců nevykazujících kognitivní poruchu byl po provedení autopsie mozku zjištěn vztah mezi závažnější patologií spojenou s ACH a nižšími skóry v testu B ‑ SIT [69]. Pro přechod od MKP k ACH vykazuje rozšířená sada Sniffin‘ Sticks, jejímž výstupem je kompozitní skóre detekčního prahu, diskriminace a identifikace (TDI), senzitivitu 92,3 % a specificitu 75 % [70]. Pro UPSIT byly u MKP v závislosti na stanoveném cut‑off skóre (29 – 33 ze 40 možných bodů) zjištěny hodnoty pro senzitivitu v rozmezí 58,1 – 87,1 % a pro specificitu 56,3 – 80,2 % [71].
Kvalitativní poruchy čichu u ACH jsou v literatuře udávány podstatně méně. Ačkoli je u ACH přítomnost bludů a halucinací běžná a predikuje kognitivní a funkční pokles [72], fantosmie se vyskytují zřídka (~2 – 4 %) [72,73] či vůbec [74,75]. Možné změny hodnocení percepčních charakteristik pachů (příjemnosti, intenzity, známosti a jedlosti) u neurodegenerativních onemocnění obecně jsou problematika, která byla zatím zkoumána jen velmi okrajově. Výsledky nemnoha takto zaměřených studií, se navíc opírají o velmi malé soubory. Royet et al kupříkladu uvádějí, že pacienti s ACH, ale také starší zdraví jedinci pachy hodnotili jako méně intenzivní než mladší zdravé osoby, což je do určité míry dáno korelací mezi hodnocením intenzity a detekčními prahy, jež se s věkem zvyšují (tj. citlivost se snižuje) [76]. Pacienti s ACH však vykazovali rovněž nižší hodnocení známosti než zdraví jedinci bez ohledu na věk. Hodnocení příjemnosti a jedlosti pachů se mezi skupinami (pacienty s ACH, staršími zdravými a mladšími zdravými osobami) nelišilo. Jiná studie však naznačuje, že v dospělosti ke změnám vnímané příjemnosti u zdravých osob s věkem dochází [77]. Je tedy zřejmé, že bude zapotřebí dalších studií, abychom získali robustnější představu o souvislosti mezi ACH a kvalitativními poruchami čichu.
Parkinsonova choroba
U PCH, multisystémového onemocnění spadajícího mezi alfa‑synukleinopatie [78], je mezi prvními postižen čichový kyj [79,80]. Porucha čichu je vysoce robustní a bilaterální s prevalencí kolem 90 % u sporadické PCH [81], tedy s prevalencí stejnou nebo vyšší, než jakou vykazují hlavní motorické příznaky choroby [82]. Metaanalýza provedená na konci 20. století ukázala, že Cohenovo d pro rozdíly v čichových testech mezi pacienty s PCH a kontrolními jedinci dosahuje či přesahuje 3, značící velmi silný efekt [10]. Recentní studie uvádí, že UPSIT rozlišuje mezi pacienty s PCH a kontrolními jedinci se 79,7% senzitivitou a 68% specificitou při cut‑off skóre ≤ 25 s celkovou přesností diagnózy PCH 75,3 % [83]. B ‑ SIT a Sniffin‘ Sticks diskriminují mezi pacienty s PCH a zdravými jedinci s 90% senzitivitou [84]. Signifikantně nižší bodové hodnocení získaly také osoby s PCH v testu OMT [42]. Longitudinální studie pak ukazují, že pokles čichových funkcí předchází klasické motorické symptomy PCH v řádu let a slouží tak jako preklinický či premotorický marker PCH [85 – 87]. Kupříkladu ve studii, jíž se zúčastnilo přes 2 000 mužů, bylo pomocí B ‑ SIT testu zjištěno, že zhoršená identifikace se objevuje alespoň čtyři roky před motorickými příznaky PCH [87]. Podobné výsledky byly získány pomocí Sniffin‘ Sticks [85]. Poruchy čichu byly zjištěny také u familiárního parkinsonizmu [88] a u příbuzných prvního stupně pacientů se sporadickými formami PCH, kteří nevykazují symptomy choroby. Synové a dcery především otců s PCH vykazovali nižší UPSIT skóre než ti, jejichž rodiče byli zdraví [89]. Rozvoj PCH je u těchto příbuzných vzácný, je ovšem pravděpodobnější, jsou‑li hyposmičtí nežli normosmičtí [86].
Důvod, proč byl pokles čichových funkcí rozpoznán coby jeden z hlavních příznaků PCH až v 80. letech minulého století a extenzivněji zkoumán až v průběhu 90. let [90], spočívá mimo jiné ve skutečnosti, že 80 % pacientů není zcela anosmických. Běžnější je hyposmie, viz např. [81,91], kdy kupříkladu pacienti nejsou schopni pachy správně pojmenovat, ale přesto vnímají, že stimuly nějaký pach mají. Nejedná se ani o specifickou anosmii, tedy neschopnost vnímat pouze určité pachy, přestože existují studie uvádějící, že některé odoranty rozlišují mezi pacienty s PCH a kontrolními jedinci lépe než jiné [84,92 – 96]. Výsledky těchto studií jsou však značně nekonzistentní vzhledem k vlivům kultury, percepčních charakteristik odorantů či verbálních deskriptorů a navíc jsou stimuly v testech, jako je UPSIT, tvořeny nikoli jednou, ale množstvím chemických látek. Pacienti si přitom nejsou zhoršení svého čichu vědomi [81], stejně jako je tomu u pacientů s ACH [56] a u obecné populace [97].
Mezi faktory, které ovlivňují skóre v čichových testech, lze u PCH kromě obvyklých proměnných, jako je pohlaví a věk, zařadit též specificky sníženou aktivní inhalaci odorantů, i když příspěvek této motorické složky k celkovému zhoršení se jeví jako spíše malý [98]. Faktory, které na čichové funkce naopak vliv nemají, jsou medikace (levodopa, agonisté dopaminu, anticholinergika), kdy medikovaní pacienti vykazují srovnatelnou tíži choroby jako ti nemedikovaní [91,99,100], a pravděpodobně fáze či trvání choroby [81,91,95,101], i když některé studie naznačují, že tomu tak nemusí být u všech pacientů či u pacientů v nejranějších fázích choroby [102 – 104].
Diferenciální diagnostiku mohou usnadnit rozdíly v čichových testech mezi pacienty s PCH a s chorobami, které bývají jako PCH nesprávně diagnostikovány. Menší či žádné poškození čichu provází PSP, MPTP ‑ P, MSA a esenciální tremor (ET). Pacienti s PSP v testu UPSIT nevykazují signifikantní rozdíly oproti zdravým jedincům [105,106] (ve srovnání se [107]), avšak mohou mít zvýšené detekční prahy (sníženou citlivost) [106]. Doposud byla provedena jediná studie s MPTP ‑ P [108] ukazující pouze trend rozdílu v skórech UPSIT a detekčních prazích oproti kontrolním jedincům, zatímco pacienti s PCH se od kontrolních jedinců lišili signifikantně. ET nebývá spojen s žádným čichovým deficitem [109 – 111], ačkoli Louis et al uvádějí opak [112]. MSA provází mírný pokles čichových funkcí [105,113 – 116]. Při použití Sniffin‘ Sticks pro rozlišení MSA a PCH dosahuje při TDI cut‑off skóre 19,5 senzitivita 78 % a specificita 100 %, zvýší‑li se cut‑off TDI na 24,8, zvýší se senzitivita na 100 % a specificita klesne na 63 % [117]. Tato omezená specificita představuje limitující faktor pro diagnostické účely. V souladu s tím Americká neurologická akademie doporučuje brát testy čichu v potaz při rozlišování PCH od PSP, ale nikoli MSA [118]. Naopak podobná skóre v testu UPSIT vykazují pacienti s GPK [119,120] a s ACH [10,121]. Zevrubné srovnání poruch čichu u dalších neurodegenerativních chorob s parkinsonickými příznaky viz Doty [3].
Na rozdíl od kvantitativních poruch čichu výskyt dysosmií u PCH není obvyklý. Landis a Burkhard v případové studii popisují rozvoj PCH současně s vymizením fantosmií u dvou pacientů, kteří nevykazovali závažné kvantitativní poruchy čichu, a soudí, že by fantosmie mohla být premotorickým příznakem PCH [122]. Další studie ovšem ukazuje, že u žádného ze 44 pacientů s idiopatickou fantosmií se v průběhu 10 let sledování nevyskytla PCH, a autoři míní, že představuje z hlediska neurologie spíše neškodný symptom než časný marker PCH či jiné závažné choroby [123]. Je však třeba dodat, že fantosmie závažným způsobem ovlivňují kvalitu života jedince. Recentní studie uvádí výskyt čichových halucinací popisovaných jako krátkodobé a nepříjemné u 10 % z 87 pacientů s PCH, avšak u žádného z kontrolních jedinců [124]. U PCH byla problematika změn percepčního hodnocení doposud studována více než u ACH, ovšem i zde je nutno upozornit na nízký počet účastníků těchto studií. Hudry et al uvádějí, že pacienti hodnotili podněty, k nimž aktivně přičichávali, jako méně příjemné, méně intenzivní a méně známé než zdraví jedinci srovnatelného věku [125]. Hodnocení jedlosti ovlivněno nebylo. Naproti tomu Hummel et al zjistili, že podněty prezentované pomocí olfaktometru byly pacienty hodnoceny jako méně intenzivní, zato příjemnější oproti kontrolním jedincům [126]. Rozdíly v hodnocení percepčních charakteristik podnětů pacienty (nejen s PCH, ale obecně) a kontrolními jedinci tedy může značně záviset na povaze předkládaných podnětů, jejich schopnosti dráždit trojklaný nerv a způsobu jejich prezentace.
Alzheimerova choroba a Parkinsonova choroba – srovnání
Metaanalýza provedená před více než 15 lety na 26 studiích poruch čichu u ACH a PCH ukázala výrazný pokles čichových funkcí u obou chorob, ovšem současně nenaznačila, že by některá z čichových schopností byla u jedné z chorob poškozena více než u druhé [10]. Z recentní metaanalýzy [121] celkem 81 studií (ACH = 39) v souladu s předchozími závěry rovněž vyplývá výrazné zhoršení identifikace a diskriminace pachů a detekčních prahů u obou chorob. Navíc se však ukazuje, že u ACH (avšak nikoli u PCH) je výrazněji postižena identifikace pachů oproti detekčním prahům, zatímco u PCH je pokles napříč čichovými schopnostmi homogennější. U PCH se nadto detekční prahy zdají být zvýšeny (čichová citlivost snížena) více než u ACH. Souhrnně tyto výsledky mohou naznačovat rozdílnou etiologii poruch čichu: zatímco ACH se může projevovat větším zhoršením na centrální úrovni (identifikace), PCH pravděpodobně srovnatelně postihuje úroveň centrální i periferní (detekční prahy). Je však třeba upozornit, že toto rozdělení je do určité míry umělé, neboť i detekční prahy jsou ovlivněny zpracováním na vyšších úrovních [127]. Jednou z příčin těchto rozdílů by mohl být deficit, který vykazují pacienti s PCH, avšak nikoli s ACH, jímž je snížená intenzita aktivní inhalace pachů, která přispívá k horším výsledkům při identifikaci pachů i testování detekčních prahů [98]. Pokles čichových funkcí u PCH ale nelze zcela vysvětlovat tímto deficitem, neboť studie využívající pasivní olfaktometrie, kdy vyšetřovaná osoba stimuly aktivně nevdechuje, nýbrž je tlakovaný odorizovaný vzduch veden na nosní sliznici, také ukazují pokles odpovědi na pachové stimuly [101].
Implikace pro diagnostiku neurodegenerativních onemocnění
Míra poškození čichu se u jednotlivých neurodegenerativních chorob různí, avšak zároveň je zde patrná variabilita a překryv charakteru poruch čichu, což diagnostickou hodnotu psychofyzického testování čichu limituje. Nicméně kupříkladu pacienti, u nichž je podezření na PCH, by měli vykazovat hyposmii a obdobně u ACH lze již v jejích raných stádiích očekávat výrazně nižší skóre u většiny pacientů. Je třeba vzít v potaz skutečnost, že u obou chorob kvantitativní porucha čichových schopností, jež lze chápat jako speciální případ kognitivních schopností [37], do jisté míry odráží postupující deficit mimo jiné exekutivních funkcí a sémantické paměti. Studie prováděné na zdravých jedincích totiž ukazují, že zejména těmito kognitivními funkcemi jsou signifikantně ovlivněny identifikace a diskriminace pachů, ale ne detekční prahy [128]. Pacienti s ACH i PCH často vykazují poruchu exekutivních funkcí [129,130] i sémantické paměti [131,132]. Není doposud jasné, nakolik s poklesem kognitivních funkcí souvisí hodnocení jednotlivých percepčních charakteristik (např. příjemnosti), avšak z četných studií se zdravými jedinci vyplývá, že i ona mohou být kognitivními funkcemi do značné míry ovlivněna [133 – 135]. Ačkoli tedy psychofyzické hodnocení libosti a dalších percepčních charakteristik může přinést novou informaci do problematiky, k jeho využití je třeba přistupovat s maximální opatrností. Libost pachů totiž vykazuje i v rámci zdravé populace vysokou interindividuální variabilitu, do určité míry podléhá celoživotním změnám a nadto je ovlivněna mnoha krátkodobými i dlouhodobými faktory, od momentální sytosti po osobní citově zabarvené vzpomínky spojené s daným pachem [135]. Určité dílčí řešení může představovat tvorba testovacích sad založených na rozdílné míře dráždění trojklaného nervu, neboť se předpokládá, že právě ona do jisté míry libost pachů ovlivňuje [136,137]. Tuto trigeminovou složku však nelze v žádném případě, vzhledem k výše uvedenému, považovat za jediný a výhradní činitel ovlivňující libost pachů. V pozdějších stadiích chorob, kdy jsou výsledky těchto testů a hodnocení méně spolehlivé vzhledem ke kognitivnímu poklesu, je proto vhodnější využít metod méně závislých na kognitivních odpovědích, mezi něž patří např. OERP či SMT [138,139]. Jejich nevýhodou je však časová náročnost a vyšší pořizovací cena. U asymptomatických příbuzných pacientů s ACH či PCH by psychofyzické vyšetření čichu mohlo posloužit jako biomarker rizika budoucího výskytu choroby. U ACH by baterie pro odhalení subklinických případů měla obsahovat zejména test identifikace, zatímco u PCH by měl být důraz kladen zejména na detekční prahy [121].
U všech chorob je však třeba upozornit na dvě skutečnosti. Zaprvé, ačkoli je možné detekovat vyšší výskyt poruch čichu na úrovni celých skupin, dostupná literatura také ukazuje, že se individuální skóre dosažená jednotlivými pacienty a kontrolními jedinci značně překrývají. Zadruhé, vykazuje‑li zdravá osoba při vyšetření čichu výsledky horší, než jaké by se daly čekat pro danou věkovou kohortu ve zdravé populaci, je u ní zvýšené relativní riziko výskytu choroby. Absolutní riziko je nicméně nízké. Například v souboru čítajícím přes 2 000 mužů se u více než 98 % z těch, jejichž výsledky spadaly do nejhoršího kvartilu, za čtyři a osm let po prvním vyšetření PCH nevyskytla [87]. Souhrnně lze říci, že vyšetření poruch čichu může pomoci nejen při stanovování diagnózy, ale také jako neinvazivní index změn, k nimž dochází ve funkci těch oblastí mozku, jež jsou rovněž spoluodpovědné za zpracování čichových informací. Tyto změny jsou v současné době studovány převážně za pomoci zobrazovacích metod a neuropatologického vyšetření [140,141]. Vyšetření čichu je tudíž možno využít v kombinaci s těmito metodami za účelem sledování progrese choroby nebo zhodnocení účinnosti terapie, přičemž toto jeho využití nezávisí na tom, zda je či není zhoršení určité čichové schopnosti specifické pro danou chorobu. Stále však před námi stojí několik zásadních úkolů [142]. Není např. jasné, zda a nakolik kvantitativní porucha čichu souvisí s progresí choroby. Nejsou totiž zatím k dispozici longitudinální studie vývoje čichových dysfunkcí a zároveň strukturních a funkčních deficitů v relevantních oblastech mozku v průběhu onemocnění. Další oblastí vyžadující pozornost jsou např. možné rozdíly v hodnocení příjemnosti, intenzity a známosti pachů mezi pacienty a zdravými jedinci u jednotlivých chorob a potenciální souvislost změn v hodnocení těchto percepčních charakteristik s progresí choroby.
Studie byla podpořena grantem IGA MZ ČR NT13145-4/2012, projektem „Národní ústav duševního zdraví (NUDZ)“, registrační číslo ED2.1.00/03.0078, financovaným z Evropského fondu regionálního rozvoje, a projektem UNCE 204004 „Příroda a kultura – interakce kulturní a biologické evoluce v mezioborové perspektivě“. Na vznik této publikace byla FHS UK poskytnuta Institucionální podpora na dlouhodobý koncepční rozvoj výzkumné organizace (MŠMT‑2014) v rámci programu PRVOUK P20. Vznik publikace byl také částečně podpořen grantem TAČR TA04011114.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 12. 5. 2015
Přijato do tisku: 14. 9. 2015
Mgr. Lenka Martinec Nováková, Ph.D.
Fakulta humanitních studií
UK v Praze
U Kříže 8
158 00 Praha 5
e-mail: Lenka.Novakova@fhs.cuni.cz
Sources
1. Ansari KA, Johnson A. Olfactory function in patients with Parkinson’s disease. J Chronic Dis 1975; 28(9): 493 – 497.
2. Waldton S. Clinical observations of impaired cranial nerve function in senile dementia. Acta Psychiatr Scand 1974; 50(5): 539 – 547.
3. Doty RL. Olfaction in Parkinson‘s disease and related disorders. Neurobiol Dis 2012; 46(3): 527 – 552. doi: 10.1016/ j.nbd.2011.10.026.
4. Sun GH, Raji CA, MacEachern MP, Burke JF. Olfactory identification testing as a predictor of the development of Alzheimer‘s dementia: a systematic review. Laryngoscope 2012; 122(7): 1455 – 1462. doi: 10.1002/ lary.23365.
5. Hawkes CH, Doty RL. Neurodegenerative diseases that affect olfaction. In: Hawkes CH, Doty RL (eds). The Neurology of Olfaction. New York: Cambridge University Press 2009 : 153 – 214.
6. Mondon K, Naudin M, Beaufils E, Atanasova B. Perception of taste and smell in normal and pathological aging: an update. Geriatr Psychol Neuropsychiatr Vieil 2014; 12(3): 313 – 320. doi: 10.1684/ pnv.2014.0484.
7. Doty RL, Kamath V. The influences of age on olfaction: a review. Front Psychol 2014; 5 : 20. doi: 10.3389/ fpsyg.2014.00020.
8. Schofield PW, Finnie S, Yong YM. The role of olfactory challenge tests in incipient dementia and clinical trial design. Curr Neurol Neurosci Rep 2014; 14(9): 479. doi: 10.1007/ s11910 ‑ 014 ‑ 0479 ‑ z.
9. Doty RL. Odor perception in neurodegenerative diseases. In: Doty RL (ed.). Handbook of Olfaction and Gustation. 2nd ed. New York, NY: Marcel Dekker 2003 : 479–502.
10. Mesholam RI, Moberg PJ, Mahr RN, Doty RL. Olfaction in neurodegenerative disease: a meta‑analysis of olfactory functioning in Alzheimer‘s and Parkinson‘s diseases. Arch Neurol 1998; 55(1): 84 – 90.
11. Nordin S, Monsch AU, Murphy C. Unawareness of smell loss in normal aging and Alzheimer’s disease: discrepancy between self ‑ reported and diagnosed smell sensitivity. J Gerontol B Psychol Sci Soc Sci 1995; 50(4): P187 – P192.
12. Hummel T, Welge ‑ Lüessen A. Assessment of olfactory function. In: Hummel T, Welge ‑ Lüessen A (eds). Taste and Smell. An Update. Advances in Oto ‑ Rhino ‑ Laryngology. Basel: Karger 2006 : 84 – 98.
13. Doty RL, Deems DA, Frye RE, Pelberg R, Shapiro A. Olfactory sensitivity, nasal resistance, and autonomic function in patients with multiple chemical sensitivities. Arch Otolaryngol Head Neck Surg 1988; 114(12): 1422 – 1427.
14. Hawkes CH, Doty RL. General disorders of olfaction. In: Hawkes CH, Doty RL (eds). The Neurology of Olfaction. New York, NY: Cambridge University Press 2009 : 111 – 152.
15. Landis BN, Hummel T, Hugentobler M, Giger R, Lacroix JS. Ratings of overall olfactory function. Chem Senses 2003; 28(8): 691 – 694.
16. Soter A, Kim J, Jackman A, Tourbier I, Kaul A, Doty RL. Accuracy of self ‑ report in detecting taste dysfunction. Laryngoscope 2008; 118(4): 611 – 617.
17. Marschner H, Gudziol H, Guntinas ‑ Lichius O. Olfactory dysfunctions are substantially more frequent than they are complained. Laryngorhinootologie 2010; 89(11): 654 – 659. doi: 10.1055/ s ‑ 0030 ‑ 1262779.
18. Shu CH, Lee PL, Lan MY, Lee YL. Factors affecting the impact of olfactory loss on the quality of life and emotional coping ability. Rhinology 2011; 49(3): 337 – 341. doi: 10.4193/ Rhino10.130.
19. Murphy C, Schubert CR, Cruickshanks KJ, Klein BE, Klein R, Nondahl DM. Prevalence of olfactory impairment in older adults. JAMA 2002; 288(18): 2307 – 2312.
20. Hoffman HJ, Ishii EK, Macturk RH. Age‑related changes in the prevalence of smell/ taste problems among the United States adult population – results of the 1994 disability supplement to the National Health Interview Survey (NHIS). Ann N Y Acad Sci 1998; 855 : 716 – 722.
21. Nordin S, Bramerson A, Bende M. Prevalence of self ‑ reported poor odor detection sensitivity: the Skövde population‑based study. Acta Otolaryngol (Stockh) 2004; 124(10): 1171 – 1173.
22. Frasnelli J, Landis BN, Heilmann S, Hauswald B, Huttenbrink KB, Lacroix JS et al. Clinical presentation of qualitative olfactory dysfunction. Eur Arch Otorhinolaryngol 2004; 261(7): 411 – 415.
23. Simmen D, Briner HR. Olfaction in rhinology – methods of assessing the sense of smell. Rhinology 2006; 44(2): 98 – 101.
24. Leopold D. Distortion of olfactory perception: Diagnosis and treatment. Chem Senses 2002; 27(7): 611 – 615.
25. Landis BN, Frasnelli J, Hummel T. Euosmia: a rare form of parosmia. Acta Otolaryngol (Stockh) 2006; 126(1): 101 – 103.
26. Bramerson A, Johansson L, Ek L, Nordin S, Bende M. Prevalence of olfactory dysfunction: the Skövde population‑based study. Laryngoscope 2004; 114(4): 733 – 737.
27. Vennemann MM, Hummel T, Berger K. The association between smoking and smell and taste impairment in the general population. J Neurol 2008; 255(8): 1121 – 1126. doi: 10.1007/ s00415 ‑ 008 ‑ 0807 ‑ 9.
28. Landis BN, Konnerth CG, Hummel T. A study on the frequency of olfactory dysfunction. Laryngoscope 2004; 114(10): 1764 – 1769.
29. Nordin S, Bramerson A, Millqvist E, Bende M. Prevalence of parosmia: the Skövde population‑based studies. Rhinology 2007; 45(1): 50 – 53.
30. Henkin RI. Hyperosmia and depression following exposure to toxic vapors. JAMA 1990; 264(21): 2803.
31. Grant AC. Interictal perceptual function in epilepsy. Epilepsy Behav 2005; 6(4): 511 – 519.
32. Blau JN, Solomon F. Smell and other sensory disturbances in migraine. J Neurol 1985; 232(5): 275 – 276.
33. Hirsch AR. Olfaction in migraineurs. Headache 1992; 32(5): 233 – 236.
34. Vodička J. Rozdělení poruch čichu. In: Chrobok V (ed.). Poruchy čichu a chuti. Havlíčkův Brod: Tobiáš 2012 : 56 – 60.
35. Vodička J, Pellant A. Metody vyšetření čichu v klinické praxi. Otorinolaryng a Foniat 2004; 53 : 7 – 10.
36. Doty RL, Laing DG. Psychophysical measurement of human olfactory function, including odorant mixture assessment. In: Doty RL (ed.). Handbook of Olfaction and Gustation. 2nd ed. New York, NY: Marcel Dekker 2003 : 203 – 228.
37. Flanagan DP, Harrison PL. Contemporary Intellectual Assessment: Theories, Tests, and Issues. 3rd ed. New York, NY: Guilford Press 2012.
38. Hawkes CH, Doty RL. Clinical evaluation. In: Hawkes CH,Doty RL (eds). The Neurology of Olfaction. New York, NY: Cambridge University Press 2009 : 59 – 109.
39. Hummel T, Sekinger B, Wolf SR, Pauli E, Kobal G. ‚Sniffin‘ Sticks‘: olfactory performance assessed by the combined testing of odor identification, odor discrimination and olfactory threshold. Chem Senses 1997; 22(1): 3 – 52.
40. Doty RL, Shaman P, Kimmelman CP, Dann MS. University of Pennsylvania Smell Identification Test: a rapid quantitative olfactory function test for the clinic. Laryngoscope 1984; 94(2): 176 – 178.
41. Vodicka J, Pellant A, Chrobok V. Screening of olfactory function using odourized markers. Rhinology 2007; 45(2): 164 – 168.
42. Vodička J, Pecková LK, A, Ehler E, Chrobok V. Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů. Cesk Slov Neurol N 2010; 73/ 106(1): 45 – 50.
43. Magerová H, Vyhnálek M, Laczó J, Bojar M, Hort J. Přínos vyšetření čichu v časné diagnostice demencí. Cesk Slov Neurol N 2008; 71/ 104(3): 298 – 302.
44. Doty RL. The Smell Identification Test administration manual. Haddon Heights, NJ: Sensonics 1995.
45. Doty RL, Shaman P, Dann M. Development of the University of Pennsylvania smell identification test: a standardized microencapsulated test of olfactory function. Physiol Behav 1984; 32(3): 489 – 502.
46. Doty RL, Marcus A, Lee WW. Development of the 12 - item Cross ‑ Cultural Smell Identification Test (CC ‑ SIT). Laryngoscope 1996; 106(3): 353 – 356.
47. Vodička J, Menšíková A, Balatková Z, Shejbalová H, Racková R, Matoušek P et al. Fyziologické hodnoty čichových testů v české populaci. Otorinolaryng Foniat 2011; 60(3): 119 – 124.
48. Brothánková P, Vodička J. Normální hodnoty Nového testu libosti pachů u zdravé populace. Cesk Slov Neurol N 2015; 78/ 111(1): 78 – 82.
49. Mortimer JA, Borenstein AR, Gosche KM, Snowdon DA. Very early detection of Alzheimer neuropathology and the role of brain reserve in modifying its clinical expression. J Geriatr Psychiatry Neurol 2005; 18(4): 218 – 223.
50. Humpel C. Identifying and validating biomarkers for Alzheimer‘s disease. Trends Biotechnol 2011; 29(1): 26 – 32. doi: 10.1016/ j.tibtech.2010.09.007.
51. Craig ‑ Schapiro R, Fagan AM, Holtzman DM. Biomarkers of Alzheimer‘s disease. Neurobiol Dis 2009; 35(2): 128 – 140. doi: 10.1016/ j.nbd.2008.10.003.
52. Jack CR jr, Knopman DS, Jagust WJ, Shaw LM, Aisen PS,Weiner MW et al. Hypothetical model of dynamic biomarkers of the Alzheimer‘s pathological cascade. Lancet Neurol 2010; 9(1): 119 – 128. doi: 10.1016/ S1474 ‑ 4422(09)70299 ‑ 6.
53. Murphy C. Loss of olfactory function in dementing disease. Physiol Behav 1999; 66(2): 177 – 182.
54. Doty RL, Hawkes CH, Good KV, Duda JE. Odor perception and neuropathology in neurodegenerative diseases and schizophrenia. In: Doty RL (ed.). Handbook of Olfaction and Gustation. 3rd ed. Hoboken, NJ: John Wiley & Sons 2015 : 403–451.
55. Serby M, Larson P, Kalkstein D. The nature and course of olfactory deficits in Alzheimer‘s disease. Am J Psychiatry 1991; 148(3): 357 – 360.
56. Devanand DP, Michaels ‑ Marston KS, Liu XH, Pelton GH,Padilla M, Marder K et al. Olfactory deficits in patients with mild cognitive impairment predict Alzheimer‘s disease at follow‑up. Am J Psychiatry 2000; 157(9): 1399 – 1405.
57. Morgan CD, Nordin S, Murphy C. Odor identification as an early marker for Alzheimer‘s disease: impact of lexical functioning and detection sensitivity. J Clin Exp Neuropsychol 1995; 17(5): 793 – 803.
58. Bacon AW, Bondi MW, Salmon DP, Murphy C. Very early changes in olfactory functioning due to Alzheimer‘s disease and the role of Apolipoprotein E in olfaction. In: Murphy C (ed.). Olfaction and Taste Xii: an International Symposium. New York Academy of Sciences. New York: New York Academy of Sciences 1998 : 723 – 731.
59. Graves AB, Bowen JD, Rajaram L, McCormick WC, McCurry SM, Schellenberg GD et al. Impaired olfaction as a marker for cognitive decline: interaction with apolipoprotein E epsilon 4 status. Neurology 1999; 53(7): 1480 – 1487.
60. Nordin S, Bramerson A, Liden E, Bende M. The Scandinavian Odor ‑ Identification Test: development, reliability, validity and normative data. Acta Otolaryngol (Stockh) 1998; 118(2): 226 – 234.
61. Folstein MF, Folstein SE, McHugh PR. „Mini‑mental state“. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12(3): 189 – 198.
62. Olofsson JK, Ronnlund M, Nordin S, Nyberg L, Nilsson LG,Larsson M. Odor identification deficit as a predictor of five‑year global cognitive change: interactive effects with age and ApoE ‑ epsilon 4. Behav Genet 2009; 39(5): 496 – 503. doi: 10.1007/ s10519 ‑ 009 ‑ 9289 ‑ 5.
63. Murphy C, Gilmore Mm, Seery CS, Salmon DP, Lasker BR.Olfactory thresholds are associated with degree of dementia in Alzheimer‘s disease. Neurobiol Aging 1990; 11(4): 465 – 469.
64. Nordin S, Almkvist O, Berglund B, Wahlund LO. Olfactory dysfunction for pyridine and dementia progression in Alzheimer disease. Arch Neurol 1997; 54(8): 993 – 998.
65. Schubert CR, Carmichael Ll, Murphy C, Klein BEK, Klein R, Cruickshanks KJ. Olfaction and the 5‑year incidence of cognitive impairment in an epidemiological study of older adults. J Am Geriatr Soc 2008; 56(8): 1517 – 1521.
66. Murphy C, Anderson JA, Markison S. Psychophysical assessment of chemosensory disorders in clinical populations. In: Kurihara K, Suzuki N, Ogawa H (eds). Olfaction and taste XI. Tokyo: Springer Japan 1994 : 609 – 613.
67. Schiffman Ss, Graham BG, Sattely ‑ Miller EA, Zervakis J,Welsh ‑ Bohmer K. Taste, smell and neuropsychological performance of individuals at familial risk for Alzheimer‘s disease. Neurobiol Aging 2002; 23(3): 397 – 404.
68. Djordjevic J, Jones ‑ Gotman M, De Sousa K, Chertkow H. Olfaction in patients with mild cognitive impairment and Alzheimer‘s disease. Neurobiol Aging 2008; 29(5): 693 – 706.
69. Wilson RS, Arnold SE, Schneider JA, Boyle PA, Buchman AS, Bennett DA. Olfactory impairment in presymptomatic Alzheimer‘s disease. Ann N Y Acad Sci 2009; 1170 : 730 – 735. doi: 10.1111/ j.1749 ‑ 6632.2009.04013.x.
70. Marigliano V, Gualdi G, Servello A, Marigliano B, Volpe LD, Fioretti A et al. Olfactory deficit and hippocampal volume loss for early diagnosis of Alzheimer disease: a pilot study. Alzheimer Dis Assoc Disord 2014; 28(2): 194 – 197. doi: 10.1097/ WAD.0b013e31827bdb9f.
71. Tabert MH, Liu XH, Doty RL, Serby M, Zamora D, Pelton GH et al. A 10 - item smell identification scale related to risk for Alzheimer‘s disease. Ann Neurol 2005; 58(1): 155 – 160.
72. Scarmeas N, Brandt J, Albert M, Hadjigeorgiou G, Papadimitriou A, Dubois B et al. Delusions and hallucinations are associated with worse outcome in Alzheimer disease. Arch Neurol 2005; 62(10): 1601 – 1608.
73. Cummings JL, Victoroff JI. Noncognitive neuropsychiatric syndromes in Alzheimer‘s disease. Cogn Behav Neurol 1990; 3(2): 140 – 158.
74. Foerster S, Vaitl A, Teipel SJ, Yakushev I, Mustafa M, la Fougere C et al. Functional representation of olfactory impairment in early Alzheimer‘s disease. J Alzheimers Dis 2010; 22(2): 581 – 591. doi: 10.3233/ JAD ‑ 2010 ‑ 091549.
75. Lopez OL, Becker JT, Brenner RP, Rosen J, Bajulaiye OI, Reynolds CF. Alzheimer‘s disease with delusions and hallucinations: neuropsychological and electroencephalographic correlates. Neurology 1991; 41(6): 906 – 912.
76. Royet JP, Croisile B, Williamson ‑ Vasta R, Hibert O, Serclerat D, Guerin J. Rating of different olfactory judgements in Alzheimer‘s disease. Chem Senses 2001; 26(4): 409 – 417.
77. Markovic K, Reulbach U, Vassiliadu A, Lunkenheimer J,Lunkenheimer B, Spannenberger R et al. Good news for elderly persons: olfactory pleasure increases at later stages of the life span. J Gerontol A Biol Sci Med Sci 2007; 62(11): 1287 – 1293.
78. Halliday GM, Barker RA, Rowe DB. Non ‑ dopamine Lesions in Parkinson‘s Disease. 1st ed. Oxford: Oxford University Press 2011.
79. Braak H. Staging of brain pathology related to sporadic Parkinson‘s disease. Neurobiol Aging 2003; 24(2): 197 – 211.
80. Braak H, Ghebremedhin E, Rub U, Bratzke H, Del Tredici K. Stages in the development of Parkinson‘s disease‑related pathology. Cell Tissue Res 2004; 318(1): 121 – 134.
81. Doty RL, Deems DA, Stellar S. Olfactory dysfunction in parkinsonism: a general deficit unrelated to neurologic signs, disease stage, or disease duration. Neurology 1988; 38(8): 1237 – 1244.
82. Alves G, Forsaa EB, Pedersen KF, Gjerstad MD, Larsen JP.Epidemiology of Parkinson‘s disease. J Neurol 2008; 255 (Suppl 5): 18 – 32. doi: 10.1007/ s00415 ‑ 008 ‑ 5004 ‑ 3.
83. Rodriguez ‑ Violante M, Gonzalez ‑ Latapi P, Camacho ‑ Ordonez A, Martinez ‑ Ramirez D, Morales ‑ Briceno H,Cervantes ‑ Arriaga A. Low specificity and sensitivity of smell identification testing for the diagnosis of Parkinson‘s disease. Arq Neuropsiquiatr 2014; 72(1): 33 – 37. doi: 10.1590/ 0004 ‑ 282X20130190.
84. Double KL, Rowe DB, Hayes M, Chan DKY, Blackie J, Corbett A et al. Identifying the pattern of olfactory deficits in Parkinson disease using the Brief Smell Identification Test. Arch Neurol 2003; 60(4): 545 – 549.
85. Haehner A, Hummel T, Hummel C, Sommer U, Junghanns S, Reichmann H. Olfactory loss may be a first sign of idiopathic Parkinson‘s disease. Mov Disord 2007; 22(6): 839 – 842.
86. Ponsen MM, Stoffers D, Booij J, van Eck ‑ Smit BLF, Wolters EC, Berendse HW. Idiopathic hyposmia as a preclinical sign of Parkinson‘s disease. Ann Neurol 2004; 56(2): 173 – 181.
87. Ross GW, Petrovitch H, Abbott RD, Tanner CM, Popper J,Masaki K et al. Association of olfactory dysfunction with risk for future Parkinson‘s disease. Ann Neurol 2008; 63(2): 167 – 173.
88. Markopoulou K, Larsen KW, Wszolek EK, Denson MA, Lang AE, Peiffer RF et al. Olfactory dysfunction in familial parkinsonism. Neurology 1997; 49(5): 1262 – 1267.
89. Montgomery EB, Baker KB, Lyons K, Koller WC. Abnormal performance on the PD test battery by asymptomatic first ‑ degree relatives. Neurology 1999; 52(4): 757 – 762.
90. Radil T, Roth J, Růžička E, Tichý J, Wysocki CJ. Porucha čichu: příznak Parkinsonovy nemoci. Cesk Slov Neurol N 1995; 58/ 91(6): 286 – 289.
91. Doty RL, Stern MB, Pfeiffer C, Gollomp SM, Hurtig HI. Bilateral olfactory dysfunction in early stage treated and untreated idiopathic Parkinson‘s disease. J Neurol Neurosurg Psychiatry 1992; 55(2): 138 – 142.
92. Boesveldt S, Verbaan D, Knol DL, van Hilten JJ, Berendse HW. Assessment of odor identification and discrimination in Dutch Parkinson‘s disease patients. Mov Disord 2007; 22: S161.
93. Bohnen NI, Gedela S, Kuwabara H, Constantine GM, Mathis CA, Studenski SA et al. Selective hyposmia and nigrostriatal dopaminergic denervation in Parkinson‘s disease. J Neurol 2007; 254(1): 84 – 90.
94. Daum RF, Sekinger B, Kobal G, Lang CJG. Olfactory testing with „Sniffin‘ Sticks“ in idiopathic parkinsonism. Nervenarzt 2000; 71(8): 643 – 650.
95. Hawkes CH, Shephard BC, Daniel SE. Olfactory dysfunction in Parkinson‘s disease. J Neurol Neurosurg Psychiatry 1997; 62(5): 436 – 446.
96. Silveira ‑ Moriyama L, Williams D, Katzenschlager R, Lees AJ. Pizza, mint, and licorice: smell testing in Parkinson‘s disease in a UK population. Mov Disord 2005; 20: S139.
97. Wehling E, Nordin S, Espeseth T, Reinvang I, Lundervold AJ. Unawareness of olfactory dysfunction and its association with cognitive functioning in middle aged and old adults. Arch Clin Neuropsychol 2011; 26(3): 260 – 269. doi: 10.1093/ arclin/ acr019.
98. Sobel N, Thomason ME, Stappen I, Tanner CM, Tetrud JW, Bower JM et al. An impairment in sniffing contributes to the olfactory impairment in Parkinson‘s disease. Proc Natl Acad Sci U S A 2001; 98(7): 4154 – 4159.
99. Quinn NP, Rossor MN, Marsden CD. Olfactory threshold in Parkinson‘s disease. J Neurol Neurosurg Psychiatry 1987; 50(1): 88 – 89.
100. Roth J, Radil T, Ruzicka E, Jech R, Tichy J. Apomorphine does not influence olfactory thresholds in Parkinson‘s disease. Funct Neurol 1998; 13(2): 99 – 103.
101. Barz S, Hummel T, Pauli E, Majer M, Lang CJ, Kobal G. Chemosensory event‑related potentials in response to trigeminal and olfactory stimulation in idiopathic Parkinson‘s disease. Neurology 1997; 49(5): 1424 – 1431.
102. Herting B, Schulze S, Reichmann H, Haehner A, Hummel T. A longitudinal study of olfactory function in patients with idiopathic Parkinson‘s disease. J Neurol 2008; 255(3): 367 – 370.
103. Siderowf A, Newberg A, Chou KL, Lloyd M, Colcher A,Hurtig HI et al. Tc ‑ 99m TRODAT ‑ 1 SPECT imaging correlates with odor identification in early Parkinson disease. Neurology 2005; 64(10): 1716 – 1720.
104. Tissingh G, Berendse HW, Bergmans P, DeWaard R,Drukarch B, Stoof JC et al. Loss of olfaction in de novo and treated Parkinson‘s disease: Possible implications for early diagnosis. Mov Disord 2001; 16(1): 41 – 46.
105. Wenning GK, Shephard B, Hawkes C, Petruckevitch A,Lees A, Quinn N. Olfactory function in atypical parkinsonian syndromes. Acta Neurol Scand 1995; 91(4): 247 – 250.
106. Doty RL, Golbe LI, McKeown DA, Stern MB, Lehrach CM, Crawford D. Olfactory testing differentiates between progressive supranuclear palsy and idiopathic Parkinson‘s disease. Neurology 1993; 43 : 962 – 965.
107. Silveira ‑ Moriyama L, Hughes G, Church A, Ayling H,Williams DR, Petrie A et al. Hyposmia in progressive supranuclear palsy. Mov Disord 2010; 25(5): 570 – 577.
108. Doty RL, Singh A, Tetrud J, Langston JW. Lack of major olfactory dysfunction in MPTP‑induced parkinsonism. Ann Neurol 1992; 32(1): 97 – 100.
109. Busenbark KL, Huber SI, Greer G, Pahwa R, Koller WC. Olfactory function in essential tremor. Neurology 1992; 42(8): 1631 – 1632.
110. Djaldetti R, Nageris BI, Lorberboym M, Treves TA, Melamed E, Yaniv E. I ‑ 123 - FP ‑ CIT SPECT and olfaction test in patients with combined postural and rest tremor. J Neural Transm 2008; 115(3): 469 – 472. doi: 10.1007/ s00702 ‑ 007 ‑ 0851 ‑ 0.
111. Shah M, Muhammed N, Findley LJ, Hawkes CH. Olfactory tests in the diagnosis of essential tremor. Parkinsonism Relat Disord 2008; 14(7): 563 – 568. doi: 10.1016/ j.parkreldis.2007.12.006.
112. Louis ED, Bromley SM, Jurewicz EC, Watner D. Olfactory dysfunction in essential tremor: a deficit unrelated to disease duration or severity. Neurology 2002; 59(10): 1631 – 1633.
113. Abele M, Riet A, Hummel T, Klockgether T, Wullner U.Olfactory dysfunction in cerebellar ataxia and multiple system atrophy. J Neurol 2003; 250(12): 1453 – 1455.
114. Garland EM, Raj SR, Peltier AC, Robertson D, Biaggioni I. A cross ‑ sectional study contrasting olfactory function in autonomic disorders. Neurology 2011; 76(5): 456 – 460. doi: 10.1212/ WNL.0b013e31820a0caf.
115. Goldstein DS, Holmes C, Bentho O, Sato T, Moak J, Sharabi Y et al. Biomarkers to detect central dopamine deficiency and distinguish Parkinson disease from multiple system atrophy. Parkinsonism Relat Disord 2008; 14(8): 600 – 607. doi: 10.1016/ j.parkreldis.2008.01.010.
116. Muller A, Mungersdorf M, Reichmann H, Strehle G,Hummel T. Olfactory function in Parkinsonian syndromes. J Clin Neurosci 2002; 9(5): 521 – 524.
117. Muller A, Reichmann H, Livermore A, Hummel T. Olfactory function in idiopathic Parkinson‘s disease (IPD): results from cross ‑ sectional studies in IPD patients and long‑term follow‑up of de novo IPD patients. J Neural Transm 2002; 109(5 – 6): 805 – 811.
118. McKinnon JH, Demaerschalk BM, Caviness JN, Wellik KE, Adler CH, Wingerchuk DM. Sniffing out Parkinson disease: can olfactory testing differentiate parkinsonian disorders? Neurologist 2007; 13(6): 382 – 385.
119. Ahlskog JE, Waring SC, Petersen RC, Esteban ‑ Santillan C, Craig UK, O‘Brien PC et al. Olfactory dysfunction in Guamanian ALS, parkinsonism and dementia. Neurology 1998; 51(6): 1672 – 1677.
120. Doty RL, Perl DP, Steele JC, Chen KM, Pierce JD, Reyes P et al. Odor identification deficit of the parkinsonism ‑ dementia complex of Guam: equivalence to that of Alzheimer‘s and idiopathic Parkinson‘s disease. Neurology 1991; 41(5): 77 – 81.
121. Rahayel S, Frasnelli J, Joubert S. The effect of Alzheimer‘s disease and Parkinson‘s disease on olfaction: a meta‑analysis. Behav Brain Res 2012; 231(1): 60 – 74. doi: 10.1016/ j.bbr.2012.02.047.
122. Landis BN, Burkhard PR. Phantosmias and Parkinson disease. Arch Neurol 2008; 65(9): 1237 – 1239. doi: 10.1001/ archneur.65.9.1237.
123. Landis BN, Reden J, Haehner A. Idiopathic phantosmia: outcome and clinical significance. ORL J Otorhinolaryngol Relat Spec 2010; 72(5): 252 – 255. doi: 10.1159/ 000317024.
124. Bannier S, Berdague JL, Rieu I, de Chazeron I, Marques A, Derost P et al. Prevalence and phenomenology of olfactory hallucinations in Parkinson‘s disease. J Neurol Neurosurg Psychiatry 2012; 83(10): 1019 – 1021. doi: 10.1136/ jnnp ‑ 2012 ‑ 302414.
125. Hudry J, Thobois S, Broussolle E, Adeleine P, Royet JP.Evidence for deficiencies in perceptual and semantic olfactory processes in Parkinson‘s disease. Chem Senses 2003; 28(6): 537 – 543.
126. Hummel T, Fliessbach K, Abele M, Okulla T, Reden J,Reichmann H et al. Olfactory fMRI in patients with Parkinson‘s disease. Front Integr Neurosci 2010; 4 : 125. doi: 10.3389/ fnint.2010.00125.
127. Keller A, Vosshall LB. Human olfactory psychophysics. Curr Biol 2004; 14(20): R875 – R878.
128. Hedner M, Larsson M, Arnold N, Zucco GM, Hummel T. Cognitive factors in odor detection, odor discrimination, and odor identification tasks. J Clin Exp Neuropsychol 2010; 32(10): 1062 – 1067. doi: 10.1080/ 13803391003683070.
129. Green J, McDonald WM, Vitek JL, Evatt M, Freeman A, Haber M et al. Cognitive impairments in advanced PD without dementia. Neurology 2002; 59(9): 1320 – 1324.
130. Swanberg Mm, Tractenberg RE, Mohs R, Thal LJ, Cummings JL. Executive dysfunction in Alzheimer disease. Arch Neurol 2004; 61(4): 556 – 560.
131. Giffard B, Desgranges B, Nore‑Mary F, Lalevee C, de la Sayette V, Pasquier F et al. The nature of semantic memory deficits in Alzheimer‘s disease – new insights from hyperpriming effects. Brain 2001; 124(8): 1522 – 1532.
132. Portin R, Laatu S, Revonsuo A, Rinne UK. Impairment of semantic knowledge in Parkinson disease. Arch Neurol 2000; 57(9): 1338 – 1343.
133. de Araujo IE, Rolls ET, Velazco MI, Margot C, Cayeux I.Cognitive modulation of olfactory processing. Neuron 2005; 46(4): 671 – 679.
134. Herz RS. The effect of verbal context on olfactory perception. J Exp Psychol Gen 2003; 132(4): 595 – 606.
135. Rouby C, Pouliot S, Bensafi M. Odor hedonics and their modulators. Food Qual Prefer 2009; 20(8): 545 – 549.
136. Schaal B. Prenatal and postnatal human olfactory development: influences on cognition and behavior. In: Doty RL (ed.). Handbook of Olfaction and Cognition. 3rd ed. Hoboken, NJ: John Wiley & Sons 2015 : 305 – 335.
137. Cometto ‑ Muñiz JE, Simons C. Trigeminal Chemesthesis. In: Doty RL (ed.). Handbook of Olfaction and Gustation. 3rd ed. Hoboken, NJ: John Wiley & Sons 2015 : 1091–1112.
138. Frank RA, Dulay MF, Gesteland RC. Assessment of the Sniff Magnitude Test as a clinical test of olfactory function. Physiol Behav 2003; 78(2): 195 – 204.
139. Tourbier IA, Doty RL. Sniff magnitude test: relationship to odor identification, detection, and memory tests in a clinic population. Chem Senses 2007; 32(6): 515 – 523.
140. McLaughlin NCR, Westervelt HJ. Odor identification deficits in frontotemporal dementia: a preliminary study. Arch Clin Neuropsychol 2008; 23(1): 119 – 123.
141. Attems J, Jellinger KA. Olfactory tau pathology in Alzheimer disease and mild cognitive impairment. Clin Neuropathol 2006; 25(6): 265 – 271.
142. Wesson DW, Wilson DA, Nixon RA. Should olfactory dysfunction be used as a biomarker of Alzheimer‘s disease? Expert Rev Neurother 2010; 10(5): 633 – 635. doi: 10.1586/ern.10.33.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 5-
All articles in this issue
- Results of Early Endarterectomies after Transient Ischaemic Attack
- Methodology of Systematic Review Development I: the Effectiveness of Hyperbaric Oxygen Therapy on Mortality in Adults with Craniotrauma
- Non‑ organic Visual Loss in Children
- Skull‑ base Osteomyelitis Misdiagnosed and Treated as Neuroborreliosis – a Case Report
- Recurrent Transient Global Amnesia – Four Case Reports
- Hypoglossofacial Anastomosis – Three Case Reports
- Acute Hyperkinetic Syndromes Treated with Stereotactic Neurosurgery Intervention – Three Case Reports
- Diagnostic in Patient with Acute Vertigo
- Implementation Science
- Contribution of Olfactory Tests to Diagnosis of Neurodegenerative Diseases
- Differential Diagnosis of Tauopathies – a Clinical Approach
- Cognitive‑ communication Disorders in Patients with Dementia Due to Alzheimer’s Disease
- Normative Data for the Rey‑ Osterrieth Complex Figure Test in Older Czech Adults
- Calcifying Pseudoneoplasm of the Neural Axis – a Case Report
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostic in Patient with Acute Vertigo
- Recurrent Transient Global Amnesia – Four Case Reports
- Normative Data for the Rey‑ Osterrieth Complex Figure Test in Older Czech Adults
- Contribution of Olfactory Tests to Diagnosis of Neurodegenerative Diseases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

