-
Medical journals
- Career
Recidivující tranzitorní globální amnézie – čtyři kazuistiky
: A. Mitášová 1; J. Bednařík 1,2
: Neurologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut, MU, Brno 2
: Cesk Slov Neurol N 2015; 78/111(5): 580-584
: Case Report
Tranzitorní globální amnézie (TGA) je charakterizována náhlým vznikem těžké anterográdní amnézie a absencí dalších fokálních neurologických příznaků. I když je TGA většinou považována za monofázické onemocnění, recidivující průběh není raritní. Etiopatogeneze recidivujících případů nebyla většinou systematicky hodnocena. Cílem naší práce je posouzení výskytu a možných etiopatogenetických faktorů recidivující TGA. V průběhu pěti let bylo na naší klinice hospitalizováno 55 pacientů s TGA, z toho u čtyř (7,3 %) šlo o recidivující formu onemocnění. Jednotlivé případy prezentujeme formou kazuistik. Naše práce poukazuje na skutečnost, že výskyt recidivující TGA není vzácný a v našem souboru (7,3 %) odpovídá literárním údajům. Recidivy se mohou vyvinout v období několika měsíců až let od první ataky. Etiopatogeneze se zřejmě neliší od nerecidivujících forem TGA. Prokázali jsme možnou souvislost s migrénou a vaskulární příčinou kardioembolické geneze. U žádného z pacientů nebyla prokázána souvislost s epilepsií, anamnéza nepodporovala familiární výskyt.
Klíčová slova:
paměť – tranzitorní globální amnézie – tranzitorní ischemická ataka – migrénaÚvod
Tranzitorní globální amnézie (TGA) byla poprvé popsána Fisherem a Adamsem v roce 1964 [1]. Jedná se o jednotku charakterizovanou náhlým vznikem těžké anterográdní amnézie a absencí dalších fokálních neurologických příznaků.
Z časového hlediska rozdělujeme paměť na okamžitou, krátkodobou (recentní) a dlouhodobou. Okamžitá paměť zahrnuje množství informace, které je jedinec schopen udržet bez aktivního učení a je typicky postižena u jedinců s poruchou pozornosti a u pacientů s lézí horního frontálního neokortexu, není vázána na hipokampy. Krátkodobá (recentní) paměť zahrnuje schopnost vnímat a vybavovat si specifické informace, jako jsou slova nebo události, s odstupem minut nebo hodin. Klíčovou roli při vybavování recentních paměťových stop mají hipokampy. Jednoduchým nástrojem k posouzení krátkodobé paměti je test číselných řad. Dlouhodobá paměť uchovává informace získávané po celý život. Vzpomínky jsou uloženy prostřednictvím hipokampu a v průběhu dnů až měsíců delokalizovány do neokortexu. Vybavení těchto vzpomínek z dlouhodobé paměti je zachováno i při poškození hipokampu [2].
Amnézie je termín, kterým označujeme ztrátu deklarativní paměti na určité ohraničené období. Retrográdní amnézie se vztahuje na události, které předcházely poškození mozku. Naproti tomu anterográdní amnézie znamená neschopnost vybavit si děje a skutečnosti, které se odehrály po poškození hipokampu. Může se objevit při narušení krátkodobé paměti nebo přepisu do paměti dlouhodobé [2].
TGA je příkladem poruchy krátkodobé paměti s postižením ukládání nových informací po dobu záchvatu (anterográdní amnézie) a částečným narušením vybavování událostí před vznikem potíží (částečná retrográdní amnézie). Typický příznak onemocnění je neustálé opakování stejných dotazů a tvrzení. I po odeznění klinických příznaků mají pacienti na epizodu TGA trvale amnézii. Jak již z názvu vyplývá, jedná se o přechodný stav, který obvykle trvá 2 – 8 hod a nikdy nepřesahuje 24 hod [3].
Standardní diagnostická kritéria vytvořili Hodges a Warlow v roce 1990 [3], tato kritéria zahrnují:
- jednoznačné příznaky anterográdní amnézie, potvrzené přítomnými pozorovateli;
- absence poruchy vědomí či jiné kognitivní poruchy než amnézie;
- žádný fokální neurologický deficit;
- trvání příznaků do 24 hod;
- vyloučeno recentní trauma hlavy, nebyly zjištěny žádné znaky epilepsie nebo aktivní epilepsie v posledních dvou letech.
V literatuře uváděná incidence onemocnění se pohybuje od tří do osmi případů na 100 000 obyvatel za rok [4 – 6]. TGA obvykle postihuje jedince mezi 40 a 80 lety a přibližně stejným poměrem postihuje ženy i muže [7].
Příčina onemocnění není jednoznačně objasněna, existuje však několik teorií. Někteří autoři předpokládají, že příčinou TGA je arteriální ischemie [8 – 10], což dokládají zvýšeným výskytem cévních rizikových faktorů [10] a také přítomností malých lézí patologicky zvýšeného signálu v elokventních paměťových oblastech temporálního laloku a hipokampu na difuzně váženém obrazu (Diffusion ‑ Weighted Imaging; DWI) magnetické rezonance (MR) mozku [8]. V posledních letech se objevují studie, které ischemickou příčinu TGA spíše vyvracejí [11,12], případně prokazují odlišný podklad ischemie od pacientů s tranzitorní ischemickou atakou (TIA), a to ischemii způsobenou venózní kongescí či na podkladě vazospazmů [13,14]. V literatuře je často uváděna souvislost vzniku TGA s cerebrální venózní kongescí, která se vytváří na podkladě inkompetence chlopní vena jugularis interna s následným venózním refluxem během Valsalvova manévru [15 – 18].
Řada autorů zdůrazňuje zvýšenou incidenci migrény u pacientů s TGA, čímž poukazují na možnou souvislost těchto dvou jednotek [4,5,19,20]. Přestože existuje řada rozdílů mezi těmito diagnózami, jako je např. věk nástupu obtíží, počet recidiv a absence bolestí hlavy během TGA, uvažuje se o společném patofyziologickém podkladu, a to dysregulaci v oblasti mozkového kmene [19]. V minulosti byl zvažován i epileptický původ TGA [21,22]. Pantoni et al poukázali především na krátké epizody TGA (trvající méně než hodinu) a recidivující TGA související s možnou epileptickou etiologií [18]. V současnosti převládá názor, že klasická TGA nemá epileptický původ, o čemž svědčí i diagnostická kritéria, kde je epilepsie jejím vylučujícím kritériem [3]. Dalšími spouštěcími faktory TGA mohou být hyperventilace, potápění ve studené vodě [18], emoční stres, paradoxní embolizace cestou foramen ovale apertum (FOA) [3,23,24]. Saura et al publikovali kazuistiku, ve které popisují případ výskytu TGA po dobutamin‑atropinové zátěžové echokardiografii [25]. Existují práce popisující výskyt TGA v souvislosti s endoskopickými výkony. V roce 2006 publikovali Hiraga et al tři kazuistické případy vzniku TGA po gastroskopickém vyšetření [26]. Profice et al uvádějí kazuistiku 54leté pacientky, u níž došlo ke vzniku TGA v průběhu transezofageální echokardiografie (TEE). Anterográdní amnézie vznikla během provádění Valsalvova manévru, na jehož základě bylo následně prokázáno FOA [27].
I když byla TGA většinou považována za monofázické onemocnění, recidivující průběh není raritní. V limitovaném vzorku dosud publikovaných prací se riziko recidivy TGA pohybovalo mezi 5 a 18 % [3,5,6,20,28 – 30].
Etiopatogeneze recidivujících případů nebyla většinou systematicky hodnocena, někteří autoři uvádějí možnou genetickou predispozici. Corston et al popisují případ recidivující TGA u čtyř bratrů, kdy dva z nich prodělali dvě epizody a další dva prodělali tři epizody TGA [31]. Na možnou genetickou predispozici k vzniku TGA poukazují ve své práci i Segers ‑ van Rijn et al, jež publikují případ rodiny, jejíž pět členů prodělalo TGA (čtyři z osmi sourozenců a jejich matka). Někteří z nich měli recidivující formu TGA [32]. Formou kazuistiky byl publikován případ recidivující familiární TGA objevující se po vysazení betablokátoru u pacienta s anamnézou migrény [33]. Na souvislost recidivující TGA a migrény poukázala i práce Melo et al, kdy všichni pacienti s rekurentní TGA měli v předchorobí migrenózní cefaleu [20].
Cílem naší práce bylo zhodnocení výskytu a možných etiopatogenetických faktorů recidivující TGA. V průběhu let 2009 – 2014 bylo na naší klinice hospitalizováno celkem 55 pacientů s TGA, průměrný věk 65,7 (rozmezí 41 – 89), 34 žen a 21 mužů. Průměrný věk žen i mužů byl téměř totožný (ženy 63,9; muži 65,6).
Čtyři pacienti prodělali více než jednu epizodu TGA, což představuje 7,3 % nemocných. Tyto čtyři případy prezentujeme formou jednotlivých kazuistik. Podrobný přehled je uveden v tab. 1.
1. Podrobný přehled kazuistik. 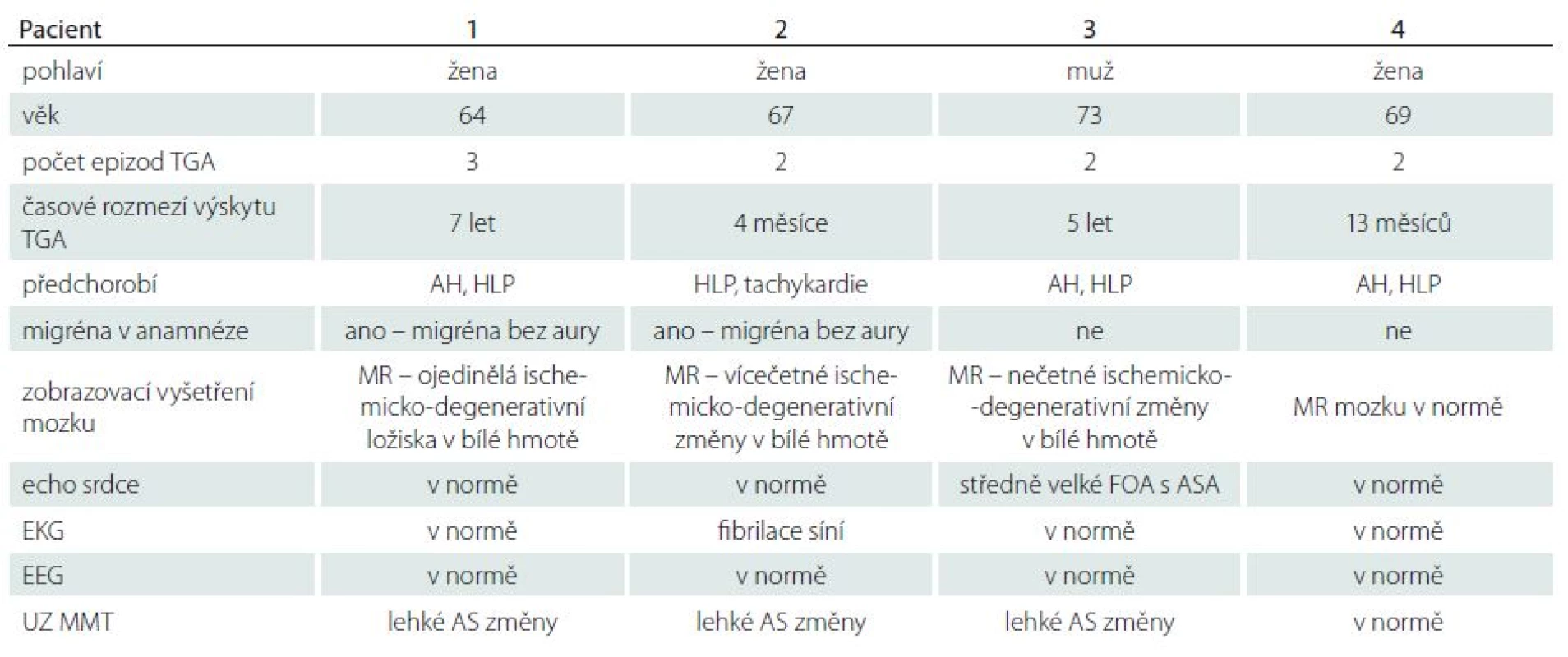
AH – arteriální hypertenze, AS – aterosklerotické, ASA – atriální septální aneuryzma, CT – počítačová tomografie, ECHO – echokardiografie, EEG – elektroencefalogram, EKG – elektrokardiogram, FOA – foramen ovale apertum, HLP – hyperlipidémie, MR – magnetická rezonance, TGA – tranzitorní globální amnézie, UZ MMT – ultrazvuk magistrálních mozkových tepen. Kazuistiky
Pacient 1
Pacientka (70 let) prodělala třikrát epizodu TGA v průběhu sedmi let (v 57, 62 a 64 letech). Doba trvání jednotlivých epizod byla 6 – 12 hod. V předchorobí se léčila s arteriální hypertenzí, hypercholesterolemií a od dětství trpěla migrénou bez aury. Provedená MR mozku prokázala drobná ischemicko‑degenerativní ložiska v bílé hmotě. Ultrazvuk magistrálních mozkových tepen (UZ MMT) prokázal lehké aterosklerotické změny, bez nálezu hemodynamicky významné stenózy. Elektroencefalogram (EEG) byl bez ložiskové, paroxyzmální či epileptické aktivity. V rámci pátrání po možné kardiologické etiologii bylo provedeno 24hod Holterovo monitorování EKG, které neprokázalo srdeční arytmii, a transtorakální echokardiografie byla s normálním nálezem. Původně zvažovaná TEE nebyla provedena pro špatnou toleranci vyšetření pacientkou. U této pacientky bylo pozoruhodným jevem úplné vymizení migrenózních atak v období klimakteria (od 52 let), ve kterém došlo k rozvoji recidivující TGA.
Pacient 2
Pacientka (67 let) byla hospitalizována pro epizodu TGA dvakrát v průběhu čtyř měsíců. Anamnesticky se léčila s hypercholesterolemií, migrénou bez aury a pro paroxyzmální supraventrikulární tachykardie užívala chronicky malou dávku betablokátoru. Obdobně jako u předchozího případu byl na MR mozku nález ischemicko‑degenerativních změn, zde byly vícečetné. UZ MMT taktéž prokázal lehké aterosklerotické změny, EEG vyšetření bylo s normálním nálezem. K recidivě TGA došlo v průběhu vyšetření TEE, kdy byl poprvé zachycen paroxyzmus fibrilace síní. TEE byla bez patologického nálezu. Pro nově zjištěnou paroxyzmální fibrilaci síní byla následně zavedena chronická antikoagulační terapie.
Pacient 3
Muž (73 let) byl přijat na Neurologickou kliniku LF MU a FN Brno pro příznaky TGA. Obdobné potíže prodělal již před pěti lety na dovolené v zahraničí. Doposud se léčil s arteriální hypertenzí a hyperlipidémií. MR mozku prokázala opět nespecifické ischemicko‑degenerativní změny v bílé hmotě hemisfér. Obdobně jako u předchozích případů byl UZ MMT s nálezem lehkých aterosklerotických změn bez hemodynamicky významných stenóz, EEG vyšetření neprokázalo epileptickou aktivitu. EKG Holter ukázal pouze trend k nižší tepové frekvenci, bez záchytu srdeční arytmie. Patologický nález byl ovšem objeven na TEE, kde bylo prokázáno středně velké FOA s atriálním septálním aneuryzmatem charakteru bidirekčního zkratu. FOA bylo velikosti 2 mm, levopravý zkrat s průnikem kontrastu spontánně, masivněji pak při Valsalvově manévru. Kardiologem byl indikován uzávěr FOA Amplatzerovým okludérem.
Pacient 4
Jako poslední případ představujeme 69letou pacientku, u níž se recidiva TGA vyskytla po 13 měsících od první epizody onemocnění. Byla sledována pro arteriální hypertenzi, hypercholesterolemii a osteoporózu. V tomto případě byly veškeré provedené vyšetřovací metody – MR mozku, UZ MMT, EEG i kardiologická vyšetření – bez průkazu patologie. Anamnesticky netrpěla na bolesti hlavy, přičemž oběma epizodám TGA předcházela intenzivní cefalea, která vznikla ráno po probuzení a přetrvávala i v průběhu poruchy krátkodobé paměti.
Diskuze
Údaje v literatuře i naše výsledky potvrzují vyšší výskyt recidivující TGA, než se dříve předpokládalo. V našem souboru se recidiva TGA vyskytla v 7,3 %, což je v souladu s literárními údaji.
Melo et al hodnotili recidivující TGA na podobném vzorku pacientů (51) a prokázali výskyt recidivy v 5,8 % [20]. Druhá epizoda onemocnění se vyskytla v intervalu od 4 do 60 měsíců od první epizody. Tyto údaje plně odpovídají i našim výsledkům, v nichž se první recidiva TGA objevila ve zcela totožném časovém rozmezí. V roce 1994 publikovali Melo et al práci obsahující větší soubor pacientů (103), z nichž 13 mělo recidivující formu onemocnění (12,6 %) [29]. Díky většímu vzorku pacientů bylo možné lépe hodnotit i počet recidiv TGA. Nejvíce zastoupeni byli pacienti s jednou recidivou TGA (osm případů), čtyři měli tři epizody a jeden pacient prodělal TGA čtyřikrát. Výskyt dvou epizod byl v rozmezí 3 – 60 měsíců. V našem souboru pouze jedna pacientka prodělala více recidiv onemocnění, u ostatních se vyskytla TGA jen dvakrát. Našim údajům odpovídají i výsledky práce Hodgese et al, kteří na větším souboru pacientů (114) prokázali recidivující TGA v 7,9 % [4]. Vyšší výskyt rekurentní TGA (18 %) doložili ve své práci Auyeung et al na vzorku 27 pacientů [30].
Všechny naše případy měly cévní rizikové faktory, arteriální hypertenzi a hyperlipidemii, vyjma jedné pacientky, která měla hyperlipidemii a paroxyzmální fibrilaci síní. Tyto skutečnosti poukazují na možnou ischemickou genezi TGA a její souvislost s TIA. Ischemickou etiologii můžeme předpokládat i vzhledem k nálezu ischemicko‑degenerativních ložisek na MR mozku u 75 % našich pacientů. Stejně tak práce Winbecka et al poukazuje na možnou souvislost TGA s TIA embolické etiologie či na podkladě venózní kongesce ve strukturách odpovědných za paměťové funkce [10]. V jeho práci porovnával pacienty s TGA a TIA. V obou skupinách se vyskytovalo podobné procento pacientů s cévními riziky: arteriální hypertenzí, hyperlipidemií a nikotinizmem. V obou sledovaných vzorcích pacientů byl taktéž zaznamenán podobný výskyt fibrilace síní (u TGA u 7 %, u TIA u 8 % pacientů). Ischemickou etiologii kardioembolické geneze předpokládáme u pacientky 2 našeho souboru, u které byl poprvé zachycen paroxyzmus fibrilace síní právě při vzniku druhé epizody TGA, jež vznikla čtyři měsíce po první. V anamnéze měla tato pacientka paroxyzmy supraventrikulární tachykardie, nelze ovšem vyloučit již dříve probíhající paroxyzmy fibrilace síní, které nebyly prokázány na Holterově monitorování EKG. Po zavedení chronické antikoagulační terapie byla pacientka bez další recidivy TGA. U této pacientky by bylo možné v případě druhé epizody TGA uvažovat i o souvislosti s endoskopickým výkonem, jelikož existují práce popisující výskyt TGA právě během těchto výkonů. Autoři Hiraga et al popisují vznik TGA během gastroskopie [26] a Profice et al publikovali kazuistiku vzniku TGA během TEE. V druhé uváděné práci se jednalo o pacientku, u níž bylo pomocí TEE prokázáno FOA, a lze tedy předpokládat i možnost kardioembolické geneze [27]. Možnost ischemické geneze TGA podporují také Yang et al, kteří prokázali na DWI léze v oblasti laterální porce hipokampu odpovídající cévnímu povodí [8].
Naproti tomu studie Hodgese et al tuto teorii nepodporuje. Prokázali signifikantně vyšší výskyt následné CMP či TIA ve skupině pacientů s TIA, v porovnání se skupinou s TGA [4].
V práci Paie et al se u dvou ze tří pacientů s recidivující TGA v následujícím období vyskytla CMP v intervalu 24 – 36 měsíců [28].
Možnou cévní etiologii charakteru paradoxní embolizace lze předpokládat u našeho pacienta 3, u kterého bylo prokázáno středně velké FOA s atriálním septálním aneuryzmatem charakteru bidirekčního zkratu. K průniku kontrastu docházelo spontánně, masivněji pak při Valsalvově manévru.
Paradoxní embolizaci prokázali Klötzsch et al, kteří vyšetřili 53 pacientů s TGA pomocí transkraniální dopplerovské sonografie s kontrastní látkou, u 55 % pacientů prokázal FOA ve srovnání s kontrolní skupinou, kde bylo FOA v 27 %. U více než třetiny pacientů předcházel rozvoji TGA Valsalvův manévr [23].
Z naší skupiny čtyř pacientů s recidivující TGA trpěly dvě pacientky na migrénu bez aury. Zajímavým případem je právě pacientka 1, u níž došlo ke dvěma recidivám TGA. Pacientka trpěla na menstruační migrénu a v době klimakteria došlo k úplné regresi migrenózních atak a nově se objevily epizody TGA. I u naší pacientky 4 lze předpokládat migrenózní etiologii vzhledem k přítomnosti cefaley doprovázející obě epizody TGA. V práci Melo et al všichni tři pacienti s recidivující formou TGA a polovina pacientů s jednou epizodou TGA měli v anamnéze migrénu [20]. Přestože jsou zde rozdíly v těchto dvou jednotkách, např. věk výskytu, počet recidiv, lze předpokládat jistou patofyziologickou souvislost. Hodges et al prokázali vyšší prevalenci migrény u pacientů s TGA (23 %) v porovnání s TIA (9 %) a zdravými kontrolami (6 %) [4].
U žádného z našich pacientů jsme neprokázali paroxyzmální epileptickou aktivitu, EEG bylo ve všech případech negativní. Stejné výsledky publikovali Melo et al, kde u pacientů s krátkými rekurentními epizodami TGA bylo pomýšleno na možnou epileptickou genezi, která nebyla potvrzena. Paroxyzmální epileptická aktivita nebyla detekována u žádného z nich [29].
V literatuře byly uváděny kazuistické případy familiární formy recidivující TGA. V rámci pátrání po možné genetické predispozici recidivující TGA jsme u žádného z našich pacientů neprokázali výskyt TGA u rodinných příslušníků.
Závěr
Výskyt recidivující TGA není vzácný a v našem souboru (7,3 %) odpovídá literárním údajům. Recidivy se objevují v období několika měsíců až let od první ataky. Etiopatogeneze se zřejmě neliší od nerecidivujících forem TGA. U našich pacientů byla zachycena možná souvislost s migrénou a TIA kardioembolické etiologie. U žádného z našich pacientů jsme neprokázali epileptickou genezi ani genetickou predispozici k TGA.
Přechodná ztráta paměti je velice stresující zkušenost jak pro pacienty, tak pro jejich příbuzné. Je potřeba věnovat vždy dostatek času na vysvětlení povahy onemocnění a upozornit i na možnost opakování příznaků.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 27. 5. 2015
Přijato do tisku: 6. 8. 2015
MUDr. Adéla Mitášová, Ph.D.
Neurologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: adela.mitasova@email.cz
Sources
1. Fisher CM, Adams RD. Transient global amnesia. Acta Neurol Scand 1964; 40 (Suppl 9): 1 – 83.
2. Hort J, Rusina R. Paměť a její poruchy. 1. vyd. Praha: Maxdorf 2007.
3. Hodges JR, Warlow CP. Syndromes of transient amnesia: towards a classification. A study of 153 cases. J Neurol Neurosurg Psychiatry 1990; 53(10): 834 – 843.
4. Hodges JR, Warlow CP. The aetiology of transient global amnesia. A case ‑ control study of 114 cases with prospective follow‑up. Brain 1990; 113(3):639 – 657.
5. Quinette P, Guillery ‑ Girard B, Dayan J, de la Sayette V, Marquis S, Viader F et al. What does transient global amnesia really mean? Review of the literature and thorough study of 142 cases. Brain 2006; 129(7): 1640 – 1658.
6. Berli R, Hutter A, Waespe W, Bachli EB. Transient global amnesia – not so rare after all. Swiss Med Wkly 2009; 139(19 – 20): 288 – 292.
7. Zeman AZ, Hodges JR. Transient global amnesia. Br J Hosp Med 1997; 58(6): 257 – 260.
8. Yang Y, Kim S, Kim JH. Ischemic evidence of transient global amnesia: location of the lesion in the hippocampus. J Clin Neurol 2008; 4(2): 59 – 66. doi: 10.3988/ jcn.2008.4.2.59.
9. Ay H, Furie KL, Yamada K, Koroshetz WJ. Diffusion ‑ weighted MRI characterizes the ischemic lesion in transient global amnesia. Neurology 1998; 51(3): 901 – 903.
10. Winbeck K, Etgen T, von Einsiedel HG, Röttinger M, Sander D. DWI in transient global amnesia and TIA: proposal for an ischemic origin of TGA. J Neurol Neurosurg Psychiatry 2005; 76(3): 438 – 441.
11. Romero JR, Mercado M, Beiser AS, Pikula A, Seshadri S,Kelly ‑ Hayes M et al. Transient global amnesia and neurologic events: the framingham heart study. Front Neurol 2013; 4 : 47. doi: 10.3389/ fneur.2013.00047.
12. Enzinger C, Thimary F, Kapeller P, Ropele S, Schmidt R,Ebner F et al. Transient global amnesia: diffusion ‑ weighted imaging lesions and cerebrovascular disease. Stroke 2008; 39(8): 2219 – 2225. doi: 10.1161/ STROKEAHA.107.508655.
13. Sander K, Sander D. New insights into transient global amnesia: recent imaging and clinical findings. Lancet Neurol 2005; 4(7): 437 – 444.
14. Menéndez González M, Rivera MM. Transient global amnesia: incerasing evidence of a venous etiology. Arch Neurol 2006; 63(9): 1334 – 1336.
15. Nedelmann M, Eicke BM, Dietrich M. Incerased incidence of jugular valve insufficiency in patiens with transient global amnesia. J Neurol 2005; 252(12): 1482 – 1486.
16. Schreiber SJ, Doepp F, Klingebiel R, Valdueza JM. Internal jugular vein valve incompetence and intracranial venous anatomy in transient global amnesia. J Neurol Neurosurg Psychiatry 2005; 76(4): 509 – 513.
17. Chung CP, Hsu HY, Chao AC, Chang FC, Sheng WY, Hu HH. Detection of intracranial venous reflux in patients of transient global amnesia. Neurology 2006; 66(12): 1873 – 1877.
18. Pantoni L, Lamassa M, Inzitari D. Transient global amnesia: a review emphasizing pathogenic aspects. Acta Neurol Scand 2000; 102(5): 275 – 283.
19. Schmidtke K, Ehmsen L. Transient global amnesia and migraine. A case control study. Eur Neurol 1998; 40(1): 9 – 14.
20. Melo TP, Ferro JM, Ferro H. Transient global amnesia. A case control study. Brain 1992; 115(1): 261 – 270.
21. Rowan AJ, Protass LM. Transient global amnesia: clinical and electroencephalographic findings in 10 cases. Neurology 1979; 29(6): 869 – 872.
22. Fisher CM. Transient global amnesia. Precipitating activities and other observations. Arch Neurol 1982; 39(10): 605 – 608.
23. Klötzsch C, Sliwka U, Berlit P, Noth J. An increased frequency of patent foramen ovale in patients with transient global amnesia. Analysis of 53 consecutive patients. Arch Neurol 1996; 53(6): 504 – 508.
24. Owen D, Paranandi B, Sivakumar R, Seevaratnam M. Classical diseases revisited: transient global amnesia. Postgrad Med J 2007; 83(978): 236 – 239.
25. Saura D, Peñafiel P, Morales A, Albert L, Martínez F, de la Morena G et al. Transient global amnesia after dobutamine – atropine stress echocardiography. Eur J Echocardiogr 2008; 9(4): 567 – 568.
26. Hiraga A, Matsunaga T. Transient global amnesia after gastroscopy. J Neurol Neurosurg Psychiatry 2006; 77(8): 995 – 996.
27. Profice P, Rizzello V, Pennestrì F, Pilato F, Della Marca G, Sestito A et al. Transient global amnesia during transoesophageal echocardiogram. Neurol Sci 2008; 29(6): 477 – 479. doi: 10.1007/ s10072 ‑ 008 ‑ 1034 ‑ y.
28. Pai MC, Yang SS. Transient global amnesia: a retrospective study of 25 patients. Zhonghua Yi Xue Za Zhi 1999; 62(3): 140 – 145.
29. Melo TP, Ferro JM, Paiva T. Are brief or recurrent transient global amnesias of epileptic origin? J Neurol Neurosurg Psychiatry 1994; 57(5): 622 – 625.
30. Auyeung M, Tsoi TH, Cheung CM, Fong DY, Li R, Chan JKet al. Association of diffusion weighted imaging abnormalities and recurrence in transient global amnesia.J Clin Neurosci 2011; 18(4): 531 – 534. doi: 10.1016/ j.jocn.2010.08.019.
31. Corston RN, Godwin‑Austen RB. Transient global amnesia in four brothers. J Neurol Neurosurg Psychiatry 1982; 45(4): 375 – 377.
32. Segers ‑ van Rijn J, de Bruijn SF. Transient global amnesia: a genetic disorder? Eur Neurol 2010; 63(3): 186 – 187. doi: 10.1159/ 000290249.
33. Vyhnalek M, Bojar M, Jerabek J, Hort J. Long lasting recurrent familiar transient global amnesia after betablocker treatment withdrawal. Neuro Endocrinol Lett 2008; 29(1): 44 – 46.
34. Schakelaar JH. Two attacks of transient global amnesia within a year: a case report. Cases J 2009; 2 : 6309. doi: 10.4076/ 1757 ‑ 1626 ‑ 2 ‑ 6309.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 5-
All articles in this issue
- Results of Early Endarterectomies after Transient Ischaemic Attack
- Methodology of Systematic Review Development I: the Effectiveness of Hyperbaric Oxygen Therapy on Mortality in Adults with Craniotrauma
- Non‑ organic Visual Loss in Children
- Skull‑ base Osteomyelitis Misdiagnosed and Treated as Neuroborreliosis – a Case Report
- Recurrent Transient Global Amnesia – Four Case Reports
- Hypoglossofacial Anastomosis – Three Case Reports
- Acute Hyperkinetic Syndromes Treated with Stereotactic Neurosurgery Intervention – Three Case Reports
- Diagnostic in Patient with Acute Vertigo
- Implementation Science
- Contribution of Olfactory Tests to Diagnosis of Neurodegenerative Diseases
- Differential Diagnosis of Tauopathies – a Clinical Approach
- Cognitive‑ communication Disorders in Patients with Dementia Due to Alzheimer’s Disease
- Normative Data for the Rey‑ Osterrieth Complex Figure Test in Older Czech Adults
- Calcifying Pseudoneoplasm of the Neural Axis – a Case Report
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostic in Patient with Acute Vertigo
- Recurrent Transient Global Amnesia – Four Case Reports
- Normative Data for the Rey‑ Osterrieth Complex Figure Test in Older Czech Adults
- Contribution of Olfactory Tests to Diagnosis of Neurodegenerative Diseases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

