-
Medical journals
- Career
Akutní hyperkinetické syndromy léčené stereotaktickým neurochirurgickým zákrokem – tři kazuistiky
Authors: A. Fečíková 1; R. Jech 1; J. Roth 1; M. Bareš 2; O. Černá 3; Z. Libá 4; D. Kemlink 1; J. Fiksa 1; A. Křepelová 5; D. Urgošík 1,6
Authors‘ workplace: Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze 1; 1. neurologická klinika LF MU a FN u sv. Anny v Brně 2; Klinika dětského a dorostového lékařství 1. LF UK a VFN v Praze 3; Klinika dětské neurologie 2. LF UK a FN v Motole, Praha 4; Ústav biologie a lékařské genetiky, 2. LF UK a FN v Motole, Praha 5; Stereotaktická a radiační neurochirurgie, Nemocnice Na Homolce, Praha 6
Published in: Cesk Slov Neurol N 2015; 78/111(5): 591-596
Category: Case Report
doi: https://doi.org/10.14735/amcsnn2015591Overview
Dyskinetické extrapyramidové syndromy mohou vzácně vést k akutnímu zhoršení do život ohrožujícího stavu, který si vyžádá hospitalizaci na jednotce intenzivní péče, hlubokou analgosedaci a umělou plicní ventilaci. V případě neúspěšnosti symptomatické farmakologické léčby lze uvažovat o stereotaktickém neurochirurgickém výkonu (pallidotomii nebo hluboké mozkové stimulaci). V příspěvku uvádíme naše dosavadní zkušenosti se třemi pacienty, kteří v akutní fázi dyskinetického syndromu takový výkon podstoupili. U dvou dětských pacientů (12 a 6 let) pro status dystonicus s geneticky verifikovanou hereditární generalizovanou dystonií (DYT ‑ 6 a DYT ‑ 1) byla provedena hluboká mozková stimulace vnitřního pallida a u jedné pacientky (21 let) s Huntingtonovou nemocí byla provedena pallidotomie pro akutní zhoršení generalizované chorey s rozvojem balizmu. Přes počáteční kritický stav došlo u všech tří pacientů v odstupu 1 – 6 týdnů od výkonu k významnému potlačení mimovolných pohybů. Stereotaktická neurochirurgická léčba by proto měla být zvažována jako metoda volby v terapii akutních, život ohrožujících hyperkinetických stavů, kde farmakologická terapie selhala.
Klíčová slova:
hluboká mozková stimulace – globus pallidus – pallidotomie – hyperkinetické syndromy – status dystonicus – chorea – balizmusÚvod
Status dystonicus neboli dystonická „bouře“ je život ohrožující stav, který je charakterizován náhlým zvýšením mimovolných svalových kontrakcí nebo výskytem tonických či fázických generalizovaných křečí, které mohou vzniknout vzácně u kteréhokoli dystonického syndromu bez ohledu na jeho etiologii. Stav byl prvně popsán Jankovicem a Pennem v roce 1982 [1] u osmiletého pacienta s hereditární generalizovanou dystonií. Hlavními spouštěcími faktory bývají infekce nebo úprava medikace [2]. Dalšími vyvolávajícími faktory může být trauma, chirurgická operace, anestezie, dekompenzace metabolického onemocnění, stres, bolest nebo minerálová nerovnováha [2,3]. U třetiny případů se vyvolávající faktor nepodaří nalézt [3]. Mezi léky považované za potencionální spouštěcí faktory patří pimozid, metoklopramid a paradoxně i klonazepam. Náhlé snížení nebo vysazení lithia, anticholinergik, tetrabenazinu, benzodiazepinů, perorálního či intratékálního baklofenu může také vést ke vzniku dystonického statu [2].
Pacient se status dystonicus by měl vždy být hospitalizován na jednotce intenzivní péče pro riziko respiračních komplikací, rabdomyolýzy a následného renálního selhání. Od roku 1984 do současností bylo publikováno do 100 případů pacientů se status dystonicus, u kterých se mortalita pohybovala kolem 10 % [2,3]. U většiny pacientů si klinický stav vyžádal myorelaxaci, hlubokou analgosedaci propofolem a barbituráty a umělou plicní ventilaci. U pacientů s těžkým subakutním horšením dystonie nebo u predystonické krize bývá doporučováno tlumení chloralhydrátem v kombinaci s klonidininem [2]. Při nedostatečném efektu je nutná další eskalace léčby včetně podání benzodiazepinů (nejčastěji midazolamu), případně propofolové kóma. Zlepšení dystonického statu bylo popsáno i po nasazení anticholinergik (obvykle trihexyfenidyl), dopaminových blokátorů (haloperidol) nebo tetrabenazinu [3,4]. Podání jiných benzodiazepinů (klonazepam, diazepam) může vést rovněž ke zlepšení [5], častěji však zůstává bez efektu [6]. S ojedinělým úspěchem byl v léčbě status dystonicus použit perorální baklofen a levodopa [4,5]. V případě selhání medikamentózní terapie je vhodné uvažovat o invazivní léčbě – hluboké mozkové stimulaci (Deep Brain Stimulation; DBS) [2,5,6], pallidotomii [5] nebo intratékální aplikaci baklofenu pomocí pumpy [3]. DBS se v terapii dystonie používá od roku 1999 [7], kdy byly intrakraniální elektrody oboustranně implantovány do vnitřního pallida (GPi) s následným zlepšením klinického stavu. DBS GPi se doposud běžně používá v symptomatické léčbě různých druhů dystonických syndromů.
Další potenciálně život ohrožující hyperkinetickým stavem je akutní zhoršení choreatických dyskinezí do obrazu vyčerpávajících balistických pohybů. Tento stav může nastat u neurodegenerativních onemocnění, které se klinicky se projevují choreou (např. Huntingtonova nemoc, dentato ‑ rubro‑pallidoluysiánská degenerace, neuroakantocytóza), nebo u ischemických lézí bazálních ganglií, kdy se dyskineze manifestují zpravidla asymetricky v podobě hemibalizmu. K ovlivnění masivních choreatických dyskinezí u Huntingtonovy nemoci bývá nejčastěji používán tetrabenazin, risperidon, olanzapin, haloperidol a benzodiazepiny [8]. Při farmakorezistenci bývá nutná hluboká analgosedace propofolem nebo fenobarbitalem a event. následná indikace neurochirurgické léčby – zavedení DBS [9] anebo pallidotomie [10]. Terapeutický postup shrnuje tab. 1.
Table 1. Terapeutický postup v léčbě status dystonicus. 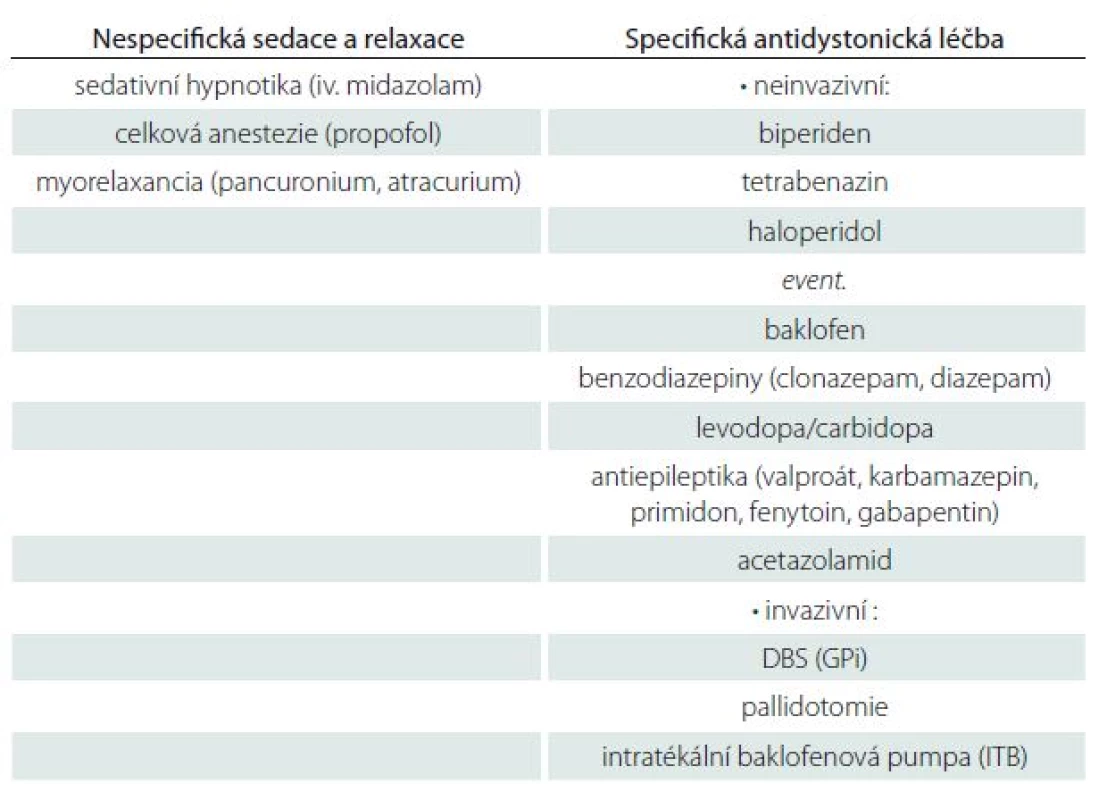
Upraveno dle [2], modifikováno dle dostupností preparátů v České republice a Slovenské republice. V práci uvádíme naše dosavadní zkušenosti se třemi pacienty, u kterých se v období let 2007 – 2015 rozvinul akutní obraz závažného dyskinetického syndromu, který byl úspěšně léčen stereotaktickým výkonem. Šlo o dva pacienty s diagnózou hereditární generalizované dystonie s rozvojem status dystonicus a o pacientku s Huntingtonovou nemocí s akutním zhoršením generalizované chorey.
Pacient 1
První případ je 12letý chlapec s geneticky verifikovanou hereditární generalizovanou dystonií (DYT ‑ 6, mutace c.89C>G v exonu 2genu pro thanatos asociovaný protein 1; THAP1) [11]. Identická symptomatická mutace byla zjištěna i u jeho sestry. Asymptomatická mutace byla potvrzena také u matky nemocného, jejích dvou sester, jejího otce a strýce. První příznaky se u pacienta manifestovaly v osmi letech, kdy se objevila písařská křeč na pravé ruce. V průběhu dalších tří let došlo k rozvoji dystonického stáčení levé dolní končetiny, zhoršení řeči a tremoru hlavy. V 11 letech nastala progrese, s manifestací cervikální a trupové dystonie. Ve 12 letech stav v průběhu jednoho týdne progredoval do status dystonicus, ve kterém dominovala těžká fázická trupová dystonie s opistotonem a retrocollis (obr. 1a). Motorické skóre Burke ‑ Fahn ‑ Marsden Dystonia rating Scale (BFMDS) dosáhlo 41 bodů. Vyvolávající faktor akutního zhoršení dystonie nebyl zjištěn. Perorální terapie baklofenem (60 mg/ den) a klonazepamem (3 mg/ den) byla bez výraznějšího efektu. Stav si vyžádal hlubokou analgosedaci (sufentanil, midazolam, propofol), umělou plicní ventilaci a oběhovou podporu. Léčba tetrabenazinem (25 mg/ den) a vysokými dávkami biperidenu (18 mg/ den) zůstala bez odezvy. Při těžkých záchvatech dystonických křečí bylo bolusově podáváno myorelaxans (atracurium). Pro neúspěšnost farmakologické léčby bylo po dvou týdnech od vzniku status dystonicus přistoupeno k provedení bilaterální DBS s cílem ve vnitřním pallidu (GPi) (obr. 1b, c). Operace proběhla v celkové endotracheální anestezii za použití stereotaktického Leksellova rámu s vizualizací cíle na předoperační magnetické rezonanci (MR). Definitivní místo pro implantaci permanentních elektrod (Medtronic, 3389) bylo vyhledáno pomocí detekce neuronální aktivity ze tří exploračních mikroelektrod (mediální, centrální a laterální). Obě permanentní elektrody byly během téhož operačního výkonu připojeny ke dvěma neurostimulátorům (Medtronic, Soletra) umístěným do podkoží levé a pravé podklíčkové oblasti. Stimulace byla zahájena bezprostředně po výkonu (stimulační parametry iniciálně s amplitudou 0,9 V, délkou pulzu 270 µs a frekvencí 100 Hz). Z důvodu dlouhodobé umělé plicní ventilace byla 10. den od operace provedena tracheostomie. Ke klinickému zlepšování došlo přibližně až za šest týdnů od zahájení stimulace. Devět a půl týdne po operaci byla tracheostomie zrušena a pacient pozvolna probuzen. Pacient byl nadále ponechán na terapii tetrabenazinem, baklofenem a biperidenem a pro depresivní symptomatiku byla zahájena terapie sertralinem. Deset týdnů od zavedení DBS GPi došlo k natolik významnému zlepšení dystonických projevů, že pacient mohl být propuštěn z nemocničního zařízení. Stimulační parametry byly během následujícího roku postupně navýšeny na amplitudu 1,7 V vlevo a 2,1 V vpravo (450 µs, 250 Hz), což bylo doprovázeno dalším zlepšováním klinického stavu (BFMDS skóre je 1 bod). S časovým odstupem dvou let od zavedení DBS došlo k mírnému zhoršení dystonie na pravostranných končetinách a k progresi dysartrie. V prvních letech od zavedení DBS pacient reagoval na vypnutí stimulace akutní deteriorací cervikální dystonie, což se při kontrolním vypnutí stimulace nyní již nestává. Pacientovi je v současné době již 20 let a pomocí DBS GPi je úspěšně léčen osmým rokem. V mezidobí prodělal výměnu dvou stimulátorů za dobíjitelný neurostimulátor (Medtronic, RC). Pozitivní efekt DBS GPi nadále přetrvává i přes jisté zhoršení cervikální dystonie a akrální dystonii horních končetin (aktuální BFMDS skóre je 14 bodů). Nadále užívá perorální biperiden (6 mg/ den) a sertralin (50 mg/ den).
Image 1. Pacient 1 (DYT-6) s rozvojem status dystonicus. 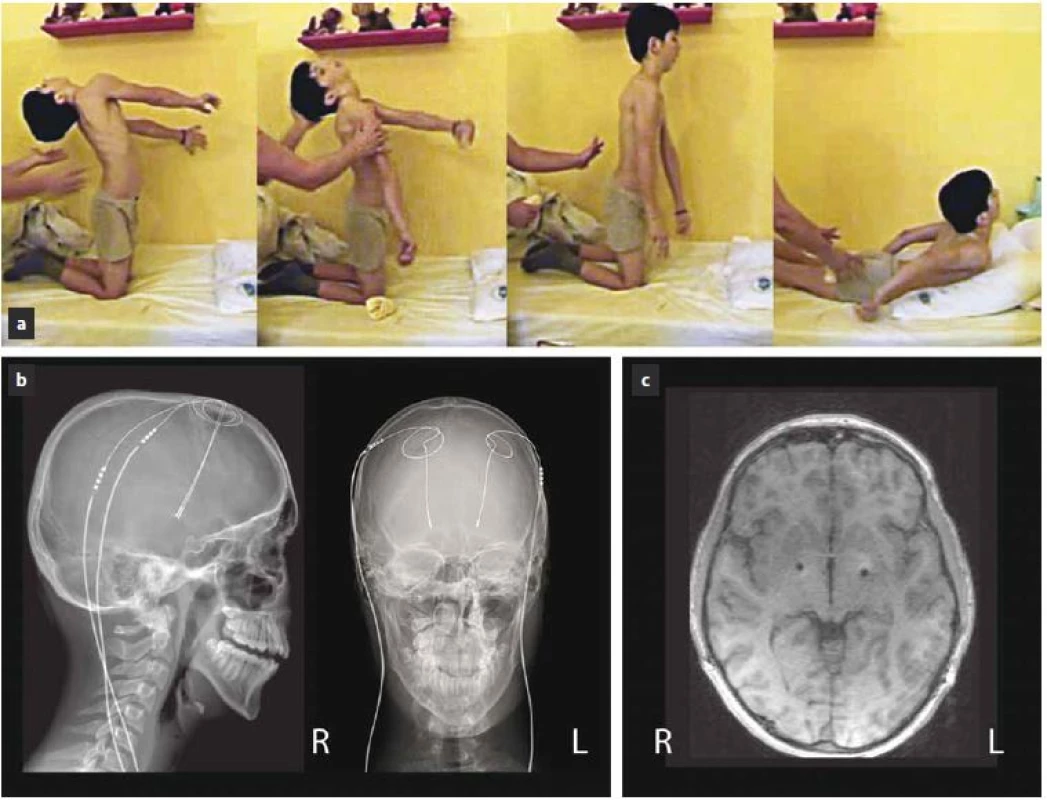
Obr. 1a) Status dystonicus s projevy těžké fázické trupové dystonie s opistotonem a retrocollis bezprostředně před zahájením dlouhodobé analgosedace (tzn. dva týdny před operací). Obr. 1b) RTG snímek s časovým odstupem 1,5 roku od operace zobrazující zavedené kvadripolární elektrody do GPi bilaterálně. Obr. 1c) T1 vážené MR snímky mozku v axiální rovině s odstupem 1,5 roku se susceptibilními artefakty ze zavedených elektrod v GPi: x = 17 mm laterálně (vlevo a vpravo) od střední čáry, y = 3 mm před polovinou spojnice AC–PC (přední a zadní komisury), z = 2,5 mm pod AC–PC spojnicí. Pacient 2
Druhý případ je šestiletý chlapec s geneticky verifikovanou hereditární generalizovanou dystonií (DYT ‑ 1), u kterého byla prokázaná mutace c.907_909delGAG (p.Glu303del) v exonu 5 genu TOR 1A v heterozygotním stavu. Stejná, avšak asymptomatická mutace byla prokázána u jeho otce a strýce. K rozvoji prvních symptomů došlo u pacienta v souvislosti s lehkou respirační infekcí, kdy se u něj objevilo dystonické stáčení hlavy doleva a neobratnost levé horní končetiny. Pro dyskineze byla zahájena terapie biperidenem (1 mg/ den) vedoucí ke zmírnění příznaků. Po třech týdnech byl biperiden postupně vysazen. Dva měsíce od objevení se prvních příznaků a šest dnů od vysazení biperidenu došlo během několika dní k rozvoji těžkého generalizovaného choreodyskinetického syndromu s dominantní dystonií trupu a s balistickými pohyby končetin. Terapie levodopou po dobu jednoho měsíce (dávka nezjištěna) byla zcela bez efektu. Dystonicko‑dyskinetický syndrom postupně progredoval do obrazu status dystonicus, ve kterém dominovaly kontinuální extenční dystonické stahy trupu, které měly fázický charakter (odhad BFMDS z videozáznamu na 49 bodů) (obr. 2a). Měsíc byla zkoušena kombinace biperidenu s levodopou a benzodiazepiny (midazolam, diazepam, klonazepam) jen s malým efektem. Dále bylo pokračováno v terapii chloralhydrátem, tiapridem a fenobarbitalem. Postupně došlo k celkovému vyčerpání organizmu, rozvoji rabdomyolýzy a oligurii až anurii a pacienta bylo nutné uvést do hluboké analgosedace s umělou plicní ventilací. Pro vyčerpané možnosti farmakologické léčby bylo měsíc od vzniku dystonického statu přistoupeno k provedení DBS GPi. Operační výkon proběhl v celkové anestezii, při kterém byla do posteroventrální části GPi oboustranně zavedena kvadripolární elektroda (Medtronic 3389) (obr. 2b, c). Operace proběhla standardním postupem pomocí stereotaktického Leksellova rámu s MR navigací a registrací neuronálního signálu s použitím pětice mikroelektrod. V rámci stejného výkonu proběhla rovněž implantace dobíjitelného neurostimulátoru (Medtronic, RC Activa) do levé podklíčkové krajiny. Neurostimulace byla zahájena ještě tentýž den po operaci (proud 0,5 mA bilaterálně, šířka pulzu 120 µs, frekvence 130 Hz). Zlepšení trupové dystonie bylo pozorováno již během následujícího týdne, přičemž devátý den od operace byl pacient extubován. Pooperační průběh byl komplikován toxoalergickou reakcí na oxacilin, který byl podán jako prevence možných infekčních komplikací. Zlepšování dystonických projevů pokračovalo s dalším navyšováním stimulačních parametrů na distálním kontaktu v monopolárním zapojení na současných 2,4 mA, 120 µs a 130 Hz bilaterálně. Zatímco tři měsíce od zahájení DBS GPi byla u pacienta přítomna mírná deviace trupu doleva a lehká dystonie prstů levé ruky (BFMDS skóre 3 body), s odstupem dalších devíti měsíců trupová dystonie zcela vymizela. V současnosti přetrvává jen lehká neobratnost levé ruky. Medikamentózní léčba (fenobarbital, fluoxetin, klonazepam) byla postupně zcela vysazena. Ke zhoršení kognitivního stavu nedošlo, chlapec je schopen nástupu do první třídy základní školy v běžném termínu.
Image 2. Pacient 2 (DYT-1) s rozvojem status dystonicus. 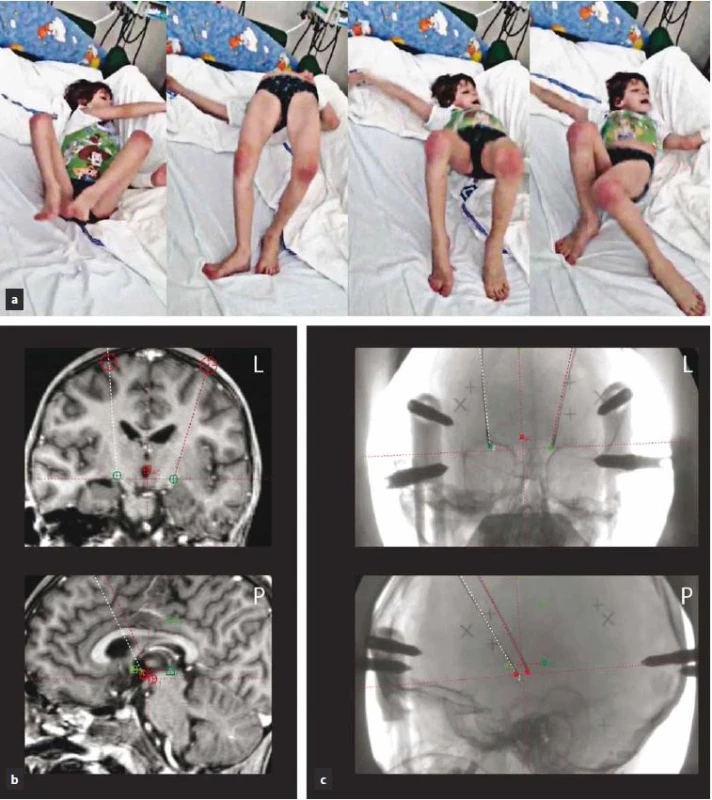
Obr. 2a) Status dystonicus s projevy těžké fázické trupové dystonie s opistotonem a balistickými pohyby končetin. Obr. 2b) Zobrazení cíle v GPi s vizualizací v systému SurgiPlan 10.0 Software (Elekta, Švédsko) na předoperačním T1 váženém MR snímku – cíl vlevo: x = 17,5 mm laterálně od střední čáry, y = 2,5 mm před středem spojnice AC–PC (přední a zadní komisury), z = 4,5 mm pod AC–PC spojnicí, cíl vpravo: x = 17,5 mm laterálně od střední čáry, y = 2,5 mm před středem spojnice AC–PC, z = 3,8 mm pod AC–PC spojnicí. Obr. 2c) Intraoperační RTG snímky v boční a předozadní projekci znázorňující implantované kvadripolární elektrody včetně původně plánované trajektorie (tečkovaná čára). Pacient 3
Jedná se o 21letou ženu s juvenilní formou Huntingtonovy nemoci (58 repetic CAG tripletu), jejíž matka na stejnou nemoc zemřela. První symptomy se u pacientky objevily v 18 letech a zprvu měly charakter akrálních choreo ‑ myoklonických záškubů končetin. Později se objevilo zhoršení kognitivních funkcí. Léčba byla zahájena risperidonem (3 mg/ den), escitalopramem (10 mg/ den) a amantadinem (400 mg/ den). Pro nedostatečnou efektivitu, vznik polékové hyperprolaktinemie a amenorey byl risperidon po dvou letech nahrazen tetrabenazinem. Pro myoklonickou složku dyskinezí byl přidán klonazepam (1,5 mg/ den). I přes podávání tetrabenazinu (125 mg/ den) došlo během následujícího roku k postupnému zhoršování dyskinezí a posturální stability. Tetrabenazin byl následně nahrazen haloperidolem (9 mg/ den) jako lékem poslední volby v kombinaci s vyšší dávkou klonazepamu (6 mg/ den). Po třech letech od vzniku prvního příznaku onemocnění došlo u pacientky v průběhu několika dnů k rozvoji generalizovaných choreobalistických dyskinezí končetin doprovázených těžkou choreodystonií trupu. V důsledku dyskinezí nebyla pacientka schopna jakéhokoliv volního pohybu, nemohla komunikovat a ani se udržet v sedu. Pro riziko pádu v důsledku extrémní intenzity pohybů mohla jen ležet na matraci položené na podlaze. Termín popisující intenzitu dyskinezí odpovídal těžkému „status quadrubalisticus“.
V tomto stavu byla přijata na jednotku intenzivní péče a tam byla intubována a tlumena kombinací fenobarbitalu, midazolamu a propofolu. Pokračovalo se v terapii klonazepamem (6 mg/ den) a haloperidolem s postupnou redukcí dávky (z 9 mg na 1,5 mg). Nově byl nasazen valproát (1 800 mg/ den) a amantadin (nejdříve intravenózně v dávce 500 ml/ den, následně perorálně 300 mg/ den). Poté došlo k rozvoji rabdomyolýzy a infekčních komplikací. Pro celkové zhoršení stavu a neúspěch farmakologické léčby byla pacientka 11. den od akutního zhoršení indikována k provedení bilaterální termoléze GPi (pallidotomie). Operace proběhla v celkové endotracheální anestezii. Léze byla provedena unipolární radiofrekvenční elektrodou (TCU 003, Fisher ‑ Leibinger, max. teplota 70 °C/ 60 s) pomocí Leksellova stereotaktického rámu a navigací dle předoperační MR (obr. 3a). Bezprostředně po výkonu se u pacientky objevila přechodná deviace bulbů doprava s oboustrannou areaktivní mydriázou. CT mozku bylo bez známek intrakraniálního krvácení. Příznaky postupně odezněly a pacientka byla extubována třetí den po výkonu. Již tehdy byla patrna výrazná redukce choreatických dyskinezí. Pooperační průběh byl komplikován dvěma epizodami aspirační pneumonie. V cílových oblastech postupně došlo ke vzniku hypodenzních lezí (obr. 3b). Pacientka byla propuštěna dva měsíce po provedení pallidotomie zcela bez choreatických dyskinezí. Šestnáct měsíců po provedeném stereotaktickém zákroku je pacientka stále bez chorey. Z důvodu základního onemocnění u ní dominuje těžký kognitivní deficit, dysartrie, dysfagie a těžká fixní akrální dystonie horních a středně těžká dystonie dolních končetin. Kvůli dystonii již není schopna samostatné chůze ani stoje. Na posteli se sama posadí. Komunikuje pomocí několika dysartrických slov nebo za použití tabulky s písmeny.
Image 3. Pacientka 3 (Huntingtonova nemoc) s rozvojem těžkých kvadrubalistických dyskinezí. 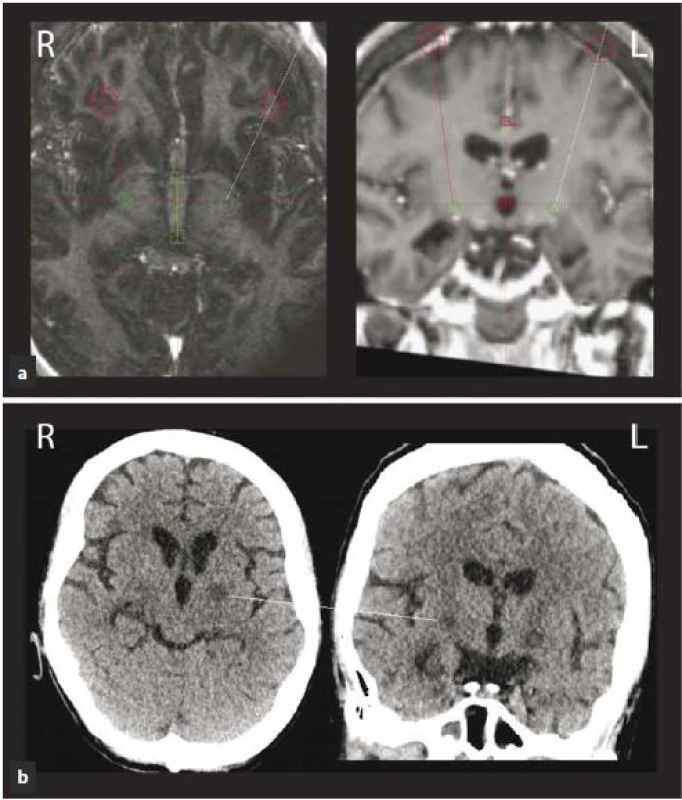
Obr. 3a) Předoperační MR snímky s vyznačením cíle pro pallidotomii v plánovacím systému SurgiPlan 10.0, cíl v GPi vlevo: x = 19,0 mm laterálně od střední čáry, y = 2,5 mm před středem spojnice AC–PC (přední a zadní komisury), z = 2 mm pod AC–PC spojnicí, cíl v GPi vpravo: x = 20 mm od střední čáry, y = 2,5 mm před středem spojnice AC–PC, z = 2 mm pod AC–PC spojnicí. Obr. 3b) Nativní CT v axiálních a koronálních řezech první den po operaci, přímka ukazuje místa elektrokoagulace (termoléze) v GPi. Závěr
V naší práci uvádíme tři případy akutních život ohrožujících hyperkinetických stavů, které si vyžádaly hospitalizaci na jednotce intenzivní péče, hlubokou analgosedaci, umělou plicní ventilaci a rozsáhlou farmakologickou léčbu. Vzhledem k farmakorezistenci hyperkinetického syndromu následované celkovým vyčerpáním organizmu, rozvojem rabdomyolýzy a infekčních komplikací byl u všech tří pacientů indikován stereotaktický výkon v části vnitřního pallida definovaném dle Coubese et al [12]. U dvou pacientů se status dystonicus byla provedena oboustranná DBS GPi a u pacientky s akutním zhoršením balistických dyskinezí byla provedena oboustranná pallidotomie. U všech pacientů došlo následně k výrazné redukci hyperkinetických symptomů.
Zatímco v léčbě dystonického statu má DBS GPi již své nezastupitelné místo [2], v terapii akutního kvadrubalistického syndromu neexistují jednoznačná doporučení. Doposud bylo publikováno několik sporadických případů s dobrým efektem pallidotomie [10] či hluboké mozkové stimulace [9]. Naše kazuistiky předchozí dobré zkušenosti potvrzují. Stereotaktický neurochirurgický výkon na vnitřním pallidu by měl být bezodkladně indikován nejen u pacientů se status dystonicus, ale i u akutně vzniklých, život ohrožujících choreobalistických dyskinezí.
Podpořeno grantem IGA MZ ČR NT12282 - 5, výzkumným projektem Univerzity Karlovy PRVOUK‑P26/ LF1/ 4.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 24. 8. 2015
Přijato do tisku: 23. 9. 2015
prof. MUDr. Robert Jech, Ph.D.
Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze
Kateřinská 30
128 21 Praha 2
e-mail: jech@cesnet.cz
Sources
1. Jankovic J, Penn AS. Severe dystonia and myoglobinuria. Neurology 1982; 32(10): 1195 – 1197.
2. Allen NM, Lin JP, Lynch T, King MD. Status dystonicus: a practice guide. Dev Med Child Neurol 2014; 56(2): 105 – 112. doi: 10.1111/ dmcn.12339.
3. Fasano A, Ricciardi L, Bentivoglio AR, Canavese C, Zorzi G,Petrovic I et al. Status dystonicus: predictors of outcome and progression patterns of underlying disease. Mov Disord 2012; 27(6): 783 – 788. doi: 10.1002/ mds.24981.
4. Manji H, Howard RS, Miller DH, Hirsch NP, Carr L, Bhatia Ket al. Status dystonicus: the syndrome and its management. Brain 1998; 121(2): 243 – 252.
5. Teive HA, Munhoz RP, Souza MM, Antoniuk SA, Santos ML, Teixeira MJ et al. Status Dystonicus: study of five cases. Arq Neuropsiquiatr 2005; 63(1): 26 – 29.
6. Franzini A, Cordella R, Rizzi M, Marras CE, Messina G, Zorzi G et al. Deep brain stimulation in critical care conditions. J Neural Transm 2014; 121(4): 391 – 398.
7. Kumar R, Dagher A, Hutchison WD, Lang AE, Lozano AM. Globus pallidus deep brain stimulation for generalized dystonia: clinical and PET investigation. Neurology 1999; 53(4): 871 – 874.
8. Frank S. Treatment of Huntington‘s disease. Neurotherapeutics 2014; 11(1): 153 – 160. doi: 10.1007/ s13311 ‑ 013 ‑ 0244 ‑ z.
9. Biolsi B, Cif L, Fertit HE, Robles SG, Coubes P. Long‑term follow‑up of Huntington disease treated by bilateral deep brain stimulation of the internal globus pallidus. J Neurosurg 2008; 109(1): 130 – 132. doi: 10.3171/ JNS/ 2008/ 109/ 7/ 0130.
10. Slavin KV, Baumann TK, Burchiel KJ. Treatment of hemiballismus with stereotactic pallidotomy. Case report and review of the literature. Neurosurg Focus 2004; 17(1): E7.
11. Jech R, Bareš M, Křepelová A, Urgošík D, Havránková P,Růžička E. DYT 6 – a novel THAP1 mutation with excellent effect on pallidal DBS. Mov Disord 2011; 26(5): 924 – 925. doi: 10.1002/ mds.23599.
12. Coubes P, Vayssiere N, El Fertit H, Hemm S, Cif L, Kienlen J et al. Deep brain stimulation for dystonia. Surgical technique. Stereotact Funct Neurosurg 2002; 78(3 – 4): 183 – 191.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 5-
All articles in this issue
- Výsledky včasnej karotickej endarterektómie po tranzitornej ischemickej atake
- Metodologie tvorby systematických review I: Efekt hyperbarické oxygenoterapie na úmrtnost pacientů po kraniotraumatu
- Psychogenní poruchy vidění u dětí
- Osteomyelitida baze lební mylně léčená jako neuroborrelióza – kazuistika
- Recidivující tranzitorní globální amnézie – čtyři kazuistiky
- Hemihypoglossofaciální anastomóza – tři kazuistiky
- Akutní hyperkinetické syndromy léčené stereotaktickým neurochirurgickým zákrokem – tři kazuistiky
- Diagnostika pacienta s akutní závratí
- Implementační věda
- Přínos vyšetření čichu pro diagnostiku neurodegenerativních onemocnění
- Diferenciální diagnostika tauopatií – klinický pohled
- Kognitívno‑ komunikačné poruchy u pacientov s demenciou pri Alzheimerovej chorobe
- Normativní studie testu Reyovy‑ Osterriethovy komplexní figury v populaci českých seniorů
- Mozkový kámen – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika pacienta s akutní závratí
- Recidivující tranzitorní globální amnézie – čtyři kazuistiky
- Normativní studie testu Reyovy‑ Osterriethovy komplexní figury v populaci českých seniorů
- Přínos vyšetření čichu pro diagnostiku neurodegenerativních onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

