-
Medical journals
- Career
Extrémna hypertrofia periférnych nervových štruktúr pri CIDP – kazuistika
Authors: J. Michalik 1; E. Kurča 1; M. Hladká 2; B. Hofericová 1; V. Nosáľ 1; M. Grofik 1; E. Kantorová 1; M. Adámková 1
Authors‘ workplace: JLF UK a UN Martin Neurologická klinika 1; JLF UK a UN Martin Rádiologická klinika 2
Published in: Cesk Slov Neurol N 2011; 74/107(1): 72-75
Category: Case Report
Overview
Chronická zápalová demyelinizačná polyradikuloneuropatia (chronic inflammatory demyelinating polyradiculoneuropathy, CIDP) predstavuje autoimunitné ochorenie periférneho nervového systému charakterizované obyčajne chabou kvadruparézou spojenou s poruchou povrchovej aj hlbokej citlivosti a možným postihnutím kraniálnych nervov. Okrem klinického obrazu sa v diagnostike CIDP používa elektromyografia (EMG), vyšetrenie cerebrospinálneho likvoru, biopsia nervu, vyšetrenie periférnych nervových štruktúr magnetickou rezonanciou (MR) a posúdenie vývoja klinického stavu vo vzťahu k použitej imunosupresívnej a imunomodulačnej liečbe. MR vyšetrenie umožňuje včasnú detekciu hypertrofie periférnych nervových štruktúr, ktorá nie je zriedkavá. V našej kazuistike predstavujeme prípad CIDP s ojedinelou hypertrofiou periférnych nervových štruktúr extrémnych rozmerov.
Klíčová slova:
chronická zápalová demyelinizačná polyneuropatia – hypertrofia – magnetická rezonanciaÚvod
Chronická zápalová demyelinizačná polyradikuloneuropatia (CIDP) je súčasťou skupiny imunitne podmienených demyelinizačných alebo demyelinizačne-axonálnych polyneuropatií s chronickým priebehom. Na patogenéze CIDP sa spolupodieľa aberantná celulárna a humorálna imunitná odpoveď cielená proti antigénom periférnych nervových štruktúr s ich následnou perivaskulárnou a intersticiálnou infiltráciou zápalovými T bunkami a makrofágmi. Dôsledkom inflamácie je segmentálna demyelinizácia periférnych nervových štruktúr spolu s možným zánikom axónov a ložiskovými nekrózami tkaniva, ale aj procesy remyelinizácie a patologickej reaktívnej hypertrofie. Stanovenie diagnózy CIDP je dôležité, nakoľko klinický obraz CIDP je rôznorodý a neexistuje jednoznačný biologický marker tejto nozologickej jednotky, ktorá je ale potenciálne terapeuticky ovplyvniteľná imunosupresívnymi a imunomodulačnými postupmi.
Epidemiológia, klinický obraz, pomocné vyšetrenia a liečba
CIDP postihuje mužov a ženy v pomere približne 2 : 1. Jedná sa o ochorenie všetkých vekových skupín. Najčastejšie vzniká CIDP medzi 50. a 60. rokom života, pričom asi 10 % z celkového počtu prípadov začína v detskom veku.
Klinický obraz obyčajne pozostáva z pomaly progredujúceho (najmenej dva mesiace) proximálneho aj distálneho zmiešaného symetrického kvadrupoškodenia v zmysle chabej periférnej obrny a asociovanej poruchy citlivosti pre všetky kvality s možným poškodením hlavových nervov a zároveň bez poškodenia zvieračov. Okrem uvedeného typického klinického obrazu CIDP poznáme aj atypické formy CIDP a diagnózu vylučujúce klinické okolnosti.
Z pomocných vyšetrení zohráva kľúčovú úlohu v diagnostike CIDP elektrofyziológia. Cieľom elektroneurografických kondukčných štúdií (distálne latencie, rýchlosť vedenia motorickými a senzitívnymi vláknami, charakteristika F odpovedí, kondukčné bloky, temporálna disperzia CMAP, trvanie distálnych CMAP) je preukázanie najmenej jedného ložiska presvedčivej demyelinizácie. Dve ložiská demyelinizácie spolu so zodpovedajúcim klinickým obrazom postačujú podľa kritérií EFNS k definitívnej diagnóze CIDP [1]. K podporným pomocným vyšetreniam radíme:
- vyšetrenie likvoru s nálezom proteinocytologickej disociácie;
- MR vyšetrenie periférnych nervových štruktúr s obrazom hypertrofie a ich možným patologickým sýtením po podaní gadolínia;
- biopsia nervu s nálezom demyelinizačných a remyelinizačných zmien a možným úbytkom axónov.
V 10 % prípadov je hypertrofia periférnych nervov detegovateľná klinickým vyšetrením aspekciou a palpáciou. MR vyšetrením je možné detegovať hypertrofiu periférnych nervových štruktúr až v 50 % pacientov, a to obzvlášť v prípadoch s dlhotrvajúcim priebehom ochorenia. Jedná sa o hypertrofiu miechových koreňov, brachiálneho a lumbosakrálneho plexu, kraniálnych, interkostálnych a ďalších periférnych nervov. Hypertrofiu cervikálnych miechových koreňov je možné zistiť aj ultrazvukovým vyšetrením (UZ) [2]. Biopsia nervu môže byť prínosom pri vylučovaní alternatívnych príčin polyneuropatie (napr. amyloidóza, vaskulitídy, iné hereditárne alebo toxické neuropatie).
Liečba CIDP zásadne alebo čiastočne zlepšuje stav až v 70 % prípadov. K liečbe CIDP v rámci medicíny založenej na dôkazoch radíme steroidy (prednizón), humánny polyklonálny imunoglobulín (IVIG) a plazmaferézu. V terapii CIDP sa používajú aj ďalšie imunosupresívne a imunomodulačné postupy (napr. azatioprín, cyklofosfamid, cyklosporín A, interferon a-2a, mycophenolat mofetil, rituximab).
Kazuistika
Uvádzame kazuistiku 59-ročnej pacientky s 10 rokov trvajúcou anamnézou ťažkostí. V popredí klinického obrazu bola symetrická progredujúca kvadruparéza periférneho typu s predominujúcim ťažkým poškodením dolných končatín a intermitentnými relapsmi ochorenia. Manifestné poškodenie kraniálnych nervov nebolo prítomné. Ďalej sme konštatovali zníženie povrchovej aj hlbokej citlivosti, neuropatické bolesti a ataxiu postoja a chôdze. V poslednom období pacientka udávala výraznú lumbalgiu s difúznou propagáciou bolesti do dolných končatín. Miera bolesti významne narastala pri vzostupe intraabdominálneho tlaku (napr. pri defekácii). Stupeň funkčného zneschopnenia pacientky bol ťažký. Pacientka bola schopná samostatnej chôdze s oporou na krátku vzdialenosť (relatívna samostatnosť v rámci bytovej jednotky) a bolesti rovnako zásadne znižovali kvalitu jej života (napr. sťaženie až znemožnenie spánku).
EMG vyšetrenie ukázalo obraz chronickej periférnej lézie ťažkého stupňa. Motorické neurogramy (n. fibularis, n. tibialis, n. medianus a n. ulnaris obojstranne) a antidrómne senzitívne neurogramy (n. plantaris medialis, n. medianus a n. ulnaris obojstranne) boli nevýbavné. Ihlová EMG z viacerých inzerčných polôh v m. tibialis anterior obojstranne ukázala neprítomnosť pokojovej aktivity, pri vôľovej kontrakcii spomalený nábor motorických jednotiek s výrazne preriedenou krivkou a prítomnosťou iba ojedinelých normofázických MUAPs vysokej amplitúdy a predĺženého trvania. Vyšetrenie likvoru ukázalo diskrétnu pleiocytózu (2/3 lymfocyty a 23/3 monocyty) spolu s výraznou hyperproteinorhachiou (4,9 g/ l). Histopatologické vyšetrenie n. suralis preukázalo degeneratívne zmeny axónov s fokálnou demyelinizáciou a iba ojedinelými známkami regenerácie nervových vlákien. Prítomnosť infiltrátov buniek mononukleárneho fagocytujúceho systému nebola potvrdená.
Počas relapsov ochorenia bola pacientka liečená vnútrožilovým podaním metylprednizolónu a plazmaferézami. V medziobdobí bola pacientka nastavená na dlhotrvajúcu perorálnu terapiu prednizonom a bolesti boli ovplyvňované pregabalinom a tramadolom. V prospech diagnózy CIDP svedčila aj pozitívna terapeutická odpoveď na liečbu relapsov v zmysle zásadného zlepšenia chôdze (chôdza bez opory, rádovo väčšia vzdialenosť).
MR vyšetrenie periférnych nervových štruktúr
Aborálny úsek vertebrálneho kanála je vyplnený hypertrofickými miechovými koreňmi (obr. 1) a po výstupe z vertebrálneho kanála je šírka jednotlivých miechových koreňov v priemere 12 mm (obr. 2). Rovnako sú rozšírené foramina intervertebralia a foramina sacralia. Plocha n. ischiadicus v priečnom reze je 48 × 22 mm a plocha n. femoralis je 16 × 12 mm. V porovnaní s normálnym nálezom to predstavuje 3–4-násobné zväčšenie (obr. 3). V cervikálnom úseku sú miechové korene po výstupe z vertebrálneho kanála široké 12–18 mm (obr. 4). Extrémna hypertrofia postihuje aj kraniálne nervy, a to najmä vetvy n. trigeminus a nervy postranného zmiešaného systému (n. glossopharyngeus, n. vagus, accesorius) (obr. 4–6). Po podaní gadolínia sa hypertrofické periférne nervové štruktúry mierne, okrskovite a nehomogénne sýtili iba v čase relapsu ochorenia. V pokojovom štádiu CIDP sa MR obraz periférnych nervových štruktúr po podaní kontrastnej látky nezmenil.
Image 1. T2 váženie – sagitálny rez v úrovni lumbálnej chrbtice. 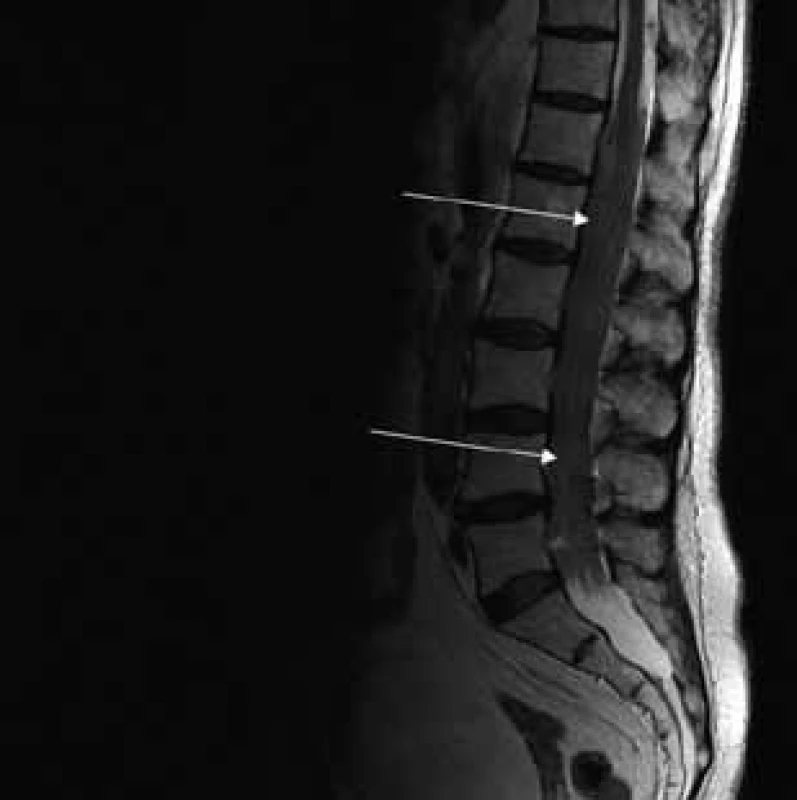
Šípky ukazujú vyplnenie aborálneho úseku vertebrálneho kanála hypertrofickými koreňmi caudae equinae. Image 2. T2 váženie – koronárny rez v úrovni lumbálnej chrbtice. 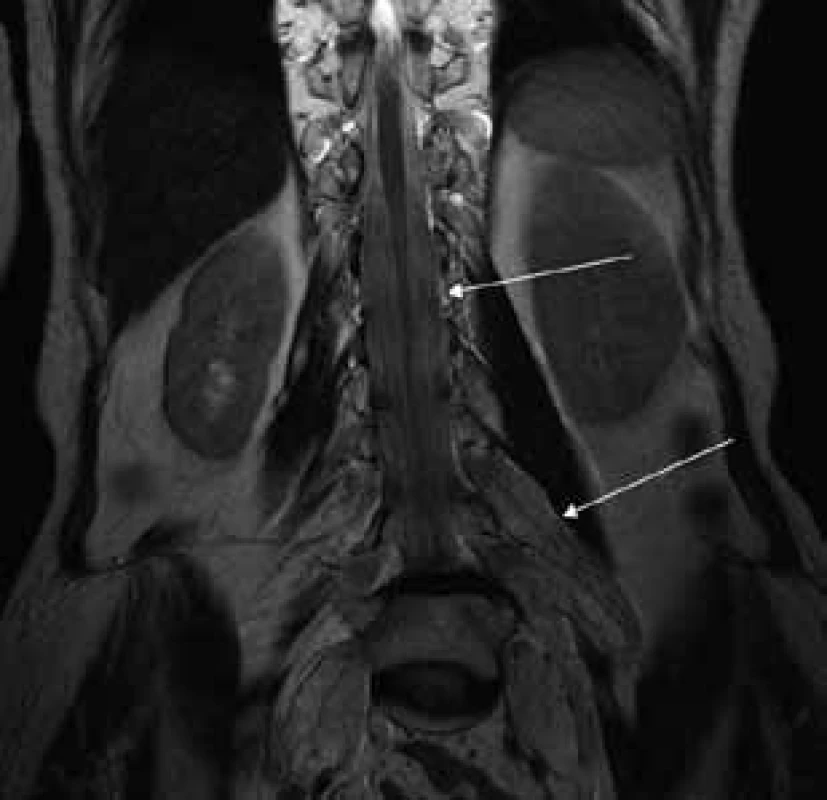
Šípky ukazujú hypertrofiu koreňov cauda equina, ktoré vypĺňajú celý aborálny úsek vertebrálneho kanála a hypertrofické korene plexus lumbosacralis, ktoré vystupujú cez foramina intervertebralia. Image 3. T2 váženie – transverzálny rez v úrovni proximálnej tretiny stehna. 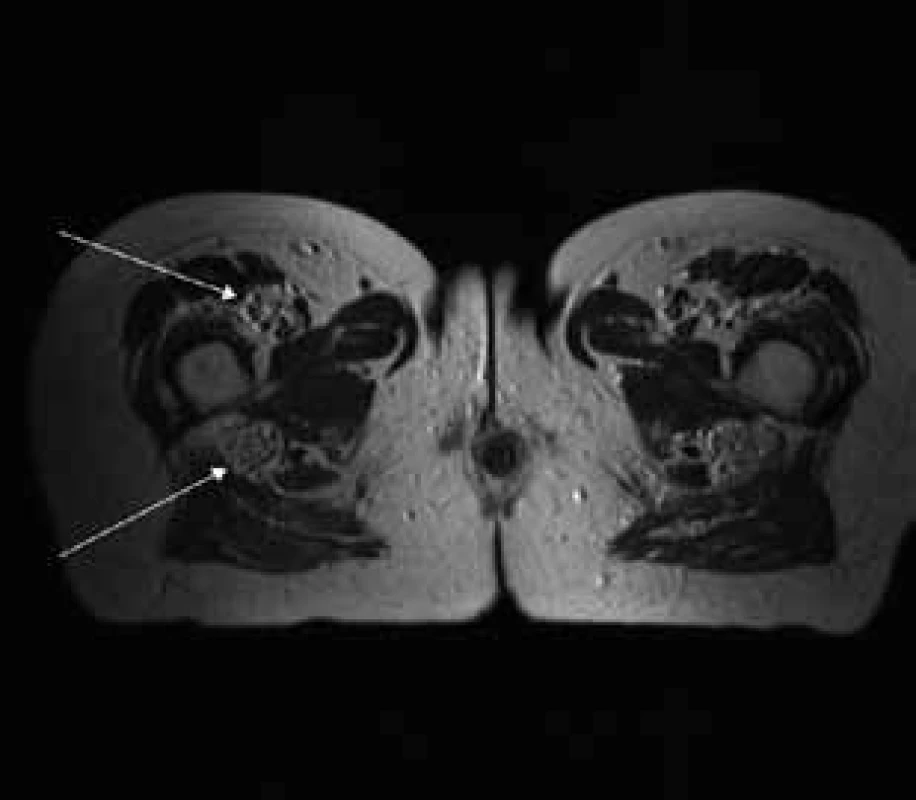
Šípky ukazujú hypertrofiu n. femoralis a dorzálne hypertrofiu n. ischiadicus. Image 4. T2 tirm váženie – koronárny rez v úrovni cervikálnej chrbtice. 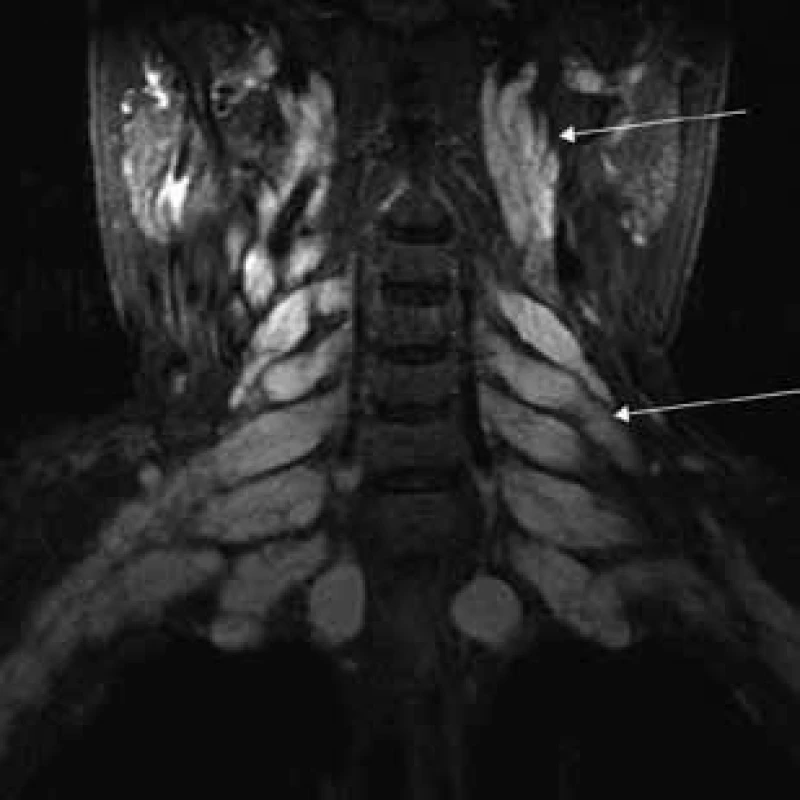
Šípky ukazujú pod bázou lebky hypertrofické kraniálne nervy (n. glossopharyngeus, n. vagus a n. accesorius) a hypertrofické cervikálne miechové korene vystupujúce cez rozšírené foramina intervertebralia. Image 5. T2 tirm váženie – transverzálny rez v úrovni pons Varoli a fissura orbitalis superior. 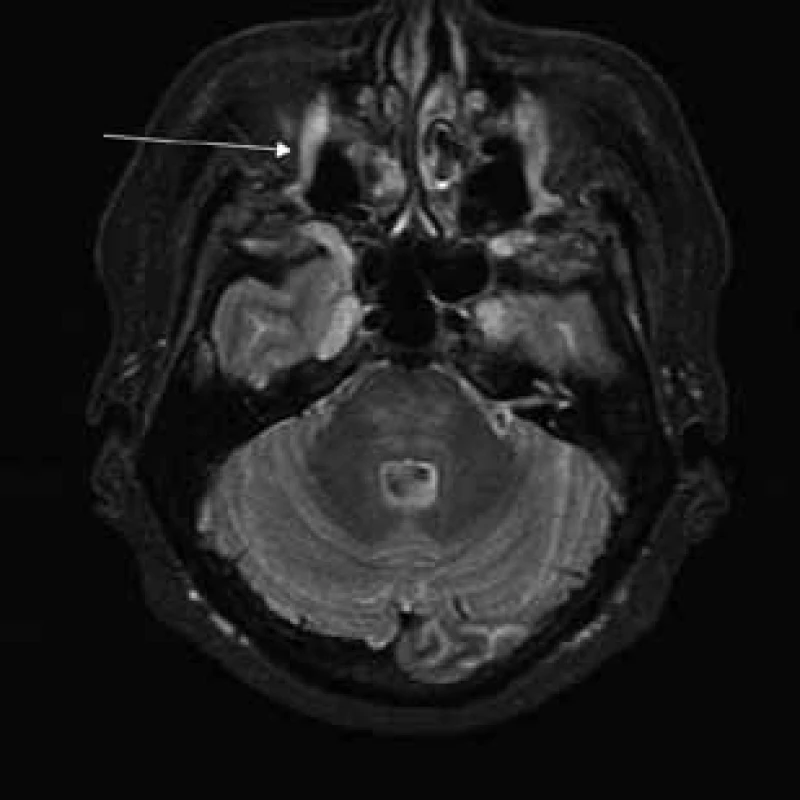
Šípka ukazuje hypertrofiu vetiev n. ophthalmicus. Image 6. T2 váženie – koronárny rez v úrovni očných bulbov. 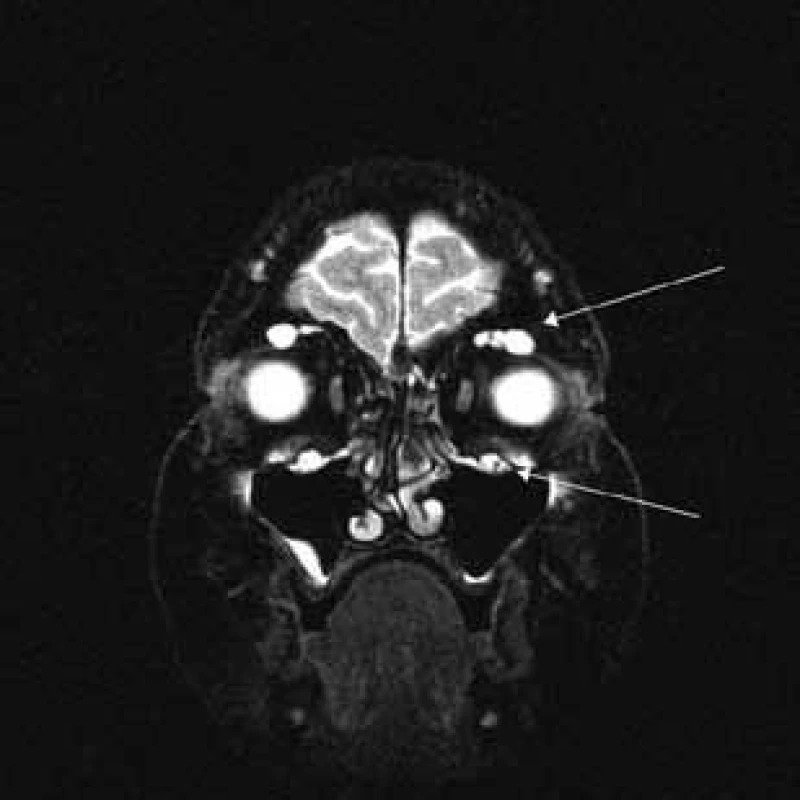
Šípky ukazujú v hornej časti orbity hypertrofiu vetiev n. ophthalmicus a v dolnej časti hypertrofiu vetiev n. mandibularis. Diskusia
V diferenciálnej diagnóze generalizovaných hypertrofických neuropatií je potrebné od CIDP odlíšiť vybrané hereditárne hypertrofické neuropatie (HMSN 1. a 3. typu, Refsumova choroba, neurofibromatóza) a zo získaných neuropatií hlavne amyloidózu, multifokálnu motorickú neuropatiu alebo zriedkavé nádorové ochorenie neurolymfomatózu.
CIDP s extrémnou hypertrofiou periférnych nervových štruktúr sa môže manifestovať iritačným a/alebo zánikovým viackoreňovým syndrómom na horných a dolných končatinách podmieneným okrem základného zápalového a reparačného procesu kompresívnym mechanizmom. V lumbálnom úseku vzniká dokonca obraz typickej spinálnej stenózy spojenej okrem klaudikácie s torpídnym bolestivým stavom, ktorý nereaguje na konvenčnú protibolestivú terapiu a rovnako nemusí dostatočne odpovedať na liečbu ovplyvňujúcu neuropatickú bolesť [3]. Ďalším možným dôsledkom nedostatku priestoru môže byť syndróm kompresie cervikálnej miechy pri patologickej hypertrofii cervikálnych koreňov [4]. V literatúre sú opísané ojedinelé prípady, v ktorých až chirurgická liečba zmiernila príznaky známky kompresívnej pluriradikulopatie. Napr. pri hypertrofickej radikulopatii caudae equinae bola s úspechom vykonaná lumbálna dekompresívna laminektómia s plastikou dura mater [5]. Aj v našom prípade sme v pokročilom štádiu ochorenia zistili prítomnosť lumbálnej spinálnej stenózy. Excesívne zvýšenú hladinu celkových bielkovín v cerebrospinálnom likvore získanom lumbálnou punkciou (4,9 g/ l) považujeme čiastočne za dôsledok obštrukcie spinálneho kanála hypertrofickými koreňmi kaudy. V liečbe pacientky sme doteraz nemuseli pristúpiť k chirurgickej terapii a zatiaľ sa nám podarilo stav dostatočne ovplyvniť medikamentóznou liečbou.
Ťažká paréza dolných končatín, ľahšie poškodenie horných končatín a chýbanie klinicky manifestného poškodenia kraniálnych nervov vysvetľujeme čiastočne vplyvom dĺžky nervu na jeho funkciu pri ťažkej hypertrofickej demyelinizačnej polyneuropatii, kedy majú anatomicky krátke nervy podstatne vyššiu pravdepodobnosť a potenciál úspešného prevodu vzruchov v porovnaní s dlhými končatinovými nervami hlavne dolných končatín. Túto skutočnosť považujeme za nepriamy dôkaz demyelinizácie, nakoľko miera hypertrofie nervov dolných končatín a kraniálnych nervov nie je odlišná. Tazawa et al dokonca potvrdili signifikantný vzťah medzi mierou hypertrofie miechových koreňov a stupňom predĺženia minimálnych latencií F odpovedí pri CIDP [6].
Určitou otázkou zostáva miera správnosti stanovenia diagnózy CIDP. Je zrejmé, že konvenčné elektroneurografické kritéria neboli naplnené ani v rovine možnej demyelinizácie, nakoľko sme konštatovali úplnú periférnu elektrickú nedráždivosť. Uvedenú skutočnosť však vysvetľujeme práve pokročilou hypertrofiou periférnych nervov, ktorá neumožňuje ich povrchovú stimuláciu a ani povrchovú registráciu z nich. Dôvodom je izolačná schopnosť hypertrofického tkaniva, ktoré dokonale elektricky izoluje reziduálne funkčné axóny v centre extrémne hypertrofického nervu pri bežne používaných intenzitách stimulačného prúdu. Predpokladáme, že v prípade vyšetrenia pacientky skôr vo včasných štádiách ochorenia by bola viacložisková periférna demyelinizácia preukázaná bez pochybností.
Počet buniek v likvore ľahko prevyšuje ten, ktorý je uvedený v diagnostických odporučeniach (≤ 10/3). Vysvetlenie vidíme v parciálnej obštrukcii miechového kanála hypertrofickými štruktúrami s následnou proteino-cytologickou disociáciou (4,9 g /l vs 25/3 buniek).
V prospech diagnózy CIDP je aj fakt, že sú prítomné všetky štyri podporné diagnostické kritéria podľa EFNS/PNS (vyšetrenie likvoru, MR, biopsia nervu a pozitívna terapeutická odpoveď na imunosupresiu/imunomoduláciu). Sme toho názoru, že napriek nenaplneniu časti štandardných diagnostických kritérií CIDP (elektroneurografický dôkaz demyelinizácie) môžeme v kontexte vyššie uvedených informácií hovoriť o diagnóze aspoň pravdepodobnej CIDP [1,7].
Záverom môžeme konštatovať, že aj keď hypertrofia periférnych nervových štruktúr pri CIDP nie je zriedkavá, tak iba v ojedinelých prípadoch dosahuje podobne extrémne rozmery, ako je tomu v našej kazuistike. Vtedy sa k autoimunitnému zápalu a reparačným pochodom pridáva ďalší patofyziologický mechanizmus a tým je priestorová kompresia vo vybraných lokalizáciach. Suverénnou diagnostickou metódou je zobrazovacie vyšetrenie magnetickou rezonanciou (MR), ako to dokumentuje náš obrazový materiál. UZ v diagnostike hypertrofie periférnych nervových štruktúr má miesto podriadené MR vyšetreniu. Z anatomických dôvodov je v dobrej technickej kvalite uskutočniteľné iba v krčnej a hornej brachiálnej oblasti. V prípade realizácie MR vyšetrenia sa stáva UZ redundantným. Pri neprítomnosti palpačne detegovateľnej hypertrofie nervov a ťažšej dostupnosti MR môže byť UZ alternatívou určujúcou smer ďalšieho diagnostického postupu. V liečbe týchto pacientov môže byť okrem odporúčanej farmakoterapie v rámci medicíny založenej na dôkazoch a symptomatickej farmakoterapie výnimočne indikovaná aj neurochirurgická, resp. spondylochirurgická dekompresívna liečba.
prof. MUDr. Egon Kurča, PhD.
Neurologická klinika
JLF UK a UN Martin
Kollárova 2
036 59 Martin
e-mail: kurca@mfn.sk
Sources
1. Hughes RA, Bouche P, Cornblath DR, Evers E, Hadden RD, Hahn A et al. EFNS/PNS guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: report of a joint task force of the EFNS and the PNS. Eur J Neurol 2006; 13(4): 326–332.
2. Matsuoka N, Kohriyama T, Ochi K, Nishitani M, Sueda Y, Mimori Y et al. Detection of cervical nerve root hypertrophy by ultrasonography in chronic inflammatory demyelinating polyradiculoneuropathy. J Neurol Sci 2004; 219(1–2): 15–21.
3. Ishida K, Wada Y, Tsunemi T, Kanda T, Mizusawa H. Marked hypertrophy of the cauda equina in a patient with chronic inflammatory demyelinating polyradiculoneuropathy presenting as lumbar stenosis. J Neurol 2005; 252(2): 239–240.
4. Freitas MR, Nascimento OJ, Soares CN, Brito AR, Domingues RC. Chronic inflammatory demyelinating polyradiculoneuropathy: two cases with cervical spinal cord compression. Arq Neuropsiquiatr 2005; 63(3): 666–669.
5. Kretzer RM, Burger PC, Tamargo RJ. Hypertrophic neuropathy of the cauda equina: case report. Neurosurgery 2004; 54(2): 515–518.
6. Tazawa K, Matsuda M, Yoshida T, Shimojima Y, GonoT, Morita H et al. Spinal nerve root hypertrophy on MRI: clinical significance in the diagnosis of chronic inflammatory demyelinating polyradiculoneuropathy. Intern Med 2008; 47(23): 2019–2024.
7. Van den Bergh PY, Hadden RD, Bouche P, Cornblath DR,Hahn A, Illa I et al. European Federation of Neurological Societies/Peripheral Nerve Society Guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society – first revision. Eur J Neurol 2010; 17(3): 356–363.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery
2011 Issue 1-
All articles in this issue
- Monitoring pacientů s těžkým poraněním mozku
- Farmakologická neuroprotekce u akutní ischemické cévní mozkové příhody
- Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Validizační studie české verze dotazníku FAQ
- Resekční epileptochirurgie u pacientů s perirolandickou epilepsií
- Peroperační kontrola funkce extra-intrakraniálního bypassu ultrazvukovými metodami
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
- Extrémna hypertrofia periférnych nervových štruktúr pri CIDP – kazuistika
- Nokardiové abscesy mozku – dvě kazuistiky
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- 12-kDa FK 506-vážící protein zapojený do neuroprotektivního účinku dantrolenu v mozkové kůře potkanů po ischemicko-reperfuzním postižení
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Monitoring pacientů s těžkým poraněním mozku
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

