-
Medical journals
- Career
Glykozylácia ako dôležitý regulátor funkcie protilátok
Authors: L. Uhrík; L. Hernychová; B. Vojtěšek
Authors‘ workplace: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2019; 32(Supplementum 3): 46-55
Category: Review
doi: https://doi.org/10.14735/amko20193SOverview
Východisko: Glykozylácia konštantných oblastí protilátok zásadne ovplyvňuje ich interakčné schopnosti s bunkami imunitného systému. Jedná sa o modifikáciu, ktorá okrem biologickej aktivity protilátok zasahuje aj do ich konformácie, stability, rozpustnosti, sekrécie, farmakokinetiky a imunogénnosti. Pre ich správnu funkciu nie je podstatná len lokalizácia samotných glykozylácií na molekule protilátok, ale aj štruktúra jednotlivých glykánov. Zmeny glykozylačných profilov protilátok boli popísané u niektorých fyziologických procesov, akými sú tehotenstvo alebo starnutie, ale taktiež u mnohých patologických stavov ako reumatoidnej artritídy, či nádorov žalúdka, pľúc alebo prostaty. Stále existuje celé množstvo neobjasnených mechanizmov, ktoré riadia glykozyláciu protilátok alebo sú týmito modifikáciami naopak regulované. Viaceré zdroje popisujú význam niektorých špecifických glykozylácií ako potenciálnych biomarkerov.
Cieľ: Cieľom tohto prehľadového článku je zhrnúť a priblížiť doterajšie poznatky o glykozylácii protilátok a upozorniť na ich vplyv na imunitné odpovede a ich úlohu v priebehu ochorenia. Ich dôležitosť podčiarkuje aj to, že väčšina vyvíjaných a využívaných terapeutických protilátok je modifikovaných glykozyláciou. Práve cielené vnesenie vhodných glykozylácií, ktoré podporujú aktivity akými sú napr. bunková cytotoxicita závislá na protilátkach, bunková fagocytóza závislá na protilátkach alebo cytotoxicita závislá na komplemente, viedlo k zlepšeniu schopností týchto protilátok likvidovať patogény alebo nádorové bunky. Preto je oblasti glykozylácie protilátok venovaná stále väčšia pozornosť. Získané znalosti môžu prispieť k ďalšiemu vývoju efektívnych nástrojov diagnostiky a terapie rôznych ochorení.
Klíčová slova:
protilátky – glykozylácia – farmakológia – imunitný systém – terapia
Úvod
Protilátky, proteíny produkované maturovanými B-lymfocytmi, patria k základným súčastiam humorálnej imunitnej odpovedi. Sú to proteíny zložené z dvoch ľahkých a dvoch ťažkých polypeptidových reťazcov spojených disulfidickými väzbami, pričom sa ich štruktúra skladá z fragmentu viazajúceho antigén (fragment antigen binding – Fab) a konštantného alebo kryštalizujúceho fragmentu (fragment crystallizable – Fc) [1]. Na základe zloženia konštantných oblastí ťažkých reťazcov rozlišujeme päť izotypov ľudských protilátok, imunoglobulíny triedy A (IgA), D (IgD), E (IgE), G (IgG) a M (IgM) [2]. Biologické funkcie jednotlivých izotypov protilátok podrobne rozoberajú Schoeder et al [3]. Zatiaľ čo sú oblasti určujúce komplementaritu Fab zodpovedné za väzbu antigénu [4], Fc oblasti umožňujú komunikáciu s ďalšími zložkami imunity, a môžu tak aktivovať mechanizmy, ako sú apoptóza, bunková cytotoxicita závislá na protilátkach (antibody dependent cellular cytotoxicity – ADCC), bunková fagocytóza závislá na protilátkach (antibody dependent cellular phagocytosis – ADCP) a cytotoxicita závislá na komplemente (complement dependent cytotoxicity – CDC) (obr. 1) [5,6].
Image 1. Protilátky a mechanizmy likvidácie patogénu. Protilátky dokážu likvidovať patogén priamym pôsobením a to väzbou na povrchové molekuly zodpovedné za jeho prichytenie k hostiteľskej bunke (neutralizácia) alebo receptory aktivujúce apoptické signály. Protilátky dokážu svojimi Fc oblasťami interagovať s povrchovými receptormi ďalších buniek imunitného systému a spúšťať tak ďalšie imunitné mechanizmy. Na obrázku znázornená NK bunka interaguje prostredníctvom receptoru CD16 (FcγRIIIa) s Fc časťami protilátky vystavenej na povrchu patogénu, aktivuje svoje cytotoxické mechanizmy a uvolňuje do extracelulárneho priestoru cytotoxické granulá s enzýmami perforínom a granzýmom, ktoré nie sú schopné zabiť len samotný patogén, ale tiež nádorové bunky alebo bunky infi kované vírusom (ADCC). Rovnako FcγRIIa receptory makrofágu aktivujú fagocytózu patogénu (ADCP), Fc oblasti taktiež dokážu interagovať zo zložkami komplementu a aktivovať tak lýzu bunky (CDC). Prevzaté a upravené z [6]. ![Protilátky a mechanizmy likvidácie patogénu. Protilátky dokážu likvidovať patogén priamym pôsobením a to väzbou na povrchové
molekuly zodpovedné za jeho prichytenie k hostiteľskej bunke (neutralizácia) alebo receptory aktivujúce apoptické signály.
Protilátky dokážu svojimi Fc oblasťami interagovať s povrchovými receptormi ďalších buniek imunitného systému a spúšťať
tak ďalšie imunitné mechanizmy. Na obrázku znázornená NK bunka interaguje prostredníctvom receptoru CD16 (FcγRIIIa) s Fc časťami
protilátky vystavenej na povrchu patogénu, aktivuje svoje cytotoxické mechanizmy a uvolňuje do extracelulárneho priestoru
cytotoxické granulá s enzýmami perforínom a granzýmom, ktoré nie sú schopné zabiť len samotný patogén, ale tiež nádorové
bunky alebo bunky infi kované vírusom (ADCC). Rovnako FcγRIIa receptory makrofágu aktivujú fagocytózu patogénu (ADCP), Fc oblasti
taktiež dokážu interagovať zo zložkami komplementu a aktivovať tak lýzu bunky (CDC). Prevzaté a upravené z [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c62ede2a767c23adb3e12a5d1aee2f0b.png)
Fc – konštantné oblasti protilátok, NK – natural killer, ADCC – bunková cytotoxicita závislá na protilátkach, ADCP – bunková fagocytóza závislá na protilátkach, CDC – cytotoxicita závislá na komplemente Existuje niekoľko typov Fc receptorov (FcR) nachádzajúcich sa na ostatných bunkách imunitného systému. Tab. 1 popisuje rôzne typy týchto receptorov. Možu sa odlišovať na izotype protilátok, ktoré dokážu rozoznať, ich afinite tejto väzby a type buniek, ktoré ich exprimujú. Na základe týchto rozdielov sú spúšťané odlišné dráhy vedúce k likvidácii patogénu [2,7].
Table 1. Fc receptory. Rozdelenie Fc receptorov a ich izoforiem v závislosti na protilátkach, ktoré dokážu viazať, odlišnostiach v afi nite interakcie a bunkách imunitného systému, na povrchu ktorých sú exprimované. 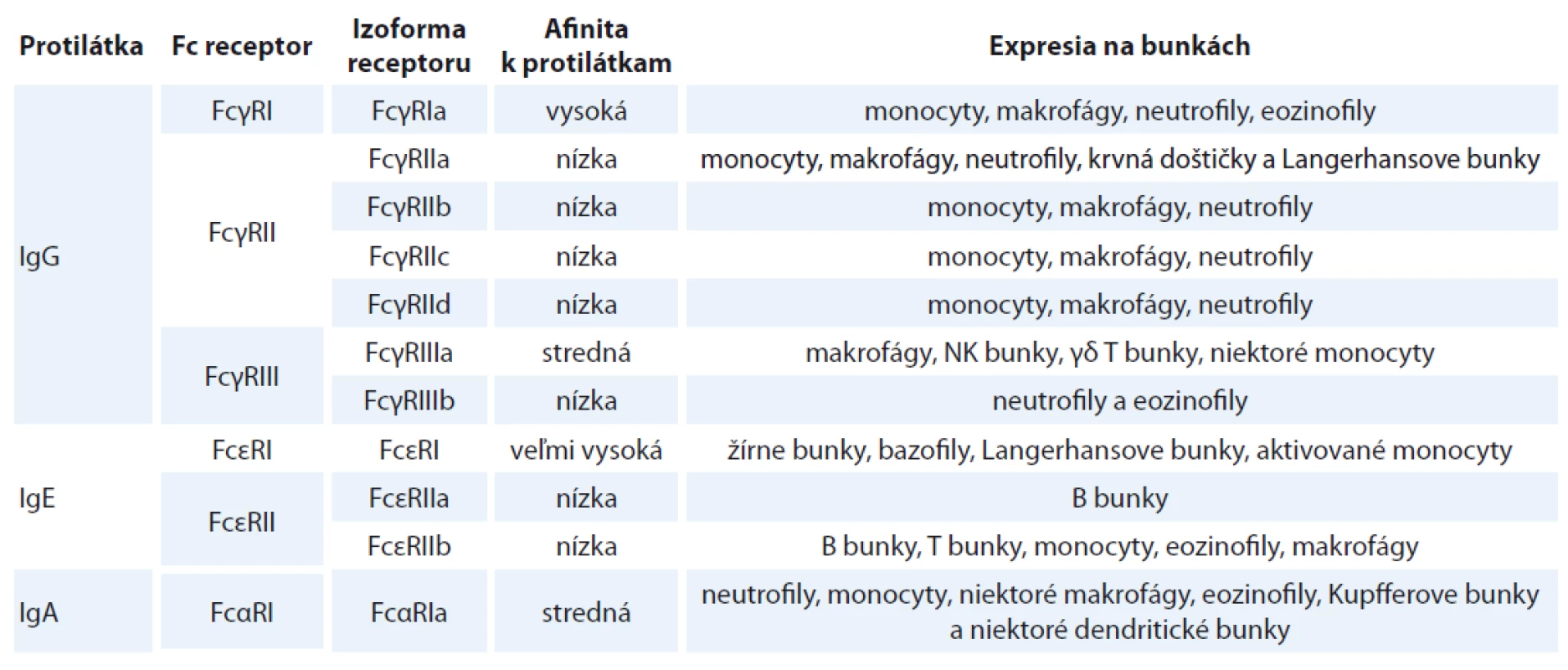
Fc – konštantné oblasti protilátok, Ig – imunoglobulíny, NK – natural killer Tak ako mnohé iné proteíny aj protilátky podliehajú posttranslačným modifikáciám. N-glykozylácia je najčastejšou modifikáciou membránových a sekrétovaných proteínov u eukaryotov [8]. Pri tomto vysoko konzervovanom procese odohrávajúcom sa v endoplazmatickom retikule, je oligosacharyl-transferázovým komplexom rozoznávaná sekvencia N-X-S(T) a na asparagín (N) prenesená oligosacharidová zložka so zložením Glc3Man9GlcNAc2 (glukóza – Glc, manóza – Man, N-acetylglukózamín – GlcNAc). Takto modifikovaný proteín prechádza do Golgiho aparátu, kde je štruktúra glykánu postupne spracovávaná špecifickými glykozidázami a glykosyltransferázami. Finálny glykoproteín je sekretovaný mimo bunku [9,10]. Existuje veľké množstvo molekúl N-glykánov, ktorými sú proteíny modifikované. Jej základ pozostáva však vždy z dvoch molekúl GlcNAc a troch manózových jednotiek (obr. 2).
Image 2. Proces glykozylácie. Proces glykozylácie začína v endoplazmatickom retikule, kde je štruktúra Glc3Man9GlcNAc2 prenesená z molekuly dolicholilu (A) ukotveného v membráne na asparagín (N) v sekvencii novo syntetizovaného proteínu (B). Postupne je takýto glykoproteín transportovaný do Golgiho aparátu, kde je štruktúra prekurzorového glykánu spracovaná na štruktúru Man3GlcNAc2 s dvomi anténami (C), ktorá tvorí základ všetkých N-glykozylácií. Na toto jadro môžu byť pridávané molekuly galaktózy, fukózy, N-acetylglukózamínu a kyseliny N-acetylneuramínove (D – core-fukozylácia, E – digalaktózovaný glykán, F – bisektínový glykán, G – disialylovaný glykán). Prevzaté a upravené z [9]. ![Proces glykozylácie. Proces glykozylácie začína v endoplazmatickom retikule, kde je štruktúra Glc3Man9GlcNAc2 prenesená
z molekuly dolicholilu (A) ukotveného v membráne na asparagín (N) v sekvencii novo syntetizovaného proteínu (B). Postupne
je takýto glykoproteín transportovaný do Golgiho aparátu, kde je štruktúra prekurzorového glykánu spracovaná na štruktúru
Man3GlcNAc2 s dvomi anténami (C), ktorá tvorí základ všetkých N-glykozylácií. Na toto jadro môžu byť pridávané molekuly galaktózy,
fukózy, N-acetylglukózamínu a kyseliny N-acetylneuramínove (D – core-fukozylácia, E – digalaktózovaný glykán, F – bisektínový
glykán, G – disialylovaný glykán). Prevzaté a upravené z [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/17b82959d726dfa18cabdb74d4581020.png)
Glykozylácia IgG
IgG tvoria približne 75 % z celkového množstva ľudských sérových protilátok a rovnako sú prevažujúcou skupinou používaných a vyvíjaných protilátok využívaných v terapii rôznych ochorení [11]. Zásadný efekt na funkciu IgG má N-glykozylácia oblasti Fc. Tieto oblasti totiž interagujú s receptormi FcγR nachádzajúcimi sa na ďalších imunitných bunkách [12] a deglykozylácia Fc vedie k takmer úplnej strate väzby s receptormi FcγRI [13]. Ľudské IgG obsahujú na svojom Fc len jedinú konzervovanú pozíciu glykozylácie nachádzajúce sa na CH2 doméne na asparagínu v pozícii 297 (N297) (obr. 3) [14]. I keď sú štruktúry Fc glykánov IgG pomerne heterogénne [15], oproti ostatným glykoproteínom tvoria len dvojantenárne štruktúry, ktoré môžu byť obohatené ďalšími molekulami sacharidov ovplyvňujúcich štruktúrne i funkčné vlastnosti IgG, ako jej stabilitu alebo typ FcγR, na ktoré sa viažu [16]. α-1,6 anténa glykánu totiž nekovalentne interaguje s Fc reťazcom, zatiaľ čo druhá anténa (α-1,3) smeruje do priestoru medzi reťazcami a tam interaguje s rovnakým ramenom glykánu druhého ťažkého reťazca, čo stabilizuje štruktúru protilátky [17]. V minulosti sa na základe kryštalografických dát predpokladalo, že táto glykozylácia vytvára otvorenú konformáciu Fc oblastí, zatiaľ čo absencia glykozylácie viedla k zatvorenej konformácii, ktorá nie je schopná interakcie s receptormi [18,19]. Neskôr bol však tento model vyvrátený experimentami s protilátkami v roztoku a bolo preukázané, že neglykozylované Fc fragmenty sú flexibilné a môžu vytvárať ešte otvorenejšie konformácie [20].
Image 3. Ilustrácia konzervovanej glykozylácie IgG v pozícii N297 a príklady vplyvov odlišných štruktúr na efektorové funkcie IgG. Obrázok popisuje vplyv zloženia glykozylácie na zápalovú odpoveď. Zatiaľ čo je terminálnej sialylácii a core-fukozylácii je pripisovaný protizápalový, bisektínové glykány majú prozápalový efekt na pôsobenie IgG. Prevzaté a upravené z [21]. ![Ilustrácia konzervovanej glykozylácie IgG v pozícii N297 a príklady vplyvov odlišných štruktúr na efektorové funkcie IgG.
Obrázok popisuje vplyv zloženia glykozylácie na zápalovú odpoveď. Zatiaľ čo je terminálnej sialylácii a core-fukozylácii je pripisovaný
protizápalový, bisektínové glykány majú prozápalový efekt na pôsobenie IgG. Prevzaté a upravené z [21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/cfaf8f2995bfdbdfb6f23030724818a2.png)
IgG – imunoglobulíny triedy G Ako už bolo spomenuté, základná štruktúra glykánu (GlcNAc2Man2) môže byť modifikovaná molekulami iných sacharidov, konkrétne galaktózy (Gal), kyseliny neuramínovej (NeuAc), fukózy (Fuc) alebo ďalšími molekulami GlcNAca Man [21]. U zdravých jedincov sú najčastejšími štruktúrami negalaktózylovaná štruktúra (IgG-G0), monogalaktózylovaná štruktúra (IgG-G1) a digalaktózylovaná štruktúra (IgG-G2) tvoriace väčšinu glykoforiem IgG [22,23]. Viaceré štúdie poukazujú, že terminálna galaktozylácia je modulátorom zápalovej aktivity IgG, keď bolo zistené, že absencia terminálnej galaktózy pôsobí prozápalovo prostredníctvom aktivácie komplementu alternatívnou cestou [24]. Pokles hladiny galaktozylovaných glykoforiem bol naopak zaznamenaný u viacerých ochorení, ako reumatoidnej artritídy či lupus erythematosus [25 – 27]. Štúdia autorov Karsten et al na myších modeloch poukazuje na to, že galaktozylácia Fc oblastí je nevyhnutná pre efektívne spustenie protizápalovej signálnej kaskády interakciou s FcγRIIB receptorom [28]. O prozápalovom pôsobení terminálnych galaktozylácií však hovoria ďalšie výsledky. Cez afinitu k C1q zložke komplementu podporujú CDC a väzbou aktivujúcich FcγR receptorov taktiež ADCC [29]. Tieto kontrastujúce výsledky poukazujú na komplexnosť signálnych dráh imunitných reakcií sprostredkovaných protilátkami. Napojenie ďalšieho typu sacharidu – kyseliny neuramínovej v procese sialylácie – taktiež vedie k významnej modifikácii pre reguláciu zápalovej aktivity IgG [30,31]. Predpokladá sa, že práve sialylované glykoformy majú význam pre protizápalovú aktivitu intravenózneho imunoglobulínu (intravenous immunoglobulin – IVIg) indikovaného pri mnohých imunodeficientných, neurologických a ďalších ochoreniach [32,33]. U zdravých jedincov je sialylácia (mono - a disialylácia) na rozdiel od galaktozylácie málo abundantná, vyskytujúca sa na približne u 10 – 15 % glykoforiem IgG [11]. Naopak fukozylácia prvej molekuly GlcNAc, ktorou sa glykán viaže na proteín (core-fukozylácia), sa u ľudskej populácie vyskytuje v približne 90 % prípadoch. Takéto štruktúry dokážu viazať receptory FcγRIII až 100násobne slabšie a znižujú tak cytotoxickú aktivitu takýchto IgG najmä pri ADCC [34,35]. Funkcia fukozylácie je pravdepodobne regulačná, vytvára stérickú prekážku pre naviazanie receptorov, a tak zabraňuje aktivácii prozápalových procesov pri fyziologických podmienkach (obr. 3) [36,37].
Opačné pôsobenie, i keď v menšej miere, bolo popísané u bisektínových glykoforiem IgG (obr. 2 – štruktúra F). Z dôvodu stérickej zábrany, ktorú bisektínový GlcNAc vytvára pre fukozylačný enzým, tieto štruktúry neobsahujú core-fukozyláciu. Nárast ADCC aktivity u bisektínových glykoforiem IgG je tak pripisovaný skôr absencii tejto fukozylácie, ktorá by bola schopná tlmiť ADCC aktivitu IgG [38].
Popri konzervovaných miestach glykozylácie, Fc obsahuje približne 15 – 25 % sérových IgG i glykozylácie Fab oblastí [39]. Sú to hlavne komplexné biantenárne N-glykány napojené na N-X-S/ T sekvencie, ktoré vznikli v procese hypermutácií [40]. V porovnaní s Fc tvoria glykánové štruktúry Fab z veľkej časti bisektínové, galaktozylované či sialylované glykány a naopak menšie množstvo core-fukozylovaných [41]. Lepšia dostupnosť týchto štruktúr pre glykozyltransferázy oproti stéricky bráneným Fc glykánom na CH2 doméne vedie k vzniku rozmanitejších štruktúr. Rovnako sú tieto glykozylácie dostupnejšie i prostrediu a môžu rovnako významne ovplyvňovať stabilitu, biologický polčas rozpadu či väzobné vlastnostiprotilátky [42 – 44].
Glykozylácie ďalších typov protilátok
I keď je IgG najlepšie preštudovanou izoformou protilátok, niekoľko faktov je známych aj o glykozylácii ďalších izotypov. Protilátky IgE hrajú významnú úlohu v alergických reakciách. IgE sa dokážu viazať na receptory FcεRI žírnych buniek a FcεRII B-buniek [45] a na rozdiel od IgG obsahujú IgE niekoľko glykozylačných miest. Štyri konzervované glykozylácie (tri komplexné a jedna vysokomanózová) sa nachádzajú na Fc a ďalšie tri glykozylačné miesta s komplexnými glykánmi sa nachádzajú na Fab [46,47]. Efekty glykozylácií IgE protilátok boli preukázané mutáciami, ktoré blokovali glykozylácie v popísaných pozíciách [48]. Mutácia konzervovanej pozície N394 na Fc, ktorá zodpovedá konzervovanej glykozylácii N297 u IgG, redukuje väzbu na receptor FcεRI [49]. Opačný efekt majú glykozylácie IgE na ich väzbu na receptory B-lymfocytov FcεRII, keď absencia glykozylácie vedie k zvýšeniu tejto väzby [50].
Glykozylácia IgA, ktorá má zásadnú úlohu v mukóznej imunite, je závislá na ich izotype [51]. Existujú dve izoformy protilátky IgA: IgA1 a IgA2, u druhého rozoznávame dva allotypy IgA2m(1) a IgA2m(2). U izotypu IgA1, ktorý tvorí približne 85 % celkového IgA, sú známe dve konzervované miesta N-glykozylácie modifikované komplexnými glykánmi N263 a N459 [52]. Mimo toho bola popísaná O-glykozylácia až v šiestich pozíciách v oblasti spájajúcich Fab a Fc. Tieto glykozylácie hrajú úlohu vo väzbe mikroorganizmov sekretovanými IgA [15]. Taktiež bola popísaná úloha glykozylácie IgA v patogenézii nefropatie [53]. Oba subizotypy IgA2 obsahujú štyri glykozylačné miesta N166, N263, N337, N459, subizotyp IgA2m(2) má navyše jedno miesto v pozícii N211 [15]. IgM, ktoré sú prvou skupinou protilátok produkovaných po vystavení antigénu, tvoria penta - alebo hexamérne štruktúry, ktoré sú silno glykozylované. Obsahujú päť N-glykozylačných miest obsadených tromi komplexnými a dvomi oligomanózovými štruktúrami [54]. Nedávne štúdie zaznamenali vplyv sialylácie na imunitnú aktivitu IgM moduláciou interakcie s T-lymfocytmi [55].
Protilátky IgD sú najmenej abundantným izotypom, obsahujú však taktiež konzervované glykozylácie. Sú u nich identifikované tri N-glykozyláce nutné pre ich správnu konformáciu a sekréciu a podobne ako IgA1 obsahujú aj O-glykánové modifikácie [56]. I keď sú miesta konzervovaných glykozylácií u týchto izotypov pomerne dobre popísané, je potrebné odhaliť ich konkrétne vplyvy na funkciu týchto protilátok.
Regulácia glykozylácie a jej fyziologické a patologické zmeny
Pravdepodobne existuje niekoľko mechanizmov, ktoré vplývajú na glykozyláciu protilátok, zahrnujúc expresiu glykozyltransferáz resp. glykozidáz, dostupnosti jednotlivých sacharidových substrátov, pH vnútri Golgiho aparátu, rýchlosť syntézy proteínov a dostupnosti vezikulárneho transportného aparátu. Zaznamenanie zmeny glykozylačného profilu IgG v závislosti na faktoroch, akými sú vek, pohlavie či tehotenstvo, poukazujú taktiež na vplyv hormonálneho riadenia týchto procesov. Bolo zistené, že trend rastu galaktózylovaných glykoforiem sa v období medzi 20. a 30. rokom života obracia a začína klesať [57 – 59]. Tento proces je signifikantný najmä u žien na začiatku menopauzy [60 – 62]. Redukcia agalaktozylovaných glykoforiem je kontrastne pozorovaná v tehotenstve, kde bol súbežne popísaný mierny pokles fukozylovaných glykoforiem protilátok. U tehotných pacientok s reumatoídnou artritídou nárast galaktozylovaných glykoforiem koreloval so zlepšením zdravotného stavu [63,64].
I keď je glykozylácia vysoko konzervovaným procesom, existuje niekoľko analýz, ktoré poukazujú na ich aktívne zmeny v procesoch zápalových odpovedí u autoimunitných a infekčných ochorení [65 – 68]. Taktiež boli zaznamenané zmeny v mnohých nádorových ochoreniach. Pomerne uniformne bol zachytený pokles galaktozylácie u mnohopočetného myelómu, nádoroch žalúdka, hrubého čreva, prostaty, pľúc a ďalších nádorov korelujúci s progresiou a metastázovaním [69 – 73]. Tento trend je vysvetlený vplyvom zápalovej reakcie na vývoj nádoru alebo stratou schopnosti takýchto IgG viazať C1q, a možnosťou nádorových buniek uniknúť CDC [74]. Popri galaktozylácii boli zaznamenané zmeny aj u iných glykoforiem. U nádorov žalúdka bol zachytený nárast fukozylovaných IgG a naopak pokles bisektínových IgG. V jednej štúdii bola taktiež zistená asociácia zvýšenia sialylovaných a bisektínových glykoforiem IgG s lepším prežitím [70]. Štúdie na veľkom počte subjektov (pacientov a zdravých kontrol) potvrdili pokles sialylácie v celkovom sérovom IgG spojený s vývojom nádoru a horšou prognózou [75,76]. Nárast podielu manózy u IgG Fc a Fab asociovaný s progresiou ochorenia bol zachytený u malígneho melanómu v porovnaní so zdravými pacientmi. Niektoré práce poukazujú na koreláciu profilu agalaktózových glykoforiem s hladinami zavedených biomarkerov vývoja nádorového ochorenia a metastázovania, ako je to u nádoru prostaty, pľúc a žalúdka. Navrhujú tak zaradenie hladín týchto špecifických glykozylácií ako ďalších biomarkerov pre zlepšenie diagnostiky nádorovových ochorení do budúcnosti [72,77,78].
Terapeutické protilátky
Vývoj monoklonálnych protilátok je jednou z najrýchlejšie sa vyvíjajúcich oblastí terapeutík [79]. S presadzovaním cielenej terapie rastie ponuka efektívnejších protilátok ako hlavných zástupcov biologickej liečby využiteľných pre čoraz širšie spektrum ochorení, čo podčiarkuje aj trend zvyšovania počtu pre terapiu schválených protilátok v posledných rokoch. V roku 2017 tento počet prvýkrát stúpol počet v EÚ a USA na dvojciferné číslo (10) [80]. V novembri roku 2018 to bolo už 12 protilátok a ďalšie 4 boli v procese schvaľovania [81]. Glykozylácia ako modifikácia, ktorá významne vplýva na kvalitu protilátok, patrí k základným parametrom, ktoré je nutné analyzovať pri vývoji a produkcii biosimilárnych terapeutík [82] (tab. 2).
Table 2. Príklady protilátok obsahujúcich glykozyláciu schválených pre terapiu onkologických ochorení. Tabuľka popisuje obchodný názov, štruktúru, mechanizmus ich pôsobenia a ochorenia, pri ktorých sa využívajú. 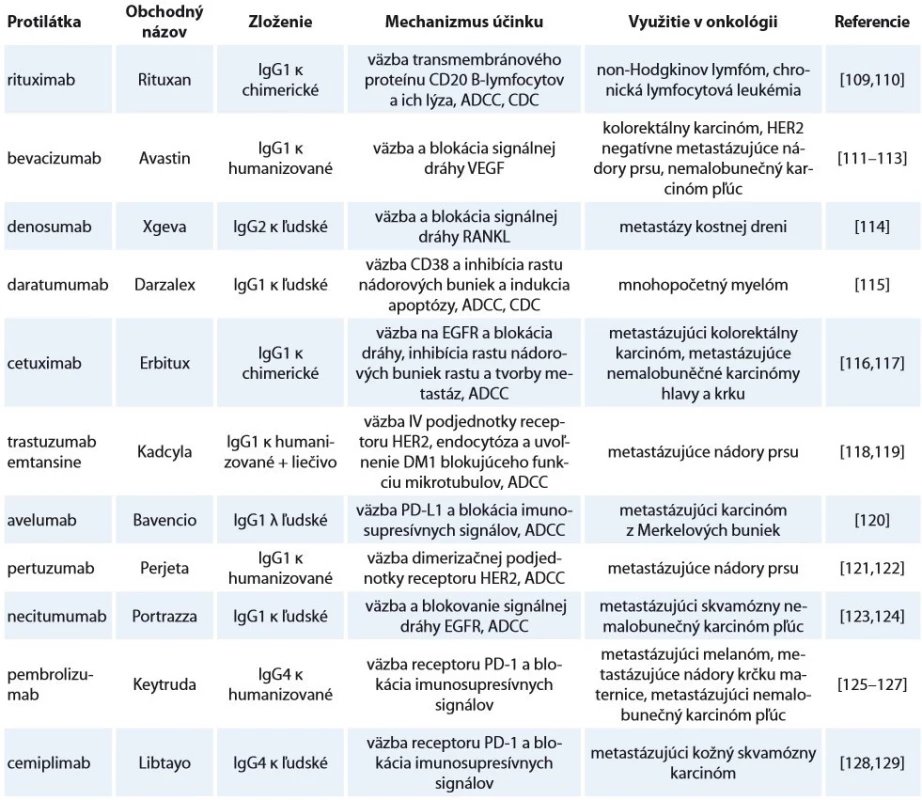
Ig – imunoglobulíny, ADCC – bunková cytotoxicita závislá na protilátkach, CDC – cytotoxicita závislá na komplemente, VEGF – vascular endothelial growth factor, RANKL – receptor activator of NFκB ligand, HER2 – human epidermal growth factor receptor 2, PD-L1 – programmed death-ligand 1, PD1 – programmed cell death protein 1 V mnohých prípadoch je produkcia monoklonálnych protilátok pre terapiu z hľadiska glykozylácie komplikovaná. Ako bolo spomenuté, väčšina Fc fragmentov ľudských IgG obsahuje komplexné biantenárne G0F, G1F a G2F s core-fukozyláciou a stopovými množstvami sialylovaných glykoforiem [83]. Pri produkcii protilátok v CHO bunkách (izolovaných z čínskeho škrečka) sú vytvárané glykoformy prirodzene sa vyskytujúce na ľudskom IgG [84]. Myšie myelómové bunky (NS0 a SP2/ 0) však dokážu na rozdiel od CHO buniek pridať abnormálne sacharidy, ako N-glykolylneuramínuvú kyselinu, ktoré môžu pôsobiť imunogénne [85]. Tieto odlišnosti v spektre glykoforiem však nemožno brať len ako problém. Myšia myelómová bunková línia YB2/ 0 dokáže produkovať rekombinantné protilátky s nízkym obsahom core-fukozylácie, čo môže mat za následok až 50násobne vyššiu ADCC aktivitu oproti produkcii v CHO bunkách [38]. Takisto kvasinky nedokážu vytvárať fukozylované štruktúry, ale zato tvoria hlavne vysokomanózové štruktúry, ktorých profil sa líši v závislosti na kmeni [86,87]. Vďaka genetickej modifikácii dokážu byť pre produkciu terapeutických Ig využité aj rastliny, kde boli vypnuté enzýmy tvoriace imunogénne glykoformy [88]. A tak ako je pre zníženie imunogénnosti nutná humanizácia ich proteínovej zložky, sú v expresných systémoch pomocou génového inžinierstva vypnuté enzymatické dráhy tvoriace takéto glykoformy a naopak zosilené dráhy tvoriace glykoformy s požadovanými vlastnosťami [89,90].
Významným parametrom terapeutických protilátok je ich farmakokinetika. V tomto procese je dôležitým mechanizmom najmä ich vychytávanie z obehu. Tento dej reguluje ich koncentráciu a tým pádom aj samotnú efektivitu terapie. Vychytávanie glykozylovaných protilátok je sprostredkovaný niekoľkými proteínmi viazajúcimi oligosacharidy (receptormi). K najvýznamnejším patria v pečeni exprimovaný asialoglykoproteínový receptor (asialoglycoprotein receptor – ASGPR) a manózový receptor (mannose receptor – ManR) [91,92]. ASGPR rozoznáva terminálnu galaktozyláciu bi-, tri - a tetraantenárnych glykoproteínov, zatiaľ čo ManR interaguje s oligomanózovými a hybridnými glykánmi (glykány obsahujúce manózové a komplexné antény). Glykoproteíny sú po väzbe endocytozované a lyzované [93 – 95]. Ukázalo sa, že pre predĺženie dĺžky biologickej účinnosti glykoproteínov je významná terminálna sialylácia, ktorá blokuje alebo aspoň významne znižuje väzbu glykánov a teda aj protilátok na tieto receptory [96]. Samotná glykozylácia N297 u IgG nie je výraznejšie významná z hľadiska farmakokinetiky. Ako bolo spomenuté, sú to najčastejšie G0 resp. G1 štruktúry a nevykazujú silnejšiu afinitu k ASGPR [97,98]. Signifikantnejšie efekty na vychytávanie protilátok cez ich glykanové modifikácie však môžu vykazovať Fab glykozylácie, a to v závislosti na ich pozícii a sacharidovom zložení [43, 99].
Problémom využitia CHO a myších buniek sú protilátky, ktoré obsahujú vysoký podiel vysokomanózových glykoforiem [100]. Autori Goetze et al poukázali na to, že ich množstvo je z krvi odbúrané výrazne rýchlejšie a selektívne oproti glykoformám obsahujúcim terminálnu galaktózu alebo GlcNAc, ktoré si zachovávali konštantnú hladinu počas 34 dní po podaní [101]. To je spôsobené ManR receptormi makrofágov a dendritických buniek a aktiváciou dráhy manan viazajúceho lektínu [102].
Neglykozylované protilátky
V terapii však nemajú miesto len glykozylované protilátky. Pri liečbe niektorých ochorení protilátkami bez glykozylácie, akými sú napr. onartuzumab (MetMAb – používaný pri liečbe nemalobunkového karcinómu plúc) alebo otelixizumab (TRXA – diabetes mellitus typ 1), nie sú požadované aktivácie ADCC/ CDC efektórových funkcií, ale len neutralizácia, resp. anti/ agonistické pôsobenie [103,104]. Neglykozylované protilátky majú porovnateľné dĺžky biologickej účinnosti ako glykozylované, ich výhodou je však rýchlejšia produkcia nižšími eukaryotmi alebo baktériami [105]. V prípade špecifických substitúcií v CH2 a/ alebo CH3, ako napr. S298G/ T299A, si dokážu zachovať schopnosť väzby určitých FcγR receptorov, ktorá je inak závislá na glykozylácii [106,107].
Záver
Protilátky nie sú len nevyhnutnými komponentami nášho imunitného systému, ale aj modernými nástrojmi terapie závažných ochorení. Glykozylácie protilátok významne vplývajú na ich funkciu (obr. 4). Medzi tieto procesy zaraďujeme najmä apoptózu, ADCC, ADCP či CDC. Obrovské množstvo zložiek, ktoré imunitný systém tvorí, však vytvára spletitosť signálnych dráh, a preto stále nie je poznanie ich presnej funkcie v prirodzených i v patologických procesoch dostatočne definované. Po odhalení funkcií jednotlivých glykozylácií či už za fyziologických alebo patologických podmienok bude umožnené navrhovať protilátky alebo aj Fc-fúzované preparáty [108] s glykozyláciami zabezpečujúcimi ešte cieľenejšiu a efektívnejšiu terapiu.
Image 4. Faktory ovplyvňujúce glykozyláciu protilátok a efekty týchto glykozylácií na štruktúru a funkciu protilátok. 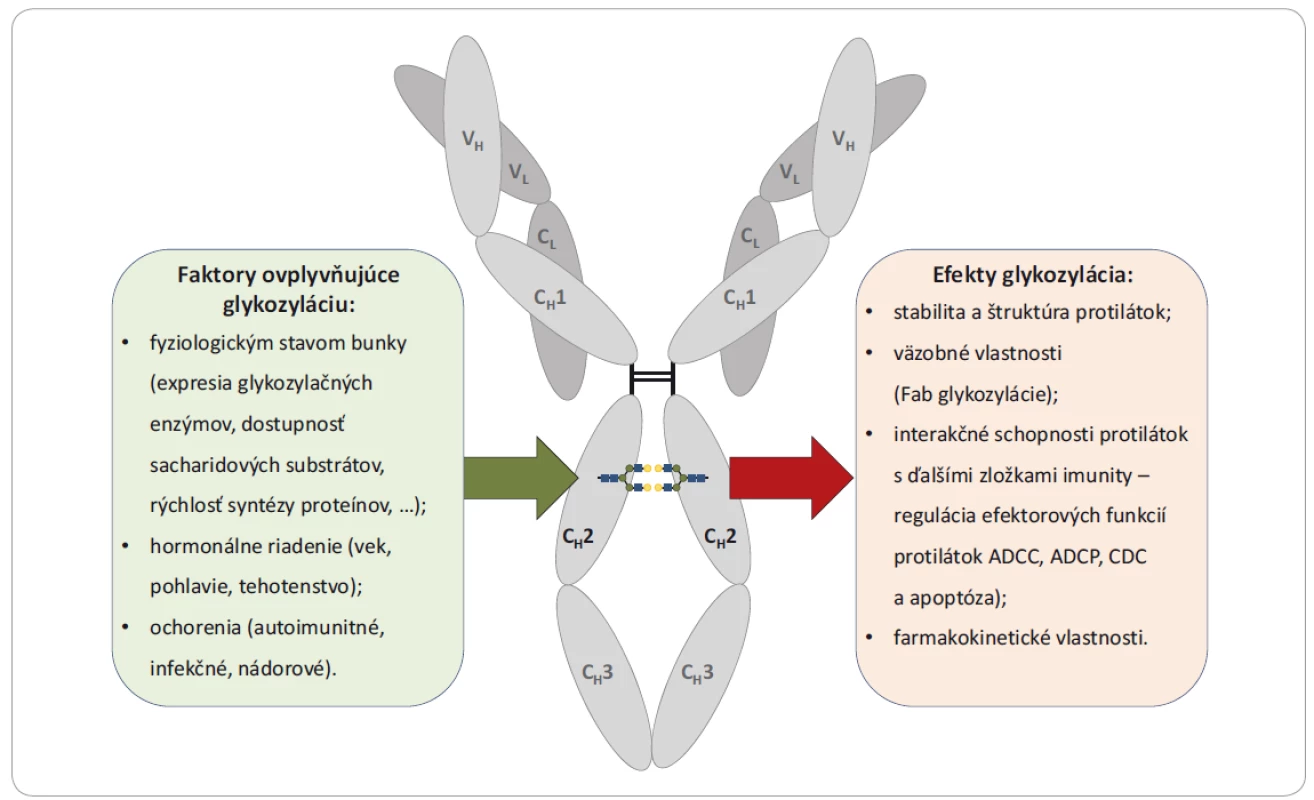
Fab – fragment viazajúci antigén, ADCC – bunková cytotoxicita závislá na protilátkach, ADCP – bunková fagocytóza závislá na protilátkach, CDC – cytotoxicita závislá na komplemente Táto práca bola podporená projektom MŠMT – NPU I – LO1413, MZ ČR – RVO (MOÚ, 00209805) a GAČR 16-04496S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Mgr. Lukáš Uhrík
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: lukas.uhrik@mou.cz
Obdržané/Submitted: 18. 6. 2019
Prijaté/Accepted: 3. 9. 2019
Sources
10.4049/ jimmunol.1402025.
56. Takahashi N, Tetaert D, Debuire B et al. Complete amino acid sequence of the delta heavy chain of human immunoglobulin D. Proc Natl Acad Sci USA 1982; 79(9): 2850 – 2854. doi: 10.1073/ pnas.79.9.2850.
57. Pucić M, Knezevic A, Vidic J et al. High throughput isolation and glycosylation analysis of IgG-variability and heritability of the IgG glycome in three isolated human populations. Mol Cell Proteomics 2011; 10(10): M111. doi: 10.1074/ mcp.M111.010090.
58. Kapur R, Kustiawan I, Vestrheim A et al. A prominent lack of IgG1-Fc fucosylation of platelet alloantibodies in pregnancy. Blood 2014; 123(4): 471 – 480. doi: 10.1182/ blood-2013-09-527978.
59. Menni C, Keser T, Mangino M et al. Glycosylation of immunoglobulin g: role of genetic and epigenetic influences. PLoS One 2013; 8(12): e82558. doi: 10.1371/ journal.pone.0082558.
60. Krištić J, Vučković F, Menni C et al. Glycans are a novel biomarker of chronological and biological ages. J Gerontol A Biol Sci Med Sci 2014; 69(7): 779 – 789. doi: 10.1093/ gerona/ glt190.
61. Ercan A, Kohrt WM, Cui J et al. Estrogens regulate glycosylation of IgG in women and men. JCI Insight 2017; 2(4): e89703. doi: 10.1172/ jci.insight.89703.
62. Ruhaak LR, Uh HW, Beekman M et al. Decreased levels of bisecting GlcNAc glycoforms of IgG are associated with human longevity. PLoS One 2010; 5(9): e12566. doi: 10.1371/ journal.pone.0012566.
63. van de Geijn FE, Wuhrer M, Selman MH et al. Immunoglobulin G galactosylation and sialylation are associated with pregnancy-induced improvement of rheumatoid arthritis and the postpartum flare: results from a large prospective cohort study. Arthritis Res Ther 2009; 11(6): R193. doi: 10.1186/ ar2892.
64. Bondt A, Selman MH, Deelder AM et al. Association between galactosylation of immunoglobulin G and improvement of rheumatoid arthritis during pregnancy is independent of sialylation. J Proteome Res 2013; 12(10): 4522 – 4531. doi: 10.1021/ pr400589m.
65. Novokmet M, Lukic E, Vuckovic F et al. Changes in IgG and total plasma protein glycomes in acute systemic inflammation. Sci Rep 2014; 4 : 4347. doi: 10.1038/ srep04347.
66. Troelsen LN, Jacobsen S, Abrahams JL et al. IgG glycosylation changes and MBL2 polymorphisms: associations with markers of systemic inflammation and joint destruction in rheumatoid arthritis. J Rheumatol 2012; 39(3): 463 – 469. doi: 10.3899/ jrheum.110584.
67. Pezer M, Stambuk J, Perica M et al. Effects of allergic diseases and age on the composition of serum IgG glycome in children. Sci Rep 2016; 6 : 33198. doi: 10.1038/ srep33198.
68. de Jong SE, Selman MH, Adegnika AA et al. IgG1 Fc N-glycan galactosylation as a biomarker for immune activation. Sci Rep 2016; 6 : 28207. doi: 10.1038/ srep28207.
69. Mittermayr S, Le GN, Clarke C et al. Polyclonal immunoglobulin G N-glycosylation in the pathogenesis of plasma cell disorders. J Proteome Res 2017; 16(2): 748 – 762. doi: 10.1021/ acs.jproteome.6b00768.
70. Kodar K, Stadlmann J, Klaamas K, Sergeyev B, Kurtenkov O. Immunoglobulin G Fc N-glycan profiling in patients with gastric cancer by LC-ESI-MS: relation to tumor progression and survival. Glycoconj J 2012; 29(1): 57 – 66. doi: 10.1007/ s10719-011-9364-z.
71. Bones J, Mittermayr S, O’Donoghue N et al. Ultra performance liquid chromatographic profiling of serum N-glycans for fast and efficient identification of cancer associated alterations in glycosylation. Anal Chem 2010; 82(24): 10208 – 10215. doi: 10.1021/ ac102860w.
72. Kanoh Y, Mashiko T, Danbara M et al. Analysis of the oligosaccharide chain of human serum immunoglobulin G in patients with localized or metastatic cancer. Oncology 2004; 66(5): 365 – 370. doi: 10.1159/ 000079484.
73. Arnold JN, Saldova R, Galligan MC et al. Novel glycan biomarkers for the detection of lung cancer. J Proteome Res 2011; 10(4): 1755 – 1764. doi: 10.1021/ pr101034t.
74. Markiewski MM, DeAngelis RA, Benencia F et al. Modulation of the antitumor immune response by complement. Nat Immunol 2008; 9(11): 1225 – 1235. doi: 10.1038/ ni.1655.
75. Vuckovic F, Theodoratou E, Thaci K et al. IgG glycome in colorectal cancer. Clin Cancer Res 2016; 22(12): 3078 – 3086. doi: 10.1158/ 1078-0432.CCR-15-1867.
76. Theodoratou E, Thaci K, Agakov F et al. Glycosylation of plasma IgG in colorectal cancer prognosis Sci Rep 2016; 6 : 28098. doi: 10.1038/ srep28098.
77. Kanoh Y, Ohara T, Tadano T et al. Changes to N-linked oligosaccharide chains of human serum immunoglobulin G and matrix metalloproteinase-2 with cancer progression. Anticancer Res 2008; 28(2A): 715 – 720.
78. Qian Y, Wang Y, Zhang X et al. Quantitative analysis of serum IgG galactosylation assists differential diagnosis of ovarian cancer. J Proteome Res 2013; 12(9): 4046 – 4055. doi: 10.1021/ pr4003992.
79. Beck A, Wurch T, Bailly C et al. Strategies and challenges for the next generation of therapeutic antibodies. Nat Rev Immunol 2010; 10(5): 345 – 352. doi: 10.1038/ nri2747.
80. Kaplon H, Reichert JM. Antibodies to watch in 2018. MAbs 2018; 10(2): 183 – 203. doi: 10.1080/ 19420862. 2018.1415671.
81. Kaplon H, Reichert JM. Antibodies to watch in 2019. MAbs 2019; 11(2): 219 – 238. doi: 10.1080/ 19420862.2018. 1556465.
82. Kirchhoff CF, Wang XM, Conlon HD et al. Biosimilars: key regulatory considerations and similarity assessment tools. Biotechnol Bioeng 2017; 114(12): 2696 – 2705. doi: 10.1002/ bit.26438.
83. Jefferis R. Glycosylation of recombinant antibody therapeutics. Biotechnol Prog 2005; 21(1): 11 – 16. doi: 10.1021/ bp040016j.
84. Raju S. Glycosylation variations with expression systems and their impact on biological activity of therapeutic immunoglobulins. BioProcess International 2003; 1 : 44 – 53.
85. Yoo EM, Chintalacharuvu KR, Penichet MLet al. Myeloma expression systems. J Immunol Methods 2002; 261(1 – 2): 1 – 20. doi: 10.1016/ s0022-1759(01)00559-2.
86. Liu CP, Tsai TI, Cheng T et al. Glycoengineering of antibody (Herceptin) through yeast expression and in vitro enzymatic glycosylation. Proc Natl Acad Sci USA 2018; 115(4): 720 – 725. doi: 10.1073/ pnas.1718172115.
87. Li H, Sethuraman N, Stadheim TA et al. Optimization of humanized IgGs in glycoengineered Pichia pastoris. Nat Biotechnol 2006; 24(2): 210 – 215. doi: 10.1038/ nbt1178.
88. Durocher Y, Butler M. Expression systems for therapeutic glycoprotein production. Curr Opin Biotechnol 2009; 20(6): 700 – 707. doi: 10.1016/ j.copbio.2009.10.008.
89. Ha S, Wang Y, Rustandi RR. Biochemical and biophysical characterization of humanized IgG1 produced in Pichia pastoris. MAbs 2011; 3(5): 453 – 460. doi: 10.4161/ mabs.3.5.16891.
90. Sehn LH, Assouline SE, Stewart DA et al. A phase 1 study of obinutuzumab induction followed by 2 years of maintenance in patients with relapsed CD20-positive B-cell malignancies. Blood 2012; 119(22): 5118 – 5125. doi: 10.1182/ blood-2012-02-408773.
91. Ashwell G, Harford J. Carbohydrate-specific receptors of the liver. Annu Rev Biochem 1982; 51 : 531 – 554. doi: 10.1146/ annurev.bi.51.070182.002531.
92. Mi Y, Lin A, Fiete D et al. Modulation of mannose and asialoglycoprotein receptor expression determines glycoprotein hormone half-life at critical points in the reproductive cycle. J Biol Chem 2014; 289(17): 12157 – 12167. doi: 10.1074/ jbc.M113.544973.
93. Baenziger JU, Fiete D. Galactose and N-acetylgalactosamine-specific endocytosis of glycopeptides by isolated rat hepatocytes. Cell 1980; 22(2 Pt 2): 611 – 620. doi: 10.1016/ 0092-8674(80)90371-2.
94. Park EI, Manzella SM, Baenziger JU. Rapid clearance of sialylated glycoproteins by the asialoglycoprotein receptor. J Biol Chem 2003; 278(7): 4597 – 4602. doi: 10.1074/ jbc.M210612200.
95. Taylor ME, Drickamer K. Structural requirements for high affinity binding of complex ligands by the macrophage mannose receptor. J Biol Chem 1993; 268(1): 399 – 404.
96. Zhou Q, Qiu H. The mechanistic impact of N-glycosylation on stability, pharmacokinetics, and immunogenicity of therapeutic proteins. J Pharm Sci 2019; 108(4): 1366 – 1377. doi: 10.1016/ j.xphs.2018.11.029.
97. Liu L, Stadheim A, Hamuro L et al. Pharmacokinetics of IgG1 monoclonal antibodies produced in humanized Pichia pastoris with specific glycoforms: a comparative study with CHO produced materials. Biologicals 2011; 39(4): 205 – 210. doi: 10.1016/ j.biologicals.2011.06.002.
98. Leabman MK, Meng YG, Kelley RF et al. Effects of altered FcgammaR binding on antibody pharmacokinetics in cynomolgus monkeys. MAbs 2013; 5(6): 896 – 903. doi: 10.4161/ mabs.26436.
99. Endo T, Wright A, Morrison SL et al. Glycosylation of the variable region of immunoglobulin G-site specific maturation of the sugar chains. Mol Immunol 1995; 32(13): 931 – 940. doi: 10.1016/ 0161-5890(95)00078-s.
100. Mimura Y, Katoh T, Saldova R et al. Glycosylation engineering of therapeutic IgG antibodies: challenges for the safety, functionality and efficacy. Protein Cell 2018; 9(1): 47 – 62. doi: 10.1007/ s13238-017-0433-3.
101. Goetze AM, Liu YD, Zhang Z et al. High-mannose glycans on the Fc region of therapeutic IgG antibodies increase serum clearance in humans. Glycobiology 2011; 21(7): 949 – 959. doi: 10.1093/ glycob/ cwr027.
102. Malhotra R, Wormald MR, Rudd PM et al. Glycosylation changes of IgG associated with rheumatoid arthritis can activate complement via the mannose-binding protein. Nat Med 1995; 1(3): 237 – 243.
103. Ju MS, Jung ST. Aglycosylated full-length IgG antibodies: steps toward next-generation immunotherapeutics. Curr Opin Biotechnol 2014; 30 : 128 – 139. doi: 10.1016/ j.copbio.2014.06.013.
104. Jung ST, Kang TH, Kelton W et al. Bypassing glycosylation: engineering aglycosylated full-length IgG antibodies for human therapy. Curr Opin Biotechnol 2011; 22(6): 858 – 867. doi: 10.1016/ j.copbio.2011.03.002.
105. Simmons LC, Reilly D, Klimowski L et al. Expression of full-length immunoglobulins in Escherichia coli: rapid and efficient production of aglycosylated antibodies. J Immunol Methods 2002; 263(1 – 2): 133 – 147. doi: 10.1016/ s0022-1759(02)00036-4.
106. Sazinsky SL, Ott RG, Silver NW et al. Aglycosylated immunoglobulin G1 variants productively engage activating Fc receptors. Proc Natl Acad Sci USA 2008; 105(51): 20167 – 20172. doi: 10.1073/ pnas.0809257105.
107. Jung ST, Reddy ST, Kang TH et al. Aglycosylated IgG variants expressed in bacteria that selectively bind FcgammaRI potentiate tumor cell killing by monocyte-dendritic cells. Proc Natl Acad Sci USA 2010; 107(2): 604 – 609. doi: 10.1073/ pnas.0908590107.
108. Jafari R, Zolbanin NM, Rafatpanah H et al. Fc-fusion proteins in therapy: an updated view. Curr Med Chem 2017; 24(12): 1228 – 1237. doi: 10.2174/ 0929867324666170113112759.
109. Plosker GL, Figgitt DP. Rituximab: a review of its use in non-Hodgkin‘s lymphoma and chronic lymphocytic leukaemia. Drugs 2003; 63(8): 803 – 843. doi: 10.2165/ 00003495-200363080-00005.
110. Weiner GJ. Rituximab: mechanism of action. Semin Hematol 2010; 47(2): 115 – 123. doi: 10.1053/ j.seminhematol.2010.01.011.
111. Hurwitz H, Fehrenbacher L, Novotny W et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350(23): 2335 – 2342. doi: 10.1056/ NEJMoa032691.
112. Velcheti V, Viswanathan A, Govindan R: The proportion of patients with metastatic non-small cell lung cancer potentially eligible for treatment with bevacizumab: a single institutional survey. J Thorac Oncol 2006 Jun; 1(5): 501.
113. von Minckwitz G, Eidtmann H, Rezai M et al. Neoadjuvant chemotherapy and bevacizumab for HER2-negative breast cancer. N Engl J Med 2012; 366(4): 299 – 309. doi: 10.1056/ NEJMoa1111065.
114. Gibiansky L, Sutjandra L, Doshi S et al. Population pharmacokinetic analysis of denosumab in patients with bone metastases from solid tumours. Clin Pharmacokinet 2012; 51(4): 247 – 260. doi: 10.2165/ 11598090-000000000-00000.
115. de Weers M, Tai YT, van der Veer MS et al. Daratumumab, a novel therapeutic human CD38 monoclonal antibody, induces killing of multiple myeloma and other hematological tumors. J Immunol 2011; 186(3): 1840 – 1848. doi: 10.4049/ jimmunol.1003032.
116. Jonker DJ, O’Callaghan CJ, Karapetis CS et al. Cetuximab for the treatment of colorectal cancer. N Engl J Med 2007; 357(20): 2040 – 2048. doi: 10.1056/ NEJMoa071834.
117. Bonner JA, Harari PM, Giralt J et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006; 354(6): 567 – 578. doi: 10.1056/ NEJMoa053422.
118. Barok M, Joensuu H, Isola J. Trastuzumab emtansine: mechanisms of action and drug resistance. Breast Cancer Res 2014; 16(2): 209. doi: 10.1186/ bcr3621.
119. Verma S, Miles D, Gianni L et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012; 367(19): 1783 – 1791. doi: 10.1056/ NEJMoa1209124.
120. Boyerinas B, Jochems C, Fantini M et al. Antibody-dependent cellular cytotoxicity activity of a novel anti-PD-L1 antibody avelumab (MSB0010718C) on human tumor cells. Cancer Immunol Res 2015; 3(10): 1148 – 1157. doi: 10.1158/ 2326-6066.CIR-15-0059.
121. Nahta R, Hung MC, Esteva FJ. The HER-2-targeting antibodies trastuzumab and pertuzumab synergistically inhibit the survival of breast cancer cells. Cancer Res 2004; 64(7): 2343 – 2346.
122. Swain SM, Baselga J, Kim SB et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015; 372(8): 724 – 734. doi: 10.1056/ NEJMoa1413513.
123. Dienstmann R, Tabernero J. Necitumumab, a fully human IgG1 mAb directed against the EGFR for the potential treatment of cancer. Curr Opin Investig Drugs 2010; 11(12): 1434 – 1441.
124. Garnock-Jones KP. Necitumumab: first global approval. Drugs 2016; 76(2): 283 – 289. doi: 10.1007/ s40265-015-0537-0.
125. Ribas A, Hamid O, Daud A et al. Association of pembrolizumab with tumor response and survival among patients with advanced melanoma. JAMA 2016; 315(15): 1600 – 1609. doi: 10.1001/ jama.2016.4059.
126. Borcoman E, Le Tourneau C. Pembrolizumab in cervical cancer: latest evidence and clinical usefulness. Ther Adv Med Oncol 2017; 9(6): 431 – 439. doi: 10.1177/ 1758834017708742.
127. Gandhi L, Rodriguez-Abreu D, Gadgeel S et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med 2018; 378(22): 2078 – 2092. doi: 10.1056/ NEJMoa1801005.
128. Markham A, Duggan S. Cemiplimab: first global approval. Drugs 2018; 78(17): 1841 – 1846. doi: 10.1007/ s40265-018-1012-5.
129. Migden MR, Rischin D, Schmults CD et al. PD-1 blockade with cemiplimab in advanced cutaneous squamous-cell carcinoma. N Engl J Med 2018; 379(4): 341 – 351. doi: 10.1056/ NEJMoa1805131.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2019 Issue Supplementum 3-
All articles in this issue
- Méně časté mutace EGFR v kontextu léčby nemalobuněčného karcinomu plic
- CRISPR-Cas9 jako nástroj v terapii nádorových onemocnění
- Syntetická letalita – její současné využití a potenciál v onkologické léčbě
- Pokroky ve využití organokovových sloučenin při vývoji protinádorových léčiv
- Souhrn aktuálních poznatků o úloze estrogenového receptoru α v nádorové buněčné signalizaci
- Glykoproteiny v sérech onkologických pacientů
- Glykozylácia ako dôležitý regulátor funkcie protilátok
- Výskum ubikvitinácie proteínov v onkológii
- Dlouhé nekódující RNA – současné možnosti detekce a využití v klinické praxi
- Interakce onkogenních virových proteinů s proteiny rodiny p53
- Editorial 2019
- Kooperace genomických, transkriptomických a proteomických metod v detekci mutovaných proteinů
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výskum ubikvitinácie proteínov v onkológii
- CRISPR-Cas9 jako nástroj v terapii nádorových onemocnění
- Glykozylácia ako dôležitý regulátor funkcie protilátok
- Méně časté mutace EGFR v kontextu léčby nemalobuněčného karcinomu plic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

