-
Medical journals
- Career
Nemalobuněčný karcinom plic s expresí estrogenových receptorů a pozitivitou ALK
Authors: L. Žarnayová 1; V. Kolek 1; J. Bouchal 2; J. Ehrmann 3
Authors‘ workplace: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc 1; Ústav molekulární a translační medicíny, LF UP v Olomouci 2; Ústav klinické a molekulární patologie, LF UP a FN Olomouc 3
Published in: Klin Onkol 2018; 31(6): 457-460
Category: Case Report
doi: https://doi.org/10.14735/amko2018457Overview
Východiska:
Estrogeny jsou steroidní hormony, které za normálních okolností ovlivňují řadu fyziologických funkcí v buňkách, známá je jejich nezastupitelná úloha v reprodukčním sytému. Jejich účinek je dán vazbou na estrogenové receptory (ER). U ER jsou rozeznávány dva hlavní subtypy – ERα a ERβ. Exprese ER jsou exprimovány nejen v buňkách orgánů reprodukčních systémů. Známá je jejich exprese i v buňkách kostí, mozku, ve střevě, v endotelu, v ledvinách, v plicích a dalších tkáních. Přítomnost ER v buňkách karcinomu plic (lung cancer – LC) byla poprvé popsána počátkem 80. let 20. století. V odborné literatuře jsou popsány také koincidence exprese ERβ s aktivační mutací epidermálního růstového faktoru, zvažován je i aditivní antiproliferační efekt antiestrogenů a inhibitorů tyrozinkináz v léčbě adenokarcinomu plic. Koincidence exprese ER a translokace ALK v dostupné literatuře doposud popsána nebyla. Čtyřleté přežití u generalizovaného nemalobuněčného karcinomu plic ukazuje na literárně diskutovanou možnost, že oba molekulární znaky (exprese ER a ALK pozitivita) mohou být příznivým prognostickým biomarkerem u tohoto nádoru.
Případ:
Je popsán případ 69leté nemocné s generalizovaným adenokarcinomem plic, u něhož byla prokázána pozitivita ER a fúzního genu ALK-EML4. Nádor byl zjištěn ve stadiu IV a dodatečným vyšetřením bylo spolehlivě vyloučeno maligní onemocnění gynekologické oblasti. Nemocná byla léčena chemoterapií a tyrozinkinázovým inhibitorem ALK.
Závěr:
Úloha jednotlivých podtypů ER v kancerogenezi LC a v možnostech jejího léčebného ovlivnění není jednoznačně stanovena. Jedná se o první popsaný případ koincidence ALK-EML4 a ERβ u LC.
Klíčová slova
nemalobuněčný karcinom plic – estrogenové receptory – ALK translokace – prognóza – léčba
Úvod
Nemalobuněčný karcinom plic (non small cell lung cancer – NSCLC) zůstává nádorem s velmi špatnou prognózou, nicméně se vyčleňují jeho podtypy s biologickými charakteristikami, které mohou směřovat k úspěšné cílené léčbě. Estrogeny jsou steroidní hormony, které za normálních okolností ovlivňují řadu fyziologických funkcí v buňkách reprodukčního systému, ale mohou ovlivnit i kancerogenezi. Jejich účinek je dán vazbou na estrogenové receptory (ER), u nichž jsou rozeznávány 2 hlavní subtypy – ERα a ERβ. Exprese ER byla nalezena i v buňkách kostí, mozku, střeva, ledvin, v endotelu a dalších tkáních. Exprese ER v plicích byla poprvé popsána v roce 1982 [1]. V roce 1985 bylo poukázáno na expresi ER ve zdravé i nádorové tkáni a byla vyslovena hypotéza, že karcinom plic (lung cancer – LC) je hormon-dependentní tumor, což vedlo k úvaze o možnosti jeho terapeutického ovlivnění antiestrogeny [2]. Fúzní gen ALK-EML4 byl poprvé popsán u anaplastického lymfomu a jeho výskyt u NSCLC byl poprvé zjištěn v roce 2007 a vyskytuje se asi u 3–5 % těchto nádorů [3]. Tato mutace má prokazatelně onkogenní potenciál a stala se vhodnou strukturou pro reálnou cílenou léčbu. Popisujeme kazuistiku nemocné s generalizovaným plicním adenokarcinomem a současným výskytem ER exprese a ALK transformace v nádoru.
Kazuistika
Prezentujeme případ 69leté pacientky, která byla vyšetřována pro generalizovaný tumor nejasného origa. V listopadu 2013 byl za pomoci video-asistované torakoskopie (VATS) z biopsie metastatického ložiska pleury diagnostikován generalizovaný plicní adenokarcinom TXN1M1a, stadium IV. Další vyšetření ukázalo nepřítomnost mutací receptoru epidermálního růstového faktoru (epidermal growth factor receptor – EGFR) a pozitivitu EML4/ ALK translokace, imunohistochemicky byla potvrzena také pozitivita ERα. Pro detekci ER byly použity zaječí monoklonální protilátky, klon SP1. Jednalo se o nekuřačku, s plicemi v minulosti neléčenou. Nemocné bylo ve spádovém zařízení podáno v 1. linii léčby šest cyklů chemoterapie ve složení cisplatina a vinorelbin a následně byla dispenzarizována. Kontrolní vyšetření pozitronovou emisní tomografií/výpočetní tomografií (PET/ CT) v únoru 2015 ve srovnání se vstupním vyšetřením prokázalo stabilizaci onemocnění. V listopadu 2016 CT plic a břicha prokázala progresi onemocnění. Generalizace byla přítomna v lymfatických uzlinách mediastina a peritonea, levém plicním hilu, plicích a játrech. V levé plíci byla vícečetná ložiska velikosti 15–20 mm, metastatické ložisko v játrech v segmentu S8 mělo velikost 27 mm. Před odesláním na naši kliniku k dalšímu vyšetření a terapii bylo realizováno ještě ve spádu v lednu 2017 PET/ CT vyšetření (obr. 1), kde byla popsána také mnohočetná generalizace do žaludku, pankreatu a skeletu. Pro dyspeptické potíže bylo doplněno gastroskopické vyšetření s nálezem přisedlého polypu, histologicky se jednalo o metastatický adenokarcinom (CK7+, TTF-1+ a napsin A+, EML4/ ALK+). Mamografie byla negativní, hysteroskopie popsala sliznici normálního vzhledu bez vizuálních známek malignity, histologicky negativní. Na naší klinice bylo doplněno bronchoskopické vyšetření s obrazem vyklenutí zadní stěny levého hlavního bronchu s nerovnou infiltrovanou sliznicí a stenóza levého dolního bronchu. Z biopsie histologicky ověřen adenokarcinom středně diferencovaný (CK7+, TTF1+, napsin A+, CD56-, EML4/ ALK+ ve 100 %), opět prokázána pozitivita ER. Pro vertigo a trvající dyspepsie s nauzeou a vomitem provedeno CT mozku s kontrastem, které bylo bez průkazu metastáz.
Image 1. PET/CT zobrazení mnohočetného postižení žaludku, pankreatu a skeletu. 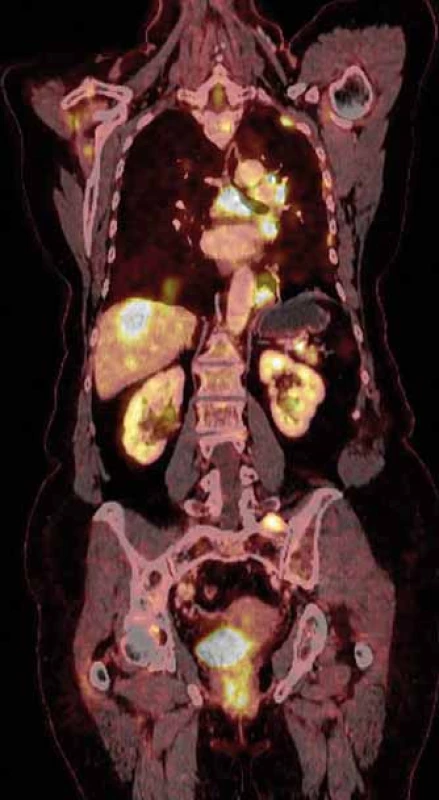
Vzhledem k pozitivitě ALK translokace bylo rozhodnuto o zahájení 2. linie léčby krizotinibem. Kontrolní skiagram hrudníku v březnu 2017 ukázal parciální regresi zastínění v oblasti levého plicního hilu ve srovnání se vstupním skiagramem. Pro podezření na nežádoucí účinky krizotinibu (zhoršení vertiga, hypacusis) musela být dávka snížena na 250 mg/ den (od 31. března 2017). Byla doplněna ještě magnetická rezonance mozku, která neprokázala přítomnost nádoru. Poslední kontrola v naší pneumoonkologické ambulanci proběhla 11. dubna 2017.
Na skiagramu hrudníku byla zjištěna další regrese onemocnění (obr. 2). Na plánovanou ambulantní kontrolu se pacientka nedostavila a 16. května 2017 zemřela během krátké hospitalizace na plicním oddělení spádové nemocnice. Zde byla hospitalizována pro celkové zhoršení stavu s dominující neurologickou symptomatologií, která nebyla blíže vyšetřena. Čtyřleté přežití (overall survival – OS) nemocné s generalizovaným adenokarcinomem plic je přesto možno považovat za terapeutický úspěch. Příčinou dyspeptických potíží mohla být poměrně vzácná generalizace do stěny žaludku, neurologické potíže nebyly vysvětleny.
Image 2. Skiagram hrudníku, vlevo únor 2017, vpravo duben 2017. 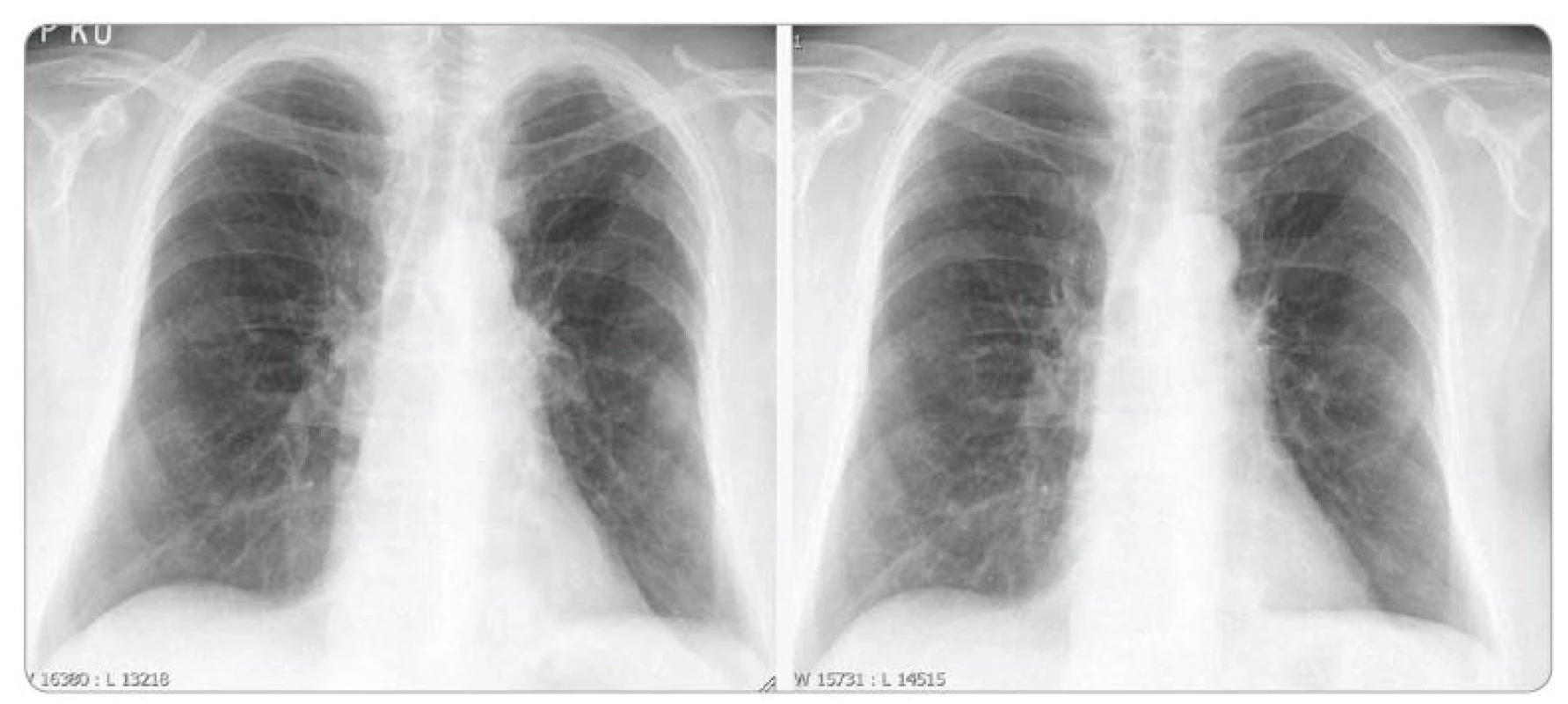
Diskuze
Vztah mezi expresí ER, koncentrací estradiolu v nádorové tkáni, pohlavím, velikostí tumoru, odpovědí na protinádorovou terapii a délkou OS je předmětem klinického výzkumu [4]. Úloha estrogenů v etiologii LC není zcela jasná a existuje řada studií s nejednoznačnými výsledky. Přesto se zdá, že může být exprese ER, resp. ERβ prognostickým ukazatelem. Schwartz et al popsali na souboru 280 pacientů expresi ERβ ve zdravé plicní tkáni (u 20 % vyšetřených) a jeho zvýšenou expresi v nádorové tkáni (u 61 % NSCLC, z toho u 70,3 % mužů a 58,3 % žen, u 77,7 % adenokarcinomů) [5]. Přítomnost ERα nebyla prokázána, exprese ER byla kvantitativně řádově nižší než u karcinomu prsu. U mužů s nádorem a pozitivitou ER bylo popsáno statisticky významně delší OS. Rovněž Atmaca et al popsali přítomnost vyšší exprese ER spojenou s delším mediánem OS metastatického NSCLC, a to 10,9 měsíce ve srovnání s pacienty s nízkou expresí ER, kde byl medián OS 5,0 měsíce (p = 0,03), dalším příznivým faktorem bylo mužské pohlaví a věk < 75 let [6]. Naopak studie Skjevstada z roku 2016, provedená na souboru 335 pacientů, popsala zvýšenou koncentraci ERβ jako signifikantně negativní prognostický faktor [7]. Dalším faktorem byla zvýšená produkce aromatázy jako klíčového enzymu biosyntézy steroidních hormonů. Metaanalýza 11 studií však žádný vliv zvýšené exprese ERβ na prognózu NSCLC nepotvrdila, což mohlo být důsledkem odlišných metod použitých v jednotlivých studiích [8]. U novějších studií se blíže diferencují typy ER exprese a také různé podtypy NSCLC. U adenokarcinomu byla popsána silná cytoplazmická i nukleární exprese ER (ve 49,4, resp. 48,5 %). Vyšší nukleární exprese ER byla asociována s výskytem mutací EGFR [9]. Tato exprese korelovala s delším časem do progrese (disease-free survival – DFS) u nemocných s EGFR mutacemi, zatímco u EGFR nemutovaných nádorů žádný prognostický vliv zjištěn nebyl [9,10]. Největší prospektivní studie z roku 2018 analyzovala soubor 981 pacientů s časnými stadii NSCLC po stránce exprese ER a exprese receptoru pro epidermální růstový faktor 2 (HER-2) [4]. U skvamózního LC byla zjištěna vyšší exprese ERα v cytoplazmě buněk ve srovnání s adenokarcinomem, zatímco adenokarcinom měl vyšší expresi receptoru HER-2. Nukleární exprese ERα byla zjištěna vyšší u žen, nekuřaček a adenokarcinomu. Příležitostné kuřačky, pacientky po menopauze a pacientky s anamnestickým údajem užívání hormonální antikoncepce měly nižší expresi jaderných ERβ a celkově nižší expresi jaderných i cytoplazmatických progesteronových receptorů. Exprese cytoplazmatických ERα a jaderných ERβ byla u žen nižší než u mužů. Kuřáci měli expresi obou ER vyšší než nekuřáci, ale nižší celkovou expresi progesteronových receptorů než nekuřáci. Vyšší cytoplazmatická a jaderná exprese ER byla spojená s horším OS. Nižší exprese jaderného ERβ u žen po menopauze a žen anamnesticky užívajících hormonální antikoncepci podporuje estrogenovou hypotézu u LC [4]. Jiné studie ukazují, že cytoplazmatická a jaderná exprese ER je spojená s horším OS pouze při současné expresi aromatáz [11,12].
Otázkou je, jaké má zvýšená exprese ER u LC terapeutické konsekvence. Tuto možnost podporuje studie o působení inhibitoru aromatáz či antiestrogenů, které navodily in vitro redukci růstu buněk LC [13]. Některé práce uvádějí, že estrogen a ER můžou aktivovat kaskádu nereceptorových tyrozinkináz a ovlivnit tak růst, proliferaci a apoptózu nádorové buňky in vitro i in vivo [14]. Bylo napsáno několik prací o funkčních vazbách mezi ER and EGFR, které vesměs ukazují vzájemnou stimulaci signalizace [14,15]. Kombinace antagonistů ER (tamoxifen) a tyrozinkinázového inhibitoru EGFR (gefitinib) snížila proliferaci buněk a růstu nádoru in vitro i in vivo a lze spekulovat, že by tato kombinace mohla potencovat účinek biologické léčby u adenokarcinomu plic s prokázanou expresí ER a mutací EGFR [14]. Je zřejmé, že hormonální rovnováhu ovlivňuje řada faktorů, jako je kouření, pohlaví, věk nebo typ nádoru, ale komplexní vztahy ER v plicích jsou určitě složitější. Například byly popsány ER spojené s G-proteiny, jejichž význam u LC je zatím zcela neznámý [16,17]. Značné rozdíly v jednotlivých závěrech studií s prokázanou expresí ER vedly k vzniku publikace Anderssona et al, zveřejněné v červenci 2017, která popsala detailní validaci 13 protilátek proti ERβ. Na nejednoznačných závěrech dosud publikovaných studií se podepsaly falešně pozitivní výsledky imunohistochemického vyšetření. Za specifickou protilátku je považován pouze klon PPZ0506 [18].
ALK translokace se nachází v naprosté většině pouze u plicního adenokarcinomu. Nemocní jsou častěji nekuřáci mladšího věku, rasově není výskyt ovlivněn, častěji dochází k metastazování do mozku. Léčebně lze kromě krizotinibu využít řadu tyrozinkinázových inhibitorů ALK [19,20]. O interakcích ER a fúze ALK-EML4 nebo bodových mutací ALK zatím literatura chybí. Koincidence exprese ER a translokace ALK uvedená v naší kazuistice v dostupné literatuře doposud popsána nebyla.
Závěr
Byl popsán případ dlouhého OS nemocné s generalizovaným NSCLC, u kterého byla potvrzena exprese ER a ALK translokace. ER jsou u LC zapojeny do komplexní sítě signálních drah a buněčných interakcí. K jejich specifickému uplatnění v léčbě budou potřebné další informace.
Tato práce byla podpořena grantem AZV 16-32318A od Ministerstva zdravotnictví ČR a grantem NPU I LO1304 od Ministerstva školství, mládeže a tělovýchovy ČR.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Obdrženo: 23. 9. 2018
Přijato: 25. 10. 2018
MUDr. Lýdia Žarnayová
Klinika plicních nemocí a tuberkulózy
LF UP a FN Olomouc
I. P. Pavlova 185/6
779 00 Olomouc
e-mail: lydia.zarnayova@fnol.cz
Sources
1. Chaudhuri PK, Thoms PA, Walker MJ et al. Steroid receptors in human lung cancer cytosols. Cancer Lett 1982; 16(3): 327–332.
2. Beattie CW, Hansen NW, Thomas PA. Steroid receptors in human lung cancer. Cancer Res 1985; 45(9): 4206–4214.
3. Soda M, Choi YL, Enomoto M et al. Identification of the transforming EML4-ALK fusion gene in non-small cell lung cancer. Nature 2007; 448(7153): 561–566. doi: 10.1038/ nature05945.
4. Cheng TD, Darke AK, Redman MW et al. Smoking, sex, and non–small cell lung cancer in steroid hormone receptors in tumor tissue (S0424). J Natl Cancer Inst 2018; 110(7): 734–742. doi: 10.1093/ jnci/ djx260.
5. Schwartz AG, Prysak GM, Murphy V et al. Nuclear estrogen receptor beta in lung cancer: expression and survival differences by sex. Clin Cancer Res 2005; 11(20): 7280–7287. doi: 10.1158/ 1078-0432.CCR-05-0498.
6. Atmaca A, Al-Batran SE, Wirtz RM et al. The validation of estrogen receptor 1 mRNA expression as a predictor of outcome in patients with metastatic non-small cell lung cancer. Int J Cancer 2014; 134(10): 2314–2321. doi: 10.1002/ ijc.28571.
7. Skjevstad K, Grindstad T, Rakaee Khanehkenari M et al. Prognostic relevance of estrogen receptor α, β and aromatase expression in non-small cell lung cancer. Steroids 2016; 113 : 5–13. doi: 10.1016/ j.steroids.2017.11.010.
8. Ma L, Zhan P, Liu Y et al. Prognostic value of the expression of estrogen receptor β in pacients with non-small cell lung cancer: a meta-analysis. Transl Lung Cancer Res 2016; 5(2): 202–207. doi: 10.21037/ tlcr.2016.04.04.
9. Nose N, Sugio K, Oyama T et al. Association between estrogen receptor-beta expression and epidermal growth factor receptor mutation in the postoperative prognosis of adenocarcinoma of the lung. J Clin Oncol 2009; 27(3): 411–417. doi: 10.1200/ JCO.2008.18.3251.
10. Raso MG, Behrens C, Herynk MH et al. Immunohistochemical expression of estrogen and progesterone receptors identifies a subset of NSCLC and correlates with EGFR mutation. Clin Cancer Res 2009; 15(17): 5359–5368. doi: 10.1158/ 1078-0432.CCR-09-0033.
11. Mah V, Marquez D, Alavi M et al. Expression levels of estrogen receptor beta in conjunction with aromatase predict survival in non-small cell lung cancer. Lung Cancer 2011; 74(2): 318–325. doi: 10.1016/ j.lungcan.2011.03.009.
12. Márquez-Garbán DC, Chen HW, Goodglick L et al. Targeting aromatase and estrogen signaling in human non-small cell lung cancer. Ann N Y Acad Sci 2009; 1155 : 194–205. doi: 10.1111/ j.1749-6632.2009.04116.x.
13. Márquez-Garbán DC, Mah V, Alavi M et al. Progesterone and estrogen receptor expression and activity in human non-small cell lung cancer. Steroids 2011; 76(9): 910–920. doi: 10.1016/ j.steroids.2011.04.015.
14. Hsu LH, Liu KJ, Tsai MF et al. Estrogen adversely affects the prognosis of patients with lung adenocarcinoma. Cancer Sci 2015; 106(1): 51–59. doi: 10.1111/ cas.12558.
15. Pietras RJ, Márquez-Garbán DC. Membrane-associated estrogen receptor signaling pathways in human cancers. Clin Cancer Res 2007; 13(16): 4672–4676. doi: 10.1158/ 1078-0432.CCR-07-1373.
16. Kolkova Z, Noskova V, Ehinger A et al. G protein-coupled estrogen receptor 1 (GPER, GPR 30) in normal human endometrium and early pregnancy decidua. Mol Hum Reprod 2010; 16(10): 743–751. doi: 10.1093/ molehr/ gaq043.
17. Jala VR, Radde BN, Haribabu B et al. Enhanced expression of G-protein coupled estrogen receptor (GPER/ GPR30) in lung cancer. BMC Cancer 2012; 12 : 624. doi: 10.1186/ 1471-2407-12-624.
18. Andersson S, Sundberg M, Pristovsek N et al. Insufficient antibody validation challenges oestrogen receptor beta research. Nature Commun 2017; 8 : 15840. doi: 10.1038/ ncomms15840.
19. Cappuzzo F, Moro-Sibilot D, Gautschi O et al. Management of crizotinib therapy for ALK-rearranged non-small cell lung carcinoma: an expert consensus. Lung Cancer 2015; 87(2): 89–95. doi: 10.1016/ j.lungcan.2014.12.010.
20. Wu J, Savooji J, Liu D. Second - and third-generation ALK inhibitors for non-small cell lung cancer. J Hematol Oncol 2016; 9 : 19. doi 10.1186/ s13045-016-0251-8.
Labels
Paediatric clinical oncology Surgery Clinical oncology Pneumology and ftiseology Laboratory
Article was published inClinical Oncology

2018 Issue 6-
All articles in this issue
- Následky hypoacidity navozené inhibitory protonové pumpy – tipy pro praxi
- Vývodný močový systém a gynekologické malignity
- Efekt a toxicita radioterapie ve vybraných paliativních indikacích
- Nediferencovaný karcinóm pankreasu – kazuistika
- Nemalobuněčný karcinom plic s expresí estrogenových receptorů a pozitivitou ALK
- Dlouhé nekódující molekuly RNA u cervikálních nádorů
- Infiltrace karcinomů prostaty CD204+ a CD3+ buňkami koreluje s expresí ERG a fúzí genu TMPRSS2-ERG
- Supernatanty Lactobacillus rhamnosus GG a Lactobacillus crispatus SJ-3C-US snižují expresi genů TSGA10, AURKC, OIP5 a AKAP4 v HeLa buňkách
- Použití metody Metal Deletion Technique pro odstraňování artefaktů při plánování radioterapie u pacientů s implantovanými kardiostimulátory
- Zriedkavý malígny PECom obličky – diagnostická výzva a neobvyklá terapeutická odpoveď
- Melanom animálního typu – velmi vzácná varianta lidského melanomu
- Význam gastrointestinální flóry v léčbě nádorů pomocí checkpoint inhibitorů
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nediferencovaný karcinóm pankreasu – kazuistika
- Efekt a toxicita radioterapie ve vybraných paliativních indikacích
- Následky hypoacidity navozené inhibitory protonové pumpy – tipy pro praxi
- Zriedkavý malígny PECom obličky – diagnostická výzva a neobvyklá terapeutická odpoveď
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

