-
Medical journals
- Career
Efekt a toxicita radioterapie ve vybraných paliativních indikacích
: Z. Pechačová 1; M. Zemanová 1; J. Končeková 2
: Onkologická klinika 1. LF UK a VFN v Praze 1; Oddělení radiační ochrany, VFN v Praze 2
: Klin Onkol 2018; 31(6): 439-447
: Original Articles
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2018439Východiska:
Radioterapie (RT) patří mezi základní modality onkologické léčby v kurativních a paliativních indikacích. V oblasti paliativní a podpůrné péče je RT indikována za účelem ovlivnění lokální kontroly onemocnění a v léčbě symptomů – zejména bolesti, útlaku okolních struktur nebo krvácení. Cílem této práce je vyhodnocení efektu a toxicity RT pacientů ozařovaných na Onkologické klinice 1. LF UK a VFN v Praze v období duben 2015 až duben 2018 s paliativním záměrem.
Soubor pacientů a metody:
V uvedeném období byla na našem pracovišti provedena paliativní RT ve 338 případech, což představuje přibližně jednu třetinu indikací této léčebné modality. Vyhodnocení bylo provedeno u tří podskupin cílových objemů – oblast primárního tumoru u pacientů s pokročilým bronchogenním karcinomem a na oblast metastáz skeletu nebo měkkých tkání u pacientů s různými onkologickými diagnózami. Pacienti byli ozářeni technikou radioterapie s modulovanou intenzitou záření přístrojem TomoTherapy HD (Accuray, USA).
Výsledky:
Paliativní RT na oblast primárního plicního nádoru byla realizována u 29 pacientů, efekt úlevy od symptomů byl zaznamenán u 22 pacientů (76 %), regrese nebo stabilizace onemocnění dle zobrazovacích metod byla potvrzena u 19 pacientů (66 %), toxicita RT byla akceptovatelná. Na oblast kostních metastáz bylo ozářeno 104 pacientů, dobrý analgetický efekt byl pozorován ve více než 75 % případů. Na oblast metastáz měkkých tkání bylo ozářeno 71 pacientů, ke klinickému efektu došlo v 60 % případů. Toxicita RT v našem souboru pacientů byla nižší, než jsou běžně uváděné literární údaje, což ukazuje na přínos pro kvalitu života pacientů ozařovaných s užitím moderních radioterapeutických technologií.
Závěr:
Paliativní RT v našem souboru poskytla výbornou kontrolu symptomů u pacientů s pokročilým nádorovým onemocněním, toxicita léčby byla minimální. RT je efektivní metoda, jež má široké uplatnění v řadě paliativních indikací.
Klíčová slova
paliativní péče – radioterapie – karcinom plic – metastázy – kostní metastázy – léčba bolesti
Úvod
Radioterapie (RT) patří mezi základní modality onkologické léčby a uplatňuje se dle léčebných protokolů v kurativních, neoadjuvantních, adjuvantních a paliativních indikacích. V oblasti paliativní a podpůrné péče je RT indikována za účelem ovlivnění lokální kontroly onemocnění a v léčbě symptomů – zejména bolesti, útlaku okolních struktur nebo krvácení [1– 3]. Pro rozhodování o způsobu provedení léčby je rozhodující primární lokalizace nádoru a jeho morfologický typ, klasifikace TNM (tumor – lymph nodes – metastasis), celkový stav pacienta (performance status – PS) a jeho symptomatologie, průběh dosavadní onkologické léčby vč. již provedené RT i motivace pacienta k léčbě [1]. Strategie onkologické léčby je výsledkem rozhodnutí multidisciplinárních týmů. Rozšířené možnosti systémové léčby vedou v současné době k delšímu přežití (overall survival – OS) pacientů, vybraná metastazující onkologická onemocnění mohou být na podkladě klinicko-biologických charakteristik a léčebných možností označena za chronicky léčitelná [4,5] a ve hře jsou též otázky kurativního potenciálu u oligometastatického onemocnění [6]. Prognóza vývoje onemocnění a očekávaná délka života pacienta hrají důležitou roli při indikaci léčebných modalit a v případě RT tyto odhady ovlivňují způsob provedení léčby – tedy volbu frakcionačního režimu i ozařovací techniky. Paliativní RT s dlouhodobým záměrem (při delší očekávané délce života řádově v letech) je prováděna za účelem dosažení stabilizace nádorového postižení a prodloužení OS pacienta. Cílový objem a frakcionační režim je podobný jako při radikální léčbě. Paliativní RT s krátkodobým záměrem (při krátké očekávané délce života řádově v měsících) je prováděna za účelem kontroly symptomů nádorového onemocnění – provádí se zkrácenými frakcionačními schématy na malý cílový objem se záměrem rychlé úlevy od obtíží s minimem nežádoucích účinků (NÚ). Profylaktická paliativní RT je prováděna u asymptomatických nemocných, u nichž lze předpokládat vznik obtíží v důsledku progrese nádorového ložiska v blízké době, většinou se jedná o profylaxi vzniku patologické fraktury nebo krvácení [1,2].
Nejčastějšími orgány a tkáněmi, pro jejichž nádorovou infiltraci a klinické projevy je paliativní RT indikována, jsou skelet, plíce, mozek, malá pánev, uzlinové oblasti, kůže a podkoží [1].
Paliativní RT karcinomu plic
Karcinomy plic (lung cancer – LC) patří mezi nejčastější příčiny úmrtí na nádorová onemocnění v ČR i ve světě, přibližně polovina pacientů má v době diagnózy pokročilé onemocnění a není možné je léčit s radikálním záměrem – u těchto nemocných je přínosné uplatnění všech možností moderní paliativní léčby [7]. LC způsobují řadu hrudních symptomů (dušnost, bolest, kašel, hemoptýza, dysfagie), které mohou být účinně zmírněny ozařováním.
Pro paliativní RT na oblast LC byla publikována doporučení postupů Americké společnosti pro radiační onkologii (American Society for Radiation Oncology – ASTRO) v roce 2011 [8]. Přínos RT u pacientů s lokálně pokročilým nebo metastatickým nemalobuněčným karcinomem plic (non-small cell lung cancer – NSCLC), kteří nemohou podstoupit kurativní léčbu, je podpořen daty z mnoha randomizovaných klinických studií [8– 12,13]. Ze zařazení RT do léčebného schématu profituje více než 75 % pacientů s LC [12]. Pravidla pro indikaci paliativní RT jsou podobná pro malobuněčný LC i NSCLC, pro dosažení optimálního léčebného efektu je důležité vhodné načasování RT a systémové léčby dle multidisciplinárního týmu za účasti klinického onkologa, radiačního onkologa a pneumologa [12]. Dle ASTRO doporučení pro paliativní RT pacienti profitují z vyšší dávky na frakci (2,5– 3,0 Gy na frakci, nejčastěji 30– 39 Gy v 10– 13 frakcích, 40 Gy v 16 frakcích apod.), tyto režimy jsou spojeny s dobrou kontrolou symptomů a s mírným zlepšením OS, toxicita je přijatelná [8,9]. Výsledky randomizovaných studií vyzněly mírně ve prospěch odkladu RT až do doby vzniku symptomů onemocnění – časné zařazení RT u asymptomatických nemocných s pokročilým LC neprokázalo benefit v kontrole symptomů, kvalitě života nebo OS [12,14], ale tato otázka zůstává nadále kontroverzní [9]. Přínos endobronchiální brachyterapie (endobronchial brachytherapy – EBB) v samostatné indikaci není podpořen daty, ale v kombinaci se zevní radioterapií (external-beam radiotherapy – EBRT) může EBB přinést benefit u pacientů s centrálními tumory způsobujícími kolaps plíce [8]. EBB také zůstává metodou volby u pacientů s endobronchiální obstrukcí nebo hemoptýzou, kteří již dříve podstoupili EBRT [8]. Kombinace chemoterapie (CHT) a RT v sekvenčním podávání je důležitá pro optimální kontrolu pokročilého LC. Byl prokázán přínos v OS i hodnocení kvality života u pacientů s inoperabilním LC, kteří byli indikováni k paliativní chemoradioterapii (CHRT), ve srovnání s CHT samotnou, i při mírně vyšším množství komplikací během léčby [13]. Role konkomitantní CHRT v paliativní indikaci na oblast LC je nadále předmětem výzkumu – ve srovnání se sekvenčním podáním prokázala mírně zvýšenou odpověď, ale za cenu vyšší toxicity a bez benefitu pro OS, přežití bez progrese nebo pro symptomovou kontrolu [8]. V roce 2018 zveřejněná aktualizace doporučení ASTRO pro paliativní RT na oblast plic na podkladě metaanalýzy dostupných dat potvrdila benefit konkomitantní CHT u definované skupiny pacientů s NSCLC stadia III, kteří nejsou kandidáty pro kurativní léčbu (PS 0– 2, očekávaná doba OS více než 3 měsíce, únosnost CHT). U pacientů ve stadiu IV nadále platí, že konkomitantní CHT není dle dostupných dat přínosná a její podání mimo klinické studie není doporučeno [10].
RT kostních metastáz
Metastázy do skeletu jsou častým projevem diseminovaného nádorového onemocnění – typické jsou zejména u karcinomu prsu (breast cancer – BC), LC a karcinomu prostaty (prostate cancer – PC) i u dalších malignit. Projevují se řadou obtěžujících symptomů – zejména bolestí, mohou způsobit frakturu kosti nebo kompresi míchy a dalších okolních struktur, mohou vést k hyperkalcemii. RT představuje jednu z velmi účinných, efektivních a poměrně nenáročných léčebných procedur k ovlivnění bolesti i dalších symptomů způsobených kostními metastázami, analgetický účinek obvykle nastupuje za 2– 4 týdny [9]. Efekt RT je v této indikaci dán útlumem růstu nádorových buněk a potlačením populace osteoklastů, které způsobují resorpci kostní tkáně, současně ale ionizující záření nezničí osteoblasty a osteocyty zodpovědné za budování kostní hmoty. Těmito mechanizmy je vysvětlováno hojení osteolytických metastáz, remineralizace a zpevnění kostí po RT na oblast metastatického postižení skeletu [15].
Pro paliativní RT na oblast kostních metastáz byla v roce 2011 publikována doporučení ASTRO [16], která byla následně v roce 2017 aktualizována [17]. Role zevní paliativní RT kostních metastáz v kontrole symptomů je podpořena daty z řady prospektivních randomizovaných klinických studií fáze III [16,17]. Při srovnání různých frakcionačních režimů byla potvrzena ekvivalence analgetického efektu různých frakcionačních schémat užívaných v této indikaci, přičemž delší schémata (10 frakcí) s sebou nesou výhodu déletrvajícího efektu a nižší potřeby reiradiací. Jednorázové ozáření poskytuje větší komfort pro pacienta a pečující osoby, ale kratší trvání analgetického efektu [16,18]. Stereotaktická RT může mít přínos u definovaných skupin pacientů – zejména u nově zjištěných i recidivujících metastáz páteře [16,17]. Podávání bisfosfonátů souběžně s RT přináší benefit v úlevě od bolesti a urychlení reosifikace poškozené kosti, bezpečnost podávání souběžně s EBRT je podpořena daty [16].
Cílem této práce je vyhodnocení efektu a toxicity RT v souboru pacientů ozařovaných na Onkologické klinice 1. LF UK a VFN v Praze s paliativním záměrem v období duben 2015 až duben 2018 se zaměřením na hlavní podskupiny cílových objemů – oblast primárního tumoru u pacientů s pokročilým bronchogenním karcinomem a na oblast metastáz skeletu nebo měkkých tkání u pacientů s různými onkologickými diagnózami.
Soubor pacientů a metody
Na našem pracovišti byla během 3 let v období duben 2015 až duben 2018 provedena RT s paliativním záměrem ve 338 případech, což představuje necelou jednu třetinu všech indikací této léčebné modality. RT je indikována na podkladě rozhodnutí multidisciplinárního týmu a je prováděna dle standardů pracoviště zpracovaných a aktualizovaných dle doporučených postupů ASTRO, Evropské společnosti pro radioterapii a onkologii (European Society for Radiotherapy and Oncology – ESTRO), Mezinárodní komise pro radiační jednotky a měření (International Commission on Radiation Units and Measurements – ICRU), Radiation Therapy Oncology Group (RTOG), Národních radiologických standardů a dalších zdrojů. Toxicita léčby je vyhodnocována dle RTOG kritérií [19]. Přehled lokalizace cílových objemů pro paliativní RT v našem souboru pacientů shrnuje tab. 1, hodnocení efektu a toxicity léčby bylo provedeno u tří podskupin – bronchogenní karcinom, metastázy skeletu a měkkých tkání.
1. Přehled lokalizace cílových objemů pro paliativní radioterapii (N = 338). 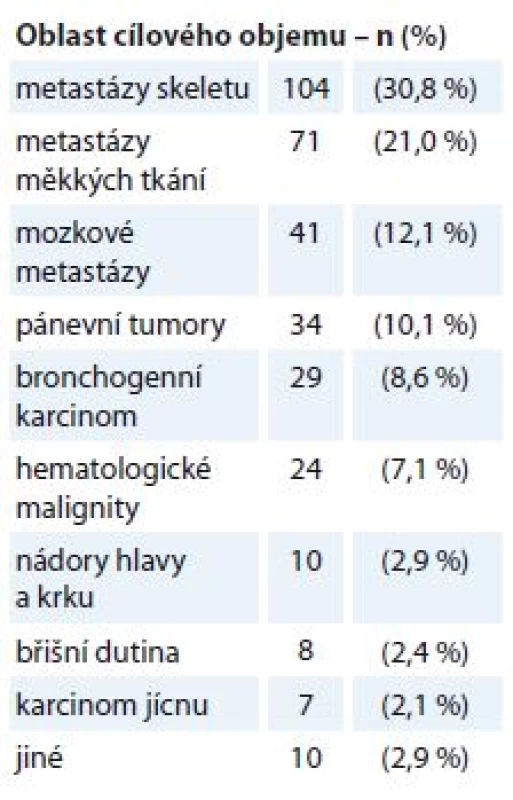
Pracoviště disponuje ozařovačem TomoTherapy HD (Accuray, USA) vybaveným lineárním urychlovačem o maximální energii 6 MeV. Všichni pacienti byli ozářeni na tomto přístroji technikou radioterapie s modulovanou intenzitou záření (intensity modulated radiation therapy – IMRT) v režimu TomoDirect nebo TomoHelical s užitím technologie obrazem řízené radioterapie (image guided radiotherapy – IGRT) [20,21]. Při realizaci paliativních plánů postupujeme velmi podobně jako u plánů s kurativním záměrem – je vyhotoveno plánovací vyšetření, dále jsou připraveny kontury cílových objemů a rizikových orgánů, následuje plánování standardními postupy pro TomoTherapy. Pro hodnocení plánů máme stejné požadavky jako na kurativní plány a technicky realizujeme kurativní i paliativní plány se stejnou mírou přesnosti. Rozdílný může být přístup onkologa hodnotícího a schvalujícího parametry plánů – u paliativních programů jsou akceptovatelné větší kompromisy v dávkovém pokrytí s ohledem na léčebný záměr. Denní nastavení pacienta probíhá vč. verifikačních CT snímků z megavoltážního zobrazovacího svazku (mega-voltage computed tomography – MVCT), aby bylo dosaženo co největší přesnosti doručení dávky.
Výsledky
Na oblast primárního LC bylo v uvedeném období s paliativním záměrem ozářeno 29 pacientů, medián doby sledování po léčbě byly 4 měsíce (1– 22 měsíců). Ozařovací schéma je voleno individuálně dle klinického stavu a stadia onemocnění, nejčastější byly režimy 30 Gy v 10 frakcích po 3 Gy a 40 Gy v 16 frakcích po 2,5 Gy. Po RT byla zaznamenána úleva od obtíží u 22 pacientů (75,9 %), odpověď dle kritérií RECIST (Response Evaluation Criteria in Solid Tumors) – parciální odpověď (PR) nebo stabilizace nemoci (SD) – byla zobrazovacími metodami potvrzena u 19 pacientů (65,6 %) (tab. 2). K rozvoji mírné akutní toxicity G1– 2 došlo u 14 pacientů (48,3 %), jednalo se o změny v krevním obrazu nebo o slizniční reakce G1– 2 (ezofagidita, přechodné zhoršení kašle). U 3 pacientů (10,3 %) byla pozorována akutní toxicita G3– 4, ve dvou případech se jednalo o pokles krevního obrazu, v jednom případě o kardiální dekompenzaci. Pozdní toxicita G1– 2 byla zaznamenána u 3 pacientů (10,3 %) ve formě mírného stupně pneumonitidy v období 3– 6 měsíců po léčbě, pozdní NÚ G3– 4 nebyly pozorovány.
2. Bronchogenní karcinom – efekt a toxicita paliativní radioterapie (N = 29). Efekt je stanoven dle kritérií RECIST. Toxicita je hodnocena dle kritérií RTOG, stupeň G0–4. 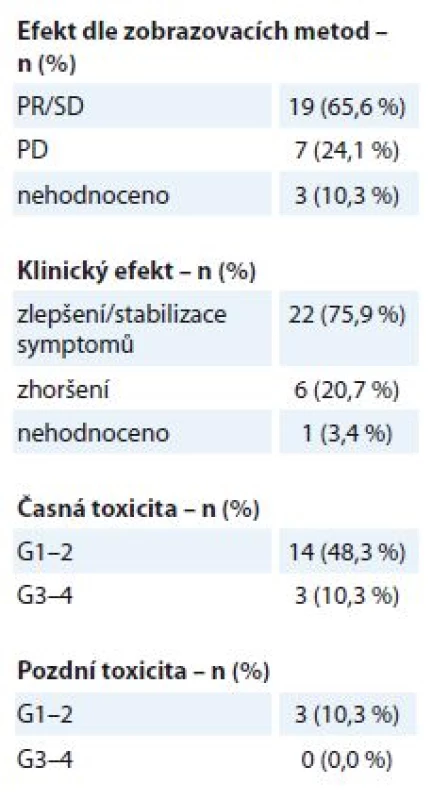
RECIST – Response Evaluation Criteria In Solid Tumors, RTOG – Radiation Therapy Oncology Group, PD – progrese nemoci, SD – stabilizace nemoci, PR – parciální odpověď Celkem bylo na našem pracovišti v uvedeném období ozářeno 104 pacientů na oblast kostních metastáz, z nichž 91 pacientů bylo k RT indikováno z důvodu bolestivosti metastázy (tab. 3), medián doby sledování po léčbě byl 6 měsíců (1– 36 měsíců). Jednalo se o pacienty s různými primárními diagnózami – BC, LC, PC, maligní melanom a další. Pacientů ozářených profylakticky bylo 13, byla použita frakcionace 30 Gy v 10 frakcích a během následujícího sledování nedošlo k rozvoji symptomů u žádného z nich. Pacientů ozářených pro bolestivé kostní metastázy bylo 91, nejčastěji byla u nich použita ozařovací schémata 30 Gy v 10 frakcích po 3 Gy nebo 20 Gy v 5 frakcích po 4 Gy (celkem 73 pacientů), u pacientů v celkově zhoršeném stavu byla indikována jednorázová RT v dávce 8 Gy (18 pacientů). Dobrý analgetický efekt (alespoň o 2 stupně vizuální analogové škály WHO pro hodnocení bolesti) byl zaznamenán v 72 případech (79,2 %). V této podskupině pozorovalo 47 pacientů (65,3 %) zmírnění bolestí již při ukončení RT, u ostatních nastoupil efekt nejpozději do měsíce po ukončení léčby. K úplnému vymizení bolestí došlo u 42 pacientů (58,3 %), zbývajících 30 pacientů (41,7 %) udávalo subjektivně podstatné zmírnění bolestí. Ve skupině pacientů s delším ozařovacím schématem (5 nebo 10 frakcí) došlo k úlevě od bolestí v 87,7 % případů, pacienti indikovaní k jednorázové RT uvedli zmírnění bolestí jen ve 44,5 % případů (tab. 3). Během léčby došlo k rozvoji vedlejších obtíží stupně G1–2 u 17 pacientů (18,7 %) (kožní nebo slizniční reakce, odchylky v krevním obrazu, nevolnost). K rozvoji toxicity stupně G3–4 došlo u 4 pacientů (4,4 %) – ve dvou případech se jednalo o slizniční reakce v oblasti horního gastrointestinálního traktu, u 1 pacienta došlo ke kardiální dekompenzaci při ozařování na oblast hrudní páteře a u 1 pacienta došlo k dekompenzaci chronických vertebrogenních obtíží s nutností infuzní myorelaxační a antiedematózní léčby. Dlouhodobější následky stupně G1–2 byly zaznamenány u 2 pacientů (2,2 %) – u obou se jednalo o mírnou dysfagii, pozdní toxicita G3– 4 nebyla pozorována.
3. Kostní metastázy – efekt a toxicita paliativní radioterapie (N = 91). Efekt je stanoven na podkladě klinického vyšetření a hodnocení bolesti dle vizuální analogové škály WHO. Toxicita je hodnocena dle kritérií RTOG, stupeň G0–4. 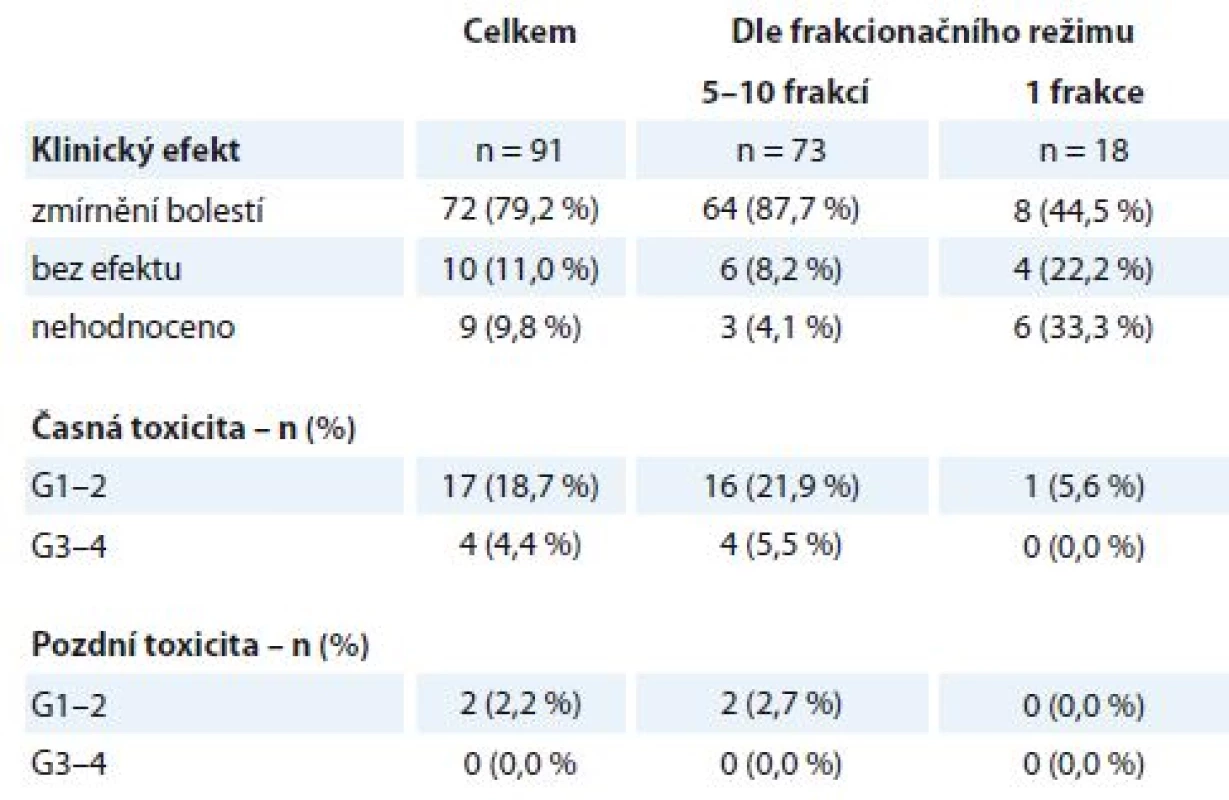
WHO – World Health Organisation, RTOG – Radiation Therapy Oncology Group. Na oblast metastáz měkkých tkání – kůže, podkoží, uzlinových oblastí a dalších měkkých tkání kromě centrálního nervového systému – bylo v uvedeném období indikováno k RT 71 pacientů. Jednalo se o metastázy různých primárních diagnóz, medián doby sledování po léčbě byl 5 měsíců (1– 29 měsíců). Ozařovací schéma bylo voleno individuálně dle lokalizace metastázy, klinického stavu pacienta a stadia onemocnění, nejčastější byly režimy 10 × 3 Gy, 5 × 4 Gy, 16 × 2,5 Gy nebo 1 × 8 Gy. Ke zmírnění symptomů došlo u 43 pacientů (60,6 %), klinicky nebo zobrazovacími metodami byl efekt potvrzen u 42 pacientů (59,2 %) (tab. 4). Projevy akutní toxicity G1– 2 během RT byly pozorovány u 31 pacientů (43,7 %) (kožní nebo slizniční reakce, odchylky v krevním obrazu, nevolnost). K projevům vážné akutní toxicity G3– 4 došlo v jednom případě – u pacientky s BC předléčené více liniemi CHT došlo k rozvoji ezofagidity G3 po RT na uzlinovou metastázu lokalizovanou v mediastinu v blízkosti jícnu. Pozdní následky G1– 2 byly pozorovány ve formě pneumonitidy u jednoho pacienta, vážnější pozdní obtíže byly zaznamenány v jednom případě u již zmíněné pacientky – protrahovaná ezofagitida G3 se stenózou jícnu.
4. Metastázy měkkých tkání – efekt a toxicita paliativní radioterapie (N = 71). Efekt je stanoven dle kritérií RECIST. Toxicita je hodnocena dle kritérií RTOG, stupeň G0–4. 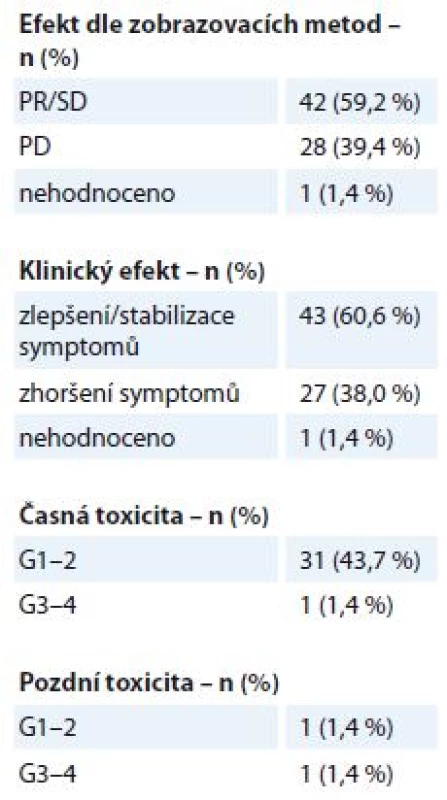
RECIST – Response Evaluation Criteria In Solid Tumors, RTOG – Radiation Therapy Oncology Group, PD – progrese nemoci, SD – stabilizace nemoci, PR – parciální odpověď Diskuze
Paliativní péče je komplexní, aktivní a na kvalitu života orientovaná péče poskytovaná pacientovi, který trpí nevyléčitelnou chorobou v pokročilém nebo konečném stadiu. Cílem paliativní péče je zmírnit bolest a další tělesná a duševní strádání, zachovat pacientovu důstojnost a poskytnout podporu jeho blízkým [22]. Přínos časného zahájení komplexní paliativní péče souběžně s paliativní onkologickou terapií byl prokázán více randomizovanými studiemi [23– 26]. Jedná se nejen o benefit pro kvalitu života nemocných, ale bylo zaznamenáno i mírné prodloužení OS pacientů ve srovnání s pacienty ve standardní péči [26]. Hranice mezi paliativní a podpůrnou léčbou není v onkologii ostrá, při kontrole symptomů se oba okruhy často překrývají [27]. Podpůrná léčba je nedílnou součástí onkologické léčby, měla by doprovázet kurativní i paliativní onkologickou léčbu – u pacientů je vhodné potřebu paliativní péče aktivně zjišťovat a poskytovat ji současně s protinádorovou léčbou [23,27,28]. Dobrá kontrola symptomů od počátku onemocnění zlepšuje PS nemocného, zvyšuje toleranci onkologické léčby, a má tak přímý vliv na OS pacienta [29]. Rovnováha protinádorové, podpůrné a paliativní léčby se v průběhu onemocnění mění podle odpovědi na onkologickou léčbu a klinického stavu pacienta (schéma 1). Paliativní specialista by měl být ideálně konzultován po vstupním vyšetření u všech pacientů s pokročilým onkologickým onemocněním [23]. Po vypracování plánu komplexní onkologické paliativní péče by byl pacient veden ošetřujícím onkologem ve spolupráci s paliatrem, přičemž pro překonání bariér bránících časné integraci paliativní péče je nutné nastavení funkčního modelu spolupráce a vzdělávání v paliativní péči [23]. Dle doporučení Americké společnosti pro klinickou onkologii (American Society of Clinical Oncology – ASCO) z roku 2018 je u pacientů s nově diagnostikovaným pokročilým nádorovým onemocněním doporučeno časné zahájení paliativní péče, ideálně do 8 týdnů od diagnózy [30], doporučení České onkologické společnosti České lékařské společnosti J. E. Purkyně zatím není pro tuto problematiku stanoveno.
Schéma 1. Integrace podpůrné a paliativní péče do komplexní onkologické léčby. Význam protinádorové, podpůrné a paliativní léčby se v průběhu onemocnění mění podle odpovědi na onkologickou léčbu a klinického stavu pacienta [29]. ![Schéma 1. Integrace podpůrné a paliativní péče do komplexní onkologické léčby. Význam protinádorové, podpůrné a paliativní léčby se
v průběhu onemocnění mění podle odpovědi na onkologickou léčbu a klinického stavu pacienta [29].](https://pl-master.mdcdn.cz/media/image_pdf/f7bdc86a8ed3828fb5b89aadb16c5dd0.jpeg?version=1544602384)
Kombinace léčebných modalit i záměr léčby jsou výsledkem rozhodnutí multidisciplinárních týmů v onkologii i paliativní péči [1– 3,22,26]. Při indikaci léčebných metod s paliativním záměrem hraje roli celá řada faktorů – aktuální stav pacienta, jeho motivace k léčbě, schopnost spolupráce, prognóza vývoje onemocnění, očekávaná délka života pacienta a další. Vzhledem k tomu, že je RT účinná, efektivní a relativně snadno proveditelná metoda, je významnou součástí paliativní péče v onkologii.
Na základě radiobiologických principů i empirických zkušeností je známo, že vyšší jednotlivá dávka může obecně přinést rychlejší efekt, ale zároveň vyšší pravděpodobnost pozdních NÚ. Nicméně podle lineárně kvadratického modelu má jednorázová RT v dávce 8 Gy nižší riziko pozdní toxicity než režim 30 Gy v 10 frakcích (ekvivalentní dávka v Gy vztažená k normofrakcionaci o jednotlivé dávce 2 Gy EQD2 (equivalent dose in 2 Gy fraction) se pro pozdní toxicitu rovná 20 Gy pro jednorázové ozáření a 37,5 Gy pro protrahovaný režim), přičemž s jednorázovou RT je spojena také nižší akutní toxicita ve srovnání s režimem 30 Gy v 10 frakcích (EQD2 pro akutní toxicitu odpovídá 12,0 Gy pro jednorázové ozáření vs. 32,5 Gy pro protrahované schéma) [1,6,31,32]. Podle lokalizace metastatického postižení s ohledem na vztah k rizikovým orgánům volíme tedy ozařovací schéma tak, aby přineslo rychlý efekt při nízké akutní toxicitě a akceptovatelném riziku pozdních NÚ s přihlédnutím k očekávané délce života pacienta.
Při užití nových technologií v RT lze ozařování lépe cílit a dosáhnout tak lepšího efektu a menší toxicity díky nižší zátěži rizikových orgánů [30,33]. Tuto skutečnost potvrzují i data našeho souboru pacientů ozařovaných pokročilou radioterapeutickou technologií, kde je zastoupení akutní i pozdní toxicity spíše nižší než v literárních údajích. Pro paliativní RT plic jsou data pro toxicitu v literatuře poměrně rozdílná, zastoupení toxicity G3– 4 bývá uváděno ve 4– 22 % [8], v našem souboru pacientů se toxicita G3– 4 rozvinula v 10 % případů. Při RT na oblast metastáz ve skeletu byla v hlavních pracích akutní toxicita reportována v rozmezí 5– 37 % pacientů, pozdní toxicita v 1– 11 % případů [16]. V našem souboru pacientů ozařovaných na oblast metastáz ve skeletu došlo k rozvoji akutní toxicity G1– 2 v necelých 19 % případů, G3– 4 ve 4 % případů, pozdní toxicita G1– 2 byla zaznamenána ve 2 % případů, vážnější pozdní toxicita G3– 4 se v souboru nevyskytla. Tato data ukazují na významný přínos pro kvalitu života pacientů při užití moderních technologií pro RT s paliativním záměrem.
U pacientů předléčených systémovou léčbou se mohou objevit výrazné NÚ RT i po nízkých dávkách záření v důsledku vyčerpaných rezerv kostní dřeně, sliznic a dalších tkání, což potvrzují i naše zkušenosti. K zajištění dobré kvality života pacienta je nutná včasná a dostatečně intenzivní léčba akutní toxicity RT [3,34].
Klinické studie potvrdily efektivitu paliativní RT i u pacientů s velmi limitovanou očekávanou délkou života, v těchto indikacích je doporučováno jednorázové ozáření s cílem minimalizace nepohodlí a zachování pravděpodobnosti benefitu [35– 37]. Vzhledem k prokázané efektivitě RT pro zmírnění symptomů pokročilého onemocnění není rozpor v indikaci této léčebné metody ani u pacientů v hospicové péči, ale provedení RT zde bývá často spojeno s organizačními i finančními překážkami [36,38].
Karcinom plic
RT přináší benefit pacientům s LC – na podkladě mezinárodních doporučení podložených daty z léčby ozařováním profitují více než tři čtvrtiny pacientů s touto diagnózou. V ČR je však indikováno k RT průměrně pouze 25 % (dle krajů 15– 40 %) pacientů s LC, což je dáno více důvody – důrazem na systémovou léčbu, horší dostupností RT v některých regionech apod. [39]. Role RT je velmi významná zejména u pacientů s pokročilým postižením vč. metastazujícího onemocnění [1,2,7,12,13,15]. V našem souboru pacientů s LC, kteří byli indikováni k RT s paliativním záměrem na oblast primárního tumoru, přinesla RT velmi dobrý efekt v ovlivnění hrudních symptomů u 76 % pacientů, ačkoli zobrazovací odpověď byla potvrzena u 66 % pacientů, příčiny této diskrepance jsou zřejmě komplexní. Akutní i pozdní toxicita byla akceptovatelná a dobře zvládnutelná. Přiložená kazuistika dokumentuje dobrý přínos v lokální kontrole i léčbě symptomů u pacientky s pokročilým onemocněním.
Kazuistika č. 1 – žena narozená 1949
U pacientky s četnými interními komorbiditami (ischemická choroba srdeční, fibrilace síní, stav po infarktu myokardu s následnou angioplastikou, ischemická choroba dolních končetin po angioplastice, chronická obstrukční plicní nemoc), ale celkově ve velmi dobrém klinickém stavu, byl v dubnu 2016 (ve věku 67 let) zjištěn adenokarcinom pravé plíce s postižením mediastinálních uzlin v rozsahu od nadklíčku po paraezofageální podbrániční uzlinu (T2N3M1). Pacientka zahájila paliativní CHT karboplatina (CBDCA) + paclitaxel, absolvovala čtyři cykly do srpna 2016, poté v říjnu 2016 následovala paliativní RT na oblast plicního tumoru vpravo a objemných postižených lymfatických uzlin v dávce 40 Gy v 16 frakcích po 2,5 Gy (obr. 1). Během léčby se cítila více unavená, jiné obtíže neměla, po RT došlo k vymizení obtěžujícího kašle. Nadále byla sledována, nedošlo k rozvoji akutní ani pozdní toxicity RT. V září 2017 (11 měsíců po léčbě) se na kontrolním CT vyšetření zobrazil relaps onemocnění vícečetně v pravé plíci, pacientka zahájila CHT pemetrexed s výbornou tolerancí. Dle kontrolních CT vyšetření v lednu a dubnu 2018 pokračovala regrese ložisek, pacientka zůstávala nadále asymptomatická, PS 0, pokračovala v CHT.
1. Plán radioterapie na oblast plic v kazuistice č. 1. Předepsaná dávka 40 Gy/16 frakcí. Ozařovací mód TomoDirect, šířka pole 2,5 cm. Kontury: okrová – obrys těla, tmavě růžová – srdce, modrá – plíce, béžová – jícen, hnědá – mícha, světle hnědá – mícha s lemem 5 mm, žlutá – gross target volume, lososová – clinical target volume, červená – planning target volume. Izodózy: červená – 100–107 % předepsané dávky, oranžová – 95 % předepsané dávky, tyrkysová – 50 % dávky. 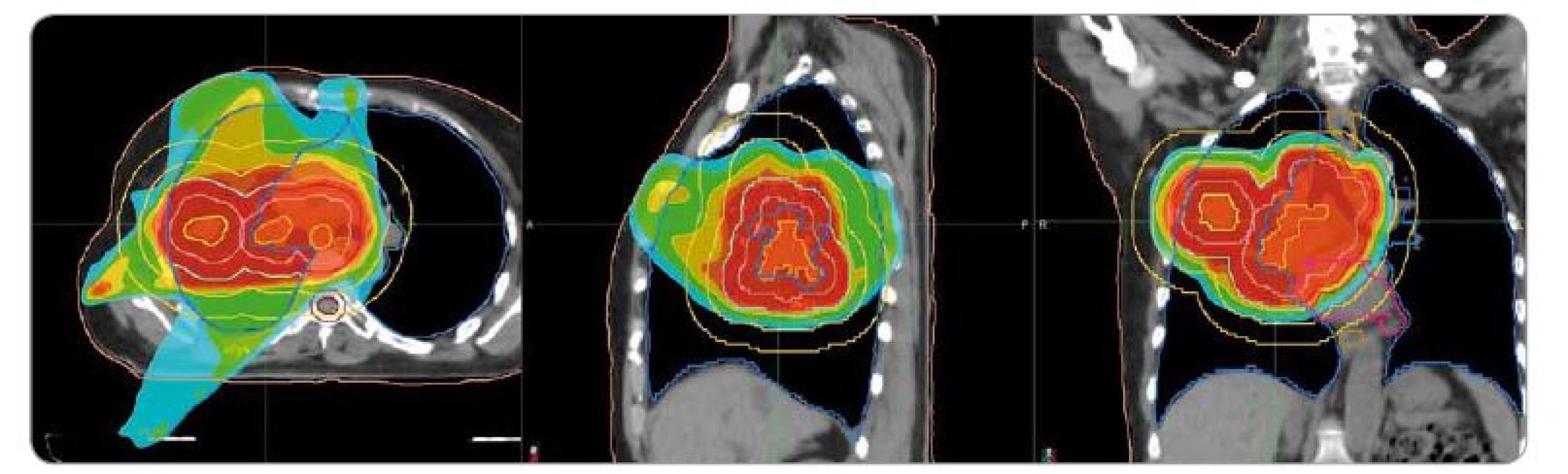
Kostní metastázy
Problematika RT na oblast metastáz ve skeletu je prověřena více než 100 lety zkušeností s aplikací této léčebné modality, opodstatněnost užití RT je v současné době podpořena i celou řadou dat [16,17]. Často je diskutována otázka vhodného frakcionačního schématu v této indikaci – metaanalýzy klinických studií potvrzují ekvivalenci různých frakcionačních schémat [16– 18]. Jednorázové ozáření poskytuje sice kratší trvání analgetického efektu, ale zároveň větší komfort pro pacienta a pečující osoby, což je výhodné zejména u pacientů v celkově zhoršeném stavu a s kratší očekávanou délkou života [16,18]. Delší schémata (10 frakcí) i přes mírně náročnější průběh samotné léčby vč. možné vyšší akutní toxicity [6] přinášejí výhodu dlouhodobějšího efektu a nižší potřeby reiradiací [17,33]. V našem souboru pacientů s delšími ozařovacími schématy (30 Gy v 10 frakcích nebo 20 Gy v 5 frakcích) došlo k úlevě od bolestí v 87,7 % případů, pacienti indikovaní k jednorázové RT udali zmírnění bolestí jen ve 44,5 % případů (tab. 3). Tento výrazný rozdíl je zřejmě dán malou velikostí souboru i skutečností, že ve skupině indikované k jednorázové RT byli pacienti v celkově výrazně zhoršeném stavu s pokročilým, rychle progredujícím nádorovým onemocněním a krátkou délkou života po RT – většinou méně než 2 měsíce. Zastoupení léčebné odpovědi v našem souboru je srovnatelné s literárními údaji [16,17]. Péče o pacienty s kostními metastázami má být mezioborová z důvodu zajištění optimální péče – dle symptomů nebo rizika jejich rozvoje je zapojen klinický onkolog, radiační onkolog, algeziolog, paliatr, klinický farmakolog, radiolog, chirurg a další specializace [2,16,22,23,27]. Přiložená kazuistika dokumentuje dlouhodobě uspokojivý management symptomů u pacienta s mnohočetným postižením skeletu díky zapojení mezioborového týmu.
Kazuistika č. 2 – muž narozený 1968
V roce 2011 (ve věku 43 let) byl u pacienta zjištěn maligní melanom kůže trupu, byla provedena excize (Breslow 1,2 mm) a mapování sentinelové uzliny, nadále byl pacient sledován. V srpnu 2016 (48 let) bylo diagnostikováno metastatické postižení jater, pacient zahájil systémovou imunoterapii. V únoru 2017 bylo nově zjištěno metastatické postižení skeletu, pro objemnou metastázu destruující horní krční úsek páteře byl nemocný indikován k provedení stabilizačního neurochirurgického výkonu. V průběhu dalších měsíců byl pacient opakovaně indikován k RT na oblast symptomatických metastáz skeletu – během 6 měsíců byl ozářen celkem na 5 lokalit v oblasti páteře (vč. stabilizovaného krčního úseku), pánve a končetin. RT přinášela opakovaně výborný efekt – do týdne po léčbě bolesti vymizely, analgetickou medikaci pacient nepotřeboval, jeho celkový stav byl velmi dobrý, PS 0, bez neurologického deficitu. Kontrolní vyšetření v září 2017 zobrazilo rozsáhlou progresi metastatického postižení jater a skeletu, onkologická terapie byla ukončena. Klinický stav se postupně zhoršoval – docházelo k progresi nádorové kachexie, bolestí skeletu vícečetně, zhoršovala se hybnost zejména pro bolesti kyčelního kloubu na podkladě rozsáhlé metastázy v oblasti acetabula a mírně se horšila hybnost levé ruky při zjištěné objemné metastáze v oblasti přechodu krční a hrudní páteře. V říjnu 2017 bylo proto provedeno jednorázové ozáření ložiska cerviko-thorakálního přechodu, následně došlo ke zlepšení hybnosti levé ruky, pacient byl schopen vykonávat běžné činnosti. Byl konzultován algeziolog, který provedl opakovaně instilaci kortikoidů do kyčelního kloubu s efektem. I přes další postupné zhoršování stavu hodnotil pacient kvalitu svého života celkem dobře, pobýval v domácím prostředí.
Metastázy měkkých tkání
RT na oblast metastáz měkkých tkání představuje oproti metastázám ve skeletu více heterogenní skupinu, nicméně ozařováním zde lze dosáhnout velmi dobré lokální kontroly i ovlivnění symptomů s minimem NÚ, což jsme si ověřili i na našem souboru pacientů. Přiložená kazuistika dokumentuje dobrý efekt RT na metastázu v nepříznivé lokalizaci u pacientky s metastazujícím BC, kdy došlo po RT k rozvoji výrazné poradiační ezofagitidy zřejmě z důvodu rozsahu a lokalizace ložiska při předléčenosti systémovou terapií. I přes recidivující obtíže v důsledku poradiačních změn jícnu bylo díky intenzivní a komplexní podpůrné léčbě dosaženo dlouhodobě dobrého klinického stavu a uspokojivé kvality života pacientky. U pacientů ozařovaných na objem v této lokalizaci s paliativním záměrem se snažíme o snížení radiační zátěže jícnu, pokud je to možné (obr. 2).
2. Plán radioterapie na oblast hrudního obratle s možností nižší dávkové zátěže jícnu. Předepsaná dávka 30 Gy/10 frakcí. Ozařovací mód TomoHelical, šířka pole 2,5 cm. Kontury: růžová – srdce, modrá – plíce, béžová – jícen, hnědá – mícha, červená – planning target volume. Izodózy: červená – 95 % předepsané dávky, tyrkysová – 50 % předepsané dávky 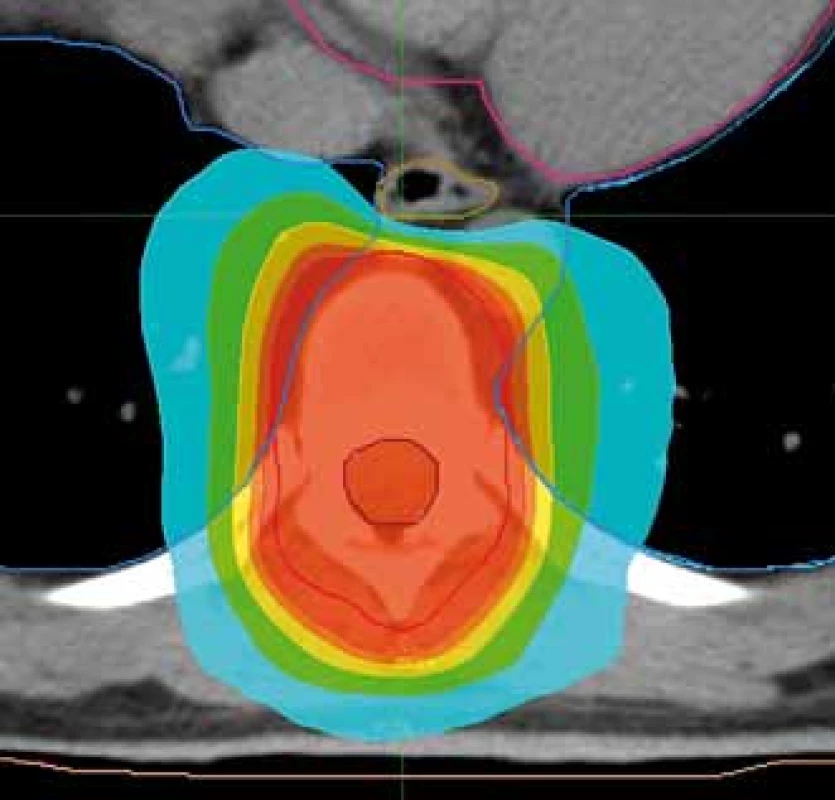
Kazuistika č. 3 – žena narozená 1971
V roce 2004 (ve věku 33 let) byl u pacientky zjištěn BC T2N0M0, podstoupila kurativní léčbu – neoadjuvantní CHT, parciální resekční výkon, adjuvantní RT, adnexektomii a hormonální terapii. V roce 2014 (43 let) byl zjištěn metastatický proces v plicích, mediastinálních uzlinách a skeletu, pacientka zahájila paliativní systémovou terapii. V červnu 2015 zůstávala většina ložisek nadále stabilizovaná, ale došlo k progresi mediastinálního postižení – ložisko pod bifurkací trachey s útlakem bronchů a plicních žil. V srpnu 2015 pacientka podstoupila paliativní ozáření ložiska v mediastinu – 30 Gy v 10 frakcích. Několik dnů po ukončení RT došlo k rozvoji dysfagie, gastroskopické (GSK) vyšetření potvrdilo mykotickou ezofagitidu v úseku po RT. Pacientka podstoupila několikatýdenní léčbu antimykotiky a antibiotiky, přechodně byla na plné parenterální výživě, ale v odstupu měsíce po RT již přijímala tekutiny a měkčí stravu bez omezení. Kontrolní GSK 3,5 měsíce po RT potvrdila zhojení jícnu, dle CT vyšetření 6 měsíců po RT došlo ke zmenšení ozářeného ložiska, ostatní nález byl stabilní, stav pacientky byl nadále velmi dobrý, PS 0– 1. V srpnu 2016 (12 měsíců po RT) došlo k recidivě dysfagie, GSK vyšetřením byla zjištěna stenóza jícnu, byla provedena dilatace, ale polykání zůstávalo obtížné, proto byl do jícnu zaveden stent, následně došlo ke zlepšení. Dle zobrazovací CT kontroly v září 2016 byla potvrzena stabilizace dříve ozařovaného ložiska, ale progrese v jiných částech mediastina a v plicích. V říjnu 2016 došlo k další recidivě dysfagií, GSK vyšetřením byla zjištěna dislokace stentu a stenóza nad stentem, provedena dilatace s dobrým efektem. Celková kondice pacientky zůstávala dobrá, PS 1.
Závěr
Paliativní RT přináší benefit pacientům s pokročilým nebo metastatickým nádorovým onemocněním a má své pevné místo v rámci komplexní paliativní péče. V našem souboru poskytla tato metoda výbornou kontrolu symptomů u pacientů s pokročilým nádorovým onemocněním, toxicita léčby byla minimální a dobře zvládnutelná. Pro dosažení optimálního managementu symptomů pokročilého onemocnění je vhodné rozhodování v rámci mezioborového týmu za účasti klinického onkologa, radiačního onkologa, paliatra, algeziologa, klinického farmakologa, radiologa, chirurga a dalších specializací. Do budoucna je výzvou hledání prognostických modelů pro odhad očekávané délky života a jejich začlenění do klinické praxe tak, aby indikace léčebných modalit u pacientů s pokročilým onkologickým onemocněním a také v závěru života probíhala na podkladě principů „evidence-based“ medicíny.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Obdrženo: 28. 8. 2018
Přijato: 29. 10. 2018
MUDr. Zdeňka Pechačová
Onkologická klinika
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: zdenka.pechacova@vfn.cz
Sources
1. Šlampa P, Petera J et al. Radiační onkologie. Praha: Galén – Karolinum 2007 : 377– 389.
2. Vorlíček J, Adam Z, Pospíšilová Y et al. Paliativní medicína. Praha: Grada 2004.
3. Sláma O, Kabelka L, Vorlíček J et al. Paliativní medicína pro praxi. Praha: Galén 2011.
4. Petruželka L. Pokročilý metastazující karcinom prostaty jako chronicky léčitelné onemocnění. Praha: AT Mediprint 2014.
5. Petruželka L et al. Léčba pokročilého hormonálně dependentního karcinomu prsu: Chemoterapie, hormonální léčba nebo bioterapie? Abstr. 020. Onkologie v gynekologii a mammologii. Praha, 2007.
6. Lutz S, Jones J, Chow E. Role of radiation therapy in palliative care of the patient with cancer. J Clin Oncol 2014; 32(26): 2913– 2919. doi: 10.1200/ JCO.2014.55.1143.
7. Skřičková J, Vorlíček J et al. Některé možnosti paliativní léčby u nemocných s rakovinou plic. Klin Onkol 2001; 14(Zvláštní číslo): 1– 5.
8. Rodrigues G, Videtic GM, Sur R et al. Palliative thoracic radiotherapy in lung cancer: an American Society for Radiation Oncology evidence-based clinical practice guideline. Pract Radiat Oncol 2011; 1(2): 60– 71. doi: 10.1016/ j.prro.2011.01.005.
9. Petruželka L et al. Nemalobuněčný karcinom plic. Praha: Farmakon Press 2016 : 56– 60.
10. Moeller B, Balagamwala EH, Chen A et al. Palliative thoracic radiation therapy for non-small cell lung cancer: 2018 Update of an American Society for Radiation Oncology (ASTRO) evidence-based guideline. Pract Radiat Oncol 2018; 8(4): 245– 250. doi: 10.1016/ j.prro.2018.02.009.
11. Stevens R, Macbeth F, Toy E et al. Palliative radiotherapy regimens for patients with thoracic symptoms from non-small cell lung cancer. Cochrane Database Syst Rev 2015; 1: CD002143. doi: 10.1002/ 14651858.CD002143.pub4.
12. Zemanová M. Místo radioterapie v léčbě karcinomu plic. Onkologie 2009; 3(5): 281– 284.
13. Strøm HH, Bremnes RM, Sundstrøm SH et al. Concurrent palliative chemoradiation leads to survival and quality of life benefits in poor prognosis stage III non-small--cell lung cancer: a randomised trial by the Norwegian Lung Cancer Study Group. Br J Cancer 2013; 109(6): 1467– 1475. doi: 10.1038/ bjc.2013.466.
14. Falk SJ, Girling DJ, White RJ et al. Immediate versus delayed palliative thoracic radiotherapy in patients with unresectable locally advanced non-small cell lung cancer and minimal thoracic symptoms: randomised controlled trial. BMJ 2002; 325(7362): 465.
15. Čoupek P, Čoupková H. Paliativní radioterapie plicních nádorů. Klin Onkol 2001; 14(Zvláštní číslo): 10– 12.
16. Lutz S, Berk L, Chang E et al. Palliative radiotherapy for bone metastases: an ASTRO evidence-based guideline. Int J Radiat Oncol Biol Phys 2011; 79(4): 965– 976. doi: 10.1016/ j.ijrobp.2010.11.026.
17. Lutz S, Balboni T, Jones J et al. Palliative radiation therapy for bone metastases: update of an ASTRO evidence-based guideline. Pract Radiat Oncol 2017; 7(1): 4– 12. doi: 10.1016/ j.prro.2016.08.001.
18. Franco P, Migliaccio F, Angelini V et al. Palliative radiotherapy for painful bone metastases from solid tumors delivered with static ports of tomotherapy (TomoDirect): feasibility and clinical results. Cancer Invest 2014; 32(9): 458– 463. doi: 10.3109/ 07357907.2014.958495.
19. Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys 1995; 31(5): 1341– 1346. doi: 10.1016/ 0360-3016(95)00060-C.
20. Pechačová Z, Zemanová M, Končeková J et al. Tomoterapie – zkušenosti prvního roku klinického provozu ve Všeobecné fakultní nemocnici v Praze. In: Radiační onkologie 2016, sborník příspěvků. 12. Konference Společnosti radiační onkologie, biologie a fyziky. Hradec Králové, 23.– 25. června 2016 : 56– 63.
21. Končeková J, Jelénková K, Pejchal O et al. Fyzikální a technické aspekty tomoterapeutického ozařovače a systém zajištění jakosti. In: Radiační onkologie 2016, sborník příspěvků. 12. Konference Společnosti radiační onkologie, biologie a fyziky. Hradec Králové, 23.– 25. června 2016 : 50– 55.
22. Sláma O, Špinková M, Kabelka L. Standardy paliativní péče 2013. Brno: Česká společnost paliativní medicíny ČLS JEP 2013.
23. Sochor M, Sláma O, Loučka M. Časná integrace paliativní péče do standardní onkologické péče – benefit, limitace, bariéry a druhy paliativní péče. Klin Onkol 2015; 28(3): 171– 176. doi: 10.14735/ amko2015171.
24. Haun MW et al. Early palliative care for adults with advanced cancer. Cochrane Database Syst Rev 2017; 6: CD011129. doi: 10.1002/ 14651858.CD011129.pub2.
25. Kain DA, Eisenhauer EA: Early integration of palliative care into standard oncology care: evidence and overcoming barriers to implementation. Curr Oncol 2016; 23(6): 374– 377. doi: 10.3747/ co.23.3404.
26. Temel JS, Greer JA, Muzikansky A et al. Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med 2010; 363(8): 733– 742. doi: 10.1056/ NEJMoa1000678.
27. Vorlíček J, Skřičková J. Paliativní léčba u onkologických nemocných. Klin Onkol 1993; 6(4): 119– 122.
28. Sláma O, Sochor M. Paliativní péče jako součást komplexní onkologické péče. Postgradual Med: odborný časopis pro lékaře 2014; 16(3): 335– 337.
29. Von Roenn JH, Temel J. The integration of palliative care and oncology: the evidence. Oncology (Williston Park) 2011; 25(13): 1258– 1260, 1262, 1264– 1265.
30. Osman H, Shrestha S, Temin S et al. Palliative care in the global setting: ASCO resource-stratified practice guideline summary. J Oncol Pract 2018; 14(7): 431– 436. doi: 10.1200/ JOP.18.00087.
31. Joiner MC, van der Kogel A. Basic clinical radiobiology. Abingdon, Oxon: CRC Press 2009 : 102– 148.
32. Feltl D, Cvek J. Klinická radiobiologie. Havlíčkův Brod: Tobiáš 2008 : 60– 64.
33. Pospíšil P, Kazda T, Procházka T. Příznivý efekt paliativní radioterapie u maligního melanomu vlasaté části hlavy. Klin Onkol 2014; 27(6): 452.
34. Spencer K, Parrish R, Barton R et al. Palliative radiotherapy. BMJ 2018; 360: k821. doi: 10.1136/ bmj.k821.
35. Meeuse JJ, van der Linden YM, van Tienhoven G et al. Efficacy of radiotherapy for painful bone metastases during the last 12 weeks of life: results from the Dutch Bone Metastasis Study. Cancer 2010; 116 : 2716– 2725. doi: 10.1002/ cncr.25062.
36. Jones JA, Lutz ST, Chow E et al. Palliative radiotherapy at the end of life: a critical review. CA Cancer J Clin 2014; 64(5): 296– 310. doi: 10.3322/ caac.21242.
37. Navrátilová P, Hynková L, Šlampa P. Role paliativní radioterapie při krvácení lokálně pokročilých nádorů gastrointestinálního traktu. Klin Onkol 2017; 30(6): 433– 436. doi: 10.14735/ amko2017433.
38. Lutz S, Spence C, Chow E et al. Survey on use of palliative radiotherapy in hospice care. J Clin Oncol 2004; 22(17): 3581– 3586. doi: 10.1200/ JCO.2004.11.151.
39. Novotvary 2015. Cancer incidence in the Czech Republic. Praha: ÚZIS ČR 2015.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2018 Issue 6-
All articles in this issue
- Consequences of Hypoacidity Induced by Proton Pump Inhibitors – a Practical Approach
- Urinary Tract and Gynecologic Malignancies
- Effect and Toxicity of Radiation Therapy in Selected Palliative Indications
- Undifferentiated Carcinoma of the Pancreas – a Case Report
- Non-Small Cell Lung Cancer with Estrogen Receptors and ALK Positivity
- Long Non-Coding RNA Signature in Cervical Cancer
- Infiltration of Prostate Cancer by CD204+ and CD3+ Cells Correlates with ERG Expression and TMPRSS2-ERG Gene Fusion
- Down-regulation of TSGA10, AURKC, OIP5 and AKAP4 genes by Lactobacillus rhamnosus GG and Lactobacillus crispatus SJ-3C-US supernatants in HeLa cell line
- Use of the Metal Deletion Technique for Radiotherapy Planning in Patients with Cardiac Implantable Devices
- Diagnostic Challenges and Extraordinary Treatment Response in Rare Malignant PEComa Tumor of the Kidney
- Animal-Type Melanoma – a Mini-Review Concerning One of the Rarest Variants of Human Melanoma
- Influence of Gastrointestinal Flora in the Treatment of Cancer with Immune Checkpoint Inhibitors
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Undifferentiated Carcinoma of the Pancreas – a Case Report
- Effect and Toxicity of Radiation Therapy in Selected Palliative Indications
- Consequences of Hypoacidity Induced by Proton Pump Inhibitors – a Practical Approach
- Diagnostic Challenges and Extraordinary Treatment Response in Rare Malignant PEComa Tumor of the Kidney
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

