-
Medical journals
- Career
Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu
Authors: P. Heinc; F. Kováčik; J. Přeček; A. Smékal; I. Šimková; M. Táborský
Authors‘ workplace: I. interní klinika – kardiologická FN Olomouc
Published in: Kardiol Rev Int Med 2014, 16(2): 88-94
Category: Cardiology Review
Overview
Nová doporučení v oblasti srdeční resynchronizační léčby uvádějí klinické a EKG rysy pro největší přínos resynchronizační léčby, klíčové důkazy pro indikaci k resynchronizační léčbě, indikace resynchronizační léčby u pacientů se srdečním selháním a nízkou ejekční frakcí levé komory při sinusovém rytmu i při fibrilaci síní. Mimo to uvádějí doporučení pro „upgrade“ původní trvalé kardiostimulace i pro primoimplantace u pacientů indikovaných k trvalé kardiostimulaci z bradykardické příčiny a v závěru se zabývají klinickými faktory, které je vhodné zohlednit při volbě mezi biventrikulárním stimulátorem a biventrikulárním defibrilátorem v primární prevenci náhlého úmrtí.
Klíčová slova:
resynchronizační léčba – srdeční selhání – optimální výběr kardiostimulátoru nebo defibrilátoruÚvod
Chronické srdeční selhání (SS) je jednou z největších ekonomických zátěží ve zdravotnictví, což je dáno především velkou incidencí tohoto onemocnění. Výskyt SS se v naší populaci pohybuje kolem 1 – 2 % s výrazným nárůstem ve vyšších věkových skupinách. Diagnostika i léčba SS jsou medicínsky náročné a prognóza při pouhé farmakoterapii byla špatná – polovina nemocných umírala do čtyř let od stanovení diagnózy. Při selhání farmakoterapie se dnes nabízí možnost srdeční resynchronizační léčby (SRL) pomocí biventrikulární (BIV) kardiostimulace. Problematika SRL je odborně zpracována v nových evropských doporučeních z minulého roku a v tomto sdělení se pokusíme aplikovat do každodenní praxe aktuální indikace, způsoby stimulace i volbu mezi kardiostimulátorem a defibrilátorem.
Srdeční selhání a EKG charakteristiky
Evropský průzkum srdečního selhání (EuroHeart Failure Survey) ukázal, že 36 % nemocných s diagnostikovaným SS má ejekční frakci levé komory (EF LK) ≤ 35 % a přitom z těchto nemocných má jen 41 % trvání QRS komplexu ≥ 120 ms a pouze 17 % má trvání QRS komplexu ≥ 150 ms [1]. Na základě kritérií, která jsou v současné době doporučována jako indikace k resynchronizační léčbě, je množství takových pacientů se SS relativně malé (5 – 10 %), nicméně ne zanedbatelné. Průměrný počet implantovaných přístrojů pro SRL byl v roce 2011 v západní a střední Evropě 140 na milion obyvatel, z toho bylo 107 defibrilátorů a 33 kardiostimulátorů. Léčebné možnosti v posledních 20 letech výrazně zlepšily prognózu nemocných se SS a např. ve studii CARE – HF z období let 2001 – 2009 se díky optimální farmakoterapii a SRL doba přežití prodloužila na osm let [2] proti srovnatelné populaci nemocných ze studie V ‑ HeFT ‑ I, kde byla doba přežití 3,5 roku (1980 – 1985) [3]. Prognóza je signifikantně horší v přítomnosti blokády levého Tawarova raménka (LBBB). Častou komplikací SS je fibrilace síní (FS), která především zhoršuje projevy SS. Podle evropského průzkumu má paroxysmální nebo permanentní formu FS až 45 % nemocných se SS a předpokládá se, že přítomnost FS vypovídá o závažnějším stadiu SS.
Role zobrazovacích metod v hodnocení mechanické dyssynchronie, na jejímž základě lze provést výběr pacientů indikovaných k SRL
Elektrická dyssynchronie není vždy spojena s mechanickou dyssynchronií a opačně mechanická dyssynchronie není vždy spojena s elektrickou dyssynchronií [4]. Existuje řada nemocných se SS s prokazatelnou mechanickou dyssynchronií LK a jejich šíře QRS komplexu je < 120 ms. U těchto nemocných nevede SRL k signifikantnímu zlepšení dle různých sledovaných cílů [5], proto stanovení mechanické dyssynchronie je všeobecně inferiorní proti šíři QRS komplexu při indikaci k SRL. K velmi podobným výsledkům se došlo, pokud se srovnával vliv SRL na celkovou mortalitu ve skupině pacientů ve funkční třídě NYHA I ‑ II (žádná redukce mortality) proti nemocným ve funkční třídě NYHA III ‑ IV [6].
Klinické závěry
Výsledky hodnocení mechanické dyssynchronie pomocí zobrazovacích metod jsou velmi nehomogenní, proto by se mechanická dyssynchronie neměla používat jako kritérium k výběru pacientů vhodných k SRL. Na druhou stranu je však okamžitý efekt SRL na mechanickou dyssynchronii nezávislým prediktorem dlouhodobého efektu SRL.
Klíčové důkazy, ze kterých vycházejí současná doporučení
Všechna doporučení se opírají o výsledky řady randomizovaných i observačních studií, které hodnotily vliv SRL na různé parametry. Především srovnávaly SRL proti konvenční léčbě včetně konvenční kardiostimulace a sledovaly vliv SRL na symptomy, funkční klasifikaci NYHA, zátěžovou kapacitu, funkci a remodelaci LK, počet rehospitalizací pro SS a na mortalitu. Vzhledem k tomu, že také kritéria dobré odpovědi na SRL nejsou ve studiích jednotná, nelze výsledky jednoznačně interpretovat. Jednotlivé studie tedy sledují různé cíle a rovněž etiologie SS není ve studiích stejná, proto také každé doporučení má rozdílnou váhu, která je vyjádřena třídou významnosti (I ‑ III) a hladinou významnosti (A ‑ C).
- Míra vlivu SRL na úmrtnost, počet hospitalizací, funkci a remodelaci LK je u pacientů s mírnými příznaky (NYHA třída II) podobná jako u pacientů ve funkční třídě NYHA III, proto také doporučení jsou jednotná pro obě funkční třídy se symptomatickým SS a výrazně sníženou EF LK.
- Vzhledem k nízkému počtu pacientů zařazených do randomizovaných studií nejsou žádné validní důkazy pro indikaci SRL u pacientů ve funkční třídě I a IV. Nicméně u pacientů ve funkční třídě NYHA IV, kteří nebyli hospitalizováni pro SS v posledním měsíci (tzn. oběhově stabilní), by měl být přístup individualizovaný ve smyslu možného snížení počtu hospitalizací pro SS a zlepšení příznaků.
- Jedním z nejvýznamnějších ukazatelů pro indikaci SRL je přítomnost LBBB, kde se prokázal její největší pozitivní vliv.
- Subanalýzy randomizovaných klinických studií ukazují, že největší pozitivní vliv na morbiditu, mortalitu a funkci LK je u žen, u pacientů s neischemickou kardiomyopatií a u pacientů s šíří QRS > 150 ms (čím delší trvání QRS, tím větší pozitivní vliv (tab.1)) [7,8].
- Vzhledem k nízkému počtu pacientů zařazených do randomizovaných studií jsou slabé důkazy pro indikaci SRL u pacientů se SS v nepřítomnosti LBBB, a to platí především pro pacienty s šíří QRS < 150 ms ve funkční třídě NYHA I ‑ II.
- Blokáda pravého Tawarova raménka (RBBB) znamená přítomnost závažnějšího zdravotního stavu, než je tomu v přítomnosti LBBB, nicméně se všeobecně neočekává, že by SRL měla pozitivní vliv na tyto nemocné, proto by rozhodnutí o zavedení SRL v přítomnosti RBBB mělo být individuální na základě jiných klinických/ zobrazovacích ukazatelů.
- Neexistuje žádný důkaz o přínosu SRL u pacientů s QRS < 120 ms.
Table 1. Míra přínosu resynchronizační léčby. 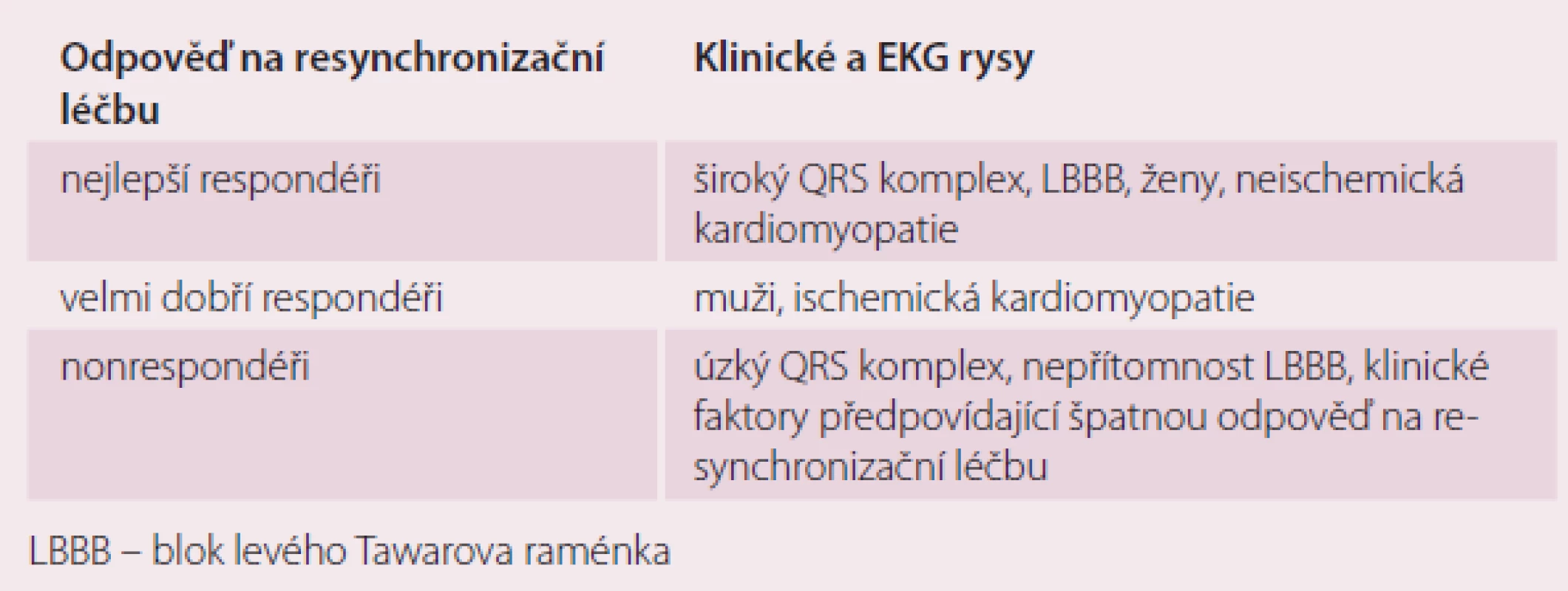
Význam SRL u nemocných se SS při sinusovém rytmu
Existují přesvědčivé důkazy o tom, že u nemocných se sinusovým rytmem SRL prokazatelně snižuje mortalitu a počet hospitalizací pro SS, zlepšuje funkci LK a ovlivňuje její remodelaci v případě, že přes optimalizovanou farmakoterapii přetrvává symptomatické SS při výrazně snížené funkci LK (EF LK ≤ 35 %) a v přítomnosti kompletní LBBB. Současně neexistují žádné důkazy o podstatném ovlivnění morbidity nebo mortality u pacientů se SS ve funkčních třídách NYHA II a III a/ nebo ve funkční třídě NYHA IV, pokud jsou oběhově stabilní. Doporučení pro SRL jsou proto koncipována souhlasně s evropskými doporučeními pro SS z roku 2012 tak, aby poskytovala společný soubor doporučení pro všechny pacienty se symptomatickým SS, a to bez ohledu na funkční třídy NYHA II ‑ IV. U pacientů, kteří nesplňují uváděná kritéria, je důkaz o účinnosti SRL natolik slabý, že bude třeba dalšího výzkumu, který by natolik přesvědčil, abychom přehodnotili současná doporučení především u pacientů ve funkční třídě NYHA I a IV, u pacientů bez LBBB a u pacientů s trváním QRS < 150 ms. Zatím neexistují žádné důkazy o přínosu SRL u pacientů se SS a šíří QRS < 120 ms (tab. 2) [9].
Table 2. Indikace SRL u pacientů se srdečním selháním a nízkou ejekční frakcí při sinusovém rytmu. 
Volba způsobu stimulace a optimalizace SRL
Cílem optimalizace SRL je snížení procenta nonrespondérů. Obvyklé empirické nastavení spočívá v simultánní stimulaci pravé i levé komory při snímané síňové aktivitě a naprogramovaném atrioventrikulárním (AV) zpoždění mezi 100 a 120 ms při umístění levokomorové elektrody v laterální nebo posterolaterální větvi koronárního sinu. Optimalizace SRL má stále čtyři hlavní oblasti výzkumu:
- Jak dosáhnout BIV stimulace, která by se blížila 100 %?
- Jak vybrat nejlepší místo pro levokomorovou elektrodu?
- Jak programovat AV interval, aby bylo dosaženo maximálního příspěvku levé síně při plnění LK?
- Jak odstranit reziduální levokomorovou dyssynchronii při BIV stimulaci (optimalizace interventrikulárního intervalu)?
Ad 1) Maximalizace biventrikulární stimulace
Trvalá a efektní BIV stimulace je základním požadavkem k dosažení nejlepšího výsledku SRL. Čím vyšší procento BIV stimulace, tím nižší mortalita a počet hospitalizací pro SS, ale toto platí, pokud se uplatňuje BIV stimulace minimálně v 93 % [10,11]. Proto základním doporučením je, aby při BIV stimulaci byla snaha o maximální uplatnění této stimulace, která by se blížila 100 % (tab. 3). Nejčastější ztráta BIV stimulace je dána nevhodnou programací dlouhého AV zpoždění (34 %), vznikem síňových arytmií s rychlým převodem na komory (31 %) a četnou komorovou ektopií (17 %) [11].
Table 3. Výběr způsobu stimulace a optimalizace resynchronizační léčby. 
Ad 2) Výběr optimálního místa pro implantaci levokomorové elektrody
Největší zpoždění mechanické kontrakce u pacientů s LBBB je v posterolaterální oblasti LK, která je proto také preferována při zavádění elektrody pro levokomorovou stimulaci. Umístění v přední, boční i zadní oblasti LK vede k podobnému klinickému zlepšení [12], ale umístění elektrody v posterolaterální lokalizaci přináší nejlepší výsledky týkající se reverzní remodelace LK, délky přežívání a intervalu do první hospitalizace pro SS [13].
Prakticky všechny studie prokazují, že nejlepší výsledky (celková mortalita, hospitalizace pro SS) jsou u nemocných, kde se levokomorovou elektrodu podaří umístit do oblasti nejpozdější mechanické aktivace, nicméně v praxi jsou značné interindividuální rozdíly mezi oblastmi s nejpozdější mechanickou aktivací v důsledku transmurálních jizev a touto oblastí nemusí být vždy posteroseptální oblast (tab. 3) [14].
Ad 3 a 4) Optimalizace nastavení kardiostimulace pro SRL
Optimalizací nastavení AV zpoždění a VV zpoždění se zabývala řada observačních i randomizovaných studií s rozmanitými výsledky, nicméně větší studie prokázaly, že optimalizované nastavení těchto parametrů má omezený vliv na klinické a echokardiografické výsledky ve srovnání s pevně nastaveným AV zpožděním (100 – 120 ms) a se současnou stimulací obou komor. Z těchto nehomogenních výsledků nelze udělat validní závěry, proto se optimalizace stimulačních parametrů (AV a VV zpoždění) rutinně u všech pacientů nedoporučuje. Nicméně u nonrespondérů na SRL, u pacientů s ischemickou chorobou srdeční nebo při potřebě síňové stimulace je vhodné zhodnotit AV a VV zpoždění s úpravou suboptimálního nastavení. K optimalizaci AV a VV zpoždění bylo navrženo několik metod. Tyto metody jsou rozděleny na echokardiografické a neechokardiografické, přičemž dle výsledků optimalizace nejsou mezi nimi zásadní rozdíly [15].
Biventrikulární stimulace vs stimulace levé komory samotné
BIV stimulace je nejčastějším způsobem stimulace při SRL, nicméně při hledání ještě lepších výsledků se zkoušela i stimulace samotné LK. Většina studií prokazovala noninferioritu samotné levokomorové stimulace při sledování klinického stavu, funkční třídy NYHA, zátěžové kapacity nebo kvality života. Nicméně, pokud jde o echokardiografické parametry (zlepšení EF LK a zmenšení objemu LK), výsledky metaanalýzy několika studií ukázaly, že BIV stimulace vede k většímu zlepšení než samotná stimulace LK [16].
Klinické závěry
Nejčastější způsob stimulace při SRL je BIV stimulace při současné stimulaci PK a LK s pevně nastaveným AV zpožděním na 100 – 120 ms. Levokomorová elektroda se umísťuje v posterolaterální větvi koronárního sinu, pokud je to možné. Optimalizace AV a VV zpoždění má omezený vliv na klinický nebo echokardiografický výsledek SRL, proto se rutinně neprovádí, nicméně tato optimalizace je vhodná u nonrespondérů na SRL, především u pacientů s ischemickou chorobou srdeční, nebo při potřebě síňové stimulace. Samotnou levokomorovou stimulaci jako levnější a jednodušší alternativu BIV stimulace lze volit pouze u dětí a mladistvých.
Problematika pacientů s fibrilací síní
SRL by měla být zvažována jen u nemocných s permanentní FS, zatímco jiné formy FS by primárně měly být řešeny antiarytmicky. SRL je bazálně indikována u nemocných s permanentní FS s výrazným hemodynamickým SS a u nemocných s rychlým převodem na komory, kde dysfunkci LK je třeba řešit ablací AV převodu k optimální kontrole komorové frekvence.
Fibrilace síní u pacientů se srdečním selháním, širokým QRS komplexem (≥ 120 ms) a sníženou ejekční frakcí levé komory (≤ 35 %)
Pouze jedna randomizovaná studie, která byla s touto kohortou nemocných provedena, ukázala, že signifikantně došlo k funkčnímu zlepšení pouze u pacientů, u kterých se BIV stimulace uplatňovala ve více než v 85 % času. Ostatní studie a metaanalýzy ukázaly prospěšnost BIV stimulace ve většině sledovaných parametrů, nicméně v menší míře, než je tomu při sinusovém rytmu. Zásadním požadavkem pro SRL u pacientů s FS je snaha o maximální uplatnění BIV stimulace. Velké registry pacientů s FS ukázaly, že vysoké procento BIV stimulace (≥ 99 %) je hlavním prediktorem efektu SRL a opačně FS (s rychlým převodem na komory) je hlavním determinantem ztráty BIV stimulace [10,11]. Skutečné uplatnění BIV stimulace je proto třeba velmi pečlivě sledovat bez spoléhání na sledovací funkce stimulátoru, který může falešně udávat stimulovanou akci (event. lze ke sledování použít i holterovu monitoraci). U většiny pacientů s FS je při normálním AV převodu možno dosáhnout adekvátní BIV stimulace jen provedením neselektivní ablace AV junkce [17]. Neselektivní ablace AV junkce a trvalá stimulace hrotu PK poskytuje vysoce účinnou kontrolu frekvence, pravidelnou odpověď komor a zlepšení příznaků [18], nicméně až u 50 % pacientů může být indukována levokomorová dyssynchronie s příznaky SS [19]. Malé randomizované studie ukázaly, že kombinace SRL s neselektivní ablací AV junkce u pacientů s FS se sníženou EF LK vedla ke snížení počtu hospitalizací pro SS a zlepšila kvalitu života, zatímco vliv na morbiditu a mortalitu a vliv na nemocné se zachovanou systolickou funkcí nemá přesvědčivé důkazy. Provedením neselektivní ablace AV junkce je pacient v dalším období většinou zcela závislý na kardiostimulátoru a tuto nevýhodu je třeba zvážit při komplexním řešení SS u pacientů s FS a ablaci AV uzlu indikovat až v případě, že se již neuvažuje o selektivní ablaci FS [20].
Klinické závěry
SRL je indikována u pacientů se SS při FS za stejných podmínek jako u sinusového rytmu za předpokladu, že u pacientů, kde se BIV stimulace dominantně neuplatňuje (≥ 99 %), je indikována ablace AV junkce. Totální uplatnění BIV stimulace je podmínkou bez ohledu na to, zda je toho dosaženo v důsledku farmakoterapie nebo neselektivní ablace AV junkce. Nejsou žádná data od pacientů se SS při FS, kteří jsou ve funkční třídě II (obr. 1, tab. 4).
Image 1. Indikace neselektivní ablace atrioventrikulární junkce u pacientů se symptomatickou permanentní FS při optimální farmakoterapii. 
Table 4. Indikace resynchronizační léčby u pacientů se SS a nízkou ejekční frakcí při FS. 
Pacienti se srdečním selháním s indikací trvalé kardiostimulace
Jedná se o populaci nemocných s již zavedenou trvalou konvenční kardiostimulací, kde progreduje SS (cca 25 % této kohorty) [21], nebo o populaci nemocných s indikací primoimplantace z bradyarytmické příčiny, kteří současně vykazují známky SS.
Upgrade z běžného kardiostimulátoru nebo kardioverteru ‑ defibrilátoru
Upgrade konvenční stimulace na BIV stimulaci by mělo být na základě menších randomizovaných a observačních studií zváženo u pacientů vyžadujících trvalou stimulaci pro bradykardii (většinou trvalý AV blok) a kteří mají závažné příznaky SS (většinou NYHA třída III nebo IV) s nízkou EF LK (většinou 35 – 40 %) při konvenční pravokomorové stimulaci [22,23]. V těchto studiích pacienti vykazovali zlepšení symptomatologie i funkce LK a méně hospitalizací pro SS při BIV stimulaci. Na druhou stranu upgrade na BIV stimulaci je spojen s vysokou mírou komplikací (18,7 %) [24], proto by toto rozhodnutí mělo být zváženo na základě poměru rizik a přínosů (tab. 5).
Table 5. Indikace resynchronizační léčby k optimalizaci již zavedené trvalé kardiostimulace (upgrade) a indikace resynchronizační léčby u de novo implantace trvalé kardiostimulace. 
Primární zavedení resynchronizační léčby u pacientů indikovaných ke konvenční kardiostimulaci z bradykardické příčiny
Malé randomizované studie [25,26] celkem jasně potvrdily, že trvalá pravokomorová stimulace vede často k trvalému postupnému horšení funkce LK a současně že zavedená SRL iniciálně brání tomuto nepříznivému procesu remodelace. Primárně zavedená SRL může snížit počet hospitalizací pro SS, zlepšit kvalitu života a omezit příznaky SS u pacientů se sníženou funkcí LK, kde byla indikace trvalé kardiostimulace z bradykardické příčiny. U pacientů, kterým je indikována primoimplantace z bradykardické příčiny, je třeba rozlišit, do jaké míry jsou klinické projevy SS na podkladě bradyarytmie či vlastní idiopatické dysfunkce LK, která by mohla po zavedení pravokomorové stimulace dále progredovat. Toto rozlišení je však v praxi v okamžiku primární indikace dosti obtížné. Na druhé straně pozdější upgrade konvenční stimulace na SRL až po rozvinutí příznaků SS přináší podobný efekt jako primární zavedení SRL u pacientů s normální funkcí LK [27,28]. Při rozhodování, zda primárně zavést SRL nebo konvenční stimulaci PK, je třeba také vzít v úvahu relativně vyšší počet komplikací, kratší životnost i vyšší cenu BIV kardiostimulátorů určených pro SRL.
Klinické závěry
V případě bradykardické indikace se zdá být u pacientů se zachovanou funkcí LK rozumná strategie primární konvenční stimulace PK a pozdější zavedení SRL až v případě, kdy dojde ke zhoršení příznaků SS (tab. 5).
Přínos implantabilního defibrilátoru při indikaci SRL
SRL bezprostředně snižuje riziko úmrtí v důsledku SS, ale redukce rizika náhlého úmrtí se vyvíjí mnohem pomaleji, což předpokládá, že snížení rizika náhlého úmrtí je dáno především rozsahem reverzní remodelace v důsledku SRL [29]. Výsledky randomizovaných studií signifikantně neprokazují nadřazenost BIV defibrilátoru (ICD) nad BIV kardiostimulátorem (PM), nicméně metaanalýzy ukazují, že implantace BIV ICD je optimální řešení. Srovnání účinků BIV ICD s ostatními typy ICD ukázalo výhodu BIV stimulace, pokud jde o mortalitu, morbiditu a regresi příznaků SS [6].
Klinické závěry
Je‑li indikace implantace ICD, pak je u pacientů se symptomatickým SS při EF LK ≤ 35 % a s kompletní LBBB doporučena implantace BIV ICD, a to i přesto, že není žádné přímé srovnání BIV ICD s BIV PM v rámci randomizované studie.
Volba mezi biventrikulárním stimulátorem a biventrikulárním defibrilátorem
Mladší pacienti ve funkční třídě NYHA I ‑ II mají méně komorbidit a vyšší podíl náhlých úmrtí proti ostatním úmrtím, proto je přednostní implantace BIV ICD u těchto oligosymptomatických pacientů odůvodnitelná. Některé studie v tomto ohledu ukázaly větší přínos BIV ICD u pacientů ve funkční třídě NYHA II proti pacientům ve funkční třídě NYHA III a podobně signifikantní snížení celkové úmrtnosti v primárně preventivní indikaci bylo prokazatelné jen u pacientů ve funkční třídě NYHA II a nebylo prokázáno u pacientů ve funkční třídě NYHA III. Tento přínos u pacientů ve funkční třídě NYHA I a II musí být zvážen proti vyšší ceně a většímu riziku komplikací při implantaci ICD (inadekvátní výboje, elektrodové komplikace) [30].
Klinické závěry
V nepřítomnosti signifikantních důkazů o nadřazenosti BIV ICD nad BIV PM nejsou dána striktní doporučení, ale pouze pokyny pro jejich výběr na základě celkového klinického stavu, nákladnosti léčby a komplikací spojených s daným přístrojem (tab. 6 a 7).
Table 6. Indikace pro implantaci BIV defibrilátoru. 
Table 7. Klinická doporučení pro výběr BIV kardiostimulátoru nebo BIV defibrilátoru v primární prevenci náhlého úmrtí. 
Závěr
Nová doporučení v oblasti resynchronizační léčby uvádějí:
- klinické a EKG rysy pro největší přínos resynchronizační léčby,
- klíčové důkazy pro indikaci k resynchronizační léčbě,
- indikace resynchronizační léčby u pacientů se srdečním selháním a nízkou ejekční frakcí LK při sinusovém rytmu i při fibrilaci síní,
- doporučení k resynchronizační léčbě pro „upgrade“ původní trvalé kardiostimulace i pro primoimplantace u pacientů indikovaných k trvalé kardiostimulaci z bradykardické příčiny,
- klinické faktory, které je vhodné zohlednit při volbě mezi biventrikulárním stimulátorem a biventrikulárním defibrilátorem v primární prevenci náhlého úmrtí.
Doručeno do redakce 20. 3. 2014
Přijato po recenzi 27. 3. 2014
doc. MUDr. Petr Heinc, Ph.D.
www.fnol.cz
petr.heinc@fnol.cz
Sources
1. Khan NK, Goode KM, Cleland JG et al. Prevalence of ECG abnormalities in an international survey of patients with suspected or confirmed heart failure at death or discharge. Eur J Heart Fail 2007; 9 : 491 – 501.
2. Cleland JG, Freemantle N, Erdmann E et al. Long‑term mortality with cardiac resynchronization therapy in the Cardiac Resynchronization ‑ Heart Failure (CARE ‑ HF) trial. Eur J Heart Fail 2012; 14 : 628 – 634. doi: 10.1093/ eurjhf/ hfs055.
3. Cohn JN, Archibald DG, Ziesche S et al. Effect of vasodilator therapy on mortality in chronic congestive heart failure. Results of a Veterans Administration Cooperative Study. N Engl J Med 1986; 314 : 1547 – 1552.
4. Hawkins NM, Petrie MC, MacDonald MR et al. Selecting patients for cardiac resynchronisation therapy: electrical or mechanical dyssynchrony? Eur Heart J 2006; 27 : 1270 – 1281.
5. Thibault B, Harel F, Ducharme A et al. Cardiac resynchronization therapy in patients with heart failure and a QRS Complex < 120 milliseconds: the evaluation of resynchronization therapy for heart failure (LESSER ‑ EARTH) trial. Circulation 2013; 127 : 873 – 881. doi: 10.1161/ CIRCULATIONAHA.112.001239.
6. Tang AS, Wells GA, Talajic M et al. Cardiac ‑ resynchronization therapy for mild ‑ to ‑ moderate heart failure. N Engl J Med 2010; 363 : 2385 – 2395. doi: 10.1056/ NEJMoa1009540.
7. Arshad A, Moss AJ, Foster E et al. Cardiac resynchronization therapy is more effective in women than in men: the MADIT ‑ CRT (Multicenter Automatic Defibrillator Implantation Trial with Cardiac Resynchronization Therapy) trial. J Am Coll Cardiol 2011; 57 : 813 – 820. doi: 10.1016/ j.jacc.2010.06.061.
8. Barsheshet A, Goldenberg I, Moss AJ et al. Response to preventive cardiac resynchronization therapy in patiens with ischaemic and nonischaemic cardiomyopathy in MADIT ‑ CRT. Eur Heart J 2011; 32 : 1622 – 1630. doi: 10.1093/ eurheartj/ ehq407.
9. Beshai JF, Grimm RA, Nagueh SF et al. Cardiac ‑ resynchronization therapy in heart failure with narrow QRS complexes. N Engl J Med 2007; 357 : 2461 – 2471.
10. Hayes DL, Boehmer JP, Day JD et al. Cardiac resynchronization therapy and the relationship of percent biventricular pacing to symptoms and survival. Heart Rhythm 2011; 8 : 1469 – 1475. doi: 10.1016/ j.hrthm.2011.04.015.
11. Cheng A, Landman SR, Stadler RW. Reasons for loss of cardiac resynchronization therapy pacing: insights from 32 844 patients. Circ Arrhythm Electrophysiol 2012; 5 : 884 – 888. doi: 10.1161/ CIRCEP.112.973776.
12. Saxon LA, Olshansky B, Volosin K et al. Influence of left ventricular lead location on outcomes in the COMPANION study. J Cardiovasc Electrophysiol 2009; 20 : 764 – 768. doi: 10.1111/ j.1540 – 8167.2009.01444.x.
13. Thebault C, Donal E, Meunier C et al. Sites of left and right ventricular lead implantation and response to cardiac resynchronization therapy observations from the REVERSE trial. Eur Heart J 2012; 33 : 2662 – 2671. doi: 10.1093/ eurheartj/ ehr505.
14. Khan FZ, Virdee MS, Palmer CR et al. Targeted left ventricular lead placement to guide cardiac resynchronization therapy: the TARGET study: a randomized, controlled trial. J Am Coll Cardiol 2012; 59 : 1509 – 1518. doi: 10.1016/ j.jacc.2011.12.030.
15. Ellenbogen KA, Gold MR, Meyer TE et al. Primary results from the SmartDelay determined AV optimization: a comparison with other AV delay methods used in cardiac resynchronization therapy (SMART ‑ AV) trial: a randomized trial comparing empirical, echocardiography ‑ guided, and algorithmic atrioventricular delay programming in cardiac resynchronization therapy. Circulation 2010; 122 : 2660 – 2668. doi: 10.1161/ CIRCULATIONAHA.110.992552.
16. Liang Y, Pan W, Su Y et al. Meta‑analysis of randomized controlled trials comparing isolated left ventricular and biventricular pacing in patients with chronic heart failure. Am J Cardiol 2011; 108 : 1160 – 1165. doi: 10.1016/ j.amjcard.2011.06.018.
17. Ganesan AN, Brooks AG, Roberts ‑ Thomson KCet al. Role of AV nodal ablation in cardiac resynchronization in patients with coexistent atrial fibrillation and heart failure a systematic review. J Am Coll Cardiol 2012; 59 : 719 – 726. doi: 10.1016/ j.jacc.2011.10.891.
18. Chatterjee NA, Upadhyay GA, Ellenbogen KA et al. Atrioventricular nodal ablation in atrial fibrillation: a meta‑analysis and systematic review. Circ Arrhythm Electrophysiol 2012; 5 : 68 – 76. doi: 10.1161/ CIRCEP.111.967810.
19. Chen L, Hodge D, Jahangir A et al. Preserved left ventricular ejection fraction following atrioventricular junction ablation and pacing for atrial fibrillation. J Cardiovasc Electrophysiol 2008; 19 : 19 – 27.
20. Khan MN, Jais P, Cummings J et al. Pulmonary ‑ vein isolation for atrial fibrillation in patients with heart failure. N Engl J Med 2008; 359 : 1778 – 1785. doi: 10.1056/ NEJMoa0708234.
21. Dickstein K, Bogale N, Priori S et al. The European cardiac resynchronization therapy survey. Eur Heart J 2009; 30 : 2450 – 2460. doi: 10.1093/ eurheartj/ ehp359.
22. Hoijer CJ, Meurling C, Brandt J. Upgrade to biventricular pacing in patients with conventional pacemakers and heart failure: a double‑blind, randomized crossover study. Europace 2006; 8 : 51 – 55.
23. van Geldorp IE, Vernooy K, Delhaas T et al. Beneficial effects of biventricular pacing in chronically right ventricular paced patients with mild cardiomyopathy. Europace 2010; 12 : 223 – 229. doi: 10.1093/ europace/ eup378.
24. Poole JE, Gleva MJ, Mela T et al. Complication rates associated with pacemaker or implantable cardioverter ‑ defibrillator generator replacements and upgrade procedures: results from the REPLACE registry. Circulation 2010; 122 : 1553 – 1561. doi: 10.1161/ CIRCULATIONAHA.110.976076.
25. Albertsen AE, Nielsen JC, Poulsen SH et al. Biventricular pacing preserves left ventricular performance in patients with high‑grade atrio ‑ ventricular block: a randomized comparison with DDD(R) pacing in 50 consecutive patients. Europace 2008; 10 : 314 – 320. doi: 10.1093/ europace/ eun023.
26. Stockburger M, Gomez ‑ Doblas JJ, Lamas G et al. Preventing ventricular dysfunction in pacemaker patients without advanced heart failure: results from a multi‑centre international randomized trial (PREVENT ‑ HF). Eur J Heart Fail 2011; 13 : 633 – 641. doi: 10.1093/ eurjhf/ hfr041.
27. Laurenzi F, Achilli A, Avella A et al. Biventricular upgrading in patients with conventional pacing system and congestive heart failure: results and response predictors. Pacing Clin Electrophysiol 2007; 30 : 1096 – 1104.
28. Vatankulu MA, Goktekin O, Kaya MG et al. Effect of long‑term resynchronization therapy on left ventricular remodelling in pacemaker patients upgraded to biventricular devices. Am J Cardiol 2009; 103 : 1280 – 1284. doi: 10.1016/ j.amjcard.2009.01.023.
29. Cleland JG, Daubert JC, Erdmann E et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352 : 1539 – 1549.
30. Kleemann T, Becker T, Doenges K et al. Annual rate of transvenous defibrillation lead defects in implantable cardioverter ‑ defibrillators over a period of > 10 years. Circulation 2007; 115 : 2474 – 2480.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 2-
All articles in this issue
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu
- Současné možnosti optimalizace nastavení biventrikulární stimulace k maximálnímu využití resynchronizační léčby
- Možnosti sledování stavu oběhu a vliv dálkové monitorace na srdeční selhání
- Problematika nonrespondérů resynchronizační léčby
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Observační studie pacientů léčených lerkanidipinem v podmínkách běžné klinické praxe v České republice
- Ischemická choroba srdeční u nemocných s diabetes mellitus 1. typu
- Výsledky velkých kardiologicko‑diabetologických studií posledních let (EXAMINE, ORIGIN, SAVOR)
- Nové možnosti farmakoterapie diabetu
- Principy terapie bazálním inzulinem u diabetu 2. typu
- Selfmonitoring jako prevence komplikací diabetu
- Centrálně působící antihypertenziva – rilmenidin
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Centrálně působící antihypertenziva – rilmenidin
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

